DCIS a biopsia sentinelovej uzliny
Ductal Carcinoma in Situ (DCIS) and Biopsy of the Sentinel Lymph Node
Introduction:
Ductal carcinoma in situ (DCIS) is the disease with increasing incidence. Nowadays, approximately 80% DCIS are diagnosed via mammography and represent more than 20% of all types of breast cancer.
The acceptance of surgical procedures with this type of breast carcinoma is controversial as primary diagnosis of non-invasive carcinoma is often underestimated and in the end, histopathological examination reveals invasive carcinoma with biological potential to metastasize. In cases of „risk“ patient groups with DCIS, several studies report lymph node metastases.
The aim of the study has been to assess the incidence of sentinel lymph node metastatic involvement in high-risk patient group with DCIS and in ductal carcinoma in situ with microinvasion (DCISMI), to note the incidence of invasive carcinoma in definitive histopathology in patients with pre-operative diagnosis of DCIS and to analyze some predictors of invasivity.
Study type and patient group.
In retrospective analysis, we evaluated the setting of 119 patients who have been operated on at our Clinic from January, 1st 2008 until December, 31th 2010 for the diagnosis of DCIS. Prospectively, we have created the setting of 44 patients with high-risk DCIS with sentinel lymph node biopsy (SLNB) performed.
Methods and results.
Metastatic involvement of sentinel lymph node in high-risk DCIS has been found in 4 cases (9.0%) – in 1 patient (2.2%) with correct diagnosis of DCIS and in 3 patients (6.8%) with invasive carcinoma according to final histopathology. In the patient with DCIS, a micrometastasis of 0.4 mm was found in one sentinel lymph node. After complete axillary dissection, non-sentinel axillary lymph nodes metastatic involvement was not demonstrated (14/0). In 6 cases (5.0%), we identified DCISMI and did not find metastasis in sentinel lymph node.
In the high-risk DCIS group, in 4 patients (9.0%) DCISMI and in 12 patients (27.2%) invasive carcinoma was found after definitive histopathologic examination. In this group, the overall ratio of invasive lesions was 36.2%.
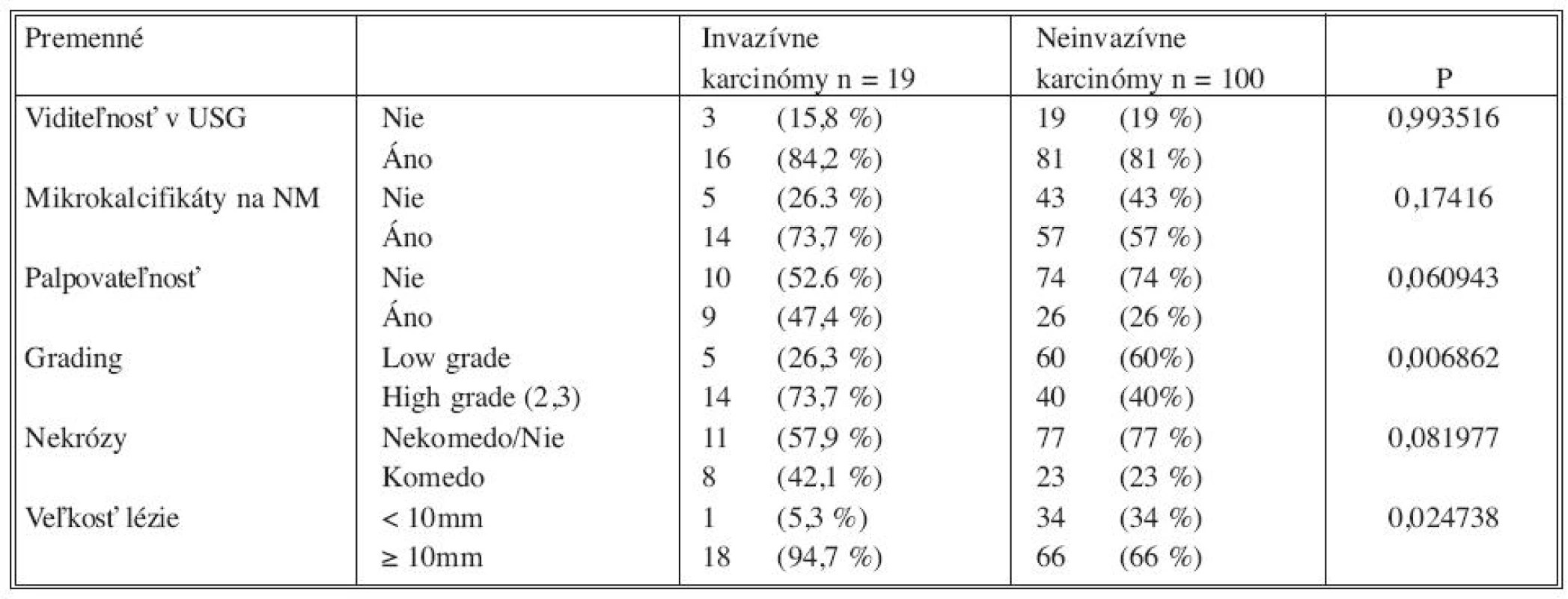
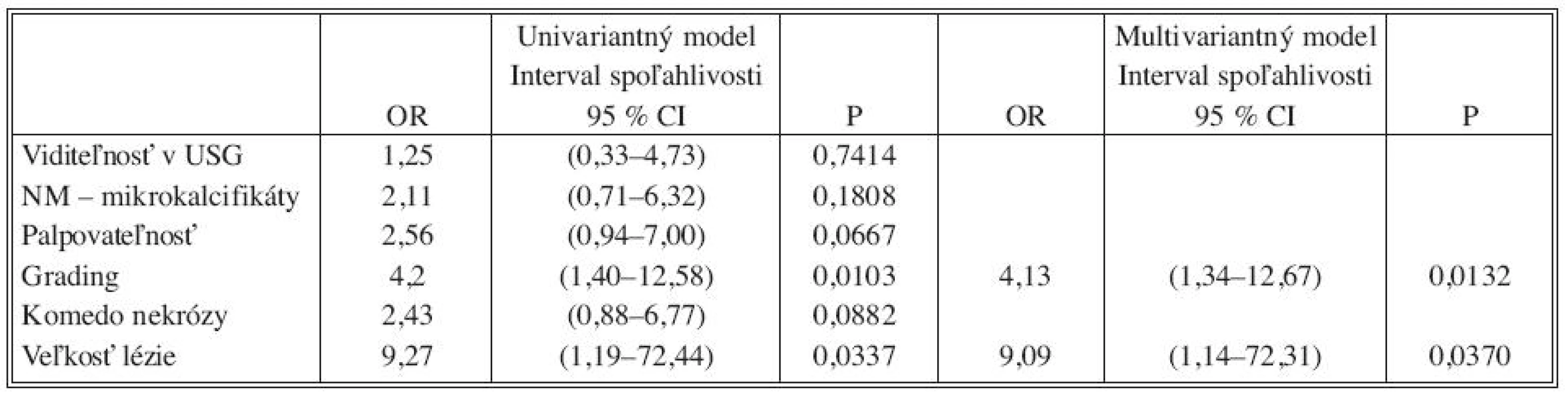
As for predictors of invasivity, high-grade carcinoma (OR 4,2; 95% CI 1,40-12,58) has more than 4-fold higher influence and lesion size
Key words:
DCIS – sentinel lymph node biopsy – high-risk DCIS – DCIS with microinvasion (DCISMI) – axillary dissection
:
P. Chválny; R. Donát; D. Dyttert; D. Šiška; M. Sabol; R. Králik; P. Mračna; J. Malina; J. Veselý 1; B. Duchaj 1; D. Cích 1; V. Lehotská 2; K. Rauová 2; M. Smreková 2; Š. Galbavý 3; D. Macák 3; K. Macháleková 3; T. Bokes 4
:
Klinika onkologickej chirurgie LF UKo a OÚSA, doc. MUDr. Štefan Durdík, Ph. D.
; Klinika nukleárnej medicíny LF UKo a OÚSA, doc. MUDr. Izabela Makaiová, CSc.
1; II. rádiologická klinika LF UKo a OÚSA, doc. MUDr. Viera Lehotská, Ph. D.
2; Oddelenie patológie OÚSA, prof. MUDr. Štefan Galbavý, CSc.
3; Katedra aplikovanej matematiky a štatistiky FMFI UKo, prof. RNDr. Marek Fila, DrSc.
4
:
Rozhl. Chir., 2011, roč. 90, č. 6, s. 352-360.
:
Monothematic special - Original
Východiská:
Duktálny karcinóm in situ (DCIS) je ochorenie s narastajúcou incidenciou. V súčasnosti je asi 80 % DCIS detekovaných v rámci mamografického vyšetrenia a reprezentuje viac ako 20 % všetkých karcinómov prsníka. Chirurgické výkony na axilárnych lymfatických uzlinách sú pri tomto ochorení kontroverzne prijímané, nakoľko primárna diagnóza neinvazívneho karcinómu je často podhodnotená a reálnou diagnózou je vo finálnej histológii invazívny karcinóm s biologickým potenciálom k metastazovaniu. Viaceré štúdie referujú o uzlinových metastázach v prípadoch „rizikových“ skupín pacientov s DCIS.
Cieľom štúdie
bolo zistiť výskyt metastatického postihnutia sentinelovej uzliny u „high risk“ skupiny pacientov s DCIS a u duktálneho karcinómu in situ s mikroinváziou (DCISMI), zaznamenať výskyt invazívneho karcinómu v definitívnej histológii u pacientov s predoperačne stanovenou diagnózou DCIS a analyzovať niektoré prediktory invazivity.
Typ štúdie a súbor pacientov.
Retrospektívnou analýzou dát sme vyhodnotili súbor 119 pacientok, ktoré sme operovali na našej klinike od 1. 1. 2008–31. 12. 2010 pre diagnózu DCIS. Prospektívne sme vytvorili súbor 44 pacientov s „high risk“ DCIS, u ktorých bola realizovaná SLNB.
Metódy a výsledky.
Metastatické postihnutie sentinelovej uzliny v skupine „high risk“ DCIS sme zistili v 4 prípadoch (9,0 %). U 1 pacientky (2,2 %) pri korektnej diagnóze DCIS a u 3 pacientok (6,8 %) pri invazívnom karcinóme vo finálnej histológii. U pacientky s DCIS sa jednalo o mikrometastázu (veľkosť 0,4 mm) v jednej sentinelovej uzline. Kompletná axilárna disekcia nepreukázala metastatické postihnutie non-sentinelových axilárnych uzlín (14/0). DCISMI sme identifikovali v 6 prípadoch (5,0 %), metastázy v sentinelovej uzline sme nezistili. V skupine „high risk“ DCIS sme vo finálnej histológii stanovili u 4 pacientok (9,0 %) diagnózu DCISMI a v 12 prípadoch (27,2 %) invazívny karcinóm. Celkový podiel invazívnych lézií tvoril v danej skupine 36,2 %. Z prediktorov invazivity vykazoval „high grade“ (OR 4,2; 95% CI 1,40-12,58) vyše 4-násobný vplyv na výskyt invázie a veľkosť lézie
Kľúčové slová:
DCIS – biopsia sentinelovej uzliny – high risk DCIS – DCIS s mikroinváziou (DCISMI) – axilárna disekcia
ÚVOD
V krajinách s dobrou úrovňou skríningových vyšetrení je duktálny karcinóm in situ (DCIS) charakterizovaný stále stúpajúcou incidenciou vo všetkých vekových kategóriách, najviac u žien nad 50 rokov [1].V súčasnosti je asi 80 % DCIS detekovaných v rámci mamografického vyšetrenia a reprezentuje viac ako 20 % všetkých karcinómov prsníka [2, 3].
V Slovenskej republike bolo v roku 2006 hlásených 102 prípadov. Štandardizovaná incidencia DCIS podľa Národného onkologického registra Slovenskej republiky v roku 2006 bola 2,6/100 000 žien. Z celkového počtu všetkých maligných ochorení prsníka predstavoval DCIS 4,5 % [4]
Histopatologicky sa jedná o pestrú skupinu nádorov, ktoré sú reprezentované zhubným bujnením epitelu vývodov mliečnej žľazy, bez porušenia bazálnej membrány a bez infiltrácie do okolitých štruktúr. Osobitným typom v rámci DCIS je mikroinvazívny karcinóm (DCISMI), ktorý spĺňa kritéria invazívneho rastu, ale infiltrácia bazálnej membrány nepresahuje v celom jeho rozsahu 1 mm.
V minulosti bol DCIS zistený fyzikálnym vyšetrením, diagnostikovaný otvorenou biopsiou a liečený mastektómiou s axilárnou disekciou. V súčasnosti sa detekuje prevažne skríningovou mamografiou, diagnostikuje punkčnou biopsiou a vo väčšine prípadov sa lieči prsník záchovnou operáciou.
Napriek tomu, že DCIS nie je typickým metastazujúcim ochorením, indikácia operačného výkonu na axilárnych lymfatických uzlinách je stále predmetom diskusií. Kým vo včasnom štádiu invazívneho karcinómu prsníka je biopsia sentinelovej uzliny (SLNB) považovaná za štandardný postup, tak v prípade DCIS je indikácia tejto metódy kontroverzne prijímaná. Obhajcovia aktívnejšieho prístupu argumentujú tým, že pre určitú „rizikovú“ skupinu pacientov s DCIS môže byť metastatické postihnutie axily relativne vysoké a preferujú operáciu primárneho tumoru spolu s SLNB v jednej dobe. Oponenti takéhoto postupu poukazujú na fakt, že v prípade korektne stanovenej diagnózy DCIS je minimálny predpoklad metastatického postihnutia axilárnych lymfatických uzlín a preto výkon v axile nie je potrebný [3, 5]. DCIS je považovaný za prekurzorovú léziu invazívneho karcinómu, s čím do istej miery súvisí aj diskrepancia histopatologických nálezov medzi predoperačnou biopsiou a finálnym patologickým výsledkom. Ex post stanovená diagnóza invazívneho karcinómu však zväčša mení pôvodnú taktiku a techniku chirurgickej liečby. Nutnosť dvojetapovej operácie má svoje nevýhody a riziká, ktoré sú dané absolvovaním druhej operácie a možným zlyhaním metódy SLNB.
CIELE PRÁCE
Hlavným zámerom tejto štúdie bola snaha identifikovať rizikovú skupinu pacientov s DCIS a overiť korektný axilárny status v danom súbore. Hľadali sme odpoveď na otázku, či nami selektovaná skupina pacientov s predpokladaným rizikom invázie, môže mať benefit z biopsie sentinelovej uzliny. Ciele:
- Zistiť výskyt metastatického postihnutia sentinelovej uzliny (SU) u „high risk“ skupiny pacientov s DCIS a u duktálneho karcinómu in situ s mikroinváziou.
- Zaznamenať výskyt invazívneho karcinómu a DCISMI v definitívnej histológii.
- Analyzovať niektoré prediktory invazivity a overiť ich štatistickú významnosť.
PACIENTI A METÓDY
Retrospektívnou analýzou dát sme získali súbor 130 pacientok, ktoré boli operované na Klinike onkologickej chirurgie OÚSA od 1. 1. 2008–31. 12. 2010 pre diagnózu DCIS, resp. suspektného DCIS v predoperačnej histológii.
Jedenásť prípadov, ktoré patológ diagnostikoval z core cut biopsie ako suspektný DCIS, ale v konečnom výsledku sa jednalo o benígny nález, resp. iné ochorenie, sme do našej analýzy nezahrnuli. Zohľadnením tohto kritéria sa veľkosť súboru zmenšila na konečných 119 pacientov. Vo všetkých prípadoch sa jednalo o ženy vo veku 30–81 rokov. Priemerný vek bol 58,3 rokov. U všetkých pacientok bolo vykonané základné klinické vyšetrenie (aspekcia, palpácia), doplnené sonografickým vyšetrením prsníka a axily, natívnou mamografiou, prípadne magnetickou rezonanciou. Vo väčšine prípadov bola diagnóza stanovená z core cut biopsie, v ojedinelých prípadoch vakuovou mamotómiou. Pomocou zobrazovacích metód sme zaznamenávali veľkosť lézie, prítomnosť mikrokalcifikátov, multifokalitu, multicentricitu a stav axilárnych LU. Hodnotili sme histologické výsledky z punkčnej biopsie pred operáciou a tieto porovnávali s finálnou histológiou. Sledovali sme niektoré biologicky potencionálne faktory invázie – grading, prítomnosť nekróz, komedo typ. Súčasťou týchto vyšetrení bolo aj stanovenie hormonálneho receptorového statusu (ER, PR, HER2) a onkomarkerov (p53, Ki 67, E-cadherin). Od mája r. 2010 sme na II. rádiologickej klinike LF UKo a OÚSA začali predoperačne vykonávať u všetkých pacientok s iniciálnym DCIS sonoelastografické vyšetrenie v rámci samostatnej prospektívnej štúdie. U 44 pacientov s DCIS bola realizovaná SLNB súčasne s operačným výkonom na prsníku. Do tejto skupiny boli zaradené pacientky, kde sme na základe fyzikálneho vyšetrenia, paraklinických zobrazovacích metód a biologických vlastností tumoru predpokladali vyššiu pravdepodobnosť výskytu invazívneho karcinómu v definitívnej histológii. Pri výbere kritérií potencionálnej invazivity sme vychádzali z literárnych údajov a vlastných klinických poznatkov. Nami stratifikovaní pacienti museli mať okrem predoperačnej histologickej diagnózy DCIS prítomnosť najmenej dvoch, resp. viacerých „rizikových“ faktorov:
- Palpačne prítomný tumor.
- Diameter lézie viac ako 20,0 mm (V USG, NM).
- Histopatologické charakteristiky-vysoký grade (3),nekrózy, komedo typ.
- Patológom vyslovené podozrenie z možnej invázie.
U pacientov kde sa takéto charakteristiky DCIS nepreukázali, nebola SLNB štandardne indikovaná. Pacienti, ktorí boli v minulosti liečení pre karcinóm prsníka, boli zo štúdie vyradení.
BIOPSIA SENTINELOVEJ UZLINY
Lymfatické mapovanie sme realizovali kombinovanou metódou pomocou rádioaktívneho technécia-99m (Senti Scint) a modrého farbiva (Bleu Patente, Guerbet). Rádiokoloid bol podávaný ráno, v deň operácie, na pracovisku Kliniky nukleárnej medicíny v celkovej dávke 2 mCi (75 MBq), v objeme 1–2 ml. Ak sa jednalo o klinicky hmatnú léziu, aplikovali sme rádiofarmakum (RF) do oblasti nad tumorom subdermálne z jedného až dvoch samostatných vpichov. Pri malých, ťažšie lokalizovateľných léziách do subareolárneho lymfatického plexu. Približne 10 minút pred operáciou sme injikovali (v celkovej anestéze) 2,0 ml Patentnej modrej (1 : 1 s fyziologickým roztokom) periareolárne, pričom časť farbiva bola v začiatkoch aplikovaná aj peritumorózne. Identifikácia a odstránenie SU sa realizovalo prevažne z diskontinuálneho axilárneho prístupu pomocou prenosnej gamasondy a detektora (C – Track System, Care-Wise, CA USA). Sentinelové uzliny sme disekovali harmonickým skalpelom Focus FCS 9 (Ethicon Endo-Surgery). V prípadoch viacpočetného výskytu aktívnych, resp. modro sfarbených uzlín sme vykonali ich kompletné odstránenie za kontroly radiačného pozadia. V našej štúdii bol sledovaný celkový počet SU, ako aj počet SU postihnutých metastázou. Ak bola SU pozitívna, bol operačný výkon dokončený kompletnou axilárnou disekciou I. a II. etáže axily.
HISTOPATOLOGICKÉ SPRACOVANIE
Vyšetrenie SU bolo v prvej fáze realizované peroperačne, konvenčným spracovaním. Pri negatívnom náleze metastáz nasledovalo definitívne vyšetrenie v základnom farbení hematoxylínom a eozínom. Ak sa nedokázal záchyt makrometastáz (0,2–2,0 mm), bolo toto vyšetrenie doplnené o sériové rezy (200 mm) a imunohistochemickú analýzu koktailom protilátok proti cytokeratínu na dôkaz okultných mikro, resp. nanometastáz. Non-sentinelové axilárne uzliny boli vyšetrované bez sériových rezov a imunohistochémie.
ŠTATISTICKÁ ANALÝZA
Klinické a paraklinické dáta pacientov ktorí boli diagnostikovaní a operovaní v našom ústave, sme získavali z nemocničného informačného systému PCS CARE a PACS (Picture Archiving and Communicating System). Pacienti s predoperačným manažmentom v spádových zdravotníckych zariadeniach mali informácie vyhodnotené z prinesenej dokumentácie. Analýza prediktívnych faktorov invazivity bola vykonaná matematickým softvérom Mathematica 5.0 a Excel 2007. Súbor bol testovaný na hladine významnosti 95 %, resp. 90 %. Signifikantnosť premenných sme skúmali Pearsonovým @-square testom s prípadnou Yatesovou korekciou a Fisherovým testom. Na základe univariantnej a multivariantnej analýzy logistického regresného modelu sme vybrali štatisticky vhodné premenné. Sila výsledného modelu je prezentovaná ROC krivkou a odhadom pravdepodobnosti výskytu invazivity u DCIS.
VÝSLEDKY
1. Metastatické postihnutie SU v skupine DCIS so zvýšeným rizikom invázie
SLNB sme neindikovali štandardne u každého DCIS, ale iba v prípadoch kde sme predpokladali zvýšené riziko invázie. Takto sme prospektivne vytvorili súbor 44 pacientov (37,0 %), ktorí mali vykonanú SLNB synchrónne s operačným výkonom na prsníku. Metastatické postihnutie SU sme zaznamenali u 4 pacientov (9,0 %). V 1 prípade (2,2 %) pri korektnej diagnóze DCIS a v 3 prípadoch (6,8 %) pri invazívnom karcinóme vo finálnej histológii. U pacientky s DCIS sa jednalo o mikrometastázu (veľkosť 0,4 mm) v jednej odstránenej sentinelovej uzline. Kompletná axilárna disekcia nepreukázala metastatické postihnutie non-sentinelových axilárnych uzlín (14/0).
Tri pacientky s reálnym invazívnym karcinómom mali verifikované metastázy v SU. V jednom prípade sa jednalo o makrometastázu, pričom v axilárnom disekáte sme zaznamenali ďalších 6 metastaticky postihnutých LU (15/+6).
U zvyšných 2 pacientok boli zistené mikrometastázy a indikovaná exenterácia axily. Ani v jednom prípade sa metastatické postihnutie non-sentinelových uzlín nevyskytlo.
Priemerný počet vyšetrených SU bol 2,42 a non-sentinelových LU 14,5. Jedna pacientka s makrometastázou mala postihnutú viac ako 1 sentinelovú uzlinu. V zostávajúcom súbore 75 pacientov (63,0 %) nebola SLNB indikovaná iniciálne ani v jednom prípade. U 3 pacientok sa jednalo o zákrok na spádových uzlinách v druhej etape pre dôkaz invázie, resp. mikroinvázie v definitíve. V 2 prípadoch pre finálnu diagnózu DCISMI a v jednom prípade pre invazívny karcinóm. Celkovo sme detekovali a vyšetrili 8 SU. Metastatické postihnutie sme nedokázali ani u jednej pacientky.
2. Metastatické postihnutie SU v skupine DCIS s mikroinváziou
Z celkového počtu 119 pacientov, sme identifikovali 6 prípadov (5,0 %), kde nález v definitívnej histológii spĺňal kritériá DCIS s mikroinváziou. U 4 pacientok bola vykonaná SLNB v prvej etape. V 2 prípadoch sme realizovali túto metódu v druhej dobe. Metastatické postihnutie sentinelovej uzliny sme v danej skupine pacientov nezaznamenali.
3. Výskyt invazívneho karcinómu a DCISMI v definitívnej histológii
V zostave 119 pacientok definitívna histológia potvrdila predoperačnú diagnózu DCIS v 100 prípadoch. V 19-ich prípadoch bol vo finálnej histológii verifikovaný invazívny karcinóm.
Z toho u 13 pacientok sa jednalo o invazívny duktálny karcinóm (10,9 %) a u 6 (5,0 %) bol zistený DCIS s mikroinváziou. V skupine 44 pacientov s „high risk“ DCIS sme detekovali u 4 pacientok (9,0 %) DCISMI a v 12 prípadoch (27,2%) invazívny karcinóm. Celkový podiel invazívnych lézií tvoril v danej skupine 36,2 %.
U zvyšných 75 pacientov s DCIS, kde sme nepredpokladali zvýšené riziko invázie, bola stanovená diagnóza DCISMI v 2 prípadoch (2,6 %) a invazívny karcinóm v jednom prípade (1,3 %). Celkový podiel invazívnych tumorov v tomto súbore činil 3,9 %.
4. Štatistické testovanie potencionálnych prediktorov invazivity
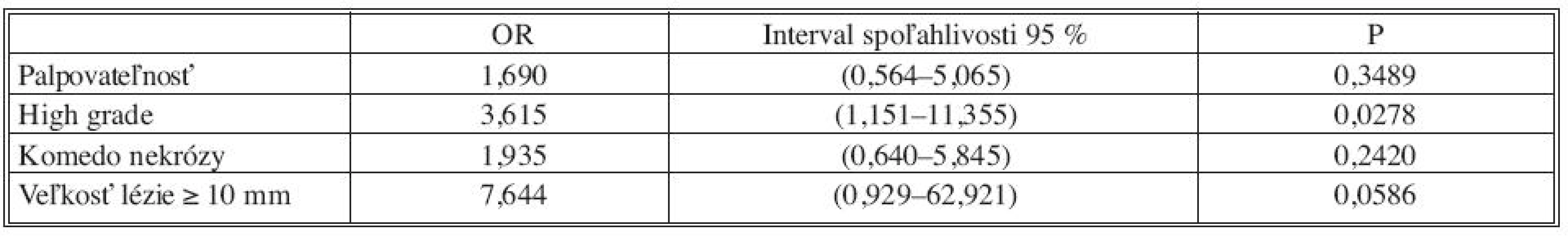
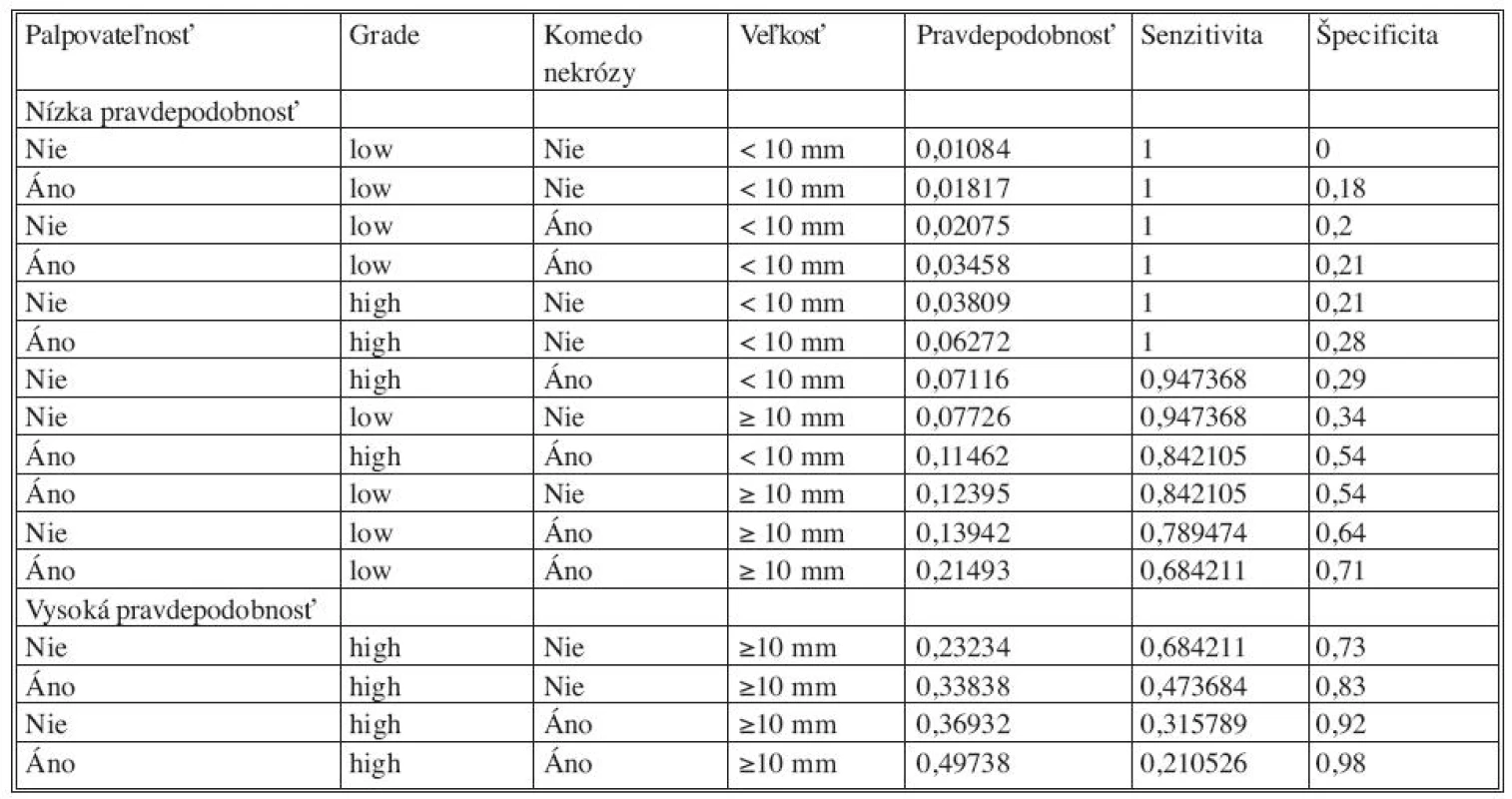
Analýzou prediktívnych faktorov invazivity štatistickými testami (Tab. 1) sme určili dve premenné (high grade, veľkosť lézie ≥ 10mm) signifikantné na hladine 95 % a ďalšie dve premenné (palpovateĺnosť lézie, komedo nekrózy) na hladine 90 %. Obdobné výsledky preukázala aj univariantná analýza regresného logistického modelu (Tab. 2). V tejto analýze high grade (OR 4,2; 95% CI 1,40-12,58) vykazoval vyše 4-násobný vplyv na výskyt invázie a veľkosť lézie ≥ 10 mm (OR 9,27; 95 % CI 1,19-72,44) mala až 9-násobný vplyv. Na nižšej hladine štatistickej významnosti vykazovali palpovateľnosť (OR 2,56; 95 % CI 0,94-7,0) a komedo nekrózy (OR 2,43; 95 % CI 0,88-6,77) približne 2,5-násobný vplyv na výskyt invázie. Multivariantnou analýzou (Tab. 2) sme potvrdili významnosť prvých dvoch spomínaných premenných. Napriek tomu, že nie všetky vybrané veličiny boli na hladine 95 %, do modelu sme zaradili všetky štyri (Tab. 3). Na základe výsledkov získaných z logistického modelu sme našli zlomový bod oddeľujúci nízku a vysokú pravdepodobnosť výskytu invázie (Tab. 4). High grade a veľkosť lézie ≥ 10mm sa ukázali ako štatisticky najvýznamnejšie prediktory invázie. Komedo nekrózy a palpovateľnosť lézie nevykazovali signifikantný vplyv na invazívnu transformáciu DCIS ložiska (Tab. 4). Sila výsledného modelu je prezentovaná ROC krivkou a odhadom pravdepodobnosti výskytu invazivity u DCIS (Graf 1).

DISKUSIA
Z celkového počtu 1 125 pacientov operovaných na KOCH OUSA s diagnózou primárneho karcinómu prsníka v rokoch 2008–2010 tvoril podiel DCIS v našom súbore 11,2 %. Je to približne 2,5-krát viac ako uvádza Národný onkologický register SR za r. 2006. Dôvody takéhoto stavu vidíme najmä v tom, že na Slovensku nie je zabezpečený celoplošný skríningový program. Značná časť pacientok je tak do nášho ústavu odosielaná z periférnej zdravotníckej siete za účelom realizovania preventívnych mamologických prehliadok. Ak zoberieme do úvahy, že len za rok 2010 sa cez diagnostické zložky nášho ústavu vykonalo približne 18 000 mamografií, je takáto vysoká záchytnosť DCIS založená na reálnom predpoklade.
Tématickou líniou našej práce bolo overenie axilárneho statusu u „high risk“ DCIS.
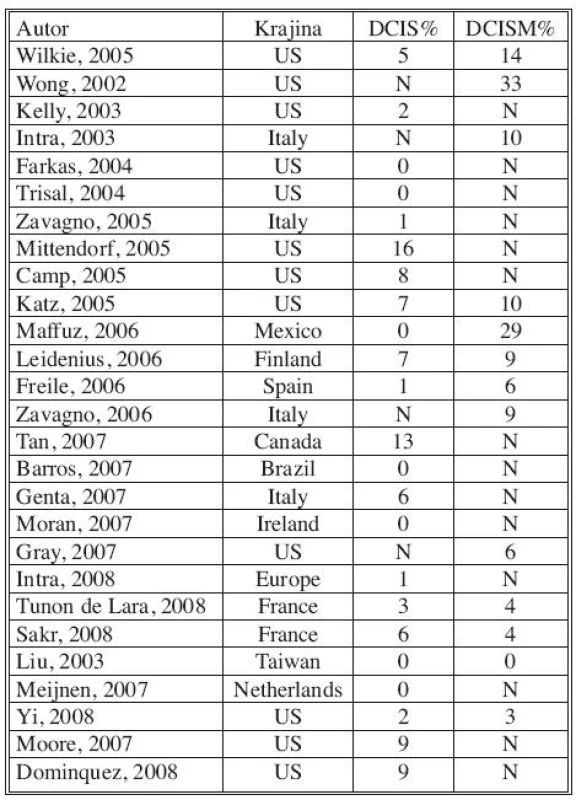
Pre heterogénnu skupinu DCIS sú uvádzané viaceré rizikové faktory u ktorých sa predpokladá, že môžu súvisieť s invazívnou transformáciou. Identifikácia prediktorov invazivity, ktoré by ešte predoperačne odhalili rizikové skupiny DCIS, vedie ku snahe selektovať pacientov vhodných k SLNB. Ako faktory asociované s vysokým rizikom invazivity sú často uvádzané: palpovateľná rezistencia, mamograficky detekované multicentrické lézie, histologická suspekcia na mikroinváziu, vysoký nukleárny grade, nekrózy, komedo typ, skríningový interval 3 a viac rokov, overexpresia Her-2/neu [9–13]. Metastatické postihnutie SU sa v takto selektovaných súboroch udáva v 4–12 % [10–13, 15]. V našej štúdii sme zaznamenali metastázy v SU u tejto rizikovej skupiny v 4 prípadoch (9,0 %), čo zodpovedá hore uvedeným poznatkom.
V rámci „high risk“ DCIS sme osobitne hodnotili axilárny status u pacientov s mikroinváziou. Diagnózu DCISMI sme stanovili v 6 prípadoch (5,0 %). U všetkých bola vykonaná SLNB, ale metastázy v spádových uzlinách sme nedetekovali. Tento fakt je síce v určitom rozpore so štatistickými zisteniami iných autorov, ale uvedomujeme si, že pri takto malej skupine pacientok majú uvedené údaje iba minimálnu výpovednú hodnotu. Napriek tomu je SLNB odporúčaná vo všetkých prípadoch DCISM, vzhľadom na zvýšenú incidenciu nodálnych metastáz [10, 14, 15, 26, 31–36]. Hodnotením metastatického postihnutia regionálnych LU pri korektnej diagnóze DCIS sme iba v jednom prípade (2,1 %) detekovali mikrometastázu v sentinelovej uzline. Toto naše zistenie je v súlade s literárnymi údajmi, kde je výskyt metastáz pri DCIS udávaný v 1–2 % [6, 10]. Z týchto dôvodov sa prevažná časť onkologických pracovísk kriticky stavia k zaradeniu SLNB do základného algoritmu chirurgickej liečby, nakoľko benefit operácie neprevyšuje riziká s ňou spojené [6–8, 20–22].
Výskyt invazívneho karcinómu v rámci DCIS je udávaný približne v 9–42 % [15, 20, 32, 36]. Z nášho súboru (n = 117) s predoperačnou diagnózou DCIS, predstavoval podiel všetkých invazívnych lézií necelých 16 %. Svoju rolu tu zrejme zohráva skladba pacientov, ktorí sú u nás v značnej miere zachytávaní pri „skríningu“ ešte v subklinickej forme.
Druhou príčinou môže byť skutočnosť, že pristupujeme aktívnejšie k chirurgickej liečbe suspektných lézií, resp. lézií nejasnej dignity. Teda v čase pred potencionálnou invazívnou transformáciou možného DCIS. Najvyšší štatistický význam vykazovala podľa očakávania cieľová „high risk“ skupina, kde boli invazívne lézie zastúpené až v 36,2 %. Naše výsledky podporujú aj závery podobných štúdií, kde je indikáciou k SLNB „high-risk“ DCIS s prítomnosťou jedného, resp. viacerých prediktívnych faktorov (Tab. 5) [9–12, 15, 35]. Napriek tomu súčasné odporúčania pre indikáciu SLNB pri DCIS sú v mnohom kontroverzné. V medicínskych databázach je publikovaných približne 50 štúdií, ktoré referujú o skúsenostiach so SLNB u žien s DCIS, pričom iba niektoré porovnávajú výsledky liečby po SLNB a exenterácii axily pri tomto ochorení [16, 17]. Pre kompletné hodnotenie metódy biopsie SLNB pri DCIS treba brať do úvahy nasledovné fakty:
- Väčšina štúdií prebieha u selektovanej skupiny pacientov (palpovateľná rezistencia, rozsiahly tumor, ,mastektomia, vysoký nukleárny grade, suspícia na inváziu) Nedostatkom väčšiny prác je skutočnosť, že v nich nie sú reprezentované všetky pacientky s DCIS, resp. ani väčšina.
- S prihliadnutím na fakt, že v mnohých prípadoch lézia podhodnotená pri core cut biopsii je nakoniec preklasifikovaná na invazívny karcinóm, treba hodnotiť aj vhodnosť a presnosť metódy biopsie sentinelovej uzliny pri DCIS. Väčšina štúdií demonštruje vhodnosť SLNB až po chirurgickej excízii [10, 18]. Rozdielna je však otázka presnosti tejto metódy. V niektorých prípadoch je falošná negativita sentinelovej uzliny po core cut biopsii alebo excízii porovnateľná, iné práce naopak udávajú falošnú negativitu signifikantne vyššiu po excízii v porovaní po core cut biopsii [19]. Vzhľadom na túto skutočnosť je aj hodnotenie incidencie sentinelových metastáz oddelené pri predoperačnej diagnóze DCIS a pri DCIS v definitíve.
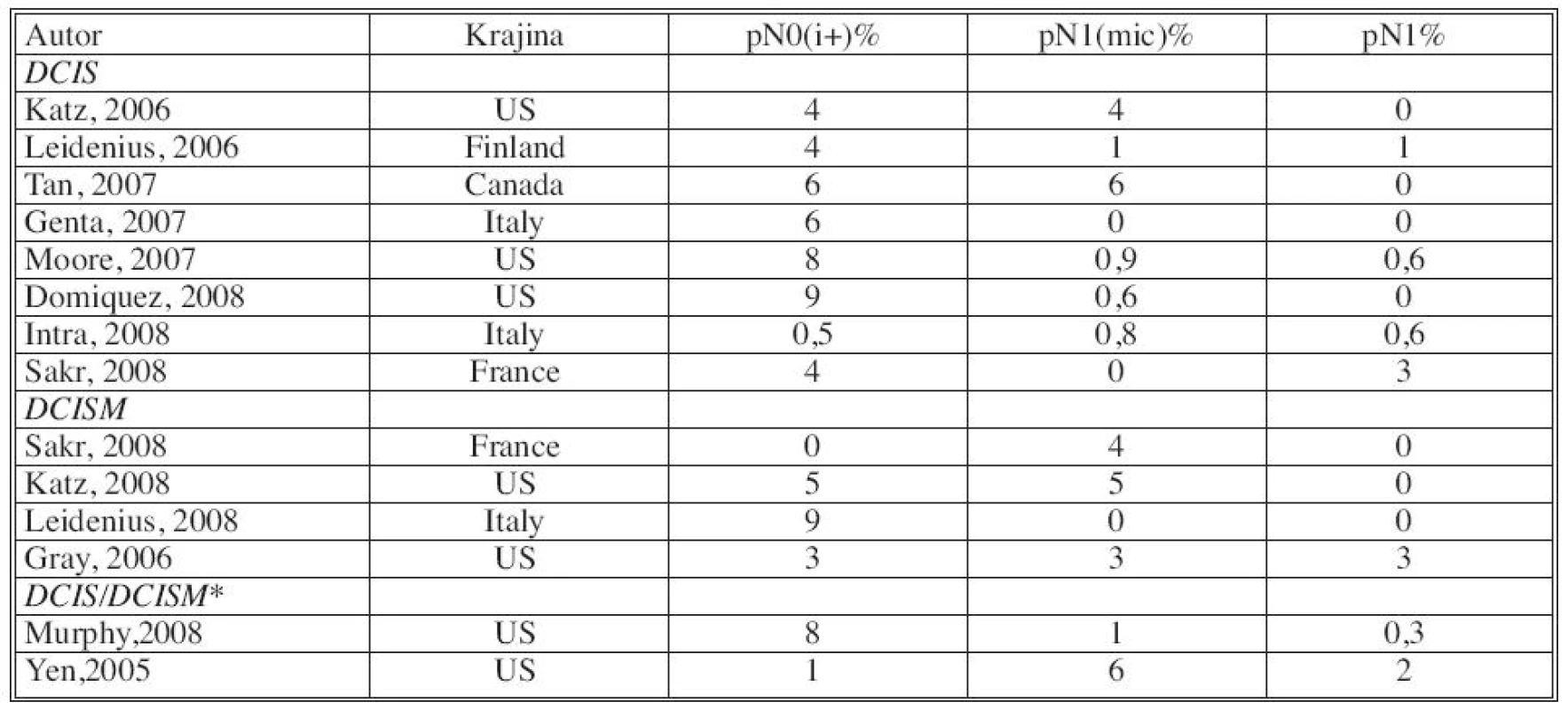
- Časť autorov hodnotí SLNB pri DCIS, vrátane DCIS s mikroinváziou, iní separátne iba pri DCIS. Na základe väčšiny prác je však pri DCISMI signifikantne vyššia incidencia metastatického postihnutia sentinelovej uzliny (Tab. 6).
- Výskyt metastáz v sentinelovej uzline varíruje aj podľa zvolených definícií. Niektoré štúdie sa pridržiavajú hodnotenia metastáz podľa AJCC kritérií (pN0, pNi, pNmic, pN1), iné klasifikujú prítomnosť metastáz v kategóriách MTS negat., HE +, IHC+, ale nešpecifikujú veľkosť metastázy. V iných sa nerozdeľujú metastázy na pNi, pNmic (Tab. 7).
- Chirurgický manažment pacientov po SLNB pri DCIS je rozdielny. V niektorých prípadoch sa vykonala ALND vždy u pozitívnej SU [15, 20–26, 31], iné štúdie selektovali pacientov pre axilárnu disekciu podľa prítomnosti makrometastázy v sentinelovej uzline [27], podľa celkového rizika metastatického ochorenia [28, 29], alebo podľa uváženia chirurga [30]. V chirurgickej liečbe pacientok s nálezom izolovaných nádorových buniek (ITC) nie je axilárna disekcia odporúčaná, avšak pri náleze mikrometastázy a makrometastázy k ALND pristupuje väčšina pracovísk [5–15, 24–37]. Niektorí autori ale nabádajú k zdržanlivosti pri indikácii ALND u čistého DCIS aj v prípade pozitívnej sentinelovej uzliny [7].
- Väčšina štúdií nereferuje o výsledkoch liečby, alebo o zmene ďalšej liečby, ktorá by sa odvíjala od výsledku SLNB. Sú teda skôr zamerané na popis metódy SLNB pri DCIS. Ďalšia liečba pacientok s pozitívnou sentinelovou uzlinou pri čistom DCIS je vysoko individuálna a bez záväzných odporúčaní. Nálezy, kedy pacienti s potvrdeným DCIS majú pozitívnu SU nastolujú otázku, či ide o ,,underdiagnosis“ invazívneho karcinómu, alebo ,,overdiagnosis“ pozitívnej sentinelovej uzliny.

ZÁVER
Biopsia sentinelovej uzliny nie je považovaná za štandardnú metódu v liečbe všetkých pacientov s DCIS. Aj keď v súčasnosti neexistuje jednoznačný konsenzus pre indikáciu SLNB u DCIS, je vo všeobecnosti táto metóda favorizovaná u DCIS so suspektnými známkami invazívneho prechodu, pri diagnóze DCISMI a v prípadoch extenzívneho DCIS u ktorého je predpoklad sanácie primárnej lézie mastektómiou [7–17, 27, 31–36]. Pacientky s prítomnosťou jedného, resp. viacerých prediktívnych faktorov invazivity sú napriek vyššiemu záchytu nodálnych metastáz indikované k SLNB na základe individuálneho zváženia.
V našej zostave pacientok sme potvrdili , že histologický high grade a veľkosť primárnej lézie prsníka viac ako 10 mm mali najväčší vplyv na výskyt invázie a boli štatisticky významné prediktory. Pritom vysokú dominanciu (impakt) mala velkosť lézie. Komedo nekrózy a palpovateľnosť ovplyvňovali výskyt invázie v menšej miere a neboli štatisticky významnými prediktormi invázie.
V skupine 44 rizikových pacientok bol v 9,0 % potvrdený DCISMI a v 27,2 % bol prítomný invazívny duktálny karcinóm. To znamená, že v rizikovej skupine pacientov bol celkový podiel invazívnych lézií 36,2 %. U všetkých sme vykonali SLNB. Metastatické postihnutie SU sme zaznamenali u 4 pacientov (9,0 %). V zostave 75 pacientok u ktorých sa nevyskytovali prediktívne rizikové faktory ,resp. ich kombinácia, sa invazívny karcinóm potvrdil len v jednom prípade ,čo predstavuje 1,3 %. DCISMI sme zistili v dvoch prípadoch t.j. v 2,6 %.
Na základe nami uvedených výsledkov vyplýva, že prezentovaná stratifikácia pacientok má praktický význam. Nazdávame sa, že indikácia k SLNB je v týchto prípadoch plne oprávnená a že pacienti s „rizikovým“ DCIS môžu mať z takéhoto postupu väčší profit, ako tí u ktorých SLNB nebola v prvej etape chirurgickej liečby indikovaná. Širšie objasnenie tejto problematiky bude zrejme vyžadovať viacero prospektívnych štúdií s veľkými súbormi pacientov a s vysokou výpovednou hodnotou.
Zložitosť predoperačnej diagnostiky, sofistikovanosť metódy biopsie sentinelovej uzliny a hľadanie príčinných súvislostí pri invazívnej transformácii tohto ochorenia budú istotne výzvou pre onkológov v nasledujúcom decéniu.
MUDr. Peter Chvalný
Bukova
5
811
02 Bratislava
Slovenská
republika
e-mail:
pchvalny@ousa.sk
Sources
1. Virnig, B. A., Tuttle, T. M., Shamliyan, T., Kane, R. L. Ductal Carcinoma In Situ of the Breast: A Systematic Review of Incidence, Treatment, and Outcomes. Journal of the National Cancer Institute, 2010; 102(3): 170–178.
2. Valenzuela, M., Julian, T. B. Ductal carcinoma in situ: biology, diagnosis and new therapies. Clin. Breast Cancer, 2007, 7 : 676–681.
3. Veronesi, P., Intra, M., Vento, A. R., et al. Sentinel lymph node biopsy for localised ductal carcinoma in situ. Breast, 2005, 14 : 520–522.
4. Incidencia zhubných nádorov v Slovenskej republike 2006, Národný onkologický register SR. Vydavateľstvo NCZI, Publisher NHIC, Bratislava 2010, ISBN 978-80-89292-21-9.
5. Baxter, N. N., Virnig, B. A., Dirham, S. B., et al. Trends in the treatment of ductal carcinoma in situ of the breast. J. Natl. Cancer Inst., 2004, 96 : 443–448.
6. Farkas, E. A., Stolier, A. J., Teng, S. C., Bolton, J. S., Fuhrman, G. M. An argument against routine sentinel node mapping for DCIS. Am. Surg., 2004; 70 : 13–18.
7. Intra, M., Rotmensz, N., Veronesi, P., Colleoni, M., et al. Sentinel node biopsy is not a standard procedure in ductal carcinoma in situ of the breast: the experience of the European institute of oncology on 854 patients in 10 years. Ann. Surg., 2008, Feb; 247(2): 315–319.
8. American Society of Breast Surgeons/ASBrS/ 11th Annual Meeting. Presented April 30, 2010, www.medscape.com/viewarticle/721152.
9. Klauber-DeMore, N., Tan, L. K., Liberman, L., et al. Sentinel lymph node biopsy: is it indicated in patients with high-risk ductal carcinoma-in-situ and ductal carcinoma-in-situ with microinvasion? Ann. Surg. Oncol., 2002; 7 : 636–642
10. Kurniawan, E. D., Rose, A., et al. Risk Factors for Invasive Breast Cancer When Core Needle Biopsy Shows Ductal Carcinoma In Situ. Arch. Surg., 2010; 145(11).
11. Klauber-DeMore, N., Tan, L. K., Liberman, L., et al. Sentinel lymph node biopsy: is it indicated in patients with high-risk ductal carcinoma-in-situ and ductal carcinoma-in-situ with microinvasion? Ann. Surg. Oncol., 2000 Oct; 7(9): 636–642.
12. Yen, T. W., Hunt, K. K., Ross, M. I., et al. Predictors of invasive breast cancer in patients with an initial diagnosis of ductal carcinoma in situ: a guide to selective use of sentinel lymph node biopsy in management of ductal carcinoma in situ. J. Am. Coll. Surg., 2005 Apr; 200(4): 516–526.
13. Meijnen, P., Oldenburg, H. S., Loo, C. E., et al. Risk of invasion and axillary lymph node metastasis in ductal carcinoma in situ diagnosed by core-needle biopsy. Br. J. Surg., 2007 Aug; 94(8): 952–926.
14. Zavagno, G., Belardinelli, V., Marconato, R., et al. Sentinel lymph node metastasis from mammary ductal carcinoma in situ with microinvasion. Breast, 2007 Apr; 16(2): 146–151.
15. Hilary, M. Shapiro-Wright, Julian, B. T. Sentinel Lymph Node Biopsy and Management of the Axilla in Ductal Carcinoma In Situ. Journal of the National Cancer Institute, No. 41, 2010.
16. Kelly, T. A., Kim, J. A., Patrick, R., et al. Axillary lymph node metastases in patients with a final diagnosis of ductal carcinoma in situ. Am. J. Surg., 2003 Oct; 186(4): 368–370.
17. Mabry, H., Giuliano, A. E., Silverstein, M. J. What is the value of axillary dissection or sentinel node biopsy in patients with ductal carcinoma in situ? Am. J. Surg., 2006 Oct; 192(4): 455–457.
18. Haigh, P. I., Hansen, N. M., Qi, K., et al. Biopsy method and excision volume do not affect success rate of subsequent sentinel lymph node dissection in breast cancer. Ann. Surg. Oncol., 2000 Jan-Feb; 7(1).
19. Krag, D. N., Anderson, S. J., Julian, T. B., et al. Technical outcomes of sentinel-lymph-node resection and conventional axillary-lymph-node dissection in patients with clinically node-negative breast cancer: results from the NSABP B-32 randomised phase III trial. Lancet Oncol., 2007 Oct; 8(10): 881–888.
20. Huo, L., Sneige, N., Hunt, K. K., et al. Predictors of invasion in patients with core-needle biopsy-diagnosed ductal carcinoma in situ and recommendations for a selective approach to sentinel lymph node biopsy in ductal carcinoma in situ. Cancer, 2006 Oct 15; 107(8): 1760–1768.
21. Sakr, R., Barranger, E., Antoine, M., et al. Ductal carcinoma in situ: value of sentinel lymph node biopsy. J. Surg. Oncol., 2006 Oct 1; 94(5): 426–430.
22. Intra, M., Veronesi, P., Mazzarol, G., et al. Axillary sentinel lymph node biopsy in patients with pure ductal carcinoma in situ of the breast. Arch. Surg., 2003 Mar; 138(3): 309–313.
23. Liu, C. L., Yang, T. L., Chen, B. F. Sentinel lymph node mapping with emulsion of activated carbon particles in patients with pre-mastectomy diagnosis of intraductal carcinoma of the breast. J. Chin. Med. Assoc., 2003 Jul; 66(7): 406–410.
24. Zavagno, G., Belardinelli, V., Marconato, R., et al. Sentinel lymph node metastasis from mammary ductal carcinoma in situ with microinvasion. Breast, 2007 Apr; 16(2): 146–151.
25. Polom, K., Murawa, D., Wasiewicz, J., et al. The role of sentinel node biopsy in ductal carcinoma in situ of the breast. Eur. J. Surg. Oncol., 2009 Jan; 35(1): 43–47.
26. Van la Parra, R. F., Ernst, M. F., Barneveld, P. C., et al. The value of sentinel lymph node biopsy in ductal carcinoma in situ (DCIS) and DCIS with microinvasion of the breast. Eur. J. Surg. Oncol., 2008 Jun; 34(6): 631–635.
27. Tan, J. C., McCready, D. R., Easson, A. M., et al. Role of sentinel lymph node biopsy in ductal carcinoma-in-situ treated by mastectomy. Ann. Surg. Oncol., 2007 Feb; 14(2): 638–645.
28. Katz, A., Gage, I., Evans, S., et al. Sentinel lymph node positivity of patients with ductal carcinoma in situ or microinvasive breast cancer. Am. J. Surg., 2006 Jun; 191(6): 761–766.
29. Moore, K. H., Sweeney, K. J., Wilson, M. E., et al. Outcomes for women with ductal carcinoma-in-situ and a positive sentinel node: a multi-institutional audit. Ann. Surg. Oncol., 2007 Oct; 14(10): 2911–2917.
30. Mittendorf, E. A., Arciero, C. A., Gutchell, V., et al. Core biopsy diagnosis of ductal carcinoma in situ: an indication for sentinel lymph node biopsy. Curr. Surg., 2005 Mar-Apr; 62(2): 253–257.
31. Vrtělová, P., Coufal, O., Pavlík, T., Bažout, M., Fait, V. Viditelnost na ultrasonografii jako nejsilnější prediktor invazivity u duktálních karcinomů in situ v retrospektivní studii. Klin. Onkol., 2009; 22(6): 278–283.
32. Gatěk, J., Hnatek, L., Dudešek, B. et al. Biopsie sentinelové uzliny u karcinomu prsu v klinické praxi. Rozhl. Chir., 2008; 87(4): 180–185.
33. Gatěk, J. Současný pohled na chirurgickou léčbu DCIS. Onkologie, 2010; 4(6): 353–356.
34. Fait V. Sentinelová biopsie a možnosti využití v současné onkochirurgii. Klin. Onkol., 2008; 21(1).
35. Coufal, O., Fait, V., Foltinová, V., et al. Chirurgická léčba karcinomu prsu v MOU. Rozhl. Chir., 2007; 86(10): 540–547.
36. Wilkie, C., White, L., Dupont, E., et al. An update of sentinel lymph node mapping in patients with ductal carcinoma in situ. Am. J. Surg., 2005, 190 : 563–566.
37. Červinka, V., Šťastný, K., Nechvátal, L., Pellant, A., Ryška, A. Význam imunohistochemického vyšetření při detekci metastáz v sentinelových uzlinách karcinómu prsu. Onkologia (Bratisl.), 2008, roč. 3 (4): 268–269.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2011 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
-
All articles in this issue
- Contribution of Mollecular Biology to the Diagnosis and Therapy of Colorectal Carcinoma – The Present and Future
- Different Impact of the Laparoscopic and Laparotomic Approach on the Immune Response Induced by Surgical Procedure
- Cholecystoduodenal Fistule as a Consequence of Calculouse Cholecystitis in a Female Elderly Patient
- Minimal Node Affection in Gastric Carcinoma – Pilote Multicentric Study Results
- Treatment Outcomes in Patients with Toxic Megacolon
- Benefits of Sentinel Lymph Node Examination in Early Breast Carcinoma
- Predictive Factors for Non-Sentinel Lymph Nodes Affection in Breast Carcinoma – Outcomes of a Czech Multicenter Study of Sentinel Lymph Nodes
- Ductal Carcinoma in Situ (DCIS) and Biopsy of the Sentinel Lymph Node
- 55 Laparoscopic Cholecystectomies Using Single Incision Laparoscopic Surgery– Initial Experience
- Ankle Fractures in Children
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Treatment Outcomes in Patients with Toxic Megacolon
- Ductal Carcinoma in Situ (DCIS) and Biopsy of the Sentinel Lymph Node
- Ankle Fractures in Children
- Benefits of Sentinel Lymph Node Examination in Early Breast Carcinoma
