Cerebral salt wasting syndrom (CSWS) – nezvyklá kazuistika z chirurgického pracoviště
Cerebral salt wasting syndrome (CSWS) – rare case from a surgical department
Introduction:
Cerebral salt wasting syndrome (CSWS) is one of several possible causes of the development of hyponatraemia in patients with severe cranial trauma associated with intracranial bleeding and brain oedema. Other possible causes of post-traumatic hyponatraemia include the syndrome of inappropriate antidiuretic hormone secretion (SIADH).
Case history:
The authors present the case of a twenty-five-year-old polytraumatized female patient who was treated in our department and who was diagnosed with cerebral salt wasting syndrome.
Conclusion:
In patients with severe cranial trauma and subsequent hyponatraemia, CSWS should be considered. It is crucial to distinguish between CSWS and SIADH as wrongly selected treatment can have serious or even fatal impacts for a gravely injured patient.
Key words:
CSWS – SIADH – cranial trauma − hyponatraemia
Authors:
D. Šmíd 1; P. Novák 1; J. Fichtl 1; V. Opatrný 1; D. Bludovský 2
Authors‘ workplace:
Chirurgická klinika FN a LF UK v Plzni, přednosta: prof. MUDr. V. Třeška, DrSc.
1; Neurochirurgické oddělení FN a LF UK v Plzni, primář: MUDr. V. Přibáň, Ph. D.
2
Published in:
Rozhl. Chir., 2014, roč. 93, č. 11, s. 549-553.
Category:
Case Report
Tato práce byla podpořena grantem MZ IGA NT14227.
Overview
Úvod:
Cerebral salt wasting syndrom (CSWS) tvoří jednu z několika možných příčin vzniku hyponatremie u nemocných s těžkým kraniotraumatem, které je spojeno s nitrolebním krvácením a se vznikem otoku mozku. Mezi další možné příčiny poúrazové hyponatremie patří syndrom of inappropriate anti diuretic hormone secretion (SIADH).
Kazuistika:
Jedná se o případ 25leté polytraumatizované ženy, která byla léčena na našem pracovišti a u které byl diagnostikován cerebral salt wasting syndrom.
Závěr:
U nemocných s těžkým kraniotraumatem a následným výskytem hyponatremie je nutné pomýšlet i na CSWS. Klíčové je rozlišení CSWS od SIADH, protože nesprávně zvolená léčba u těžce poraněného pacienta může mít závažné nebo dokonce fatální následky.
Klíčová slova:
CSWS – SIADH – kraniotrauma – hyponatremie
ÚVOD
Cerebral salt wasting syndrom (CSWS) neboli syndrom cerebrálně podmíněné ztráty vody a iontů soli tvoří jednu z několika možných příčin vzniku hyponatremie u nemocných po úrazu hlavy, zejména u těžších kraniotraumat spojených s nitrolebním krvácením a se vznikem otoku mozku [1,2,3]. Výskyt hyponatremie po vážném poranění mozku se v literatuře uvádí v rozmezí 14–30 %, častější výskyt je spojen se vznikem subarachnoidálního krvácení, až 56 % [14]. Současný výskyt hyponatremie a poranění hlavy patří mezi faktory zhoršující celkovou mortalitu a morbiditu nemocných [5,6,8,14]. Hyponatremii však nemusíme pozorovat jen u kraniotraumat, ale můžeme ji vidět i u nemocných po operacích mozku, u těžkých neuroinfekcí a u nemocných s nádory CNS. Většina těchto afekcí má jako společného jmenovatele otok mozku. Mezi další možné příčiny vzniku poúrazové hyponatremie patří syndrom nepřiměřené sekrece antidiuretického hormonu (SIADH, syndrom of inappropriate anti diuretic hormone secretion). V praxi je třeba diferenciálně diagnosticky odlišit zejména první dvě zmíněné příčiny vzniku hyponatremie, tedy CSWS a SIADH, a to ze dvou důvodů: z hlediska léčby a z hlediska rizika zhoršení mozkové perfúze. [1,2,3,10] CSWS pojem byl poprvé použit v roce 1950 Petersem a spolupracovníky, kdy popisovali případy tří nemocných s nitrolebním procesem doprovázeným otokem mozku, u kterých byla přítomna těžká hyponatremie, polyurie a i přes intenzivní léčbu přetrvávaly hypovolemie a vysoké ztráty sodíku močí [1]. O čtyři roky později popsal případ svého nemocného se stejnými příznaky Cort, zde však nebyla vyjádřena hypovolemie. Přesto použil stejný popis diagnózy, tedy CSWS [2]. Tento syndrom je definován jako perzistující hyponatremie, způsobená ztrátou sodných iontů močí, což je doprovázeno ztrátou vody a následným poklesem objemu extracelulární tekutiny. Mohou tak vzniknout projevy dehydratace, případně symptomy vyplývající z hyponatremie. Intenzita vyjádřených příznaků je přímo úměrná rychlosti vzniku poruchy a současně velikosti odchylky aktuální koncentrace sodných iontů od referenčního rozmezí. Základní klasifikační kritéria pro CSWS jsou uvedena v Tab. 1 [1,2,3,4,9,10,14].
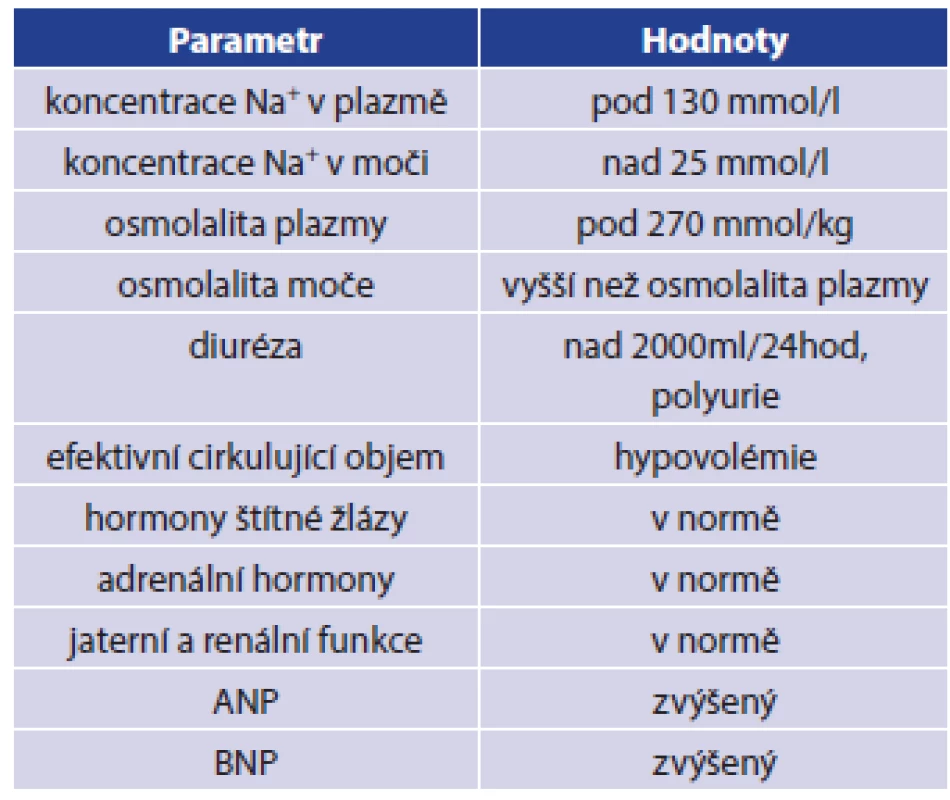
Rozpoznání symptomů je často komplikováno tíží poranění CNS a s tím související poruchou vědomí. Někdy může při náhlé změně koncentrace Na+ dojít ke vzniku zmatenosti, dezorientace, obojí však může být připisováno současně přítomnému poranění mozku. Nepřímou známkou progrese poruchy může být vznik hemokoncentrace, zvýšení plazmatické koncentrace albuminu a jiných proteinů krevní plazmy. Za klíčové v diferenciální diagnostice se považuje časté stanovení a porovnání vývoje hodnot plazmatické (sérové) koncentrace Na+, K+, močoviny, osmolality, BNP (mozkový natriuretický peptid, brain natriuretic peptide) a kreatininu. Současně se stanovuje z moči koncentrace Na+, močoviny, kreatininu, osmolality a frakční exkrece sodíku a vody. Stanovování koncentrace ADH (antidiuretický hormon, vazopresin) není v diferenciální diagnostice CSWS a SIADH přínosné, protože sekrece ADH může být zvýšena i u CSWS z důvodu přítomné hypovolemie a současně působících neosmotických stimulů sekrece ADH (stres, bolest, zvýšený intrakraniální tlak apod.). Léčba CSWS spočívá v doplnění chybějícího volumu tekutin a substituci sodíku. K doplnění chybějícího objemu tekutin se využívají krystaloidní infuzní roztoky, u traumatizovaných nemocných, kde je současně přítomna krevní ztráta, se v rámci komplexní péče mohou využít také krevní deriváty. Rychlost a množství podaných tekutin se řídí aktuálním stavem nemocného. Celkový příjem tekutin by se měl pohybovat kolem 50 ml/kg tělesné hmotnosti a den. Tekutiny lze podávat dle aktuálního stavu nemocného parenterálně, enterálně či perorálně. Kromě doplnění chybějícího objemu tekutin je třeba také korigovat hodnotu natremie. Ke korekci hyponatremie se doporučuje podání 150 ml 3% roztoku NaCl během 20 minut s následnou kontrolou hladiny natremie za 4 hod., očekává se zvýšení plazmatické koncentrace sodíku o 5 mmol/l. Korekce hyponatremie by mělo být dosaženo během 48–72 hodin, je však nutné dodržovat bezpečné změny plazmatické koncentrace sodíku s ohledem na riziko vzniku centrální pontinní myelinolýzy. Za limity bezpečné korekce hyponatremie se považuje zvýšení plazmatické hladiny sodíku rychlostí do 10 mmol/l během prvních 24 hodin a následně by neměla rychlost zvyšování překročit 8 mmol/l během 24 hodin. Z podpůrných léků se používá Fludrokortizon, který zvyšuje reabsorbci sodíku v distálním tubulu nefronu. Současně je třeba kontrolovat, zda nevznikla u nemocného iatrogenní hypertenze, hypokalemie či plicní otok. U nemocných se závažnými projevy hyponatremie se doporučuje aplikace 150 ml 3% NaCl po dobu 20 minut. Po aplikaci je nutná kontrola plazmatické koncentrace sodíku. Pokud nedojde ke zvýšení koncentrace sodíku o 5 mmol/l, tak se aplikace zopakuje. V případě, že dojde ke zvýšení koncentrace sodíku o 5 mmol/l v průběhu první hodiny a současně k vymizení příznaků hyponatremie, ukončíme aplikaci koncentrovaného NaCl a podáváme pomalou infuzi 0,9% NaCl. Plazmatickou hladinu koncentrace sodíku kontrolujeme v 6–12hodinových intervalech. V případě, že nedojde ani po navýšení koncentrace sodíku o 5 mmol/l k vymizení příznaků hyponatremie, doporučuje se podávání 3% NaCl. Rychlost navyšování plazmatické koncentrace sodíku by měla být 1 mmol/l za hodinu. Musíme však dodržet bezpečné limity korekce hypotremie. Aplikaci koncentrovaného roztoku NaCl ukončíme při dosažení plazmatické koncentrace sodíku 130 mmol/l [1,2,4,7,9,10,14].
V roce 1953 Leaf prokázal vznik hyponatremie jako důsledek podání antidiuretického hormonu, což vysvětlil zadržením nadměrného množství vody v těle, čímž došlo k dočasnému naředění extracelulární tekutiny a poklesu koncentrace iontů v krevním séru. Vlastní pojem SIADH použil až v roce 1957 Schwartz, který jej odlišil od CSWS [4,10,12]. Stejně je přítomna hyponatremie, avšak u SIADH není přítomna hypovolemie, ale euvolemie nebo hypervolemie. Příčinou je zvýšená sekrece antidiuretického hormonu v hypotalamu, popř. z jiné ektopické produkce nebo naopak zvýšená citlivost tubulárního systému ledviny na adekvátně tvořený ADH. Výsledkem je retence čisté vody, nárůst objemu extracelulární tekutiny, čímž dojde ke zvětšení objemu tekutiny, ve které je rozpuštěno omezené množství sodných iontů a tím dojde k poklesu plazmatické koncentrace sodíku. Protože dochází ke zpětné resorbci vody ve sběrných kanálcích ledvin, zjistíme vysokou natriurézu při oligurii, v některých případech je produkce moči normální. Diuréza bude závislá na objemu přijaté tekutiny, neboť je narušen regulační mechanismus sekrece ADH. Diagnostická kritéria pro SIADH při normální renální funkci jsou v Tab. 2 [1,2,3,4,9,10].
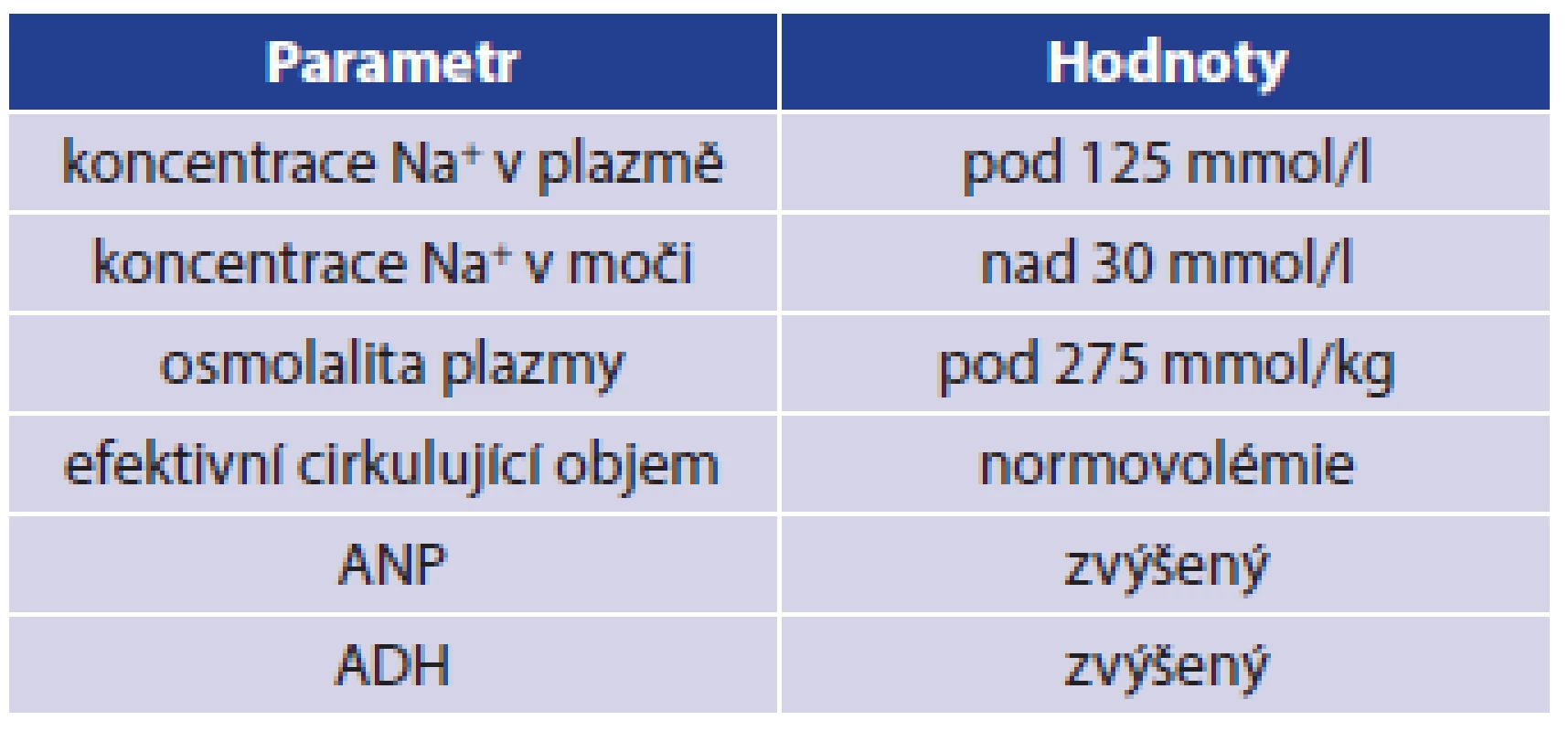
Vlastní syndrom může být dočasný, někdy i iatrogenní, ale jsou popisovány i chronické formy. Původně byl SIADH popisován u nemocných s nádory mozku, dnes však je známa celá řada příčin vzniku tohoto syndromu. Obecně se můžeme setkat s SIADH u nemocných s neuropsychiatrickým onemocněním, s nádorem mozku, u nemocných po neurochirurgické operaci či po závažném poranění CNS, u neuroinfekcí či některých onemocněních plic. SIADH může být iatrogenní v souvislosti s užíváním určitých léků, např. barbituráty, karbamazepin, tricyklická antidepresiva a selektivní blokátory zpětného vychytávání serotoninu. Vzácně je popisován tento syndrom u lidí po extrémní fyzické zátěži, např. byl popsán u běžců maratonského běhu. Při prudkém poklesu natremie může vzniknout podobně jako u CSWS porucha soustředění, zmatenost, dezorientace, v krajním případě může nemocný upadnout do bezvědomí nebo mohou vzniknout křeče. Pro přesnou monitoraci nemocných v těžkých stavech se využívá stejně jako u CSWS objektivní hodnocení náplně krevního řečiště. V akutním stavu se provádějí v rámci diferenciální diagnostiky stejná vyšetření jako u CSWS, viz výše v textu. Za nejprůkaznější se považuje provedení koncentračního testu při zátěži vodou, tento test se však nedoporučuje provádět u nemocných s hyponatremií kolem 120 mmol/l. Léčba SIADH v akutním stadiu spočívá v restrikci tekutin i za cenu využití diuretik. Dále se doporučuje podání antagonistů vasopresinových receptorů a demeklocyclinu v dávce 1 g denně. V případech oběhové nestability či nutnosti doplnění intravaskulární tekutiny se využívá 0,9% roztok NaCl. U chronického stavu se využívají diuretika, omezený příjem tekutin, zvýšený příjem či perorální substituce NaCl. V dlouhodobé léčbě se doporučuje podávat močovinu v dávce 0,25–0,50 g/kg/den. Další možností je podání selektivních blokátorů V2R (Vasopresin receptor), moderními preparáty jsou Lixivaptan, Mozavaptan, Satavaptan a Tolvaptan. Při léčbě zejména u akutních stavů je nutné stejně jako u CSWS myslet na riziko centrální pontinní myelinolýzy při rychlé změně koncentrace sodíku [4,8,9,10,13].
Kazuistika
25letá žena polytraumatizovaná kriminálním činem byla přivezena na naši ambulanci s lehkou poruchou vědomí, centralizovaná, hypotenzní, tachykardická. Při vstupním vyšetření byla zjištěna mnohočetná poranění měkkých tkání po celém těle s převahou na hlavě a horní polovině těla, dále byla zjištěna levostranná hemiparéza s plegií horní končetiny, bolestivá komprese s krepitací pravého hemithoraxu, kde byly současně oslabené dechové ozvy, břicho bylo stažené, neprohmatné, výrazně bolestivé v levém podžebří. Na provedeném celotělovém CT byl zjištěn subdurální hematom interhemisferálně, difuzní otok mozku bez známek konusu, prokrvácení frontálních a maxilárních sinů, zlomenina nosních kůstek, sériová zlomenina 2. až 7. žebra vpravo, tenzní pneumothorax vpravo s kompletním kolapsem plíce a přesunem mediastina, drobný hrotový pneumothorax vlevo, rozsáhlé kontuze obou plic, rozsáhlá centrální ruptura a objemný subkapsulární hematom jater, rozsáhlá fissura sleziny a hemoperitoneum. Urgentně jsme zavedli hrudní drenáž vpravo a provedli explorativní laparotomii. V dutině břišní jsme nalezli 1500 ml tekuté krve a četná koagula. Za zdroj krvácení byla označena lacerace dolního pólu sleziny, proto jsme provedli resekci dolního pólu sleziny, založili drenáž dutiny břišní. Po výkonu byla nemocná extubována, oběhově i ventilačně stabilní a hospitalizována na anesteziologicko-resuscitační klinice. První pooperační den došlo náhle ke vzniku těžké respirační insuficience, pro kterou byla nemocná intubována a napojena na umělou plicní ventilaci. V následujících šesti dnech došlo ke zlepšení ventilačních parametrů, nemocná byla oběhově stabilní, postupně odtlumena a extubována, stále přetrvávala levostranná hemiparéza. V průběhu sedmého pooperačního dne při mobilizaci nemocné došlo k rozvoji oběhové nestability, pro kterou byla provedena urgentní revize dutiny břišní. Příčinou bylo masivní hemoperitoneum při ruptuře objemného subkapsulárního hematomu jater. Dokončili jsme splenektomii a pro pokračující krvácení z jater jsme založili tamponádu dutiny břišní. Nemocná byla ponechána na umělé plicní ventilaci bez nutnosti oběhové podpory. Během několika hodin došlo k rozvoji břišního kompartment syndromu s anurií, pro který byla zrušena tamponáda dutiny břišní. Časně po operaci došlo znovu ke vzniku oběhové nestability při pokračujícím krvácení z jaterního parenchymu; znovu jsme založili tamponádu dutiny břišní. Pro pokračující krvácení z jaterního parenchymu při rozsáhlé centrální ruptuře jater byl proveden pokus o radiointervenční ošetření zdroje krvácení. V průběhu vyšetření se však nepodařilo prokázat zdroj krvácení vhodný k embolizaci. V následujícím týdnu bylo provedeno celkem 5 revizí dutiny břišní střídavě pro krvácení z jaterního parenchymu a střídavě pro břišní kompartment syndrom při založené tamponádě dutiny břišní. Nemocná byla celou dobu intubována na umělé plicní ventilaci. Po 7 dnech a celkem 5 operačních revizích dutiny břišní nebyly známky pokračujícího krvácení, byla zrušena tamponáda a definitivně uzavřena dutina břišní. Nemocná byla extubována a přeložena na jednotku intenzivní péče chirurgické kliniky, odkud byla po 5 dnech přeložena na standardní oddělení. Velmi rychle došlo k převedení na plný perorální příjem a zahájení rehabilitace. V klinickém obraze dominovala levostranná hemiparéza, hypotenze zejména posturální s prekolapsovými stavy, nízké hodnoty centrálního žilního tlaku, polyurie a polydipsie. V laboratorním nálezu dominovala hyponatremie. Pomocí magnetické rezonance a kontrolního CT jsme vyloučili poranění krční míchy, míšních kořenů a periferních nervů, nález na mozku byl ve výrazné regresi. Při intenzivní rehabilitační léčbě došlo postupně k návratu plné hybnosti levostranných končetin.
U nemocné jsme iontovou dysbalanci a dlouhodobě negativní tekutinovou bilanci zpočátku řešili v rámci komplexní intenzivní péče substitucí pomocí koncentrovaných roztoků (10% NaCl) a vysokým tekutinovým obratem, proto k úplnému demaskování projevů došlo až při převedení nemocné na plný perorální příjem. Laboratorní hodnoty, hodnoty tlaku krve, hodnoty centrálního žilního tlaku a tekutinovou bilanci znázorňuje Tab. 3.
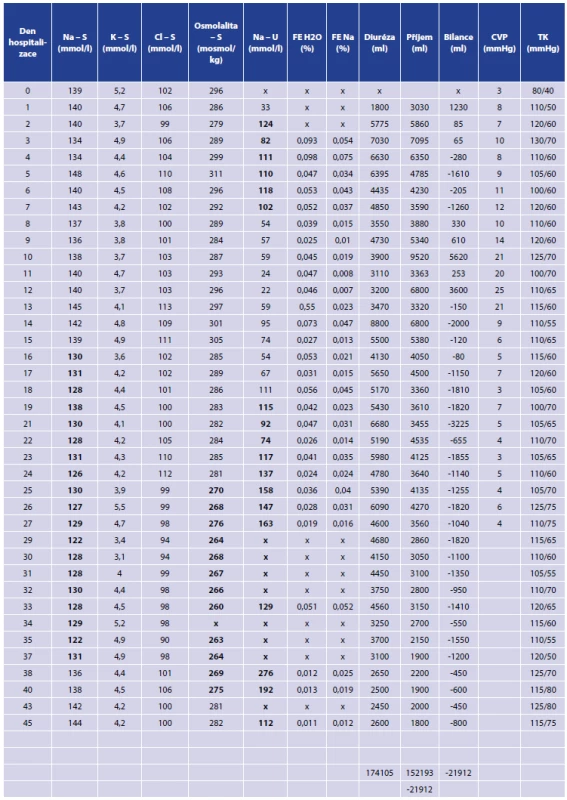
Zpočátku jsme u nemocné pátrali jen po příčině polyurie a dlouhodobě negativní tekutinové bilanci. Doplnili jsme magnetickou rezonanci mozku se zaměřením na hypofýzu, protože jsme uvažovali o centrálním diabetu insipidu. S ohledem na normální výsledek vyšetření jsme požádali o endokrinologické konzilium, kde bylo prvně vysloveno podezření na CSWS. Doplnili jsme požadovaná vyšetření, a protože nemocná byla na plném perorálním příjmu, zahájili jsme léčbu fludrokortisonem (Fludrocortison 0,2mg tbl. 2x denně), desmopresinem (Minirin 0,1mg tbl. 3x denně) a substituci Na (NaCl tbl. 3x3 denně). Postupně během týdne došlo ke snížení diurézy, vysadili jsme tedy Minirin, došlo také k normalizaci hladiny sodíku a vymizely všechny ostatní příznaky. Postupně byla vysazena i substituce NaCl. Nemocná byla bez pocitu žízně, bez prekolapsových stavů a perorální příjem tekutin se stabilizoval cca na 2000 ml/24 hod., přestože přetrvávala mírně negativní tekutinová bilance. Opakovaně byla přítomna normonatremie. Nemocná byla propuštěna do domácího ošetřování s medikací Fludrocortison tbl. 0,2 mg 2x denně.
DISKUZE
CSWS je obvyklá komplikace těžkého kraniotraumatu často ve spojení se subarachnoidálním krvácením a otokem mozku. Současně se však jedná o nepříliš častou diagnózu, se kterou se setkáváme u nemocných na chirurgických odděleních [11]. Více zkušeností s tímto syndromem mají specializovaná neurochirurgická pracoviště a dále pracoviště zabývající se komplexní léčbou o polytraumatizované pacienty. Zkušenosti s diagnostikou a léčbou mají také endokrinologové, protože u většiny diagnostikovaných se nejedná o důsledek poranění. V praxi při správném monitorování nemocných s kraniotraumatem a komplexní intenzivní péčí se hyponatremie nemusí projevit. Cílem léčby je udržet dlouhodobě normální hodnoty natremie a dostatečný objem intravaskulární tekutiny a tím korigovat hypotenzi. K substituci se zpočátku využívají koncentrované roztoky NaCl, ale korekce musí být pozvolná s ohledem na riziko vzniku centrální pontinní myelinolýzy. V akutních stavech platí, že je větší chybou provést restrikci tekutin u nemocných s hyponatremií způsobenou CSWS než podat fyziologický roztok nemocnému s SIADH. Velmi důležité v léčbě CSWS je sledování tekutinové a sodíkové bilance [5,6,8,9,10]. Na naší kazuistice jsme chtěli ukázat případ nemocné, kde došlo k vyslovení podezření na CSWS až delší čas od vlastního úrazu, zprvu jsme na přítomnost CSWS vůbec nepomýšleli.
ZÁVĚR
Z literárních údajů je patrné, že v případě těžkého kraniotraumatu a následného výskytu hyponatremie je nutné pomýšlet jako na jednu z možných příčin také na CSWS. Klíčové je však rozlišení CSWS od SIADH, protože nesprávně zvolená léčba u těžce poraněného pacienta může mít závažné nebo dokonce fatální následky [2,8,9,10,11]. Péče o polytraumatizované nemocné by měla probíhat ve specializovaných centrech, kde je zajištěn komplexní multioborový přístup a péče.
MUDr. David Šmíd
Žlutická 5
323 00 Plzeň
e-mail: smidd@fnplzen.cz
Sources
1. Peters JP, Welt LG, Sims EA, Orloff J, Needham J. A salt – wasting syndrome associated with cerebral disease. Trans. Assoc Am Physicians 1950;63 : 57−64.
2. Cort JH. Cerebral salt wasting. Lancet 1954;266 : 752−4.
3. Momi J, Tang CM, Abcar AC, Kujubu DA, Sim JJ. Hyponatremia – what is cerebral salt wasting? Perm jurnal 2010;14 : 62−5.
4. Sterns RH, Silver MS. Cerebral salt wasting versus SIADH: What difference? Jour Am Soc Nephrol 2008;19 : 194−196.
5. Audibert G, Steinmann G, Talance GS, Laurens MH, Dao P, el al. Endocrine response after severe subarachnoid hemorrhage related to sodium and blood volume regulation. Neurosurgical anesthesiology and neuroscience 2009;108 : 1922−1918.
6. Ascar A, Tarif N. Cerebral salt wasting in a patient with head trauma: Management with saline hydration and fludrocortisone. Saudi J kidney dis. and transplant 2007;18 : 95−99.
7. Costa KN, Nakamura HM, Cruz LR, de Miranda LSVF, Santos Neto RC, et al. Hyponatremia and brain injury. Absence of alterations of serum brain natriuretic peptide and vasopressin. Arq Neuropsiquiatr 2009;67 : 1037−1044.
8. Albanese A, Hindmarsh P, Stanhope R. Management of hyponatremia in patients with acute cerebral insult. Arch Dis Child 2001;85 : 246−251.
9. Vylam P, Šutak V, Winkler M. Posttraumatický syndrom cerebrálně podmíněné ztráty vody a iontů (CSWS) – kazuistika. Rozhl Chir 2006;85 : 269−272.
10. Jabor A, et al. Vnitřní prostředí. Praha, Grada Publishing 2008.
11. Lohani S, Devkota UP. Hyponatremia in patients with traumatic brain injury: Etiology, Incidence and severiry correlation. World neurosurgery 2011;76 : 355−360.
12. Schwartz WB, Benett W, Curelop S, Bartter FC. A syndrome of renal sodium loss and hyponatremia probably resulting from inappropriate secretion of antidiuretic hormone. Am J Med 1957;23 : 529−542.
13. Greenberg A, Verbalis JG. Vasopresin receptor antagonist. Kidney International 2006;69 : 2124−2130.
14. Spasovski G, et al. Clinical practise quideline on diagnosis and treatment of hyponatremia. Nefrol Dial Transplant 2014;29(2):i1−i39.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2014 Issue 11
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
-
All articles in this issue
- Komplikace v chirurgii
- Efekt dekomprese krční míchy při spondylogenní myelopatii na korové funkce mozku
- Vztah antikoagulační a antigregační terapie u nemocných s chronickým subdurálním hematomem k závažnosti předoperačního stavu a výsledku chirurgické léčby
- Pilonidální sinus – diagnóza na pomezí všeobecné a plastické chirurgie
- Cerebral salt wasting syndrom (CSWS) – nezvyklá kazuistika z chirurgického pracoviště
- Karcinóm sigmy v inkarcerovanej slabinovej prietrži
- 3D High Resolution anorektální manometrie ve funkčním hodnocení anorekta
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Cerebral salt wasting syndrom (CSWS) – nezvyklá kazuistika z chirurgického pracoviště
- Pilonidální sinus – diagnóza na pomezí všeobecné a plastické chirurgie
- Karcinóm sigmy v inkarcerovanej slabinovej prietrži
- Komplikace v chirurgii
