Žilní vstupy v onkologii
Venous access in cancer patients
The most commonly used permanent venous access devices in cancer patients are the port, PICC port and PICC catheter (peripherally inserted central catheter). It is always necessary to consider the type of venous access needed for each individual cancer patient. Implantation should be performed using modern instruments to minimize the risk of early and late complications and thereby a delay in oncological treatment. The use of ultrasound is recommended at all stages of introduction. Precise tip placement of the central catheter in the sinoatrial junction region further reduces the number of thromboses arising in the catheter. A trend towards the treatment of catheter infections is certainly to maintain the venous access without compromising the patient’s health. Permanent venous access devices allow the application of chemotherapy and repeated blood sample collections with minimal impact on the quality of life in cancer patients.
Keywords:
port – PICC – cancer patient – complication – tip position
Authors:
O. Zapletal 1; L. Sirotek 1; O. Coufal 1,2,3
Authors‘ workplace:
Klinika operační onkologie, Masarykův onkologický ústav, Brno
1; Klinika operační onkologie, Lékařská fakulta Masarykovy univerzity, Brno
2; Regionální centrum aplikované molekulární onkologie (RECAMO), Brno
3
Published in:
Rozhl. Chir., 2019, roč. 98, č. 11, s. 427-433.
Category:
Review
doi:
https://doi.org/10.33699/PIS.2019.98.11.427–433
Overview
Permanentní žilní vstupy implantované u onkologických pacientů jsou port, PICC port a PICC katétr (peripherally inserted central catheter). Je nutné vždy individuálně zvážit typ potřebného žilního vstupu u každého onkologicky nemocného. Implantaci je vhodné provádět s použitím moderních přístrojů tak, aby bylo minimalizováno riziko vzniku časných i pozdních komplikací a tím oddálení podání onkologické léčby. Použití ultrazvuku je doporučováno ve všech fázích zavádění. Přesné umístění distálního konce katétru do oblasti sinoatriální junkce dále snižuje množství trombóz vznikajících v souvislosti s katétrem. Trendem léčby nekomplikovaných infekcí dlouhodobých žilních vstupů je jistě jejich zachování a další možné používání. Dlouhodobé žilní vstupy umožňují aplikaci chemoterapie a opakované krevní odběry s minimálním ovlivněním kvality života u onkologicky nemocných.
Klíčová slova:
port – PICC – onkologicky nemocný – komplikace – lokalizace konce katétru
Úvod
Moderní léčba onkologických pacientů vyžaduje zpravidla opakovanou intravenózní aplikaci léčiv, tj. cytostatik, antibiotické terapie, krevních derivátů či parenterální výživy. Z hlediska komfortu pacienta i zdravotnického personálu je v dnešní době nemyslitelné podávání těchto látek cestou opakovaných venepunkcí. Využívá se proto systémů zavedených po určitou dobu do žilního řečiště (žilní vstupy), které umožňují opakované aplikace při minimálním dyskomfortu a s přijatelným množstvím komplikací.
Podle umístění distálního konce katétru dělíme žilní vstupy na centrální a periferní. Nejčastěji používaným periferním žilním vstupem je nitrožilní kanyla, která však umožňuje aplikaci pouze některých méně koncentrovaných či méně iritujících léčiv. Česká Společnost pro porty a permanentní katétry (www.sppk.eu) definuje situace, kdy je doporučena volba centrálního žilního přístupu [1]. Jsou přehledně uvedeny v tabulce (Tab. 1). Správnou indikací žilního vstupu předcházíme vzniku vaskulitid a dalších možných komplikací při paravazálním úniku.
Tab. 1. Indications for central venous access

Cytostatika se podle potenciálu působit poškození tkání dělí dle doporučení European Society of Medical Oncology (ESMO) na vezikanty, iritanty a nonvezikanty [2]. Do periferní žíly je možné aplikovat pouze ty chemoterapeutické režimy, které neobsahují koncentrované vesikanty či vasoiritanty (antracykliny, taxany, 5-fluorouracyl, platinové deriváty aj.).
Zavádění centrálních žilních vstupů by v dnešní době mělo být podmíněno užitím ultrasonografie (USG) ve všech jeho fázích [3]. Preimplantačně zjišťujeme pomocí USG stav žilního systému ve vybrané oblasti. V průběhu zákroku se využívá USG jednak při venepunkci, při kontrole směřování katétru a dále při ozřejmování polohy konce katétru. Popisujeme tak odlišné pohledy na jehlu (tzv. „in plane“ a „out of plane“) a na žílu („short axis“ a „long axis“). Nejméně rizikové je užití „in plane + long axis“ [4], kdy v USG obraze vidíme reálně průběh jehly a podélné zobrazení žíly. Užití ultrazvuku při venepunkci prokazatelně vede ke zvýšení počtu úspěšných kanylací [5]. V neposlední řadě je možné využití USG postimplantačně při vyhledávání komplikací, jako jsou pneumotorax, migrace katétru, trombóza apod.
1. Základní typy centrálních žilních vstupů a jejich výběr
V dnešní době je k dispozici několik základních typů centrálních žilních vstupů (Obr. 1):
- Klasický centrální žilní katétr (CŽK) zaváděný zpravidla cestou vena jugularis nebo vena subclavia
- PICC katétr (peripherally inserted central catheter) – tj. delší katétr, jehož konec je umístěn v centrální žíle, avšak zavedený je přes žílu periferní
- Hrudní port sestávající z katétru připojeného na aplikační komůrku implantovanou do podkoží v podklíčkové oblasti
- PICC port či „arm port“, jehož komůrka je menší a je implantována na vnitřní stranu paže
Fig. 1. Types of venous access devices

Klasický CŽK a PICC katétr jsou žilními vstupy, u nichž je jejich začátek vyveden na povrch těla, zatímco portové systémy (porty) patří mezi katétry plně implantované. S tím souvisí i rozdělení podle časového úseku, po který mohou být zavedeny v těle pacienta. Použití klasického CŽK je pouze krátkodobé (dny až týdny), PICC katétr bývá používán po dobu měsíců, portový systém řádově roky.
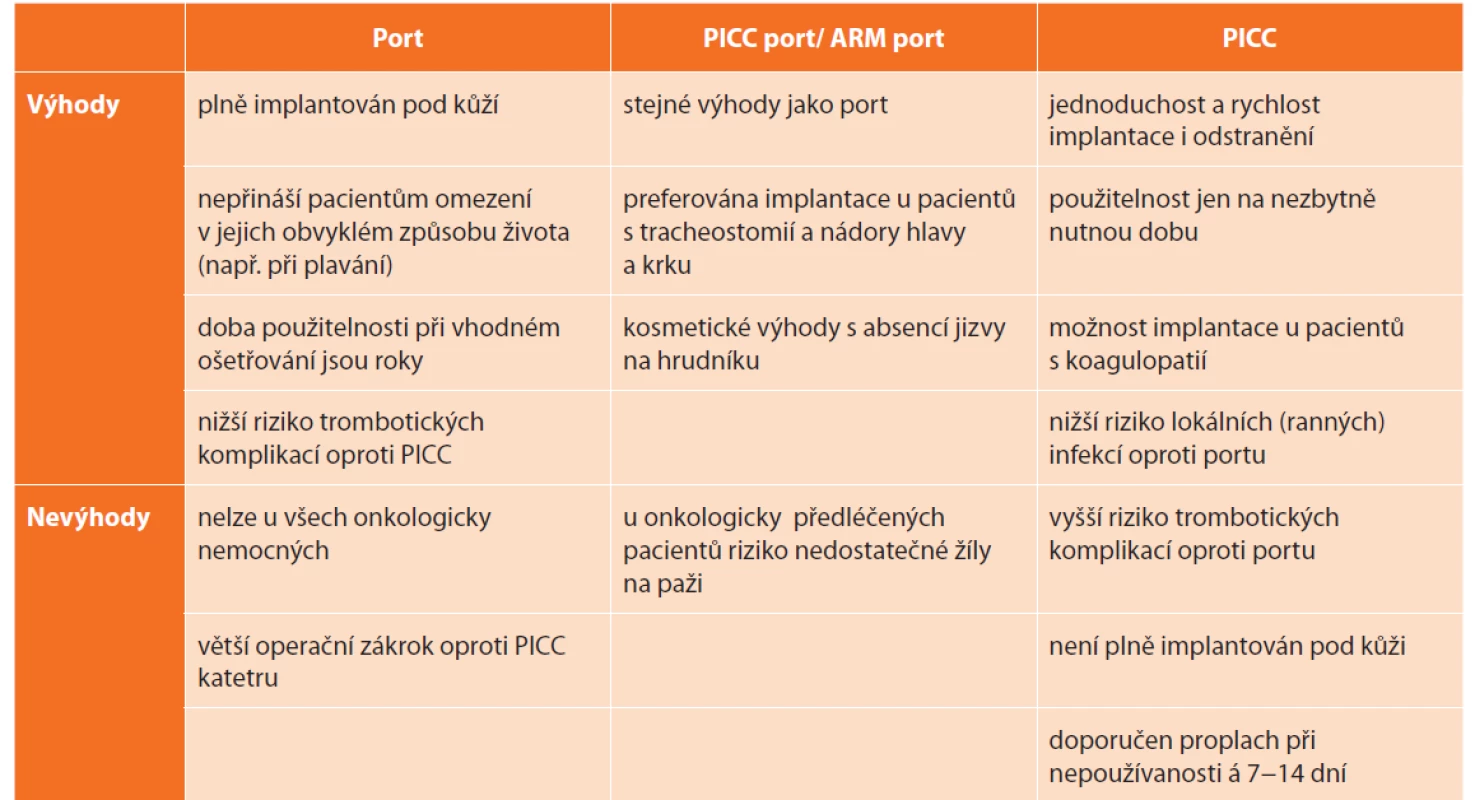
Při výběru typu pomůcky mají být zohledněny vlastnosti podávané látky, předpokládaná délka podávání (měsíce, roky), onkologická diagnóza a přítomnost dalších klinicky relevantních faktorů (tracheostomie, stp. disekci axily apod.). Doporučení typu žilního vstupu je většinou v gesci ošetřujícího onkologa, nicméně definitivní volba a zodpovědnost leží na lékaři, který systém implantuje. Je třeba důrazně zohlednit i preference pacienta, který nejlépe zhodnotí předpokládaný vliv pomůcky na svou kvalitu života. Obecné výhody a nevýhody jednotlivých typů katétrů shrnuje tabulka (Tab. 2).
Tab. 2. Advantages and disadvantages of different types of central vein access devices
Pro správnou indikaci ze strany ošetřujícího lékaře je vhodná znalost konkrétních pomůcek používaných na daném pracovišti. Výrobci u jednotlivých typů katétrů totiž uvádějí podrobnější parametry, které mohou ovlivňovat způsoby dalšího ošetřování a možnosti užití žilních přístupů při kontrolních paraklinických vyšetřeních (CT, MR). Jednotlivé pomůcky se liší nejčastěji nutností heparinizace systému, tj. užití roztoku heparinu při posledním proplachu, maximálním průtokem katétru a maximálním možným tlakem při podání kontrastní látky při CT vyšetření.
2. Umístění žilního vstupu
Místo implantace centrálního žilního vstupu musí být především prosto nádorů a infekčních agens. Přístup do žíly i stranové umístění portové komůrky je stále předmětem diskuzí. V případě hrudních portů je možno punktovat jednak v. jugularis interna, truncus brachiocephalicus, vena subclavia ze supraklavikulárního či infraklavikulárního přístupu a vena axillaris. V případě pažních portů a PICC katétrů jsou vhodné vena brachialis a vena basilica na vnitřní straně paže, dále vena cefalica a vena axilaris. Průměr zvolené žíly však musí být minimálně trojnásobkem průměru implantovaného katétru [6]. Obecně není doporučována implantace portu cestou v. femoralis [7]. Stranové umístění je dáno především přáním pacienta a jeho onkologickou diagnózou.
U pacientů s nádory hlavy a krku (v kterémkoli stadiu onemocnění) volíme obecně stejnou lokalizaci centrálního žilního vstupu jako u pacientů s tracheostomií. Žilní vstup je zde vhodné umístit co možná nejdále od otevřených dýchacích cest. Jejich bezprostřední okolí je totiž kolonizováno množstvím bakterií. Volíme tedy pažní port nebo PICC katétr.
U pacientek s nádory prsu volíme vždy kontralaterální stranu, vzhledem k prodělanému či předpokládanému chirurgickému výkonu na stejnostranných spádových uzlinách. V případě oboustranných exenterací axily je možno po ultrazvukovém vyšetření implantovat cestou tr. brachiocephalicus či v. jugularis interna.
U nádorů jícnu a gastroezofageální junkce s potenciálem resekčního výkonu je vhodné zvolit raději periferně zavedený žilní přístup, nebo po domluvě s operatérem zvolit stranu, která nebude interferovat se zamýšlenou torakotomií a stranou zvolenou ke krční anastomóze.
U pacientů v preterminálním stadiu a s krátkou očekávanou délkou života volíme raději PICC katétr. Je snadno ošetřovatelný a použitelný pracovníky Domácí péče v domácím prostředí pacienta a nevyžaduje užití Huberových jehel.
Preference pacientů vycházejí nejčastěji z jejich aktivit v pracovním životě a volném čase. V případě profesionálních řidičů je vhodná implantace portové komůrky vpravo. Vlevo může dojít opakovanou traumatizací bezpečnostním pásem k proležení komůrky. Uživatelé dlouhých palných zbraní (např. myslivci, vojáci) preferují implantaci portové komůrky do podklíčkové oblasti na nedominantní straně (možnost traumatizace pažbou zbraně).
3. Technika implantace
Zavedení portového systému je chirurgickým zákrokem, který je nutné provádět v prostředí operačního sálu. Implantace portu je v současné době v České republice prováděna lékařem. Implantace začíná vždy prekanylačním ultrazvukovým vyšetřením a výběrem vhodné žíly. K dezinfekci kůže by mělo být užito kožního antiseptika s obsahem chlorhexidinu (2% chlorhexidin glukonát v 70% isopropyl alkoholu), který signifikantně snižuje množství infekcí spojených s žilním vstupem (CRBSI – catheter-related bloodstream infection) [8]. V místní anestezii je pacientům nejprve punktována přístupová žíla a poté vytvořena podkožní kapsa pro implantaci portové komůrky. Tato může být umístěna v podklíčkové oblasti u hrudního portu, nebo v oblasti vnitřní strany paže u PICC portu. Po inzerci a fixaci komůrky portu je následně provedena sutura ran včetně pomocných tunelizačních nářezů [9].
Místo venepunkce závisí především na kvalitě a průměru punktované žíly, přehledností lokality v USG obraze a preferencí pacienta. Hlavním činitelem, který ovlivňuje míru rizika vzniku trombózy v punktované žíle, je její průměr jak v místě punkce, tak centrálněji, tedy v úseku žilního řečiště, který implantováním katétru arteficiálně zúžíme. Průměr katétru, udávaný ve Frenchích (1 French = 0,33 mm), můžeme modifikovat výběrem odlišného portu v závislosti na zjištěném průměru žíly při preimplantačním ultrazvukovém vyšetření. Průměr katétrů je dnes 6–7,5 Fr u hrudních portů, 4,5–5,5 Fr u PICC portů a 4−6 Fr u PICC katétrů. PICC katétry existují i vícecestné (1−3cestné), užívané především v intenzivní medicíně. Jednoznačně jsou dnes preferovány portové systémy s mikropunkční jehlou, která minimalizuje traumatizaci punkčního místa žíly a při opakovaných punkcích snižuje množství komplikací u punktovaných nežilních struktur (arterie, pleurální dutina, nerv, okostice) a tím výrazně ovlivňuje následnou morbiditu pacientů.
Zavedení PICC katétru je v ČR zpravidla v kompetenci lékařů, nicméně světové trendy směřují k implantaci erudovanou sestrou. Vzhledem k trvalému vyústění katétru na kůži je nutné důsledně dbát pravidel asepse po celou dobu ošetřování. Optimální místo punkce kůže při implantaci PICC katétru se nachází v proximální části střední třetiny paže. Není příliš blízko axily a zároveň je to místo s nejlepším přístupem do co nejširší žíly na paži. Při nedodržení pravidla třetiny průměru katétru pacienta vystavujeme zvýšenému riziku trombotických příhod na dané horní končetině [6,10] včetně jejích krátkodobých i dlouhodobých následků (otok horní končetiny). Doporučovaná je bezstehová fixace lepením na kůži (Statlock) či použitím podkožní kotvičky (Securacath). Místo vpichu na kůži je navíc vhodné „uzavřít“ tkáňovým akrylátovým lepidlem a krýt transparentním krytím, které umožňuje denní aspekci místa vpichu bez nutnosti převazu.
Zavedení centrálního žilního katétru patří k běžně prováděným výkonům v intenzivní péči. Místo přístupu i technika provedení se mohou poněkud lišit v závislosti na zvyklosti jednotlivých pracovišť. Centrální žilní katétr zavedený cestou vena subclavia lze při dodržení zásad vhodného ošetřování využít v hospitalizační onkologické péči po dobu až 3 týdnů.
Zavedení periferní intravenózní kanyly – krátkodobého periferního žilního vstupu – je zcela v kompetenci onkologických sester stacionáře či oddělení.
4. Lokalizace distálního konce katétru
Vzhledem k důsledné minimalizaci rizik trombotických příhod je nutné umístit konec centrálního katétru do přechodu horní duté žíly a pravé síně [11−13]. Detekovat nejvhodnější místo vyústění katétru lze jednak land-mark technikou, skiaskopicky, za pomoci intrakardiálního EKG, popřípadě echokardiograficky. Jednotlivé metody se liší jednak přesností, ale i použitelností u jednotlivých pacientů.
Land-mark technika za pomoci odměřování či odhadu vzdálenosti jednotlivých anatomických struktur je metodou nejméně přesnou a umístění kavoatriální junkce nám lokalizuje velmi nepřesně. Je však vždy dostupná a není k ní potřeba dalších zdravotnických přístrojů. V dnešní době není u elektivních zákroků, což implantace žilních vstupů v onkologii jistě je, doporučována.
Skiaskopická metoda patří dnes v České republice ke standardní metodě zaměření distálního konce katétru. Katétry jsou RTG kontrastní, použití kontrastní látky k detekci konce katétru je proto vždy rozhodnutím kanylujícího lékaře. Její možná nepřesnost je pak dána především sumací srdečního stínu ve skiaskopickém obraze. Umístění kavoatriální junkce můžeme na skiaskopickém snímku odhadovat dle umístění okolních struktur, 3–5 cm kaudálně od kariny, 2 obratlová těla pod karinou, dle polohy projasnění pravého intermediálního bronchu, kontury přechodu horní duté žíly do pravé síně atd.
Detekce kavoatriální junkce elektrokardiograficky je metodou nejpřesnější, nejlevnější a nejrychlejší [14,15]. V oblasti přechodu horní duté žíly do pravé komory se nachází sinoatriální uzel, jehož aktivitu je možno graficky znázornit jako p-vlnu na EKG záznamu. Peroperačním porovnáváním tvaru a amplitudy p-vlny intrakardiálním EKG můžeme detekovat aktuální umístění konce katétru vzhledem k sinoatriálnímu uzlu. Tímto je možno reálně a relativně přesně zaměřit polohu konce katétru bez nutnosti ozařování pacienta skiaskopicky. Navíc odpadá i užití RTG i.v. kontrastní látky s jejími možnými nežádoucími účinky. Užití intrakardiálního EKG může být omezené u pacientů bez sinusového rytmu (fibrilace síní, zavedený kardiostimulátor) [16]. Intrakardiální EKG můžeme realizovat za pomoci solného můstku nebo užitím drátku (vodiče), jehož konec je umístěn v konci katétru.
Využití echokardiografické metody k detekci konce katétru není možná u všech pacientů, používá se především u dětí [17]. Centrální (abdominální) obezita, patologická kumulace ascitu v dutině břišní i poloha pacienta na zádech nepřispívají k dobrému ultrazvukovému zobrazení ze subxifoidálního pohledu. V interkostálním (parasternálním) pohledu je zase obtížnější podélná projekce zobrazující horní a dolní dutou žílu a pravou síň. Tato metoda jen zřídkakdy zobrazí konec katétru přímo, je tedy nutné užití kontrastní látky – mikrobublinky plynu ve fyziologickém roztoku. Umístění konce katétru tak odhadujeme pomocí časové odchylky mezi podáním kontrastu a grafickým zobrazením na ultrazvukovém přístroji.
5. Komplikace
Komplikace spojené se zavedením permanentního žilního vstupu rozdělujeme podle časového hlediska na periimplantační, časné (do 30 dnů od implantace) a pozdní (Tab. 3). Dále je možné komplikace rozdělit na obecné, týkající se všech žilních vstupů obecně, a specifické, souvisící s jednotlivými typy použité pomůcky.
Tab. 3. Types of complications

Bezprostřední (periimplantační) komplikace souvisejí s vybranou lokalitou pro implantaci. Při zavádění hrudního portu jsou to: pneumothorax, hemothorax, srdeční arytmie, poranění brachiálního plexu a vzduchová embolie. Dále sem můžeme zařadit punkci podklíčkové tepny. Její punkce mikropunkční sadou je oproti punkci standardní punkční jehlou zatížena menší traumatizací stěny [18]. Počet bezprostředních komplikací je možno výrazně snížit peroperační reálnou ultrazvukovou lokalizací jehly a punktované žíly [19]. Nejčastější periimplantační komplikací je pneumothorax, jeho výskyt je udáván 0,5−3 % [20,21]. V případě pažního portu a PICCu jsou bezprostřední komplikace poranění struktur na vnitřní straně paže – poranění a. brachialis, vv. brachiales i vláken nervus ulnaris a medianus.
Časné komplikace zahrnují především poruchy hojení rány a souvisejí s technikou provedení implantace. Řadíme sem hematom v místě implantace a prodloužené hojení operační rány (epidermolýza, dehiscence). Četnost hematomu v místě implantované komůrky portu bývá udávána do 1 % [22].
Mezi pozdní komplikace, které se vyskytují za dobu déle než 30 dní od implantace, patří infekce, trombóza a technické selhání (ruptura katétru, otočení komůrky portu, proležení části portu).
Infekci v místě zavedeného žilního vstupu je možno rozdělit na lokální a s celkovými příznaky. Lokální infekce vyžaduje vždy aktivní přístup ošetřujícího lékaře k zabránění dalšímu šíření infekce. Lokální infekt v místě punkce kůže u PICC katétru je možné řešit konzervativně řádným chirurgickým ošetřením a přelepením transparentním krytím nejlépe s antibakteriálním činidlem, např. chlorhexidinem. Terapie lokální infekce v místě hadičky PICC katétru či komůrky portu v hrudní i pažní oblasti závisí na závažnosti lokálního nálezu a původci infektu. V průběhu léčby kombinací aplikace lokální antibiotické zátky a celkové antibiotické terapie je nutná pravidelná kontrola lokálního nálezu. Při bakteremii přetrvávající nad 72 hodin, relapsu v průběhu antibiotické léčby a kontaminaci katétru či komůrky mykotickým nebo multirezistentním původcem je nutná explantace portu [23].
Při infekci s celkovými příznaky (CRBSI – catheter-related bloodstream infection) je nutná inspekce místa žilního vstupu a odlišení od případného infekčního fokusu v jiné lokalitě. Vhodný je odběr hemokultur jednak z implantovaného žilního vstupu a dále z periferie. V případě nutnosti explantace pomůcky u pacienta s insuficientním periferním žilním řečištěm je vhodné zavedení krátkodobého centrálního žilního katétru k aplikaci intravenózní antibiotické terapie. Četnost CRBSI je nejčastěji udávaná na 1000 dnů se zavedeným žilním přístupem. U PICC katétrů se hodnoty pohybují v rozmezí 0,2−0,6/1000, u portů pak 0,1−0,2/1000 [9,12,24].
Trombotické komplikace lze obecně rozdělit na okluze, tedy neprůchodnost katétru, trombotické komplikace související s koncem katétru (centrální) a pak trombotické komplikace v místě žilní kanylace (periferní), které jsou typické zejména pro PICC katétry a PICC porty.
Okluze katétrů stojí svou podstatou mimo běžné trombózy. Jsou následkem nedostatečného proplachu, kdy dochází uvnitř katétru ke vzniku krevní sraženiny nebo vysrážení nekompatibilních látek v lumen katétru. Okluze se klinicky projeví obtížnou, případně nemožnou aplikací do katétru. Správná technika proplachu je nejlepší prevencí okluze. Fyziologický roztok aplikovaný metodou Start-Stop vytvoří uvnitř katétru turbulentní proudění, které vede k dostatečnému vypláchnutí zbytků krve nebo léčiv z katétru. Heparin nebo jiná protisrážlivá činidla se v prevenci okluzí neosvědčily [25]. V případě již vzniklé okluze na podkladě krevní sraženiny je účinnou metodou vedoucí k obnovení průchodnosti katétru intrakaterová trombolýza [26].
Centrální trombotické komplikace mají symptomatologii podobnou. Postupně dochází k obtížné aspiraci krve z katétru, následuje obtížná až nemožná aplikace. I v případě této komplikace je známá účinná prevence, spočívající ve správném uložení konce katétru. Lokalizace konce katétru do oblasti kavoatriální junkce redukuje četnost tohoto typu trombotických komplikací na jednotky procent. Již vzniklou trombózu v oblasti konce katétru je možné léčit terapeutickou dávkou nízkomolekulárního heparinu s cílem prevence nárůstu trombu, obnovení funkce katétru a prevence posttrombotických změn v centrálním žilním řečišti.
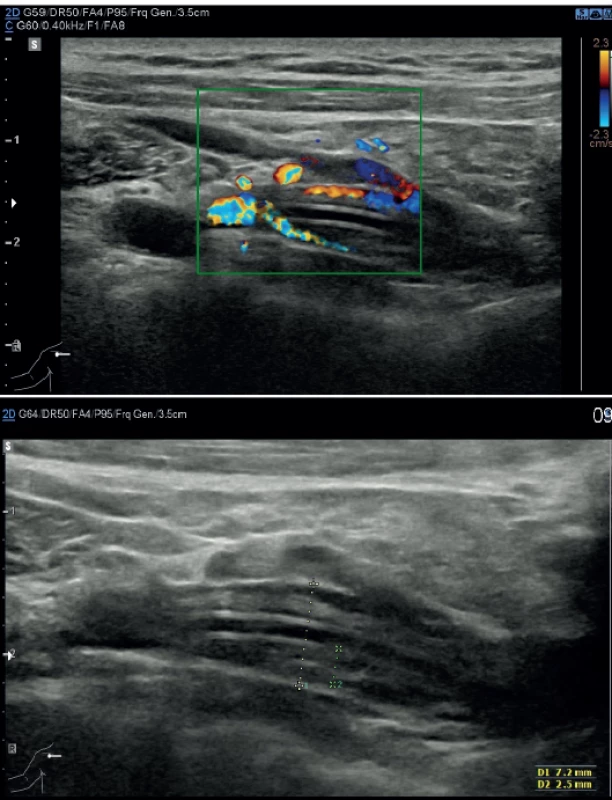
Trombotické komplikace v místě kanylace žíly jsou u centrálních žilních vstupů nejčastější a jsou vnímány jako trombózy v užším smyslu slova. Etiologicky jsou způsobeny Virchowovou triádou – poškození endotelu cévní stěny, stáza krve a hyperkoagulační stav. Diagnostika se zakládá na USG vyšetření (Obr. 2). I u periferních trombotických komplikacích je znám soubor opatření vedoucích k minimalizaci rizika jejich vzniku. Je to rutinní použití USG, volba optimální žíly, mikropunkční technika kanylace a použití katétru o nejmenším možném průměru. Již vzniklou trombózu je možné v iniciální fázi léčit terapeutickou dávkou nízkomolekulárního heparinu. V případě trvající potřeby katétru není vyžadována jeho extrakce. Výjimkou je septická tromboflebitida nebo syndrom horní duté žíly, kdy je extrakce doporučována [27]. Při dodržení opatření k prevenci vzniku trombózy v místě kanylace je incidence symptomatických trombóz u pacientů se solidními nádory 4–12% u PICC katétrů a 1−3 % u portů [28].
Fig. 2. Partial thrombosis of subclavian vein where the
central end of the catheter is found: Doppler mode (above);
USG (below)
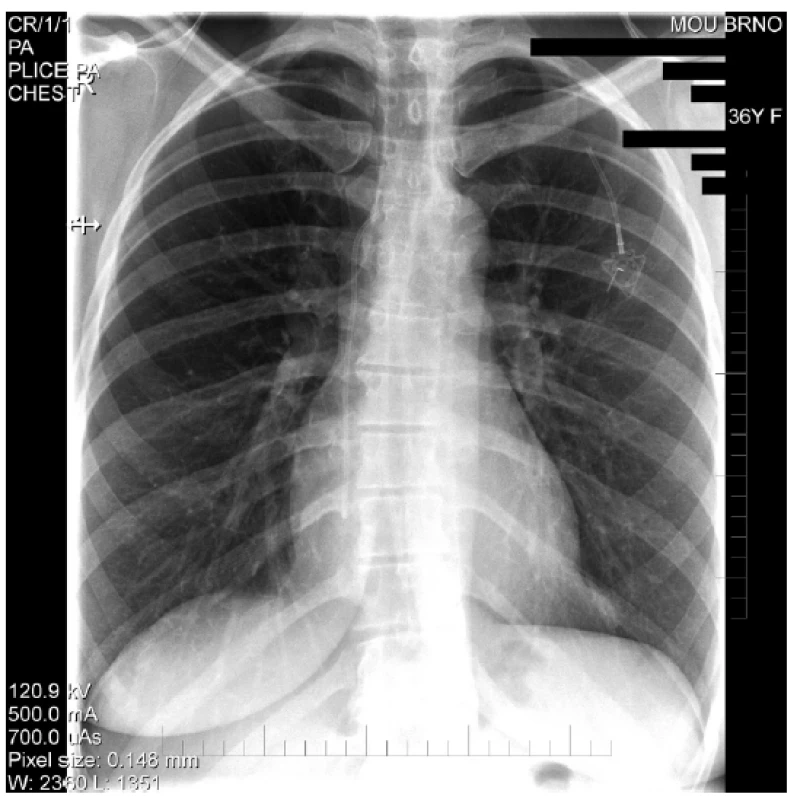
Mezi komplikace žilních vstupů z technických příčin řadíme parciální či kompletní rupturu s embolizací distálního konce katétru (Obr. 3) či otočení komůrky portu [29]. Spontánní rupturu katétru v místě přechodu klíční kosti přes první žebro nazýváme pinch-off syndrom (Obr. 4). U moderních systémů jsou při správné implantaci tyto komplikace velmi málo časté. Katétry nynějších žilních vstupů jsou částečně rentgen kontrastní, což usnadňuje jejich zaměření při vycestování. Při kompletní ruptuře katétru jeho distální část embolizuje do pravé komory, dolní duté žíly či plicních arterií. Jeho extrakci je nutné konzultovat na katetrizačním či kardiochirurgickém pracovišti. Další komplikace z technických příčin, otočení komůrky portu, je častější u pacientů s vyšší BMI, u nichž je tedy vhodné fixovat komůrku více stehy.
Fig. 3. Partial rupture of the port catheter
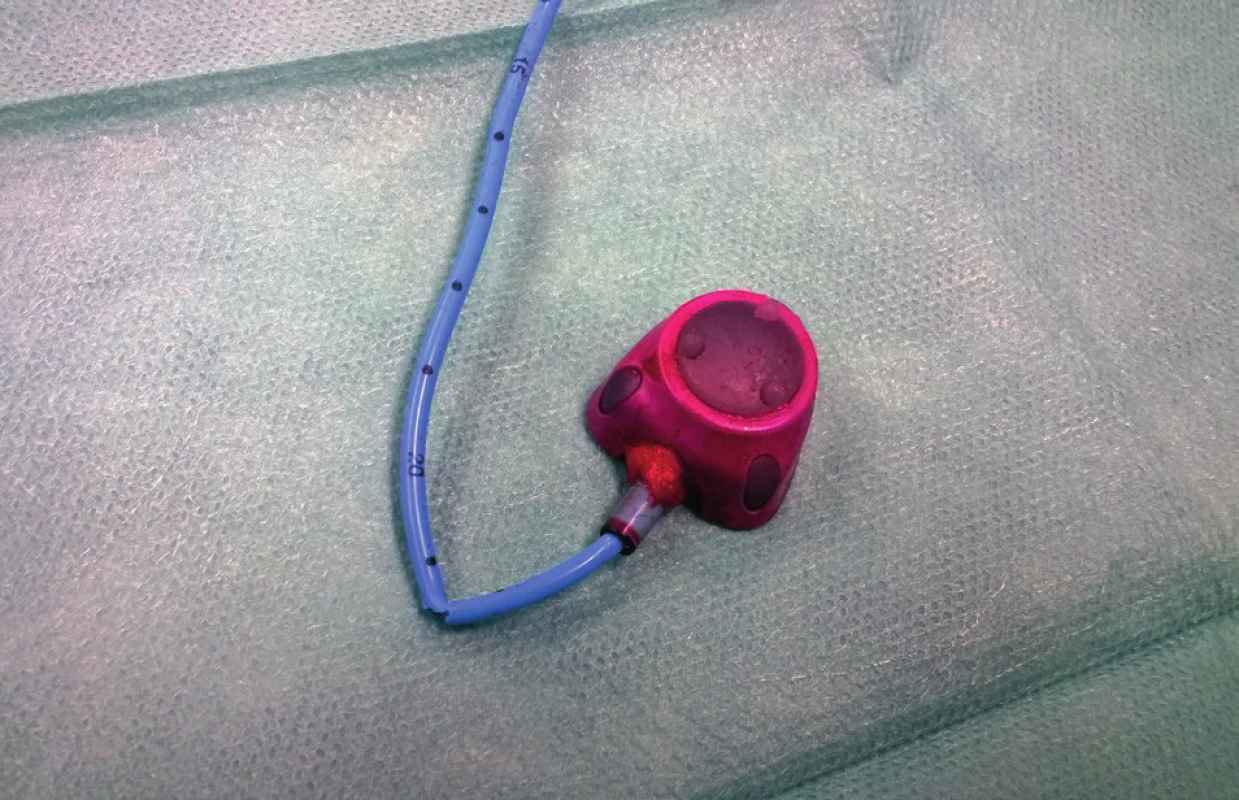
Fig. 4. Chest X-rays – Complete rupture of the port catheter
(pinch-off)
Závěr
Užití dlouhodobých žilních vstupů u onkologicky nemocných přináší výrazné zvýšení kvality jejich života. Multioborová spolupráce je velmi důležitá pro správnou indikaci a optimalizaci řešení komplikací žilních vstupů. Počet komplikací lze účinně snižovat užitím moderních přístrojů (USG, detektor intrakardiálního EKG) i vhodně zvolených materiálů a typů žilních katétrů. Výskyt některých komplikací dnes automaticky neznamená jejich nutné odstranění. Při dodržování doporučení české Společnosti pro porty a permanentní katétry je užití permanentních katétrů bezpečné, pacientům prospěšné a s minimálním dopadem na morbiditu onkologických pacientů.
Práce byla podpořena projekty: MZ ČR – RVO (MOÚ, 00209805) a MŠMT – NPU I – LO1413.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Ondřej Zapletal
Klinika operační onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: ondrej.zapletal@mou.cz
Sources
- http://www.sppk.eu/?page_id=488
- Maňásek V. Extravazace cytostatik – prevence a doporučené postupy. Klin Onkol. 2016;29 : 93−9.
- Denys GB, Uretsky BF, Reddy PS. Ultrasound-assisted cannulation of the internal jugular vein: a prospective comparison to the external landmark-guided technique. Circulation 1993;1557–62. doi. 10.1161/01.cir.87.5.1557.
- Sommerkamp SK, Romaniuk VM, Witting MD, et al. A comparison of longitudinal and transverse approaches to ultrasound-guided axillary vein cannulation. Am J Emerg Med. 2013;31 : 478−81. doi: 10.1016/j.ajem.2012.09.015.
- Skolnick ML. The role of sonography in the placement and management of jugular and subclavian central venous catheters. AJR Am J Roentgenol. 1994;291–5. doi: 10.2214/ajr.163.2.8037017.
- Patel GS, Jain R, Kumar R, et al. Comparison of peripherally inserted central venous catheters (PICC) versus subcutaneosly implanted port-chamber catheters by complication and cost for patients receiving chemotherapy for non-haematological malignancies. Support Care Cancer 2014;22 : 121−8. doi: 10.1007/s00520-013-1941-1.
- Mermel LA, Allon M, Bouza E, et al. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2009;49 : 1−45. doi: 10.1086/599376.
- Musuuza JS, Guru PK, O´Horo JC, et al. The impact of chlorhexidine bathing on hospital-acquired bloodstream infections: a systematic review and meta-analysis. BMC Infect Dis. 2019;19 : 416. doi: 10.1186/s12879-019-4002-7.
- Walser EM. Venous access ports: Indication, implantation technique, follow-up and complication. Cardiovasc Intervent Radiol. 2012;35 : 751−64. doi: 10.1016/j.jvir.2009.07.035.
- Biffi R, Orsi F, Pozzi S, et al. Best choice of central venous insertion site for the prevention of catheter-related complications in adult patients who need cancer therapy: a randomized trial. Ann Oncol. 2009;20 : 935−40. doi: 10.1093/annonc/mdn701.
- Petersen J, Delaney JH, BrakstadMT, et al. Silicone venous access devices positioned with their tips high in the superior vena cava are more likely to malfunction. Am J Surg. 1999;178 : 38−41. doi: 10.1016/s0002-9610(99)00124-5.
- Caers J, Fontaine C, Vinh-Hung V, et al. Catheter tip position as a risk factor for thrombosis associated with the use of subcutaneous infusion ports. Support care cancer 2005;13 : 325−31. doi: 10.1007/s00520-004-0723-1.
- Shan PN, Kane D, Appukutty J. Depth of central venous catheterization by intracardiac electrocardiogram in adults. Anestesiology and pain medicine 2013;2 : 111−4. doi: 10.5812/aapm.7557.
- Olivier G, et al. ECG-based PICC tip verification system: an evaluation 5 years on. Br J Nurs. 2016;25:S4−S10. doi: 10.12968/bjon.2016.25.19.S4.
- Pittiruti M, Bertollo D, Briglia E, et al. The intracavitary ECG method for positioning the tip of central venous catheters: results of an Italian multicenter study. J Vasc Access. 2012;13 : 357−65. doi: 10.5301/JVA.2012.9020.
- Gao Y, Liu Y, Zhang H, et al. The safety and accurancy of ECG-guided PICC tip position verification applied in patients with atrial fibrillation. Ther Clin Risk Manag. 2018;14 : 1075−81. doi: 10.2147/TCRM.S156468.
- Sharma D, Farabakhsh N, Tabatabaii SA. Role of ultrasound for central catheter tip localization in neonates: a review of the current evidence. J Matern Fetal Neonatal Med. 2019;32 : 2429−37. doi: 10.1080/14767058.2018.1437135.
- Contractor SG, Phatak TD, Klyde D, et al. Single-incision technique for tunneled central venous access. J Vasc Interv Radiol. 2009;20 : 1052−8. doi: 10.1016/j.jvir.2009.04.065.
- Hind D, Calvert N, McWilliams, et al. Ultrasonic locating devices for central venous cannulation: metaanalysis. BMJ 2003;327 : 361. doi: 10.1136/bmj.327.7411.361.
- Araújo C, Silva JP, Antunes P, et al. A comparative study between two central veins for the introduction of totally implantable venous access devices in 1201 cancer patients. Eur J Surg Oncol. 2008;34 : 222−6. doi: 10.1016/j.ejso.2007.04.003.
- Chang DH, Boecker J, Hellmich M, et al. Experiences with ultrasound-guided port implantations via the lateral subclavian vein: a retrospective analysis of 1532 patients. Rofo 2012;184 : 726−33. doi: 10.1055/s-0032-1312745.
- Mudan S, Giakoustidis D, Morrison D, et al. 1000 Port-A-Cath placements by subclavian vein approach: single surgeon experience. World J Surg. 2015;39 : 328−34. doi: 10.1007/s00268-014-2802-x.
- Popálená J. Katétrové infekcie u pacientov v programe domácej parenterálnej výživy. Nutrition news 2019;3 : 18−21.
- Blot K, Bergs J, Vogelaers D, et al. Prevention of central line-associated bloodstream infection through quality improvement interventions: a systematic review and meta-analysis. Clin Infect Dis. 2014;59 : 96−105. doi: 10.1093/cid/ciu239.
- Verso M, Agnelli G, Bertoglio S, et al. Enoxaparin for the prevention of venous thromboembolism associated with central vein catheter: a double-blind, placebo-controlled, randomized study in cancer patients. J Clin Oncol. 2005 : 4057–62. doi: 10.1200/JCO.2005.06.084.
- Reddy AS, Lang EV, Cutts J, et al. Fibrin sheath removal from central venous catheters: an internal snare manoeuvre. Nephrol Dial Transplant. 2007;22 : 1762–5. doi: 10.1093/ndt/gfm154.
- Namyslowski J, et al. Management of catheter-induced venous thrombosis. Tech Vasc Interv Radiol. 2002;5 : 85−8. Review. doi: 10.1053/tvir.2002.36052.
- Taxbro K, Hammarskjöld F, Thelin B, et al. Clinical impact of peripherally inserted central catheters vs implanted port catheters in patients with cancer: an open-label, randomised, two-center trial. British Journal od Anaesthesia 2019;122 : 734−1. doi: 10.1016/j.bja.2019.01.038.
- Busch JD, Vens M, Herrmann J, et al. Material failure of silicone catheter lines: A retrospective review of partial and complete ruptures in 553 patients. AJR Am Roentgenol. 2017;208 : 464−9. doi: 10.2214/AJR.16.16540.
- Song MG, Seo TS, Kim YH, et al. Effectiveness of breast fixation to reduce migration of the tip of a totally implantable venous access port in women. J Vasc Access. 2016;17 : 348−52. doi: 10.5301/jva.5000565.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2019 Issue 11
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Žilní vstupy v onkologii
- Laparoskopické versus otevřené resekce jater pro metastázy kolorektálního karcinomu: srovnání časných výsledků chirurgické léčby
- Kongruence histologické diagnózy se zobrazovací a operační diagnózou u akutní apendicitidy
- Rok 1848 – významný mezník v historii české chirurgie
- Souručenství rukou a rolí
- Pseudolymfom jater: překvapivý nález u pacienta s předpokládanou generalizací plicního karcinomu
- Radiofrekvenční ablace karcinomu pankreatu
- Přínos hybridních metod (PET/CT, PET MRI) v diagnostice patologických nálezů břišní aorty
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Žilní vstupy v onkologii
- Kongruence histologické diagnózy se zobrazovací a operační diagnózou u akutní apendicitidy
- Laparoskopické versus otevřené resekce jater pro metastázy kolorektálního karcinomu: srovnání časných výsledků chirurgické léčby
- Pseudolymfom jater: překvapivý nález u pacienta s předpokládanou generalizací plicního karcinomu
