Vývoj cévní náhrady pro nízké průtoky – přehled
Development of vascular substitutes for low-flow peripheral bypass grafting – a review
The development of a low-flow vascular prosthesis is a very topical issue. The authors present a pathway for the development of a prosthesis with optimal properties based on the idea of mimicking the characteristics of a biological model (saphenous vein graft) and programming these properties in the model of the prosthetic substitute. The vascular prosthesis presented consists of three layers – a non-absorbable scaffold representing vascular “media”, and two absorbable collagen layers – pseudointima and pseudoadventitia. The basic methods of physical testing are presented – the single axis stretch test and inflation-extension test, as well as other procedures that affect the final properties. These include collagen curing, antithrombotic treatment of the inner layer and the use of sterilization methods. The designed new graft was successfully implanted in an ovine model.
Keywords:
vascular substitutes for low-flow peripheral bypass grafting – testing
Authors:
P. Mitáš 1; M. Špaček 1; T. Grus 1; H. Chlup 2; M. Mlček 3; L. Lambert 4; M. Krajíček 1; J. Lindner 1
Authors‘ workplace:
II. chirurgická klinika kardiovaskulární chirurgie, Všeobecná fakultní nemocnice a 1. lékařská fakulta Univerzity, Karlovy, Praha
1; Odbor biomechaniky, Ústav mechaniky, biomechaniky a mechatroniky, Fakulta strojní, ČVUT, Praha
2; Fyziologický ústav, 1. lékařská fakulta Univerzity Karlovy, Praha
3; Radiodiagnostická klinika, Všeobecná fakultní nemocnice a 1. lékařská fakulta Univerzity Karlovy, Praha
4
Published in:
Rozhl. Chir., 2019, roč. 98, č. 6, s. 233-238.
Category:
Review
Overview
Vývoj cévní náhrady pro nízké průtoky je aktuální otázkou. Autoři představují vlastní model hledání vývoje náhrady optimálních vlastností, které vycházejí z myšlenky převzetí charakteristiky biologického modelu – veny sapheny, a naprogramování těchto vlastností do modelu konstruované náhrady. Představovaná cévní náhrada se skládá ze tří částí – nevstřebatelného scaffoldu představujícího medii a dvou vstřebatelných kolagenních vrstev – pseudointimy a pseudoadventicie. Autoři představují základní metody fyzikálního testování (inflačně-extenzní test), stejně jako další postupy, které ovlivňují konečné vlastnosti vyvíjené protézy. Mezi takové patří tvrzení kolagenu, antitrombogenní ošetření vnitřního povrchu cévní náhrady a použití metody sterilizace. Testovaný prototyp byl úspěšně ověřen implantací na ovčím modelu.
Klíčová slova:
cévní náhrada pro nízké průtoky – fyzikální testování
ÚVOD
Jedním z pilířů rekonstrukční cévní chirurgie jsou cévní náhrady. Snaha o jejich nalezení se datuje již do druhé poloviny devatenáctého století. Za zásadní příspěvek v této oblasti (cévní steh) byl Carrel v roce 1912 oceněn Nobelovou cenou [1]. První pokusy s cévní rekonstrukcí byly vynuceny válečnými zraněními, ale po skončení druhé světové války se již rekonstrukční cévní chirurgie začala rozvíjet jako samostatný obor. Jako první náhrady se začaly používat tepenné alotransplantáty a nejčastější indikací výkonu byly výdutě, zejména na břišní aortě. Poměrně brzy se však začaly objevovat problémy v důsledku imunologicky vyvolaných změn – rejekce, s uzávěrem nebo fatální rupturou. V roce 1952 publikoval Kunlin [2] úspěch při použití vlastní žíly nemocného (vena saphena magna) k tepenné rekonstrukci. Dodnes zůstává žilní autotransplantát jednou z nejlepších náhrad. Jeho využití je však limitováno kvalitou a dostupností u řady nemocných. Celou tuto dobu přetrvávala snaha vytvořit umělou cévní náhradu, což se podařilo v roce 1954, kdy Voorhes a spol. publikovali zkušenosti s porézní cévní náhradou vytvořenou textilním způsobem ze syntetických vláken [3]. Tento základní průlom byl následován dynamickým vývojem a konstrukcí škály cévních protéz z různých materiálů, různých charakteristik a rozměrů, takže je bylo možno použít téměř ve všech anatomických oblastech tepenného systému.
Obecnou nevýhodou cévních protéz je nízká průchodnost v případě nízkého průtoku rekonstrukce, limitem jsou průtoky nižší než 100–200 ml/min. Druhou zásadní nevýhodou je citlivost polyesterového vlákna vůči infekci. Na základě dlouhodobých zkušeností s cévními náhradami vycházejí autoři z představy, že klíčovou charakteristikou pro úspěch žilního autotransplantátu v tepenných oblastech s nízkým průtokem jsou její fyzikální vlastnosti, které umožňují dokonalé technické provedení anastomóz a též umožňují náhradě přizpůsobit se průtokovým a tlakovým poměrům v rekonstruovaném tepenném úseku [4–8]. Přibližování vlastností syntetických cévních náhrad biologickým autologním materiálům je tedy jednou z možných cest vývoje
Vlastní koncepce cévní náhrady
Cévní náhrada je konstruována jako kompozitní poddajná trubice s třívrstvou sendvičově uspořádanou stěnou – sestávající z prostřední nevstřebatelné porézní vrstvy – tzv. scaffold – a dvou vstřebatelných vrstev z biologického materiálu – zevní a vnitřní, tzv. pseudointima a pseudoadventicie [9]. Jako mechanicky základní vrstva scaffoldu je použita monofilová polyesterová nevrapovaná pletenina s porozitou vyšší než 10 000 ml/min/cm2/120 mmHg [10]. Tato vrstva by měla zaručit limitní roztažnost (dilataci) alternativní protézy. Síla vláken i charakter pletení jsou voleny tak, aby nevstřebatelná složka nebránila klasické perfuzi živin z lumina až do zevní vrstvy, která při dostatečné vaskularizaci odvádí produkty metabolismu. Jinak řečeno, vlákna nevytvářejí tzv. perfuzní stíny. Pro vstřebatelné vrstvy, pseudointimu a pseudoadventicii, přicházejí z biopolymerů v úvahu kolagen, želatina, elastin, rekombinantní tropoelastin, polylysin, chitosan, celulóza a její deriváty, hyaluran a jeho deriváty [11−13].
Metody
Výroba nosného scaffoldu protézy
Pro výrobu scaffoldu bylo použito monofilní polyesterové vlákno o průměru 0,034 mm. Toto vlákno bylo v pletacím stroji sdružováno do svazků po 2 a byla z něj vytvořena pleteninová trubice. Než se dospělo k finální konstrukci pleteniny, bylo testováno několik variant. Ty se lišily počtem sdružovaných monofilních polyesterových vláken a hustotou, tím i velikostí ok pleteniny. Před integrací pleteninového scaffoldu do kolagenní hmoty, byla pletenina ještě chemicky ošetřena praním a předsrážením. Pletenina jako scaffold byla zvolena pro své mechanické vlastnosti. Pleteninová trubice se dokáže vhodně deformovat v obvodovém i podélném směru. Tím by měla být umožněna dobrá poddajnost alternativní cévní protézy zejména v obvodovém směru. To je mimo jiné důležité pro přenos pulzací v krevním systému a propagaci pulzní vlny. Vzhledem k dobrým mechanickým vlastnostem a biokompatibilitě je polyester využíván jak v chirurgii, tak v tkáňovém inženýrství.
Pseudointima a pseudoadventicie – kolagenní vrstvy
Na základě podrobné analýzy vlastností byl vybrán bovinní a rybí kolagen vyrobený za kontrolovaných podmínek. Kolagen je typická vláknitá bílkovina, která je spolu s retikulinem hlavní součástí fibrilárních struktur vaziva, kůže, kostí a podpůrného skeletu všech orgánů a tkání. Antigenní vlastnosti nativního kolagenu jako heterologní bílkoviny vyvolávají vazbu komplementu, aglutinaci, anafylaxi a další reakce. Kolagenní hmota byla při výrobě protéz vystavena tvrzení, v tomto případě pomocí chemických činidel vytvářejících přídavné příčné vazby na molekulární úrovní struktury kolagenu typu I. Tato materiálová úprava je klíčová pro ovlivnění vlastní kolagenu, zejména bobtnavosti, stupně denaturace a doby vstřebávání. V této oblasti je zcela zásadní spolehlivá kontrola stupně vytvrzení [14,15]. Stupeň vytvrzení se hodnotí podle takzvané teploty smrštění (Ts) nebo též denaturační teploty. Vlákna netvrzeného kolagenu se při stoupající teplotě, mezi 30 až 40 °C, smrští. Dochází také k denaturaci a změně fyzikálních vlastností hmoty, např. poklesu mechanických vlastností. Úměrně se stupněm vytvrzení stoupá i teplota, při které ke smrštění dochází. Bylo jednoznačně prokázáno, že antigenicita nativního kolagenu klesá úměrně se stupněm vytvrzení (hodnoceno podle Ts) až k bezvýznamným hodnotám. Podobný trend byl pozorován u trombogenicity. Je však nezbytné uváděné výhodné faktory korelovat s mechanickými vlastnostmi a hledat optimální konfiguraci úpravy kolagenní hmoty.
Testování fyzikálních vlastností biologických cévních náhrad
Inflačně-extenzní test je vhodnou metodou k testování fyzikálních vlastností cévních náhrad. Jedná se o cyklické zatěžování tubulárního vzorku vnitřním tlakem, kdy jsou pozorovány deformace vzorku v obvodovém a podélném směru. Sledováno je i torzní chování vzorku. Všechny deformace jsou ve vazbě s monitorovaným interním tlakem ve vzorku a s rychlostí cyklického zatěžování simulující různé tepové frekvence. Princip je blíže vysvětlen na Schema 1. Test začíná upnutím vzorku mezi dva trny. Horní trn je spojen s dávkovačem kapaliny, který je kotven na lineární elektrické motory, jejichž pohyb je řízen měřicím počítačem. Deformace vzorku během zatěžování vnitřním tlakem je sledována pomocí dvou na sebe kolmo ustavených kamer. Následně je ze získaného experimentu zpracován graf závislosti napětí - deformace nebo tlak – deformace.
Schema 1: Left: A schematic view of the sample secured in the console
Scheme corresponding to the real photographs in Fig. 1. Right: Diagram of the deformation of a tubular sample during an inflation-
extension test. Blue and green lines indicate levels at which the circumferential and axial deformations have been measured.

Testování kompozitních celků
Dalším krokem ve vývoji cévní náhrady je mechanický test náhrady jako kompozitního celku v různých sendvičových uspořádáních (Schema 2 vlevo). Rozdílná uspořádání vrstev cévní náhrady se promítají do různých vlastností, které tímto uspořádáním náhrada dostává. Z provedených měření vzešla doporučená struktura cévní náhrady, která je na Schematu 2 označená jako E20. Takto utvořená náhrada se svými fyzikálními vlastnostmi nejvíce přibližuje nativní saféně. Jde o uspořádání stěny trubice, kdy je kolagenní trubice uvnitř síťky. Na náhradě byla vytvořena i vnější kolagenní vrstva – pseudoadventicie, aby byl scaffold překryt kolagenní hmotou. Pro lepší přiblížení mechanické odezvy cévní náhrady humánní žíle [16] bylo nutno zmenšit tloušťku stěny náhrady, která se u testovaných vzorků pohybovala kolem 0,45 mm, a to zhruba cca o 50 %, tj. na hodnotu 0,2 až 0,3 mm. Důvodem je, aby závislost deformace na tlaku byla méně strmá a posunula se v grafu směrem doprava, tj. do oblastí větších obvodových deformací při stejném zatížení vnitřním tlakem. Provedená redukce tloušťky stěny vedla ke zmiňovanému efektu posuvu deformačních charakteristik cévní náhrady do oblastí větších deformací, jak je patrné na Schematu 2 [17].
Schema 2: Inflation-extension tests of vascular grafts with different sandwich wall configurations
Left: tested variants of the sandwich arrangement of the graft wall, where blue color represents the scaffold, green and orange
colors the outer and inner walls of the collagen-based layer. Right: Detail of the left figure within physiological values.

Antitrombogenní ošetření vnitřního povrchu cévní náhrady
Lokální aplikace antitrombotických látek může zpomalovat počáteční nekontrolované ukládání fibrinu na vnitřní stěnu cévních náhrad, které u cév s malým průtokem může vést až k jejich uzávěru. Také postupné uvolňování heparinu do krevního řečiště může významně prodloužit životnost cévních náhrad. V průběhu roku 2014 byly autory vyvinuty antitrombotické biomateriály s postupným uvolňováním heparinu a/nebo streptokinázy [18]. Obě tyto látky jsou již široce využívány v klinické praxi [19]. V posledních letech je věnována zvýšená pozornost možnosti využití jiného antitrombotického činidla, oxidu dusnatého (NO). Přirozená endoteliální výstelka cév uvolňuje NO, který inhibuje aktivaci krevních destiček a polymorfonukleárních leukocytů, brání tak jejich agregaci a působí preventivně proti cévní trombóze. Kromě antitrombotických účinků má NO celou řadu dalších důležitých fyziologických funkcí [22]. Další účinnou látkou je např. dipiridamol, který inhibuje vychytávání adenosinu v erytrocytech, krevních destičkách a endoteliálních buňkách za podmínek in vivo i in vitro. Inhibice dosahuje v maximu přibližně 80 % a její intenzita je při terapeutických koncentracích (0,5−2,0 μg/ml) závislá na podané dávce [18]. Snížení agregace krevních destiček snižuje jejich konzumpci k normálním hodnotám. Navíc má adenosin vazodilatační účinky, což je jeden z mechanismů, kterým dipyridamol vyvolává vazodilataci.
Výsledky
Experimentální ověření
Uvedené poznatky získané během experimentální práce vedly k vytvoření kompozitní třívrstvé cévní náhrady. Prostřednictvím technologie výroby extruze homogenizované kolagenní hmoty, se podařilo změnou uspořádání orientace kolagenních vláken a jejich svazku, vytvořit anizotropní materiál s nelineární mechanickou odezvou při zatěžování. To je další krok přibližující alternativní cévní náhradu nativním cévám. Dalším krokem bylo její experimentální ověření na ovčím modelu [9]. Při implantaci graftu jako náhrady ovčí karotidy (bypass s anastomózami end-to-side nebo náhrada s anastomózami end-to-end) u 7 ovcí a peroperačním omezením průtoku zaškrcením výtokového traktu (s průtoky cca 150 ml/min.) bylo při půlročním přežití ovcí dosaženo velmi dobré průchodnosti (6 průchodných, 1 uzavřená) [9].
Vliv sterilizace na mechanickou odezvu cévní náhrady
Ukázalo se, že typ sterilizace má na mechanické chování náhrady značný vliv [26−28]. Při sterilizaci vznikají ve vnitřní struktuře kolagenní hmoty přídavné vazby, tzv. crosslinky, jak názorně dokumentuje Schema 3. Ukázalo se, že tyto přídatné vazby ve struktuře kolagenu mají na jeho výsledné fyzikální vlastnosti významný vliv. Je tedy podstatné, jakým způsobem sterilizujeme cévní náhradu, v jejíž struktuře je obsažen kolagen. Tato skutečnost může vést nejen ke změně vlastností ve smyslu obvodové a axiální deformace (Schema 3), ale i k vyšší náchylnosti cévní náhrady k trombóze.
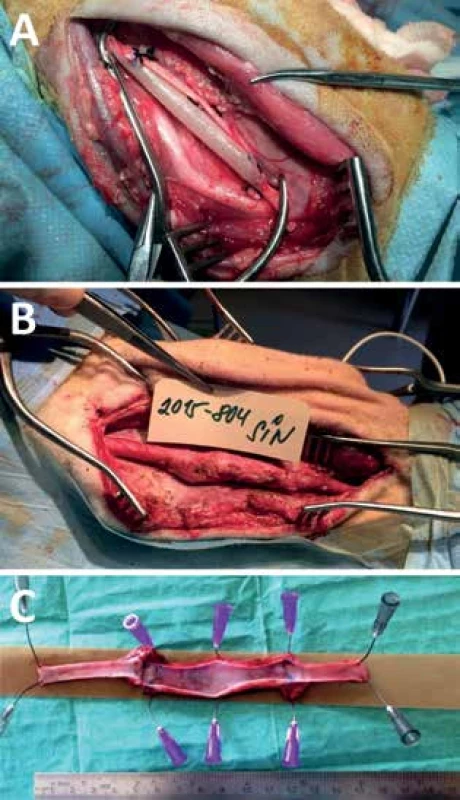
Fig.1: Perioperative photo of implanted graft
Perioperative photo of implanted graft (A), 6 months later (B)
and explanted graft with no thrombi (C).
Schema 3: The effect of the type of sterilization on the mechanical response of the vascular graft in the inflation-extension test
Left: characteristics of the internal pressure in the replacement – circumferential deformation of the graft. Right: characteristics of
internal pressure in the graft - axial deformation of the graft.

Diskuze
Mezi základní požadavky na cévní náhrady patří biokompatibilita, vhodné mechanické vlastnosti – dostatečná pevnost a viskoeleastické nebo hyperelastické vlastnosti podobné jako u nativní cévy a schopnost adaptace na měnící se podmínky krevního průtoku. Dalším nezbytným požadavkem je nízká trombogenicita vnitřního povrchu cévních náhrad [29]. Nejnáročnější požadavky jsou na cévní náhrady s malým průtokem a malým průměrem, které jsou velmi náchylné k trombóze. V současné době nejsou na trhu skutečně spolehlivé syntetické cévní náhrady určené pro nízké průtoky.
Chan-Park et al. popisují postupy tkáňového inženýrství vedoucí k požadovaným vlastnostem cévních náhrad [30]. Diskutují zde i požadavky na biodegradovatelné materiály. Cévní náhrady s malým průtokem jsou vyžadovány zejména pro pacienty s potřebou náhrady koronárních a podkolenních cév – tzv. distálních bypassů. Současné možnosti zahrnují použití autologních cév a syntetických náhrad [31,32]. Požadovanými mechanickými vlastnostmi infrainguinálních bypassů se zabývali Sarkara et al. [33]. Ideální biomateriál pro tuto oblast tkáňového inženýrství by se měl mechanickými vlastnostmi blížit nativním cévám, ale také podporovat buněčný růst, podporovat produkci extracelulární matrix a inhibovat trombogenicitu [12,23]. Kaibara et al. popsali metodu in vitro hodnocení trombogenicity biomateriálů [23]. Rovněž z těchto požadavků vycházejí autoři při hledání adekvátních vlastností cévní náhrady.
V případě použití biologického materiálu pro konstrukci cévní protézy pro nízké průtoky – tedy například kolagenu – je třeba zohlednit, že výrobou proces vytváření fyzikálních vlastností náhrady nekončí a vliv sterilizace na tuhost náhrady může být zásadní [34]. Typ použitého kolagenu je otázkou dalších experimentů s výhledem využití rybího kolagenu s předpokladem nižší antigenicity, ve srovnání s nejčastěji používaným kolagenem bovinním.
Závěr
Souhrnem lze říci, že vyvíjenou cévní protézu lze jako kompozitní trubici „naprogramovat“ následujícími kroky: 1) volbou vhodné geometrie scaffoldu (velikost ok síťoviny a tloušťka vlákna), 2) vhodně zvoleným sendvičovým uspořádáním kompozitní trubice (pozice scaffoldu vůči matrici), 3) technologií výroby kolagenních vrstev náhrady, kdy může dojít k plánované řízené změně uspořádaní vnitřní struktury materiálu, např. extruzí, s dopadem na fyzikální vlastnosti, 4) dobou tvrzení kolagenní hmoty matrice náhrady (vznik přídavných vazeb mezi kolagenními vlákny – crosslink), 5) vhodným ošetřením vnitřního povrchu cévní náhrady ve smyslu nízké trombogenicity a 6) volbou typu sterilizace hotové cévní protézy (vznik dalších přídavných vazeb mezi kolagenními vlákny). Experimentálně získaná data a ověření modelu cévní náhrady na zvířecím modelu dává naději na budoucí použití v klinické praxi [9,17].
Práce je věnována památce doc. MUDr. Milana Krajíčka, DrSc.
Poděkování: Práce vznikla s podporou grantu MZ ČR AZV 15-27941A, projektu Specifického vysokoškolského výzkumu 2019 – 260 372 a projektu PROGRES Q38/LF1.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Miroslav Špaček, Ph.D.
II. chirurgická klinika kardiovaskulární chirurgie,
VFN a 1. LF UK Praha
U Nemocnice 2
128 08 Praha 2
e-mail: miroslav.spacek@vfn.cz
Sources
-
Carrel A. Ultimate results of aortic transplantation J Exp Med. 1912;15 : 389−92.
-
Kunlin J. Venous grafts. J Int Chir. 1953;13 : 313−9.
-
Blakemoore AH, Voorhees AB Jr. The use of tubes constructed from vinyon N cloth in bridging arterial defects; experimental and clinical. Ann Surg. 1954;140 : 324−34.
-
Kakisis JD, Liapis ChD, Breuer Ch, et al. Artificial blood vessel: The Holy Grail of peripheral vascular surgery. J Vasc Surg. 2005;41 : 349−54. doi: 10.1016/j.jvs.2004.12.026.
-
Kannan RY, Salacinski HJ, Butler PE, et al. Current status of prosthetic bypass grafts: a review. J Biomed Mater Res B Appl Biomater. 2005;74 : 570−81. doi: 10.1002/jbm.b.30247
-
Chlupáč J, Filová E, Bačáková L. Blood vessel replacement: 50 years of development and tissue engineering paradigms in vascular surgery. Physiol Res. 2009;58 (Suppl.2) S119−S139.
-
Heyligers JMM, Arts CHP, Verhagen HJM, et al. Improving small-diameter vascular grafts: From the application of an endothelial cell lining to the construction of a tissue-engineered blood vessel. Ann Vasc Surg. 2005;19 : 448−56.doi. 10.1007/s10016-005-0026-0.
-
Berglund JD, Mohseni MM, Nerem RM, et al. A biological hybrid model for collagen-based tissue engineered vascular constructs. Biomaterials 2003;24 : 1241–54.
-
Grus T, Lambert L, Mlcek M, et al. In vivo evaluation of short-term performance of new three-layer collagen-based vascular graft designed for low-flow peripheral vascular reconstructions. Biomed Res Int. 2018. doi:10.1155/2018/3519596
-
Veselý J, Chlup H, Krajíček M, et al. Mechanical properties of biological composite reinforced by polyester mesh. In Experimental Stress Analysis 2015. Czech Technical University in Prague 2015 : 466−8.
-
Veselý J, Horný L, Chlup H, et al. Effect of polyvinyl alcohol concentration on the mechanical properties of collagen/polyvinyl alcohol blends. Applied Mechanics and Materials 2015;732 : 161−4. doi: 10.4028/www.scientific.net/AMM.732.161.
-
Ravi S, Chaikof EL. Biomaterials for vascular tissue engineering. Regen Med. 2010;5 : 107.doi: 10.2217/rme.09.77
-
Nerem RM. Tissue engineering a blood vessel substitute: The role of biomechanics. Yonsci Medical Journal 2000;41 : 735−9. doi:10.3349/ymj.2000.41.6.735.
-
Martinez AW, Caves JM, Ravi S, et al. Effects of crosslinking on the mechanical properties, drug release and cytocompatibility of protein polymers. Acta Biomater. 2014;10 : 26−33. doi: 10.1016/j.actbio.2013.08.029.
-
Chaouat M, Le Visage C, Baille WE, et al. A novel cross-linked poly(vinyl alcohol) (PVA) for vascular grafts. Adv Funct Mater. 2006;18 : 2855−61. doi:10.1002/adfm.200701261.
-
Veselý J, Horný L, Chlup H, et al. Constitutive modeling of human saphenous veins at overloading pressures. J Mech Behav Biomed Mater. 2015;45 : 101−8. doi:10.1016/j.jmbbm.2015.01.023
-
Špaček M, Chlup H, Mitáš P, et al. Three-layer collagen-based vascular graft designed for low-flow peripheral vascular reconstructions. J Appl Biomed. 2019, in press.
-
Beran M, Drahorad J, Molik P, et al. Site-specific thrombolytic and anticoagulant biomaterials. Proceedings of AMN-7. Int J Nanotechnology 2017;14 : 31−7. doi.10.1504/IJNT.2017.082443.
-
Fernandes EG1, de Queiroz AA, Abraham GA, et al. Antithrombogenic properties of bioconjugate streptokinase-polyglycerol dendrimers. J Mater Sci Mater Med. 2006;17 : 105−11. doi: 10.1007/s10856-006-6813-5
-
Sask KN. Antithrombogenic biomaterials: Surface modification with an sntithrombin-heparin covalent complex. Open access dissertations and theses 4-1-2012. McMaster University. DigitalCommons@McMaster
-
Zhou Z, Meyerhoff ME. Preparation and characterization of polymeric coatings with combined nitric oxide release and immobilized active heparin. Biomaterials 2005;26 : 6506−17. doi: 10.1016/j.biomaterials.2005.04.046.
-
Carpenter AW, Johnson JA, Schoenfisch MH. Nitric oxide-releasing silica nanoparticles with varied surface hydrophobicity. Colloids and Surfaces a: Physicochemical and Engineering Aspects. 2014;454 : 144−51. doi: 10.1016/j.colsurfa.
-
Kaibara M, Kawamoto Y, Yanagida S, et al. In vitro evaluation of antithrombogenicity of hybrid-type vascular vessel models based on analysis of the mechanism of blood coagulation. Biomaterials 1995;16 : 1229−34.
-
Popowich Q, Jiang JA, Hrabie JE, et al. Nitric oxide and nanotechnology: A novel approach to inhibit neointimal hyperplasia. Journal of Vascular Surgery 2008;47 : 173−82. doi: 10.1016/j.jvs.2007.09.005.
-
Innocente F, Mandracchia D, Pektok E, et al. Paclitaxel-eluting biodegradable synthetic vascular prostheses: a step towards reduction of neointima formation? Circulation 2009;120(11 Suppl):S37−45. doi: 10.1161/CIRCULATIONAHA.109.848242.
-
Noah EM, Chen J, Jiao X, et al. Impact of sterilization on the porous design and cell behavior in collagen sponges prepared for tissue engineering. Biomaterials 2002;23 : 2855–61.
-
Olde Damink LH, Dijkstra PJ, Van Luyn MJ, et al. Influence of ethylene oxide gas treatment on the in vitro degradation behavior of dermal sheep collagen. Journal of Biomedical Materials Research 1995;29 : 149−55. doi: 10.1002/jbm.820290203.
-
Cheung DT, Perelman N, Tong D, et al. The effect of gamma-irradiation on collagen molecules, isolated alphachains, and crosslinked native fibers. Journal of Biomedical Materials Research 1990;24 : 581−9. doi: 10.1002/jbm.820240505.
-
Sarkar S, Schmitz-Rixen T, Hamilton G, et al. Achieving the ideal properties for vascular bypass grafts using a tissue engineered approach: a review. Med Biol Eng Comput. 2007;45 : 327−36. doi:10.1007/s11517-007-0176-z
-
Chan-Park MB, Shen JY, Cao Y, Xiong Y, et al. Biomimetic control of vascular smooth muscle cell morphology and phenotype for functional tissue-engineered small-diameter blood vessels. J Biomed Mater Res A. 2009;88 : 1104−21. doi:10.1002/jbm.a.32318.
-
Nerem RM, Seliktar D. Vascular tissue engineering. Annu Rev Biomed Eng. 2001;3 : 225−43. doi:10.1146/annurev.bioeng.3.1.225.
-
Sarkar S, Salacinskij HJ, Hamilton G, et al. The mechanical properties of infrainguinal vascular bypass grafts: their role in influencing patency. Eur J Vasc Endovasc Surg. 2006;31 : 627−36. doi: 10.1016/j.ejvs.2006.01.006.
-
Sarkar S, Burriesci G, Wojcik A, et al. Manufacture of small calibre quadruple lamina vascular bypass grafts using a novel automated extrusion-phase-inversion method and nanocomposite polymer. Journal of Biomechanics 2009;42 : 722−30. doi: 10.1016/j.jbiomech.2009.01.003.
-
Veselý J, Chlup H, Žitný R, et al. Effect of sterilization on mechanical properties of biological composite. ECCOMAS Congress 2016 VII European Congress on Computational Methods in Applied Sciences and Engineering. June 2016.
Labels
Surgery Orthopaedics Trauma surgeryArticle was published in
Perspectives in Surgery

2019 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
-
All articles in this issue
- Vývoj cévní náhrady pro nízké průtoky – přehled
- Řešení krvácení z přední epidurální žilní pleteně bederní páteře pomocí preparátu z oxidované neregenerované celulózy
- Katetrizační laserová ablace povrchových žil dolních končetin v léčbě symptomatického žilního refluxu s varixy – porovnání bezprostřední účinnosti dvou typů laserových generátorů
- Poranění hrudní aorty při ezofagektomii pro karcinom jícnu – kazuistické sdělení a review literatury
- Mladí, chcete operovat? Přidejte nám na důchody!
- Kombinované endovaskulární a chirurgické řešení tandemové symptomatické okluze arteria carotis communis a arteria cerebri media − kazuistika
- Madelungova choroba – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Madelungova choroba – kazuistika
- Kombinované endovaskulární a chirurgické řešení tandemové symptomatické okluze arteria carotis communis a arteria cerebri media − kazuistika
- Vývoj cévní náhrady pro nízké průtoky – přehled
- Řešení krvácení z přední epidurální žilní pleteně bederní páteře pomocí preparátu z oxidované neregenerované celulózy
