Bezpečnostný profil tibolonu z aspektu prsníka pri dlhodobom režime užívania
The profile of tibolon with regard to breast safety in long-term therapy
Hormonal substitution during menopause has a dramatic impact on the quality of life of women. Conventional hormonal therapy increases the incidence of mastodynia and MG density. Great stress is therefore laid on the selection of a preparation which has a minimum impact on MG density and on subjective feelings of patients when long-term use of hormone replacement therapy is necessary. The longitudinal retrospective study assessed 25 women taking tibolon for 36–119 months as compared with mammographic findings in women who had finished taking tibolon 36 months before. No difference was found between mammographic findings in women receiving long-term tibolon therapy and those in women who had finished taking tibolon. Tibolon appears to be a modality of postmenopause hormone replacement therapy which is well tolerated by patients even in cases where long-term therapy is necessary.
Key words:
tibolon – mammographic density – mastodynia
:
MUDr. Petrovičová Zuzana 1; prim. MUDr. Tibor Bielik; Ph.D. 2; MUDr. Milica Piškaninová 3
:
privátna gynekologická ambulancia
Banská Bystrica
1; gyn. -pôr. odd. FNsP FDR
Banská Bystrica
2; Organon, Bratislava
3
:
Prakt Gyn 2006; 10(3): 111-114
Hormonálna substitúcia v postmenopauze výrazným spôsobom ovplyvňuje kvalitu života žien. Konvenčná hormonálna liečba zvyšuje incidenciu mastodynie a denzitu mamografických (MG) snímok. Preto pri potrebe dlhodobého užívania hormonálnej substitúcie sa veľký dôraz kladie na výber preparátu, ktorý minimálne ovplyvňuje MG-denzitu a subjektívne pocity užívateliek. V longitudinálnej retrospektívnej štúdii sme hodnotili súbor 25 žien, užívajúcich tibolon 36–119 mesiacov v komparácii s mamografickými nálezmi žien, ktoré ukončili užívanie hormonálnej liečby tibolonom pred 36 mesiacmi. Neboli zistené rozdiely v mamografických nálezoch u žien dlhodobo užívajúcich tibolon v porovnaní s nálezmi u žien, ktoré ukončili užívanie tibolonu. Tibolon sa javí ako modalita hormonálnej substitúcie v postmenopauze dobre tolerovaná užívateľkami aj pri potrebe dlhodobého režimu.
Klíčová slova:
tibolon – mamografická denzita – mastodynia
Úvod
Mastodynia (35 %) a strach z rakoviny prsníka (18 %) sú jednou z najčastejších príčin prerušenia užívania hormonálnej terapie (HT) v klimaktériu [1]. Nemalou mierou k tomu prispela aj neadekvátna interpretácia výsledkov //PROSÍM O VYSVETLENIE/ROZVEDENIE SKR.//WHI EPT-ramena a MWS masmédiami. V komplikovanej situácii sa nachádza gynekológ, ktorého pacientky chcú užívať HT dlhodobo. Dostáva sa do dilemy v definovaní a meraní pravdepodobného stupňa individuálneho rizika v kontexte klinických rozhodovacích procesov. Rozhodnutie užívať dlhodobú HT na prevenciu chorôb a zlepšenie kvality života je súčasťou životného štýlu, musí byť však posúdené z aspektu rizika a benefitu HT samotnej a porovnané s prínosom a rizikom iných terapeutických možností.
Riziko karcinómu prsníka stúpa s vekom, ktorý je jedným z najvýznamnejších rizikových faktorov tohto ochorenia. Napriek tomu, že z farmako-ekonomického hľadiska, hlavne pri dlhodobom užívaní, patrí HT k najlacnejšej preventívno-terapeutickej liečbe závažných patologických stavov, postoj verejnosti je ovplyvnený negatívnymi emóciami, hlavne kvôli jej vzťahu k riziku karcinómu prsníka.
Postoj pacientky k HT, akceptácia rizika, závisí od jej individuálnej situácie, načasovania iniciácie liečby, prítomnosti symptómov znižujúcich kvalitu jej života. Pri výbere preparátu na dlhodobé užívanie musí gynekológ vychádzať z terapeutických možností, a posúdiť liečbu z aspektu rizika a benefitu pre konkrétnu pacientku.
Konvenčná hormonálna liečba (ET/EPT) zvyšuje incidenciu mastodynie a mamografickú (MG) denzitu prsníkov [2]. Môže sťažiť diagnostickú interpretáciu MG-snímok. Je spojená s miernym zvýšením relatívneho rizika karcinómu prsníka pri užívaní dlhšom ako 5 rokov [3].
V dôsledku vedľajších účinkov konvenčnej HT, vývojové trendy v klimakterickej farmakológii viedli k vytvoreniu alternatívnych prípravkov.
K nekonvenčným preparátom HT v klimaktériu patrí prvý člen skupiny STEAR –tibolon. Tibolon je syntetický steroid-derivát 19 –nortestosteronu, ktorý patrí medzi selektívne regulátory estrogénnej bunkovej aktivity. Z aspektu enzýmovej regulácie a ovplyvnenia procesu proliferácie a apoptózy v bunkách prsníka vyplýva, že vplyv tibolonu na prsník je odlišný od konvenčných ET/EPT preparátov [4,5].
V 2002 roku sme v časopise Slovenská gynekológia a pôrodníctvo publikovali výsledky nerandomizovanej, longitudinálnej, retrospektívnej štúdie, v ktorej sme hodnotili 5-ročné (l997 – 2002) obdobie užívania tibolonu u 98 žien [6]. S odstupom 3 rokov sme sa rozhodli zhodnotiť súbor týchto pacientiek.
Klinický súbor a metodika
Ide o nerandomizovanú, otvorenú, longitudinálnu, retrospektívnu štúdiu, v ktorej sme hodnotili 98 postmenopauzálnych žien, ktoré boli nastavené na liečbu tibolonom v rokoch 1997 až 2002.
Zo súboru 98 pacientiek - užívateliek tibolonu, v roku 2002 z aspektu dlhodobého užívania tibolonu spĺňalo hodnotiace kritéria 52 žien. Zo súboru 52 žien pokračuje v užívaní tibolonu 25 žien, 3 pacientky zmenili tibolon na konvenčnú liečbu, 2 pacientky exitovali na karcinóm kolorekta. Indikáciou zahájenia užívania tibolonu bol klimakterický syndróm, prevencia osteoporózy a znížená kvalita života.
Základná demografická charakteristika súboru 25 žien je uvedená v tab. 1. Z celkového súboru 98 žien 20 žien ukončilo užívanie tibolonu a od roku 2002 sa nedostavili na ambulanciu, 20 žien ukončilo užívanie tibolonu a pravidelne absolvuje gynekologické vyšetrenie, mamografické a sonografické (USG) vyšetrenie prsníkov. 28 pacientok užíva tibolon menej ako 3 roky. Tieto pacientky sme nezačlenili do hodnotenia USG - a MG-nálezov. Zaoberali sme sa súborom 25 žien užívajúcich tibolon od 36 - 119 mesiacov a súborom 20 žien, ktoré ukončili užívanie tibolonu pred viac ako 3 rokmi (tab. 2). Základná demografická charakteristika súboru 20 žien, ktoré ukončili liečbu tibolonom je uvedená v tab. 3. Dĺžka užívania tibolonu v súbore 25 žien je v tab. 4.



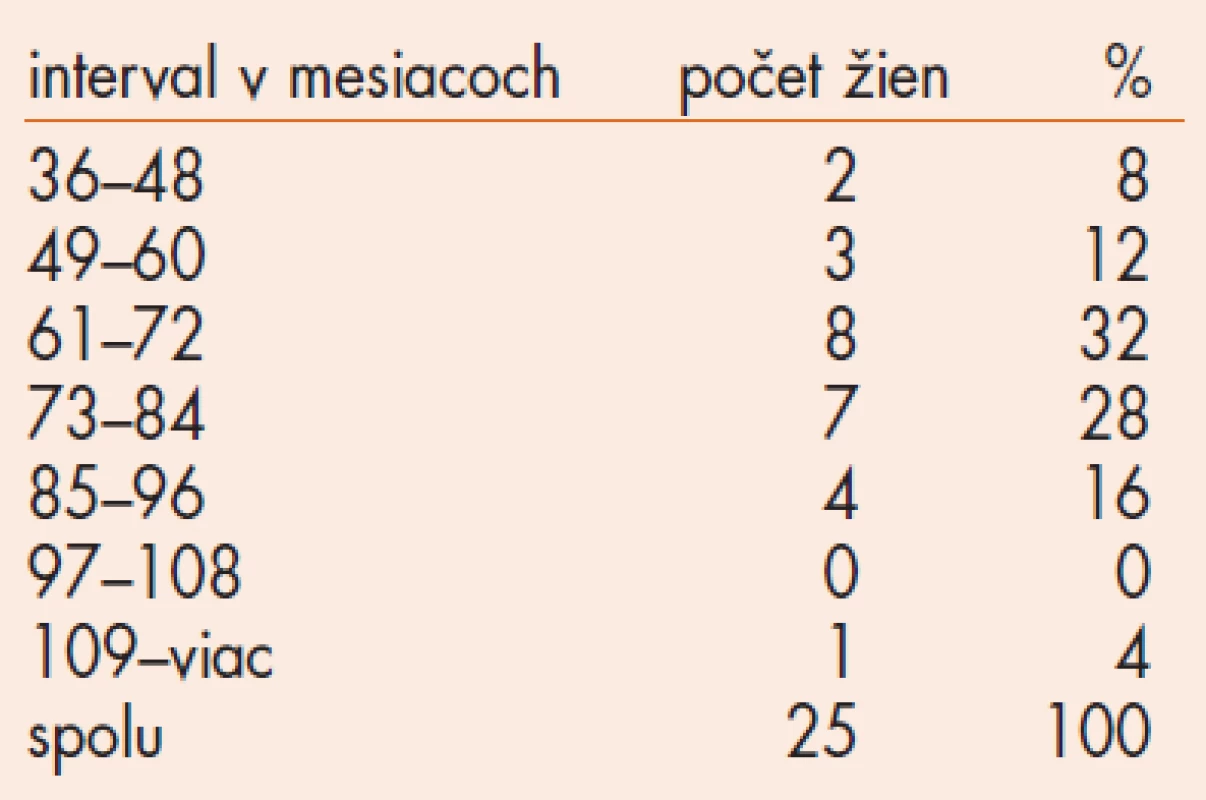
Pacientky v oboch súboroch absolvovali pravidelné gynekologické, sonografické vyšetrenie prsníkov a mamografické vyšetrenie v intervaloch 2 roky. Mamografické a sonografické nálezy hodnotil 1 z 3 rádiodiagnostikov. Rentgenológovia neboli oboznámení s typom hormonálnej liečby a dĺžkou užívania. Mamografické snímky hodnotili subjektívnym posudzovaním množstva tkaniva vzhľadom na vek, hodnotili denzitu, pomer žľazy k tukovému tkanivu, rozloženie tkaniva, prítomnosť štrukturálnych zmien, prítomnosť ložísk a mikrokalcifikátov.
Výsledky
Kontrolné mamografické a sonografické vyšetrenie prsníkov absolvovali všetky hodnotené pacientky. U všetkých žien, ktoré ukončili užívanie tibolonu pred viac ako 2 rokmi bol mamografický a sonografický nález stabilizovaný, hodnotený mamodiagnostikom ako involučný typ prsníka.
Kontrolné mamografie a sonografie prsníkov žien užívajúcich tibolon od 36 - 119 mesiacov neboli zaznamenané žiadne zmeny denzity v porovnaní s predchádzajúcimi snímkami. Všetky sonografické a mamografické výsledky v tejto skupine boli stabilizované. Žiadna žena užívajúca tibolon, ani žena, ktorá ukončila užívanie tibolonu neudávala zväčšenie prsníkov, napätie či mastodyniu.
Diskusia
Lekári, ktorí sa starajú o postmenopauzálne pacientky s klimakterickými symptómami, rozvinutým organickým a metabolickým estrogén-deficitným syndrómom, hlavne po neodbornej interpretácii výsledkov štúdií posledných rokov (WHI EPT-rameno a MWS) sa nachádzajú v nezávideniahodnej situácii v rozhodovacom procese voľby prípravku pri potrebe dlhodobej hormonálnej liečby.
Pretože karcinóm prsníka je významný socioekonomický problém, ktorý postihuje 1 z 10 - 12 žien, ohrozuje ju nielen na zdraví a živote, ale ovplyvňuje aj jej psychiku, vzhľad a ženskosť, trend v klimakterickej farmakoterapii smeruje k vývoju prípravkov, ktoré nebudú zvyšovať incidenciu karcinómu prsníka u postmenopauzálnych užívateliek v porovnaní s placebom [7]. Cieľom v terapii karcinómu prsníka a jeho prevencii je objasniť mechanizmus jeho vzniku a vytvoriť látky, ktoré budú blokovať tvorbu estrogénov v bunkách prsníka. Treba si uvedomiť, že proces vedúci ku karcinómu prsníka je mnohostupňový fenomén, pri ktorom hrá významnú úlohu genetická výbava, hormonálny status, vek, BMI a environmentálne vplyvy. Každá žena má pre vývoj karcinómu prsníka individuálne karcinogenetické riziko. Napriek tomu, že estrogény nevyvolávajú karcinogenézu, v dôsledku svojej mitotickej aktivity pôsobia ako rastové promotory malígnej transformácie, ktorá vznikla pod vplyvom iných faktorov. Hoci hladina cirkulujúcich estrogénov je u postmenopauzálnych žien nízka, bunky prsníka sú schopné syntetizovať estradiol lokálne chemickou konverziou pomocou enzymatickej výbavy z inaktívnych komponent [8]. V bunkách karcinómu prsníka sú hladiny estradiolu rovnako vysoké u premenopauzálnych aj postmenopauzálnych žien. Prsník u postmenopauzálnej ženy reaguje odlišne od prsníka premenopauzálnej ženy. Proliferačná aktivita u postmenopauzálnych žien bez hormonálnej terapie je veľmi nízka. U žien po menopauze užívajúcich ET mierne, nesignifikantne stúpa. U žien nastavených na EPT je proliferačná aktivita buniek prsníka zreteľne zvýšená. Dochádza tiež k expresii progesterónových receptorov. V postmenopauzálnom prsníku efekt progesterónu na proliferáciu je významný po predchádzajúcej chronickej estrogénnej stimulácii [9]. Vyššie riziko karcinómu prsníka ET - 1,3, EPT – 2,0.
Od roku 1988 je na trhu tibolon-selektívny regulátor estrogénnej bunkovej aktivity (TEAR). Má výhodu pred ET/EPT tým, že nezvyšuje MG-denzitu a nedochádza k výskytu mastodynie. Tkanivovo-selektívny efekt tibolonu je výsledkom jeho metabolizmu, pre-receptorovej enzýmovej regulácie a receptorovej aktivácie, ktorá je odlišná v rôznych tkanivách [10]. V prsníku tibolon a jeho metabolity inhibujú sulfatázu a 17beta-HSD typ I a stimulujú sulfotransferázu a 17beta-HSD typ II, čím blokujú tvorbu aktívneho estrogénu [11]. Estrogénnu aktivitu v rozdielnych tkanivách reguluje tibolon tým, že ovplyvňuje dostupnosť estrogénnych zlúčenín pre estrogénny receptor tkanivovo selektívnym spôsobom [12]. V prsníku ovplyvňuje bunkovú homeostázu tým, že inhibuje proliferáciu a stimuluje apoptózu buniek prsníka [13]. Porovnávacie štúdie publikované v poslednom období dokázali, že tibolon má odlišný klinický profil od iných terapeutických modalít používaných na tú istú indikáciu.
Prekvapivé boli výsledky ohľadne tibolonu v MWS, v ktorej autori vykázali RR 1,45 z aspektu rizika karcinómu prsníka. Podľa hodnotenia Kenemansa, MWS vyvoláva pochybnosti ohľadne hodnovernosti údajov, v štúdii sa nadsadzuje vplyv HT na riziko karcinómu prsníka. Výsledky ohľadne výskytu rakoviny prsníka v prvom roku liečby neboli potvrdené žiadnou randomizovanou placebom kontrolovanou štúdiou [14].
Tibolon vykazuje kompletne odlišný účinok na bunky prsníka ako konvenčná ET/EPT. Tým, že znižuje koncentráciu estradiolu v bunkách prsníka, užívateľky tibolonu udávajú nízky výskyt mastodynie a napätia prsníka. V doteraz publikovaných štúdiach o vplyve tibolonu na mamografickú denzitu autori zhodne opisujú jeho minimálny vplyv [15].
Záver
Na základe našich skúseností tibolon pacientky dobre tolerujú aj pri dlhodobom užívaní. U dlhodobých užívateliek nedochádza k zvyšovaniu MG-denzity a výskytu mastodynie. Z aspektu dlhodobého hodnotenia akceptácie preparátu, patrí tibolon k vhodným modalitám hormonálnej terapie pri potrebe dlhodobého režimu užívania.
MUDr. Petrovičová Zuzana1
prim. MUDr. Tibor Bielik, Ph.D.2
MUDr. Milica Piškaninová3
1privátna gynekologická ambulancia, Banská Bystrica
2gyn.-pôr. odd. FNsP FDR Banská Bystrica
3Organon, Bratislava
Sources
1. Bundred N. Hormone replacement therapy, breast cancer and the future, J Br Menopause Soc 2001; 13–15.
2. Eden J. The need for tissue selective menopausal agents. Gynecol Endocrinol 2005; 21 : 22–27.
3. Gompel A, Kandouz M, Siromachkova M et al. The effect of tibolone on proliferation, differentiation and apoptosis in normal breast cells. Gynecol Endocrinol 1997; 11 : 77–79.
4. Helmond FA. Livial and its tissue specific effects on breast tissue. J Menopause 2001; 8 : 19–20.
5. Jaminch. Treatment of menopause and breast in practice. J Menopause 2001; 8 : 21–23.
6. Petrovičová Z, Bielik T, Piškaninová M. Bezpečnostný profil tibolonu z aspektu prsníka pri prechode z krátkodobého režimu na dlhodoby režim užívania. Slov Gynekol a Pôrod. 2002; 9 : 175–179.
7. Kenemans P. Tibolone: how does its mechanism of action translate into clinical effects. Maturitas 2004; www.sciencedirect.com.
8. Kloosterboer HJ. Tissue-selectivity: the mechanism of action of tibolone. Maturitas 2004; www.sciencedirect. com.
9. Lundstrome E. Effects of tibolone and continuous combined hormone replacement th. on mammography breast density. J Am Obstet Gynecol 2000; 186 : 717–721.
10. Pasqualini JR. Synthesis and regulation of sex hormones in breast tissue during pre and postmenopause. J Menopause 2001; 8 : 10–13.
11. Recommendations for Estrogen and Progestogen Use in Peri - and Postmenopausal Women. The North American Menopause Society 2004.
12. Reed MJ. Role of enzymes and tissue-specific actions of steroids. Maturitas 2004; available online at www.sciencedirect.com.
13. Santen R. Menopausal hormone therapies. Gyneol Endocrynol 2005; 21 : 12–16.
14. Speroff L. The meaning of mammography breast density in users of postmenopausal hormone therapy; Maturitas 2002; 42 : 31–35.
15. Valdivia I, Ortega D. A one year evaluation on mammary radiographic density (MxDx) changes with different HRTs regimens in climacteric woman. Acta Obstet Gynaecol Scand 1997; 76.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Practical Gynecology

2006 Issue 3
-
All articles in this issue
- Ovarian Cancer in Infertile Females in the Czech Republic: part I
- The possibility of donated gametes or embryos usage in infertility treatment
- Ureaplasma Urealyticum as a Cause of Chronic Vaginal Discharge
- The profile of tibolon with regard to breast safety in long-term therapy
- New gyneco-urological and sexological implications of the female prostate and female prostate specific antigen
- Practical Gynecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Ureaplasma Urealyticum as a Cause of Chronic Vaginal Discharge
- New gyneco-urological and sexological implications of the female prostate and female prostate specific antigen
- The profile of tibolon with regard to breast safety in long-term therapy
- The possibility of donated gametes or embryos usage in infertility treatment
