Role homocysteinu a příbuzných thiolů v etiopatogenezi poruch lidské reprodukce
The role of homocysteine and related thiols in etiopathogenesis of human reproduction disorders
Metabolism of homocysteine and related thiols plays an important role in many physiological processes of the human reproductive system. Its disturbances influence methylation reactions and are strongly associated with an increased risk of oxidative stress. An imbalance between overproduction of free radicals and efficacy of antioxidant systems in germ cells is considered to be the fundamental factor in cell membrane and DNA injuries. Hyperhomocysteinemia inhibits the methylation reactions that play an important role in DNA repairs and genom stabilisation. The aim of the study was to provide an overview of current knowledge on the association between metabolism of homocysteine and related thiols and human reproduction.
Key words:
homocysteine – glutathione – thiols – oxidative stress – infertility
Authors:
M. Králíková 1; I. Crha 2
; J. Melounová 1
Authors‘ workplace:
Biochemický ústav, LF MU, Brno
1; Gynekologicko-porodnická klinika, LF MU a FN Brno
2
Published in:
Prakt Gyn 2011; 15(2): 78-82
Category:
Review Article
Overview
Metabolizmus homocysteinu a dalších thiolů hraje významnou roli v řadě fyziologických procesů v lidských gonádách. Jeho narušení je spojeno se zvýšeným rizikem oxidačního stresu a s ovlivněním methylačních reakcí. Nerovnováha mezi nadprodukcí volných radikálů a účinností antioxidačních systémů zárodečných buněk je považována za jeden ze základních faktorů poškození buněčné membrány a genetické informace. Hyperhomocysteinemie inhibuje methylační reakce hrající důležitou roli mimo jiné při opravách DNA a stabilizaci genomu. Cílem práce je uvést přehled současných poznatků o metabolizmu homocysteinu a ostatních thiolů v souvislosti s lidskou reprodukcí.
Klíčová slova:
homocystein – glutathion – thioly – oxidační stres – neplodnost
Úvod
Vzestupný trend v počtu neplodných párů v posledních desetiletích vede k intenzivnímu zájmu o problematiku etiopatogeneze lidské neplodnosti [1].
Řada fyziologických procesů v lidských gonádách je úzce vázána na metabolizmus základních aminokyselin. Významnou úlohu má homocystein (Hcy) a další thioly. Hyperhomocysteinemie je signifikantně spojena se zvýšeným rizikem oxidačního stresu. Nerovnováha mezi nadprodukcí volných radikálů a účinností antioxidačních systémů zárodečných buněk je považována za jeden ze základních faktorů poškození buněčné membrány a genetické informace. Cílem práce je předložit přehled současných poznatků o metabolizmu homocysteinu v souvislosti s lidskou reprodukcí.
Mužská reprodukce
Důkazů o tom, že homocystein a vitaminy související s jeho metabolizmem (kyselina listová, B6 a B12) mají velký význam pro mužskou plodnost, stále přibývá [2–5]. Byl prokázán vztah mezi hyperhomocysteinemií a narušením spermatogeneze, ke kterému může dojít kdykoli v průběhu buněčné proliferace a diferenciace, a také vztah mezi „zdravou uvědomělou“ stravou, plazmatickou hladinou homocysteinu a poškozením DNA spermií [6,7]. Koncentrace homocysteinu ve spermiích subfertilních mužů je vyšší než u mužů plodných [3]. Naproti tomu koncentrace homocysteinu (a také vitaminu B12)v seminální tekutině azoospermiků je nižší než u normospermiků [8]. Homocystein zvyšuje expresi prozánětlivých cytokinů, monocytárního chemotaktického proteinu-1 a interleukinu-8, které hrají roli v procesu testikulárního zánětu, spermatogeneze, při pohybu spermií, kapacitaci, akrozomální reakci a fertilizaci a snižují dostupnost oxidu dusnatého během erekce.
Homocystein ovlivňuje mužskou reprodukci především nadměrnou tvorbou reaktivních forem kyslíku (ROS), které působí na spermie dvěma klíčovými mechanizmy – peroxidacínenasycených mastných kyselin a přímým poškozením DNA.
Oxidační stres
Ačkoli ke tvorbě ROS dochází i fyziologicky při zrání a kapacitaci spermií, nadměrná tvorba je poškozuje [9]. ROS vznikají během autooxidace homocysteinu a ke vzniku neplodnosti mužů přispívají ve 30–80 % případů. Protože během spermatohistogeneze ztrácí spermie většinu cytoplazmy, je ve zralé spermii limitována dostupnost enzymů nutných pro obranu proti ROS.
Prvním z mechanizmů patologického působení je peroxidace nenasycených mastných kyselin v membráně spermií, čímž dochází k porušení fluidity membrány, která má velký význam při splynutí spermie a vajíčka během fertilizace [10,3]. Dochází ovšem i k poškození mitochondrií, které vede ke snížení pohyblivosti spermií a narušení jejich schopnosti proniknout do vajíčka. Druhým mechanizmem je přímé poškození DNA spermií [11]. Standardně je DNA v hlavičce spermií pevně sbalena v důsledku disulfidových vazeb mezi cysteinovými zbytky v molekulách protaminů, které ji před napadením ROS chrání. Ve spermiích neplodných mužů byla prokázána nedostatečná protaminace DNA. Následkem je zvýšená citlivost DNA k oxidačnímu poškození [3,11,12]. Oxidace cysteinu na cystin je důležitá také pro ochranu DNA před fyzikálním a jiným chemickým poškozením a udržení struktury bičíku a pohyblivosti spermie [3].
Hlavními zdroji ROS ve spermatu jsou leukocyty (převládají neutrofily) a samy spermie. Rychlost produkce volných radikálů je u leukocytů 1 000krát vyšší než u spermií při kapacitaci [12], kdy dosahuje svého maxima.
Na druhé straně je produkce určitého množství ROS spermiemi nutná k zajištění jejich správné funkce. ROS mají pozitivní účinky právě při kapacitaci spermií. Peroxid vodíku stimuluje akrozomální reakci a aktivitu spermií, a napomáhá tak oplodnění vajíčka. Posiluje vazbu membrány spermií na protein ZP-3 zóny pellucida, a podporuje tím splynutí spermie s vajíčkem.
Tvorba ROS spermiemi nepřímo koreluje s jejich zráním. Během spermatohistogeneze ztrácí spermie cytoplazmu, následkem čehož dochází k silnému zhuštění DNA v hlavičce spermie. Nezralé spermie s patologickou morfologií jsou charakteristické přítomností nadměrného množství cytoplazmatických zbytků. Tyto zbytky obsahují glukóza-6-fosfátdehydrogenázu (G6PD), která katalyzuje produkci NADPH + H+. NADPH je využit pro tvorbu O2– působením NADPH-oxidázy, která je lokalizována v membráně spermií (obdoba respiračního vzplanutí ve fagocytujících buňkách). Výsledkem je zvýšená produkce ROS v porovnání s morfologicky normálními spermiemi [3,12].
Mužská reprodukce a ostatní thioly
Úlohou cysteinu a glutathionu je ochrana před oxidačním stresem způsobeným ROS. Jsou součástí enzymatických a neenzymatických antioxidačních mechanizmů v pohlavním traktu i samotných spermiích, kterými organizmus udržuje oxidační rovnováhu, a zajišťuje tak ochranu buněk před oxidačním poškozením. Glutathion je syntetizován i v samotných spermiích, nicméně tato produkce je nedostatečná pro celkový obrat glutathionu a pro jeho dostatečnou tvorbu je nezbytná mezibuněčná komunikace se Sertoliho buňkami.
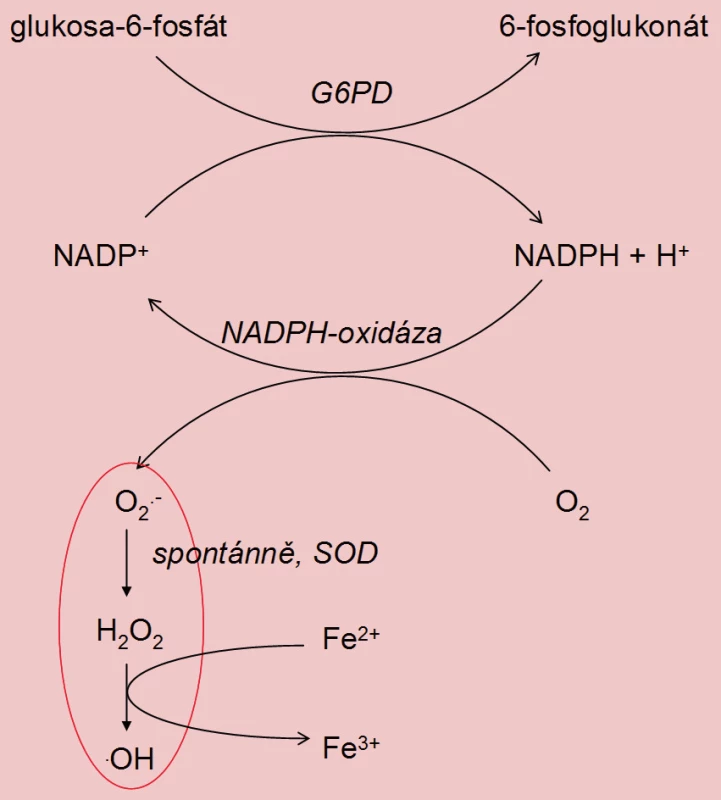
Několik studií prokázalo nižší hladinu glutathionu, příp. i cysteinu, v ejakulátu či seminální tekutině subfertilních mužů ve srovnání s muži plodnými [13,3]. Hladina cysteinylglycinu je srovnatelná [3]. Zajímavé je, že ve studii je u subfertilních mužů intracelulární koncentrace všech thiolů ve spermiích významně vyšší [3], zatímco jiná práce uvádí u oligospermiků naopak nižší hodnoty než u zdravých kontrol [14]. Intramuskulární léčba glutathionem má pozitivní účinek na pohyblivost a morfologii spermií.
Při reakci thiolů s peroxidem vodíku dochází k jejich oxidaci, která je důležitá pro stabilizaci struktury bičíku spermií, jejich pohyblivost a ochranu DNA protaminací. Dalšími významnými neenzymovými antioxidanty ve spermatu jsou kyselina askorbová, α-tokoferol, aminokyseliny taurin a hypotaurin, albumin, karnitin, karotenoidy, flavonoidy, kyselina močová či pyruvát [14]. Řada studií potvrdila výrazně nízkou aktivitu neenzymatických antioxidantů u neplodných mužů ve srovnání s muži plodnými [11,12].
Nejtoxičtější účinky na spermie z ROS vykazuje peroxid vodíku [14]. Ochranu před ním poskytují enzymy kataláza a glutathionperoxidáza (GPX):
Kataláza:
2 H2O2
→ 2 H2O
+ O2
GPX:
H2O2
+ 2 GSH →
GSSG + 2 H2O
GPX se vyskytuje ve varlatech, nadvarlatech, chámovodech, prostatě, semenných váčcích, seminální tekutině i spermiích v klesající koncentraci v průběhu spermatogeneze. Ve zralé spermii se nachází především v oblastikrčku, kde je součástí tzv. mitochondriálního pouzdra. Kromě peroxidu vodíku rozkládá i ostatní hydroperoxidy. Její aktivita je závislá na regeneraci oxidovaného glutathionu na redukovanou formu. Vysoká intracelulární hladina GSH je zajištěna NADPH dependentní glutathionreduktázou (GRX):
GSSG + NADPH + H+ → 2 GSH + NADP+
Selektivní inhibice GRX snižuje dostupnost redukovaného glutathionu, a spermie jsou tak vystaveny oxidačnímu stresu. Koordinace aktivity GPX a GRX tedy hraje klíčovou roli v ochraně spermií před oxidačním poškozením [12].
Svou úlohu v antioxidační ochraně spermií má zřejmě i další z enzymů závislých na glutathionu, a to glutathion-S-transferáza, jejíž aktivita byla stanovena v seminální tekutině [13].
Posledním z antioxidačních enzymů je superoxiddizmutáza (SOD), která rozkládá superoxidový anion radikál O2−. SOD se vyskytuje v seminální tekutině i ve spermiích a byla potvrzena souvislost mezi deficitem SOD a mužskou neplodností [14].
Nadměrné vychytávání ROS má na druhou stranu negativní účinky na průběh fertilizace [3]. Potvrzuje se tak, že fyziologická hladina ROS je pro tento proces nezbytná.
Ženská reprodukce
Estrogeny a homocystein
Protektivní účinky estradiolu na cévní endotel souvisí s jeho vlivem na metabolizmus homocysteinu. Mezi hladinou estradiolu a Hcy existuje inverzní vztah [15]: podávání estrogenů signifikantně snižuje koncentraci Hcy i u postmenopauzálních žen [16]. Kromě indukce celkové enzymatické aktivity zvyšuje estradiol především aktivitu cystathionin-β-syntázy (CBS), následkem čehož dojde k převaze transsulfurační metabolické dráhy a katabolizaci homocys-teinu [3,15,17]. Dalším protektivním efektem estradiolu je zvýšení hladiny antioxidantu glutathionu.
Hladina homocysteinu se vlivem estradiolu mění také v průběhu menstruačního cyklu. Předchozí studie prokázaly, že koncentrace Hcy u premenopauzálních žen je signifikantně nižší v luteální fázi menstruačního cyklu než ve fázi folikulární [18].
Homocystein a asistovaná reprodukce
Ovariální stimulace u žen podstupujících metody asistované reprodukce snižuje koncentraci homocysteinu v krevní plazmě [17]. Podobně jako u fyziologického působení estradiolu v průběhu menstruačního cyklu se zřejmě jedná o důsledek indukce celkové enzymatické aktivity, která zahrnuje i enzymy katabolizmu homocysteinu, tedy především CBS [17]. Hyperhomocysteinemie u párů podstupujících metody asistované reprodukce je spojena s nižším podílem úspěšných nidací a klinických těhotenství a vyšším počtem potratů [19]. Hyper-homocysteinemie je spojena také s poruchami hemokoagulace, představující možnou příčinu vzniku mikro-trombů v děložních cévách, násled-kem kterých dochází k zábraně nidaceoplodněného vajíčka či může dojít k potratu.
Přítomnost homocysteinu ve folikulární tekutině byla poprvé prokázána v roce 1993 [20] a potvrzena novějšími pracemi [17,21]. Nízká koncentrace homocysteinu ve folikulární tekutině je spojena s vyšším stupněm zrání oocytu [20], zatímco vysoké hladiny homocysteinu a folátů ve folikulární tekutině mají negativní vliv na velikost a vývoj folikulu [17] a negativně korelují s úspěšností oplodnění oocytů a kvalitou embryí [3,21]. Negativní korelace s velikostí folikulu je výrazně silnější u žen, které neužívaly kyselinu listovou. Avšak u žen, které kyselinu listovou užívaly, překvapivě koncentrace folátu ve folikulární tekutině také negativně koreluje s velikostí folikulu. To naznačuje, že vysoké koncentrace jak Hcy, tak folátu mohou mít škodlivý vliv na růst folikulu a je třeba nalézt optimální dávky kyseliny listové nejen pro prevenci výskytu defektů neurální trubice, ale také pro zlepšení kvality oogeneze [17].
Zvýšená hladina Hcy také může potlačit syntézu estradiolu, a tím ovlivnit zrání oocytu a fertilizaci u žen se syndromem polycystických ovarií [17,21]. Koncentrace homocysteinu ve folikulární tekutině je u těchto žen výrazně vyšší ve srovnání se zdravými ženami a také u nich byla zjištěna negativní spojitost mezi hladinou homocysteinu a kvalitou oocytů a embryí a podílem fertilizace. Byla vyslovena hypotéza, že vyšší koncentrace homocysteinu ve folikulární tekutině může způsobovat poškození oocytu, které potom brání oplození. Homocystein může tedy u žen se syndromem polycystických ovarií, které podstoupily IVF, představovat vhodný marker pro stanovení kvality oocytů a embryí a predikci úspěšnosti fertilizace [21]. Produkce estradiolu buňkami zona granulosa u žen podstupujících metody asistované reprodukce je rovněž ovlivněna oxidačním stresem. Také zde se může jednat o souvislost s působením homocysteinu, který k rozvoji oxidačního stresu přispívá.
Protože je exprese CBS v lidském oocytu velmi nízká až nulová, remethylační metabolická dráha je v těchto případech jedinou alternativou pro odstranění nadbytečného homocysteinu. Homocystein zároveň inhibuje methylační děje, což vysvětluje jeho negativní vliv na vývoj oocytů a embryí. Tento negativní efekt na methylační reakce bychom měli mít na zřeteli zvláště s ohledem na trend kultivovat embrya v médiích postrádajících esenciální aminokyseliny včetně methioninu v době, kdy mají methylace nepostradatelný význam [22].
Gravidita a homocystein
Pro těhotenství je charakteristická řada fyziologických změn, které se týkají také hladiny homocysteinu, která je v plazmě těhotných žen o 50–60 % nižší než u ostatních žen [23].
Přesný důvod snížení Hcy během gravidity není znám. Mezi možná vysvětlení řadíme hemodiluci, zvýšenou produkci estrogenů, zvýšenou ledvinovou clearance homocysteinu nebo zvýšené požadavky rostoucího plodu na dávky methioninu [24,25].
Plazmatická hladina Hcy matky je vyšší než u plodu, přičemž mezi oběma existuje signifikantní přímá závislost [26,27]. Hladina Hcy plodu je přímo ovlivňována mateřskou koncentrací, a značný význam má proto transport homocysteinu přes placentární bariéru. V placentě dochází k přenosu homocysteinu přes plazmatickou membránu mikroklků buněk syncytio-trofoblastu třemi transportními systémy (L, A a y+L). U těhotných žen s hyperhomocysteinemií soutěží homocystein o tyto transportní systémy s ostatními endogenními aminokyselinami, což omezuje přísun daných aminokyselin vyvíjejícímu se plodu [27]. K depleci navíc může přispět i antiport Hcy/aminokyselina hlavním transportním systémem L.
V průběhu gravidity může dojít ke vzniku řady komplikací a patofyziologických stavů. U mnoha z nich hraje klíčovou roli také homocystein.
Samovolné a habituální potraty
Bylo zjištěno, že hyperhomocysteinemie zvyšuje riziko potratů až 3krát, neboť je spojena s poškozením deciduálních a chorionických cév, které může bránit nidaci oplodněného vajíčka nebo způsobit narušení cévního zásobení plodových obalů a následnou smrt plodu [28]. Možnosti terapie jsou limitovány etiologií [29].
Spontánní potrácení je ovlivněno také polymorfizmem methylentetrahydrofolát reduktázy (MTHFR) – genotyp 677TT představuje zvýšené riziko. Ačkoli mechanizmus působení není zcela objasněn, byla vyslovena hypotéza o spojitosti s hyperhomocysteinemií. Ta mimo jiné inhibuje methylační reakce hrající důležitou roli při opravách DNA a stabilizaci genomu. Polymorfizmus MTHFR je spojen se sníženou methylací DNA.
Nejen mateřská hyperhomocysteinemie zvyšuje riziko habituálního potrácení. I hyperhomocysteinemie otce, genotyp 677TT a vyšší věk jsou rizikovými faktory vzniku opakovaných potratů [30].
Vrozené vývojové vady
Hyperhomocysteinemie je spojena také s raně ontogenetickými postiženími, především defekty neurální trubice. Hlavní příčinou poruch uzavírání neurální trubice je nedostatek kyseliny listové v raných stadiích těhotenství, ale byla odhalena také souvislost s 677TT genotypem MTHFR [27]. Vyšší hladina homocysteinu byla nalezena také u matek dětí s orofaciálními malformacemi a vrozenými srdečními vadami. Prevencí všech těchto vrozených vývojových vad je podávání kyseliny listové prekoncepčně a dále v průběhu gravidity [24].
Závěr
Dnešní poznatky svědčí o významném vlivu homocysteinu na rozvoj oxidačního stresu a poškození zárodečných buněk. Přesná diagnostika může objasnit příčiny poruch plodnosti a vytvořit předpoklady pro cílenou terapii.
Práce byla podpořena grantem IGA MZ ČR NS/9661-4.
MUDr. Michaela Králíková
Biochemický ústav, LF MU, Brno
mkralik@med.muni.cz
Sources
1. Sviteková M, Čadová K, Crha I et al. Vliv výživy na výsledky léčby neplodnosti metodami IVF/ET. Prakt Gyn 2010; 14(2): 85–88.
2. Wallock LM, Tamura T, Mayr CA et al. Low seminal plasma folate concentrations are associated with low sperm density and count in male smokers and nonsmokers. Fertil Steril 2001; 75(2): 252–259.
3. Ebisch IM, Peters WH, Thomas CM et al. Homocysteine, glutathione and related thiols affect fertility parameters in the (sub)fertile couple. Hum Reprod 2006; 21(7): 1725–1733.
4. Boxmeer JC, Smit M, Weber RF et al. Seminal plasma cobalamin significantly correlates with sperm concentration in men undergoing IVF or ICSI procedures. J Androl 2007; 28(4): 521–527.
5. Boxmeer JC, Smit M, Utomo E et al. Low folate in seminal plasma is associated with increased sperm DNA damage. Fertil Steril 2009; 92(2): 548–556.
6. Vujkovic M, de Vries JH, Dohle GR et al. Associations between dietary patterns and semen quality in men undergoing IVF/ICSI treatment. Hum Reprod 2009; 24(6): 1304–1312.
7. Oborná I, Fingerová F, Hajdúch M et al. Lykopen v terapii mužské plodosti. Čes Gynek 2007; 72(5): 326–329.
8. Crha I, Kralikova M, Melounova J et al. Seminal plasma homocysteine, folate and cobalamin in men with obstructive and non-obstructive azoospermia. J Assist Reprod Genet 2010; 27(9–10): 533–538.
9. Crha I, Přibyl J, Skládal P et al. AFM (Atomic Force Microscopy) zobrazení spermií poškozených oxidačním stresem. Prakt Gyn 2010; 14(3): 120–122.
10. Oborna I, Wojewodka G, De Sanctis JB et al. Increased lipid peroxidation and abnormal fatty acid profiles in seminal and blood plasma of normozoospermic males from infertile couples. Hum Reprod 2010; 25(2): 308–316.
11. Shen HM, Ong CN. Detection of oxidative DNA damage in human sperm and its association with sperm function and male infertility. Free Radic Biol Med 2000; 28(4): 529–536.
12. Tremellen K. Oxidative stress and male infertility – a clinical perspective. Hum Reprod Update 2008; 14(3): 243–258.
13. Raijmakers MT, Roelofs HM, Steegers EA et al. Glutathione and glutathione S-transferases A1-1 and P1-1 in seminal plasma may play a role in protecting against oxidative damage to spermatozoa. Fertil Steril 2003; 79(1): 169–172.
14. Ochsendorf FR, Buhl R, Bästlein A et al. Glutathione in spermatozoa and seminal plasma of infertile men. Hum Reprod 1998; 13(2): 353–359.
15. Dimitrova KR, DeGroot K, Myers AK et al. Estrogen and homocysteine. Cardiovasc Res 2002; 53(3): 577–588.
16. Madsen JS, Kristensen SR, Klitgaard NA et al. Effect of long-term hormone replacement therapy on plasma homocysteine in postmenopausal women: a randomized controlled study. Am J Obstet Gynecol 2002; 187(1): 33–39.
17. Boxmeer JC, Steegers-Theunissen RPM, Lindemans J et al. Homocysteine metabolism in the pre-ovulatory follicle during ovarian stimulation. Hum Reprod 2008; 23(11): 2570–2576.
18. Tallova J. Tomandl J, Bicikova M et al. Changes of plasma total homocysteine levels during the menstrual cycle. Eur J Clin Invest 1999; 29(12): 1041–1044.
19. Pacchiarotti A, Mohamed MA, Micara G et al. The possible role of hyperhomocysteinemia on IVF outcome. J Assist Reprod Genet 2007; 24(10): 459–462.
20. Steegers-Theunissen RP, Steegers EA, Thomas CM et al. Study on the presence of homocysteine in ovarian follicular fluid. Fertil Steril 1993; 60(6): 1006–1010.
21. Berker B, Kaya C, Aytac R et al. Homocysteine concentrations in follicular fluid are associated with poor oocyte and embryo qualities in polycystic ovary syndrome patients undergoing assisted reproduction. Hum Reprod 2009; 24(9): 2293–2302.
22. Menezo Y, Elder K, Benkhalifa M et al. DNA methylation and gene expression in IVF. Reprod Biomed Online 2010; 20(6): 709–710.
23. Cikot RJ, Steegers-Theunissen RP, Thomas CM et al. Longitudinal vitamin and homocysteine levels in normal pregnancy. Br J Nutr 2001; 85(1): 49–58.
24. de la Calle M, Usandizaga R, Sancha M et al. Homocysteine, folic acid and B-group vitamins in obstetrics and gynaecology. Eur J Obstet Gynecol Reprod Biol 2003; 107(2): 125–134.
25. Tamura T, Picciano MF. Folate and human reproduction. Am J Clin Nutr 2006; 83(5): 993–1016.
26. Malinow MR, Rajkovic A, Duell PB et al. The relationship between maternal and neonatal umbilical cord plasma homocyst(e)ine suggests a potential role for maternal homocyst(e)ine in fetal metabolism. Am J Obstet Gynecol 1998; 178(2): 228–233.
27. Tsitsiou E, Sibley CP, D’Souza SW et al. Homocysteine is transported by the microvillous plasma membrane of human placenta. J Inherit Metab Dis 2011; 34(1): 57–65.
28. Qublan HS, Eid SS, Ababneh HA et al. Acquired and inherited thrombophilia: implication in recurrent IVF and embryo transfer failure. Hum Reprod 2006; 21(10): 2694–2698.
29. Hudeček R, Krajčovičová R, Ventruba P. Aktuální farmakologické možnosti embryoprotektivní terapie infertilních žen. Klin Farmakol Farm 2009; 23(2): 76–82.
30. Govindaiah V, Naushad MS, Prabhakara K et al. Association of paternal hyperhomocysteinemia and C677T Methylene tetrahydrofolate reductase (MTHFR) polymorphism with recurrent pregnancy loss. Clin Biochem 2009; 42(4–5): 380–386.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Practical Gynecology

2011 Issue 2
-
All articles in this issue
- Postkoitální servis up to date
- Diferenciální diagnostika vulvovaginitid
- Disekce aorty u gravidní s Turnerovým syndromem
- Probiotika v gynekologické praxi
- GyneFix – nitroděložní tělísko bez pevného těla a ramének
- Proteom seminální plazmy u mužů s azoospermií
- Prognostický význam tumor markeru SCCA u pacientek s operabilními stadii dlaždicobuněčného karcinomu děložního hrdla
- Farmakoterapie endometriózy v reprodukční gynekologii
- Role homocysteinu a příbuzných thiolů v etiopatogenezi poruch lidské reprodukce
- Bolest nenádorového původu v gynekologii a možnosti její léčby
- Practical Gynecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- GyneFix – nitroděložní tělísko bez pevného těla a ramének
- Farmakoterapie endometriózy v reprodukční gynekologii
- Prognostický význam tumor markeru SCCA u pacientek s operabilními stadii dlaždicobuněčného karcinomu děložního hrdla
- Probiotika v gynekologické praxi
