Genetická predikce osteoporózy v klinické praxi
Genetic prediction of osteoporosis in clinical practice
Objective:
The aim of the study was to explore the utility of predictive genetic testing in a group of women with a risk of osteoporosis.
Materials and methods:
257 women aged 34–68 years at an increased risk of osteoporosis were evaluated using densinometry, biochemistry and genetics. Eight genetic variants of the COL1A1, ESR1, VDR, LRP5, LRP6 and ALOX12 genes, associated with the risk of osteoporosis, were evaluated. Genetic predisposition was classified protective, high-risk or neutral based on the overall genetic score.
Results:
The tested sample comprised 16% of genetically high-risk women. Most frequently (39.1%), the women carried the high-risk TT genotype of the VDR gene (c.1025–49G>T); this is twice the prevalence in the general population. The protective AA genotypee of the ESR1 gene (c.453–351A>G) was also relatively frequent (37.4% of women). Osteopenia, as a clinical sign of an increased risk of osteoporosis, was diagnosed in 15% of the evaluated women. When correlated, 3% of women had an increased genetic and clinical risk.
Conclusion:
Genetic testing could become one of the predictors of risk of osteoporosis, which would allow early and targeted prevention of osteoporosis even prior to the development of any clinical and densinometric changes.
Key words:
osteoporosis – predictive genetic testing – densitometry
Authors:
Tomáš Fait 1,2
; M. Koudová 2
Authors‘ workplace:
Gynekologicko-porodnická klinika, 1. LF UK a VFN Praha
1; Klinika GHC Praha, genetické laboratoře GHC GENETICS
2
Published in:
Prakt Gyn 2011; 15(3-4): 144-148
Category:
Original Article
Overview
Cíl:
Cílem studie bylo ověřit možnosti prediktivní genetiky v souboru žen s rizikem osteoporózy.
Materiál a metodika:
257 žen ve věku 34–68 let ve vyšším riziku osteoporózy bylo vyšetřeno denzitometricky, biochemicky a geneticky. V rámci genetické analýzy bylo hodnoceno 8 genetických variant v genech COL1A1, ESR1, VDR, LRP5, LRP6 a ALOX12, které mají vztah k riziku vzniku osteoporózy. Celkové genetické skóre určilo, zda je kombinace genetických vloh protektivní, riziková, či neutrální.
Výsledky:
V testovaném souboru bylo nalezeno 16 % geneticky rizikových žen. Nejčastěji byl u žen prokázán rizikový genotyp TT genu VDR (c.1025-49G>T), tj. v 39,1 %, což je 2krát více než populační frekvence. Relativně často (37,4 % žen) se také vyskytoval protektivní genotyp AA genu ESR1 (c.453-351A>G). Ve sledované skupině žen byla diagnostikována u 15 % žen osteopenie jako klinická známka rizika osteoporózy. Při vzájemné korelaci bylo zvýšené genetické i klinické riziko zaznamenáno u 3 % žen.
Závěr:
Genetické vyšetření by se mohlo stát jedním z prediktorů rizika osteoporózy, což by umožnilo včasnou a cílenou prevenci.osteoporózy ještě před rozvinutím klinických nebo denzitometrických změn.
Klíčová slova:
osteoporóza – prediktivní genetika – denzitometrie
Úvod
Osteoporóza je častá choroba charakterizovaná sníženou kostní minerální denzitou (BMD) a zvýšeným rizikem zlomenin. V České republice trpí osteoporózou přibližně 7–8 % obyvatel, nejčastěji postmenopauzálních žen.
Diagnostika osteoporózy je postavena na průkazu snížení kostní minerální denzity v takzvaném T-skóre, tedy v poměru k zdravému 25letému jedinci stejného pohlaví, o minimálně 2,5 směrodatné odchylky (SD). U žen nad 70 let preferujeme hodnocení Z-skóre, tedy poměru k stejně starým zdravým jedincům. Při současné přítomnosti osteoporotické zlomeniny hovoříme o komplikované osteoporóze. Pokles o 1–2,5 SD hodnotíme jako osteopenii. Hodnocení BMD je standardně prováděno celotělovým denzitometrem na principu dvoufotonovéabsorpcimetrie (DEXA). Hodnocení BMD pomocí DEXA pomáhá stanovit riziko osteoporotické zlomeniny, je vodítkem ve volbě léčebné či preventivní modality a pomáhá hodnotit účinek léčby.
BMD je však pouze hodnocením hustoty kostního minerálu. Kvalita kosti je dána jejími biomechanickými vlastnostmi, které měřit neumíme. Ultrazvukovou denzitometrii hodnotící i strukturu kosti nelze aplikovat na všechna prediktivní místa zlomenin. Markery kostního obratu ukazují metabolickou aktivitu kosti a velmi rychle ukážou reakci kosti na léčbu. Za průkazúčinku léčby v klinických studiích se považuje až zabránění vzniku zlomeniny. Spojením BMD s anamnézou a hodnocením rizikových faktorů životního stylu vzniká v současnosti doporučovaný systém hodnocení FRAX (Fracture Risk Assessment Tool), který je v mnoha zemích doporučován v managementu osteoporózy.
Za významný rizikový faktor osteoporózy je považován i výskyt osteoporotické zlomeniny u přímých příbuzných [1,2], což vede ke snaze identifikovat geny zodpovědné za osteoporózu. Jiní autoři toto popírají [3]. Logické se jeví zjištění věkové závislosti významu genetické predispozice. Michaelson et al [4] prokazuje 68% dědičnost zlomeniny krčku kosti stehenní ve věku do 65 let, ale nulový význam v osmé dekádě.
Na základě principů prediktivní genetiky je možné při záchytu rizikového genotypu doporučit včasnou prevenci osteoporózy a vyšetření BMD.
Cíl práce
Cílem naší studie bylo zjistit možnosti prediktivního genetického vyšetření v populačním vzorku žen s rizikem osteoporózy a korelaci nálezů rizikového genotypu s klinickým nálezem poruchy kostního metabolizmu.
Materiál a metodika
Do otevřené populační studie se v období od 1. 6. 2010 do 31. 1. 2011 přihlásilo 315 žen starších 18 let. Po vyplnění základního dotazníku (tab. 1) bylo do studie zařazeno 257 žen, které v něm dosáhly více než 5 bodů (za rizikový faktor získávaly +1 bod, za protektivní –1 bod). Průměrný věk pacientek byl 45,9 roku (34–68 let).
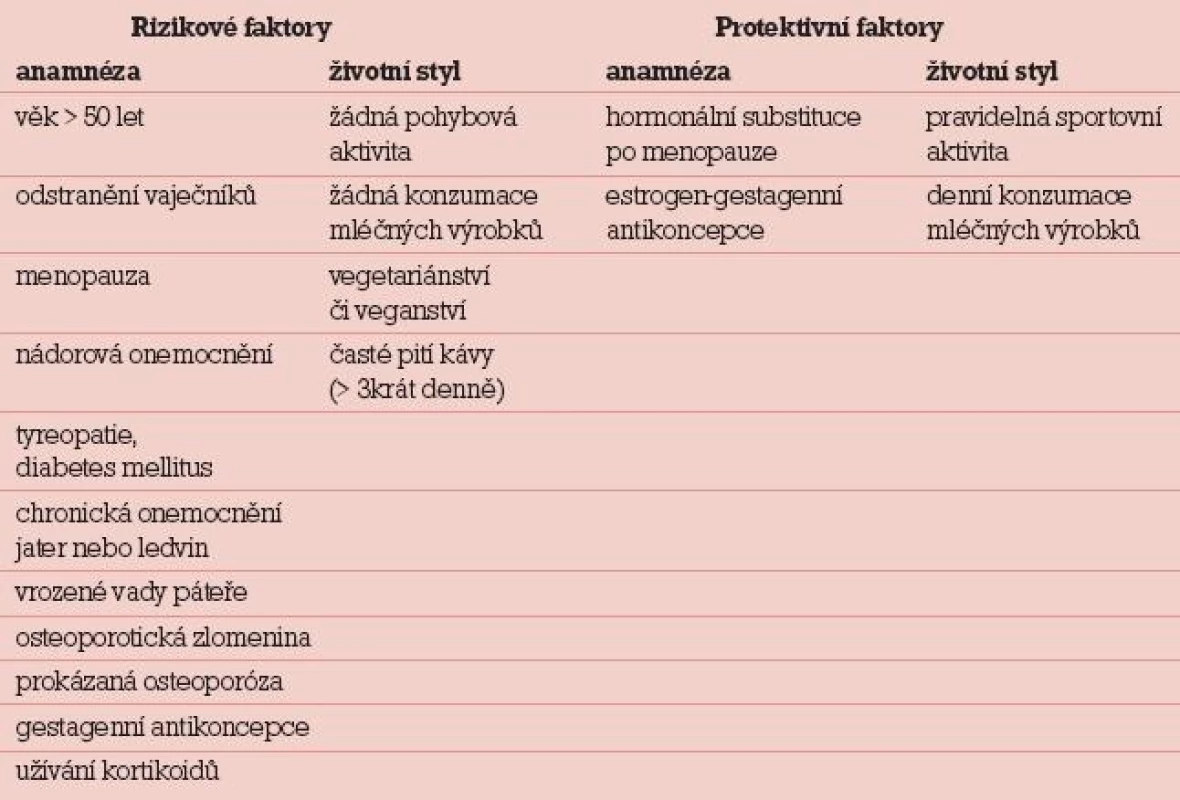
Projekt se řídil Etickým kodexem GHC GENETICS, s. r. o. Každá pacientka byla předem dostatečně a podrobně poučena o prováděném genetickém testování a sama rozhodla o tom, jak má být naloženo s její DNA po dokončení genetického testování. Pro bezpečnost genetických dat jsou laboratoře GHC GENETICS, s.r.o., zabezpečeny biometrickými systémy společnosti Biomatrixx.
Ženy zařazené do studie podstoupily vstupní konzultaci, odběry krve pro biochemické a molekulárně genetické vyšetření (tab. 2), odběry moče včetně vzorků sbíraných 24 hod a denzitometrické vyšetření.
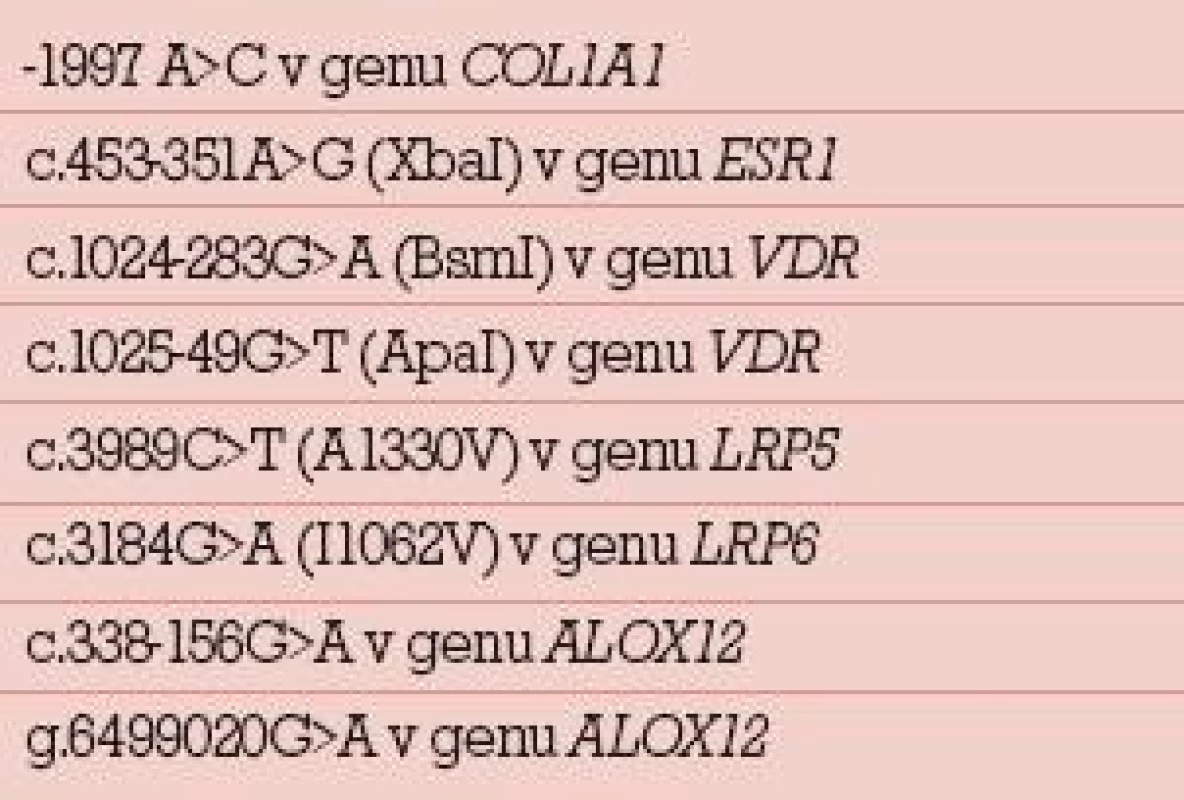
DNA byla izolována použitím separačních kolonek Qiagen pomocí kitu QIAamp DNA minikit a využitím přístroje pro semiautomatickou izolaci DNA QuickGene 810. Izolovaná DNA byla analyzována použitím metod pro molekulárně genetickou analýzu: High Resolution Melting Analysis na přístroji LightScanner a DNA Microarray (GoldenGate Genotyping Assay) na přístroji BeadStation 500G.
Biochemická stanovení byla prováděna na programovatelném automatickém analyzátoru Mascott plus (Lisabio, Francie). Pro hematologickáměření byl používán hematologickýanalyzátor Datacell 18 (Hycell, Francie).Dílčí imunochemická stanovení byla prováděna na poloautomatickém analyzátoru Turbox plus (Orion, Maďarsko), pro měření iontů byl používán analyzátor Biolyte 2000 (Biocare, USA). Denzitometrické vyšetření bylo prováděno ultrazvukovým denzitometrem Sunlight Omnisense (Sunlight, USA) na distální části radia nedominantní ruky.
Výsledky každé ženy byly hodnoceny klinickým genetikem a v závěrečné zprávě byla vyjádřena míra rizika osteoporózy a doporučena přiměřená prevence.
Výsledky
Frekvence výskytu jednotlivých rizikových genotypů a protektivního genotypu genu ESR1 testovaných genetických variant u všech klientek v projektu je zobrazena v grafu 1. Nejčastěji byl u pacientek prokázán rizikový genotyp TT polymorfizmu c.1025-49G>T genu VDR, a to v 39,1 %, tedy s dvojnásobnou frekvencí oproti populačním datům.

Celkem bylo zachyceno 16 % žen ve zvýšeném genetickém riziku pro rozvoj osteoporózy. Toto, vzhledem k vysokému výskytu výše zmíněného polymorfizmu genu VDR, nízké číslo je dáno skutečností, že většina pacientek byla současně nositelkami protektivního genotypu genu ESR1. Nicméně tyto ženy jsou chráněny jen do období menopauzy.
Vysoký výskyt protektivního genotypu ESR1 podporuje doporučení Mezinárodní menopauzální společnosti (International Menopause Society, IMS) užívat v prevenci osteoporózy po menopauze hormonální terapii. Jejím klinicky významným rizikem je riziko tromboembolické nemoci, proto byla současně u všech žen vyšetřena genetická predispozice k tromboembolické nemoci. Mutace Leiden genu F5 byla zachycena v 7,6 % vždy v heterozygotní formě (genotyp AG), mutace protrombinu G20210A genu F2 v heterozygotní formě (genotyp AG) v 3,2 %. Často vyšetřovaný gen pro metyltetrahydrofolátreduktázu MTHFR se ve významnější mutaci C677T v homozygotní formě vyskytoval v 11,4 %. Frekvence těchto mutací odpovídáudávaným populačním frekvencím. Dvě procenta žen byla nositelkami kombinací výše uvedených trombofilních mutací, a tyto ženy byly tedy pro užívání hormonální substituční terapie zcela nevhodné pro vysoké riziko tromboembolické nemoci.
V testovaném souboru 257 žen jsme ve statisticky významném počtu nenalezli výraznější odchylky biochemických parametrů stanovovaných faktorů v krvi. Hraničně sníženou hladinu fosfátů jsme nalezli u 5 žen s postmenopauzální osteopenií. V celém souboru jsme nezaznamenali významnější změny hladin kalcemie. Hodnoty intermediárních dusíkatých metabolitů, zejména kyseliny močové a kreatininu, v souboru žen kolísaly ve značné variační šíři přesahující v 15 případech uváděný fyziologický rozptyl. Výše hodnot, zejména u kyseliny močové, je zpravidla důsledkem životního stylu a odpovídá anamnéze. Z metabolického hlediska lze uvažovat o uvedených metabolitech jako o jednom z kauzálních faktorů osteopenie či osteoporózy, z námi provedených měření ale tato souvislost nevyplývá. Příčinou může být relativně malý rozsah souboru.
Hematologické parametry byly sledovány v rámci klinického vyšetření, existující odchylky se týkaly zpravidla průběžně probíhajících zánětlivých chorob či stavu po prodělaném infektu horních cest dýchacích.
Při fyzikálním a chemickém vyšetření močového sedimentu nebyly nalezeny významnější odchylky se vztahem k osteoporóze. Významnější, bakteriurie s pozitivitou nitrátů, byla zachycena u 9 klientek, stav byl hodnocen jako klinicky asymptomatická bakteriurie a byl vodítkem pro další cílenou péči.
Kvantitativní odpady (ztráty) minerálů za 24 hod byly hraničně vyšší u celkem 6 klientek s denzitometricky verifikovanou postmenopauzální osteopenií. Podstatným faktorem u těchto klientek byla absence hormonální substituce, velmi nízká pohybová aktivita a příjem černé kávy ve stravě.
Snížené hodnoty kostní denzity byly zaznamenány u 35 žen, 7 z nich mělo prokázanou osteopenii s T-skóre v rozmezí -1,5 až -2,5. U 8 žen byla nalezena zvýšená hodnota BMD nad +1,5, tyto ženy byly pro předpoklad zvýšené hormonální stimulace a riziko karcinomu prsu indikovány k senologické kontrole.
Diskuze
Při hledání možností genetické predikce osteoporózy bylo zkoumáno množství kandidátních genů.
Nejčastěji je nalézána silná genetická predispozice pro BMD a geometrii krčku kosti stehenní. Jiné genyjsou spojovány s dosažením maximální BMD v mládí a jiné regulují odbourávání kostní hmoty [5]. Podíl dědičnosti BMD je 50–80 %, geometrie krčku kosti stehenní 70–85 %, kostního obratu 40–70 %, kostní mikroarchitektury 50–60 % a zlomenin 25–48 % [6].
Mezi kandidátní geny pro osteoporózu jsou řazeny geny podílející se na metabolizmu kostní hmoty:
- gen pro receptor vitaminu D VDR [7–9],
- gen pro alfa 1 řetězec kolagenu typu I COL1A1 [10–13],
- gen pro estrogenový receptor alfa ESR1 [14,15],
- gen pro transformující růstový faktor beta 1 TGFB1 [16,17],
- gen pro lipoprotein receptor-related protein 5 LPR5 a protein LPR6 [18,19],
- gen pro sclerostin SOST [20],
- gen pro APT6i podjednotku protonové pumpy osteoklastů TCIRGI [21],
- gen pro chloridové kanály osteoblastů CLCN7 [22],
- gen pro interleukin 6 IL6 [23],
- gen pro osteoprotegerin TNFRSF1 [24].
Gen COL1A1 kóduje hlavní složku kolagenu typu 1. Jedná se o pro-α 1 řetězec, který spolu s pro-α 2 řetězcem (produkt genu COL1A2) formuje vláknitý prokolagen typu 1. Testovaný polymorfizmus -1997A>C genu pro COL1A1 je asociován se změněnou strukturou kostí i BMD. Nositelky AA genotypu mají nižší BMD oproti ženám s ochranným AC, resp. CC genotypem. V rámci preventivních opatření je jedincům s rizikovým genotypem doporučeno užívání suplementů pro podporu syntézy kolagenu, jako je např. chondroitin sulfát či glukosamin sulfát [10–13].
Gen ESR1 kóduje jádrové receptory pro steroidní hormony – estrogeny.Testovaný polymorfizmus c.453-351A>G(XbaI) je prediktorem rizika fraktury nezávislým na BMD a byla popsána jeho asociace s obezitou horní části těla ve středním věku. AA genotyp má protektivní efekt a snižuje obecné riziko zlomenin u žen až o 20 %, především zlomenin obratlů [14,15].
Gen VDR kóduje tvorbu intracelulárního receptoru pro aktivní formu vitaminu D (kalcitriol). V současnosti je známo více než 50 genů, které jsou regulovány vitaminem D. Mutace a polymorfizmy v genu VDR jsou asociovány s BMD, křivicí, monogenní osteomalacií a alopecií. Další asociace byly nalezeny i se zánětlivými, degenerativními a nádorovými onemocněními. V některých studiích byla prokázána souvislost mezi polymorfizmy VDR a BMD obratlů postmenopauzálních žen, nikoli však premenopauzálních. Polymorfizmy ve VDR jsou asociovány i s různou odpovědí na terapii kalcitriolem (vitamin D). Ženy s genotypem AA testovaného polymorfizmu c.1024+283G>A (BsmI) v genu VDR mají nižší BMD než ženy s genotypy AG a GG, přičemž ale prevalence AA genotypu v populaci je asi 16,8 %. U žen po menopauze se snižuje kostní hustota v průměru o 0,3 SD (Standard Deviation – směrodatná odchylka) tabelovaného průměru daného parametru pro daný věk a pohlaví, kde pokles BMD o 1SD znamená o 50 % vyšší riziko vzniku zlomenin. U nositelek AA genotypu může být pokles spinální BMD ještě o 2,4 % nižší. Nositelky AA genotypu mají častější výskyt zlomenin, mírně vyšší riziko osteoporózy a mírně nižší citlivost k léčbě bifosfonáty. Ženy s genotypem TT testovaného polymorfizmu c.1025-49G>T (ApaI) v genu VDR mají nižší BMD než ženy s genotypy TG a GG. U těchto rizikových žen se mohou v období po menopauze vyskytnout vyšší ztráty vápníku, proto bylo těmto klientkám doporučeno přísnější dodržování preventivních opatření vůči vzniku osteoporózy a užívání suplementů obsahujících vápník [7–9].
Gen LRP5 kóduje membránový receptor, který je klíčovým regulátorem kostní hmoty a ovlivňuje vývoj kostí v dětství. Snížení funkce LRP5 vlivem mutací je příčinou dědičného onemocnění skeletu zvaného osteoporosis-pseudogliom syndrom. Byla prokázánavýznamná asociace polymorfizmů tohoto genu se sníženou BMD a vznikemfraktur bederních obratlů páteře u žen nezávisle na věku či dalších zevních vlivech. Polymorfizmus c.3989C>T v genupro LRP5 způsobuje záměnu aminokyseliny alanin za valin v místě 1330 sekvence aminokyselin proteinu LRP5 (p.A1330V). Genotyp TT je asociován s nižší BMD a s menší velikostí páteřních obratlů a šířkou krčku stehenní kosti. Nositelky tohoto genotypu mohou mít až o polovinu vyšší riziko osteoporotických zlomenin. Ženy s tímto genotypem mají nevhodný vývoj kostí od dětství, proto jim bylo doporučeno přísnější dodržování preventivních opatření vůči vzniku osteoporózy [18,19].
Gen LRP6 (Low Density Lipoprotein Receptor Related Protein 6) kóduje membránový receptor, který se s ostatními ko-receptory (LPR5, Wnt) podílí na ovlivnění BMD. Mutace a polymorfizmy v tomto genu jsou asociovány s nízkou hustotou kostí a mohou vést k abnormálnímu formování kostí. Polymorfizmus c.3184G>A v genu pro LRP6 způsobuje záměnu aminokyseliny valin za izoleucin v místě 1062 sekvence aminokyselin proteinu LRP6 (p.V1062I). Genotyp GG může být asociován s nižší BMD páteřních obratlů a se zvýšeným rizikem osteoporotických zlomenin. U tohoto polymorfizmu byla také popsána asociace GG genotypu s nižší tělesnou výškou [20].
Gen ALOX12 (Arachidonate 12 Lipoxygenase) kóduje enzym, který hraje roli v patogenezi zánětlivých onemocnění, karcinogenezi, ateroskleróze a osteoporóze. Je významně asociováns kostní hustotou, zejména páteře, a se změnami BMD u postmenopauzálních žen. Testované polymorfizmy c.338-156G>A a g.6499020G>A v genu v promotorové oblasti genu ALOX12 mohou ovlivnit míru exprese tohoto enzymu i jeho aktivitu. Rizikové genotypy souvisí s nižší BMD bederních obratlů páteře, ale riziko osteoporózy nezvyšují [25].
Závěr
V testovaném souboru bylo nalezeno 16 % celkově geneticky rizikových žen. Nejčastěji byl u žen prokázán rizikový genotyp TT genu VDR (c.1025-9G>T), tj. v 39,1 %, což je 2krát více než populační frekvence. Relativně často (37,4 % žen) se také vyskytoval protektivní genotyp AA genu ESR1 (c.453-351A>G).
Ve sledované skupině žen bylo nalezeno 15 % klinicky rizikových žen na základě zjištěné osteopenie. Při vzájemné korelaci bylo zvýšené genetické i klinické riziko zaznamenáno u 3 % žen.
Genetické vyšetření by se mohlo stát v budoucnosti jedním z prediktorů rizika osteoporózy. Následným zavedením dispenzarizace a cílených preventivních opatření u rizikových žen bude možné snížit riziko rozvoje osteoporózy, oddálit nástup onemocnění a zahájit včasnou terapii ještě před rozvinutím denzitometrických a klinických změn.
Studie byla podpořena společným grantem GHC Genetics s.r.o. a Zdravotní pojišťovny Metal Aliance a.s. „Včasnou prevencí ke zdravějším kostem žen“.
Doručeno do redakce: 6. 9. 2011
Přijato po recenzi: 19. 9. 2011
MUDr. Tomáš Fait, Ph.D.1,2
prim. MUDr. Monika Koudová2
1Gynekologicko-porodnická klinika,
1. LF UK a VFN Praha
2Klinika GHC Praha,
genetické laboratoře GHC GENETICS
tfait@seznam.cz koudova@ghc.cz
Sources
1. Deng HW, Chen WM, Rocker S et al. Genetics determination of Colles’ fracture and diffe-rential bone mass in women with and without Colles’ fracture. J Bone Miner Res 2000; 15(7): 1243–1252.
2. Andrew T, Antioniades L, Scurrah KJ et al. Risk of wrist fracture in women is heritable and is influenced by genes that are largely independent of those influencing BMD. J Bone Miner Res 2005; 20(1): 67–74.
3. Kannus P, Palvanen M, Kaprio J et al. Genetics factors and osteoporotic fractures in elderly people: prospective 25 year follow up of a nationwide cohort of elderly Finnish twins. BMJ 1999; 319(7221): 1334–1337.
4. Michaëlsson K, Melhus H, Ferm H et al. Genetics liability for fractures in the elderly. Arch Intern Med 2005; 165(16): 1825–1830.
5. Ralston SH. Genetics of osteoporosis. Proc Nutr Soc 2007; 66(2): 158–165.
6. Ferrari S. Human genetics of osteoporosis. Best Pract Res Clin Endocrinol Metanol 2008; 22(5): 723–735.
7. Arai H, Miyamoto KI, Yoshida M et al. The polymorphism in the caudal-related homeodomain protein Cdx-2 binding element in the human vitamin D receptor gene. J Bone Miner Res 2001; 16(7): 1256–1264.
8. Gross C, Eccleshall TR, Malloy PJ et al. The presence of a polymorphism at the translation initiation site of the vitamin D receptor gene is associated with low BMD in postmenopausal Mexican-American women. J Bone Miner Res 1997; 11(12): 1850–1856.
9. Thakkinstian A, D’Este C, Eisman J et al. Meta-analysis of molecular association studies: vitamin D receptor gene polymorphisms and BMD as a case study. J Bone Miner Res 2004; 19(3): 419–428.
10. Grant SF, Reid DM, Blake G et al. Reduced bone density and osteoporosis associated with polymorphic Sp1 binding site in the collagen type I alpha 1 gene. Nat Genet 1996; 14(2): 203–205.
11. Harris SS, Patel MS, Cole DE et al. Association of the collagen type I alpha 1 Sp1 polymorphism with five-year rates of bone loss in older adults. Calcif Tissue Int 2000; 66(4): 268–271.
12. Mann V, Hobson EE, Li B et al. A COL1A1 Sp1 binding site polymorphism predisposes to osteoporotic fracture by affecting bone density and quality. J Clin Invest 2001; 107(7): 899–907.
13. Steward TL, Roschger P, Misof BM et al. Association of COL1A1 Sp1 alleles with defective bone nodule formation in vitro and abnormal bone mineralization in vivo. Calcif Tissue Int 2005; 77(2): 113–118.
14. Albagha OM, Pettersson U, Stewart A et al. Association of oestrogen receptor alpha gene polymorphisms with postmenopausal bone loss, bone mass, and quantitative ultrasound properties of bone. J Med Genet 2005; 42(3): 240–246.
15. Ioannidis JP, Stavrou I, Trikalinos TA et al. Association of polymorphisms of the oestrogen receptor alpha gene with BMD and fracture risk in women: a meta-analysis. J Bone Miner Res 2002; 17(11): 2048–2060.
16. Shah R, Rahaman B, Hurley CK et al. Allelic diversity in the TGFB1 regulatory region: characterization of novel functional single nucleotide polymorphisms. Hum Genet 2006; 119(1–2): 61–74.
17. Yamada Y, Miyauchi A, Takagi Y et al. Association of the C-509T polymorphism, alone of in combination with the T869-C polymorphism, of the transforming growth factor-beta1 gene with BMD ad genetic susceptibility to osteoporosis in Japanese women. J Mol Med 2001; 79(2–3): 149–156.
18. Ferrari SL, Deutsch S, Choudhury U et al. Polymorphism in the low-density lipoprotein receptor-related protein 5 (LPR5) gene are associated with variation in vertebral bone mass, vertebral size, and stature in whites. Am J Hum Genet 2004; 74(5): 866–875.
19. van Meurs JB, Rivadeneira F, Jhamai M et al. Common genetic variation of the low-density lipoprotein receptor-related protein 5 and 6 genes determines fracture risk in elderly white men. J Bone Miner Res 2006; 21(1): 141–150.
20. Uitterlinden AG, Arp PP, Paeper BW et al. Polymorphisms in the sclerosteosis/van Buchem disease gene (SOST) region are associated with BMD in elderly whites. Am J Hum Genet 2004; 75(6): 1032–1045.
21. Sobacchi C, Vezzoni P, Reid DM et al. Association between a polymorphism affecting an AP1 binding site in the promoter of the TCIRG1 gene and bone mass in women. Calcif Tissue Int 2004; 74(1): 35–41.
22. Pettersson U, Albagha OM, Mirolo M et al. Polymorphisms of the CLCN7 gene are associated with BMD in women. J Bone Miner Res 2005; 20(11): 1960–1967.
23. Murray RE, McGuigan F, Grant SF et al. Polymorphism of IL6 gene are associated with BMD. Bone 1997; 21(1): 89–92.
24. Langdahl BL, Carstens M, Stenkjaer L et al. Polymorphisms in the osteoprotegerin gene are associated with osteoporotic fractures. J Bone Miner Res 2002; 17(7): 1245–1255.
25. Harsløt T, Husted LB, Nyegaard M et al. Polymorphisms in the ALOX12 gene and osteoporosis. Osteoporos Int 2011; 22(8): 2249–2255.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Practical Gynecology

2011 Issue 3-4
-
All articles in this issue
- Genetická predikce osteoporózy v klinické praxi
- Prevence postpartální hemoragie u císařského řezu carbetocinem
- Analoga gonadoliberinu v léčbě infertility
- Cílená – biologická léčba karcinomu ovaria
- Vyšetření spermií metodou fluorescenční in situ hybridizace
- Prevence dědičného rizika nádorů prsu a ovaria
- Sayana – nová tvář klasického depotního medroxyprogesteron acetátu
- Císařský řez, ale jaká anestezie?
- Liečba rekurentného karcinómu ovária
- Vývoj spontánnych potratov na Slovensku v rokoch 1997–2009
- Príčiny závažných foriem ovariálneho hyperstimulačného syndrómu u hospitalizovaných pacientok
- Operační techniky a legislativní podmínky sterilizace žen v České republice
- Donošená vysoká kornuální gravidita
- Prolaps dělohy a pochvy přes Mayerův podpůrný pesar
- 13th World Congress on Menopause
- Inhibítory aromatázy v liečbe karcinómu prsníka: prehľad a možné prínosy u žien pred menopauzou
- Practical Gynecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Prolaps dělohy a pochvy přes Mayerův podpůrný pesar
- Analoga gonadoliberinu v léčbě infertility
- Donošená vysoká kornuální gravidita
- Príčiny závažných foriem ovariálneho hyperstimulačného syndrómu u hospitalizovaných pacientok
