Histopatologická klasifikace karcinomu prsu a její vztah k využitelným modalitám systémové léčby
Histopathological classification of breast cancer in relation to the use the types of systemic treatment
Breast cancer is a very heterogeneous group of tumours with a varying range of malignant potential, etiopathogenesis, prognosis and types of treatment. The traditional histopathological classification based on morphological appearance differentiates between the ductal, lobular and other cancers. The present stage of the targeted therapy results from the studies of expression relating to the hormone receptor, gene and protein profiles of tumours. Based on these profiles, breast cancers are divided into four basic groups - cancers with the luminal differentiation A, with the luminal differentiation B, HER2-positive tumours and what is known as „triple negative tumours“. The presence or absence of expression of the hormone receptors and HER2-protein is the essential factor indicating the type of systemic treatment in the complex therapy for breast cancer, as well as chemotherapy, hormonal therapy and targeted biological therapy. The absence of expression of the hormone receptors and, on the other hand, overexpression of HER2-protein, are parameters which significantly influence the prognosis of the disease. They indicate that especially the group of cancers with basal differentiation, that is HER2-positive and triple negative, are prognostically unfavourable.
Key words:
breast cancer – histopathological classification – hormone receptors – targeted therapy – chemotherapy
Authors:
Luboš Minář 1; Vít Weinberger 1; Eva Jandáková 2
Authors‘ workplace:
Gynekologicko-porodnická klinika LF MU a FN Brno
1; Ústav patologie LF MU a FN Brno
2
Published in:
Prakt Gyn 2012; 16(1): 36-41
Category:
Oncogynecology: Case report
Overview
Karcinom prsu představuje značně heterogenní skupinu nádorů s různým maligním potenciálem, etiopatogenezí, prognózou i spektrem léčebných modalit. Tradiční histopatologická klasifikace, která vychází z morfologického vzhledu, dělí karcinomy na duktální, lobulární a ostatní. Současná etapa cílené onkologické léčby vychází ze studia exprese hormonálních receptorů a genového a proteinového expresního profilu nádorů. Na základě těchto profilů se malignity prsu dělí na 4 základní skupiny – karcinomy s luminální diferenciací A, s luminální diferenciací B, nádory HER2-pozitivní a tzv. triple negativní nádory. Přítomnost či absence exprese hormonálních receptorů a HER2 proteinu je rozhodujícím faktorem pro indikaci modalit systémové léčby v rámci komplexní multimodální terapie karcinomu prsu, tedy chemoterapie, hormonální terapie a v neposlední řadě cílené biologické léčby. Absence exprese hormonálních receptorů, a naopak overexprese proteinu HER2 jsou parametry, které výrazným způsobem ovlivňují prognózu onemocnění. Z tohoto pohledu jsou prognosticky závažné především karcinomy ze skupiny s bazální diferenciací, tj. HER2-pozitivní a triple negativní.
Klíčová slova:
karcinom prsu – histopatologická klasifikace – hormonální receptory – cílená molekulární terapie – chemoterapie
Úvod
Karcinom prsu je nejčastější malignitou ženské populace v České republice. Dle údajů Národního onkologického registru (NOR) z roku 2009 byla jeho incidence 115, což v absolutních číslech odpovídá cca 5 700–5 800 nově diagnostikovaných malignit. Trend růstu je v posledním dvacetiletí setrvale rostoucí, což je typický jev pro vyspělé země severní a západní Evropy a severní Ameriky. I přes stále rostoucí incidenci nádorů prsu úmrtnost na tento typ malignity dlouhodobě stagnuje, což ukazuje na vyšší efektivitu léčby, především v souvislosti se záchytem nemoci v nejčasnějších klinických stadiích v rámci screeningového programu. Přesto však malignity prsu zůstávají nejčastější příčinou úmrtí na nádorové onemocnění naší ženské populace, ročně na ně umírá cca 1 950 žen, tedy 36–37 ze 100 tisíc žen, dle údajů NOR z roku 2009 je mortalita 35 případů na 100 tisíc žen [1]. Karcinom prsu představuje značně heterogenní skupinu nádorů s různým maligním potenciálem, etiopatogenezí, prognózou i spektrem léčebných modalit. Prognózu onemocnění ovlivňuje celá řada parametrů, přičemž k těm historicky základním je řazen mj. histologický typ nádoru a jeho diferenciace. Mezi další základní prognostické parametry patří velikost nádoru, vzdálenost nádoru od resekčních okrajů, stav regionálních lymfatických uzlin a přítomnost vzdálených metastáz, za negativní prognostický faktor se považuje např. přítomnost peritumorózní lymfovaskulární invaze, perineurální propagace nebo výskyt malignity u ženy mladší 35 let [2]. K základním parametrům se postupně přidaly další charakteristiky komplexního histopatologického vyšetření, tj. informace o expresi hormonálních receptorů (ER – estrogenové receptory, PR – progesteronové receptory), proliferačních antigenů (Ki-67) a některých dalších proteinů (např. HER2/neu) [3]. V moderní histopatologické diagnostice se pak stále více využívají nové poznatky z oblasti genomiky a proteomiky, zkoumá se možnost využití dalších prognostických markerů, např. EGFR (epidermal growth factor receptor), TGFα (transforming growth factor α), p53, Bcl-2, katepsin D aj [4]. Poznání nových prognostických markerů s sebou zároveň přináší i nové možnosti terapie, zejména v oblasti biologické léčby.
Histopatologická klasifikace karcinomu prsu a její vývoj
Tradiční histopatologická klasifikace, která vychází z morfologického vzhledu, dělí karcinomy na duktální, lobulární a ostatní, což je celá řada minoritních a vzácných histologických typů (např. tubulární, kribriformní, hlenotvorný, medulární, papilární, mikropapilární, apokrinní, obr. 1–5, s. 38, atd) [5]. Základní morfologická odlišnost dvou dominantních histotypů je založena na tom, že duktální karcinom je spojen s masivní fibroprodukcí, solidním růstem a tuhou konzistencí nádoru, zatímco lobulární karcinom se vyznačuje infiltrativním růstem. Příčinou je ztráta exprese E-kadherinu, který je přítomen v membráně epiteliálních buněk a odpovídá za udržení mezibuněčných kontaktů. Výsledkem je volný růst nádorových buněk do okolní tkáně prsní žlázy a může docházet k metastazování i do některých neobvyklých lokalizací, např. mozkových blan nebo gastrointestinálního traktu. Tato klasifikace je však v souvislosti s objevy nových prognostických a prediktivních faktorů ne zcela dostačující, např. existují minimální rozdíly v biologickém chování duktálních a lobulárních karcinomů a nejsou tedy nijak zásadní rozdíly v prognóze a způsobu léčby i přes zcela odlišný morfologický vzhled [6,7].
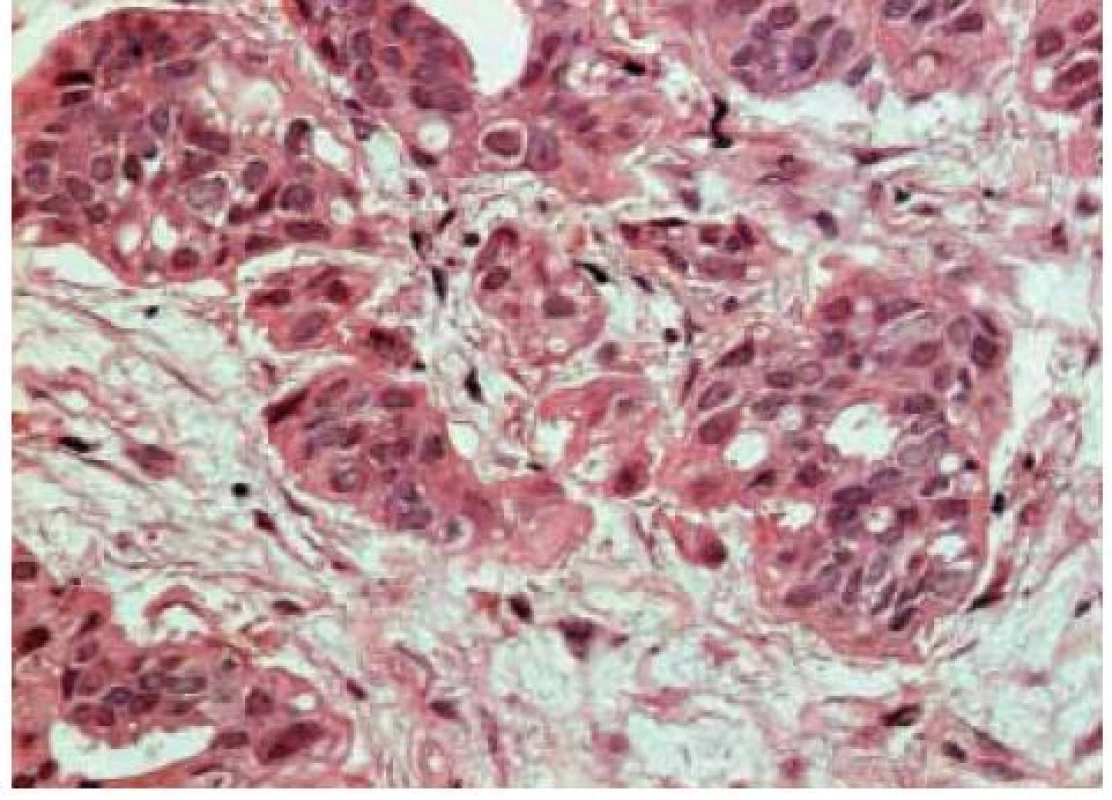
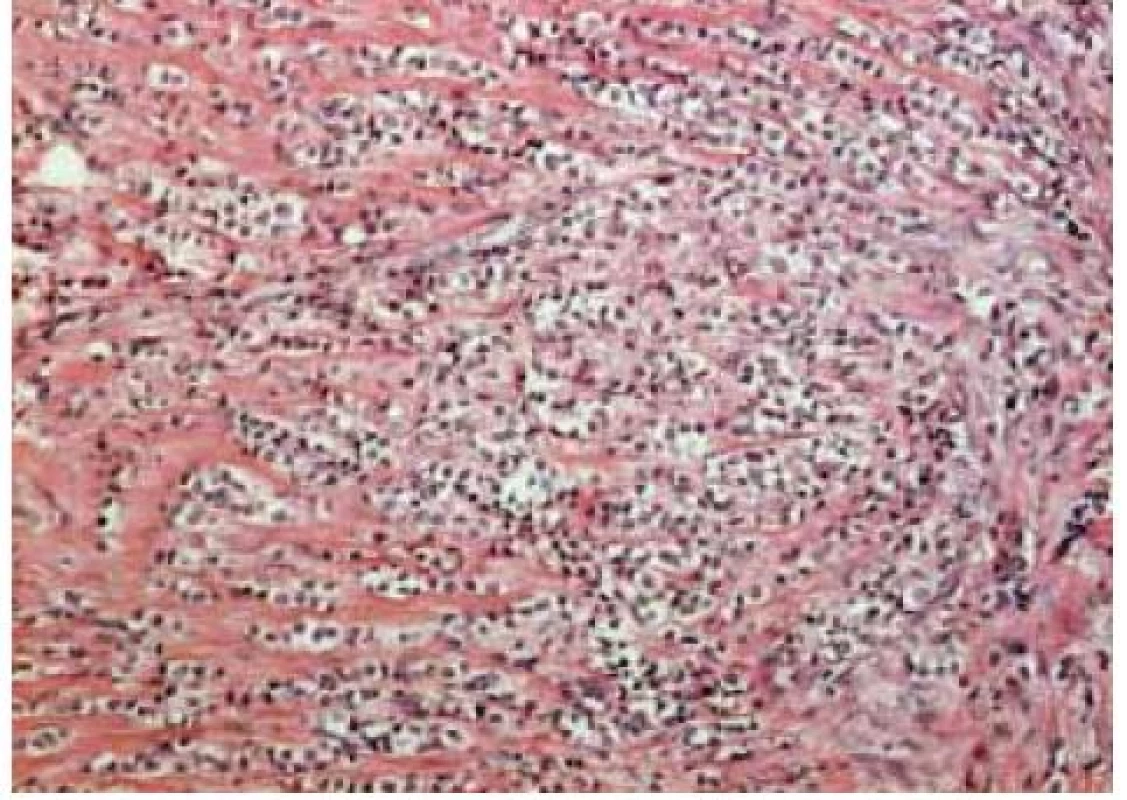
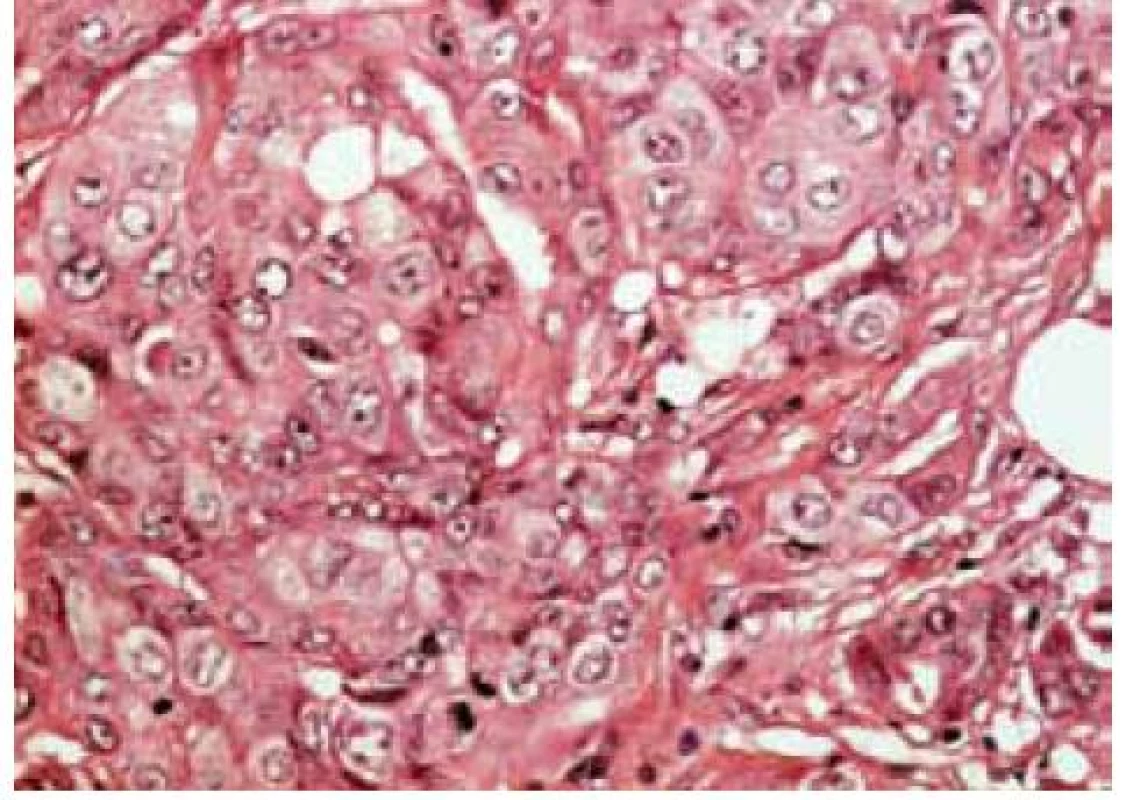
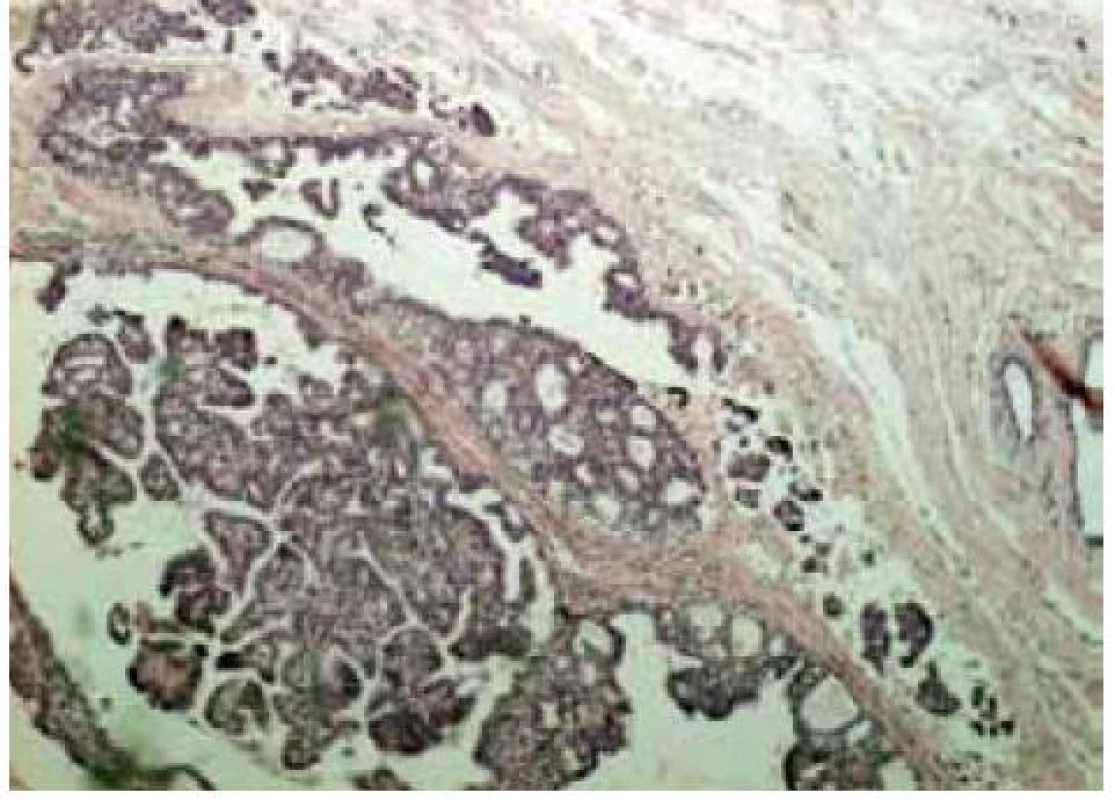
Zásadní naopak zůstává rozlišení lobulárních a duktálních prekanceróz. Duktální karcinom in situ je charakterizován tendencí k progresi do invazivního duktálního karcinomu. Existuje závislost na stupni diferenciace a současně nutnost kompletního odstranění léze s dostatečně širokým lemem nepostižené tkáně. Naopak lobulární karcinom in situ (resp. lobulární intraepiteliální neoplazie) je označován jako tzv. indikátorová léze, tj. ukazatel zvýšeného rizika vzniku invazivního karcinomu kdekoliv v prsu.
Současná etapa cílené onkologické léčby vychází ze studia exprese hormonálních receptorů a genového a proteinového expresního profilu nádorů. Na základě těchto profilů se malignity prsu dělí do dvou skupin, a to na karcinomy s luminální a bazální diferenciací, které se liší v závislosti na regulaci steroidními hormony [8]. V rámci obou základních skupin byly dále identifikovány menší podskupiny, které pravděpodobně vznikají odlišnými genetickými změnami, což může mít zásadní význam pro volbu adekvátní cílené terapie.
V současnosti jsou rozeznávány 4 základní skupiny:
- karcinomy s luminální diferenciací A
- karcinomy s luminální diferenciací B
- nádory HER2-pozitivní
- tzv. triple negativní nádory
Skupinu karcinomů s luminální diferenciací A (ER/PR+, HER2-) představuje většina lobulárních invazivních karcinomů a velká část dobře diferencovaných duktálních karcinomů. Vyznačují se expresí hormonálních receptorů (ER/PR+), neexprimují HER2-protein, mají nízkou proliferační aktivitu, dobrou diferenciaci (grade 1, 2), méně častou mutaci p53, vyskytují se u pacientek vyššího věku a mají příznivější klinický průběh s méně častými recidivami.
Karcinomy s luminální diferenciací B (ER/PR+, HER2+) jsou druhou nejpočetnější skupinou, exprimují nejen hormonální receptory (ER/PR+), ale také HER2, případně vykazují mutaci p53, mají vysokou proliferační aktivitu, nízkou diferenciaci (grade 3), častěji recidivují.
Nádory HER2-pozitivní (ER/PR-, HER2+) neexprimují hormonální receptory, ale jsou charakteristické overexpresí HER2-proteinu.
Poslední skupinu karcinomů prsu tvoří tzv. triple negativní nádory (TN), jejichž společným definujícím znakem je absence exprese hormonálních receptorů (ER/PR) a HER2-proteinu (ER/PR-, HER2-).
Přítomnost či absence exprese hormonálních receptorů a HER2-proteinu je rozhodujícím faktorem pro indikaci modalit systémové léčby v rámci komplexní multimodální terapie karcinomu prsu, tedy chemoterapie, hormonální terapie a v neposlední řadě cílené biologické léčby. Absence exprese hormonálních receptorů a naopak overexprese proteinu HER2 jsou parametry, které výrazným způsobem ovlivňují prognózu onemocnění. Z tohoto pohledu jsou prognosticky závažné především karcinomy ze skupiny s bazální diferenciací, tj. HER2-pozitivní a triple negativní [9].
HER2-pozitivní karcinomy prsu
Pro HER2-pozitivní karcinomy prsu je charakteristická nízká diferenciace, vysoký proliferační index, výskyt v mladším věku a nepříznivá prognóza s výskytem viscerálních i mozkových metastáz. Vyšetření proteinu HER2/neu bylo velice významným pokrokem v cílené protinádorové léčbě po již zavedeném rutinním vyšetřování exprese hormonálních receptorů. HER2 je transmembránový receptor, jeho intracelulární komponenta vykazuje tyrozinkinázovou aktivitu a ovlivňuje zejména buněčný růst. U nádorů s overexpresí HER2 je v jedné nádorové buňce přítomen až ve 100násobném množství ve srovnání s fyziologickou epiteliální buňkou prsní žlázy. Overexprese je z hlediska genetického podmíněna v naprosté většině amplifikací genu na 17. chromozomu, podstatně méně často se jedná o tzv. pseudoamplifikaci genu, což je polysomie chromozomu 17. Zmnožení receptoru na membráně nádorových buněk je spojeno se zvýšenou proliferační aktivitou tumoru, jeho agresivním chováním, statisticky významně klesá přežití pacientek (DFI – disease free interval i OS – overall survival) bez ohledu na postižení regionální lymfatické oblasti. Overexprese HER2 v nádorových buňkách se prokazuje dvěma metodami: pomocí nepřímé imunohistochemie (IHC) na úrovni nadměrné exprese proteinu nebo různými metodami in situ hybridizace na úrovni zmnožení kopií genu (fluorescenční in situ hybridizace – FISH, chromogenní in situ hybridizace – CISH, in situ hybridizace s impregnací stříbrem – SISH). IHC je levná, jednoduchá, časově nenáročná metoda, která je však spojena s poměrně významným rizikem falešných výsledků v podobě negativity i pozitivity. Metodika in situ hybridizace je složitější, časově náročnější, vyžaduje nákladnější vybavení, je výrazně dražší, ale vykazuje prakticky nulové riziko falešných výsledků [10]. Zastoupení karcinomů s pozitivitou HER2 se v jednotlivých populacích značně liší, do značné míry závisí na spektru jednotlivých morfologických subtypů nádorů, rozdíly mohou být podmíněny rovněž geneticky. Dle literárních údajů se vysoká prevalence HER2 pozitivních nádorů týká např. arabského světa, kde je zastoupení až 31 % [11], nebo Korejského poloostrova (přes 40 %) [12,13]. Dle několika publikovaných amerických studií se celkové zastoupení HER2 pozitivních nádorů mezi bělošskou a afroamerickou populací významně neliší, je však evidentní rozdíl v zastoupení jednotlivých subtypů karcinomů prsu v rámci etnických skupin. Pro černou rasu je typické signifikantně vyšší zastoupení triple negativních karcinomů, které jsou prognosticky podstatně nepříznivější. Naopak je u ní podstatně nižší podíl luminálních karcinomů ze skupiny A, které jsou hormonálně dependentní, HER2 negativní, s nižším grade a jejich vznik je dáván do souvislosti s širokým využíváním hormonální substituční terapie (hormone replacement therapy – HRT). V souborech, kde je většina nádorů zachycena v rámci screeningové mamografie, je zastoupení HER2-pozitivních karcinomů poměrně nízké. Prokazují to rovněž některé dlouhodobé populační americké studie. Např. v jedné z nich bylo v souboru více než 120 tisíc zdravotních sester zjištěno téměř 3 tisíce karcinomů prsu. Retrospektivní analýzou histologických preparátů byla prokázána overexprese HER2 jen u necelých 11 % invazivních karcinomů, zastoupení luminálních karcinomů skupiny A bylo téměř 75% [14]. Rovněž v rámci střední Evropy je podíl HER2-pozitivních nádorů ve studovaných souborech podstatně nižší, jak dokládají literární údaje v publikovaných studiích (např. Švýcarsko 17% [11], Polsko necelých 14% [15], Rakousko 20% [16]). V rámci pracovišť České republiky byla dosud publikována jediná systematická studie obsahující více než 500 karcinomů prsu, v níž byl podíl HER2-pozitivních nádorů 14% [17]. Nízký podíl nádorů s overexpresí HER2 je vysvětlován zavedením screeningového programu, pro nějž je charakteristický nárůst záchytu časných stadií karcinomů, zejména luminálních subtypů A, což může dle literárních údajů rezultovat v relativně nižší podíl HER2-pozitivních případů v rámci studovaných souborů [15]. Zásadní součást komplexní protinádorové léčby u HER2-pozitivních nádorů představuje biologická léčba, která využívá humanizovanou monoklonální protilátku proti transmembránovému receptoru HER2 – trastuzumab nebo nověji blokátor tyrozinkinázové aktivity receptoru – lapatinib.
Triple negativní karcinomy prsu
Triple negativní nádory, jejichž společným definujícím znakem je absence exprese hormonálních receptorů (ER/PR) a HER2-proteinu, jsou novou skupinou karcinomů prsu, která se vyčlenila po zavedení imunoterapie do jejich léčby. Triple negativní nádory se dle literárních zdrojů dále dělí na 2 podskupiny:
- tzv. bazaloidní (basal-like) karcinomy
- karcinomy tzv. neklasifikované nebo „podobné normální žláze“ (normal breast-like)
Bazaloidní karcinomy exprimují markery diferenciace směrem k myoepiteliálním buňkám (bazální cytokeratiny – CK 5,6,14,17, p53) [18], tzv. neklasifikované karcinomy žádný z těchto markerů nemají. Nádory mají často atypickou medulární morfologii, kromě exprese cytokeratinů (CK 5,6,14,17) a proteinu p53 s častými mutacemi se vyznačují ve více než 50 % případů dysregulací a overexpresí receptoru epidermálního růstového faktoru (EGFR) [19]. Jsou to nádory značně agresivní se špatnou prognózou, s vysokým rizikem vzdálených metastáz (zejména do plic a mozku) [20], signifikantně častěji jsou spojeny s přítomností metastatického postižení uzlin [21,22], rovněž se vyznačují častým výskytem lokálních recidiv [23–25]. Kvůli své vysoké proliferační aktivitě, a tedy rychlému růstu tvoří poměrně velkou část intervalových karcinomů, tedy karcinomů, které se objeví mezi dvěma pravidelnými kontrolami v rámci screeningové mamografie [26]. Vyskytují se hlavně u mladších pacientek, často s přítomností mutace BRCA1. Jejich zastoupení v populaci představuje dle různých studií 12–26 % [27–30], v černošské populaci se udává vyšší zastoupení (cca 32 %) [29], v souboru duktálních karcinomů představují TN cca 5–7 %. Klasická antihormonální léčba je u nich neúčinná, stejně jako biologická léčba. Základní, ale zároveň jedinou systémovou léčebnou modalitou rutinně využívanou v praxi v adjuvantní léčbě i u metastatických forem onemocnění je chemoterapie, na kterou tyto karcinomy reagují lépe než karcinomy luminální [31]. Nejčastěji užívaná cytostatika v léčbě karcinomu prsu představují antracykliny a taxany, což se týká rovněž i triple negativních tumorů. Antracykliny se užívají v neoadjuvantní i adjuvantní léčbě, v neoadjuvanci nejčastěji v kombinaci s cyklofosfamidem. Dobrým efektem se vyznačuje rovněž neoadjuvantní podání taxanů v podobě paklitaxelu ve weekly-režimu a následně v adjuvanci kombinace FEC (fluorouracil, epirubicin, cyklofosfamid) nebo CMF (cyklofosfamid, metotrexát, fluorouracil) [21]. Dobrý efekt v léčbě TN-karcinomů prsu vykazuje rovněž platinový derivát v podobě cis - nebo karboplatiny [27]. Některé publikované klinické studie prokázaly vysokou léčebnou odezvu na chemoterapeutické režimy, kompletní patologické remise jsou popisovány v 18–40 % případů, u pacientek s mutací BRCA1 dokonce ve více než 70 % [32]. Zjišťuje se rovněž přínos i dalších cytostatik, např. ixabepilonu v kombinaci s kapecitabinem v adjuvantní terapii i u metastatických forem. Realizují se rovněž klinické studie, které kombinují chemoterapii s antiangiogenní léčbou bevacizumabem u pacientek s metastatickým karcinomem prsu, tyto prokázaly zlepšení léčebných výsledků i u pacientek s TN-karcinomem prsu [27]. Současně pokračuje i snaha o vysoce cílenou terapii TNkarcinomů prsu. Vzhledem k časté přítomnosti overexprese EGFR lze do budoucna uvažovat o využití anti-EGFR terapie (cetuximab, panitumumab) [19]. Mezi další markery exprimované u této vysoce agresivní skupiny malignit prsu patří např. cytokeratiny, vimentin nebo cévní růstový faktor (vascular endothelial growth factor – VEGF) [33]. Některé práce prokázaly vyšší hladinu VEGF v séru u pacientek s TNkarcinomem prsu ve srovnání s pacientkami s jinými typy nádorů [33,34]. V rámci výzkumu byl detekován enzym poly-ADP-ribóza-polymeráza (PARP), který hraje důležitou roli v buněčné proliferaci a opravě DNA, zejména u nádorových buněk. Inhibitory PARP (iniparib, olaparib) mohou alterovat opravu DNA především u nádorových buněk s mutací genů BRCA1 nebo BRCA2. V literatuře byly prezentovány výsledky klinické studie u pacientek s metastatickým TN-karcinomem prsu, které prokázaly zlepšení léčebných výsledků při použití kombinace cytostatické léčby (gemcitabin s platinovým derivátem) a inhibitorem PARP [28,35].
Závěr
Počet nově diagnostikovaných karcinomů prsu má trvale vzestupnou tendenci a problematika tohoto onemocnění má ve společenském kontextu komplexní a velice závažný dopad, a to nejen lidský na samotné pacientky, ale i zdravotnický a ekonomický. I když je mortalita onemocnění vysoká, nesleduje strmý nárůst incidence vyspělých ekonomik Evropy a Severní Ameriky. Dominantně se na tom podílí včasný záchyt onemocnění v rámci screeningového programu a včasná léčba, v menší míře zlepšená terapie. Úspěšná léčba karcinomu prsu je jednoznačně záležitostí interdisciplinární v celém svém rozsahu, a to od stanovení diagnózy až po dispenzární péči. Základním krokem stanovení správné diagnózy je morfologická klasifikace nádorového onemocnění, na druhou stranu je zřejmá jednoznačná potřeba individualizace terapie s ohledem na konkrétní nádor u konkrétní pacientky, a to samozřejmě vede k narůstajícím požadavkům na kvalitu a množství histopatologických a molekulárně biologických vyšetření. Samotná terapie by měla probíhat podle standardizovaného diagnosticko-terapeutického protokolu, aby se výsledky léčby daly hodnotit a byla možná kontrola, ev. revize léčebných postupů. Dále je nutno rozvíjet nové postupy, které by měly probíhat vzhledem ke své ekonomické náročnosti v rámci kontrolovaných studií, což by umožnilo posoudit jejich přínos a eventuální možnosti zavedení do rutinní diagnosticko-terapeutické praxe.
Doručeno do redakce: 3. 1. 2012
Přijato po recenzi: 1. 4. 2012
MUDr. Luboš Minář
e-mail: lminar@fnbrno.cz
Gynekologicko-porodnická klinika LF MU a FN Brno
www.fnbrno.cz
Sources
1. Národní onkologický registr České republiky, Ústav zdravotnických informací a statistiky ČR, data z let 1977–2009.
2. Povýšil C. Histologie mléčné žlázy a její patologické změny. In: Abrahámová J, Povýšil C (eds) et al. Atlas nádorů prsu. Praha: Grada Publishing 2000.
3. Harari D, Yarden Y. Molecular mechanism underlying ErbB2/HER2 action in breast cancer. Oncogene 2000; 19(53): 6102–6114.
4. Mendelsohn J, Baselga J. Status of Epidermal Growth Factor Receptor Antagonists in the Biology and Treatment of cancer. J Clin Oncol 2003; 21(14): 2787–2799.
5. Tavassoli FA, Devilee P. World Health Organisation Classification of tumours. Pathology and Genetics of Tumours of the Breast and Female Genital Organs. Lyon: IARC Press 2003.
6. Turashvili G, Bouchal J, Hermann J et al. Novel immunohistochemical markers for the differentiation of lobular and ductal invasive breast carcinomas. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2007; 151(1): 59–64.
7. Turashvili G, Bouchal J, Burkadze G et al. Differentiation of tumours of ductal and lobular origin: I. Proteomics of invasive ductal and lobular breast carcinomas. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2005; 149(1): 57–62.
8. Jacquemier J, Ginestier C, Rougemont J et al. Protein expression profiling identifies subclasses of breast cancer and predicts prognosis. Cancer Res 2005; 65(3): 767–779.
9. Ryška A, Laco J, Hornychová H et al. Nové trendy v diagnostice a klasifikaci karcinomu prsu. Česk Patol 2009; 45(2): 29–34.
10. Ménard S et al. Biologic and therapeutic role of HER2 in cancer. Oncogene 2003; 22(42): 6570–6578.
11. Al-Kuraya K, Schraml P, Sheikh S et al. Predominance of high-grade pathway in breast cancer development of Middle East women. Mod Pathol 2005; 18(7): 891–897.
12. Cho EY, Choi YL, Han JJ et al. Expression and amplification of Her2, EGFR and cyclin D1 in breast cancer: immunohistochemistry and chromogenic in situ hybridization. Pathol Int 2008; 58(1): 17–25.
13. Choi DH, Shin DB, Lee MH et al. A comparison of five immunohistochemical biomarkers and HER-2/neu gene amplification by fluorescence in situ hybridization in white and Korean patients with early-onset breast carcinoma. Cancer 2003; 98(8):1587–1595.
14. Tamimi RM, Baer HJ, Marotti J et al. Comparison of molecular phenotypes of ductal carcinoma in situ and invasive breast cancer. Breast Cancer Res 2008; 10(4): R67.
15. Yang XR, Herman ME, Rimm DL et al. Differences in risk factors for breast cancer molecular subtypes in a population-based study. Cancer Epidemiol Biomarkers Prev 2007; 16(3): 439–443.
16. Schippinger W, Dandachi N, Regitnig P et al. The predictive value of EGFR and HER-2/neu in tumor tissue and serum for response to anthracycline-based neoadjuvant chemotherapy of breast cancer. Am J Clin Pathol 2007; 128(4):630–637.
17. Fabián P et al. Incidence Her-2 amplifikace u mammárního karcinomu a její korelace s klinicko-patologickými parametry. Sestava 500 konsekutivních mammárních karcinomů MOÚ. Abstrakt 098. 30. brněnské onkologické dny a 20. konference pro sestry a laboranty. Brno 2006 : 153.
18. Kusinska R, Potemski P, Jesionek-Kupnicka D et al. Immunohistochemical identification of basal-type cytokeratins in invasive ductal breast carcinoma-relation with grade, stage, estrogen receptor and HER2. Pol J Pathol 2005; 56(3): 107–110.
19. Lakhani SR, Reis-Filho JS, Fulford L et al. Prediction of BRCA1 status in patients with breast cancer using estrogen receptor and basal phenotype. Clin Cancer Res 2005; 11(14): 5175–5180.
20. Haffty BG, Yang Q, Weiss M et al. Locoregional Relapse and Distant Metastasis in conservatively manager Triple Negative Early-Stage Breast Cancer. J Clin Oncol 2006; 24(36): 5652 - 5657.
21. Sotiriou C, Neo SY, McShane LM et al. Breast cancer classification and prognosis based on gene expression profiles from a population-based study. Proc Natl Acad Sci U S A 2003; 100(18): 10393–10398.
22. van de Vijver MJ, He YD, van’t Veer LJ et al. A gene-expression signature as a predictor of survival in breast cancer. N Engl J Med 2002; 347(25): 1999–2009.
23. Liu H, Fan Q, Zhang Z et al. Basal-HER2 phenotype shows poorer survival than basal-like phenotype in hormone receptor-negative invasive breast cancers. Hum Pathol 2008; 39(2): 167–174.
24. Rakha EA, Putti TC, Abd El-Rehim DM et al. Morphological and immunophenotypic analysis of breast carcinomas with basal and myoepithelial differentiation. J Pathol 2006; 208(4): 495–506.
25. Fulford LG, Reis-Filho JS, Ryder K et al. Basal-like grade III invasive ductal carcinoma of the breast: patterns of metastasis and long-term survival. Breast Cancer Res 2007; 9(1):R4.
26. Collett K, Stefansson IM, Eide J et al. A basal epithelial phenotype is more frequent in interval breast cancers compared with screen detected tumors. Cancer Epidemiol Biomarkers Prev 2005; 14(5): 110–112.
27. Stark A, Kapke A, Schultz D et al. Advanced stages and poorly differentiated grade are associated with an increased risk of HER2/neu positive breast carcinoma only in White women: findings from a prospective cohort study of African-American and White-American women. Breast Cancer Res Treat 2008; 107(3): 405–414.
28. Huang HJ, Neven P, Drijkoningen M et al. Association between tumour characteristics and HER-2/neu by immunohistochemistry in 1362 women with primary operable breast cancer. J Clin Pathol 2005; 58(6): 611–616.
29. Carey LA, Perou CM, Livasy CA et al. Race, breast cancer subtypes, and survival in the Carolina Breast Cancer Study. JAMA 2006; 295(21): 2492–2502.
30. Kaplan HG, Malmgren JA. Impact of Triple Negative Phenotype on Breast Cancer Prognosis. Breast J 2008; 14(5):456–463.
31. Carey LA, Dees EC, Sawyer L et al. The triple negative paradox: primary tumor chemosensitivity of breast cancer subtypes. Clin Cancer Res 2007; 13(8): 2329–2334.
32. Abdel-Fatah TM, Powe DG, Hodi Z et al. High frequency of coexistence of columnar cell lesions, lobular neoplasia, and low grade ductal carcinoma in situ with invasive tubular carcinoma and invasive lobular carcinoma. Am J Surg Pathol 2007; 31(3): 417–426.
33. Ellis IO, Bartlett J, Dowsett M et al. Best Practice No 176: Updated recommendations for HER2 testing in the UK. J Clin Pathol 2004; 57(3): 233–237.
34. Breton JD, Carey LA, Ahmed AA et al. Molecular classification and molecular forecasting of breast cancer: ready for clinical application? J Clin Oncol 2005; 23(29): 7350–7360.
35. Yaziji H, Goldstein LC, Barry TS et al. HER-2 testing in breast cancer using parallel tissue-based methods. JAMA 2004; 291(16): 1972–1977.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Practical Gynecology

2012 Issue 1
-
All articles in this issue
- Podání transfer-faktoru (IMUNOR) u žen s chronickým vulvovaginálním diskomfortem: výsledky klinické studie
- Význam hyaluronátu v gynekologii a porodnictví
- Využití fytoestrogenů v gynekologii
- Anafylaxe v těhotenství
- Mechanizmus implantace embrya
- Menstruační migréna (migréna bez aury): diagnostika a možnosti hormonální léčby
- Novinky v postkoitální kontracepci
- Histopatologická klasifikace karcinomu prsu a její vztah k využitelným modalitám systémové léčby
- Nádorové kmenové buňky u karcinomu ovaria
- Paravaginální hematom: kazuistika
- Practical Gynecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Mechanizmus implantace embrya
- Paravaginální hematom: kazuistika
- Podání transfer-faktoru (IMUNOR) u žen s chronickým vulvovaginálním diskomfortem: výsledky klinické studie
- Menstruační migréna (migréna bez aury): diagnostika a možnosti hormonální léčby
