MUŽSKÝ FAKTOR INFERTILITY: VYŠETŘENÍ A LÉČBA
MALE FACTOR INFERTILITY: EVALUATION AND MANAGEMENT
There is a male factor involved in up to half of all infertile couples. Potential etiologies in male factor infertility are many and require thorough evaluation for their accurate identification. A complete medical history in conjunction with a focused examination can allow for an appropriate choice of laboratory and imaging studies. The semen analysis is a crucial first step, but by no means is it sufficient to determine a specific etiology or dictate therapy. A systematic approach is necessary to help guide the work-up and rule out less likely causes. The etiologies discussed within this article are tremendously broad, and the prognosis for any given couple depends, in large part, on the etiology. Without a firm understanding of the genetics, anatomy, physiology, and complex interplay of the male reproductive system, the evaluation becomes an inefficient exercise that often fails to define the precise etiology. Couples with male factor infertility need a systematic approach with the efficiency of ultimate treatment determined largely by the physician's ability to identity the specific cause of the man's reproductive failure.
KEY WORDS:
male infertility, diagnostics, treatment
Authors:
Larry I. Lipshultz; Md
Authors‘ workplace:
Division of Male Reproductive Medicine and Surgery, Scott Department of Urology, Baylor College of Medicine, Houston, TX, USA
Published in:
Urol List 2006; 4(1): 6-14
Overview
U téměř poloviny infertilních párů je příčinou infertility páru muž. Potencionálních příčin vzniku mužské infertility je mnoho a vyžadují pro přesnou identifikaci důkladné vyšetření. Kompletní lékařská anamnéza spolu s cíleným vyšetřením umožní vhodný výběr laboratorních a zobrazovacích vyšetření. Analýza semene je zásadním prvním krokem, ale v žádném případě není dostačující pro určení specifické příčiny nebo terapie. Pro pomoc při řešení a vyloučení méně pravděpodobných příčin je nezbytný systematický přístup. Množství příčin onemocnění diskutované v tomto článku je obrovské a prognóza u každého jednotlivého páru závisí zejména na příčině vzniku. Bez jasného porozumění genetice, anatomii, fyziologii a komplexní souhře mužského reprodukčního systému se stává vyšetření neefektivním a často neumožní určit přesnou etiologii. Páry s mužským faktorem infertility vyžadují systematický přístup s úspěšností konečné léčby podmíněné zejména schopností lékaře rozpoznat specifickou příčinu selhání reprodukční schopnosti muže.
KLÍČOVÁ SLOVA:
mužská infertilita, diagnostika, léčba
ÚVOD
Infertilita postihuje ve Spojených státech amerických více než 6 miliónů párů. U poloviny je infertilita způsobena zčásti mužským faktorem infertility a u téměř 30 % pouze mužským faktorem [1]. Ve většině takových případů nejprve ženy vyhledají svého gynekologa nebo praktického lékaře s obavou, že jsou neplodné. To vede přirozeně k nutnosti analýzy ejakulované tekutiny (semene) jejího partnera. Po rozpoznání abnormálních parametrů semene se může péče o subfertilního muže značně lišit, v závislosti na představách a přáních postiženého páru, dostupných zdrojích v daném, místním předávání pacientů a způsobu léčby zainteresovaných lékařů. Autoři jsou přesvědčení, že nejproduktivnější a ekonomicky nejvýhodnější terapii lze provádět pouze po úplném zhodnocení mužského faktoru infertility. Stejně významné je u těchto pacientů zjištění potenciálně významné, nebo dokonce život ohrožující patologie, která může být přítomna u 1,3 % infertilních mužů [2]. Tento článek přináší přehled vyšetření infertilního muže, zabývá se etiologií testikulárního selhání a přehledem současných možností léčby. Je rozdělen na pretestikulární, testikulární a posttestikulární příčiny mužské infertility.
ANAMNÉZA A FYZIKÁLNÍ VYŠETŘENÍ
Vyšetření subfertilního muže začíná odebráním detailní anamnézy a provedením fyzikálního vyšetření. Reprodukční anamnéza zjišuje, zda pár již dříve počal (sekundární infertilita) nebo jestli je infertilní primárně. Pokud se již jednomu partnerovi během předchozího vztahu podařilo početí, zaměří se předběžné vyšetření na druhého partnera. Důležitá je doba trvání pokusů o početí, nebo delší doba trvání neplodnosti znamená horší prognózu. Další důležitá informace sexuální anamnézy zahrnuje dobu a frekvenci pohlavního styku, anamnézu dřívějších infekcí pohlavních cest a užívání lubrikantů během styku, což může narušit motilitu spermií (K-Y jelly, Lubifax, Surgilube, krémy na ruce, vazelína a sliny) [3].
Poruchy v dětství a současné zdravotní potíže mohou vést k narušení spermatogeneze nebo poskytnout informaci týkající se hormonálního původu infertility. Dřívější operace skrota, pánve nebo retroperitonea může vést k obstrukci extratestikulárního vývodného systému nebo ovlivnit ejakulaci a vést k neadekvátnímu průniku spermií do vaginy. Konzumace alkoholu, tabáku, nepříznivé prostředí pracoviště a některé medikamenty mohou být gonadotoxické a měly by být důkladně prozkoumány.
Fyzikální vyšetření by se mělo soustředit na celkový habitus muže, abychom mohli posoudit, zda je jedinec odpovídajícím způsobem virilizován bez známek gynekomastie. Mělo by být provedeno důkladné vyšetření genitourinárních cest, zjišující patologii penisu nebo šourku. Penis by měl být vyšetřen se zaměřením na možnou přítomnost hypospadie a kožních lézí. Je třeba pečlivě vyšetřit velikost a tvar varlat, včetně přítomnosti případné rezistence. Normální velikost varlat se pohybuje mezi 18 a 20 ml a malá varlata pravděpodobněji ukazují na narušenou spermatogenezi [4]. Je třeba prověřit přítomnost chámovodu a nadvarlete a povšimnout si přítomnosti indurace nebo jeho cyst. Nakonec lze pečlivou palpací chámovodu zjistit nejčastější léčitelnou příčinu mužské infertility - varikokélu [5], a to bez i při provedení Valsalvova manévru.
LABORATORNÍ VYŠETŘENÍ
Laboratorní vyšetření infertilního muže začíná analýzou semene. Rozbor spermatu však není testem mužské plodnosti. Zaprvé je fertilita fenoménem týkajícím se obou partnerů. Rutinní analýza spermatu vypovídá pouze velmi málo o skutečné funkci spermií. Vzorek by měl být odebrán při masturbaci po 2 až 3 denní pohlavní abstinenci. Dlouhá abstinence vede ke snížení motility a kratší abstinence vede k menšímu objemu a koncentraci spermií. Při doporučované frekvenci pohlavního styku obden a 2denní abstinenci jsou parametry spermatu obdobné jako při přirozeném početí (tab. 1).
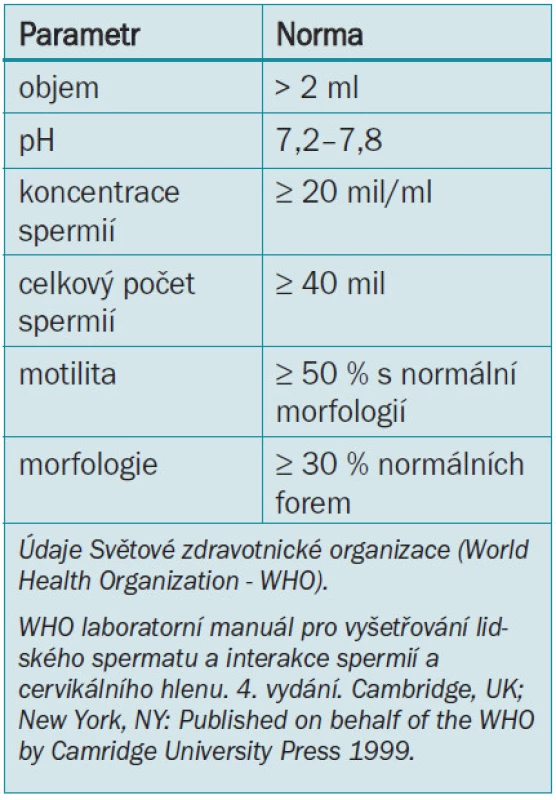
U téměř 20 % infertilních mužů byly zjištěny endokrinní poruchy [6]. Hodnota testosteronu a folikuly stimulujícího hormonu (follicle-stimulating hormone - FSH) v séru identifikuje 99 % všech endokrinních abnormalit u mužů s měkkými varlaty a méně než 1 milionem spermií v mililitru. Další potencionálně užitečné hormonální parametry zahrnují hodnotu luteinizačního hormonu (LH), prolaktinu, estradiolu, jež by měly být analyzovány náhodně během anamnézy, fyzikálního vyšetření a počátečního hodnocení hormonů.
AZOOSPERMIE
Azoospermie je úplná absence spermií v ejakulátu a je přítomna u 8 % infertilních mužů. Azoospermie může být způsobena obstrukcí extratestikulárního vývodného systému (obstrukční azoospermie) nebo defekty ve spermatogenezi (neobstrukční azoospermie). Muži s obstrukční azoospermií mají obvykle varlata normální velikosti, plné epididymidy a normální hodnotu FSH v séru. Muži s neobstrukční azoospermií mají často malá nebo měkká varlata a zvýšenou hodnotu FSH. Důležitou částí vyšetření muže s azoospermií je centrifugace vzorku s mikroskopickým vyšetřením pelety. 21 % mužů s počáteční diagnózou neobstrukční azoospermie má v centrifugovaném vzorku svého spermatu přítomny motilní spermie, tito muži nemají skutečnou azoospermii [7].
Pacienti s neobstrukční azoospermií by měli před přikročením k použití reprodukčních technik podstoupit genetické testy (viz dále). 40 až 60 % těchto mužů má spermie přítomny ve varlatech a tyto spermie mohou být užity pro oplodnění in vitro (in vitro fertilization - IVF) při použití intracytoplazmatické injekce spermie do vajíčka (intracytoplasmic sperm injection - ICSI). Biopsie varlat by se u těchto mužů neměla provádět pouze jako diagnostický výkon, ale měla by také sloužit jako součást terapeutické procedury k získání spermií (testikulární extrakce spermií). Biopsie varlat z čistě diagnostických důvodů se doporučuje pouze v případě podezření na obstrukci nebo částečnou obstrukci. V těchto případech normální spermatogeneze potvrzuje obstrukci.
PRETESTIKULÁRNÍ PŘÍČINY MUŽSKÉ INFERTILITY
Endokrinopatie
Hypotalamo-hypofyzární-gonadální (HHG) osa se je složitý integrovaný systém nezbytný pro normální reprodukci. Hypotalamus je centrem reprodukční hormonální osy, nebo přijímá podněty z mnoha oblastí mozku a dále zpětné vazby ve formě steroidních a proteinových hormonů z gonád a nadledvin. Hypotalamus uvolňuje gonadotropin-uvolňující hormon (gonadotropin-releasing hormon - GnRH) z preoptického a obloukovitého jádra jako konečný výsledek své integrační funkce. GnRH je pak vylučován pulzačním režimem do portálního žilního řečiště hypofýzy, které zásobuje přední část podvěsku mozkového. GnRH stimuluje uvolňování LH a FSH z předního laloku hypofýzy. Uvolnění LH je ovlivněno zpětnou vazbou androgenů na úrovni hypofýzy i hypotalamu. Uvolnění FSH je zřejmě regulováno negativní zpětnou vazbou inhibinu i aktivinu ze Sertoliho buněk varlat. Ve varlatech LH stimuluje tvorbu testosteronu Leydigovými buňkami, zatímco FSH je nezbytný pro iniciaci a udržení spermatogeneze. Oba LH i FSH jsou nezbytné pro kvantitativně normální spermatogenezi. Zpětná vazba této osy je nezbytná pro normální funkci a objevuje na četných úrovních, umožňující přesnou regulaci hormonální aktivity. Abnormality kdekoliv v HHG-ose mohou mít potencionálně negativní vliv na fertilitu muže. Obecně řečeno endokrinní defekty vedoucí k mužské infertilitě mohou být iniciálně zhodnoceny analýzou testosteronu, LH, FSH, prolaktinu a estradiolu.
Genetické endokrinopatie
Genetické abnormality mohou způsobit hormonální dysfunkci, dysfunkci růstového faktoru a dysfunkci receptoru postihující HHG-osu [8]. Následující poruchy se vyskytují vzácně, ale mohou těžce poškodit mužskou fertilitu. Tyto poruchy jsou většinou způsobeny mutacemi, malými delecemi nebo polymorfní expanzí v některých genech zahrnutých do endokrinní nebo humorální regulace sexuálního vývoje a funkce.
Poruchy tvorby nebo sekrece GnRH
Poruchy vedoucí k abnormální syntéze a uvolňování GnRH a následně nízkým hodnotám FSH a LH bez anatomické příčiny se nazývají „idiopatický hypogonadotropní hypogonadizmus“ [8]. Bez adekvátních hodnot gonadotropinů tvorba androgenů a spermatogeneze selhává.
Kallmanův syndrom
Kallmanův syndrom je nejčastější porucha mužské infertility vázaná na chromozom X a objevuje se přibližně u 1 z 10 000 až 1 z 60 000 narozených jedinců [9]. Mutace na genu Kal (Xp22,3) vede k nedostatečnému vylučování GnRH hypotalamem [10]. Mnozí pacienti s Kallmanovým syndromem jsou vysocí, trpí anosmií a sekundárně ukazují na selhání nástupu puberty. Vzhledem k nedostatečné FSH - a LH-stimulaci varlat nedochází ke spermatogenezi ani tvorbě testosteronu a tito muži mají tuhá varlata předpubertální velikosti a malý penis. Pacienti mohou být současně postižení kongenitální hluchotou, mít asymetrickou lebku a obličej, rozštěp patra, cerebrální dysfunkci, kryptorchizmus nebo renální abnormality. Plodnosti lze u mnoha pacientů s Kallmanovým syndromem dosáhnout kombinací hormonálních substitučních terapií (lidský chorionický gonadotropin a FSH) [3]. Ostatní defekty sekrece GnRH nebo receptoru GnRH vedou k idiopatickému hypogonadotropnímu hypogonadizmu, jejž lze léčit substitucí FSH a lidského chorionického gonadotropinu (tab. 2).
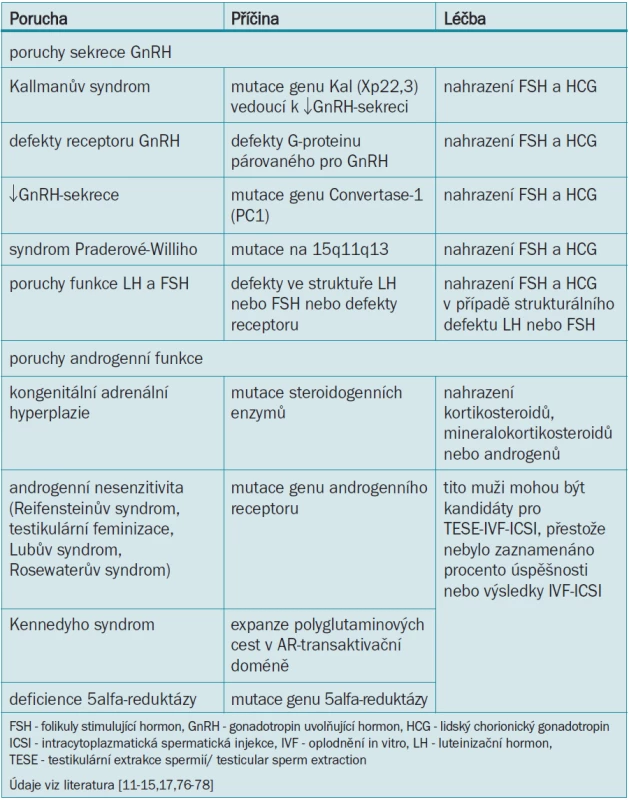
Poruchy luteinizačního hormonu, folikuly-stimulujícího hormonu a androgenní funkce
Luteinizační hormon a FSH jsou uvolňovány hypofýzou pod vlivem pulzační stimulace GnRH. Mutace způsobující biologicky neaktivní LH nebo FSH jsou zapříčiněny abnormalitami ve struktuře FSH nebo LH nebo aktivitě LH - nebo FSH-receptoru. Tyto abnormality vedou k celému spektru onemocnění od úplného selhání virilizace po méně závažný hypogonadizmus [11-13]. LH řídí tvorbu androgenu. Syntéza a metabolizmus androgenů je komplexní, postupný proces a mutace enzymů zahrnutých do této biosyntézy ovlivňují mužskou reprodukční funkci. Pro syntézu testosteronu z cholesterolu je zapotřebí 5 enzymů. Mutace těchto enzymů vedou k současné adrenální hyperplazii způsobující fenotypy od neúplné virilizace po úplně feminizovaný genitál s kryptorchickými varlaty [14].
Testosteron je metabolizován na dihydrotestosteron 5alfa-reduktázou ve vnějších genitáliích a v prostatě. Mutace genu 5alfa-reduktázy způsobuje neúplný vývoj zevního genitálu [14] a následně infertilitu, vzhledem k neschopnosti efektivně vylučovat sperma. Testosteron a dihydrotestosteron volně pronikají do všech buněk, přestože do jádra, kde ovlivňují buněčnou aktivitu, se mohou dostat pouze pomocí androgenních receptorů. Defekty genu androgenního receptoru (AR) narušují funkci tohoto receptoru a mohou způsobit celou řadu interních i externích virilizačních abnormalit. Tyto abnormality zahrnují syndromy androgenní necitlivosti, jako například Reifensteinův syndrom, testikulární feminizaci, Lubův syndrom a Rosewaterův syndrom [15]. Klinicky způsobuje androgenní insenzitivita celou řadu fenotypů. Nejasná diference genitálu, mikropenis a hypospadie vznikají díky částečné androgenní odpovědi, zatímco úplná androgenní necitlivost vede k ženskému fenotypu s intraabdominálními varlaty [16].
Další druh androgenní insenzitivity je spojen s onemocněním motorického neuronu vznikajícím v dospělosti. Spinální a bulbární svalová atrofie nebo Kennedyho syndrom je genetické onemocnění vázané na chromozom X, spojené s rozšířením polyglutaminové dráhy v transaktivační doméně AR. Pacienti s Kenndeyho syndromem mají progresivní slabost v proximálních spinálních a bulbárních svalech spolu s gynekomastií, testikulární atrofií a narušením spermatogeneze. Symptomy se obvykle objevují ve středním věku a s každou další generací se nástup a závažnost onemocnění zhoršuje. To je zapříčiněno prodloužením CAG-úseku (cytozin, adenozin, guanin), procesem, který je označován jako anticipace [17].
Testování na lehké genetické endokrinopatie není však běžně k dispozici. Muži s podezřením na Kallmanův syndrom mohou být vyšetřeni pro přítomnost Kal-mutací, jinak se speciální genetické testy obvykle neprovádí.
Endokrinopatie negenetického původu
Adenomatózní růst hypofýzy je další neobvyklou, ale známou příčinou mužské infertility. Hypofyzární útvary mohou zasahovat do uvolňování gonadotropinů buï přímou kompresí portálního systému, nebo sníženou sekrecí FSH-LH způsobující hypogonadotropní hypogonadizmus. U pacientů se sníženou hodnotou testosteronu spolu s nízkým LH, je třeba zvážit adenom hypofýzy a je nezbytné provedení MRI hlavy. Hyperprolaktinemie se také vyskytuje spolu s adenomy hypofýzy. Zvýšená hodnota prolaktinu interferuje s normálním pulzačním uvolňováním GnRH a sama o sobě může být příčinou hypogonadizmu s následnou sexuální dysfunkcí a infertilitou. Operace, ozařování i medikamentózní léčba jsou efektivní terapií spolu s kabergolinem (Dostinex) a bromokriptinem (Parlodel) jako hlavní forma medikamentózní terapie. Iatrogenní příčiny hyperprolaktinemie zahrnují inhibitory zpětného přenosu serotoninu (SSRI), které jsou často předepisovány na mnohé psychické poruchy. Obecně je vyšetření hypofýzy pomocí MRI oprávněné pouze pokud symptomy nebo rutinní hormonální vyšetření ukazují na onemocnění hypofýzy.
Je obecně známo, že aplikace exogenního androgenu způsobuje supresi endogenní produkce testosteronu. Užívání anabolických steroidů způsobuje negativní zpětnou vazbu na úrovni hypotalamu a hypofýzy a produkce LH je snížena jako součást mechanizmu zpětné vazby HHG--osy. Normální spermatogeneze vyžaduje adekvátní hodnotu intratestikulárního testosteronu, u pacientů užívajících steroidy, je tvorba spermií významně snížena a často se setkáme s azoospermií. Rozsah a zvratnost škodlivého účinku steroidů na spermatogenezi závisí na dávkování a trvání aplikace exogenních steroidů.
Testosteron je aromatázou metabolizován na estradiol. Nedávné studie odhalily, že někteří muži s nízkou koncentrací a motilitou spermií mají snížený poměr testosteron : estradiol. U těchto pacientů vede léčba orálními inhibitory aromatázy (anastrozol - Arimidex a letrozol - Femara, v ČR Femara) k statisticky významnému zvýšení koncentrace a motility spermií [18].
TESTIKULÁRNÍ PŘÍČINY MUŽSKÉ INFERTILITY
Varikokéla
Varikokéla se vyskytuje často a nalézáme ji asi u 15 % populace mužů [19], ovšem u mužů s primární infertilitou se incidence zvyšuje až na 40 % [20] a 45 % až 81 % mužů se sekundární infertilitou má varikokélu [21], čímž se varikokéla stává nejčastější léčitelnou příčinou mužské infertility. Varikokéla je tvořena dilatovanými vnitřními spermatickými žílami, které spolu s kremasterickými žílami a žílami chámovodu odvádí krev z varlat. Tyto dilatované žíly se nacházejí častěji spíše na levé straně nebo bilaterálně než jen na straně pravé [22] a jsou považovány za důsledek nedostatečnosti žilních chlopní.
Existuje několik teorií týkajících se patofyziologie varikokély způsobující subfertilitu muže. Jedna teorie předpokládá, že špatná žilní drenáž narušuje výměnu tepla v chámovodu, nebo zvyšuje testikulární perfuzi umožňující zvýšení teploty ve skrotu [23]. Zvýšená skrotální teplota následně vede k narušení spermatogeneze [24]. Další teorie předpokládá, že buněčné metabolity působící jako gonadotoxiny jsou špatně odváděny z varlat a způsobují narušení spermatogeneze [25]. U mužů s varikokélou byla také zjištěna abnormální koncentrace testosteronu, která se zlepší po operaci varikokély, to ukazuje na možný hormonální původ narušené spermatogeneze [26,27].
Operace varikokély je indikována u mužů, u nichž je varikokéla spojena s bolestivostí, testikulární atrofií nebo infertilitou, jež nelze připsat jiné příčině. Varikokélu lze operovat ligací dilatovaných vnitřních spermatických žil nebo radiografickou embolizací těchto žil. V současné době užívá většina chirurgů zabývajících se mužskou reprodukcí mikrochirurgické techniky zachovávající vnitřní spermatické arterie a lymfatické cévy. Ve studii Pryora a Howardse [20] zlepšila operace varikokély kvalitu semene u 51 až 78 % pacientů a 24 % až 53 % pacientů bylo schopno po operaci spontánně oplodnit partnerku. Prospektivních randomizovaných studií zabývajících se rekonstrukcí varikokély existuje pouze málo. Madgar et al [28] v prospektivní, randomizované, zkřížené studii zaznamenali, že 71 % mužů podstoupivších operaci varikokély bylo schopno spontánně oplodnit partnerku ve srovnání s 10 % mužů schopných spontánního oplodnění, kteří byli randomizováni k nulové terapii. Bylo také zaznamenáno zlepšení v hustotě a motilitě spermií a procentu oplodnění. V nedávné době byla navíc po operaci varikokély popsána zlepšení tzv. striktní morfologie spermií [29-31] a po korekci varikokély pak i penetrace spermií [32]. Konečně u některých azoospermatických mužů byl po operaci varikokély zaznamenán návrat spermií do ejakulátu [34-36].
Korekce varikokély nabízí subfertilním párům nejen zlepšení procenta spontánního oplodnění, ale také zlepšení kvality semene, jež může změnit úroveň asistované reprodukční technologie (např. IVF při intrauterinní inseminaci) nezbytné pro dosažení oplodnění. Rekonstrukce varikokély je většinou cenově výhodná léčba [37,38]. Ve studii 540 infertilních mužů s varikokélou Cayan et al zjistili [37], že u 31 % mužů vyžadujících ICSI nebo IVF (celkový počet motilních spermií < 5 milionů) pro léčbu infertility došlo po operaci varikokély k zlepšení kvality spermatu umožňující intrauterinní inseminaci nebo spontánní oplodnění (celkový počet motilních spermií > 5 milionů). Tato zjištění doplnila ještě 36,6 % spontánních oplodnění. V další studii hodnotil Schlegel [38] cenovou výhodnost operace varikokély ve srovnání s IVF a ICSI. Při odhadu 42,2% úspěšnosti a ceně 62 263 USD při IVF a ICSI, byla operace varikokély výrazně levnější při 30% úspěšnosti a ceně 26 268 USD. Operací varikokély se také vyhneme komplikacím spojeným s IVF, jako například vícečetným těhotenstvím a hyperstimulaci vaječníků. Tato terapie také umožňuje více než 1 přirozené těhotenství pomocí jediné terapie.
Genetika
Genetická porucha může poškodit spermatogenezi, narušit normální vývoj genitálních cest a snížit motilitu spermií a kapacitu fertilizace, což může vést k různým stupňům mužské subfertility nebo infertility. Genetické poruchy mohou být charakterizovány jako abnormality karyotypu, delece specifických oblastí chromozomů zahrnutých do regulace spermatogeneze nebo specifické mutace genů.
Abnormality karyotypu se častěji vyskytují u infertilních mužů (5,8 %) než u normální populace novorozenců mužského pohlaví (0,5 %) [39]. Abnormality pohlavních chromozomů jsou častější (4,2 %) než abnormality autozomálních chromozomů (1,5 %). Defekty chromozomů se dělí do kategorií numerické nebo strukturální. Numerické chromozomální abnormality zahrnují deleci nebo duplikaci celých chromozomů. Strukturální chromozomální abnormality zahrnují deleci, inverzi nebo duplikaci části chromozomů, nebo translokaci části chromozomu na jiný chromozom. Strukturální a numerické chromozomální abnormality se objevují u některých pacientů s azoospermií a závažnou oligospermií a zahrnují autozomální chromozomy, pohlavní chromozomy nebo obojí.
Klinefelterův syndrom (47,XXY) je nejčastější poruchou pohlavních chromozomů, vyskytující se 30krát častěji u infertilních mužů navštěvujících pracoviště zabývající se léčbou neplodnosti [40]. Pacienti s Klinefelterovým syndromem jsou azoospermatičtí, nebo mají závažnou oligospermii [41] a tvoří asi 14 % všech případů azoospermie [42]. Fenotyp mužů s Klinefelterovým syndromem je různý, ale může zahrnovat malá tuhá varlata, vyšší postavu, ženské ochlupení, varixy dolních končetin, nižší inteligenci, diabetes mellitus, obezitu, zvýšenou incidenci leukemie, tumorů neseminomatózních a extragonadálních tumorů z germinálních buněk a infertilitu [43]. Pacienti s gynekomastií mají zvýšené riziko vzniku karcinomu prsu. 10 % pacientů s Klinefelterovým syndromem má mozaiku 46,XY/47,XXY a mají méně závažný fenotyp [42]. Tito pacienti mají různý stupeň tvorby spermií, ale vzácně dosahují otcovství pomocí přirozeného oplodnění [44]. Další méně časté abnormality pohlavních chromozomů zahrnují smíšenou gonadální dysgenezi, XX muže a XXY muže a jsou zobrazeny v tab. 3.
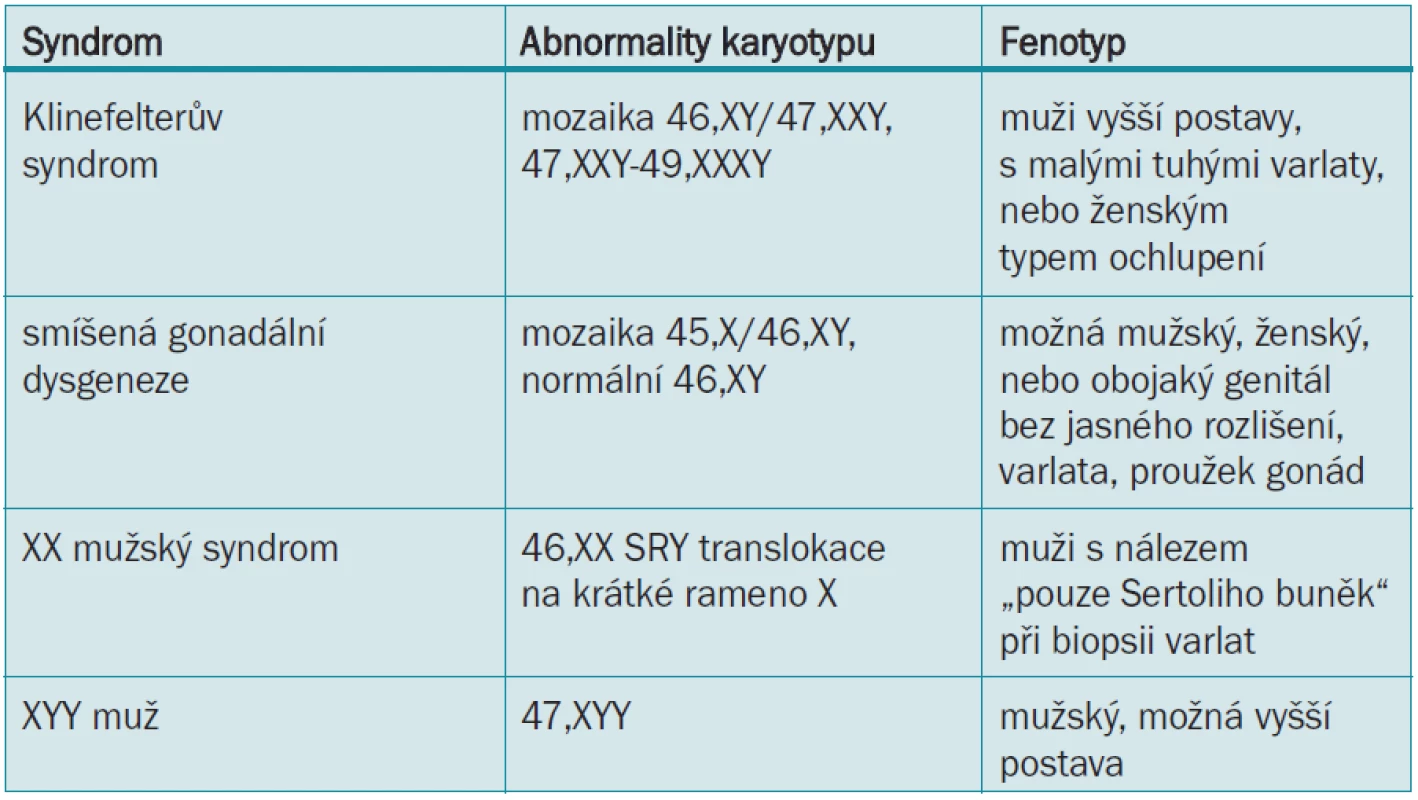
Chromozom Y hraje hlavní roli při mužské reprodukční funkci. Nejprve je na kratším rameni chromozomu Y (Yp) [45] nalezen faktor určující charakter varlat (SRY), důležitá oblast pro normální vývoj muže. Oblast faktoru azoospermie (AZF) chromozomu Y je taktéž nezbytná pro normální spermatogenezi a nalézá se na dlouhém rameni chromozomu Y (Yq11) [46]. Byly identifikovány 3 nepřekrývající se intervaly v AZF oblasti (AZFa, AZFb a AZFc) a u některých infertilních mužů se vyskytují mikrodelece zasahující tyto oblasti. Geny v těchto oblastech zřejmě kódují proteiny zahrnuté do regulace spermatogeneze. Publikovaná incidence mikrodelece chromozomu Y se v různých studiích liší v závislosti na kritériích výběru pacienta. Celkem mají 4 % oligospermatických mužů mikrodelece chromozomu Y a incidence se zvyšuje na 18 % u mužů s idiopatickou azoospermií [47]. Pro identifikaci mikrodelecí chromozomu Y musí laboratoře provádět polymerázovou řetězovou reakci a gelovou elektroforézu.
Incidence abnormalit karyotypu a mikrodelecí chromozomu Y se zvyšuje se snižující se denzitou spermií. Autoři doporučují cytogenetickou analýzu s vysokým rozlišením a mikrodelece chromozomu Y u všech mužů s hustotou spermií méně než 5 milionů na mililitr, zejména u těch zvažujících využití asistovaných reprodukčních technik. Infertilní pacienti s abnormálními karyotypy nebo mikrodelecemi chromozomu Y mohou mít menší množství spermií v ejakulátu nebo ve varlatech. Tyto spermie lze užít při ICSI-IVF. Za použití těchto technik bylo dosaženo pomocí spermií s abnormálními karyotypy a mikrodelecemi chromozomu Y úspěšných těhotenství. Děti otců s abnormalitami karyotypu mohou být normální. Vzhledem k riziku nevyvážené translokace, ke které dochází během meiózy, avšak některé z těchto dětí mohou mít malformace a nemusí přežít [44,48]. Potomci mužského pohlaví u otců s mikrodelecemi chromozomu Y zřejmě tyto mikrodelece zdědí [49]. Pár, v němž má partner abnormální karyotyp nebo mikrodeleci chromozomu Y by měl podstoupit před pokusem o dosažení těhotenství genetické testy.
Kryptorchizmus
Incidence kryptorchizmu v 1. roce života je asi 0,8 % [50]. Mnoho těchto mužů je subfertilních, přestože přesná patofyziologie výsledné infertility nebyla zjištěna. U těchto pacientů existují 2 možné příčiny vzniku infertility. První příčina - anatomická lokalizace varlete mimo šourek vede k narušení spermatogeneze. U kryptorchických varlat nalézáme menší seminiferózní kanálky, snížený počet spermatogonií a zesílené membrány od 1,5 roku věku [51]. Pokud jsou ponechány v kryptorchické lokalizaci, 69,2 % varlat má histologii s pouze Sertoliho buňkami, pokud jsou odstraněny po pubertě [52]. Muži s kryptorchizmem mají také špatnou reakci na stimulaci GnRH a nižší základní hodnoty LH a testosteronu [53]. Pokud jsou ponecháni bez léčby, 50 až 70 % mužů s unilaterálním kryptorchizmem je oligospermatických nebo azoospermatických a téměř všichni muži s bilaterálním kryptorchizmem mají azoospermii [54]. Z mužů, kteří podstoupili orchidopexi před pubertou mělo 62 % mužů s unilaterálním kryptorchizmem a 30 % s bilaterálním kryptorchizmem hustotu spermií větší než 20 milionů spermií na milimetr [55]. Muži s azoospermií mohou podstoupit testikulární extrakci spermií pro získání spermií pro IVF-ICSI cykly. Při testikulární extrakci spermií autoři doporučují získání testikulární biopsie pro patologické vyšetření z důvodu vyloučení karcinomu in situ.
Vystavení gonadotoxinům
Mnohé substance a povolání snižují kvalitu semene. Tyto potencionální gonadotoxiny bylo obtížné zkoumat vzhledem k malé rozsáhlosti vzorku a okolních faktorů, které je obtížné kontrolovat. Níže uvádíme seznam gonadotoxinů. Účinky těchto látek jsou zvratné, pokud je jejich působení eliminováno před poklesem kvality ejakulátu na úroveň azoospermie.
Léčiva
- cimetidin
- sulfasalazin
- nitrofurantoin
- anabolické steroidy
- narkotika
- chemoterapeutika
Chemikálie
- organická rozpouštědla
- pesticidy
Teplo
- svářeči nebo výrobci keramiky
- opakované nebo dlouhé koupele v horké vodě
Radiace
- terapeutická radiace
- pracovníci v jaderné elektrárně
Těžké kovy
- výroba baterií
- tiskařství
Užívání marihuany nebo tabáku
Konzumace alkoholu
Radiace a chemoterapie mohou trvale poškodit germinální epitel, což vede k různým restitucím spermatogeneze. Doporučujeme, aby si pacienti před započetím terapie zachovali pro zabezpečení budoucí fertility své sperma. Po chemoterapii jsou muži požádáni, aby se vyhnuli oplodnění po dobu 2 let, po nichž bude proveden rozbor spermatu, pokud nebude schopen pacient oplodnění. Muži azoospermatičtí po chemoterapii mají 41% šanci, že budou mít ve varleti spermie vhodné pro užití v IVF-ICSI-cyklech, které budou získány testikulární extrakcí spermií [56].
POSTTESTIKULÁRNÍ PŘÍČINY MUŽSKÉ INFERTILITY
Obstrukce
Obstrukce vývodného systému se může vyskytnout v průběhu ejakulačních kanálků, chámovodů nebo nadvarlat. Anamnéza, fyzikální vyšetření, parametry spermatu a radiologické vyšetření mohou být využity pro určení lokalizace obstrukce. Obstrukce chámovodu může být způsobena operací v tříselné nebo pánevní oblasti. Operace skrota, jako např. operace spermatokély, orchidopexe nebo plastika hydrokély, mohou vést k obstrukci epididymidy. Recidivující epididymitidy mohou vést k obstrukci kanálků nadvarlete. Při fyzikálním vyšetření je absence chámovodu zjištěna u pacientů s kongenitální bilaterální absencí chámovodu (congenital bilateral absence of the vas deferens - CBAVD) a dilatované nadvarle ukazuje na možnou obstrukci.
Rozbor spermatu se liší dle místa obstrukce. Úplná obstrukce ejakulačních kanálků vede ke kyselému ejakulátu negativnímu na fruktózu o nízkém objemu. Obstrukce chámovodu nebo epididymidy způsobuje zásaditý ejakulát pozitivní na fruktózu s normálním objemem. Muži, u nichž je obstrukce jedinou příčinou infertility, mají normální hladinu testosteronu a FSH. V případě podezření na obstrukci exkrekčních kanálků je třeba provést radiografické vyšetření. Transrektální ultrazvukové vyšetření podporuje diagnózu obstrukce ejakulačních kanálků identifikací dilatovaných ejakulačních kanál-ků, semenných váčků a cystických mas a konkrementů způsobujících obstrukci. Transrektální aspirát dilatovaných semenných váčků během transrektálního ultrazvukového vyšetření, jenž prokáže četné spermie, je také důkazem pro přítomnost obstrukce ejakulačních kanálků. Absence semenných váčků nebo přítomnost hypoplastických semenných váčků při transrektálním ultrazvukovém vyšetření potvrzují diagnózu CBAVD. V případě podezření na okluzi chámovodu potvrdí vazogram provedený při revizi skrota diagnózu a určí místo obstrukce. 1-0 nylonová sutura abdominálním chámovodem při vazografii stanoví přesnou vzdálenost od vazostomie k místu obstrukce. Léčbou volby pro obstrukci ejakulačních kanálků je transuretrální resekce ejakulačních kanálků. U přibližně poloviny mužů podstupujících tuto proceduru při obstrukci ejakulačních váčků dojde ke zlepšení parametrů jejich spermatu a polovina z nich následně dosáhne oplodnění [57]. Muži s obstrukcí chámovodu nebo obstrukcí epididymidy jsou kandidáty pro mikrochirurgickou rekonstrukci, která umožní normální početí nebo mikrochirurgickou epididymální aspiraci spermií pro získání spermií, které budou užity při IVF-ICSI.
Vrozená bilaterální absence chámovodu je nejčastěji se vyskytující obstrukcí extratestikulárního vývodného systému, postihující 1 až 2 % infertilních mužů [58]. CBAVD je částí spektra fenotypu cystické fibrózy (CF), autozomálně recesivního onemocnění, jež přenáší 1 z 25 bělochů [58]. CF je způsobená genetickou mutací transmembránového regulačního CF-genu (CFTR). CFTR je velký gen (250 000 párů bází) a dodnes bylo identifikováno více než 1 000 mutací CFTR. Charakteristika mužů s CBAVD zahrnuje absenci chámovodu, hypoplastické nefunkční semenné váčky a ejakulatorní kanálky a zbytky nadvarlat, často složené pouze z oblasti hlavy, která je tuhá a distendovaná [59]. Spermatogeneze není u těchto pacientů narušena, sperma lze získat z nadvarlete (mikrochirurgická epididymální aspirace spermií) pro využití při ICSI-IVF, což umožňuje postiženým párům dosáhnout otěhotnění. Muži s CBAVD a jejich ženy by měli být vyšetřeni pro možnou přítomnost mutací CFTR a před započetím získávání spermií by měli podstoupit genetické poradenství.
Rutinní analýza genu CFTR je k dispozici ve většině genetických laboratoří. V klinických diagnostických laboratořích je prováděn test na pouze asi 30 mutací z 1 000 možných, takže může být přítomna mutace, jež není identifikována. Absence mutace při těchto omezených rozborech nezaručuje, že se potomek nenarodí s CF, pokud je žena také přenašečka. Navíc k 1 000 známých mutací tohoto genu existuje polymorfní intron 8 (nekódovaná oblast), jenž kvantitativně ovlivňuje tvorbu produktu CFTR-genu. Alely této polymorfní oblasti CFTR-genu obsahují 5 (5T), 7 (7T) nebo 9 (9T) tymidinů. 5T-alela způsobuje nejméně efektivní přenášení CFTR mRNA. 5T-mutace vedou k menšímu množství vzniklého proteinu a zvýšené závažnosti pozorovaného fenotypu [59]. Pro vyšetření tohoto nejběžnějšího polymorfizmu (5T) musí být provedena samostatná analýza, tento test se však běžně neprovádí ve všech klinických laboratořích rutinně provádějících analýzu genu CF, což zvyšuje omezení spojená s negativním výsledkem. Vzhledem k mnoha rozličným mutacím a obtížné identifikaci všech možných mutací u jediného pacienta, se u všech pacientů s CBAVD uvažuje o tom, že mají genetickou formu CF [59]. Muži s idiopatickou epididymální obstrukcí mají také zvýšenu incidenci mutací CF. Tito muži by také měli podstoupit test na CF před rekonstrukcí nebo mikroskopickou epididymální aspirací spermií.
Také pacienti s unilaterální absencí chámovodu jsou rizikoví a měli by podstoupit analýzu genu CFTR, přestože unilaterální absence chámovodu u pacientů s kontralaterální ledvinou může představovat jinou vrozenou anomálii.
Imunologická infertilita
Protilátky proti spermiím má 9 až 33 % infertilních párů. U 8 až 19 % těchto párů se vyskytují protilátky u muže a u 1 až 21 % u partnerky [60-62]. Rizikové faktory pro tvorbu protilátek proti spermiím u mužů zahrnují vazektomii a epididymitidu [63, 64], přestože přesná příčina tvorby těchto protilátek je často nejasná.
Obvykle nejsou zralé spermie identifikovány samy o sobě. Spermie se tvoří až od puberty, dlouho po vyvinutí imunologické tolerance na autoantigeny. Sekundární spermatocyty a zrající spermie jsou izolovány od imunitních buněk v luminální části semenných kanálků. Předpokládá se taktéž, že malý únik spermatických specifických antigenů způsobuje pozdní toleranci na tyto antigeny [65] a může také přispět k prevenci vzniku protilátek proti spermiím.
Protilátky proti spermiím mohou snížit potenciál fertility v některých významných bodech, jež jsou důležité pro přirozené oplodnění. Protilátky proti spermiím způsobují shlukování spermatických buněk, což zpomaluje motilitu spermií [66]. Také se naruší penetrace spermií hlenem děložního čípku [67]. Spermie s protilátkami proti spermiím mají také špatnou interakci mezi spermií a vajíčkem. Akrosomová reakce [68] a vazba na zona pellucida [69] mohou být narušeny, což může snížit celkový potenciál fertility.
Protilátky proti spermiím jsou nejčastěji detekovány pomocí imunologického testu nebo SpermMAR-testu. Pokud jsou u infertilního páru zjištěny protilátky proti spermiím, existuje řada možností léčby. Nejprve by měli být muži s infekcí genitourinárních cest, včetně epididymitidy nebo prostatitidy léčeni vhodnými antibiotiky, a u mužů s obstrukcí duktů by měla být zvážena operační rekonstrukce. Pokud nelze zjistit přesnou příčinu výskytu protilátek proti spermiím, další terapie zahrnují imunosupresi pomocí steroidů, zpracováním spermií při intrauterinní inseminaci a IVF s ICSI [70-72].
Poruchy ejakulace
Ejakulace se sestává z koordinované depozice semene do prostatické uretry (emise), uzavření hrdla močového měchýře a kontrakce periuretrální svalovinya svaloviny pánevního dna způsobující vypuzení semene z uretry (ejakulaci). Proces ejakulace je řízen centrálním a periferním nervovým systémem. Emise je řízena sympatickými neurony počínajícími v T10-L3, a procházejícími paravertebrálními sympatickými ganglii. Ejakulace vyžaduje somatickou motorickou inervaci z S2-4 a pokračuje pudendálními nervy do hrdla močového měchýře a svaloviny pánevního dna.
Abnormality ejakulace mohou vést k nedostatečné emisní ejakulaci a retrográdní ejakulaci a mohou být způsobeny neurologickými, anatomickými nebo psychologickými příčinami. Retrográdní ejakulace je zapříčiněna neúplným uzavřením hrdla močového měchýře. Diabetes mellitus způsobuje poškození periferního nervového systému, což může vést k retrográdní ejakulaci či anejakulaci. Selhání emise nebo ejakulace může být také způsobeno excizí části sympatického řetězce nebo pánevních nervů při retroperitoneální lymfadenektomii u testikulárního karcinomu nebo jiné retroperitoneální, abdominální nebo pánevní operaci. Léze centrálního nervového systému, jako například poranění míchy a myelodysplazie mohou také způsobit ejakulatorní dysfunkci. Některá léčiva, jako například alfablokátory (způsobující retrográdní ejakulaci), antidepresiva, antipsychotika a některá antihypertenziva ovlivňují ejakulaci. Anatomické příčiny dysfunkce ejakulace zahrnují obstrukci ejakulatorních kanálků a předchozí operaci hrdla močového měchýře (Y-V -plastika hrdla močového měchýře, transuretrální incize nebo resekce prostaty), vedoucí k retrográdní ejakulaci.
Léčba ejakulatorních poruch může být medikamentózní nebo operační. Neurologické příčiny selhání emise, ejakulace a retrográdní ejakulace lze léčit sympatomimetickými látkami, jež zvyšují emisi a uzavírají hrdlo močového měchýře. Tyto medikamenty zahrnují imipramim hydrochlorid a pseudoefedrin hydrochlorid. Pokud selže konverze z retrográdní na antegrádní ejakulaci, lze získat funkční spermie z močového měchýře a užít je pro intrauterinní inseminaci nebo IVF-cykly. Další techniky pro získání semene od mužů s ejakulační dysfunkcí zahrnují vibrační stimulaci a elektroejakulaci. Vibrační stimulace vyžaduje užití vibrátoru k vyvolání ejakulace a vyžaduje intaktní reflexní oblouk v torakolumbální míše [73]. Nejlepšími predikátory úspěchu užití této techniky zahrnují reflexní flexi v kyčli, při podráždění chodidla [74] a intaktní bulbokavernózní reflex [75]. U mužů, u nichž selže medikamentózní terapie a vibrační stimulace, lze přistoupit k elektroejakulaci.
Larry I. Lipshultz, MD
Division of Male Reproductive Medicine and Surgery, Scott Department of Urology, Baylor College of Medicine, Houston, TX, USA
Sources
1. Poland ML, Moghissi KS, Giblin PT, Ager JW, Olson JM. Variation of semen measures within normal men. Fertil Steril 1985; 44 : 396-400.
2. Kolettis PN, Sabanegh ES. Significant medical pathology discovered during a male infertility evaluation. J Urol 2001; 166 : 178-180.
3. Sigman M, Lipschultz LI. Evaluation of the subfertile male. In: Lipsehultz LI, Howard SS (eds). Infertility in the male. 3rd ed. St. Louis: Mosby 1997 : 173-193.
4. Chipkevitch E, Nishimura RT, Tu DG. Galea-Rojas M. Clinical measurement of testicular volume in adolescents: comparison of the reliability of 5 methods. J Urol 1996; 156 : 2050-2053.
5. Naughton CK, Nangiu AK, Agarwal A. Pathophysiology of varicoceles in male infertility. Hum Reprod Update 2001; 7 : 473-481.
6. Sigman M. Jarow JP. Endocrine evaluation of infertile men. Urology 1997; 50 : 659-664.
7. Jaffe TM, Kim ED, Hoekstra TH, Lipshultz LI. Sperm pellet analysis: a technique to detect the presence of sperm in men considered to have azoospermia by routine semen analysis. J Urol 1998 : 159 : 1548-1550.
8. Seminara SB, Oliveria LM, Beranova M, Hayes FJ, Crowley WF Jr. Genetics of hypogonadotropic hypogonadism. J Endocrinol Invest 2000; 23 : 560-565.
9. Bick D, Franco B, Sherins RJ, Heye D, Pike L, Crawford J et al. Brief report intragenic deletion of the KALIG-1 gene in Kallmann's syndrome. N Engl J Med 1992; 326 : 1752-1755.
10. Franco B, Guioli S, Pragliola A et al. A gene detected in Kallmann's syndrome shares homology with neural cell adhesion and axonal path-finding molecules. Nature 1991; 353 : 529-536.
11. Weiss J, Axelrod L, Whitcomb RW, Harris PE, Crowley jr WF, Jameson JL. Hypogonadism caused by a single amino acid substitution in the beta subunit of luteinizing hormone. N Engl J Med 1992; 326 : 179-183.
12. Wu SM; Leschek EW; Rennert OM; Chan WY. Luteinizing hormone receptor mutations in disorders of sexual development and cancer. Front Biosci 2000; 5: D343-352.
13. Simoni M, Gromoll J, Hoppner W, Kamischke A, Krafft T, Stahle D et al. Mutational analysis of the follicle-stimulating hormone (FSH) receptor in normal and infertile men: identification and characterization of two discrete FSH receptor isoforms. J Clin Endocrinol Metab 1999 : 84 : 751-755.
14. Grillin JG. Androgen resistance: the clinical and molecular spectrum. N Engl J Med 1992; 326 : 611-618.
15. Quigley CA, De Bellis A, Marschke KB, el Awady MK, Wilson EM, French FS. Androgen receptor defects: historical, clinical, and molecular perspectives. Endocr Rev 1995; 16 : 271-321.
16. Brinkmann AO. Molecular basis of androgen insensitivity. Mol Cell Endocrinol 2001; 179 : 105-109.
17. Casella R, Maduro MR, Lipshultz LI, Lamb DJ. Significance of the polyglutamine tract polymorphism in the androgen receptor. Urology 2001; 58 : 651-656.
18. Pavlovich CP, King P, Goldstein M, Schlegel PN. Evidence of a treatable endocrinopathy in infertile men. J Urol 2001; 165 : 837-841.
19. Belloli G, D'Agostino S, Pesce C, Fantuz E. Varicocele in childhood and adolescence and other testicular anomalies: a epidemiological study. Pediatr Med Chir 1993; 15 : 159-162.
20. Pryor JL, Howards SS. Varicocele. Urol Clin North Am 1987; 14 : 499-513.
21. Jarow JP, Coburn M, Sisman M. Incidence of varicoceles in men with primary and secondary infertility. Urology 1996; 47 : 73-76.
22. Dubin L, Amelar RD. Varicocelectomy 986 cases in a twelve-year study. Urology 1977, 10 : 446-449.
23. Saypol DC, Howards SS, Turner TT, Miller ED Jr. Influence of surgically induced varicocele on testicular blood flow, temperature, and histology in adult rats and dogs. J Clin Invest 1981; 68 : 39-45.
24. MacCleod JHR. The effect of hyperpcrexia on spermatozoa counts in men. Endocrinology 1941; 28 : 780.
25. Peng BC, Tomashefsky P, Nagler HM. The cofactor effect: varicocele and infertility. Fertil Steril 1990; 54 : 143-148.
26. Cayan S, Kadioglu A, Orhan I, Kandirali E, Tefekli A, Tellaloglu S. The effect of microsurgical varicocelectomy on serum follicle stimulating hormone, testosterone and free testosterone levels in infertile men with varicocele. BJU Int 1999; 84 : 1046-1049.
27. Su LM, Goldstein M, Schlegel PN. The effect of variocelectomy on serum testosterone levels in infertile men with varicoceles. J Urol 1995; 154 : 1752-1755.
28. Madgar I, Weissenberg R, Lunenfeld B et al. Controlled trial of high spermatic vein ligation for varicocele in infertile men. Fertil Steril 1995; 63 : 120-124.
29. Kibar Y, Seçkin B, Erduran D: The effects of subinguinal varicocelectomy on Kruger morphology and semen parameters. J Urol 2002; 168: l071-1074.
30. Schatte EC, Hirshberg SJ, Fallick ML, Lipschultz LI, Kim ED. Varicocelectomy Improves Sperm Strict Morphology and Motility. J Urol 1998; 160 : 1338-1340.
31. Vazquez-Levin MH, Friedmann P, Goldberg SI, et al. Response of routine semen analysis and critical assessment of sperm morphology by Kruger classification to therapeutic varicocelectomy. J Urol 1997; 158 : 1804-1807.
32. Ohl DA. The effect of varicocele repair on optimized sperm penetration assay. Orlando. FL: ASRM 2001.
33. Mostafa T, Anis TH, El-Nashar A et al. Varicocelectomy reduces reactive oxygen species levels and increases antioxidant activity of seminal plasma from infertile men with varicocele. Int J Androl 2001; 24 : 261-265.
34. Matthews GJ, Matthews ED, Goldstein M. Induction of spermatogenesis and achievement of pregnancy after microsurgical varicocelectomy in men with azoospermia and severe oligoasthenospermia. Fertil Steril 1998; 70 : 71-75.
35. Kim ED, Leibman BB, Grinblat DM, Lipshultz LI. Varicocele repair improves semen parameters in azoospermic men with spermatogenic failure. J Urol 1999; 162 : 732-140.
36. Kadioglu A, Tefekli A, Cayan S, Kandirali E, Erdemir F, Tellaloglu S. Microsurgical inguinal varicocele repair in azoospermic men. Urology 2001; 57 : 328-333.
37. Cayan S, Erdemir F, Ozbey I, Turek PJ, Kadioglu A, Tellaloglu S. Can varicocelectomy significantly change the way couples use assisted reproductive technologies? J Urol 2002; 167 : 1749-1752.
38. Schlegel PN. Is assisted reproduction the optimal treatment for varicocele-associated male infertility? A cost-effectiveness analysis. Urology 1997; 49 : 83-90.
39. Johnson MD. Genetic risks of intracytoplasmic sperm injection in the treatment of male infertility: recommendations for genetic counseling and screening. Fertil Steril 1998; 70 : 397-411.
40. De Braekeleer M, Dao TN. Cytogenetic studies in male infertility: a review. Hum Reprod 1991; 6 : 245-250.
41. Palermo GD, Schlegel PN, Sills ES, Veeck LL, Zaninovic N, Menendez S, Rosenwaks Z. Births after intracytoplasmic injection of sperm obtained by testicular extraction from men with nonmosaic Klinefelter's syndrome. N Engl J Med 1998; 338 : 588-590.
42. Therman ESM. Human Chromosomes: structure, behavior and effects. 3rd ed. New York: Springer Verlag 1993.
43. Gordon DL, Krmpotic E, Thomas W, Gandy HM, Paulsen CA. Pathologic testicular findings in Klinefelter's syndrome. 47,XXY vs 46,XY-47,XXY. Arch Intern Med 1972; 130 : 726-729.
44. Poulakis V, Witzsch U, Diehl W, de Vries R, Becht E, Trotnow S. Birth of two infants with normal karyotype after intracytoplasmic injection of sperm obtained by testicular extraction from two men with nonmosaic Klinefelter's syndrome. Fertil Steril 2001; 76 : 1060-1062.
45. Koopman P, Gubbay J, Vivian N, Goodfellow P, Lovell-Badge R. Male development in chromosomally female mice transgenic for Sry. Nature 1991; 135 : 117-121.
46. Tiepolo L, Zuffardi O. Localization of factors controlling spermatogenesis in the nonfluorescent portion of the human Y chromosome long arm. Hum Genet 1976; 34 : 119-124.
47. Foresta C, Moro E, Ferlin A. Y chromosome microdeletions and alterations of spertnatogencsis. Endocr Rev 2001; 22 : 226-239.
48. Belin V, Farhat M, Monset-Couchard M. Intracytoplasmic sperm injection pregnancy with trisomy 20p and monosomy 22q in a newborn resulting from a balanced paternal translocation. Biol Neonate 1999; 75 : 398-401.
49. Page PC, Silber S, Brown LG. Men with infertility caused by AZFc deletion can produce sons by intracytoplasmic sperm injection, but are likely to transmit the deletion and infertility. Hum Reprod 1999; 14 : 1722-1726.
50. Villumsen AL, Zachau-Christiansen B. Spontaneous alterations in position of the testes. Arch Dis Child 1966; 41 : 198-200.
51. Cooper B. The histology of the retained testis in the human subject at different ages and its comparison with the testis. J Anat 1929; 64 : 5-10.
52. Rogers E, Teahan S, Gallagher H, Butler MR, Grainger R, McDermott TE et al. The role of orchiectomy in the management of postpubertal cryptorchidism. J Urol 1998; 159 : 851-854.
53. Job JC, Toublanc JE, Chaussain JL, Gendrel D, Roger M, Canlorbe P. The pituitary-gonadal axis in cryptorchid infants and children. Eur J Pediatr 1987; 146 (Suppl 2): S2-S5.
54. Leissner J, Filipas D, Wolf HK, Fisch M. The undescended testis: considerations and impact on fertility. BJU Int 1999; 83 : 885-892.
55. Lipshultz LI. Cryptorchidism in the subfertile male. Fertil Steril 1976; 27 : 609-620.
56. Chan PT, Palermo GD, Veeck LL, Rosenwaks Z, Schlegel PN. Testicular sperm extraction combined with intracytoplasmic sperm injection in the treatment of men with persistent azoospermia postchemotherapy. Cancer 2001; 92 : 1632-1637.
57. Schlegel P. Management of ejaculatory duct obstruction. In: Lipschultz L, Howards S (eds). Infertility in the Male. 3rd ed. St Louis: Mosby 1997 : 385-394.
58. Quinzii C, Castellani C. The cystic fibrosis transmembrane regulator gene and male infertility. J endocrinol Invest 2000; 23 : 684-689.
59. Daudin M, Bieth E, Bujan L, Massat G, Pontonnier F, Mieusset R. Congenital bilateral absence of the vas deferens: clinical characteristics, biological parameters, cystic fibrosis transmembrane conductance regulator gene mutations, and implications for genetic counseling. Fertil Steril 2000; 74 : 1164-1174.
60. Menge AC, Beitner O. Interrelationships among semen characteristics, antisperm antibodies, and cervical mucus penetration assays in infertile couples. Fertil Steril 1989; 51 : 486-492.
61. Menge AC, Medley NE, Mangione CM, Dietrich JW. The incidence and influence of antisperm antibodies in infertile human couples on sperm-cervical mucus interactions and subsequent fertility. Fcrtil Steril 1982; 38 : 434-446.
62. Collins JA, Burrows EA, Yeo J, YoungLai EV. Frequency and predictive value of antisperm antibodies among infertile couples. Hum Reprod 1993; 8 : 592-598.
63. Jarow JP, Sanzone JJ. Risk factors for male partner antisperm antibodies. J Urol 1992; 148 : 1803-1807.
64. Heidenreich A, Bonfig R, Wilbert DM, Strohmaier WL, Engelmann UH. Risk factors for antisperm antibodies in infertile men. Am J Reprod Immunol 1994; 31 : 69-76.
65. Tung KS, Unanue ER, Dixon FJ. Pathogenesis of experimental allergic orchitis II. The role of antibody. J Immunol 1971; 106(6): 1463-1472.
66. Clarke GN, Elliott PJ, Smaila C. Detection of sperm antibodies in semen using the immunobead test: A survey of 813 consecutive patients. Am J Reprot Immunol Microbiol 1985; 7 : 118-123.
67. Barratt CL, Dunphy BC, McLeod I, Cooke ID. The poor prognostic value of low to moderate levels of sperm surface-bound antibodies Hum Reprod 1992; 7 : 95-98.
68. Bandoh R, Daitoh T, Yamano S, Aono T, Kamada M. Effect of sperm-immobilizing antibodies on the acrosome reaction of human spermatozoa. Fertil Steril 1992; 57 : 387-392.
69. Liu DY, Clarke GN, Baker HW. Inhibition of human sperm-zona pellucida and sperm-oolemma building by antisperm antibodies. Fertil Steril 1991; 55 : 440-442.
70. Agarwal A. Treatment of immunological infertility by sperm washing and intrauterine insemination. Arch Androl 1992; 29 : 207-213.
71. Shulman S, Harlin B, Davis P, Reynick JV. Immune infertility and new approaches to treatment. Fertil Steril 1978; 29 : 309-313.
72. Bollendorf A, Check JH, Katsoff D, Fedele A. The use of chymotrypsin/galactose to treat spermatozoa bound with anti-sperm antibodies prior to intra-uterine insemination. Hum Report 1994; 9 : 484-488.
73. Shaban SF et al. Treatment of abnormalities of ejaculation. In: Lipshultz LI, Howards SS. Infertility in the male. 3rd edition. St Louis: Mosby 1997 : 423-438.
74. Brindley GS. Reflex ejaculation under vibratory stimulation in paraplegic men. Paraplegia 1981; 19 : 299-302.
75. Bird VG, Brackett NL, Lynne CM, Aballa TC, Ferrell SM. Reflexes and somatic responses as predictors of ejaculation by penile vibratory stimulation in men with spinal cord injury. Spinal Cord 2001; 39 : 514-519.
76. de Roux N, Young J, Misrahi M, Schaison G, Milgrom E. Loss of function mutations of the GnRH receptor: a new cause of hypogonadotropic hypogonadism. J Pediatr Endocrinol Metab 1999; 12 (Suppl 1): 627-275.
77. Jackson RS, Creemers JW, Ohagi S, Raffin-Sanson ML, Sanders L, Montague CT et al. Obesity and impaired prohormone processing associated with mutations in the human prohormone convertase 1 gene. Nat Genet 1997; 16 : 303-306.
78. Smeets DF, Hamel BC, Nelen MR, Smeets HJ, Bollen JH, Smits AP et al. Prader-Willi syndrome and Angelman syndrome in cousins from a family with a translocation between chromosomes 6 and 15. N Engl J Med 1992; 326 : 807-811.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2006 Issue 1
-
All articles in this issue
- MUŽSKÝ FAKTOR INFERTILITY: VYŠETŘENÍ A LÉČBA
- HYPOGONADIZMUS OČIMA ČESKÉHO PRAKTICKÉHO LÉKAŘE: VÝCHODISKA (NEJEN) PRO UROLOGY
- VASKULÁRNÍ RIZIKOVÉ FAKTORY U EREKTILNÍ DYSFUNKCE
- TRANSSEXUALIZMUS A CHIRURGICKÁ KONVERZE POHLAVÍ
- MÍSTO MEDIKAMENTÓZNÍ TERAPIE V LÉČBĚ KOMPLIKOVANÉ EREKTILNÍ DYSFUNKCE
- INTRAKAVERNÓZNÍ VAZOAKTIVNÍ LÉČBA EREKTILNÍ DYSFUNKCE
- PRIAPIZMUS
- INDURATIO PENIS PLASTICA: PEYRONIEOVA CHOROBA
- ÚLOHA UROLOGA V IVF-PROGRAMU PŘI DIAGNOSTICE A LÉČBĚ NEPLODNÉHO PÁRU
- ANDROGENNÍ DEFICIT U STÁRNOUCÍCH MUŽŮ
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- INTRAKAVERNÓZNÍ VAZOAKTIVNÍ LÉČBA EREKTILNÍ DYSFUNKCE
- INDURATIO PENIS PLASTICA: PEYRONIEOVA CHOROBA
- TRANSSEXUALIZMUS A CHIRURGICKÁ KONVERZE POHLAVÍ
- MUŽSKÝ FAKTOR INFERTILITY: VYŠETŘENÍ A LÉČBA
