Úbytek kostní hmoty u androgen deprivační terapie: naléhavý problém pacientů s karcinomem prostaty – naše zkušenosti
Cancer treatment induced bone loss (CTIBL): burning issue in prostate cancer patients – our experience
Androgen deprivation therapy (ADT) is well established in locally advanced or metastatic prostate cancer patients management. Its contribution to the prognosis of these patients is undisputable; CTIBL as its consequence is discussed in a much lesser extent. Cancer treatment induced bone loss leads ultimately to increased morbidity and mortality as well as to increased societal costs. We investigated the presence of osteoporosis and osteopenia based on bone mineral density measurement at DXA in a group of
104 patients at our clinic. The following article presents our data and considers new treatment option for patients suffering from CTIBL presented by a new monoclonal antibody denosumab.
Key words:
androgen deprivation therapy (ADT), BMD, RANKL, denosumab, prostate cancer, pathological fractures
Authors:
Prof. MUDr. Dalibor Pacík, CSc. 1; as. MUDr. Vítězslav Vít 1; prim. MUDr. Jana Katolická, Ph.D. 2; RNDr. Jiří Jarkovský, Ph.D. 3
Authors‘ workplace:
Urologická klinika LF MU, FN Brno
1; Onkologicko-chirurgické oddělení, FN u sv. Anny Brno
2; Institut biostatistiky a analýz, MU Brno
3
Published in:
Urol List 2011; 9(1): 60-64
Overview
Androgenní deprivační terapie (ADT) hraje v dnešní době nezastupitelnou roli v léčbě pacientů s lokálně pokročilým nebo metastazujícím karcinomem prostaty. Její přínos pro prognózu pacientů s tímto onemocněním je nepochybný; méně se hovoří o úbytku kostní hmoty, ke kterému v důsledku této léčby dochází. Úbytek kostní hmoty vlivem ADT (tzv. CTIBL – Cancer Treatment Induced Bone Loss) vede v konečném důsledku ke zvýšené morbiditě i mortalitě a ke zvýšeným celospolečenským nákladům. Na našem souboru 104 pacientů jsme zjišťovali výskyt osteoporózy a osteopenie na základě měření kostní denzity (BMD – Bone Mineral Density). Následující článek nabízí výsledky našeho šetření a zamýšlí se nad novou možností léčby CTIBL, kterou představuje plně humánní monoklonální protilátka denosumab.
Klíčová slova:
androgenní deprivační terapie, BMD, RANKL, denosumab, karcinom prostaty, patologické fraktury
Úvod
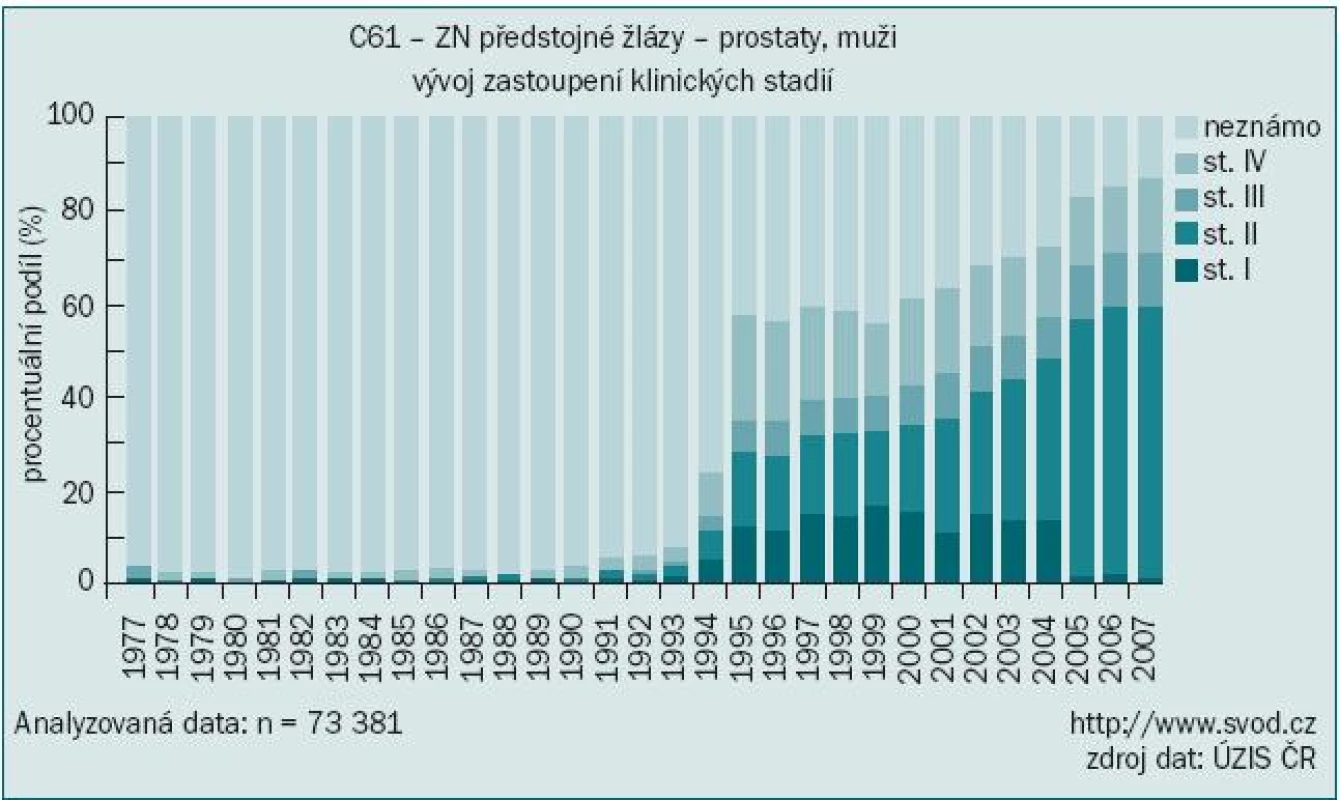
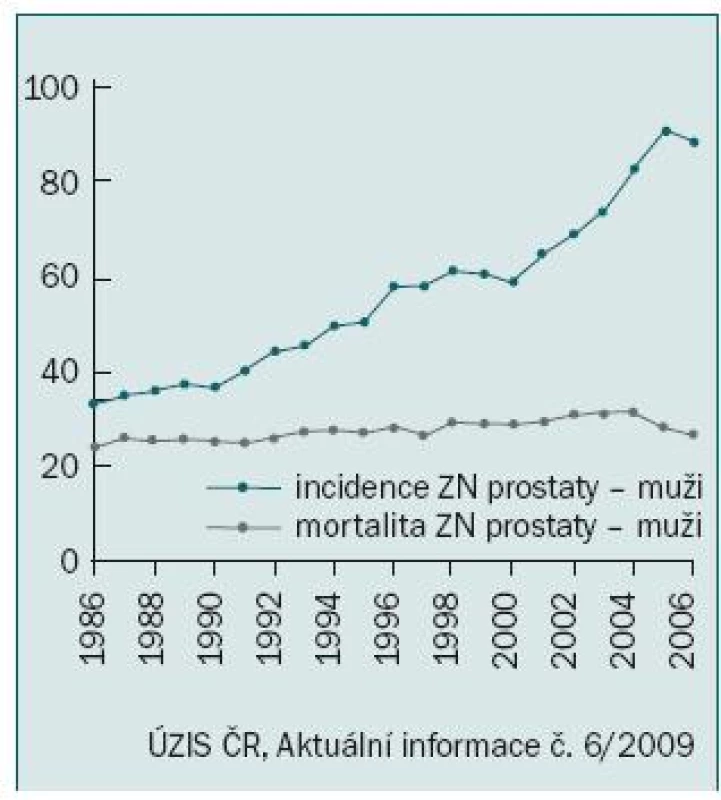
Vyloučíme-li diagnózu „jiného zhoubného novotvaru kůže“ (zastoupeného především bazaliomem), byl karcinom prostaty v roce 2006 podle údajů Národního onkologického registru nejčastěji diagnostikovaným onkologickým onemocněním mužů u nás s počtem 4 829 nových případů, čímž předstihl v incidenci i karcinom plic [1]. O dva roky později, v roce 2008, již bylo hlášeno 5 719 nových onemocnění, což představuje hrubou incidencí 113,1/100 000 obyvatel. Nárůst incidence a prevalence nádorů prostaty je vysvětlován stárnutím populace a zdokonalením a dostupností diagnostických metod, především pak vyšetřováním prostatického specifického antigenu (PSA). S tím souvisí i zvyšující se podíl záchytu v časných stadiích tohoto onemocnění, kdy dvě třetiny případů jsou hlášeny ve stadiu I nebo II (obr. 1). Tím lze vysvětlit stabilizovanou mortalitu navzdory zvyšující se incidenci (obr. 2).
Androgenní deprivační léčba a úbytek kostní hmoty
Mezi základní léčebné modality karcinomu prostaty patří androgen deprivační léčba, která tvoří základ léčby diseminovaného onemocnění [2,3]. Časté je její užití i u pacientů s lokálně pokročilým onemocněním, kde prokazatelně zlepšuje celkové přežití i přežití bez známek nemoci v adjuvanci po radioterapii [4,5], případně u pacientů po radikální prostatektomii a pánevní lymfadenektomii s pozitivními uzlinami [6] a u pacientů se vzrůstající hladinou PSA po selhání primární léčby.
Vedle chirurgické léčby se při ADT uplatňují nejčastěji LHRH analoga, která zpětnovazebním mechanizmem vedou k down regulaci androgenních receptorů s cílem snížit hladinu testosteronu a dihydrotestosteronu na kastrační úroveň, a tím omezit růstové stimuly pro prostatické nádorové buňky.
Účinná léčba však přináší i nežádoucí účinky. Pacienti jsou často postaveni před nutnost vyrovnat se s erektilní dysfunkcí, gynekomastií a změnou v oblasti pohlavních orgánů. Okolí pacientů může trpět jejich výkyvy nálad, depresemi a ztrátou energie. Vedle těchto zjevných nežádoucích účinků ADT jsou pacienti ohroženi i plíživými změnami lipidového spektra, rozvojem metabolického syndromu a hypertenze, jež s sebou přináší riziko vzniku nebo zhoršení kardiovaskulárních chorob a s nimi spojené mortality. Pro minimalizaci těchto rizik je důležité doporučení směřující k úpravě režimu pacientů včetně cvičení a racionální diety, což může současně zlepšit kvalitu jejich života, včetně zmírnění deprese a únavy.
Jedním ze skrytých rizik androgenní deprivační léčby (ADT) je snížení denzity kostního minerálu, které může vést až k iatrogenně navozené osteopenii a osteoporóze a s nimi spojenými patologickými frakturami [7]. Hovoříme o úbytku kostní hmoty v důsledku ADT (tzv. CTIBL – Cancer Treatment Induced Bone Loss), ve které hraje klíčovou roli signální dráha zahrnující RANKL (ligand receptoru aktivujícího nukleární faktor kappa B).
Je nutno si uvědomit, že věkový průměr mužů s diagnózou karcinomu prostaty je poměrně vysoký – tři čtvrtiny pacientů je starších 65 let. V tomto věku je zdraví kosti ohroženo fyziologickým úbytkem kostního minerálu, který postihuje muže obdobným mechanizmem, jaký známe u postmenopauzální osteoporózy u žen. Muži tvoří přibližně 20 % všech pacientů s diagnostikovanou osteoporózou. Přestože z celkového počtu fraktur proximálního femuru jich připadá na muže 25–30 %, mortalita v prvním roce po prodělané fraktuře je dvojnásobná ve srovnání se stejně postiženými ženami [9]. U mužů nad 75 let je riziko úmrtí v průběhu jednoho roku po fraktuře 20,7 % ve srovnání se 7,5% rizikem u žen.
Role RANK ligandu v patogenezi CTIBL
Pro úbytek kostní hmoty je charakteristická snížená mechanická odolnost, která predisponuje kost k frakturám. Pevnost kosti je dána množstvím kostního minerálu, kvalitou organické kostní matrix a mikroarchitekturou kosti. Pro udržení této pevnosti je důležité zachování rovnováhy mezi odbouráváním kosti a její novotvorbou. V 90. letech minulého století prokázaly studie na transgenních myších, že tato rovnováha je dána poměrem RANK ligandu a osteoprotegerinu. RANKL je polypeptid z rodiny TNF receptorů. Vazbou na svůj receptor RANK na povrchu myeloidních progenitorových buněk umožní diferenciaci a maturaci těchto prekurzorů, jejichž fúzí vznikají velké polynukleární osteoklasty. Vazba RANKL na receptor na povrchu zralých osteoklastů vede k jejich aktivaci a inhibicí apoptózy též k jejich prodlouženému přežívání. Tomu fyziologicky brání osteoprotegerin (OPG), solubilní glykoprotein secernovaný osteoblasty. Vazbou na RANK ligand brání jeho interakci s RANK na osteoklastech a následné osteoklastogenezi a akcelerované osteoresorpci.
Produkce OPG je stimulována řadou faktorů, z nichž nejdůležitější roli hrají estrogeny. V důsledku poklesu hladiny estrogenů u postmenopauzálních žen dochází k nedostatečnému secernování OPG a rozvoji postmenopauzální osteoporózy. U mužů je dostatečné množství OPG zajištěno přeměnou androgenů na estrogeny za účasti enzymu aromatázy. Při hormonálně ablativní terapii, ať již chirurgické, či chemické za použití LHRH analog, dochází v důsledku poklesu hladiny androgenů k nedostatečné přeměně na estrogeny. Následný nedostatek osteoprotegerinu vede k převaze osteoresorpce nad osteoformací. Výsledkem je úbytek kostní hmoty, destrukce kosti a zvýšený sklon k frakturám i u mužů, u kterých ještě nedošlo k rozvoji kostních metastáz.
ADT představuje velmi významný rizikový faktor – úbytek kostní hmoty v důsledku ADT je devítinásobný ve srovnání s mladými zdravými muži a pětinásobný oproti postmenopauzálním ženám [8]. Riziko fraktury roste s délkou podávání ADT [10]. Ze srovnání 3 887 pacientů s nemetastazujícím karcinomem prostaty léčených LHRH agonisty a 7 774 pa - cientů bez ADT vyplynula statisticky signifikantně kratší doba do první fraktury ve skupině pacientů s ADT podávanou déle než rok.
Shahinian ve své studii z roku 2005 ukázal, že jeden z pěti mužů, kteří byli léčeni LHRH agonisty, utrpěl do 4 let patologickou frakturu. Riziko fraktury bylo nepřímo úměrné počtu dávek ADT. Při počtu dávek ≥ 9 bylo riziko fraktury vyšší o 45 %, u orchiektomie dokonce o 54 %.
Výsledky sledování kostní denzity pacientů s karcinomem prostaty v rámci pracoviště Urologické kliniky FN Bohunice
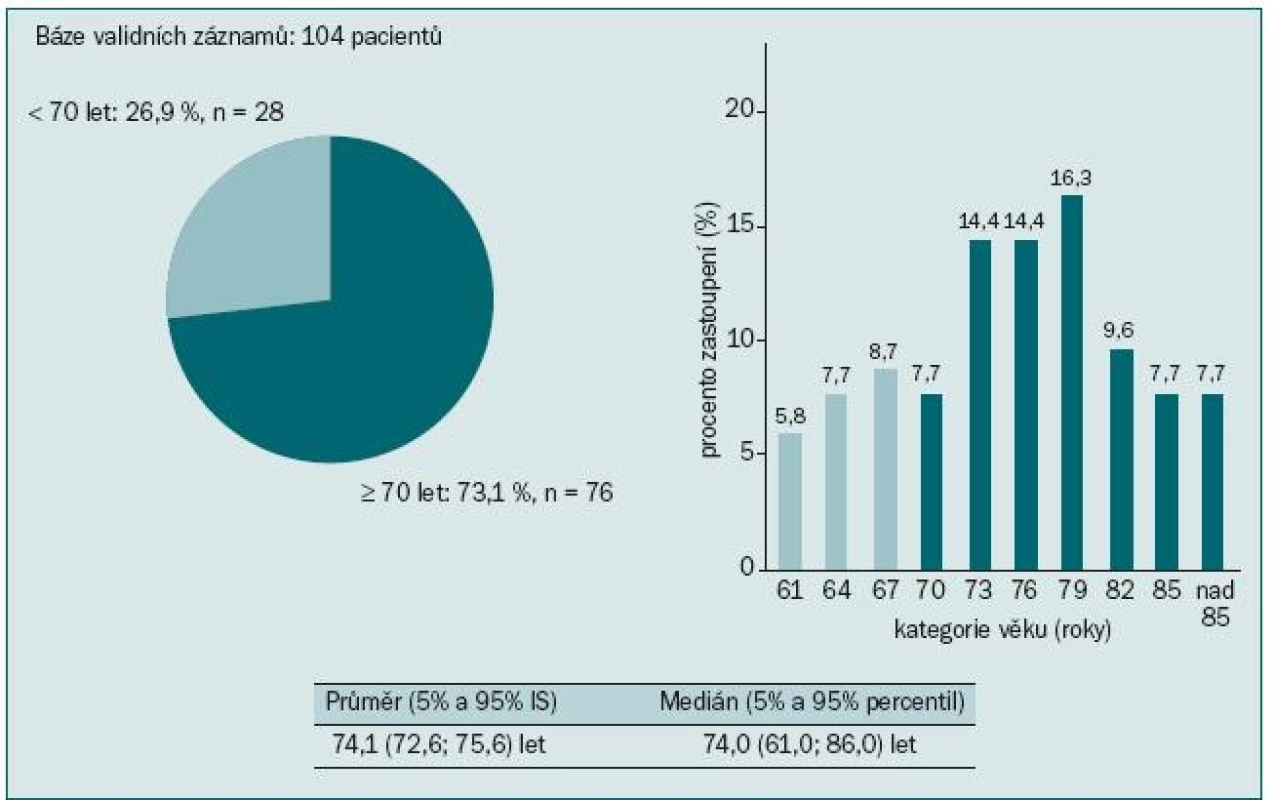
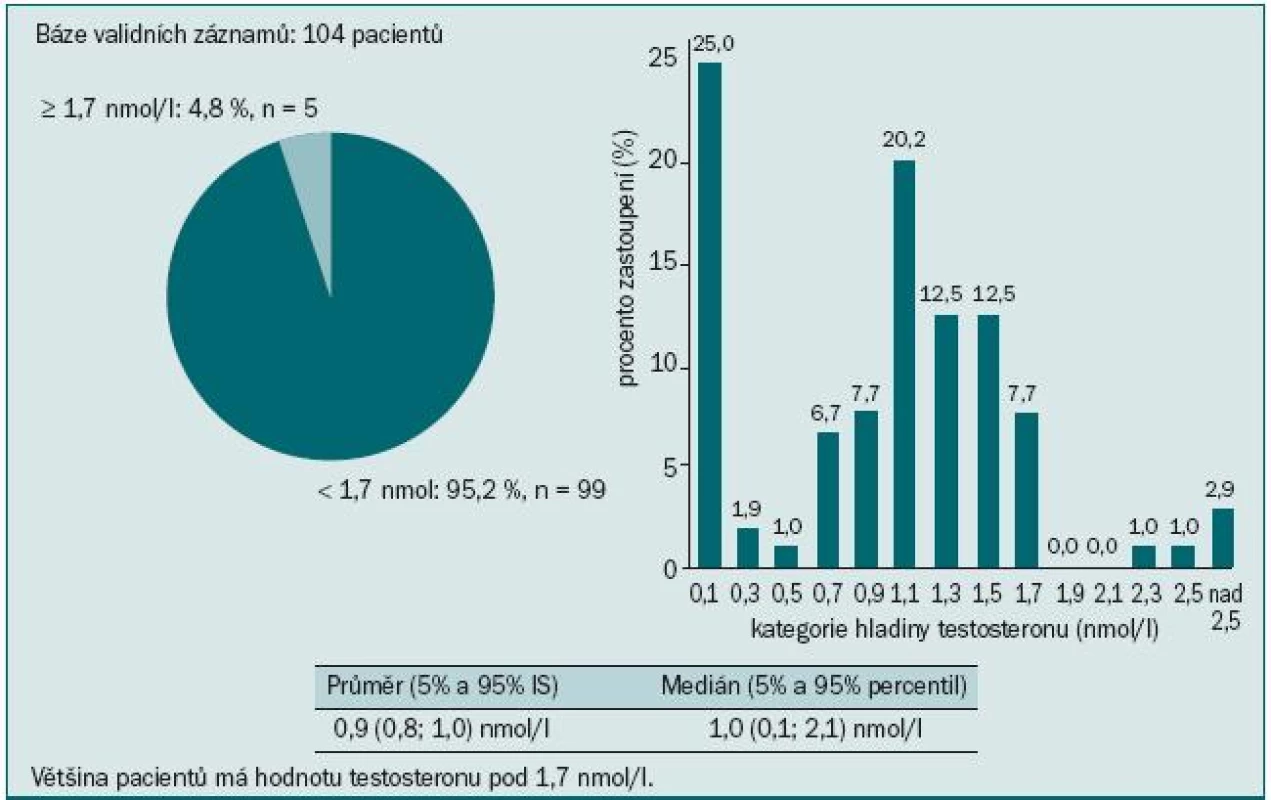
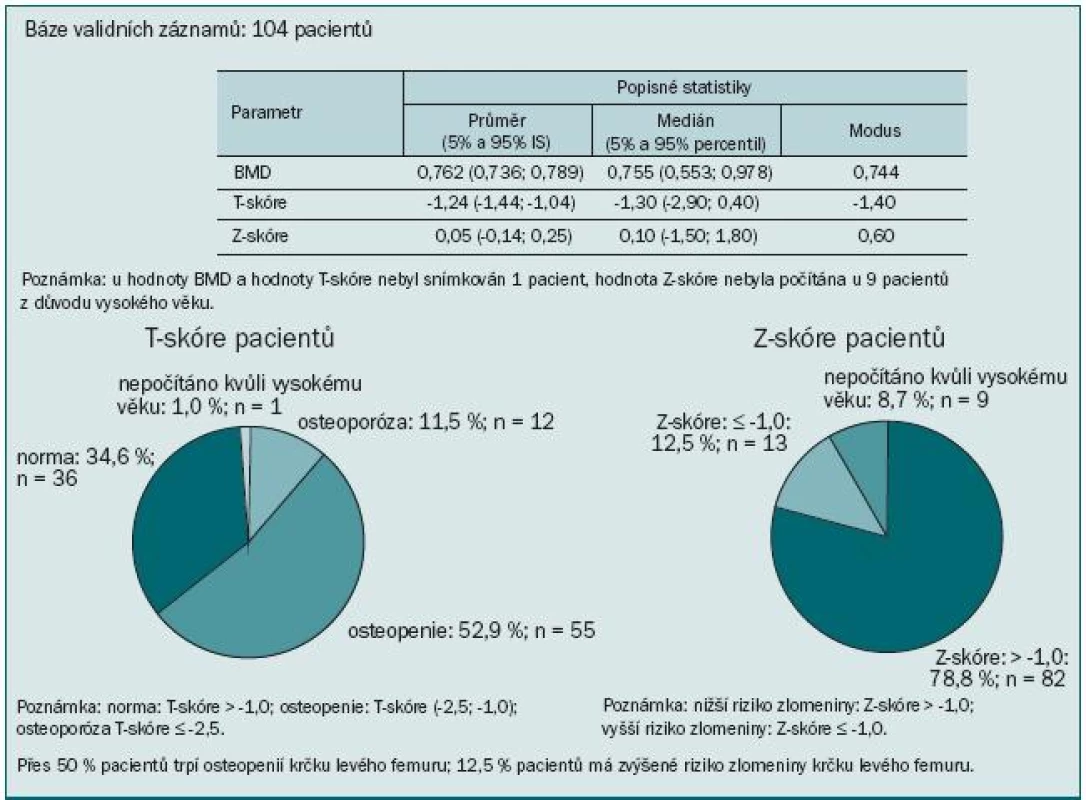
V našem souboru 104 pacientů jsme sledovali výskyt osteoporózy a osteopenie u pacientů užívajících ADT. 73,1 % pacientů bylo starších 70 let, průměrný věk pacientů byl 74,1 let (obr. 3). Většina pacientů (95,2 %) měla hodnoty testosteronu pod kastrační hodnotou (1,7 nmol/l) (obr. 4). Údaje o délce užívání ADT jsme měli k dispozici u třetiny pacientů. Všichni dostávali ADT po dobu ≥ 10 měsíců. Měření kostní denzity bylo provedeno na DXA přístrojích HOLOGIC DISCOVERY (98,1 % pacientů) a LUNAR PRODIGY (1,9 % pacientů). Osteoporóza byla u pacientů diagnostikována, pokud měli T-skóre ≤ -2,5, za osteopenické byli pacienti označeni, pokud měli v měřených místech skeletu (bederní páteř, proximální femur, krček femuru, distální 1/3 předloktí) T-skóre ≤ -1,0 a > -2,5. Normální denzita předpokládá T-skóre > -1,0. Riziko fraktury bylo určeno za pomoci Z-skóre, které porovnává kostní denzitu vyšetřovaného jedince s průměrnými hodnotami stejně starých jedinců téhož pohlaví. Hodnoty Z-skóre pod -1,0 určuje pacienty s vyšším rizikem zlomeniny.
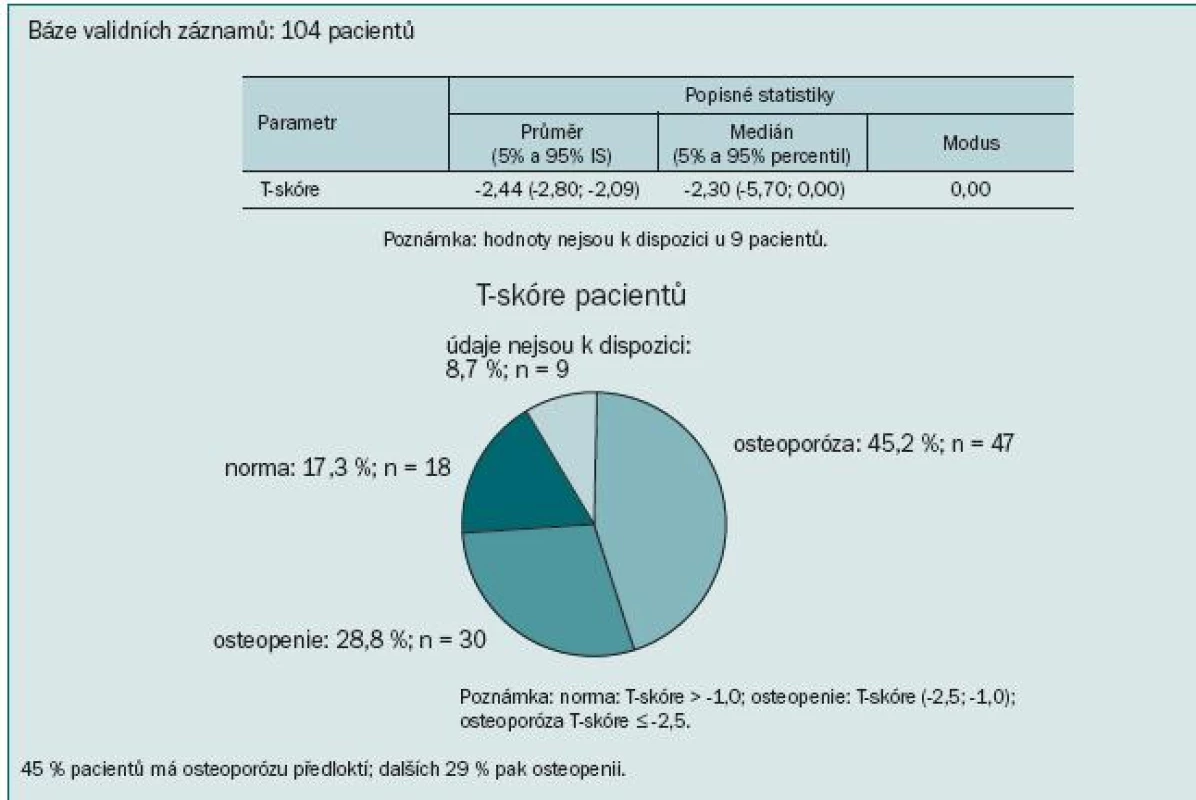
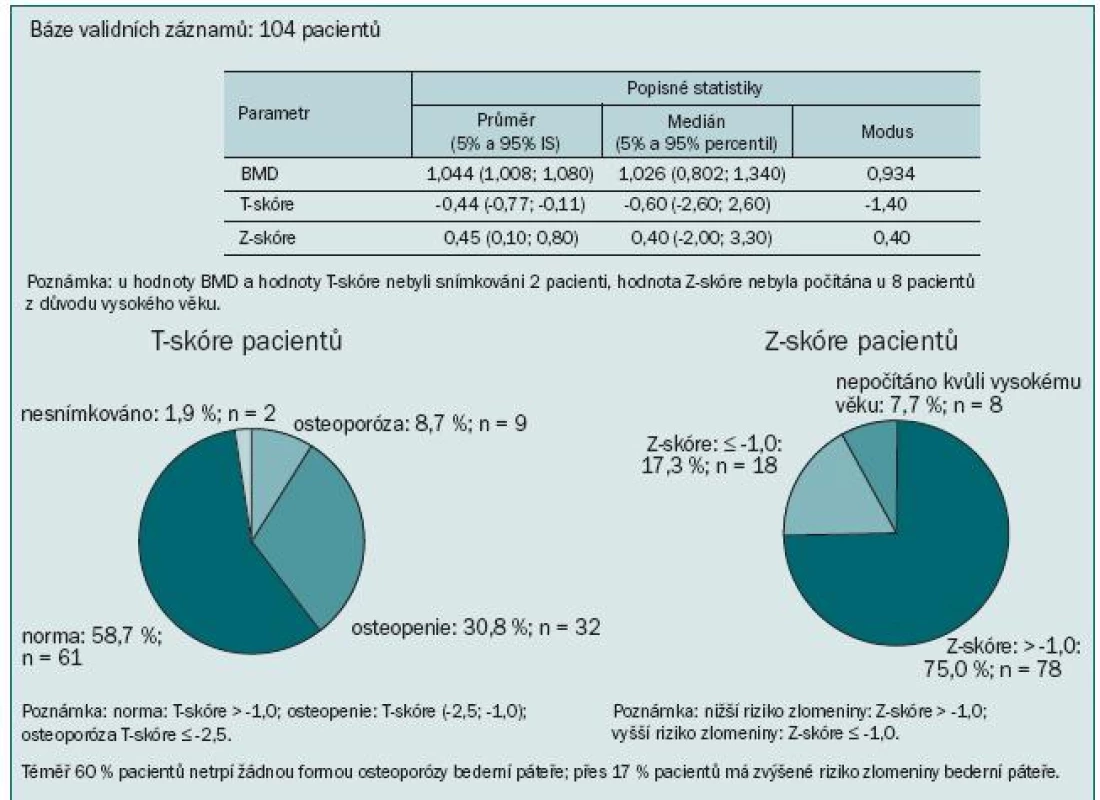
Výsledky ukázaly kostní postižení srovnatelné s literárními údaji: u 74 % pacientů jsme zaznamenali T-skóre -1,0 v oblasti páteře, proximálního femuru nebo krčku femuru, to znamená snížený úbytek kostní hmoty proti normě téměř u 3/4 pacientů. Z toho 17,3 % pacientů mělo BMD v rozmezí hodnot pro osteoporózu a 56,7 % pacientů mělo osteopenii. Obzvláště alarmující je více než 64% výskyt osteoporózy nebo osteopenie v oblasti krčku levé kosti stehenní. Průměrná hodnota BMD se pohybovala v této lokalizaci v oblasti osteopenie (obr. 5). Přitom většina patologických fraktur se vyskytuje v osteopenickém terénu. Ještě vyšší míru ohrožení jsme pozorovali při měření kostní denzity v distální třetině radia: T-skóre ≤ -2,5 svědčící pro osteoporózu jsme zaznamenali u 45 % pacientů a osteoporózu nebo osteopenii dokonce u 74 % (obr. 6). To je v souladu se známou skutečností, že Collesova fraktura patří mezi první známky osteoporózy. Mnohem závažnější však jsou kompresivní fraktury obratlů, obzvláště pokud vedou k míšní kompresi, a fraktury krčku kosti stehenní spojené s výrazným snížením kvality života, imobilizací a nutností hospitalizace.
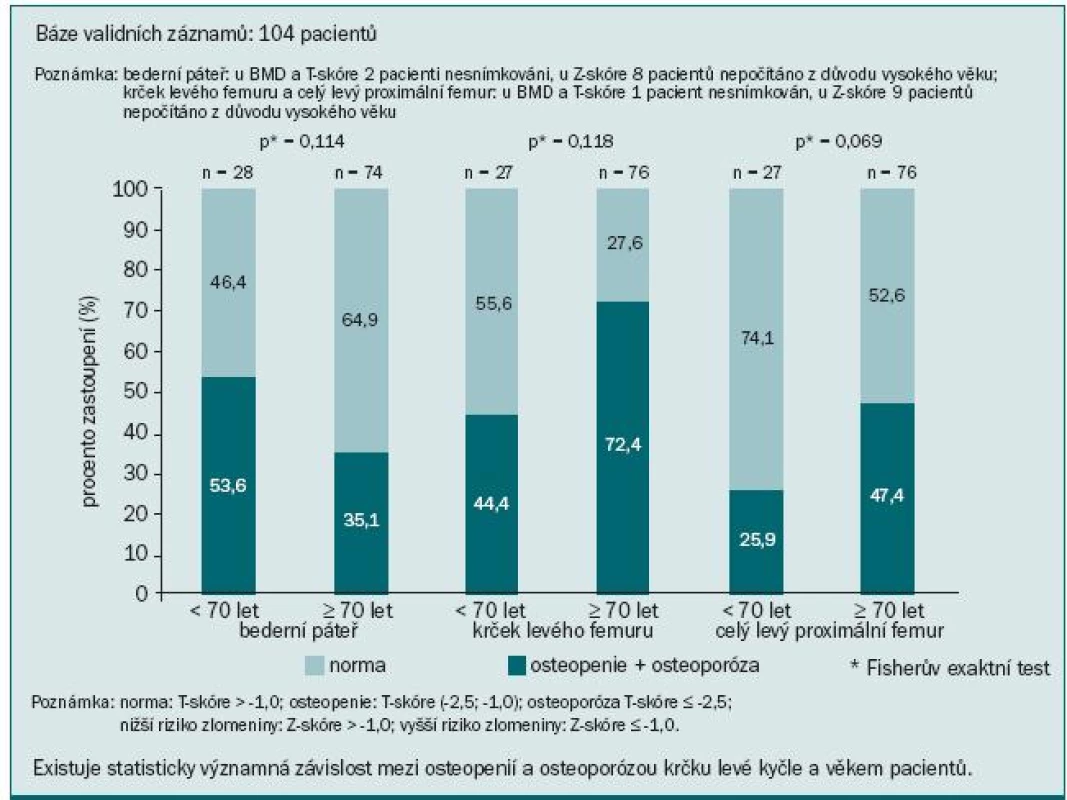
V naší populaci pacientů jsme pozorovali statisticky významnou závislost BMD krčku levé kyčle na věku: pacienti ve věku nad 70 let měli osteoporózu nebo osteopenii v 72,4 %, zatímco u pacientů do 70 let se tento nález vyskytoval jen v 44,4 % (p = 0,018) (obr. 7). Každý osmý pacient z našeho souboru měl zvýšené riziko fraktury krčku kosti stehenní a každý šestý měl zvýšené riziko kompresivní fraktury v oblasti L1–L4 páteře (obr. 8). Výsledky mohou být poněkud zkresleny dalšími faktory přispívajícími k rozvoji osteoporózy, jako např. komorbiditami, kouřením v anamnéze, výskytem osteoporózy v rodině, výchozí BMD, léčbou glukokortikoidy ap. Přesto je zřejmé, že naše vlastní klinické zkušenosti potvrdily četnost a závažnost této problematiky, stejně jako naléhavou potřebu věnovat jí daleko větší pozornost než doposud.
Bylo prokázáno, že fraktury jsou u pacientů s karcinomem prostaty spojené se sníženou kvalitou života a kratším přežitím [11,12]. Z uvedeného vyplývá přínos léčby, jež by dokázala snížit riziko patologických fraktur u těchto pacientů.
Denosumab – nová možnost léčby CTIBL
Od června roku 2010 je schválen první léčivý přípravek pro léčbu úbytku kostní hmoty – plně humánní protilátka denosumab cílená proti RANK ligandu. Působí inhibici RANK ligandu, a napodobuje tak funkci endogenního osteoprotegerinu. Podkladem pro registraci denosumabu byla dvojitě zaslepená studie fáze III s 1 468 pacienty publikovaná v roce 2009 v New England Journal of Medicine, v níž Smith demonstroval účinek denosumabu na kostní denzitu a incidenci vertebrálních fraktur u pacientů s nemetastazujícím karcinomem prostaty užívajícím kontinuální ADT po dobu 6 měsíců.
V jednom rameni byl podáván subkutánně denosumab v dávce 60 mg každých šest měsíců, v druhém rameni dostávali pacienti placebo. Primárním cílem studie bylo stanovení kostní denzity v bederní páteři po dvou letech, sekundárním cílem bylo určení BMD v ostatních lokalizacích a dopad na incidenci vertebrálních fraktur ve 24 měsících.
Během této doby došlo v rameni s denosumabem ke zvýšení BMD v oblasti bederní páteře o 5,6 %, v rameni s placebem došlo naopak k poklesu o 1,0 %. Rozdíl byl vysoce statisticky signifikantní (p < 0,001) od prvního měsíce až do ukončení studie. Obdobně byl v rameni s denosumabem signifikantně vyšší i nárůst kostní denzity v oblasti proximálního femuru, krčku kosti stehenní a distální třetiny radia ve srovnání s kontrolní skupinou. Nemocní, kteří dostávali denosumab, měli během 36 měsíců sníženou incidenci nových vertebrálních fraktur (1,5 % vs 3,9 % placebo) (RR = 0,38; 95% CI, 0,19–0,78; p = 0,006) [13].
Závěr
Hormonální ablace pacientů s karcinomem prostaty vede k velmi častému úbytku kostní hmoty, jenž ohrožuje pacienty patologickými frakturami a následným snížením kvality života a zvýšenou morbiditou a mortalitou. Monoklonální protilátka denosumab zvyšuje kostní denzitu, snižuje riziko vertebrálních fraktur, a představuje tak významný přínos v léčbě těchto pacientů.
prof. MUDr. Dalibor Pacík, CSc.1
as. MUDr. Vítězslav Vít1
prim. MUDr. Jana Katolická, Ph.D.2
RNDr. Jiří Jarkovský, Ph.D.3
1Urologická klinika LF MU, FN Brno
2Onkologicko-chirurgické oddělení, FN u sv. Anny Brno
3Institut biostatistiky a analýz, MU Brno
Urologická klinika FN Brno
Jihlavská 20, 625 00 Brno
dpacik@fnbrno.cz
Sources
1. ÚZIS ČR, Aktuální informace č. 6/2009.
2. Heidenreich A, Aus G, Bolla M et al. EAU guidelines on prostate cancer. Eur Urol 2008; 53 : 68–80.
3. Loblaw DA, Virgo KS, Nam R et al. Initial hormonal management of androgensensitive metastatic, recurrent, or progressive prostate cancer: 2006 update of an American Society of Clinical Oncology practice guideline. J Clin Oncol 2007; 25 : 1596–6050.
4. Bolla M. Adjuvant hormonal treatment with radiotherapy for locally advanced prostate cancer. Eur Urol 1999; 35 (Suppl 1): S23–S26.
5. Bolla M, Collette L, Blank L et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 2002; 360 : 103–108.
6. Messing EM, Manola J, Sarosdy M et al. Immediate hormonal therapy compared with observation after radical prostatectomy and pelvic lymphadenectomy in men with node-positive prostate cancer. N Engl J Med 1999; 341 : 1781–1788.
7. Higano CS. Side effects of androgen deprivation therapy: monitoring and minimizing toxicity. Urology 2003; 61 : 32–38.
8. Maillefert JF, Sibilia J, Michel F et al. Bone mineral density in men treated with synthetic gonadotropin-releasing hormone agonists for prostatic carcinoma. J Urol 1999; 161 : 1219–1222.
9. Cooper C. The crippling consequences of fractures and their impact on quality of life. Am J Med 1997 (suppl); 103 : 12S–17S.
10. Smith MR, Lee WC, Brandman J, Wang Q, Botteman M, Pashos CL. Gonadotropin-releasing hormone agonists and fracture risk: a claims-based cohort study of men with nonmetastatic prostate cancer. J Clin Oncol 2005; 23 : 7897–903.
11. Weinfert K, Li Y, Castel L et al. The impact of skeletal-related events on health-related quality of life of patients with metastatic prostate cancer. Ann Oncol 2002; 13 (suppl 5, abstr 662): 180.
12. Oefelein MG, Ricchiuti V, Conrad W et al. Skeletal fractures negatively correlate with overall survival in men with prostate cancer. J Urol 2002; 168 : 1005–1007.
13. Smith MR, Egerdie B, Toriz NH et al. Denosumab in Men Receiving Androgen-Deprivation Therapy for Prostate Cancer. N Engl J Med 2009; 361 : 745–755.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2011 Issue 1
-
All articles in this issue
- Technika odběru štěpu ze sliznice dutiny ústní při rekonstrukci močové trubice: hodnocení pooperačních komplikací a spokojenosti pacientů
- Léčba striktury uretry: dorzální lalok z bukální sliznice – zlatý standard
- Poranění močových cest a genitálu
- Neurourologické vyšetření a léčba
- Stresová močová inkontinence u žen: diagnostika a léčba na základě hodnocení AUA Guidelines
- Perkutánní nefrolitotomie (PNL): přehled užívaných technik a novinek v této oblasti
- Hormonální terapie při léčbě karcinomu prostaty: jak léčit karcinom a neuškodit pacientovi
- Úbytek kostní hmoty u androgen deprivační terapie: naléhavý problém pacientů s karcinomem prostaty – naše zkušenosti
- EAU Guidelines pro léčbu poranění močové trubice
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Léčba striktury uretry: dorzální lalok z bukální sliznice – zlatý standard
- Hormonální terapie při léčbě karcinomu prostaty: jak léčit karcinom a neuškodit pacientovi
- Poranění močových cest a genitálu
- Technika odběru štěpu ze sliznice dutiny ústní při rekonstrukci močové trubice: hodnocení pooperačních komplikací a spokojenosti pacientů