Současný pohled na léčbu malých nádorů ledvin
Current view on small renal masses
Renal cancers and their treatment represent a significant subfield of uro-oncology. Every single urologist, be it outpatient specialist or clinician, will deal with this condition during his/her practice. A large proportion of diagnostic and therapeutic approaches and monitoring methods are based on imaging. Radiological imaging methods are being continuously improved. Better availability of radiological imaging techniques has resulted in higher rate of small renal masses detection. These tumours are asymptomatic and usually detected incidentally during testing for different indication. Surgery is the standard treatment modality. Alternative options include less invasive approaches (ablation therapy); and conservative treatment is feasible in selected patient population with shorter estimated survival. The authors review current techniques for SRM treatment, their indications and outcomes. Furthermore they discuss the options and principles of active surveillance.
Key words:
small renal masses, ablation therapy, radiofrequency ablation, cryoablation, renal cancer biopsy, active surveillance
:
A. Čermák; D. Pacík; V. Vít
:
Urol List 2012; 10(3): 6-15
Nádory ledvin a jejich léčba zaujímají jednu podstatnou část uroonkologie. S touto problematikou se setkává každý urolog v průběhu své praxe, ať se jedná o ambulantního specialistu nebo lékaře klinického pracoviště. Velká část diagnostických, terapeutických postupů i sledování výsledků léčby se opírá o zobrazovací metody. Radiologické zobrazovací techniky jsou stále dokonalejší. Díky stále větší dostupnosti radiologických vyšetření je také detekován stále vyšší počet malých nádorů ledvin, které jsou asymptomatické a velmi často jsou detekovány jako vedlejší nález při vyšetřování z úplně jiné indikace. Standardní způsob léčby je chirurgický. Alternativními možnostmi malých nádorových lézí (SRM) jsou méně invazivní postupy (ablační terapie) a u vybrané skupiny pacientů s kratší dobou přežití je možná konzervativní léčba. Autoři předkládají přehled současných možností léčby SRM, jejich indikací a dosahovaných výsledků. Zabývají se také možnostmi a pravidly aktivního sledování.
Klíčová slova:
malé nádory ledvin, ablační terapie, radiofrekvenční ablace, kryoablace, biopsie nádoru ledviny, aktivní sledování
Nádory ledvin patří mezi třetí nejčastější uroonkologická onemocnění s nejvyšší incidencí na světě v ČR [1]. I přes nárůst detekce malých incidentálních nádorů je v současné době stále patrný poměrně vysoký záchyt také objemných nádorů. To je dáno dlouhým asymptomatickým průběhem onemocnění. Právě tyto objemné nádory udržují téměř stabilní úroveň mortality nádorů ledvin za poslední desetiletí. Mortalita nádorů ledvin narůstala strměji v rámci celé Evropy až do přelomu 80. a 90. let 20. století, od tohoto období se udržuje téměř na stejné úrovni. Standardizovaná úmrtnost na nádory ledvin u mužů byla v letech 1990–1994 4,8 na 100 000 obyvatel, o 10 let později 4,1 na 100 000 obyvatel. U žen úroveň mortality v odpovídajícím období poklesla o 17 % z 2,1 na 100 000 obyvatel na 1,8 na 100 000 obyvatel. K největšímu poklesu mortality došlo ve skandinávských zemích a částečně v zemích západní Evropy, v zemích východní Evropy se jednalo spíše jen o stabilizaci úrovně mortality. V ČR se mortalita v období roků 2000–2004 pohybovala na úrovni 11/100 000 obyvatel při incidenci 27/100 000 obyvatel [2].
Vzrůstající počet detekovaných malých ledvinných lézí (SRM – Small Renal Masses) s různou histologickou skladbou a s různým biologickým chováním je trend pozorovaný již několik let. Ložiskové léze jsou detekovány různými metodami. S vývojem modernějších a přesnějších zobrazovacích metod je detekováno stále více SRM.
Nádory ledvin vykazují radiorezistencii chemorezistenci. Základní metodou léčby karcinomu ledviny, a to jak u lokalizovaného, tak i u metastatického karcinomu ledviny je léčba chirurgická. Pro malé nádory ledvin (T1a) zůstává nadále standardní léčbou resekční výkon s šetřením ledvinného parenchymu vždy, když je to technicky možné. Výkon nelze však vždy provést u starších nemocných s četnými komorbiditami, jejichž celkový stav to nedovoluje. Resekční výkon rovněž neumožňuje nevhodné umístění nádoru [3] nebo komplikované anatomické poměry. Proto byly hledány miniinvazivní metody, které ničí nádorovou tkáň a šetří paren-chym. To je důležité především u nádorů ledvinách s chronickou renální insuficiencí (CHRI).
MALÉ NÁDORY LEDVIN
V posledních dvou dekádách lze sledovat ročně 2% nárůst incidence renálních karcinomů (RCC). Tento trend je pozorován v Evropě i v Severní Americe [4,5]. Nárůst incidence je především z důvodu detekce malých nádorů ledvin u asymptomatických pacientů, kteří jsou vyšetřeni pro nespecifické abdominální potíže nebo poruchy muskuloskeletálního aparátu. Druhou velkou skupinou záchytu jsou pacienti, kteří se podrobují pravidelnému screeningovému vyšetření pro jinou malignitu [6]. Většina lézí je detekována ultrazvukovým vyšetřením (UZ). K přesnému zhodnocení solidní nebo cystické formace, velikosti, tvaru, invaze a „enhancement“ je však potřebné vyšetření multidetektorovou počítačovou tomografií (CT) nebo magnetickou rezonancí (MR) s aplikací kontrastní látky. Malé nádorové léze (SRM) jsou definovány jako ložiskové postižení ledviny, které se zvýšeně vysycuje kontrastní látkou a největší rozměr je ≤ 4 cm [7].
Histologická skladba SRM je heterogenní. Některé SRM vykazují i přes své malé rozměry agresivní chování. Analýza databáze SEER (Surveillance Epidemiology and End Results) 1998–2003 ukázala 5,2% prevalenci metastazování u 8 792 pacientů RCC ≤ 4 cm, s nárůstem metastazování o 3,5 % na každý nárůst velikosti tumoru o 1 cm [8]. Naopak přibližně 20–25 % radiologicky podezřelých ložisek jsou benigní léze [9].
Základní metodou léčby karcinomu ledviny, a to jak u lokalizovaného, tak i u metastatického karcinomu ledviny, je léčba chirurgická. Nádory ledvin vykazují radiorezistenci i chemorezistenci. Proto chirurgická resekce zůstává nadále standardní léčbou i pro malé nádory ledviny (T1a). Nelze ji však provést u starších nemocných s četnými komorbiditami, jejichž celkový stav nedovoluje chirurgický výkon. Resekční výkon rovněž nedovoluje nevhodné umístění nádoru [3]. Proto byly hledány miniinvazivní metody, které ničí nádorovou tkáň a šetří parenchym. To je důležité především u nádorů ledvin s chronickou renální insuficiencí (CHRI).
Vzrůstající počet lokalizovaných nádorových onemocnění ledvin v posledních dvou dekádách a úmrtnost na toto onemocnění vede k hodnocení současných léčebných postupů. Standardní metodou malých ložiskových lézí je chirurgické odstranění nádoru se snahou o postup šetřící ledvinný parenchym. Urologové stále hledají alternativní metody ke klasické chirurgické léčbě. Hledají takové postupy, které by byly méně agresivní, méně zatěžující pacienta nebo metody, které lze využít u stavů, kdy klasické či laparoskopické metody jsou neúměrnou zátěží.
Alternativou k chirurgické léčbě malých ledvinných nádorů je snaha využít zejména různých fyzikálních principů vedoucích k destrukci tumoru. Tyto metody se aplikují laparoskopicky nebo perkutánně. Nejužívanější metodiky, nejvíce se blížící klinické praxi, jsou kryoablace a radiofrekvenční ablace. Zkouší se i fokusovaný ultrazvuk vysoké intenzity, mikrovlnná termoterapie, intersticiální fotonová iradiace nebo laserová intersticiální ablace. Tyto nové metody by současně měly být svou účinností srovnatelné s klasickou chirurgií. S postupujícím časem a zdokonalováním technik se hodnotí dlouhodobé výsledky, výhody i nevýhody a jasněji se definují důkazy, kdy a jaký postup přináší efektivitu. Alternativní, méně invazivní metody jsou možným řešením u vybraných skupin vysoce rizikových pacientů se záměrem snížit jejich morbiditu.
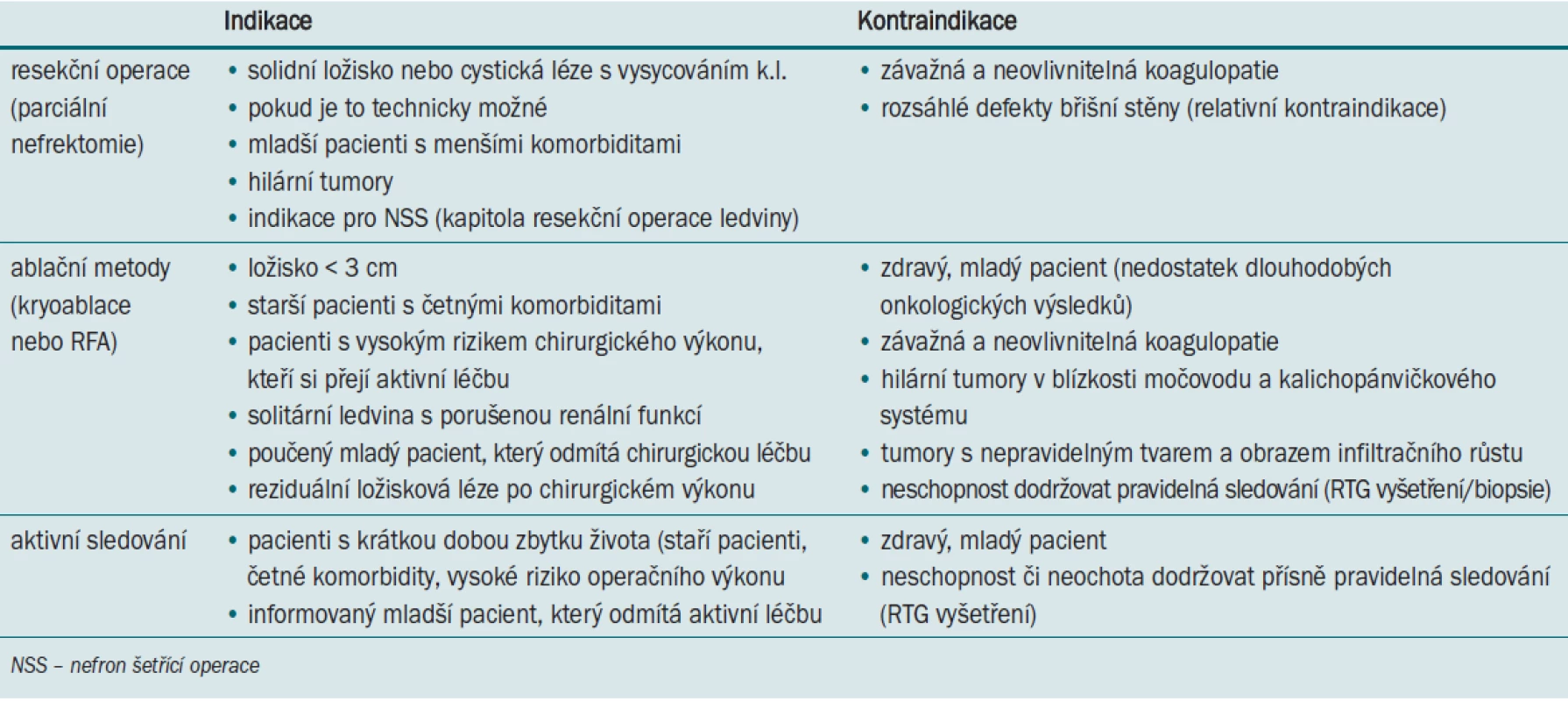
Podle doporučených postupů Americké urologické asociace (AUA Guidelines) je základní doporučenou metodou léčby SRM renálních tumorů klin. st. T1 chirurgický výkon.
Léčba renálních tumorů klin. st. T1 → nefron šetřící operace (NSS).
Alternativní léčba → ablační techniky.
CHIRURGICKÁ LÉČBA
Resekce ledviny
Historicky byla metodou léčby SRM radikální nefrektomie. Nefron šetřící operace (NSS) byla doporučena při detekci SRM 1. u anatomicky nebo funkčně solitární ledviny (absolutní indikace); 2. u pacientů s kontralaterální ledvinou, u níž lze předpokládat v budoucnosti poškození funkce; 3. v případě multiplicitního, bilaterálního nádorového postižení nebo u hereditární formy RCC s vysokým rizikem vzniku nádoru v kontralaterální ledvině (relativní indikace) [10]. V posledních letech je příklon k rozhodování o zvýšení indikací k provádění resekčních výkonů u lokalizovaných RCC i se zdravou kontralaterální ledvinou (elektivní indikace).
Onkologické výsledky
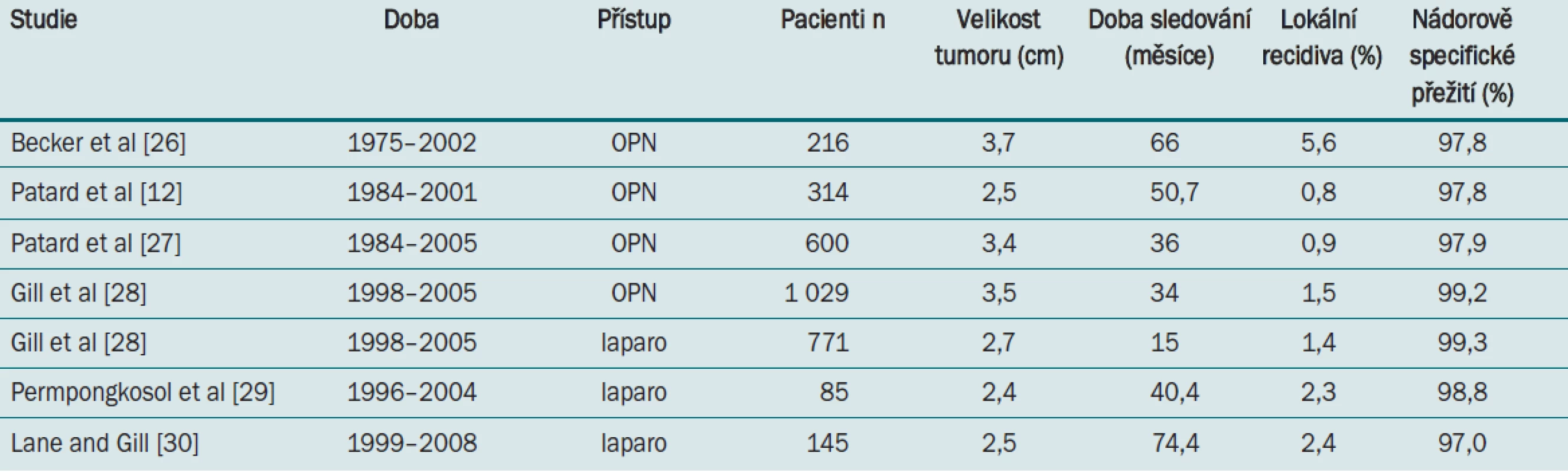
Nedávné publikované výsledky EORTC randomizované fáze 3 a zhodnocení řady nerandomizovaných studií prokázaly porovnatelné výsledky nádorově-specifického přežití u NS a radikální nefrektomie u SRM. U 541 pacientů (průměrná doba sledování 9,3 roku) došlo k nádorem podmíněné smrti u čtyř pacientů (RANE) a u osmi pacientů (NSS). Při omezené výpovědní hodnotě souborů s malým počtem pacientů nebyla prokázána u resekčních operací vyšší nádorově-specifická mortalita (p = 0,23) [11]. Podobně Patard et al hodnotili tumor-specifické přežití u 1 454 pacientů s karcinomem ledviny T1 N0 M0 a neshledali statisticky významný rozdíl mezi NSS a RANE [12].
Šetření renálních funkcí
Zvyšující se počet elektivních indikací pro NSS je dán i faktem, že chronická renální insuficience (CHRI) je všeobecný medicínský problém. CHRI je definována jako pokles glomerulární fitrace GFR < 60 ml/min na 1,73 m2. Známé jsou též negativní vlivy na kardiovaskulární systém (ischemická choroba srdeční, srdeční selhání, cévní mozková příhoda, onemocnění periferního cévního systému) negativní vlivy na vyšší četnost hospitalizací a úmrtí u těchto pacientů [13]. Šetření funkčního parenchymu a zajištění dobrých renálních funkcí je prvořadým cílem při dodržení zásad onkologické bezpečnosti u všech pacientů i u těch s normálními hodnotami kreatininu. Analýza databáze SEER (Surveillance Epidemiology and End Results) ukázala, že pacienti podstupující resekční operaci měli menší počet komplikací, menší počet renálních selhání, menší počet hemodialýz, menší počet chirurgických intervencí v souvislosti s hemodialýzou či peritoneální dialýzou a menší počet renálních transplantací [14]. Podle dat získaných ze SEER u pacientů > 66 let léčených pro RCC velikosti < 4 cm vykazovala radikální nefrektomie celkově vyšší mortalitu (HR: 1,38; p < 0,01) (HR – Hazard Ratio) a 1,4× vyšší riziko kardiovaskulárních komplikací [15]. Poměrně překvapivá zpráva je, že i u neočekávaně benigní histologie byly resekční operace spojeny s lepším celkovým přežitím [16].
Současné doporučené postupy (parciální nefrektomie)
Na základě onkologických a funkčních výsledků je parciální nefrektomie (PN) doporučována v současné době a v současném textu doporučených postupů Evropské urologické asociace (EAU Guidelines) a Americké urologické asociace (AUA). PN je v současné (2012) verzi doporučována jako metoda volby solitárních nádorů ledviny do velikost < 7 cm, vždy když je to technicky možné [17,18]. Nehledě na rozšiřování indikačních kritérií pro PN a na rozdíl od doporučení řady urologických organizací a skupin není provádění PN tak časté, jak by se dalo očekávat. Ačkoli podle zdroje SEER dochází v poslední dekádě k signifikantní změně poměru PN vs RANE, zůstává v USA stále 55 % renálních tumorů řešeno radikální nefrektomií [19]. V současné době je PN mnohem častěji využívána v univerzitních nemocnicích a výukových centrech s velkými objemy operovaných pacientů. Nedávný přehled v USA prokazuje, že PN je prováděna u malých, méně exofytických nebo polárních SRM.
Komplikace
Četnost komplikací je mírně vyšší u PN ve srovnání s radikální nefrektomií (otevřené operace). Prospektivní srovnávací studie otevřených operací odhalily vyšší četnost krvácení u NSS oproti RANE (3,1 vs 1,2 %). Urinózní pištěl byla u PN pozorována ve 4,4 % případů. Poranění pleury a sleziny byly v obou skupinách srovnatelné. Pooperační CT vyšetření prokázalo abnormality v 5,8 % u NSS a ve 2,0 % RANE. Reoperace pro komplikace byla u NSS ve 4,4 % a ve 2,4 % u RANE [20].
Vliv doby ischemie na renální funkci
Dočasný uzávěr hilových cév při otevřené PN je spojen se signifikantně vyšší četností komplikací. Míra renálního selhání je úměrná délce ischemie. Sledováním scintigrafického vyšetření operované ledviny ledviny při kontralaterálně zdravé ledvině byly sledovány rozdíly v době teplé ischemie < 25 min a > 25 min (87,4 vs 61,8 % a 94,4 vs 70,9 %) jeden týden a šest měsíců po operaci [21]. V rozsáhlé multicentrické studii u solitární ledviny byl čas teplé ischemie > 20 min a čas studené ischemie > 35 min spojen s vyšší četností renálního selhání, nárůstem kreatininu a častější nutností chronické dialýzy [22]. Poslední studie poukazují na skutečnost, že parciální nefrektomie i s délkou teplé ischemie > 35 min je spojena s lepšími funkčními výsledky než radikální nefrektomie. Výsledky zkoumání resekcí u solitární ledviny předpokládají, že rozhodujícím faktorem pro výslednou funkci je množství ponechaného funkčního parenchymu, zatímco způsob ošetření (teplá ischemie) má menší význam. Samozřejmě je sledováno, že každá ušetřená minuta teplé ischemie má vliv na lepší funkční výsledek a výhodou je užití hypotermie.
Pozitivní chirurgické okraje
Základním požadavkem pro snížení rizika lokální recidivy při NSS je dosažení negativních chirurgických okrajů. Zdá se, že tloušťka negativního okraje kolem resekovaného tumoru nemá vliv na onkologické výsledky [23]. Carini et al retrospektivně zkoumali střednědobé onkologické výsledky u 232 SRM s provedenou prostou enukleací. Pří délce průměrného sledování 76 měsíců u 13 pacientů (6,4 %) pozorovali progresi nádorového onemocnění a v žádném případě nenalezli lokální recidivu v lůžku po resekci [23].
V evropské studii (Bensalah [24]) bylo retrospektivně zkoumáno 111 pacientů s pozitivním chirurgickým okrajem a porovnáno s pacienty s negativní nesekční linií. Pacienti s pozitivním okrajem měli stejnou dobu přežití bez recidivy onemocnění stejně jako u negativních okrajů. Signifikantním predikátorem pro lokální recidivu byla indikace a lokalizace tumoru, ale nikoli pozitivní chirurgický okraj [24]. Pacienti s pozitivním chirurgickým okrajem po PN mohou být sledováni a další chirurgický výkon (obvykle nefrektomie) je indikován až při jednoznačných radiologických známkách lokální recidivy.
Laparoskopická resekce ledviny
Laparoskopická parciální nefrektomie (LPN) je alternativou k otevřené PN, ale pouze v rukou zkušeného laparoskopisty. LPN může být provedena transperitoneálně nebo retroperitoneoskopicky, v závislosti na lokalizaci tumoru a chirurgových zkušenostech. Transperitoneální i retroperitoenoskopický přístup má podobné výsledky, co se týče krevních ztrát, potřeby analgetik a výskytu komplikací. Transperitoneální přístup je častěji využíván u větších tumorů, což vysvětluje delší operační čas, delší dobu teplé ischemie a dobu hospitalizace [25]. Dlouhodobé onkologické výsledky LPN a otevřených resekcí jsou srovnatelné. Také četnost pozitivních chirurgických okrajů se neliší.
Největší srovnávací studie LPN a OPN porovnala 771 pacientů operovaných laparoskopicky a 1 028 pacientů řešených otevřenou resekcí ledviny. Pacienti postupující OPN měli vyšší riziko operace většího nádoru, vyšší procento symptomatických pacientů, pacientů s renální insuficiencí a vyšší četnost nádorů v solitární ledvině. Přesto tato studie přinesla důležitou informaci, že laparoskopická resekce měla kratší operační čas, menší množství krevních ztrát a kratší dobu hospitalizace ve srovnání s otevřenou technikou. Na druhou stranu laparoskopie je zatížena signifikantně vyšším počtem komplikací a vyšším počtem vynucených výkonů k řešení komplikací. Zvláště výskyt pooperačního krvácení byl u LPN signifikantně vyšší [28]. Simon a Gill poukázali na skutečnost, že snížení počtu komplikacích po LPN lze dosáhnout pouze po odpovídající důkladné „learning curve“ (> 200 případů) [31].
Porpiglia et al sledovali prospektivně vliv času teplé ischemie (WIT) na renální funkci. Hodnocením sérového kreatininu, kreatininové clearence a renální scintigrafie došli k zjištění, že doba WIT > 30 min vede k signifikantnímu poškození funkce ledviny, které je jen částečně reverzibilní. Z toho důvodu by všechny terapeutické postupy a inovace měly být zaměřeny na zkrácení doby WIT < 30 min, aby bylo dosaženo základního předpokladu pro možnost ochrany renální funkce. S tímto cílem bylo vypracováno a je používáno v laparoskopii několik postupů. V nedávném sdělení popsali Gill et al zkušenosti a výsledky techniky s časným uvolněním renálního hilu. Uzavření hilových cév používají pouze po dobu excize nádoru a naložení počátečního pokračovacího stehu na dřeň ledviny. Všechny další stehy v lůžku resekované ledviny včetně parenchymových hemostatických stehů a uzávěr kalichopánvičkového systému prová-dějí již na perfundované revaskularizované ledvině. Tato technika byla použita na 235 pacientech a umožnila zkrácení WIT z průměrné doby 31,9 min na 14,4 min (p < 0,0001) a umožnila signifikantně snížit počet urologických komplikací bez ohledu na komplexnost tumoru. Kratší WIT umožnila dosažení zlepšení funkčních výsledků a zlepšení glomerulární filtrace [32]. V poslední době Gill referoval své zkušenosti s nulovou dobou WIT při laparoskopické resekci. Tuto techniku používá i při řešení komplexních tumorů. Metoda zahrnuje dvě inovace: 1. anatomickou mikrodisekci se superselektivní izolací vyživujících cév pro tumor nebo preparaci větvících cév (terciární či vyšší úroveň dělení) a jejich uzavření neurochirurgickými mikro-bulldog svorkami; 2. vytvoření přechodné kontrolované hypotenze. Všechny případy byly řešeny úspěšně bez uzavření hilu. Průměrné krevní ztráty byly 150 ml a nevyskytly se žádné intraoperační komplikace. Žádný pacient nepotřeboval krevní transfuzi. U dvou pacientů se vyskytla urinózní sekrece, která spontánně vymizela [26]. Tato inovativní technika však vyžaduje multicentrickou studii ke zhodnocení, zda je vůbec proveditelná méně zkušenými laparoskopisty.
Roboticky asistovaná resekce ledviny
Roboticky asistovaná parciální nefrektomie (RAPN) umožňuje stereoskopický obraz se zvětšením. Jemnost zobrazovaných struktur vyladěná s jemností pohybu nástrojů umožňuje chirurgovi dosáhnout vyššího stupně preciznosti a zejména šetrnosti prováděné preparace.
Lepší preparace tumoru je umožněna použitím instrumentů disponujícími kloubním zahnutím a trojrozměrnou vizí a snazším uzavřením rozsáhlejších rekonstrukčních operací zasahujících do renálního hilu a vývodných cest. Kloubové mechanizmy umožňují oproti klasické laparoskopii daleko větší a flexibilnější rozsah použití nástrojů.

Nejvýznamnějším benefitem robotického přístupu je zcela jasně kratší doba teplé ischemie. Zkrácení ischemie má nesmírný význam, neboť WIT představuje rizikový faktor, který má vliv na funkci zbývající části ledviny [34]. Ve všech studiích (vyjma dvou) byl robotický přístup spojen s kratší WIT, tento výkon byl významně kratší v pěti z celkem devíti studií. Gill et al uvádí nejkratší WIT: 14 min při užití techniky bez použití svorek během LPN [35]. Není zatím zřejmé, zda zkrácení WIT při robotickém přístupu ovlivňuje funkci ledviny z dlouhodobého hlediska. Další ze sledovaných výhod, které pravděpodobně poskytuje RAPN, je kratší délka hospitalizace: tři studie prokázaly statisticky významně kratší délku hospitalizace při RAPN. Chirurgické okraje: v pěti studiích byl zaznamenán výskyt pozitivních chirurgických okrajů, ve všech případech s nevýznamnou p-hodnotou. Srovnatelná byla i četnost výskytu komplikací. Bylo prokázáno, že radikální nefrektomie/ /parciální resekce ledviny dosahují srovnatelných onkologických výsledků, proto když uvážíme podobnou povahu obou výkonů, lze předpokládat, že RAPN bude dosahovat srovnatelných výsledků jako LPN. V případě LPN je i po zjištění pozitivních chirurgických okrajů míra recidivy velmi nízká. Podobný výsledek lze tedy očekávat u RAPN [36].
Další nespornou výhodou RAPN je rychlejší učební křivka pro operatéry s menšími zkušenostmi s laparoskopickou technikou. Rogers et al zjistili, že parciání resekce ledviny není dostatečně využívána a u části pacientů s malými tumory je nadále indikována radikální nefrektomie [34]. Tato skutečnost je pravděpodobně zapříčiněna tím, že velký objem tumorů ve stadiu T1 je léčen mimo centra se zkušenostmi s minimálně invazivními technikami.
Díky zvyšující se popularitě roboticky asistované operace [34] může robotická technologie zajistit rozšíření počtu parciálních resekcí ledvin. Význam některých z potenciálních benefitů RAPN vs LPN byl ve zkoumaných komparativních studiích pravděpodobně potlačen, neboť většina autorů má bohaté zkušenosti s laparoskopickým přístupem. Lze předpokládat, že zejména v centrech s menším objemem pacientů může robotický přístup podnítit přechod od otevřené k minimálně invazivní nefron šetřící operaci. Robot usnadňuje minimálně invazivní preparaci méně zkušeným urologům, ale přináší potenciální výhodu i operatérům se značnými zkušenostmi s laparoskopickými technikami. Robotický přístup umožňuje provedení parciální resekce ledviny i u hlouběji lokalizovaných a složitějších renálních tumorů, u nichž by byl při laparoskopii nutný přechod k otevřené operaci.
Základní nevýhodou RAPN technologie může být její cena. V jediném dosud provedeném srovnání cenové výhodnosti technik uvádí Mir et al, že RAPN je mnohem dražší než otevřená operace i LPN, průměrné náklady jsou následující: 11 962 USD RAPN, 11 427 USD OPN a 10 311 USD LPN [37,38]. Většina finančních analýz je však velmi zjednodušená a zohledňuje pouze některé proměnné jako délku operace a hospitalizace. Zejména obtížné je hodnocení nepřímých nákladů. Amortizace, vyjednávání smlouvy a objem případů patří mezi řadu skrytých faktorů, které jsou zohledňovány jen výjimečně. Finanční výhodnost, či nevýhodnost je obhajována prizmatem pohledu „vlastníka“ robota nebo nedostupnosti technologie a nemusí být vždy objektivní. Touto problematikou je nutné se dále zabývat. V každém případě je při posuzování výsledků důležité předkládat objektivní a pravdivé funkční i onkologické výsledky a porovnávat porovnatelné.
Radikální nefrektomie
Indikace otevřené radikální nefrektomie (RANE) jsou při léčbě malých renálních tumorů velmi omezené. Proto záchovná operace (tzv. NSS – Nephron Sparing Surgery) – chirurgická resekce ledviny, heminefrektomie a enukleace tumoru zůstávají nadále standardní léčbou i pro malé nádory ledviny (T1a). RANE je doporučena v podstatě pouze v případě, kdy urolog usoudí, že resekční výkon není technicky proveditelný nebo je rizikový. Před rozhodnutím o RANE v případě SRM by měly být zváženy i další, nechirurgické ablační metody i možnost aktivního sledování (AS). Laparoskopická radikální nefrektomie (LRN) dosahuje dlouhodobě stejné výsledky onkologické jako RANE. LRN má výhodu v kratší době hospitalizace, kratší době rekonvalesecence, menších krevních ztrátách a menší spotřebě analgetik. V omezených případech, kde je u léčby SRM indikována radikální nefrektomie, by měla být upřednostněna LRN. Výhody méně invazivní laparoskopie (radikální výkon) však nesmí vést ke snížení počtu indikací NSS při léčbě malých nádorů ledvin. Resekční výkon prováděný laparoskopicky je obtížnější než otevřenou cestou. Urologická veřejnost by měla být poučena, že v současné době je OPN a nikoli LRN správnou metodou léčby SRM, jestliže není k dispozici specializované centrum s možností provést laparoskopickou PN.
ABLAČNÍ METODY
Termální ablace
- radiofrekevenční ablace (RFA)
- mikrovlnná termoterapie (MT)
- intersticiální laserová ablace (LITT)
- fokusovaný ultrazvuk (HIFU)
Intersticiální fotonová radiační ablace (PRS)
Kryoablace (CA)
Ireverzibilní elektroporace (IRE)
Jednotlivé ablační metody (AT) jsou detailně popsány v kapitolách Hora et al – Miniinvazivní ledvinu šetřící ablační metodiky v léčbě nádorů ledvin [39], Čermák et al – Radiofrekvenční ablace nádorů ledvin [40] a Čermák A, Pacík D – Minimálně invazivní, ablační techniky při léčbě malých renálních tumorů [41].
Radiofrekvenční ablace
Radiofrekvenční ablace je alternativní metoda léčby SRM. Další srovnatelnou metodou je kryoablace (CA). RFA je méně invazivní technika vhodná pro léčbu většiny malých (< 3 cm) ložisek „low-grade“ nádorů u pacientů rizikových pro chirurgickou léčbu, kteří ale nejsou vhodní pro aktivní sledování. Pacienti musí souhlasit s pravidelným a dlouhodobým sledováním a s nutností provádění opakovaných radiologických vyšetření.
Princip RFA
Princip RFA spočívá v přeměně elektrického napětí o vysoké frekvenci (375–480 KHz) na tepelnou energii prostřednictvím pohybu iontů ve tkáních obklopujících elektrody.
Působení vysoké teploty způsobuje poškození tumoru. Zvýšená teplota způsobuje denaturaci proteinů, narušení buněčné membrány a v konečné fázi koagulační nekrózu a buněčnou smrt.
Teplota potřebná pro RFA je > 60 °C (na hrotu hrotu jehly a několik mm v jeho okolí teplota přesahuje > 100 °C)
Čím vyšší je teplota v cílové tkáni, tím kratší je doba nezbytná pro ablaci.
> 50 °C proces trvá 4–6 min
> 60 °C okamžitá destrukce
> 105 °C → vypařováni → vznik plynu → zuhelnatění tkáně, které může zamezit účinnému provedení ablace.
Mechanizmus působení RFA
Působením teploty vzniká mikrovaskulární buněčný otok, který vede k vaskulárnímu poškození. Intravaskulární trombóza a přilnutí neutrofilů k venóznímu endotelu způsobí pokles mikrovaskulární perfuze (během RFA) a k přerušení vaskulárního zásobení (po RFA). Jako další mechanizmus účinku byla popsána imunologická modulace.
Přístupy k provedení RFA
Možnosti přístupu k provedení RFA jsou cesty: otevřená, laparoskopická (LRFA) nebo perkutánní (PRFA). Laparoskopický přístup umožňuje izolovat tumor a současně se vyhnout poranění okolních orgánů. Perkutánní přístup je preferován pro svu nejmenší invazivitu. Výhodou je, že se provádí pouze v analgosedaci.
Ideální ložisková léze k RFA je solidní a denzní ložisko s periferní a exofytickou lokalizací.
Kryoablace
Mechanizmus působení kryoablace
Renální kryoablace (CA) využívá vlastnosti nízké teploty. Při teplotách < –70 °C dochází k ireverzibilní buněčné smrti. Rozmrazování na teploty –20 °C zvyšuje účinnost dosažení buněčné smrti celé ložiskové léze SRM. CA vykazuje tři mechanizmy působení:
- Okamžité poškození vzniká působením ledu na tkáň. Zvýšení osmolarity v extracelulárním prostoru vede k přesunu tekutiny z buněk do extracelulárního prostoru a způsobí poškození buňky. Extracelulání krystaly mohou mechanicky poškozovat buněčnou membránu. Vznikají také intracelulární krystaly.
- K ischemickému poškození tkáně dochází v časovém rozmezí hodin–dnů pod obrazem koagulační nekrózy.
- Imunomodulační poškození. Antigeny uvolněné poškozenou tkání mohou senzitizovat imunitní systém hostitele.

Přístup k provedení CA může být opět otevřený, laparoskopický nebo perkutánní. Nejčastěji používaným a nejvýhodnějším přístupem je laparoskopický, protože umožňuje lokalizaci tumoru a opticky lze sledovat nárůst „ice-ballu“. Laparoskopická UZ sonda umožňuje přesné monitorování rozsahu „ice-ballu“. Má charakter hypoechogenní léze s akustickým stínem.
Obecně lze říci, že pro laparoskopický přístup jsou nejvhodnější tumory na předním rtu ledviny, v horním pólu ledviny a nádory s mediální lokalizací v blízkosti močovodu.
Pro perkutánní AT jsou vhodné lokalizace na zadním rtu ledviny, endofyticky rostoucí centrální a hilární tumory.


Efektivita ablačních metod (AT)
Úspěšnost RFA, podobně jako CA, závisí na velikosti a lokalizaci tumoru. Velikost je významným prediktorem úspěchu. U tumorů velikosti < 3 cm lze téměř ve všech případech dosáhnout kompletní ablace během jediného cyklu. U tumorů velikosti 3–5 cm klesá pravděpodobnost kompletní ablace na 50 % a u tumorů o velikosti > 5 cm dokonce na 25 %. Při PRFA je možné jednotlivé cykly v rámci jediného výkonu opakovat. U centrálně lokalizovaných tumorů je míra kompletní ablace v důsledku efektu „tepelného rezervoáru“ mnohem nižší.
Zhodnocení úspěšnosti AT
Pokud není provedna biopsie po výkonu, provádí se sledování pomocí radiologických zobrazovacích metod. Nejčastěji se kontroluje nález pomocí CT nebo MR. Nejpřesnějšího hodnocení vývoje v čase je dosaženo, pokd je sledování prováděno stejnou metodou a nejlépe i na stejném pracovišti s archivací snímků k retrospektivnímu hodnocení. Známkou úspěšné léčby je vymizení vysycování kontrastní látky „no-enhancement“.
Ogan et al použili radiografická kritéria pro zhodnocení výsledků léčby po RFA. Léč̌ili 15 pacientů̊ s malým (menším než 4 cm) renálním tumorem a sledovali pacienty pomocí CT po 6 týdnech, 3, 6 a 12 měsících a každých 6 měsíců bě̌hem následující doby. Stanovili si kritéria pro úspě̌šnou ablaci léze jako lézi s okrajem normálního parenchymu bez „enhancement“ (méně̌ než 10 Hounsfieldových jednotek) při sledování zobrazovacím vyšetřením s použitím kontrastní látky [42].
Srovnání RFA a kryoablace
Retrospektivní nekontrolované studie předpokládají, že v provnání s RFA může kryoablace nabídnout menší potřebu doplňujících výkonů (reablací) a vykazuje nižší četnost lokálních recidiv. Nicméně proměnné, jako jsou chirurgický přístup (laparoskopický vs perkutánní), funkční zdatnost/nedostatečnost parenchymu, anestezie (celková vs analgosedace) a odbornost lékaře (intervenční radiolog vs urolog) mohou významně ovlivnit výsledky každé metody. Perkutánní biopsie s „fine--needle“ aspirací, nebo bez ní by měla být provedena vždy před samotnou ablací k určení histologického typu nádoru. Postablační biopsie by měla být provedena v případě podezření na nekompletní destrukci tkáně nebo při podezření na lokální recidivu.
Úspěšnost ablačních metod prokázaná histologicky byla podle studie Weighta et al 93,8 % (CA) a 64,8 % (RFA) [43]. Metaanalýza 99 pacientů prokázala lokální recidivu u 4,6 % (CA) a u RFA dosáhla 11,7 %. Obě metody vykazovaly signifikantně vyšší četnost lokálních recidiv ve srovnání s NSS [44].
AKTIVNÍ SLEDOVÁNÍ
Termín a definice aktivního sledování, známky progrese SRM
Aktivní sledování (AS) je definováno jako monitorování velikosti tumoru pravidelným scanováním zobrazovacími vyšetřeními (UZ, CT nebo MR) s odložením intervence do momentu, kdy začne docházet k progresi onemocnění. Progrese SRM během aktivního dohledu (AS) je obecně definována jako zdvojnásobení objemu tumoru za dobu kratší < 12 měsíců, nárůst průměru nádoru na hodnotu rizikovou pro vznik metastáz (3–4 cm) a/nebo detekce nových nádorových symptomů [45].
Filozofie a zdůvodnění konzervativního přístupu k onemocnění SRM je založena na hypotéze, že aktivní léčba malých nádorů ledvin nemusí mít vliv na celkové přežití. Týká se to především starších pacientů a pacientů s vážnými komorbiditami a předpokládanou kratší dobou přežití. Určitá nezanedbatelná část SRM jsou benigní tumory nebo karcinomy s relativně příznivou biologickou povahou. Studie zabývající se problematikou SRM prokázaly, že mortalita po chirurgické léčbě benigních SRM má souvislost s věkem a komorbiditami. Studie na 26 618 pacientech, kteří byli léčeni chirurgicky pro lokalizovaný karcinom ledviny, ukázala, že mortalita vzrůstala v závislosti na věku, ale nesouvisela s velikostí nádoru (u pacientů > 70 let morbidita dosahovala 28,2 %) [46].
Počáteční zkušenosti ukazovaly, že nárůst velikosti SRM během AS je značně proměnná, obvykle pomalá a nemá vztah k původní velikosti tumoru.
Při volbě zařazení pacientů do AS protokolu je nejvýznamnějším kritériem riziko progrese onemocnění do metastazujícího stadia. Smaldone v systematickém přehledu z celkem 880 pacientů se SRM, kteří podstoupili AS, odhalili 18 pacientů, u nichž došlo ke vzniku metastáz (2,1 %) [5,26–28,30,32,33,36–38]. Důležité je, že ke vzniku metastáz došlo až v poz-dější fázi (průměr 40,2 měsíců, rozmezí 12–132 měsíců). Pacienti, u nichž došlo ke vzniku metastáz, měli obvykle větší tumor (4,1 vs 2,3 cm; p < 0,0001) i odhadovaný objem tumoru (66,4 vs 15,1 cm3; p < 0,0001) v době diagnostikování onemocnění, vyšší průměrnou lineární rychlost růstu (0,80 vs 0,30 cm/rok; p = 0,0001) i vyšší rychlost růstu objemu tumoru (27,1 vs 6,2 cm3/rok; p < 0,0001). Ačkoli výsledky přehledu nasvědčují tomu, že progredující léze představují pouze malé procento všech tumorů (2,1 %), vykazují tyto léze rychlý růst (0,8 cm/rok) a v době diagnostikování byly ve stadiu > cT1b (38 % > 4 cm). Skupina pacientů s progredujícím onemocněním také častěji zahrnovala pacienty s absolutní indikací pro AS, což svědčí o tom, že pacienti nebyli vhodnými kandidáty pro operační léčbu (přestože vykazovali zjevné radiologické charakteristiky) [47,48].
Hlavními problémy hodnocení sérií pacientů v protokolu AS jsou relativně krátká doba sledování a ve většině případů absence histologické diagnózy. Většina studií jsou retrospektivní a obvykle z jednoho centra. V současné době jsou k dispozici dvě prospektivní multicentrické studie AS u 178 starších a/nebo nemohoucích pacientů. Průměrná velikost tumory na počátku AS byla 2,1 cm. Za dobu 28měsíčního sledování byl nárůst v průměru o 0,13 cm/rok a progrese do metastatického stadia byl u dvou pacientů (1,1 %). Zajímavé je zjištění, že histologicky potvrzený RCC nevykazoval rychlejší růst oproti histologicky potvrzenám benigním lézím [49].
V současné době je aktivní sledování strategie vhodná prostarší pacienty nebo pacienty s vážnými komorbiditami, kteří nejsou vhodnými adepty pro chirurgickou léčbu. Gill et al v současné doporučují do protokolu AS zařadit take pacienty s ložiskem ≤ 1 cm bez ohledu na předpo-kládanou dobu života [50]. Oproti tomu stojí v současné době všeobecně doporučovaný postup, kdy AS není doporučovaná metoda pro mladé a zdravé jedince. Větší tumory (3–4 cm) a tumory agresivního vzhledu s charakteristikami infitračního růstu mohou být spojeny s vyšším rizikem „high-grade“ a šíření mimo kapsulu. Přístup k těmto nádorům by měl být aktivní a radikální.
PERKUTÁNNÍ BIOPSIE
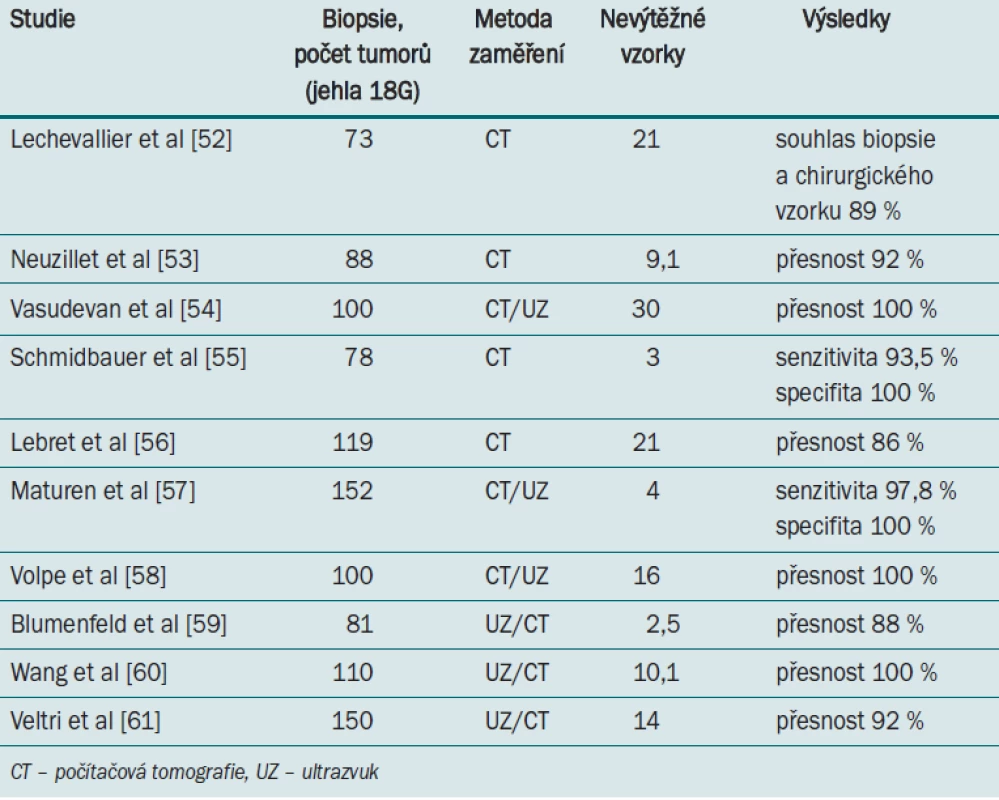
Role perkutánní biopsie při rozhodování o strategii léčby SRM nabývá stále více na významu. V minulosti byla biopsie indikována zřídka z důvodu obav z implantačních metastáz v punkčním kanále a také z důvodu malé výtěžnosti a nepřesnosti histologického hodnocení. Řada studií prokázala nízkou morbiditu biopsií, které byly prováděny ve specializovaných centrech. Signifikantní krvácení bylo < 1 % a rozšíření tumoru v důsledku biopsie bylo popsáno pouze v šesti případech [51]. Výskyty všech případů implantačních metastáz byly popsány ještě bez použití moderních bioptických technik. V současné době se používá koaxiální jehla s pochvou, která umožní odběr bioptického materiálu bez kontaktu s okolní tkání.
Úkolem biopsie je potvrdit malignitu, určit histotyp a klasifikovat „grading“ SRM. Přesná histologická diagnóza umožňuje provést léčebný postup a pomáhá při rozhodnutí o indikaci k chirurgickému výkonu a naopak odložení operace v případech nádorů, které nelze přesně zhodnotit pomocí radiologických zobrazovacích metod. Týká se to především onkocytomů a angiomyolipomů bez obsahu tuku nebo s nízkým obsahem tuku. Pekrutánní biopsie je též užitečná při provádění aktivního sledování. Histologicky potvrzené „low-grade“ tumory mohou být při AS pečlivě sledovány, u benigních tumorů může být zvoleno méně rigorózní schéma sledování.
Většinu histologických subtypů lze stanovit s poměrně vysokou přesností. Obtížně se odlišuje onkocytom od chromofobního karcinomu. K upřesnění diagnózy v nejasných případech dnes slouží již dostupné metody jako fluorescenční in situ hybridizace (FISH) nebo reverzní transkriptázová-polymerázová řetězová reakce. Možnosti přesného stanovení klasifikace podle Fuhrmanové z odebrané biopsie jsou limitované (přesnost 70–83 %). Důvodem může být heterogenita jednotlivých vzorků.
Souhrnem lze konstatovat, že při používání biopsií lze sledovat trend nárůstu a výsledky mají zvyšující se význam zvláště v rozhodovacím procesu o léčebném postupu u SRM. Správný výsledek biopsie spolu s klinickou charakteristikou tumoru a zhodnocením celkového stavu pacienta a předpokládané doby života umožňuje výbrat metodu léčby s největším benefitem pro nemocného.
ZÁVĚR
Narůstající počet detekovaných SRM u asymptomatických pacientů je výsledkem rozšiřování možností zobrazovacích metod. Většina lézí je detekována neinvazivním způsobem a obvykle je detekce SRM jako vedlejší nález při vyšetřování z úplně jiné indikace. NSS dosahuje srovnatelné onkologické výsledky a výhoda šetření renální funkce staví NSS jako léčebnou metodu do popředí před radikální nefrektomii, kdykoli je technicky proveditelná. LPN je alternativní metodou k OPN, ale pouze v rukou zkušeného urologa. V počátečních fázích zkušeností laparoskopického chirurga je nutný pečlivý výběr pacientů, aby bylo dosaženo co nejkratšího WIT a nebyla zvýšena celková morbidita. Roboticky asistovaná resekce ledviny může nabídnout snadnější řešení komplikovaných nádorů, které mohou být pro laparoskopickou resekci technicky náročné. Současné výsledky RAPN jsou povzbudivé, ale onkologické výsledky zatím nejsou jednoznačně srovnatelné.
Významná část SRM jsou nádory benigní nebo „low-grade“ RCC tumory s relativně příznivým biologickým chováním a je možno volit méně invazivní terapeutické metody. Patří sem především ablační metody (AT) a aktivní sledování (AS). Z nich může profitovat vybraná skupina pacientů s kratší předpokládanou dobou života. Vhodnými kandidáty pro pro ablační metody jsou pacienti s incidentálními, koritkálními SRM s vysokým operačním rizikem, u kterých je z důvodu nejistého biologického chování nádoru vhodný agesivnější přístup. Kryoablace (CA) a radiofrekvenční ablace (RFA) jsou slibné metody, ale je potřeba dalších sledování ke zhodnocení dlouhodobých onkologických výsledků. Je potřeba přesných kritérií a vypracování standardů pro zařazení jednotlivých pacientů do určitého terapeutického protokolu.
AS je metoda vhodná pro řešení SRM u starších pacientů nebo pacientů se závažnými komorbiditami, kteří nejsou vhodní pro chirurgickou léčbu.
Perkutánní biopsie tumoru, získání biologického materiálu a upřesnění histologického nálezu je užitečné u vybrané skupiny pacientů, u kterých jsou zvažovány různé léčebné možnosti. Může také pomoci v plánování strategie sledovacího protokolu.
prim. MUDr. Aleš Čermák
Urologická klinika FN Brno
Jihlavská 20, 625 00 Brno
acermak@fnbrno.cz
Sources
1. Geryk E. Srovnání výskytu zhoubných novotvarů: Č̌eská republika a vybrané státy = Comparison of cancer incidence: Czech Republic and selected countries. Praha: Galén 2004.
2. Sobotka R, Hanuš T. Nádory ledvin. Postgraduální medicína 2001; 1 : 48.
3. Morávek P, Morávek P Jr., Dvořák P et al. Perkutánní radiofrekvenční ablace (RFA) v léčbě nádorů ledvin – vlastní zkušenosti. Ces Urol 2010; 14(2): 104–109.
4. Jemal A, Siegel R, Xu J et al. Cancer statistics, 2010. CA Cancer J Clin 2010; 60(5): 277–300.
5. Mathew A, Devesa SS, Fraumeni JF Jr. et al. Global increases in kidney cancer incidence, 1973–1992. Eur J Cancer Prev 2002; 11(2): 171–178.
6. Kane CJ, Mallin K, Ritchey J et al. Renal cell cancer stage migration: analysis of the National Cancer Data Base. Cancer 2008; 113(1): 78–83.
7. Gill IS, Aron M, Gervais DA et al. Clinical practice. Small renal mass. N Engl J Med 2010; 362(7): 624–634.
8. Nguyen MM, GillI S. Effect of renal cancer size on the prevalence of metastasis at diagnosis and mortality. J Urol 2009; 181(3): 1020–1027.
9. Frank I, Blute ML, Cheville JC et al. Solid renal tumors: an analysis of pathological features related to tumor size. J Urol 2003; 170(6 Pt 1) : 2217–2220.
10. Uzzo RG, Novick AC. Nephron sparing surgery for renal tumors: indications, techniques and outcomes. J Urol 2001; 166(1): 6–18.
11. VanPoppel H, DaPozzo L, Albrecht W et al. A prospective randomised EORTC intergroup phase 3 study comparing the oncologic outcome of elective nephron-sparing surgery and radical nephrectomy for low-stage renal cell carcinoma. Eur Urol 2011; 59(4): 543–552.
12. Patard JJ, Shvarts O, Lam JS et al. Safety and efficacy of partial nephrectomy for all T1 tumors based on an international multi-center experience. J Urol 2004; 171(6 Pt 1): 2181–2185.
13. Go AS, Chertow GM, Fan D et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospi - talization. N Engl J Med 2004; 351(13): 1296–1305.
14. Miller DC, Schonlau M, Litwin MS et al. Renal and cardiovascular morbidity after partial or radical nephrectomy. Cancer 2008; 112(3): 511–520.
15. Huang WC, Elkin EB, Levey AS et al. Partial nephrectomy versus radical nephrectomy in patients with small renal tumors – is there a difference in mortality and cardiovascular outcomes? J Urol 2009; 181(1): 55–61.
16. Weight CJ, Lieser G, Larson BT et al. Partial nephrectomy is associated with improved overall survival compared to radical nephrectomy in patients with unanticipated benign renal tumours. Eur Urol 2010; 58(2): 293–298.
17. Ljungberg B, Cowan NC, Hanbury DC et al. EAU guidelines on renal cell carcinoma: the 2010 update. Eur Urol 2010; 58(3): 398–406.
18. Campbell SC, Novick AC, Belldegrun A et al. Guideline for management of the clinical T1 renal mass. J Urol 2009; 182(4): 1271–1279.
19. Dulabon LM, Lowrance WT, Russo P et al. Trends in renal tumor surgery delivery within the United States. Cancer 2010; 116(10): 2316–2321.
20. Van Poppel H, Da Pozzo L, Albrecht W et al. A prospective randomized EORTC intergroup phase 3 study comparing the complications of elective nephron-sparing surgery and radical nephrectomy for low-stage renal cell carcinoma. Eur Urol 2007; 51(6): 1606–1615.
21. Bruner B, Breau RH, Lohse CM et al. Renal nephrometry score is associated with urine leak after partial nephrectomy. BJU Int 2011; 108(1): 67–72.
22. Thompson RH, Frank I, Lohse CM et al. The impact of ischemia time during open nephron sparing surgery on solitary kidneys: a multi-institutional study. J Urol 2007; 177(2): 471–476.
23. Carini M, Minervini A, Masieri L et al. Simple enucleation for the treatment of PT1a renal cell carcinoma: our 20-year experience. Eur Urol 2006; 50(6): 1263–1271.
24. Bensalah K, Pantuck AJ, Rioux-Leclercq N et al. Positive surgical margin appears to have negligible impact on survival of renal cell carcinomas treated by nephron-sparing surgery. Eur Urol 2010; 57(3): 466–473.
25. Ng CS, Gill IS, Ramani AP et al. Transperitoneal versus retroperi - toneal laparoscopic partial nephrectomy: patient selection and perioperative outcomes. J Urol 2005; 174(3): 846–849.
26. Becker F, Siemer S, Humke U et al. Elective nephron sparing surgery should become standard treat - ment for small unilateral renal cell carcinoma: long-term survival data of 216 patients. Eur Urol 2006; 49(2): 308–313.
27. Patard J-J, Pantuck AJ, Crepel M et al. Morbidity and clinical outcome of nephron-sparing surgery in relation to tumour size and indication. Eur Urol 2007; 52(1): 148–154.
28. Gill IS, Kavoussi LR, Lane BR et al. Comparison of 1,800 laparoscopic and open partial nephrectomies for single renal tumors. J Urol 2007; 178(1): 41–46.
29. Permpongkosol S, Bagga HS, Romero FR et al. Laparoscopic versus open partial nephrectomy for the treatment of pathological T1N0M0 renal cell carcinoma: a 5-year survival rate. J Urol 2006; 176(5): 1984–1988.
30. Lane BR, Gill IS. 7-year oncological outcomes after laparoscopic and open partial nephrectomy. J Urol 2010; 183(2): 473–479.
31. Simmons MN, Gill IS. Decreased complications of contemporary laparoscopic partial nephrectomy: use of a standardized reporting system. J Urol 2007; 177(6): 2067–2073.
32. Gill IS, Kamoi K, Aron M et al. 800 Laparoscopic partial nephrectomies: a single surgeon series. J Urol 2010; 183(1): 34–41.
33. Gill IS, Eisenberg MS, Aron M et al. “Zero ischemia” partial nephrectomy: novel laparoscopic and robotic technique. Eur Urol 2011; 59(1): 128–134.
34. Rogers C, Sukumar S, Gill IS. Robotic partial nephrectomy: the real benefit. Curr Opin Urol 2011; 21(1): 60–64.
35. Ficarra V, Novara G, Mottrie A et al. AUA Update series 2010.
36. Desai PJ, Andrews PE, Ferrigni RG et al. Laparoscopic partial nephrectomy at the Mayo Clinic Arizona: follow-up surveillance of positive margin disease. Urology 2008; 71(2): 283–286.
37. Mir SA, Cadeddu JA, Sleeper JP et al. Cost comparison of robotic, laparoscopic, and open partial nephrectomy. J Endourol 2011; 25(3): 447–453.
38. Wisenbaugh ES, Cheney SM, Martin GL et al. Minimálně invazivní laparoskopická a roboticky asistovaná parciální resekce ledviny: stručná historie a přehled. Urol List 2011; 9(4): 17–21.
39. Hora M, Hes O, Klečka J. Miniinvazivní ledvinu šetřící ablační metodiky v léčbě nádorů ledvin. Urol List 2003; 1(1): 26–29.
40. Čermák A, Pacík D. Radiofrekvenční ablace nádorů ledvin: Urol List 2012; 10(1): 31–35.
41. Čermák A, Pacík D. Minimálně invazivní, ablační techniky při léčbě malých renálních tumorů. Urol List 2012; 10(3): Epub ahead of print.
42. Ogan K, Jacomides L, Dolmatch BL et al. Percutaneous radio fre - quency ablation of renal tumors: technique, limitations, and morbidity. Urology 2002; 60(6): 954–958.
43. Weight CJ, Kaouk JH, Hegarty NJ et al. Correlation of radiographic imaging and histopathology following cryoablation and radio frequency ablation for renal tumors. J Urol 2008; 179(4): 1277–1281.
44. Kunkle DA, Egleston BL, Uzzo RG. Excise, ablate or observe: the small renal mass dilemma—a meta-analysis and review. J Urol 2008; 179(4): 1227–1233.
45. Volpe A, Jewett MA. The role of surveillance for small renal masses. Nat Clin Pract Urol 2007; 4(1): 2–3.
46. Hollingsworth JM, Miller DC, Daignault S et al. Five-year survival after surgical treatment for kidney cancer: a population - based competing risk analysis. Cancer 2007; 109(9): 1763–1768.
47. Smaldone MC, Kutikov A, Canter DJ et al. A Critical Analysis of Active Surveillance with Delayed Curative Intent for the Treatment of Small Renal Masses. Podium presentation (#11); presented at the Society of Urologic Oncology 2010.
48. Smaldone MC, Canter D, Simhan J et al. Aktivní sledování malých tumorů ledviny. Urol List 2012; 10(1): 26–30.
49. Jewett MAS, Mattar K, Basiuk J et al. Active surveillance of small renal masses: progression patterns of early stage kidney cancer. Eur Urol 2011; 60(1): 39–44.
50. Gill IS, Aron M, Gervais DA et al. Clinical practice. Small renal mass. N Engl J Med 2010; 362(7): 624–634.
51. Volpe A, Kachura JR, Geddie WR et al. Techniques, safety and accuracy of sampling of renal tumors by fine needle aspiration and core biopsy. J Urol 2007; 178(2): 379–386.
52. Lechevallier E, Andre M, Barriol D et al. Fine-needle percutaneous biopsy of renal masses with helical CT guidance. Radiology 2000; 216(2): 506–510.
53. Neuzillet Y, Lechevallier E, Andre M et al. Accuracy and clinical role of fine needle percutaneous biopsy with computerized tomography guidance of small (less than 4.0 cm) renal masses. J Urol 2004; 171(5): 1802–1805.
54. Vasudevan A, Davies RJ, Shannon BA et al. Incidental renal tumours: the frequency of benign lesions and the role of preoperative core biopsy. BJU Int 2006; 97(5): 946–949.
55. Schmidbauer J, Remzi M, Memarsadeghi M et al. Diagnostic accuracy of computed tomography-guided percutaneous biopsy of renal masses. Eur Urol 2008; 53(5): 1003–1012.
56. Lebret T, Poulain JE, Molinie V et al. Percuta-neous core biopsy for renal masses: indications, accuracy and results. J Urol 2007; 178(4 Pt 1): 1184–1188.
57. Maturen KE, Nghiem HV, Caoili EM et al. Renal mass core biopsy: accuracy and impact on clinical management. AJR Am J Roentgenol 2007; 188(2): 563–570.
58. Volpe A, Mattar K, Finelli A et al. Contemporary results of percutaneous biopsy of 100 small renal masses: a single center experience. J Urol 2008; 180(6): 2333–2337.
59. Blumenfeld AJ, Guru K, Fuchs GJ et al. Percutaneous biopsy of renal cell carcinoma underestimates nuclear grade. Urology 2010; 76(3): 610–613.
60. Wang R, Wolf JS Jr., Wood DP Jr. et al. Accuracy of percutaneous core biopsy in management of small renal masses. Urology 2009; 73(3): 586–590.
61. Veltri A, Garetto I, Tosetti I et al. Diagnostic accuracy and clinical impact of imaging-guided needle biopsy of renal masses. Retrospective analysis on 150 cases. Eur Radiol 2011; 21(2): 393–401.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2012 Issue 3
-
All articles in this issue
- Robot assisted radical cystectomy: the Mayo Clinic technique
- Continent and incontinent urinary diversion, bladder sparing approaches
- Minimal invasive ablation techniques in small renal tumours treatment
- Current view on small renal masses
- Value of treatment, risk and responsibility in urological practice
- Localized renal tumour, epidemiology, aetiology, surgical treatment, operation techniques and their indications, the role of lymphadenectomy
- Complete duplication of bladder and urethra as organic cause of lower urinary tract dysfunction
- Rare complicaton of insertion double J stent – migration to right heart atrium
- EAU Guidelines on laser technologies
- Readmission and complication rates in patients undergoing PCNL, stratified by co-morbid factors
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Rare complicaton of insertion double J stent – migration to right heart atrium
- Continent and incontinent urinary diversion, bladder sparing approaches
- Current view on small renal masses
- Robot assisted radical cystectomy: the Mayo Clinic technique