-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Možnosti antimikrobiální ochrany centrálních žilních katétrů
Antimicrobial protection options in central venous catheters – Overview
Central venous catheters (CVC) take indispensable place in caring for critically ill patients. Catheter-related infections increase morbidity and mortality. In the article basic CVC protection methods are mentioned with accent on overview of catheters available on the market. Overviews of meta-analyses and several methodological flaws of recent studies are also referred. Meta-analyses showed that anti-infective CVCs reduce the risk of catheter-related blood stream infections, but their routinely use is still not recommended. However, the use of anti-infective CVCs should be considered, when background rates of catheter-related infections are high.
Key words:
central venous catheter – catheter-related infections – impregnated catheter – coated catheter – chlorhexidine – silver sulfadiazine – minocycline – rifampicin
Autori: Křikava Ivo; Ševčík Pavel
Pôsobisko autorov: Klinika anesteziologie, resuscitace a intenzivní medicíny FN Brno a LF MU Brno
Vyšlo v časopise: Anest. intenziv. Med., 19, 2008, č. 4, s. 210-217
Kategória: Intenzivní medicína - Přehledný článek
Súhrn
Centrální žilní katétry (CŽK) mají nezastupitelné místo v péči o kriticky nemocné pacienty. Infekce spojené s CŽK zvyšují morbiditu a mortalitu pacientů. V článku jsou zmiňovány základní metodiky používané k ochraně CŽK s důrazem na přehled katétrů dostupných v současné době na trhu. Dále jsou uvedeny přehledy metaanalýz shrnující výsledky studií za posledních 10 let. Zmiňovány jsou také nedostatky prováděných studií, které limitují jejich interpretaci. Závěry metaanalýz ukazují, že chráněné katétry snižují četnost infekcí krevního řečiště spojených s CŽK, ale jejich rutinní použití je doporučováno především na pracovištích, kde jiná opatření nevedou ke snížení infekcí spojených s CŽK a incidence těchto infekcí je na daném pracovišti vysoká.
Klíčová slova:
centrální žilní katétr – katetrové infekce – impregnovaný centrální žilní katétr – chlorhexidin – sulfadiazin stříbra – minocyklin – rifampicinÚvod
Centrální žilní katétry (CŽK) mají nezastupitelné místo v péči o kriticky nemocné pacienty. Použití jak dlouhodobě, tak i krátkodobě zavedených katétrů je spojeno s infekčními komplikacemi. Infekce spojené s centrálními žilními katétry jsou odpovědné za 5 až 10 % nozokomiálních infekcí. Tyto infekce jsou spojeny se zvýšenou morbiditou a mortalitou pacientů na jednotkách intenzivní péče (podle literárních údajů o 10–20 %) a také přinášejí navýšení nákladů na péči o pacienty. Četnost infekcí krevního řečiště spojených s CŽK (catheter-related blood stream infection – CRBSI) se dnes pohybuje v závislosti na druhu jednotky intenzivní péče od 1,5 (chirurgické JIP) do 6,8 (popáleninové JIP) případů na 1000 dnů zavedení centrálního žilního katétru [1]. Z těchto údajů vyplývá, že se jedná o nezanedbatelný problém a bylo již vynaloženo velké úsilí na výzkum faktorů ovlivňujících tyto infekce. Tato práce je zaměřena na CŽK s antimikrobiální ochranou, které jsou stále kontroverzním tématem, především z hlediska poměru vynaložených nákladů a účinnosti [2].
Definice
V souvislosti s infekcemi spojenými s centrálními žilními katétry se vyskytuje větší množství definic. V průběhu času a se zaváděním nových metodik a diagnostických testů se také tyto definice vyvíjejí a pozměňují. Srovnávání dat z různých studií při vytváření metaanalýz proto není jednoduché, a v některých případech až nemožné (viz oddíl Problémy současných studií). Nejčastěji se vyskytují pojmy:
- CRBSI – infekce krevního řečiště spojená s centrálním žilním katétrem (catheter-related blood stream infection). Vychází z definice pro infekci krevního řečiště (BSI) používané NNIS (National Nosocomial Infections Surveillance system) [3] a NHSN (National Healthcare Safety Network) [1] pro epidemiologické účely. Nebývají zde přesně definována kritéria pro stanovení totožnosti bakteriálních kmenů z kultivace katétru a hemokultur. Pokud definována jsou, tak většinou jako shoda v bakteriálním kmeni a citlivosti na antibiotika.
- CRB – bakteriémie související s katétrem (catheter-related bacteremia). Definice je založena na kultivaci stejných bakteriálních kmenů z katétru a hemokultury z periferní žilní krve. V některých studiích je tento pojem dále členěn na definitivní CRB a možnou CRB (různé možnosti, které nesplňují podmínky výše uvedené definice a nespadají ani pod CRS).
- CRS – sepse související s katétrem (catheter-related sepsis). Definice se používá v případě chybějící bakteriémie (hemokultura je negativní nebo nebyla provedena) [4].
Další nepříliš časté pojmy jsou CAI (catheter-associated infection) nebo CRLI (catheter-related local infection). Obecně se dá tato problematika rozdělit do dvou krajních možností. Definice vycházející z velkých epidemiologických studií bývají často formulovány velmi obecně a číselné údaje z nich vycházející jsou často nadhodnocené. Příčinou bývá nedostatečná identifikace bakterií (kultivace z katétru a hemokultury) a případně nedostatečná identifikace jiných zdrojů infekce. Druhou krajní možností jsou přesné definice u menších studií, často komerčních, které mají za cíl zhodnotit účinnost daného katétru. Epidemiologické údaje zjištěné v těchto studiích se dají považovat za přesnější, nicméně metodiky v nich používané (fagotypizace bakterií, elektroforetické metody) jsou nákladné a nejsou vhodné pro rutinní použití v praxi.
Biofilm
Biofilmem nazýváme organizované, často mnohovrstevné společenstvo mikrobů, které vzniká na pevných površích a je obaleno mezibuněčnou hmotou, kterou produkují. Mikrobi tvořící biofilm navíc vykazují změněný fenotyp a exprimují geny kódující tvorbu biofilmu (např. ica operon u stafylokoků). Pro mikroby má biofilm význam hlavně ochranný. Jedná se především o adhezi k povrchům, a tedy i mechanickou ochranu (před odplavením), dále ochranu před účinky imunitního systému a antimikrobiálních agens a v neposlední řadě hraje úlohu ve vzniku rezistence mikrobů k antibiotikům. Biofilm hraje důležitou roli v přírodním prostředí a i u člověka má pozitivní úlohu v ochraně slizničních povrchů. Bohužel, tři ze čtyř nejčastějších nozokomiálních nákaz (respirační a močové infekce, chirurgické ranné infekce a infekce cévního řečiště) jsou spojeny se zavedením cizorodého materiálu. V případě, že není možné biofilm z umělého povrchu mechanicky odstranit (povrchy při běžné dezinfekci) nebo přímo odstranit cizorodý materiál, je velmi obtížné až nemožné použít k eliminaci biofilmu běžnou antibiotickou léčbu. Extracelulární matrix totiž vytváří bariéru, která snižuje průnik antimikrobiální látky, a navíc je tato látka při pomalejším průniku rychleji odbourávána degradačními enzymy (beta-laktamázy). Dále se zde významně uplatňuje vliv povrchového náboje extracelulární hmoty, který ovlivňuje především pozitivně nabité aminoglykosidy. U biofilmu se projevují také komplexnější vlastnosti, jako je zpomalení růstu bakterií a snazší vznik rezistence v biofilmu. Ke zpomalení růstu bakterií dochází hlavně z důvodu omezené dostupnosti substrátů a nahromadění metabolických zplodin v biofilmu a je příčinou nižšího účinku antibiotik (beta-laktamy, glykopeptidy). Vznik rezistence je výrazně usnadněn rychlým přenosem plazmidů v populaci biofilmu, případně obecnějším mechanismem selektování rezistentní subpopulace mikroorganismů [5].
Při shrnutí výše uvedených faktů zjišťujeme, že bakterie v biofilmu bude reagovat na antibiotickou léčbu jinak než bakterie vykultivovaná na živné půdě v laboratoři. V souvislosti s pojmem minimální inhibující koncentrace (MIC), zjištěným při testování citlivosti na antibiotika in vitro, tak byly zavedeny termíny minimální biofilm inhibující koncentrace (MBIC) a minimální biofilm eradikující koncentrace (MBEC) – graf 1.
Graf 1. Porovnání MIC, MBIC a MBEC u S. epidermidis (podle [6]) ![Porovnání MIC, MBIC a MBEC u S. epidermidis (podle [6])](https://pl-master.mdcdn.cz/media/image/0c261ecc420e6685286a0060f1aee5ce.png?version=1537792252)
Snaha zabránit vytvoření biofilmu na centrálních žilních katétrech vede k vývoji nových typů materiálů a způsobů ochrany těchto katétrů. Jednak vytvářením povrchů, jejichž vlastnosti snižují možnost uchycení mikroorganismů (hydrofilní nebo heparinizovaný povrch), a jednak vytvářením materiálů, které jsou ošetřeny antiseptiky nebo antibiotiky, a zabraňují tak růstu již uchycených mikroorganismů na povrchu katétru.
Typy ochrany centrálních žilních katétrů
Způsoby úpravy povrchu katétrů
Při popisu ochrany katétrů se často vyskytují termíny jako „impregnovaný“, „potažený“ (angl. coated) nebo katétr ošetřený navázáním určité látky (angl. bonding). Poslední zmiňovaný termín se již příliš nevyskytuje a používal se dříve pro katétry ošetřené navázáním antibiotik, které se dnes již nepoužívají. Dnes používané katétry s nekovalentně vázanou antimikrobiální látkou, které by mohly být takto označené, jsou již označovány jako „potažené“ (coated). Potažené katétry jsou ve výrobním procesu namáčeny do roztoku s přísadou antimikrobiální látky a potom se suší, takže tato směs vytváří na povrchu katétru jakýsi pružný povlak.
Proces impregnace nekovových materiálů se skládá ze dvou základních kroků. Prvním krokem je vytvoření antimikrobiální směsi v koncentraci, která zabraňuje růstu organismů, jako jsou Staphylococcus sp., další grampozitivní bakterie, gramnegativní bakterie a Candida sp. Při výrobě této směsi se používá většinou organické rozpouštědlo s přídavkem penetračního činidla, které usnadňuje průnik látky do daného materiálu. Ve druhém kroku je vystavena část katétru této antimikrobiální směsi za zvýšené teploty, při které vstupuje tato látka do materiálu katétru.
Rozdíl mezi impregnovaným a potaženým katétrem spočívá především v průniku dané látky do materiálu katétru. V literatuře jsou tyto termíny často zaměňovány, což příliš nevadí v případě, že je specifikována látka, kterou je katétr ošetřen.
Kombinace chlorhexidin/sulfadiazin stříbra (CH-SS)
Jedná se o jeden z nejstarších způsobů ochrany centrálních žilních katétrů. Jedno z prvních sdělení o použití těchto antiseptik k ochraně centrálního žilního katétru pochází z roku 1992 [7].
Chlorhexidin je známé antiseptikum se širokým baktericidním spektrem zahrnujícím grampozitivní a gramnegativní bakterie, s poněkud nižší účinností proti některým gramnegativním kmenům (Pseudomonas, Proteus). Chlorhexidin má slabší virocidní a fungicidní účinek. Předpokládaný mechanismus jeho antibakteriálního účinku je porušení buněčné membrány a nikoliv blokáda ATPázy, jak bylo dříve uváděno.
Sulfadiazin stříbra je sůl tvořená kationtem stříbra a aniontem sulfonamidového chemoterapeutika sulfadiazinu. Samotný sulfadiazin má antimikrobiální aktivitu založenou na interferenci s metabolismem kyseliny listové a používá se k léčbě močových infekcí. Sulfadiazin stříbra je využíván např. jako mast v lokální léčbě popálenin.
Kationt stříbra má také antimikrobiální aktivitu, pro výrazné odlišnosti je mu věnována zvláštní kapitola (viz níže).
Katétr Arrowgard Blue® ošetřený metodou impregnace CH-SS nabízí firma Arrow International. Starší typ katétru byl ošetřený pouze na vnějším povrchu a proběhlé studie často zpochybňovaly účinnost tohoto katétru alespoň v jednom ze sledovaných parametrů (nejčastěji kolonizace nebo CRBSI) [8–14].
V letech 2004–2005 uvedla firma Arrow na trh nový typ katétru, označovaný jako 2. generace katétru CH-SS, pod názvem Arrowgard Blue Plus®. Od první generace se odlišuje vyšší koncentrací antiseptika a především přítomností antiseptika na vnější i vnitřní straně katétru. V současné době je na trhu již jen druhá generace katétrů. Zavedení nového typu katétru ovšem komplikuje srovnávání starších [15] a novějších studií [16–18] a vytváření metaanalýz. Tento typ ochrany katétrů je také zatížen vyšší mírou výskytu hypersenzitivních a alergických reakcí [19]. Vyšší výskyt těžkých alergických reakcí vedl k zákazu používání těchto katétrů v Japonsku.
Ochrana pomocí antibiotik
Ochrana katétrů pomocí antibiotik je další možností. Od 90. let se hledá vhodná kombinace antibiotik a způsob aplikace na katétr. Dříve používané metodiky byly opuštěny pro nízkou účinnost antibiotika, nebo příliš rychlé uvolnění antibiotika z katétru. Katétry ošetřené navázáním cefazolinu nebo teikoplaninu na katétr nedokázaly chránit katétr déle než 2 dny. Kombinace minocyklin/rifampicin se ukázala jako nejvhodnější v testech in vitro (tab. 1) [20].
Tab. 1. Účinnost antibiotik v prevenci kolonizace katétru S. epidermidis 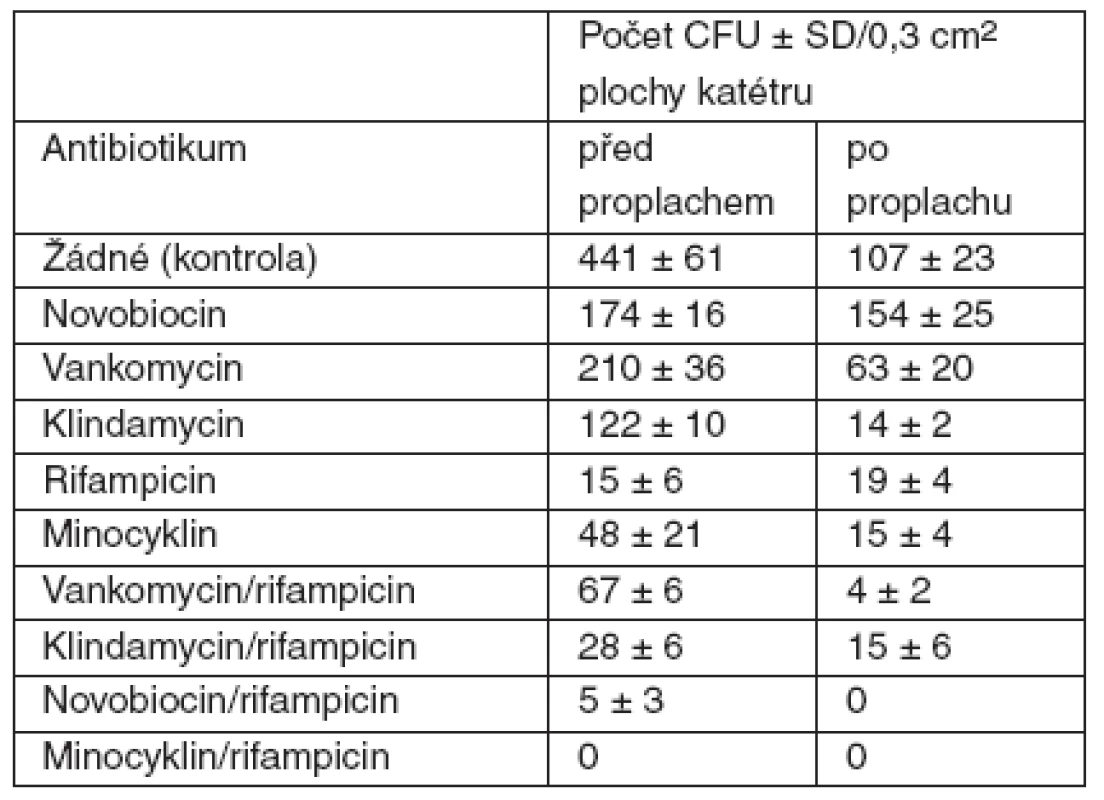
CFU – kolonie tvořící jednotky (podle [20]) Minocyklin je polosyntetické antibiotikum odvozené od tetracyklinu. Je primárně bakteriostatické a jeho efekt spočívá v inhibici syntézy proteinů. Minocyklin je komerčně dodáván jako hydrochlorid v podobě žlutého krystalického prášku, který je rozpustný ve vodě a mírně rozpustný v organických rozpouštědlech; je aktivní proti širokému spektru grampozitivních a gramnegativních bakterií.
Rifampicin je polosyntetický derivát rifamycinu B, makrocyklického antibiotika produkovaného plísní Streptomyces mediterranic. Rifampicin má baktericidní účinek způsobený inhibicí DNA-dependentní RNA polymerázy.
Katétr Cook Spectrum® je ošetřený impregnací směsí minocyklin/rifampicin a nabízí jej firma Cook Inc. V současné době je to jediný sériově vyráběný katétr chráněný antibiotiky a studie hodnotící katétry chráněné jinými antibiotiky se již téměř nevyskytují (výjimečně kombinace mikonazol/rifampicin). S ohledem na kratší dobu od uvedení na trh než u katétru CH-SS je také počet studií menší [21–23], ale jedná se o poměrně konzistentní soubor hodnotitelný i metaanalýzami [24–25] (viz níže).
Stříbro
Stříbro, podobně jako měď a další kovy, je již dlouhou dobu známé svým antimikrobiálním působením, které se nazývá oligodynamické. Toto působení je vázáno na ionizovanou formu stříbra, to znamená, že je nezbytná přítomnost volných stříbrných kationtů v médiu. Působení stříbrných kationtů je také závislé na koncentraci – od bakteriostatického působení k baktericidnímu působení ve vysokých koncentracích. Antimikrobiální spektrum stříbrných iontů je výjimečně široké a zahrnuje grampozitivní koky, včetně polyrezistentních kmenů (methicilin-rezistentní stafylokok, vankomycin-rezistentní enterokok a polyrezistentní koaguláza – negativní stafylokoky). Tvorba glykokalyx neovlivňuje protibakteriální působení stříbra a je tedy aktivní i proti gramnegativním enterobakteriím včetně pseudomonád. Je popisováno také působení proti kvasinkám a virům.
Mechanismy antimikrobiální aktivity stříbra jsou následující:
- Ionty stříbra vytvářejí v buněčné stěně nerozpustné komplexy se sulfhydrylovými skupinami, které jsou přítomny v enzymech zodpovědných za transmembránový transport.
- Ionty stříbra narušují dýchací řetězec bakterií blokádou cytochromoxidázy a NADH-sukcinát-dehydrogenázy.
- Ionty stříbra vstupují do buňky a vážou se na bakteriální DNA. Vazbou na atomy kyslíku, síry a dusíku a narušováním vodíkových vazeb v dvojšroubovici DNA přispívají k omezení procesu replikace. Tyto změny mohou být reverzibilní a při poklesu koncentrace stříbra dochází k obnově růstu bakteriálních kolonií.
Malé množství mikroorganismů může vykazovat také rezistenci vůči stříbru. Byla popsána rezistence u kmenů Citrobacter, Proteus, Enterobacter a Klebsiella. Předpokládá se několik mechanismů rezistence, jako např. produkce proteinů vytvářejících se stříbrem komplexy, a tím i snížení toxicity stříbrných iontů. Bakterie s defektními iontovými přenašeči také mohou vykazovat rezistenci ke stříbru. Zatím nebyla popsána u bakterií zkřížená rezistence mezi stříbrem a antibiotiky.
Toxicita pro lidské buňky je nízká. Stříbro vykazuje u člověka pozoruhodně nízkou akutní a chronickou toxicitu a dosud nebyly popsány kancerogenní nebo mutagenní účinky. Argyróza je jediný nežádoucí účinek systémového podávání stříbra a projevuje se šedým zbarvením kůže, které způsobuje uložení depozit stříbra v kůži. Pro rozvoj tohoto syndromu je nutný celkový příjem stříbra v množství odpovídajícím přibližně 1 g. Katétry impregnované stříbrem uvolňují asi 0,5 μg za 24 hodin. U pacientů s popáleninami je často v lokální terapii používáno stříbro, např. ve formě sulfadiazinu stříbra. Plazmatické koncentrace u těchto pacientů dosahují až 600 μg . l-1 bez rozvoje argyrózy nebo jiných klinických příznaků [26].
V historii i v současné době narážejí konstrukce katétrů s ochranou pomocí stříbra na technické obtíže. Hlavní problémy spočívají buď v příliš rychlém uvolnění stříbra z materiálu, nebo v dosažení příliš nízké koncentrace iontů stříbra na povrchu chráněného materiálu. Starší prototypy katétrů byly konstruovány jednoduchým vytvořením směsi polyuretanu a stříbrného prachu s částicemi kolem 1,5 μm. Takové částice bohužel vytvářejí malý aktivní povrch a tím i nízkou koncentraci iontů stříbra. Další zvyšování hmotnostního podílu stříbra nebylo možné, protože se zároveň nepříznivě měnily fyzikální vlastnosti katétru ve smyslu zvýšení tuhosti a křehkosti katétru [27]. Řešení možná nabídnou v budoucnu nanočástice stříbra (viz níže).
Větší množství studií, zkoumající efektivitu stříbra při ochraně katétrů v průběhu 90. let, má obtížně interpretovatelné výsledky. Katétry použité v těchto studiích byly často připravovány v malých sériích nestandardizovaným způsobem, čistě pro potřeby dané studie [14, 26, 28, 29]. Některé studie zkoumaly účinky in vitro [27, 30]. Díky tomu není ani možné vytvoření metaanalýz pro nesrovnatelné parametry katétrů a organizace studií.
Stříbro/platina/uhlík (SPC)
Od 70. let minulého století se zkoumá využití uvolnění iontů oligodynamických kovů do roztoků pomocí elektrického proudu. Tento jev je známý pod názvem oligodynamická iontoforéza a může velmi významně redukovat bakteriální kolonizaci materiálů. Proud nutný k uvolnění dostatečného množství iontů stříbra k inhibici bakteriálního růstu je velmi malý (1–400 μA). Tato velikost proudu nezpůsobí ani lokální nekrózu, ani nevyvolává bolestivé pocity. Katétr Vantex® vyvinutý firmou Edwards Lifesciences využívá speciální konstrukce materiálu Oligon®. V nosném materiálu (polyuretan) jsou rozptýleny částice stříbra a platiny. Při oxidačně-redukční reakci předává stříbro elektron platině, a vzniká tak iont, který se může uvolnit do okolí. Vodivé prostředí zajišťují částice jemně rozptýleného uhlíku a celý katétr tak vlastně tvoří miniaturní galvanický článek, jehož činnost se spustí ve chvíli, kdy je katétr ponořen do elektrolytu (fyziologický roztok, krev, moč). Propustnost polyuretanu a koncentrace jednotlivých složek a velikost částic určuje množství uvolňovaného stříbra a dobu jeho uvolňování z katétru [23]. K uvolňování iontů stříbra dochází jak na vnějším, tak na vnitřním povrchu katétru. S ohledem na krátkou dobu od uvedení katétru Vantex® na trh (cca r. 2000) je počet studií malý [23, 31, 32] a hodnotitelnost výsledků pro rozdílnou organizaci studií je tedy obtížná. Jedná se o studie in vitro [32], studie nezaslepené komerční [33], studie srovnávající dva chráněné katétry bez kontrolní skupiny [23].
Stříbro/zeolit
Od roku 2001 nabízí firma Vygon katétr vybavený speciální technologií uvolňování kationtů stříbra pod názvem Multicath Expert® a nově také pod názvem Lifecath Expert®. Jedná se o silikonový katétr obsahující zeolit, který má ve své krystalické mřížce vázané kationty stříbra. Po namočení do elektrolytu obsahujícího sodné ionty dochází k pomalé výměně za ionty stříbra, které pomalu unikají vnitřním i vnějším povrchem katétru do okolní tekutiny. Tato technologie (AgION™) zajišťuje řízené uvolňování stříbra z katétru. Jediná studie sledující účinnost těchto katétrů neprokázala nižší četnost kolonizace katétrů ve srovnání s nechráněnými katétry [34].
Nanočástice stříbra
Katétr LogiCath AgTive®, dodávaný firmou Medex Medical Ltd., je impregnovaný nanočásticemi stříbra. Za nanočástice se považují částice o velikosti 10–100 nm. Použití takto malých částic využívá faktu, že aktivní povrch je při stejné hmotnosti stříbra mnohonásobně větší. Podle dostupných údajů v současné době probíhá randomizovaná multicentrická nezaslepená studie sledující infekce spojené s centrálním žilním katétrem u impregnovaných a standardních katétrů [ClinicalTrials.gov Id: NCT00337714].
Polyhexanid
Katétr vyráběný firmou BBraun pod označením Certofix protect® má povrch ošetřený vysokomolekulárním polymerem, který je nekovalentně vázaný na polyuretan katétru. Tato ochrana je aplikovaná na vnitřní i vnější povrch namáčením a následným sušením. Struktura polymeru je tvořena základní kostrou z metylmetakrylátu a čtyřmi postranními řetězci. Jeden postranní řetězec je derivátem polymerického biguanidu, který je chemicky podobný antiseptiku polyhexanidu. Polyhexanid je základem přípravků pro povrchovou dezinfekci a přípravků určených k výplachům ran (Lavasept®). Celá tato polymerická sloučenina je odpovědná za antimikrobiální a antitrombogenní vlastnosti katétru. Katétr Certofix protect® je na trhu od roku 2003. Od roku 2005 probíhá prospektivní randomizovaná bicentrická dvojitě zaslepená studie sledující četnost kolonizace a infekcí krevního řečiště spojené s katétrem u standardního a chráněného katétru [ClinicalTrials.gov Id: NCT00555282]. Předpokládané ukončení studie je v letech 2008–2009.
5-fluorouracil (5-FU)
Nový centrální žilní katétr pokrytý 5-fluorouracilem vyvíjí firma Angiotech. 5-FU je známá a dobře vyzkoušená látka se slibným potenciálem v aplikaci jako ochrana centrálních žilních katétrů, která navíc není široce používána v běžné praxi narozdíl od antibiotik a antiseptik používaných v nemocnicích. Z tohoto důvodu je zde předpoklad nízké rezistence mikroorganismů a malá pravděpodobnost vytvoření multirezistentních kmenů. Princip použití 5-FU spočívá v zabránění kolonizace katétru běžnými kmeny kolonizujícími kůži a vytváření biofilmu na zavedeném katétru. V letech 2005–2007 proběhla randomizovaná zaslepená multicentrická studie srovnávající katétry impregnované 5-fluorouracilem s katétry impregnovanými chlorhexidinem a sulfadiazinem stříbra. Výsledky této studie byly prezentovány na 28. mezinárodním kongresu intenzivní péče v Bruselu v březnu 2008 [35]. Výsledky této studie ukazují nesignifikantní rozdíly ve srovnání s CH-SS katétry. V dubnu 2008 bylo uděleno povolení FDA nutné k uvedení katétru na trh.
Hodnocení účinnosti
Problémy současných studií
Studiím sledujícím chráněné CŽK jsou v přehledech a metaanalýzách často vytýkány chyby v organizaci, sledovaných parametrech, statistice a jiných důležitých oblastech [2, 25, 36, 37]. Definice základních pojmů je velmi důležitá a velké množství studií trpí nedostatečnými, neúplnými nebo zavádějícími definicemi pro infekci krevního řečiště spojenou s CŽK. Nejčastěji není definována souvislost kmenů vykultivovaných z hemokultury s kmeny vykultivovanými z CŽK. Ve studiích pak nacházíme plnou škálu definic – od prostého tvrzení, že vykultivované kmeny musí být stejné, až k přesnému srovnávání citlivosti na ATB nebo srovnávání genotypů. Vlastnosti CŽK často znemožňují zaslepení studií, nebo je zaslepení velmi náročné, takže množství dvojitě zaslepených studií je velmi malé. Ve studiích často chybí sledování klíčových faktorů ovlivňujících četnost CRBSI, jako např. zhodnocení závažnosti stavu pacienta a jeho onemocnění, možnost imunosuprese a konkomitantní terapie (imunosupresiva, krevní deriváty, infuze obsahující lipidy). Ze statistických parametrů bývá poukazováno na chybějící statistické výpočty, často chybí intervaly spolehlivosti a údaje přepočítané na 1000 dnů zavedení CŽK. Některé studie neuvádějí klinicky relevantní údaje (délka pobytu na JIP, délka hospitalizace, celková mortalita, četnost nežádoucích účinků spojených s CŽK). Často bývá velký rozdíl i v metodikách mikrobiologické diagnostiky.
Mikrobiologické metody hodnocení kolonizace špičky CŽK:
- prostá kultivace,
- rolování po agaru,
- proplachování katétru,
- intraluminální stěr,
- sonifikační metoda.
K nejčastěji zmiňovaným technikám patří rolování po agaru a sonifikační metoda. Rolování po agaru podle Makiho je semikvantitativní metoda, hraniční pozitivita je udávána > 15 CFU. Tato metoda neodhalí intraluminální kolonizaci a je považována za metodiku již zastaralou. Kvantitativní metody, k nimž patří např. sonifikace, využívají uvolnění bakterií do přesně definovaného množství roztoku, takže po kultivaci je možno řádově stanovit množství mikroorganismů uvolněných ze zkoumaného materiálu. Hraniční pozitivita bývá stanovena na 103 CFU . ml-1. Použití různých způsobů v mikrobiologické diagnostice nebo nastavení různých prahových hodnot může značně zkreslovat výsledky prováděných studií.
Výsledky studií
Katétry chráněné antiseptikem (CH-SS)
Přehled z roku 2003, čerpající ze zdroje Medline, shrnuje především výsledky studií týkajících se katétrů impregnovaných směsí chlorhexidin/sulfadiazin stříbra – 10 studií [36]. Pro výrazné metodologické nedostatky (zaslepení studií, chybějící základní epidemiologické údaje) nebyla v tomto přehledu provedena metaanalýza, většina studií však vykazovala nesignifikantní rozdíly v CRBSI ve srovnání se standardními katétry.
Metaanalýza z roku 2007, čerpající ze zdrojů Medline a Cochrane Library, vyhodnotila 13 studií zaměřených na katétry s ochranou CH-SS [25]. Většina studií (12 ze 13) zjistila nižší četnost CRBSI u chráněných katétrů (RR 0,50, 95% CI 0,29–0,86) [38, 39]. Tento výsledek odpovídá NNT asi 100 (number needed to treat, v tomto případě znamená počet pacientů, u kterých je třeba zavést chráněný katétr, abychom ochránili jednoho pacienta před infekcí spojenou s katétrem) při riziku CRBSI 2,3 %.
Katétry chráněné antibiotikem (MR)
Metaanalýza, čerpající ze zdrojů PubMed a takéz centrálního registru kontrolovaných studií Cochrane, zaměřená na srovnání katétrů impregnovaných směsí minocyklin/rifampicin byla publikována v roce 2007 [24]. Bylo vyhodnoceno 8 studií. Impregnované katétry vykazovaly nižší četnost jak kolonizací (OR 0,46, 95% CI 0,31–0,69), tak i CRBSI (OR 0,23, 95% CI 0,14–0,40). V žádné ze studií nebyly popisovány nežádoucí účinky a nebyl rozdíl v mortalitě mezi skupinami. Je zde opět zmiňována nižší kvalita studií a nejasný dopad na vznik rezistence na rifampicin a minocyklin. Dále je zde vysloveno doporučení zaměřit se v dalším studiu na farmakoekonomické aspekty použití těchto katétrů.
Jiná metaanalýza z roku 2007, čerpající ze zdrojů Medline a Cochrane Library, vyhodnotila 5 studií [25]. Skupina ošetřená antibiotikem vykazovala nižší četnost CRBSI (RR 0,26, 95% CI 0,08–0,82). Tento výsledek odpovídá NNT 25 pro pacienty se základním rizikem CRBSI 5,2 %. Kolonizace katétrů zde nebyla sledována.
Katétry chráněné stříbrem (SPC)
Metaanalýza hodnotící katétry impregnované stříbrem (SPC) není pro již zmiňované problémy dostupná. Jedna ze dvou větších studií ukazuje snížení četnosti CRBSI (RR 0,35, 95% CI 0,01–8,47) [25, 31]. Druhá studie sice zmiňuje snížení rizika kolonizace katétru (RR 0,63, 95% CI 0,46–0,86), ale rozdíl v četnosti CRBSI nebyl signifikantní [33].
Postupy snižující četnost CRBSI
V současné době existuje velké množství studií zkoumajících jiná opatření snižující četnost CRBSI. Na jejich základě jsou vytvářena doporučení s odstupňovanou kategorizací jednotlivých tvrzení. Mezi nejčastěji zmiňovaná doporučení patří edukace lékařů a ošetřovatelského personálu, volba místa zavedení (přednost podklíčkového přístupu před femorálním), přísně aseptické podmínky při zavádění katétru [40–42]. Rutinní výměny nechráněných centrálních žilních katétrů nevedou ke snížení četnosti CRBSI [42]. Studie srovnávající jednotlivá opatření vzájemně nejsou dostupné, nebo jsou pouze ojedinělé a jejich případná organizace bude obtížná (např. velké množství jednotlivých opatření a nemožnost zaslepení).
Závěr
Výsledky metaanalýz sice ukazují účinnost chráněných katétrů ve snížení četnosti infekcí krevního řečiště, ale na jejich podkladě není možné v současné době vyslovit doporučení pro všeobecné používání těchto chráněných katétrů. Výsledky (především NNT) jsou výrazně závislé na celkové míře rizika infekce katétru na daném pracovišti. Pracoviště s nízkou mírou rizika mají výrazně vyšší NNT, a tím i nižší efektivitu tohoto opatření. Chráněné katétry by neměly být zaváděny u pacientů s předpokládanou dobou zavedení katétru kratší než 10 dní v případě, že se jedná o pracoviště s nízkou mírou rizika CRBSI.
Další výzkum se bude zřejmě zaměřovat na identifikaci rizikových skupin pacientů, kteří budou vhodnými kandidáty pro zavedení chráněných katétrů.
Došlo 12. 5. 2008.
Přijato 12. 6. 2008.
Adresa pro korespondenci:
MUDr. Ivo Křikava
Klinika anesteziologie, resuscitace a intenzivní medicíny
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
e-mail: ikrikava@fnbrno.cz
Zdroje
1. Edwards et al. National Healthcare Safety Network (NHSN) Report, data summary for 2006. Dostupné na: http://www.cdc.gov/ncidod/dhqp/nhsn_documents.html.
2. Gastmeier, P., Zuschneid, I., Geffers, C. Antimicrobially impregnated catheters: An overview of randomized controlled trials. Journal of Vascular Access, 2003, 4, 3, p. 102–110.
3. Horan, T. C., Gaynes, R. Surveillance of nosocomial infections. In Mayhall, C. G., ed. Hospital Epidemiology and Infection Control. Philadelphia: Lippincott Williams & Wilkins, 2004, p.1659–1702.
4. Černý, V. et al. Sepse v intenzivní péči. 2. vyd., 2005, p. 28–29.
5. Morales, M. et al. Biofilm: the microbial “bunker” for intravascular catheter-related infection. Support Care Cancer, 2004, 12, p. 701–707.
6. Růžička, F. Biofilm a jeho význam. In Kurz antibiotické terapie. Praha, 2005.
7. Modak, S. M., Sampath, L. Development and evaluation of a new polyurethane central venous antisepstic catheter. Complications Surg., 1992, 11, p. 23–29.
8. Richards, B. et al. Effect of central venous catheter type on infections: a prospective clinical trial. The Journal of Hospital Infection, 2003, 54, 1, p. 10–17.
9. van Vliet, J. et al. A comparison between two types of central venous catheters in the prevention of catheter-related infections: The importance of performing all the relevant cultures. Clinical Intensive Care, 2001, 12, 3, p. 135–140.
10. Tennenberg, S. et al. A prospective randomized trial of an antibiotic - and antiseptic-coated central venous catheter in the prevention of catheter-related infections. Archives of Surgery, 1997, 132, 12, p. 1348–1351.
11. Logghe, C. et al. Evaluation of chlorhexidine and silver-sulfadiazine impregnated central venous catheters for the prevention of bloodstream infection in leukaemic patients: a randomized controlled trial. The Journal of Hospital Infection, 1997, 37, 2, p. 145–156.
12. Ciresi, D. L. et al. Failure of antiseptic bonding to prevent central venous catheter-related infection and sepsis. The American Surgeon, 1996, 62, 8, p. 641–646.
13. Sheng, W. H. et al. Evaluation of antiseptic-impregnated central venous catheters for prevention of catheter-related infection in intensive care unit patients. Diagnostic Microbiology and Infectious Disease, 2000, 38, 1, p. 1–5.
14. Dunser, M. W. et al. Central venous catheter colonization in critically ill patients: a prospective, randomized, controlled study comparing standard with two antiseptic-impregnated catheters. Anesthesia and Analgesia, 2005, 101, 6, p. 1778–1784.
15. Maki, D. G. et al. Prevention of central venous catheter-related bloodstream infection by use of an antiseptic-impregnated catheter. A randomized, controlled trial. Annals of Internal Medicine, 1997, 127, 4, p. 257–266.
16. Brun-Buisson, C. et al. Prevention of intravascular catheter-related infection with newer chlorhexidine-silver sulfadiazine-coated catheters: a randomized controlled trial. Intensive Care Medicine, 2004, 30, 5, p. 837–843.
17. Rupp, M. E. et al. Effect of a second-generation venous catheter impregnated with chlorhexidine and silver sulfadiazine on central catheter-related infections: a randomized, controlled trial. Annals of Internal Medicine, 2005, 143, 8, p. 570–580.
18. Ostendorf, T. et al. Chlorhexidine and silver-sulfadiazine coated central venous catheters in haematological patients – A double-blind, randomised, prospective, controlled trial. Supportive Care in Cancer, 2005, 13, 12, p. 993–1000.
19. Stephens, R. et al. Two episodes of life-threatening anaphylaxis in the same patient to a chlorhexidine-sulphadiazine-coated central venous catheter. British Journal of Anaesthesia, 2001, 87, 2, p. 306–308.
20. Raad, I. et al. Antibiotics and prevention of microbial colonization of catheters. Antimicrobial Agents and Chemotherapy, 1995, 39, 11, p. 2397–2400.
21. Leon, C. et al. Benefits of minocycline and rifampin-impregnated central venous catheters. A prospective, randomized, double-blind, controlled, multicenter trial. Intensive Care Medicine, 2004, 30, 10, p. 1891–1899.
22. Darouiche, R. O. et al. A comparison of two antimicrobial-impregnated central venous catheters. New England Journal of Medicine, 1999, 340, 1, p. 1–8.
23. Fraenkel, D. et al. A prospective, randomized trial of rifampicin-minocycline-coated and silver-platinum-carbon-impregnated central venous catheters. Critical Care Medicine, 2006, 34, 3, p. 668–675.
24. Falagas, M. E. et al. Rifampicin-impregnated central venous catheters: A meta-analysis of randomized controlled trials. Journal of Antimicrobial Chemotherapy, 2007, 59, 3, p. 359–369.
25. Niël-Weise, B. S., Stijnen, T., van den Broek, P. J. Anti-infective-treated central venous catheters: a systematic review of randomized controlled trials. Intensive Care Med., 2007, 12, 33, p. 2058–2068.
26. Guggenbichler, J.-P. et al. A New Technology of Microdispersed Silver in Polyurethane Induces Antimicrobial Activity in Central Venous Catheters. Infection, 1999, 27, Suppl. 1, p. S16–S23.
27. Bechert, T. et al. The Erlanger Silver Catheter: In Vitro Results for Antimicrobial Activity. Infection, 1999, 27, Suppl. 1, p. S24–S29.
28. Boswald, M. et al. Reduced rates of catheter-associated infection by use of a new silver-impregnated central venous catheter. Infection, 1999, 27, Suppl. 1, p. S56–60.
29. Goldschmidt, H. et al. Prevention of catheter-related infections by silver coated central venous catheters in oncological patients. Zentralblatt für Bakteriologie : International Journal of Medical Microbiology, 1995, 283, 2, p. 215–223.
30. Furno, F. et al. Silver nanoparticles and polymeric medical devices: a new approach to prevention of infection? J. Antimicrob. Chemother., 2004, 54, p. 1019–1024.
31. Moretti, E. W. et al. Impact of central venous catheter type and methods on catheter-related colonization and bacteraemia. The Journal of Hospital Infection, 2005, 61, 2, p. 139–145.
32. Yorganci, K. et al. In Vitro Evaluation of the Antibacterial Activity of Three Different Central Venous Catheters Against Gram-Positive Bacteria. Eur. J. Clin. Microbiol. Infect. Dis., 2002, 21, p. 379–384.
33. Ranucci, M. et al. Impact of oligon central venous catheters on catheter colonization and catheter-related bloodstream infection. Crit. Care Med., 2003, 31, 1, p. 52–59.
34. Kalfon, P. et al. Comparison of silver-impregnated with standard multi-lumen central venous catheters in critically ill patients. Crit. Care Med., 2007, 35, 4, p. 1032–1039.
35. Walz, J. M. et al. A multicenter randomized controlled clinical trial comparing central venous catheters impregnated with either 5-Fluorouracil or chlorhexidine/silver sulfadiazine in preventing catheter colonization. 28th International Symposium on Intensive Care and Emergency Medicine, Brussels, March 18-21, 2008.
36. Scott, A. et al. Do Antimicrobial-Impregnated Central Venous Catheters Prevent Catheter-Related Bloodstream Infection? Clinical Infectious Diseases, 2003, 37, p. 65–72.
37. Crnich, C. J., Maki, D. G. Are antimicrobial-impregnated catheters effective? Don’t throw out the baby with the bathwater. Clin. Infect. Diseases, 2004, 38, 9, p. 1287–1292.
38. Carrasco, M. N. et al. Evaluation of a triple-lumen central venous heparin-coated catheter versus a catheter coated with chlorhexidine and silver sulfadiazine in critically ill patients. Intensive Care Medicine, 2004, 30, 4, p. 633–638.
39. Collin, G. R. Decreasing catheter colonization through the use of an antiseptic-impregnated catheter: a continuous quality improvement project. Chest, 1999, 115, 6, p. 1632–1640.
40. Cicalini, S., Palmieri, F., Petrosillo, N. Clinical review: New technologies for prevention of intravascular catheter-related infections. Critical Care, 2004, 8, 3, p. 157–162.
41. Eggimann, P. Prevention of intravascular catheter infection. Current Opinion in Infectious Diseases, 2007, 20, 4, p. 360–369.
42. O’Grady, N. et al. Guidelines for the prevention of intravascular catheter-related infections. Infection Control and Hospital Epidemiology, 2002, 23, 12, p. 759–769.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Stala se chyba a jak dál?Článek Reaktivita na volumexpanzi a její predikce u nemocných po srdeční zástavě léčených mírnou hypotermiíČlánek Vzdělávací akce IPVZČlánek Vzdělávací akce IPVZČlánek Konference a kongresyČlánek Zdroje na www.csarim.czČlánek Výborová schůze ČSARIMČlánek In memoriam Peter BaskettČlánek UEMS
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2008 Číslo 4- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
-
Všetky články tohto čísla
- Šance na postup do elitního klubu – nastal čas na změnu a co pro to musíme udělat?
- Déjà vu, mais pas en anglais aneb jak podpořit náš časopis a zachovat publikační etiku
- Stala se chyba a jak dál?
- Poslední halotanová hepatitida v České republice?
- Reaktivita na volumexpanzi a její predikce u nemocných po srdeční zástavě léčených mírnou hypotermií
- Vzdělávací akce IPVZ
- Akútna intoxikácia teofylínom
- Vzdělávací akce IPVZ
- Akutní diseminovaná encefalomyelitida
- Možnosti antimikrobiální ochrany centrálních žilních katétrů
- Léčba akutního srdečního selhání – přehled
- Počátky anesteziologie na ORL klinice LF UK v Plzni
- Minářovy dny – MUDr. Jiří Minář, CSc.*
- Předběžná statistická data oboru Anesteziologie a resuscitace, Česká republika za rok 2007
- Konference a kongresy
- Nový výukový internetový portál www.akutne.cz
- Novinky v intenzivní medicíně 2007
- Identifikační a slevové karty pro všechny členy ČLS JEP
- Zdroje na www.csarim.cz
- Doporučené postupy a stanoviska ČSARIM na www.csarim.cz
- Výborová schůze ČSARIM
- Informace pro členy společnosti
- Referátový výběr z anesteziologie, resuscitace a intenzivní medicíny
- In memoriam Peter Baskett
- Zápis z jednání výboru 2/2008
- Zápis z jednání výboru 3/2008
- European Board of Intensive Care Medicine Meeting Minutes
- UEMS
- Za prim. MUDr. Oldřichem Markem, Ph.D.
- MUDr. Oldřich Marek, Ph.D., in memoriam
- Poslední vzpomínka na prim. MUDr. Oldřicha Marka, Ph.D.
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Akutní diseminovaná encefalomyelitida
- Možnosti antimikrobiální ochrany centrálních žilních katétrů
- Referátový výběr z anesteziologie, resuscitace a intenzivní medicíny
- Akútna intoxikácia teofylínom
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



