-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kontinuální versus intermitentní podání vankomycinu u grampozitivních infekcí rezistentních na beta-laktamová antibiotika u nemocných v intenzivní péči
Continuous infusion versus intermittent administration of vancomycin in critically ill patients with Gram-positive infections resistant to beta-lactam antibiotics
Objective:
The aim of study was to compare the clinical and microbiological efficacy of continuous infusion versus intermittent administration of vancomycin in critically ill patients with Gram-positive infections resistant to beta-lactam antibiotics. The second goal was to evaluate the safety of both the vancomycin administration modes in relation to renal function.Design:
Prospective randomized controlled study.Setting:
Interdisciplinary intensive care unit of a University teaching hospital.Materials and methods:
Patients admitted to the interdisciplinary ICU suffering from Gram-positive infection indicated for vancomycin administration were randomized to receive either continuous infusion or intermittent administration of vancomycin according to defined protocols. In addition to the basic variables, parameters allowing evaluation of efficacy and safety of the continuous and intermittent administration of vancomycin were assessed. Paired and unpaired t-test, Mann-Whitney test, Wilcoxon test, chi-square test and Fisher’s exact test were used accordingly; p < 0.05 was considered statistically significant.Results:
A total of 65 patients were enrolled and randomized to the continuous (n = 32) or intermittent (n = 33) groups. No significant differences between the groups were found in the clinical (69% vs. 64%; p = 0.58) and microbiological (59% vs. 76%; p = 0.23) efficacy, in the length of ICU stay, in ICU mortality, in the length of vancomycin therapy and in the total dose of vancomycin. No changes in serum creatinine concentration and glomerular filtration rate were detected during the period of vancomycin administration.Conclusion:
Continuous infusion and intermittent administration of vancomycin in critically ill patients provided an equivalent clinical and microbiological outcome. Neither continuous nor intermittent administration of vancomycin was associated with deterioration of the renal function.
The intermittent mode of application required more frequent assessment of the serum vancomycin concentration.Keywords:
vancomycin – continuous infusion – clinical efficacy – microbiological efficacy – nefrotoxicity
Autoři: Štěpán Martin 1; Chytra Ivan 1; Pelnář Petr 2; Bergerová Tamara 2; Kasal Eduard 1
Působiště autorů: Anesteziologicko-resuscitační klinika, Fakultní nemocnice v Plzni, Univerzita Karlova v Praze, Lékařská fakulta v Plzni 1; Ústav mikrobiologie, Fakultní nemocnice v Plzni 2
Vyšlo v časopise: Anest. intenziv. Med., 20, 2009, č. 6, s. 309-316
Kategorie: Intenzivní medicína - Původní práce
Souhrn
Cíl studie:
Cílem studie bylo srovnat klinickou a mikrobiologickou účinnost intermitentně a kontinuálně aplikovaného vankomycinu při léčbě grampozitivních infekcí rezistentních na beta-laktamová antibiotika u nemocných v intenzivní péči a zhodnotit bezpečnost obou režimů aplikace vankomycinu ve vztahu k funkcím ledvin.Typ studie:
Otevřená prospektivní randomizovaná srovnávací studie.Typ pracoviště:
Resuscitační oddělení anesteziologicko-resuscitační kliniky Fakultní nemocnice.Materiál a metoda:
Do studie byli zařazeni pacienti s grampozitivní infekcí, u nichž byla na podkladě mikrobiologického vyšetření indikována antibiotická léčba vankomycinem. Nemocní splňující vstupní kritéria byli rozděleni do skupiny s kontinuální nebo intermitentní aplikací vankomycinu podle stanoveného protokolu. Vedle základních parametrů byly sledovány parametry umožňující hodnotit účinnost a bezpečnost obou režimů aplikace vankomycinu. Ke statistickému hodnocení byly užity párový a nepárový t-test, Mannův-Whitneův test, Wilcoxonův test, chí-kvadrát test a Fisherův exaktní test. Pro všechny testy byla zvolena hladina významnosti p < 0,05.Výsledky:
Ve studii bylo hodnoceno 65 nemocných rozdělených do skupiny s intermitentní (n = 32) nebo kontinuální (n = 33) aplikací vankomycinu. Mezi intermitentním a kontinuálním podáním vankomycinu nebyl prokázán významný rozdíl v klinické ani mikrobiologické úspěšnosti léčby (69% vs 64%; p = 0,58, respektive 59% vs 76%; p = 0,23), v délce hospitalizace v intenzivní péči, v mortalitě v intenzivní péči, v délce léčby vankomycinem, ani v celkové dávce vankomycinu. V žádné z obou skupin nedošlo ke zvýšení hodnot kreatininu nebo k poklesu glomerulární filtrace.Závěr:
Kontinuální i intermitentní podání vankomycinu bylo spojeno se srovnatelným klinickým a mikrobiologickým účinkem. V žádné z obou skupin nedošlo v průběhu léčby ke zhoršení renálních funkcí. Intermitentní aplikace vankomycinu vyžadovala vyšší počet stanovení sérové koncentrace vankomycinu.Klíčová slova:
vankomycin – kontinuální infuze – klinická úspěšnost – mikrobiologická úspěšnost – nefrotoxicitaÚvod
Problémy s narůstající rezistencí mikrobů a omezená možnost vývoje antibiotik působících novými mechanismy vede k výzkumu antibiotik užívaných v současnosti. Velká pozornost je věnována studiím, které se snaží maximalizovat antibiotickou účinnost optimálním režimem dávkování. Farmakodynamické studie klasifikovaly antibiotika do skupin podle toho, zda je jejich účinnost závislá na vrcholové koncentraci dosažené po jejich podání (aminoglykosidy, fluorochinolony, nitroimidazoly, polymyxiny), nebo na době, po kterou je koncentrace antibiotika vyšší než minimální inhibiční koncentrace (beta-laktamy, oxazolidiny, některé makrolidy a linkosamidy).
U kriticky nemocných je včasná a správná antibiotická léčba základním předpokladem příznivých klinických výsledků, proto je optimálnímu režimu aplikace antibiotik věnována stále větší pozornost.
Vankomycin je užíván k léčbě grampozitivních (G+) infekcí déle než 50 let. Do nedávné doby byl nejúčinnějším antibiotikem proti problémovým patogenům, jako jsou Enterococcus species a methicillin rezistentní stafylokoky. Přes dostupnost nových antibiotik účinných proti G+ patogenům (linezolid, tigecycline, televancin) zůstává vankomycin u G+ infekcí rezistentních na beta-laktamová antibiotika lékem volby.
Farmakodynamické vlastnosti vankomycinu nejsou zcela objasněny. Ve studiích in vitro nevykazoval vankomycin závislost baktericidního účinku na vrcholové koncentraci a měl proti grampozitivním kokům jen mírný a krátkodobý postantibiotický efekt [1]. Jiné experimentální studie však určitou závislost účinku vankomycinu na velikosti vrcholové plazmatické koncentrace demonstrovaly [2]. Další práce navrhují jako nejdůležitější parametr korelující s účinností vankomycinu poměr plochy pod křivkou sérové koncentrace v průběhu 24hodinového intervalu a minimální inhibiční koncentrace (AUC24/MIC) [3, 4]. Vzhledem k těmto variabilním nálezům je optimální dávkovací režim vankomycinu nejasný a není jednoznačné doporučení pro jeho kontinuální nebo intermitentní aplikaci. U kriticky nemocných může být farmakokinetika vankomycinu proti běžným pacientům významně alterována [5] a při zvětšení distribučního objemu nebo zvýšení clearance může vést k nízkým koncentracím [4]. V těchto případech může kontinuální infuzní podání umožnit přesnější dosažení cílových koncentrací, a tím i lepších léčebných výsledků [6].
Cílem prospektivní randomizované studie bylo srovnat klinickou a mikrobiologickou účinnost intermitentně a kontinuálně aplikovaného vankomycinu při léčbě G+ infekcí rezistentních na beta-laktamová antibiotika u nemocných hospitalizovaných na lůžkovém oddělení ARK v Plzni. Dalším cílem bylo srovnat bezpečnost obou způsobů podání vankomycinu ve vztahu k funkcím ledvin.
Soubor a metoda
Otevřená prospektivní randomizovaná srovnávací studie byla součástí výzkumného záměru a byla schválena Etickou komisí Fakultní nemocnice Plzeň. Informovaný souhlas nemocného nebo jeho příbuzných nebyl (se souhlasem etické komise) vyžadován, protože metoda intermitentní a kontinuální aplikace některých antibiotik je součástí standardního léčebného režimu pracoviště. Souhlas k provedení studie byl zajištěn nezávislým lékařem a každý pacient byl při propuštění o účasti v klinické studii informován. U propuštěných nemocných byl získán souhlas se statistickým zpracováním získaných dat a s jejich publikací, při zachování anonymity osoby nemocného.
Do studie byli zařazeni pacienti s grampozitivní infekcí (abdominální infekce, bronchopneumonie, infekce kůže, měkkých tkání a kostí, infekce krevního řečiště, uroinfekce) hospitalizovaní na ARK FN v Plzni od 1. 5. 2004 do 1. 5. 2008, u nichž byla na podkladě mikrobiologického vyšetření a po konzultaci s mikrobiologem indikována antibiotická léčba vankomycinem. Podmínkou setrvání ve studii byla doba podávání vankomycinu nejméně 4 dny. Do studie nebyli zařazeni pacienti mladší 18 let, těhotné ženy, nemocní s koncentrací kreatininu v séru vyšší než 200 µmol . l-1 a pacienti se známou přecitlivělostí na vankomycin. Nemocní splňující vstupní kritéria byli rozděleni do skupiny s intermitentní (Van-I) nebo kontinuální (Van-K) aplikací vankomycinu.
U intermitentního dávkování bylo cílem dosažení průběžné koncentrace vankomycinu v séru 5–10 mg . l-1, cílová vrcholová hladina po podání byla stanovena na 25–40 mg . l-1. Při kontinuální aplikaci byla cílová plateau koncentrace vankomycinu v séru stanovena na 15–25 mg . l-1 [4, 7]. Vankomycin v intermitentním i kontinuálním režimu byl dávkován podle protokolu (obr. 1) modifikovaného podle Wyncolla et al. [7].
Obr. 1. Protokol dávkování vankomycinu 
Vankomycin byl aplikován samostatně do jednoho z lumin centrálního žilního katétru, vzorky pro stanovení koncentrace v séru vankomycinu byly odebírány z arteriálního vstupu nebo z periferní žíly. U nemocných s intermitentní aplikací vankomycinu byly pro stanovení vrcholové koncentrace vzorky odebírány 30 minut po skončení aplikace, pro stanovení průběžné hladiny bezprostředně před další aplikací vankomycinu. Pro stanovení plateau koncentrace u nemocných s kontinuálním podáním vankomycinu byl vzorek odebírán každý den ráno (v 5,00 hodin) společně s ostatními běžně indikovanými odběry.
Klinické hodnocení účinnosti antimikrobiální léčby bylo prováděno v průběhu léčby a po jejím skončení. Nemocný byl hodnocen jako vyléčený při vymizení všech známek a symptomů infekce. Stav nemocného s přetrvávajícími příznaky infekce, které byly výrazně menší než při zahájení ATB léčby, byl hodnocen jako zlepšený (zlepšení klinického stavu se známkami ústupu aktivní infekce – pokles teploty pod 38,3 °C, pokles leukocytů pod 10 . 109. l-1 nebo o více než 25 % maximální hodnoty, hodnota CRP ≤ 100 mg/l) [8]. Pro statistické zpracování byly oba tyto stavy hodnoceny jako klinicky úspěšný výsledek antibiotické léčby. Jako klinické selhání antibiotické léčby byl hodnocen stav v případě přetrvávání nebo progrese známek a symptomů infekce nebo v případě úmrtí pacienta v důsledku léčené infekce. Pokud došlo ke klinickému zlepšení infekce během ATB léčby a nemocný zemřel z jiné než infekční příčiny, byl klasifikován jako zlepšený.
Mikrobiologické hodnocení účinnosti antimikrobiální léčby bylo prováděno po skončení léčby a efekt léčby byl klasifikován jako eradikace, předpokládaná eradikace, perzistence, superinfekce, rekurence nebo nehodnotitelný. Eradikace byla definována jako eliminace patogenu z místa izolace. Jako předpokládaná eradikace byl hodnocen stav při dobrém klinickém efektu, pokud nebyl dostupný mikrobiologický materiál. Jako perzistence byl hodnocen stav při selhání eradikace, nebo pokud nebyl dostupný materiál při klinickém selhání léčby, nebo pokud došlo ke vzniku rezistence. Jako superinfekce byl klasifikován stav při průkazu jiného patogenu z místa původní izolace. Jako rekurence byl hodnocen stav, kdy došlo k nálezu původního agens z místa izolace po přechodné eradikaci. Kategorie eradikace a předpokládaná eradikace byly hodnoceny jako mikrobiologicky úspěšný výsledek léčby. Perzistence, předpokládaná perzistence nebo rezistence byly hodnoceny jako mikrobiologické selhání léčby. Kategorie superinfekce a rekurence byla hodnocena jako mikrobiologický úspěch nebo selhání na základě klinické odpovědi na léčbu. Při polymikrobiálním nálezu byly mikrobiologicky hodnoceny mikroorganismy primárně citlivé na vankomycin.
Pro hodnocení bezpečnosti antibiotické léčby ve vztahu k ledvinným funkcím byly průběžně měřeny sérové koncentrace kreatininu, hodnoty glomerulární filtrace byly kalkulovány pomocí vzorce podle studie MDRD (The Modification of Diet in Renal Disease) [9] doporučeného National Kidney Foundation v USA [10].
V obou skupinách byly hodnoceny následující parametry: věk, pohlaví, hmotnost, délka umělé plicní ventilace (UPV), délka hospitalizace v intenzivní péči, mortalita v intenzivní péči, typ infekce, vyvolávající agens včetně MIC vankomycinu, závažnost stavu při přijetí hodnocená skórovacím systémem APACHE II (Acute Physiology and Chronic Health Evaluation), stupeň orgánové dysfunkce při přijetí hodnocený pomocí SOFA skóre (Sequential Organ Failure Assessment), klinická a mikrobiologická účinnost antibiotické léčby vankomycinem, hodnota CRP (C-reaktivní protein) a leukocytů před zahájením léčby a po jejím skončení, koncentrace vankomycinu v séru podle uvedeného protokolu a četnost jejího stanovení v obou dávkovacích režimech, délka léčby vankomycinem a jeho dávka (dávka/24hodin, celková dávka), koncentrace kreatininu v séru a glomerulární filtrace před zahájením léčby a po jejím skončení.
Minimální inhibiční koncentrace (MIC) vankomycinu pro identifikované patogeny byly stanoveny pomocí Etestu (AB BIODISK, Solna, Sweden). Koncentrace vankomycinu v séru byly stanoveny na analyzátoru Axsym firmy Abbott metodou FPIA (Fluorescence Polarization Immunoassay).
Statistika
Pro inspekci proměnných byly užity popisné statistiky. Nulové hypotézy byly testovány v případě normálního rozložení proměnných párovým a nepárovým t-testem, v případě porušení normality rozložení dat testem Mannovým-Whitneovým nebo párovým Wilcoxonovým testem. Tabelární frekvenční data byla analyzována chí-kvadrát testem nebo Fisherovým exaktním testem.Výsledky užitých testů jsou vyjádřeny hodnotami pravděpodobnosti.
Pro všechny testy byla zvolena hladina významnosti p < 0,05. Podle distribuce proměnných jsou hodnoty vyjádřeny jako medián a rozpětí mezi prvním a třetím kvartilem (interquartile range – IQR) nebo jako průměr a směrodatná odchylka (± SD). Statistické vyhodnocení bylo provedeno s využitím statistického software MedCalc®, Version 10.3.2.0. Copyright® 1993–2009, Frank Schoonjans.
Výsledky
V období od 1. 5. 2004 do 1. 5. 2008 byla léčba vankomycinem indikována u 88 nemocných hospitalizovaných na ARK FN v Plzni. Vstupní kritéria splnilo 69 nemocných, kteří byli rozděleni do skupiny s intermitentní (Van-I) nebo s kontinuální (Van-K) aplikací vankomycinu. Čtyři nemocní byli ze studie později vyřazeni pro nesplnění minimální délky aplikace vankomycinu (obr. 2). Obě skupiny se nelišily ve věku, pohlaví, v závažnosti stavu při přijetí na ARK hodnoceném pomocí APACHE II skóre, ve stupni orgánové dysfunkce hodnocené pomocí příjmového SOFA skóre, v hodnotách CRP, v hodnotách kreatininu a glomerulární filtrace. Větší leukocytóza (p = 0,01) byla prokázána u skupiny s intermitentním podáním vankomycinu (tab.1).
Obr. 2. Postup při zařazení nemocných do studie 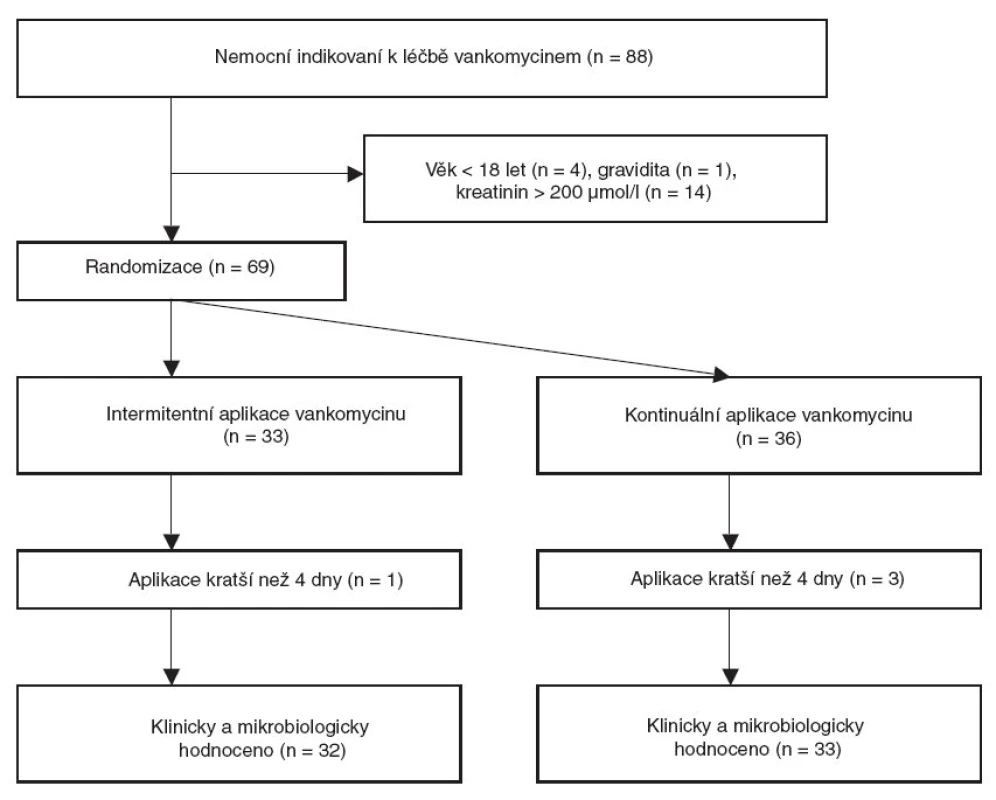
Tab. 1. Základní charakteristika souboru 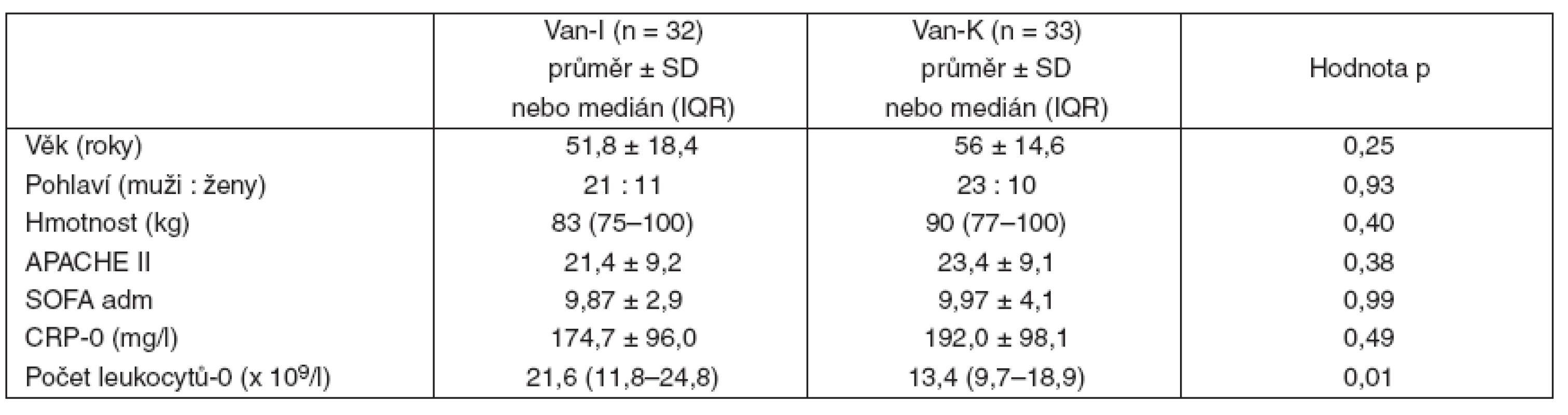
Van-I – intermitentní aplikace vankomycinu, Van-K – kontinuální aplikace vankomycinu, APACHE II – Acute Physiology and Chronic Health Evaluation, SD – směrodatná odchylka, IQR – interquartile range, SOFA adm – Sequential Organ Failure Assessment při přijetí, CRP-0 – C-reaktivní protein před zahájením léčby, počet leukocytů-0 – před zahájením léčby Mezi oběma skupinami nebyl rozdíl v typu infekce, s výjimkou vyšší frekvence abdominálních infekcí u skupiny s kontinuální aplikací vankomycinu, která se pohybovala na hranici významnosti (p = 0,05) – tabulka 2. Vyvolávajícím agens infekcí indikovaných k léčbě vankomycinem byly stafylokoky a enterokoky rezistentní na beta-laktamová antibiotika. Ve skupině s intermitentní aplikací vankomycinu byly původcem infekce častěji stafylokoky (p = 0,03), nevýznamně vyšší byl ve skupině s kontinuálním podáním kultivační nález enterokoků (p = 0,09). Hodnoty MIC vankomycinu pro identifikované patogeny byly v obou skupinách srovnatelné (tab. 3).
Tab. 2. Typy infekcí 
Van-I – intermitentní aplikace vankomycinu, Van-K – kontinuální aplikace vankomycinu Tab. 3. Kultivační nálezy 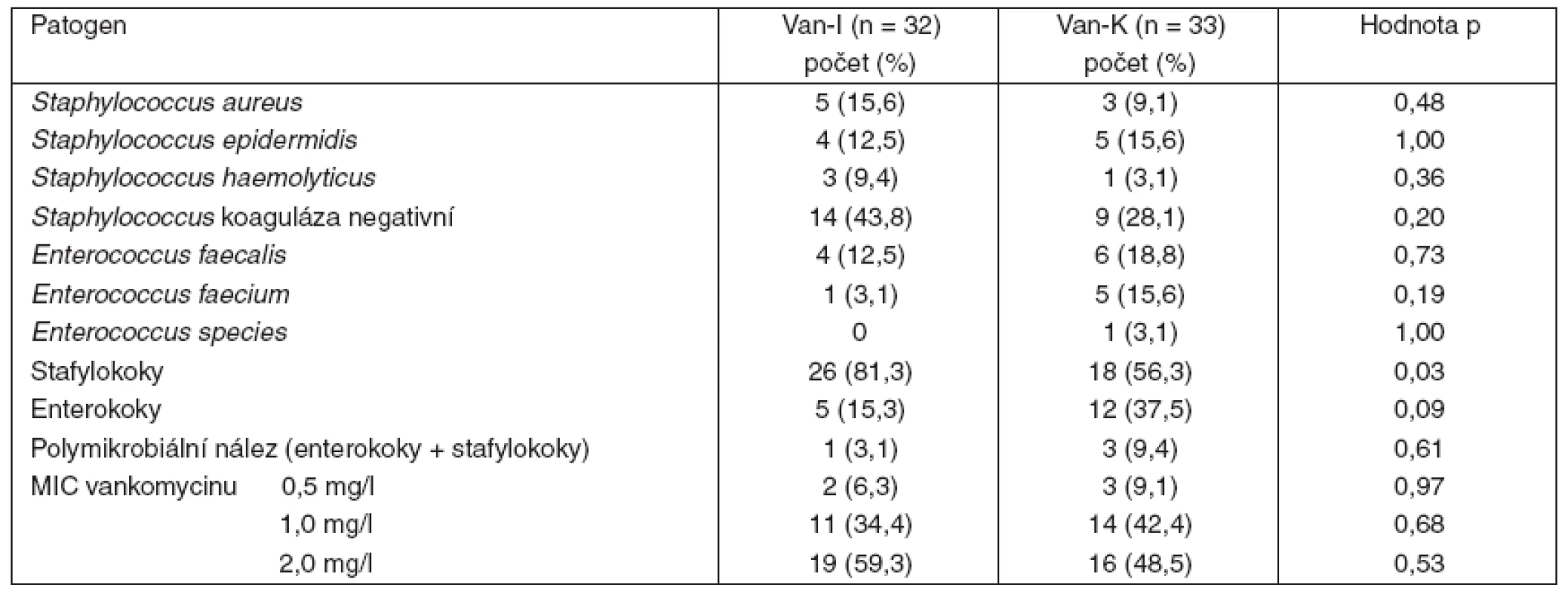
Van-I – intermitentní aplikace vankomycinu, Van-K – kontinuální aplikace vankomycinu MIC – minimální inhibiční koncentrace Mezi oběma skupinami nebyl nalezen rozdíl v klinické a mikrobiologické úspěšnosti léčby, stejně jako v délce umělé plicní ventilace, v délce hospitalizace a v mortalitě v intenzivní péči (tab. 4). Významný rozdíl v počtu leukocytů mezi oběma skupinami zjištěný při zahájení léčby již nebyl po jejím skončení průkazný. V průběhu léčby došlo v obou skupinách proti výchozím hodnotám k nevýznamnému poklesu počtu leukocytů. Obě skupiny se nelišily ve vstupních hodnotách CRP, ani v hodnotách CRP po skončení léčby. Pokles hodnot CRP po skončení léčby proti vstupním hodnotám byl v obou skupinách významný (p < 0,01) – tabulka 5.
Tab. 4. Hodnocení léčby I. 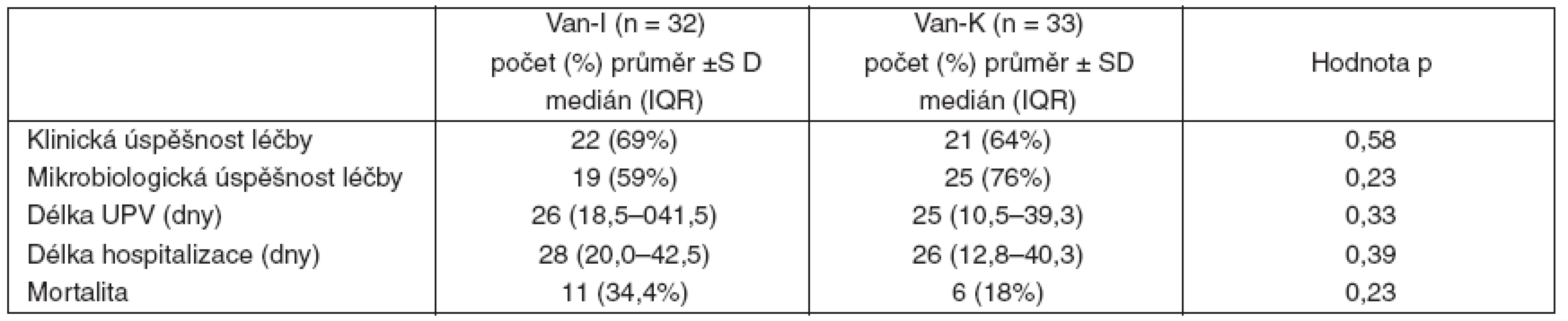
Van-I – intermitentní aplikace vankomycinu, Van-K – kontinuální aplikace vankomycinu, SD – směrodatná odchylka, IQR – interquartile range, UPV – umělá plicní ventilace Tab. 5. Hodnocení léčby II. 
Van-I – intermitentní aplikace vankomycinu, Van-K – kontinuální aplikace vankomycinu, SD – směrodatná odchylka, IQR – interquartile range, počet leukocytů-0 – před zahájením léčby, počet leukocytů-end – po skončení léčby, CRP-0 – C-reaktivní protein před zahájením léčby, CRP-end – C-reaktivní protein po skončení léčby, # – p < 0,05 při srovnání CPR-0 a CRP-end Nežádoucí účinky spojené s aplikací vankomycinu, které by vyžadovaly ukončení jeho podávání, nebyly ve sledovaných skupinách pozorovány. V průběhu léčby nedošlo ani v jedné ze skupin ke zvýšení hodnot kreatininu nebo k poklesu glomerulární filtrace (tab. 6).
Tab. 6. Hodnocení bezpečnosti léčby 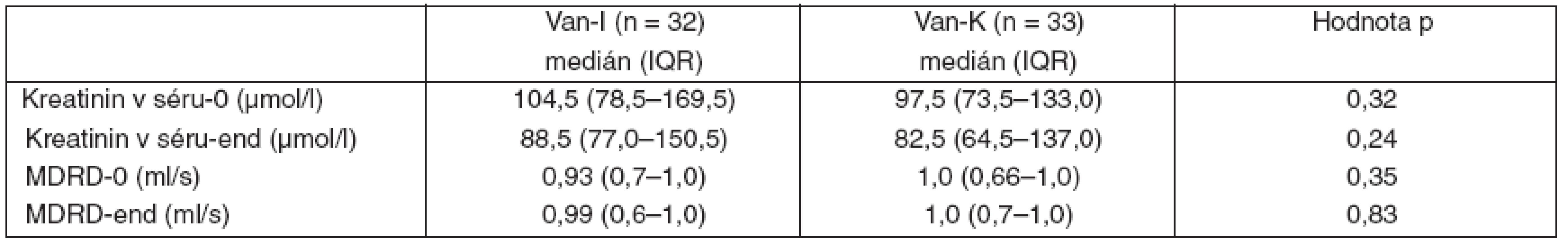
Van-I – intermitentní aplikace vankomycinu, Van-K – kontinuální aplikace vankomycinu, IQR – interquartile range, kreatinin-0 – hodnota před podáním vankomycinu, kreatinin-end – hodnota po skončení aplikace vankomycinu, MDRD-0 – hodnota glomerulární filtrace před podáním vankomycinu, MDRD-end – hodnota glomerulární filtrace po skončení aplikace vankomycinu Obě skupiny se nelišily v délce léčby vankomycinem, v dávce vankomycinu za 24 hodin ani v jeho celkové dávce. Při použitém protokolu dávkování bylo v obou skupinách dosaženo zvolených cílových sérových koncentrací vankomycinu, které více než 5krát překračovaly MIC identifikovaných patogenů. Počet vyšetření koncentrace vankomycinu v séru a s ním spojené náklady byly vyšší u skupiny s intermitentním podáním vankomycinu (tab. 7).
Tab. 7. Léčba vankomycinem – přehled hodnocených parametrů 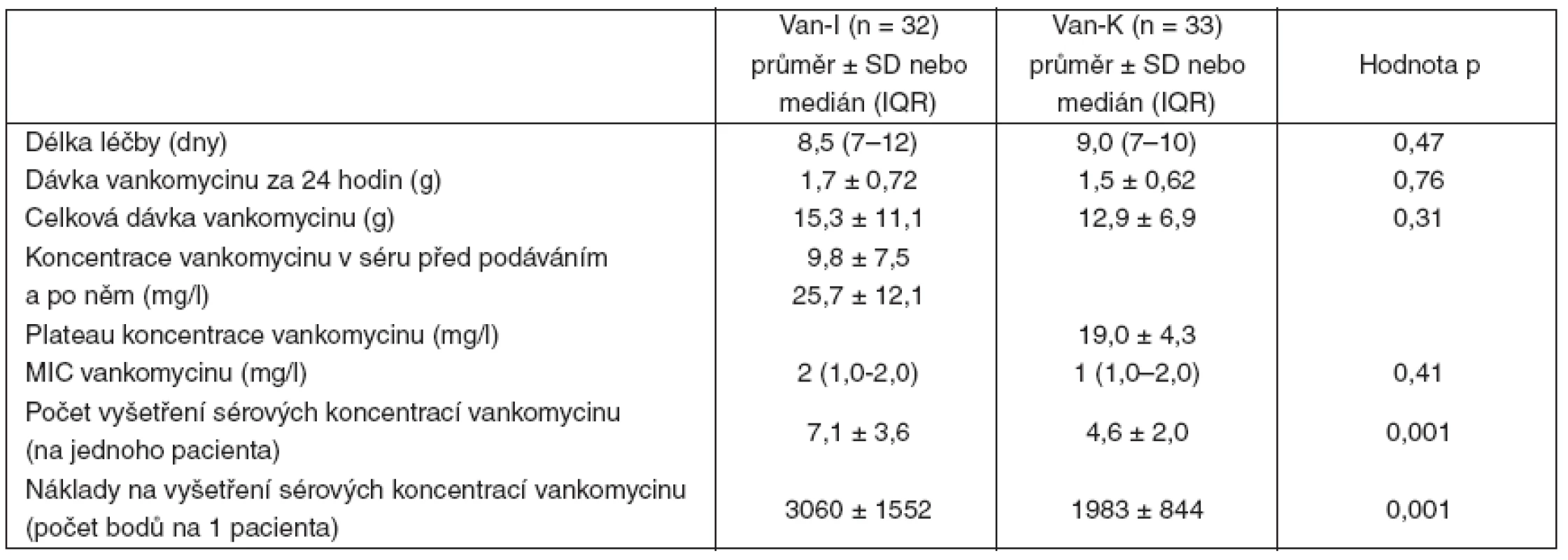
V Van-I – intermitentní aplikace vankomycinu, Van-K – kontinuální aplikace vankomycinu, MIC – minimální inhibiční koncentrace, počet bodů podle kódu 99135 – antibiotika jednotlivě – 431 bodů [Seznam zdravotních výkonů s bodovými hodnotami, Vyhláška MZ ČR č. 439/2008 Sb.] Diskuse
Optimální způsob podání antibiotika maximalizuje antibakteriální aktivitu a současně minimalizuje expozici nemocného vůči podávané látce. Přes dlouhodobé užívání vankomycinu však není do současné doby známo, jaký způsob aplikace je nejvýhodnější. K nejčastěji uváděným výhodám kontinuální aplikace vankomycinu patří nižší náklady spojené s nižší celkovou dávkou vankomycinu, menší riziko poddávkování, nižší toxicita a monitorování sérové koncentrace jednou denně ve zvolený čas, společně s jiným laboratorním vyšetřením. Teoretickou předností kontinuální aplikace může být kratší doba léčby a úspora času ošetřujícího personálu. Argumentem proti režimu kontinuální aplikace vankomycinu je především nedostatek důkazů o jeho příznivém vlivu na léčebné výsledky [7].
Výsledky naší studie neprokázaly v klinické ani v mikrobiologické účinnosti kontinuálního a intermitentního podání vankomycinu významný rozdíl. Zlepšení orgánových funkcí a odpovědi leukocytů při kontinuálním podání vankomycinu proti intermitentní aplikaci demonstroval v malé studii u 25 nemocných Di Filippo, neprokázal však rozdíl ve vývoji onemocnění [11]. Lepší klinickou a mikrobiologickou efektivitu kontinuální aplikace vankomycinu neprokázal v poměrně velké prospektivní multicentrické klinické studii u 119 nemocných ani Wysocki [12]. Pokud je autorům známo, jedinou studií, která prezentovala nižší mortalitu u nemocných s kontinuálním podáním vankomycinu (25% versus 55%, p = 0,03), je práce Rella hodnotící léčbu pneumonie vyvolanou methicillin rezistentním Staphylococcus aureus podáním glykopeptidů [13]. Kontinuální aplikace vankomycinu byla v této práci mnohočetnou logistickou regresí identifikována jako nezávislý faktor spojený s lepším přežitím (odds ratio pro mortalitu 0,22; 95% interval spolehlivosti 0,1–0,8). Výsledky této studie je však nutno hodnotit velmi opatrně, protože nebyla koncipována ke srovnání různých dávkovacích režimů, a proto chybí základní farmakodynamická data.
Pro srovnání frekvence nežádoucích účinků při kontinuálním a intermitentním podání vankomycinu je jen málo dostupných literárních údajů. Při aplikaci vankomycinu u nemocných s osteomyelitidou byla kontinuální infuze spojena s více nežádoucími účinky (42,9% vs 8,7%, p = 0,03), které zahrnovaly akutní poškození ledvin, alergické reakce a flebitidy [14]. Naproti tomu ve velké prospektivní studii Wysocki [12] nepozoroval v nefrotoxicitě žádný rozdíl. V průběhu naší studie jsme nezaznamenali žádné komplikace ve spojitosti s podáním vankomycinu, které by vedly k nutnosti přerušit léčbu. V žádné z obou skupin nedošlo k poklesu glomerulární filtrace nebo ke vzestupu kreatininu. Nefrotoxický potenciál vankomycinu bývá udáván jako menší než 5%, při současném podání s aminoglykosidy však 3–4krát potencuje nefrotoxicitu aminoglykosidů [15]. Při monitorování sérových koncentrací vankomycinu a respektování doporučených hladin je riziko poškození renálních funkcí nízké.
Jednou z předností kontinuálního režimu bývá uváděna redukce celkové dávky vankomycinu. V naší studii nebyl rozdíl v celkové dávce vankomycinu u intermitentní (15,3 g) a kontinuální aplikace (12,9 g) významný. Jedním z důvodů může být relativní poddávkování vankomycinu u skupiny s intermitentním režimem, kdy dosažená vrcholová koncentrace (25,7 mg . l-1) je těsně nad dolní cílovou hranicí (25–40 mg . l-1), ale plateau koncentrace (19,0 mg . l-1) u kontinuálního se blížila středu cílových hodnot (15–25 mg . l-1). Navíc, ve studii, která demonstrovala snížení celkové dávky vankomycinu při kontinuálním podání, byla ve skupině s intermitentním režimem zvolena vyšší cílová průběžná koncentrace (10–15 mg . l-1) vyžadující při intermitentním podání vyšší dávkování [12]. Cílové hodnoty zvolené pro naší studii se ve vztahu k MIC identifikovaných patogenů ukázaly jako dostatečné a zabezpečily v souladu s doporučením v obou skupinách koncentraci vankomycinu 4–5krát vyšší než MIC [4].
Vyšší náklady na laboratorní vyšetření reflektovaly častější stanovení vrcholové i průběžné koncentrace vankomycinu u intermitentního režimu. Rozdíl v nákladech na laboratorní stanovení koncentrace vankomycinu byl 1100 bodů (~1100 Kč) přibližně za 9 dní. I když z hlediska celkových nákladů na léčbu kriticky nemocného je tato úspora nepříliš významná, není z principu ekonomického myšlení zanedbatelná.
Naše studie je spojena s řadou nedostatků, které limitují zobecnění jejích výstupů. Hodnocení klinické a mikrobiologické úspěšnosti léčby v naší studii může být ovlivněno jednak rozdíly v typech infekce v obou skupinách, jednak rozdíly v zastoupení jednotlivých vyvolávajících patogenů (tab. 2, tab. 3). Výsledky u intermitentní aplikace mohly být příznivě ovlivněny četnějším nálezem stafylokoků, na které vankomycin působí primárně baktericidně, zatímco na enterokoky (četnější ve skupině s kontinuální aplikací) pouze bakteriostaticky. Navíc průnik vankomycinu do peritoneální dutiny při léčbě abdominálních infekcí (četnější u kontinuálního režimu) může být v závislosti na intenzitě zánětlivého procesu velmi variabilní [4]. K dalším nedostatkům patří relativně malý počet nemocných a nezaslepení studie, které umožňuje předpojatost při klinickém hodnocení efektu léčby.
Závěr
Kontinuální i intermitentní podání vankomycinu při léčbě infekcí vyvolaných grampozitivními patogeny rezistentními na beta-laktámová antibiotika u nemocných v intenzivní péči bylo spojeno se srovnatelným klinickým a mikrobiologickým účinkem.
Adekvátních cílových sérových koncentrací vankomycinu ve vztahu k MIC identifikovaných patogenů bylo dosaženo oběma dávkovacími režimy.
Kontinuální i intermitentní aplikace vankomycinu podle užitého protokolu je bezpečná a při monitorování a respektování doporučených sérových koncentrací vankomycinu není spojena se zhoršením ledvinných funkcí.
Kontinuální aplikace vankomycinu může být spojena s redukcí počtu stanovení sérových koncentrací vankomycinu.
Práce byla podpořena grantem VZ MSM 0021620819.
Došlo 9. 6. 2009.
Přijato 16. 9. 2009.
Adresa pro korespondenci:
Doc. MUDr. Ivan Chytra, CSc.
ARK FN Plzeň
Alej Svobody 80
304 60 PLZEŇ
e-mail: chytra@fnplzen.cz
Zdroje
1. Löwdin, E., Odenholt, I., Cars, O. In vitro studies of pharmacodynamic properties of vancomycin against Staphylococcus aureus and Staphylococcus epidermidis. Antimicrob. Agents Chemother., 1998, 42, p. 2739–2744.
2. Knudsen, J. D., Fuursted, K., Raber, S. et al. Pharmacodynamics of glycopeptides in the mouse peritonitis model of Streptococcus pneumoniae or Staphylococcus aureus infection. Antimicrob. Agents Chemother., 2000, 44, p. 1247–1254.
3. Craig, W. A. Basic pharmacodynamics of antibacterials with clinical applications to the use of beta-lactams, glycopeptides, and linezolid. Infect. Dis. Clin. North Am., 2003, 17, p. 479–501.
4. Rybak, M. J. The pharmacokinetic and pharmacodynamic properties of vancomycin. Clin. Infect. Dis., 2006, 42, Suppl 1, p. 35–39.
5. Llopis-Salvia, P., Jimenez-Torres, N. V. Population pharmacokinetic parameters of vancomycin in critically ill patients. J. Clin. Pharm. Ther., 2006, 31, p. 447–454.
6. Roberts, J. A., Lipman, J., Blot, S., Rello, J. Better outcomes through continuous infusion of time-dependent antibiotics to critically ill patients? Curr. Opin. Crit. Care, 2008, 14, p. 390–396.
7. Wyncoll, D. L. A., Bowry, R., Giles L.J. Antibiotics by continuous infusion: Time for re-evaluation? In Vincent, J. L., ed. Yearbook of Intensive Care and Emergency Medicine 2002, Springer-Verlag: Berlin, Heidelberg, 2002, p. 399–403.
8. Micek, S. T., Ward, S., Fraser, V. J., Kollef, M. H. A randomized controlled trial of an antibiotic discontinuation policy for clinically suspected ventilator-associated pneumonia. Chest, 2004, 125, p. 1791–1799.
9. Levey, A. S., Bosch, J. P., Lewis, J. B. et al. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group. Ann. Intern. Med., 1999, 130, p. 461–470.
10. Levey, A. S., Coresh, J., Ethan, B. et al. National Kidney Foundation Practice Guidelines for Chronic Kidney Disease: Evaluation, Classification, and Stratification. Ann. Intern. Med., 2003, 139, p. 137–147.
11. Di Filippo, A., De Gaudio, A. R., Novelli A. et al. Continuous infusion of vancomycin in methicillin-resistant staphylococcus infection. Chemotherapy, 1998, 44, p. 63–68.
12. Wysocki, M., Delatour, F., Faurisson, F. et al. Continuous versus intermittent infusion of vancomycin in severe staphylococcal infections: prospective multicenter randomized study. Antimicrob. Agents Chemother., 2001, 45, p. 2460–2467.
13. Rello, J. et al. Pneumonia caused by oxacillin-resistant Staphylococcus aureus treated with glycopeptides. Crit. Care Med., 2005, 33, p. 1983–1987.
14. Vuagnat, A., Stern, R., Lotthe, A. et al. High dose vancomycin for osteomyelitis: continuous vs. intermittent infusion. J. Clin. Pharm. Ther., 2004; 29, p. 351–357.
15. Rybak, M. J., Albrecht, L. M., Boike, S. C., Chandrasekar, P. H. Nephrotoxicity of vancomycin, alone and with an aminoglycoside. J. Antimicrob. Chemother., 1990, 25, p. 679–687.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Co přinesl rok 2009?Článek Primář MUDr. Jiří DostálČlánek Mitigace pandemie chřipkyČlánek JMENNÝ REJSTŘÍKČlánek VĚCNÝ REJSTŘÍK
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2009 Číslo 6- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
-
Všetky články tohto čísla
- Co přinesl rok 2009?
- Kam směřuje Česká společnosti intenzivní medicíny v nejbližších letech?
- Perkutánní implantace aortální chlopně z pohledu anesteziologa
- Kontinuální versus intermitentní podání vankomycinu u grampozitivních infekcí rezistentních na beta-laktamová antibiotika u nemocných v intenzivní péči
- Prognostické faktory výsledku léčby komunitní purulentní meningitidy dospělých
- Krvácivé komplikace a předávkování antikoagulační léčby
- Etické problémy při poskytování neodkladné péče
- The development of intensive care medicine in Israel from its creation until today
- Primář MUDr. Jiří Dostál
- Blahopřání doc. MUDr. Adolfě Scheinarové, CSc., k životnímu jubileu
- Mitigace pandemie chřipky
- JMENNÝ REJSTŘÍK
- VĚCNÝ REJSTŘÍK
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Krvácivé komplikace a předávkování antikoagulační léčby
- Etické problémy při poskytování neodkladné péče
- Kontinuální versus intermitentní podání vankomycinu u grampozitivních infekcí rezistentních na beta-laktamová antibiotika u nemocných v intenzivní péči
- Primář MUDr. Jiří Dostál
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



