Variabilita ve vyšetření normální a patologické mikrocirkulace pomocí SDF
Assessment of variability of normal and pathological microcirculation by SDF
Introduction:
One of the options for microcirculation monitoring is sidestream dark field imaging (SDF). The goal of this study was to assess the interobserver and intraobserver variability of SDF during an experiment simulating rupture of the abdominal aorta on a porcine model.
Methods:
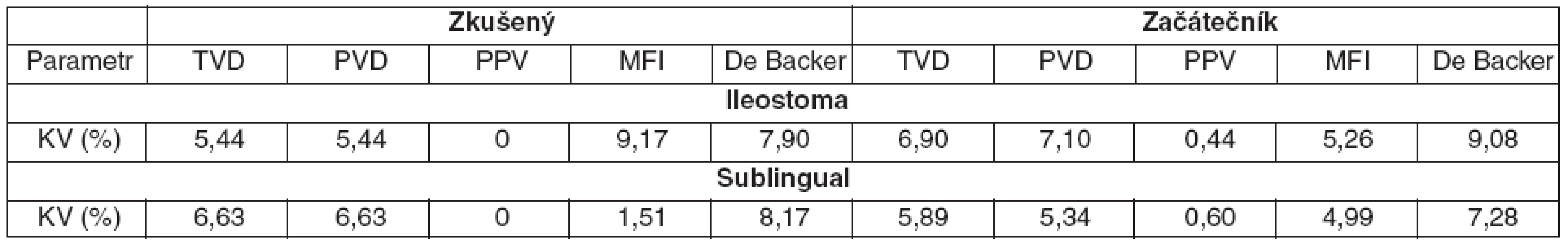
The interobserver variability was evaluated sublingually and in the ileostoma. Two investigators (skilled and novice) analyzed the recordings blindly. The interobserver variability was evaluated using the Bland Altman analysis. The results are shown as percentage bias and limits of agreement. Bias > 15% was considered as significant. The bias was sectionalized in two groups according to normal and pathological parameter values for the two main parameters (TVD, MFI). The intraobserver variability was evaluated using the coefficient of variability.
Results:
640 video recordings were analyzed for interobserver and 30 video recordings for intraobserver variability. Sublingually the bias was -5% (-20%; 12%) for TVD and -3% (-22%; 15%) for MFI. In the ileostoma the bias was 7% (-49%; 62%) for TVD and 7% (-31%; 45%) for MFI. The bias for TVD decreased when the value dropped to pathological values both sublingually and in the ileostoma but the limits of agreement were rising. The bias of MFI increased when the value dropped to pathological values and decreased when the value rose. The limits of agreement followed the same tendency. The coefficients of variability were low for both observers (CV < 10%).
Conclusion:
The intraobserver variability was minimal for both investigators. The interobserver variability was small (bias < 15%). The limits of agreement were wide for density parameters, overall for microcirculation in the ileostoma and for pathological parameter values (hyperdynamic flow was an exception).
Keywords:
microcirculation – sidestream dark field imagining – interobserver variability – intraobserver variability
Autori:
Krbúšik Ján; Suk Pavel; Hruda Jan; Zvoníček Václav; Pavlík Martin; Šrámek Vladimír; Čundrle Ivan jr.
Pôsobisko autorov:
Anesteziologicko resuscitační klinika, Fakultní nemocnice u sv. Anny v Brně Lékařská fakulta Masarykovy univerzity
Vyšlo v časopise:
Anest. intenziv. Med., 23, 2012, č. 4, s. 197-202
Kategória:
Intenzivní medicína - Původní práce
Súhrn
Úvod:
Jedna z možností, jak sledovat a hodnotit mikrocirkulaci, je pomocí techniky sidestream dark-field imaging (SDF). Naším cílem bylo zhodnotit interindividuální a intraindividuální variabilitu parametrů SDF v rámci pokusu simulujícího rupturu abdominální aorty u prasat.
Metody:
Interindividuální variabilita byla hodnocena u záznamů pořízených sublinguálně a z ileostomatu. Hodnocení proběhlo zaslepeně, off-line dvěma experimentátory (zkušený a začátečník). Interindividuální variabilita byla hodnocena pomocí Bland-Altman analýzy a výsledky byly vyjádřeny jako procentuální bias a hranice shody. Hodnota bias > 15 % byla považována za signifikantní. Hodnota bias a hranice shody byly u parametrů TVD a MFI zhodnoceny zvlášť pro patologické a normální hodnoty. Intraindividuální variabilita byla hodnocena pomocí koeficientu variability.
Výsledky:
Zhodnoceno bylo 640 videí pro interindividuální variabilitu a 30 videí pro intraindividuální variabilitu. Sublinguálně byla hodnota bias pro TVD -5 % (-20 %; 12 %) a MFI -3 % (-22 %; 15 %). V ileostomatu byla hodnota bias pro TVD 7 % (-49 %; 62 %) a MFI 7 % (-31 %, 45 %). Hodnota bias denzitního parametru TVD se snižovala, pokud velikost parametru klesala směrem k patologickým hodnotám, a to jak sublinguálně, tak v ileostomatu. Intervaly spolehlivosti ale narůstaly. Hodnota bias perfuzního parametru MFI se zvyšovala, pokud hodnota parametru klesala směrem k patologicky nízkým hodnotám, a klesala, pokud se hodnota parametru zvyšovala k hodnotám patologicky vysokým. Stejnou tendenci měly i hranice shody. Koeficienty variability byly nízké pro oba hodnotitele (KV < 10 %).
Závěr:
Intraindividuální variabilita byla minimální pro oba hodnotitele. Interindividuální rozdíly byly rovněž malé (bias < 15 %). Hranice shody byly širší pro parametry denzity (TVD), povšechně pro ileostomickou mikrocirkulaci a patologické hodnoty parametrů (s výjimkou hyperdynamického flow).
Klíčová slova:
mikrocirkulace – sidestream dark-field paging – interindividuální variabilita – intraindividuálni variabilita
Úvod
Mikrocirkulace a její monitorování u kriticky nemocných se v posledních letech těší vzrůstajícímu zájmu [1]. Tato skutečnost vyplývá především z podstaty mikrocirkulace jako prostředníka mezi makrohemodynamikou a buňkou. Přestože makrocirkulace distribuje krevní tok do celého těla, je to mikrocirkulace, která zajišťuje regionální dodávku kyslíku do konkrétních tkání [2].
Zvláště veliký přínos má monitorování mikrocirkulace u stavů, kde obnovení parametrů globální hemodynamiky nevedlo k obnově adekvátní regionální perfuze tkání, a to především ve stavech s porušenou cévní autoregulací, jako je tomu u kriticky nemocných, zvláště u distribučního šoku [3].
Možností, jak mikrocirkulaci sledovat, je celá řada – od základní kliniky (teplota a barva kůže), přes techniky přímo zobrazující mikrocirkulaci, jako je např. laser doppler, orthogonal polarization spectral imaging (OPS), sidestream darkfield imaging (SDF) a intravitální mikroskopie. Dále jsou to techniky tkáňové oxygenace (Near-infrared spectroscopy, pO2 elektrody) a techniky využívající CO2 (sublinguální a gastrická tonometrie) [4]. I když klinické hodnocení mikrocirkulace může být prospěšné [5], budoucnost leží v technickém pokroku, a to hlavně v neinvazivních technikách (OPS, SDF, NIRS).
Hodnocení mikrocirkulace pomocí technik OPS a SDF, používajících k zobrazení mikrocirkulace (respektive erytrocytů) studené světlo, se stále více začleňuje do diagnostických procesů různých patologických stavů, především šoku [6, 7]. Bohužel, obě tyto techniky mají stále mnoho technických limitací. Krátký rigidní tubus neumožňuje zobrazení mikrocirkulace vnitřních struktur, potíže mohou nastat s obtížným pořízením záznamu (tlakové a pohybové artefakty, nečistoty na sliznicích) a s jejich následným hodnocením, které probíhá off-line, je částečně subjektivní a záleží na zkušenostech a tréninku hodnotitele [8].
Cílem této studie bylo porovnat výsledky měření SDF během experimentálního hemoragického šoku a následné intenzivní péče dvěma hodnotiteli – konkrétně zhodnotit interindividuální a intraindividuální variabilitu zkušeného hodnotitele (v minulosti zhodnoceno řádově tisíce videí) a hodnotitele v tréninku (v minulosti zhodnoceny řádově stovky videí). Hypotéza byla, že rozdíly mezi hodnotiteli budou malé, že intraindividuální variabilita bude menší u zkušeného hodnotitele a že variabilita měřených patologických hodnot parametrů mikrocirkulace bude menší než variabilita hodnot blížících se normálu.
Materiál a metodika
Porcinní model
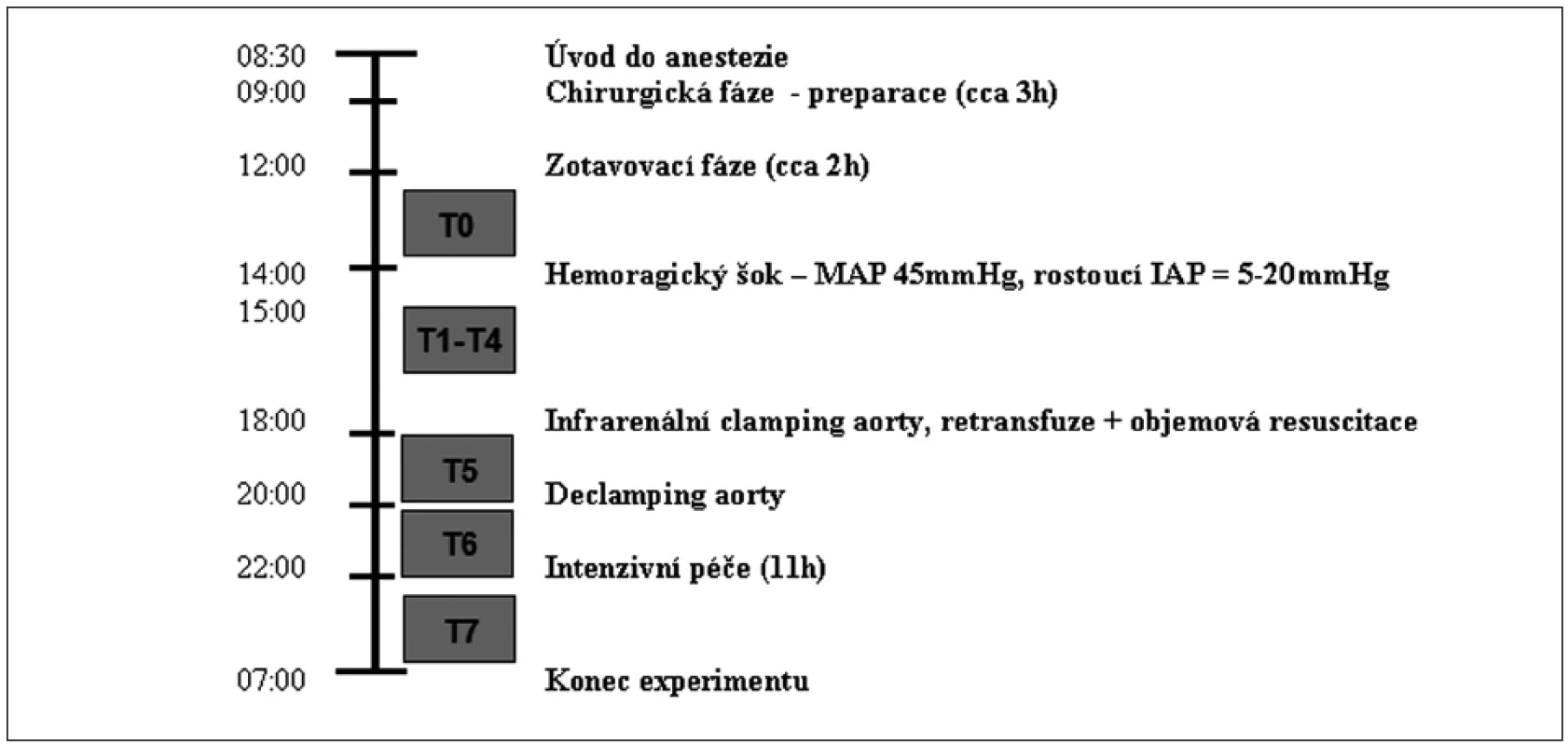
Vyvinuli jsme model chirurgické intervence rupturujícího aneurysmatu břišní aorty s cílem popsat hemodynamické, metabolické a tkáňové změny [9]. Zkráceně – prasata byla randomizována do dvou skupin (Hemoragie a Sham), uvedena do celkové anestezie a po nezbytné chirurgické preparaci (včetně vyšití ileostomatu) a dvou hodinách recovery podstoupila 4 hodiny trvající hemoragický šok kombinovaný s nitrobřišní hypertenzí (do břišní dutiny byl instilován teplý fyziologický roztok tak, aby bylo dosaženo nitrobřišního tlaku (IAP) 20 mm Hg). Prasata krvácela podle protokolu na cílový MAP 45 mm Hg – ztráta krve 25 (20–27) ml/kg. Po skončení fáze krvácení byla infrarenálně zaklemována aorta a prasata byla resuscitována jak odebranou krví, tak nezbytným množstvím koloidů a krystaloidů. Po dvou hodinách od naložení klemy byla tato opět uvolněna a následovalo 11 hodin intenzivní péče, po kterých byl experiment ukončen. SDF záznamy byly pořízeny v osmi klíčových „time pointech“ celého experimentu (T0–T7). Detaily jsou na obrázku 1.
Experiment byl schválen etickou komisí Veterinární a farmaceutické univerzity Brno.
Pořízení a analýza záznamu
Záznam byl pořízen technikou SDF (Microscan Lens, MicroVision Medical, Amsterdam, Nizozemí) v osmi „time pointech“ experimentu vždy sublinguálně a z ileostomatu. Sliznice byla před každým záznamem jemně opláchnuta fyziologickým roztokem a zbavena nečistot a bylo pořízeno tři až pět záznamů z náhodně vybraných míst. Důsledně se dbalo na vyloučení tlakových a pohybových artefaktů, se snahou o co nejostřejší a nejkvalitnější obraz.
Videosekvence byly pořízeny a analyzovány dvěma hodnotiteli. Prvním hodnotitelem byl z každého 20s videa vybrán úsek cca 50 snímků (asi 2–3 sekundy), který byl pak ve smyčce analyzován, a to zaslepeně, off-line s použitím programu AVA 3.0 (AMS, Amsterdam, Nizozemí). Hodnoceny byly denzitní (TVD, PVD, DeBacker score) a perfuzní parametry (MFI, PPV) [10]. Hodnoty parametru ze souvisejících tří míst byly zprůměrovány a pro interindivuduální analýzu byl dále použit tento průměr. Ve stručnosti: TVD – total vessel density (mm/mm2) uvádí, kolik milimetrů kapilár se nachází na mm2 sliznice. PVD – perfused vesel density ( mm/mm2) je funkční kapilární denzita, která uvádí, kolik milimetrů perfundovaných kapilár se nachází na mm2 sliznice. DeBacker score uvádí počet kapilár protínajících mřížku 3 x 3 k tomuto účelu vytvořenou během analýzy obrazu, vypovídá také o heterogenitě. PPV – proportion of perfused vessels (%) je procento perfundovaných kapilár. MFI – microvascular flow index score je založen na stanovení dominantního typu toku v kapilárách ve čtyřech kvadrantech analyzovaného obrazu. Tok je charakterizován vždy buď jako žádný (0), přerušovaný (1), obleněný (2), souvislý (3) a hyperdynamický (4). Hodnoty ze všech čtyř kvadrantů jsou pak zprůměrovány.
Inter a intraindividuální variability
Variabilita byla hodnocena mezi dvěma experimentátory. Mezi zkušeným hodnotitelem (v minulosti zhodnoceno řádově tisíce videí) a hodnotitelem v tréninku (v minulosti zhodnoceny řádově stovky videí). Pro hodnocení interindividuální variability bylo analyzováno celkem 640 videí od náhodně vybraných 12 prasat, méně než 2 % (celkem 10) byla vyřazena pro nekvalitní záznam prvním experimentátorem. Pro hodnocení intraindividuální variability bylo vybráno náhodně celkem 5 videí, tato videa byla zkrácena a stabilizována prvním experimentátorem na délku tří sekund (cca 50 snímků) a následně zaslepena. Tato videa byla pak bez dalších úprav hodnocena celkem třikrát. Vzniklo tak 15 záznamů pro analýzu intraindividuální variability.
Variabilita patologických a normálních hodnot
K tomuto hodnocení jsme stanovili arbitrární hranici pro patologické a normální hodnoty pro jeden denzitní parametr (TVD) a pro jeden perfuzní parametr (MFI). Sublinguálně byla pro parametr TVD stanovena hranice 18 mm/mm2 (přelom patologicky nízká/normální hodnota). V ileostomatu pak hodnota 22 mm/mm2. Pro parametr MFI jsme stanovili stejnou hodnotu jak pro sublinguální, tak ileostomickou oblast. Byla-li hodnota menší než 2,5, byla považována jako patologicky nízká. Hodnota 2,5–3,5 byla považována jako normální a hodnoty větší než 3,5 jako patologicky vysoké.
Statistické hodnocení
Bland-Altmanova metoda byla použita k analýze interindividuální variability (první investigátor – druhý experimentátor/průměr obou . 100 na ose y, průměr obou na ose x). Pro zjištění rozdílu variability normálních a patologických hodnot byla následně pro každý interval hodnot zvlášť (norma versus patologie) provedena Bland-Altmanova analýza. Hodnota bias (chyba) ukazuje, zda rozdíly mají systematický charakter (zda se diference systematicky liší od nuly); hranice shody (HS) ukazují, jak moc diference kolísají (jejich směrodatná odchylka).
Pro hodnocení intraindividuální variability byl použit koeficient variability (%) – standardní odchylka/průměr). 100. Ke statistickému hodnocení byl použit program Statistica 9.0 (Statsoft CZ).
Výsledky
Interindividuální variabilita
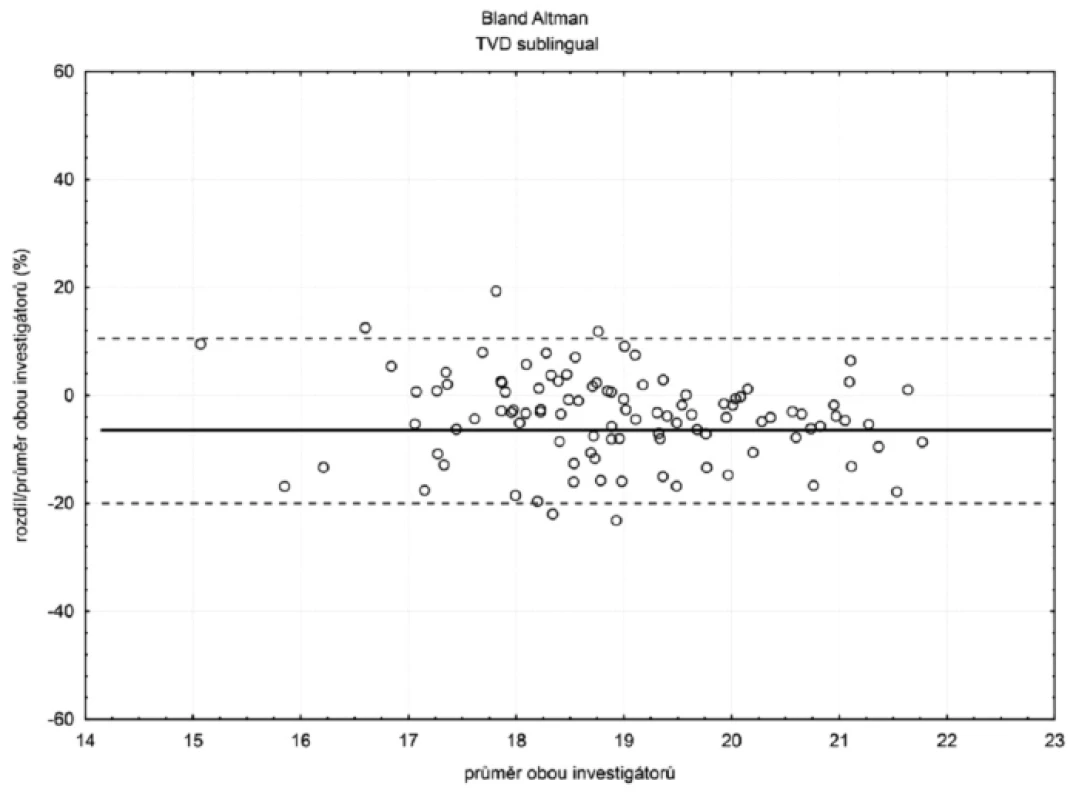
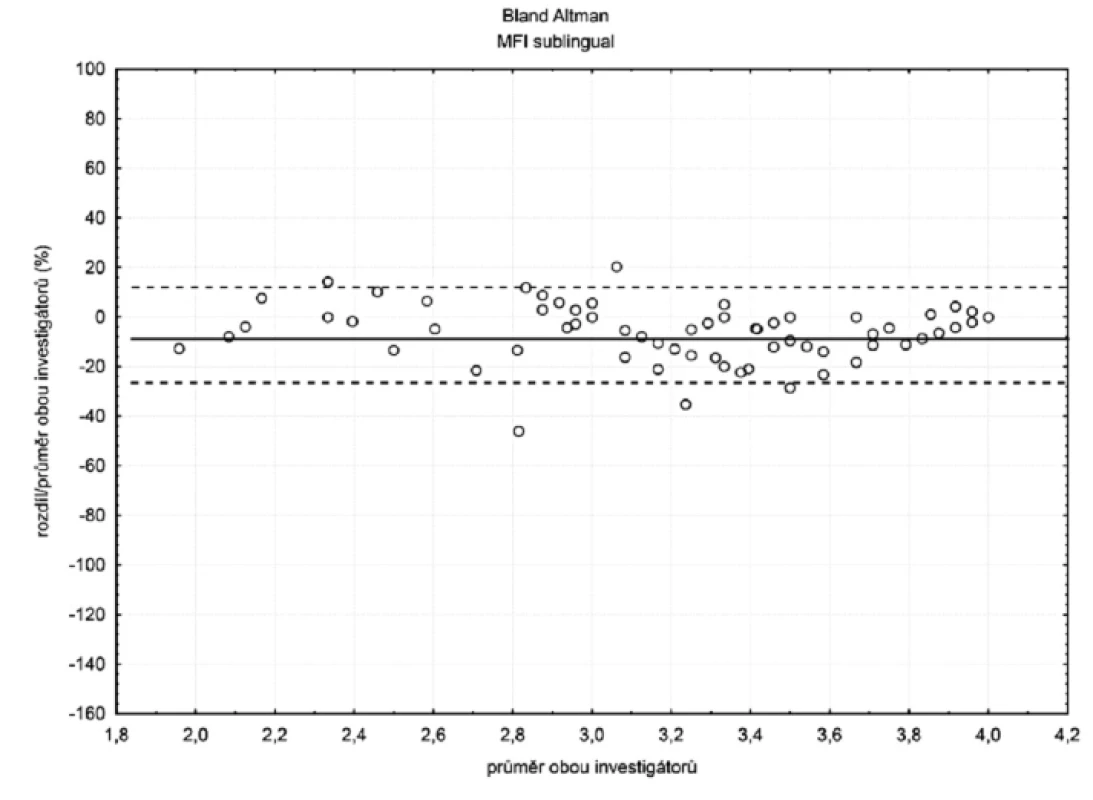
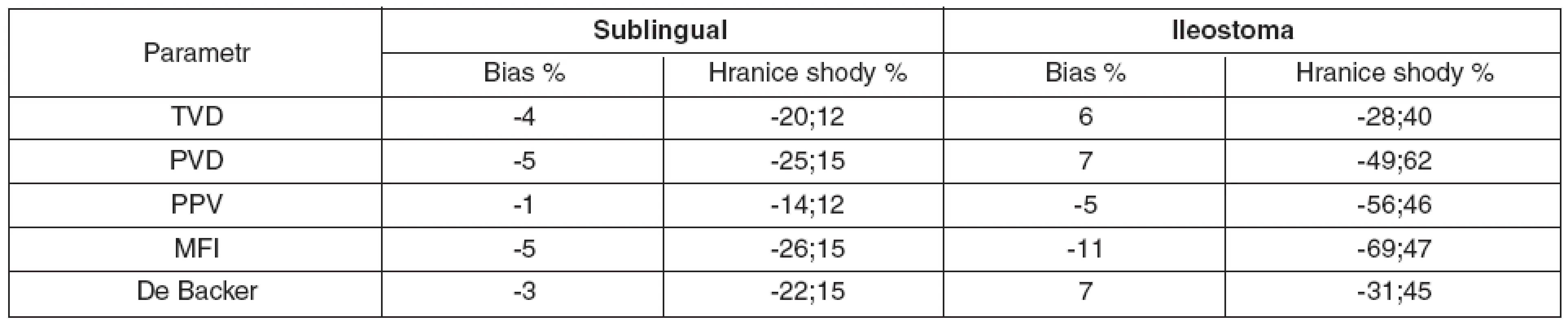
Sublinguálně (n = 105) byla hodnota bias (hranice shody) pro TVD -4 % (-20 %; 12 %) a MFI -5 % (-26 %; 15 %) – obrázky 2 a 3. Hodnoty bias a hranice shody ostatních parametrů mikrocirkulace jsou číselně uvedeny v tabulce 1.
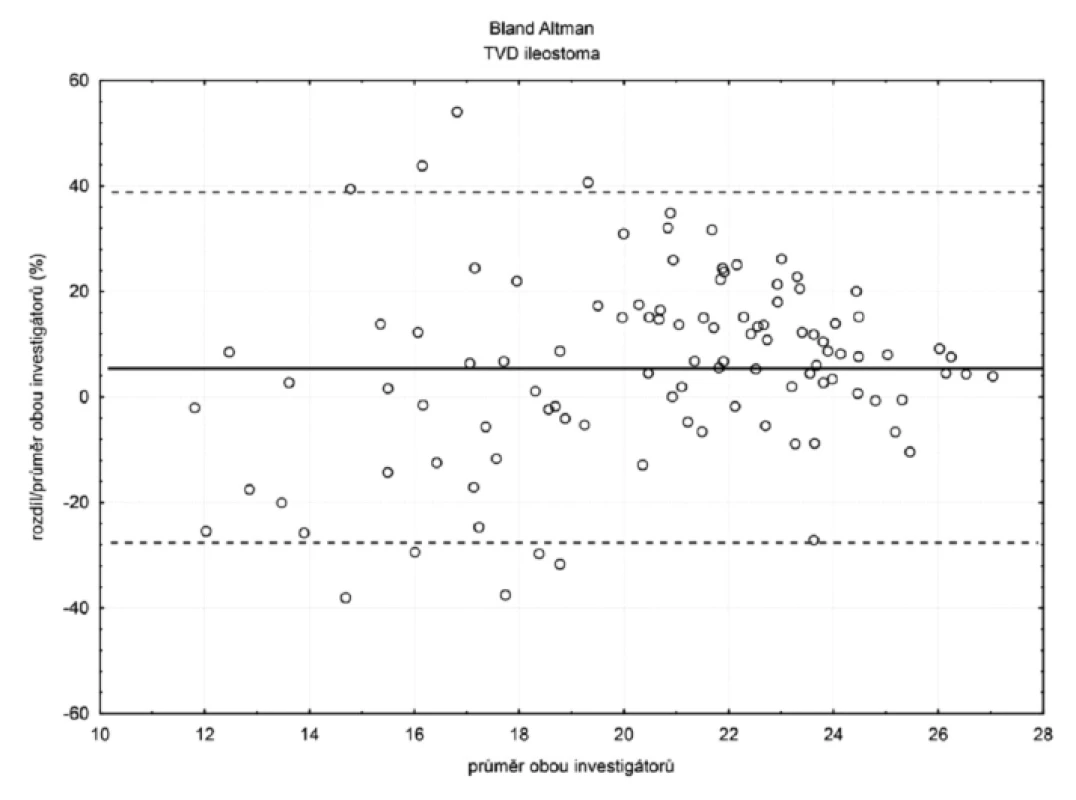
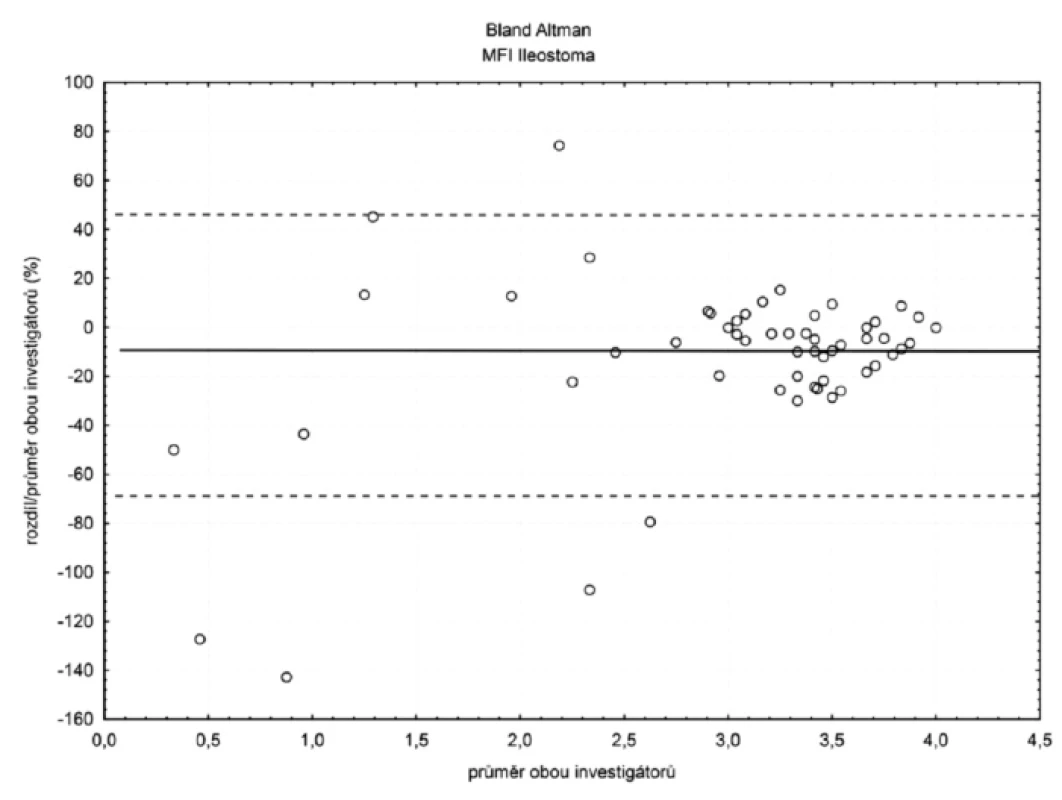
V ileostomatu (n = 105) byla hodnota bias (hranice shody) pro TVD 6 % (-28 %; 40 %) a MFI 11 % (-69 %; 47 %) – obrázky 4 a 5. Ostatní hodnoty bias a hranice shody – viz tabulka 1.
Intraindividuální variabilita
Koeficienty variability byly nízké (< 10 %) pro všechny hodnocené parametry a i pro obě hodnocené oblasti – tabulka 2.
Variabilita patologických a normálních hodnot
Sublinguálně bylo pro denzitní parametr TVD > 18 mm/mm2 hodnoceno 80 hodnot, pro parametr TVD < 18 mm/mm2 pak 25 hodnot. V ileostomatu bylo pro denzitní parametr TVD > 22 mm/mm2 hodnoceno 42 hodnot, pro parametr TVD < 22 mm/mm2 pak 63 hodnot.
Hodnota bias denzitního parametru TVD se snižovala, pokud velikost parametru klesala směrem k patologickým hodnotám, intervaly spolehlivosti ale zároveň narůstaly, a to jak sublinguálně, tak i v ileostomatu – tabulka 3.
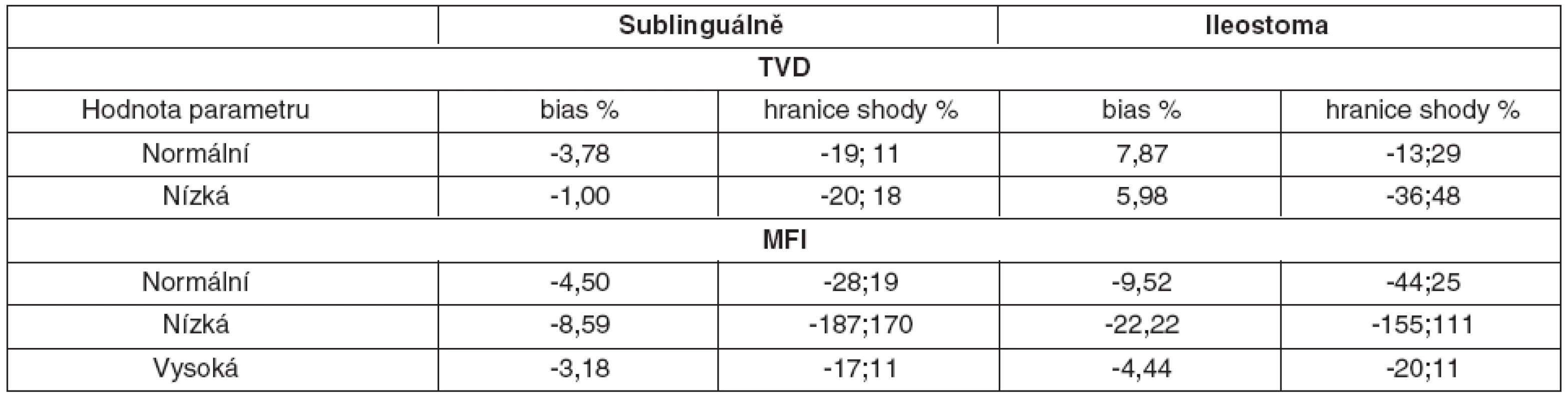
Sublinguálně bylo pro perfuzní parametr MFI > 3,5 hodnoceno 30 hodnot, pro parametr MFI v intervalu 2,5–3,5 pak 65 hodnot a pro MFI < 2,5 celkem 10 hodnot. V ileostomatu bylo pro perfuzní parametr MFI > 3,5 hodnoceno 30 hodnot, pro parametr MFI v intervalu 2,5–3,5 pak 40 hodnot a pro MFI < 2,5 celkem 35 hodnot.
Pokud hodnota perfuzního parametru MFI klesala směrem k patologicky nízkým hodnotám, bias i hranice shody se zvyšovaly jak sublinguálně, tak především v ileostomatu.
Pokud ovšem hodnota parametru MFI stoupala směrem k hyperdynamickým hodnotám bias, hranice shody se snižovaly, a to jak sublinguálně, tak i v ileostomatu (viz tab. 3).
Diskuse
Hlavní zjištění
Sublinguálně byla celková interindividuální variabilita malá (bias < 15 %, HS < 30 %). V ileostomatu byla vyjádřena více (bias < 15 %, HS > 30 %). Intraindividuální variabilita byla malá pro obě oblasti (průměrný koeficient variability byl menší než 10 %).
Subanalýza patologických hodnot prokázala malou interindividuální variabilitu pro patologicky vysoké hodnoty MFI jak sublinguálně, tak i v ileostomatu (bias < 15 %, HS < 30 %). U patologicky nízkých hodnot parametru MFI byla interindividuální variabilita větší, a to především pro mikrocirkulaci v ileostomatu (bias > 15 %, HS > 30 %).
Interindividuální variabilita patologicky nízkých hodnot TVD byla nízká sublinguálně (bias < 15 %, HS < 30 %), v mikrocirkulaci ileostomatu zůstala nízká hodnota bias (< 15 %), ale došlo k nárůstu hranice shody o více než 20 %.
Obecně ale naše zjištění svědčí pro nízkou intraindividuální a interindividuální variabilitu v měření mikrocirkulace pomocí SDF. V naší výzkumné skupině tedy příliš nezáleží výsledky hodnocení na hodnotiteli, zkušenost hraje roli především u hodnocení parametru MFI při patologicky nízkých hodnotách.
Interindividuální a intraindividuální variabilita
Stejně jako my prokázal sublinguálně obecně nízkou interindividuální a intraindividuální variabilitu De Backer [11], který hodnotil variabilitu reanalýzou 3 videosekvencí a i další, kteří rovněž naměřili nízkou variabilitu, a tedy dobrou reproducibilitu sublinguálně [12, 13].
Interindividuální variabilitu v hodnocení mikrocirkulace ileostomatu analyzoval Boerma [12], který na rozdíl od nás prokázal dobrou reproducibilitu parametru MFI. Vysvětlením tohoto rozdílu může být fakt, že Boerma hodnotil mikrocirkulaci u pacientů v septickém šoku se zřejmě adekvátní léčbou, zatímco my na modelu šoku hemoragického, zpočátku (4 hodiny) bez zajištěné terapie. Dá se předpokládat, že pokles perfuze u léčených pacientů se sepsí bude menšího rozsahu než u našeho modelu zpočátku neléčeného těžkého hemoragického šoku, kde perfuze v ileostomatu klesala postupně až k nule [9]. Tato postupná změna v celé možné škále hodnot a subjektivní podstata hodnocení MFI dává podle našeho názoru prostor pro vznik větší interindividuální variability. Na druhou stranu je nutné poznamenat, že pokles perfuze v ileostomatu u neléčeného septického šoku může rovněž dosáhnout až nulových hodnot [14].
Stanovení arbitrálních hodnot pro patologické a normální hodnoty
Podle našich nejlepších znalostí nám není známo, že by v literatuře byly tyto prahové hodnoty norma/patologie oficiálně uvedeny. Arbitrální hodnoty pro rozdělení parametrů TVD a MFI na patologické a normální byly stanoveny podle výsledků naměřeným na videosekvencích z „time pointu“ T0, tedy na samém počátku experimentu, kdy prasata neměla zjevný důvod mít patologickou mikrocirkulaci. Je nicméně možné, že už i v tomto bodě experimentu byla mikrocirkulace ovlivněna [15].
Variabilita vztažená na tíži postižení mikrocirklace
Interindividuální variabilita vztažená na hodnoty jednotlivých parametrů klesala u denzitního parametru TVD se zhoršující se mikrocirkulací, což je v souladu s naší hypotézou, ale intervaly spolehlivosti pro ileostomickou mikrocirkulaci narostly asi o 20 %, což ztěžuje jednoznačnost interpretace.
Interindividuální variabilitu u parametrů mikrocirkulace v tenkém střevě analyzoval také Bracht [16], který prokázal velké rozdíly v parametrech denzity během snižující se perfuze. Pravděpodobné vysvětlení námi zjištěného menšího nárůstu hranic shody oproti Brachtovi je použitá technika. Bracht použil k hodnocení mikrocirkulace techniku OPS, která znázorňuje kapiláry, pouze pokud jimi procházejí erytrocyty. Námi použitá technika SDF s lepším kontrastem a ostrostí oproti OPS [17] byla pravděpodobně schopna lépe zachytit i minimálně perfundované kapiláry. Zároveň se domníváme, že s ubývajícím počtem kapilár se zpřesňuje semiautomatický způsob hodnocení.
U perfuzního parametru MFI byla situace opačná. Hodnota bias rostla s klesajícím průtokem a hranice shody se rovněž rozšiřovaly. Podle našeho názoru je rostoucí hodnota bias u patologicky nízkých hodnot MFI vysvětlitelná větší subjektivitou hodnocení tohoto parametru a právě díky této subjektivitě bude hrát roli i zkušenost s hodnocením. Méně zkušený hodnotitel se vzrůstající závažností hemoragického šoku průtok nadhodnocoval (viz obr. 5).
Naši hypotézu, že se interindividuální variabilita bude zmenšovat, pokud parametry budou směřovat více k patologickým hodnotám, jsme potvrdili pouze částečně, a to pro semiautomatické hodnocení parametru TVD, kde interindividuální variabilita klesala se zhoršující se mikrocirkulací (s klesajícím počtem kapilár k detekci) jak sublinguálně, tak částečně i v ileostomické mikrocirkulaci. Interindividuální variabilita se rovněž snižovala pro perfuzní parametr MFI u stavů s hyperdynamickou perfuzí.
Naopak naši hypotézu jsme nepotvrdili pro interindividuální variabilitu parametru MFI (jak sublinguálně, tak v ileostomatu) u stavů s patologicky nízkou perfuzí. Hodnocení MFI je založeno spíše na subjektivitě a interindividuální variabilita stoupala se zhoršující se mikrocirkulací.
Cut-off hodnota bias a hranice shody
Jako klinicky nevýznamná byla stanovena hodnota bias méně než 15 %, což je méně, než je standardně doporučováno v ostatních studiích v intenzivní péči [18]. Hranice shody menší než 30% byly rovněž považovány jako klinicky akceptovatelné.
Výběr videí a jejich heterogenita
Limitací této studie je výběr videí. Běžně jsou pořizována videa v délce minimálně 20 sekund, z kterých je potom analyzován nejstabilnější výřez cca 3 sekundy. V této studii provedl zmíněné výřezy první experimentátor a druhý hodnotil až tyto vybrané výřezy. Pokud by měl druhý experimentátor možnost si výběry stanovit sám, interindividuální variabilita by byla jistě větší, jako je tomu ve studii Boerma et al. [12]. Naší snahou však bylo ukázat, zda je hodnotitel po dostatečném zaškolení schopen přesně zhodnotit pořízená videa, a tedy hodnotit interindividuální variabilitu hodnocení, a ne se vyjadřovat k opakovatelnosti této metody (SDF).
Videa byla vybrána z heterogenní skupiny. Zařazena byla prasata jak v hemoragickém šoku, tak kontrolní sham-operated prasata, a to z důvodu získání větší diverzity měřených hodnot.
Závěr
Mikrocirkulaci pomocí SDF může hodnotit experimentátor po zaškolení a zhodnocení řádově stovek videí. Zkušenost hraje roli především u hodnocení parametru MFI u stavů s patologicky nízkou perfuzí.
Podpořeno IGA MZCR NS 10109-4.
Do redakce došlo dne 16. 5. 2012.
Do tisku přijato dne 25. 7. 2012.
Adresa pro korespondenci
MUDr. Ivan Čundrle jr.
Fakultní nemocnice u Sv. Anny v Brně
Pekařská 53, 656 91
e-mail: Ivan.Cundrle@seznam.cz
Zdroje
1. De Backer, D., Ospina-Tascon, G., Salgado, D., Favory, R., Creteur, J., Vincent J-L. Monitoring the microcirculation in the critically ill patient: current methods and future approaches. Intensive Care Med., 2010, 36, p. 1813–1825.
2. Arnold, R. C., Parrillo, J. E., Phillip Dellinger, R., Chansky, M. E., Shapiro, N. I., Lundy, D. J., Trzeciak, S., Hollenberg, S. M. Point-of-care assessment of microvascular blood flow in critically ill patients. Intensive Care Med., 2009, 35, p. 1761–1766.
3. Trzeciak, S., Rivers, E. P. Clinical manifestations of disordered microcirculatory perfusion in severe sepsis. Crit. Care, 2005, 9, Suppl 4, p. 20–26.
4. Knotzer, H., Hasibeder, W. R. Microcirculatory function monitoring at the bedside – a view from the intensive care. Physiological. Measurement., 2007, 28, p. 65–86.
5. Ait-Oufella, H., Lemoinne, S., Boelle, P. Y., Galbois, A., Baudel, J. L., Lemant, J., Joffre, J., Margetis, D., Guidet, B., Maury, E., Offenstadt, G. Mottling score predicts survival in septic shock. Intensive Care Med., 2011, 37, p. 801–807.
6. Boldt, J., Ince, C. The impact of fluid therapy on microcirculation and tissue oxygenation in hypovolemic patients: a review. Intensive Care Med., 2010, 36, p. 1299–1308.
7. Ince, C. The microcirculation is the motor of sepsis. Crit. Care, 2005, 9, Suppl 4, p. 13–19.
8. Top, A. P. C., Tasker, R. C., Ince, C. The microcirculation of the critically ill pediatric patient. Crit. Care, 2011, 15, p. 213.
9. Suk, P., Cundrle, I. Jr., Hruda, J., Vocilková, L., Konecny, Z., Vlasin, M., Matejovic, M., Pavlik, M., Zvoníček, V., Sramek, V. Porcine model of ruptured abdominal aortic aneurysm repair. Eur. J. Vasc. Endovasc. Surg., 2012, 43, p. 698–704.
10. De Backer, D., Hollenberg, S., Boerma, C., Goedhart, P., Büchele, G., Ospina-Tascon, G., Dobbe, I., Ince, C. How to evaluate the microcirculation: report of a round table conference. Crit. Care, 2007, 11, p. 101.
11. De Backer, D., Creteur, J., Preiser, J. C., Dubois, M. J., Vincent, J. L. Microvascular Blood Flow Is Altered in Patients with Sepsis. Am. J. Respir. Crit. Care Med., 2002, 166, p. 98–104.
12. Boerma, E. C., Mathura, K. R., van der Voort, P. H. J., Spronk, P. E., Ince, C. Quantifying bedside-derived imaging of microcirculatory abnormalities in septic patients: a prospective validation study. Crit. Care, 2005, 9, p. 601–606.
13. Trzeciak, S., Dellinger, R. P., Parrillo, J. E., Guglielmi, M., Bajaj, J., Abate, N. L., Arnold, R. C., Colilla, S., Zanotti, S., Hollenberg, S. M. Early microcirculatory perfusion derangements in patients with severe sepsis and septic shock: relationship to hemodynamics, oxygen transport, and survival. Ann. Emerg. Med., 2007, 49, p. 88–98.
14. Verdant, C. L., De Backer, D., Bruhn, A., Clausi, C. M., Su, F., Wang, Z., Rodriguez, H., Pries, A. R., Vincent, J. L. Evaluation of sublingual and gut mucosal microcirculation in sepsis: a quantitative analysis. Crit. Care Med., 2009, 37, p. 2875–2881.
15. Vellinga, N. A., Ince, C., Boerma, E. C. Microvascular dysfunction in the surgical patient. Current Opinion in Critical Care, 2010, 16, s. 377–383.
16. Bracht, H., Krejci, V., Hiltebrand, L., Brandt, S., Sigurdsson, G., Ali, S. Z., Takala, J., Jakob, S. M. Orthogonal polarization spectroscopy to detect mesenteric hypoperfusion. Intensive Care Med., 2008, 34, p. 1883–1890.
17. Bezemer, R., Goedhart, P., Khalilzada, M., Ince, C. Side- -stream dark-field imaging versus orthogonal polarization spectroscopic imaging: a comparative study. Critical. Care, 2008, 12, p. 63.
18. Critchley, L. A., Critchley, J. A. A meta-analysis of studies using bias and precision statistics to compare cardiac output measurement techniques. J. Clin. Monit. Comput., 1999, 15, p. 85–91.
Štítky
Anestéziológia a resuscitácia Intenzívna medicínaČlánok vyšiel v časopise
Anesteziologie a intenzivní medicína

2012 Číslo 4
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- Kvalita výživy na JIS a následná kvalita života spolu úzko súvisia
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
Najčítanejšie v tomto čísle
- Gasping – co víme?
- Anestezie v břišní chirurgii (otázka č. 1/b)
- 20th Hoder Day, December 8th, 2011 Airway Management – abstracts
- Practice Guidelines for Central Venous Access