-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Předoperační vyšetření autonomního nervového systému měřením variability srdeční frekvence jako metoda predikce perioperačního průběhu
Preoperative examination of the autonomic nervous system by measurement of the heart rate variability for prediction of the perioperative course
The autonomic nervous system (ANS) plays an important role in the maintenance of systemic homeostasis. Measurement of heart rate variability (HRV) is a method for assessment of the autonomic nervous system. Dysfunction of the autonomic nervous system could complicate the perioperative course in the pacient undergoing surgery, therefore it should be considered as another risk factor during preoperative assessment. Nowadays the assessment of the autonomic nervous system function as a predictive tool of the perioperative outcome is not considered in daily anaesthetic practice.
Keywords:
autonomic nervous system – heart rate variability – perioperative complications – postoperative morbidity and mortality
Autoři: P. Reimer 1; M. Adamus 2; P. Sklienka 1; P. Ševčík 1
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Ostrava a Lékařská fakulta Ostravské univerzity v Ostravě 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Olomouc a Lékařská fakulta Univerzity Palackého v Olomouci 2
Vyšlo v časopise: Anest. intenziv. Med., 26, 2015, č. 3, s. 137-144
Kategorie: Anesteziologie - Původní práce
Souhrn
Autonomní nervový systém (ANS) hraje zásadní roli v udržování homeostázy organismu. Vyšetření funkce autonomního nervového systému se provádí měřením variability srdeční frekvence (HRV – heart rate variability). Dysfunkce autonomního nervového systému může komplikovat perioperační průběh u pacientů podstupujících operační výkon, a tudíž by měla být považována za další rizikový faktor v rámci předoperačního zhodnocení stavu pacienta. V dnešní době není zhodnocení funkce autonomního nervového systému, jakožto možného nástroje pro predikci perioperačního průběhu, zahrnuto do běžné anesteziologické praxe.
Klíčová slova:
autonomní nervový systém – variabilita srdeční frekvence – perioperační komplikace – pooperační morbidita a mortalitaÚVOD
Základním předpokladem fungování živých organismů je udržení stabilních podmínek vnitřního prostředí (homeostázy) a schopnost adaptace na neustále se měnící podmínky vnitřního a vnějšího prostředí. Dominantní roli v udržování homeostázy organismu hraje autonomní (vegetativní) nervový systém (ANS). Základní životní funkce (krevní oběh, dýchání, endokrinní funkce, gastrointestinální funkce, termoregulace a imunitní systém) jsou autonomním nervovým systémem kontinuálně monitorovány a jejich činnost je při změnách vzniklých vnějšími stimuly či endogenními změnami rychle modifikována s cílem udržení fyziologických hodnot. Funkční zdatnost autonomního nervového systému je tedy vyjádřením fyziologických rezerv organismu. Dysfunkce autonomního nervového systému naopak zhoršuje adaptaci organismu na zátěžové situace, mezi které patří stres vznikající v souvislosti s operačním výkonem. Chirurgická intervence poškozující tkáň vede k narušení homeostázy, na které organismus reaguje zánětlivou odpovědí charakterizovanou uvolněním prozánětlivých cytokinů. Jejich zvýšená produkce vede k poškození tkáně a při nadměrném uvolnění do oběhu může být příčinou až šokového stavu. Na kontrole zánětlivé odpovědi organismu se významně podílí autonomní nervový systém prostřednictvím nervu vagu, a to Kevinem Traceym postulovanou cholinergní protizánětlivou cestou (cholinergic antiinflammatory pathway). Jedná se o reflexní kontrolu imunitní odpovědi, při které aferentní vagová vlákna z místa poškození tkáně vedou informaci do CNS, kde dojde k přepojení na eferentní vagová vlákna, která končí na nikotinových acetylcholinových receptorech makrofágů a způsobují inhibici uvolňování prozánětlivých cytokinů [1].
Předoperační vyšetření pacienta je standardní součástí anesteziologické péče a jeho cílem je zhodnocení rizik vyplývajících z operačního výkonu s následným navržením optimálního rozsahu předoperační přípravy, strategie vedení anestezie i pooperační péče. Předoperační zhodnocení funkce autonomního nervového systému měřením variability srdeční frekvence je neinvazivní metodou s potenciálem identifikovat pacienty se zvýšeným rizikem perioperačních komplikací [2].
AUTONOMNÍ NERVOVÝ SYSTÉM A VARIABILITA SRDEČNÍ FREKVENCE
Autonomní nervový systém se skládá ze dvou základních větví, sympatického a parasympatického systému, které vzájemně působí na zachování dynamické rovnováhy vitálních funkcí. Autonomní nervový systém je neustále aktivní, což se projevuje permanentní impulzovou aktivitou v jeho vláknech, která tak vytváří tonický vliv na cílové orgány. Nervová aktivita se však oscilačně mění v závislosti na měnících se podmínkách vnitřního a vnějšího prostředí. V kardiovaskulárním systému se tyto oscilace autonomního nervového systému projevují fluktuací intervalu mezi dvěma srdečními stahy a jsou podstatou variability srdeční frekvence. Autonomní nervový systém je jedním z nejdůležitějších mechanismů ovlivňujících činnost srdce. Jeho vliv na srdeční činnost vychází z komplexní integrace informací přicházejících z baroreceptorů, chemoreceptorů, síňových a komorových receptorů, ze změn v respiračním systému, systému renin-angiotensin-aldosteron a v termoregulačním systému. Tyto aferentní informace se komplexně integrují na podkladě stimulace a inhibice neuronových struktur v mozkovém kmenu (základním vegetativním jádrem je nucleus tractus solitarius – NTS). Výsledná informace je přepojena na eferentní sympatická (kardioakcelerační) a parasympatická (kardiodecelerační) nervová vlákna, která v každém okamžiku ovlivňují srdeční činnost. Zhodnocení autonomního ovlivnění srdeční činnosti měřením variability srdeční frekvence je oknem do celkové autonomní regulace organismu [3, 4].
Obr. 1. Schéma cholinergní protizánětlivé cesty (cholinergic antiinflammatory pathway) 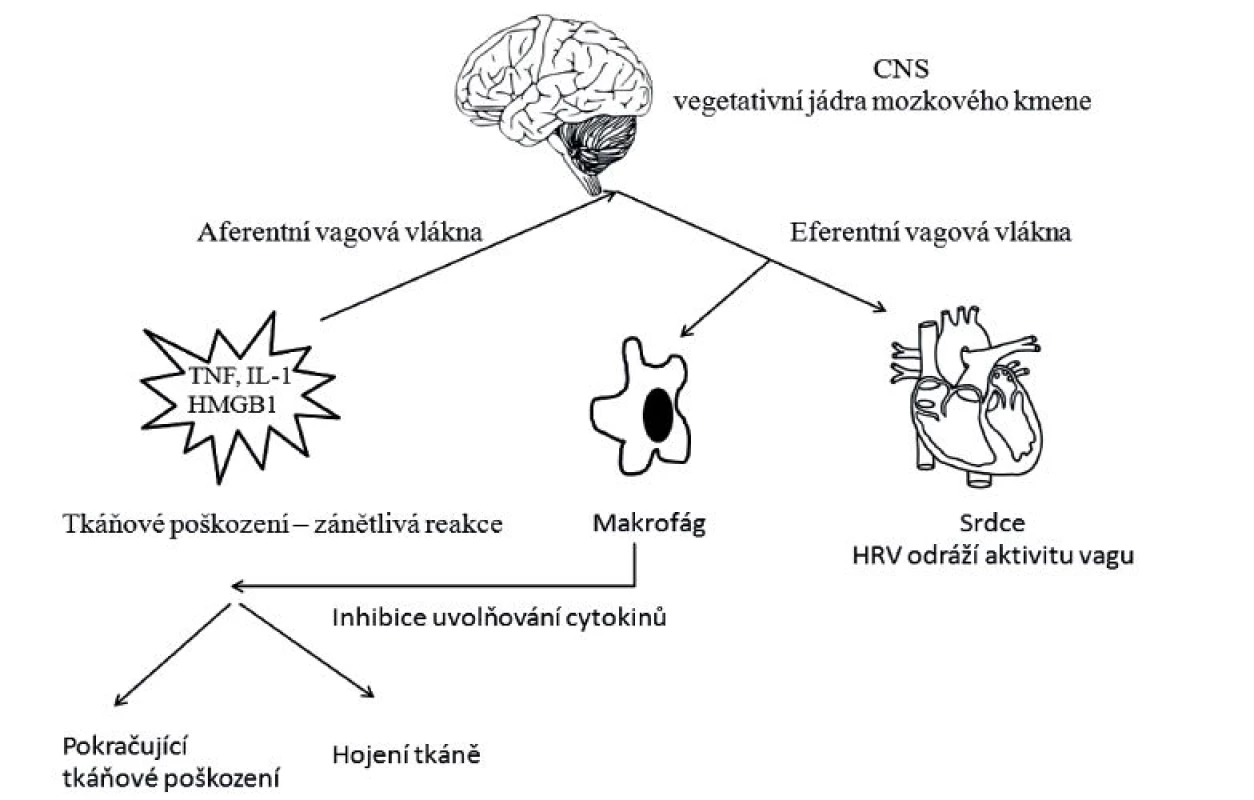
V místě tkáňového poškození dochází k uvolňování prozánětlivých cytokinů, především tumor necrosis factor (TNF), interleukin-1 (IL-1) a high mobility group B1 (HMGB1). Informace o probíhajícím zánětu je vedena aferentními vlákny nervu vagu do vegetativních jader mozkového kmene, kterými jsou nucleus tractus solitarius (NTS), rostrální ventrolaterální mícha (RVLM), nucleus ambiquus (NA) a nucleus dorsalis nervi vagi. Po polysynaptickém přepojení se aktivují eferentní vlákna vagu, která končí na alfa podjednotce nikotinových acetylcholinových receptorů makrofágů a způsobují inhibici uvolňování prozánětlivých cytokinů. Dobrá aktivita vagu objektivizovaná měřenou variabilitou srdeční frekvence vede k fyziologické kontrole zánětu a následnému dobrému hojení poškozené tkáně. Upraveno podle [1]. Obr. 2. Schéma zpětnovazebné autonomní nervové regulace kardiovaskulárního systému 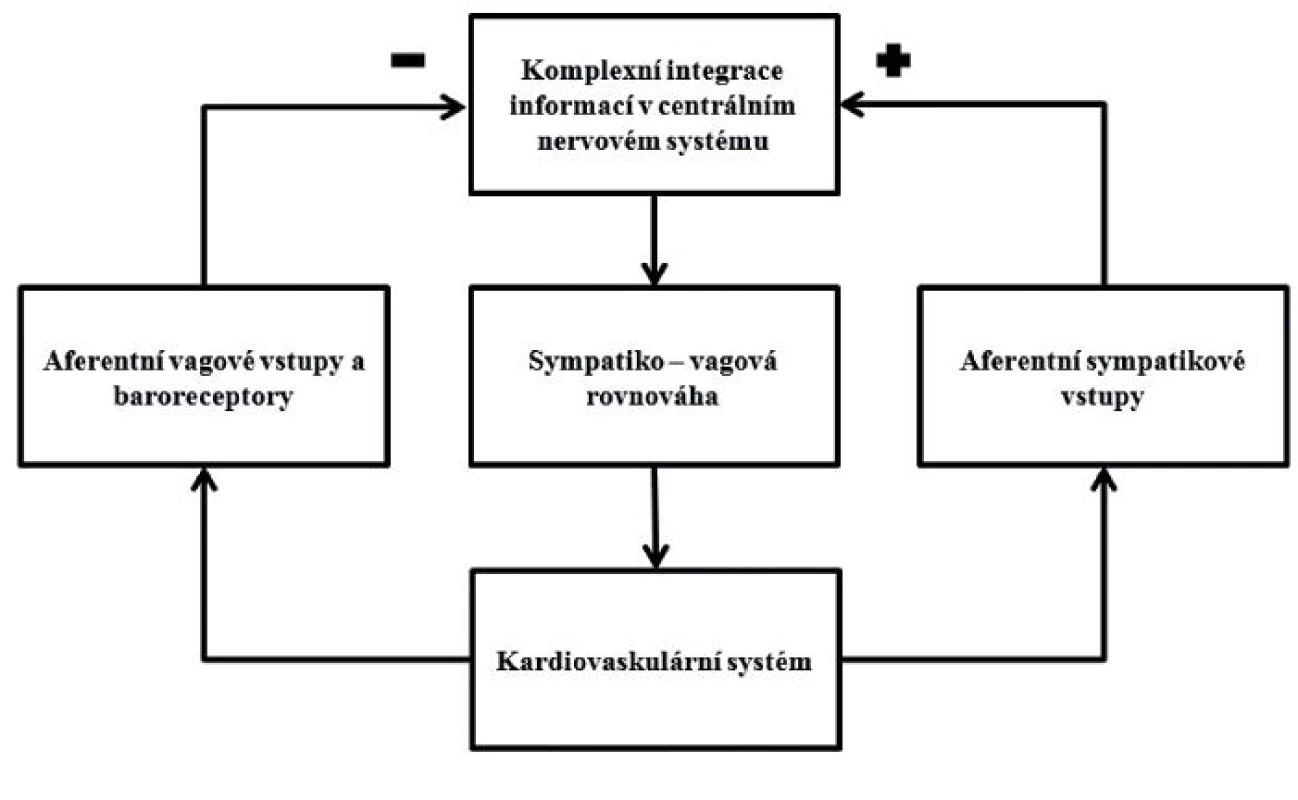
Upraveno podle [8]. METODY HODNOCENÍ VARIABILITY SRDEČNÍ FREKVENCE
Variabilita srdeční frekvence (HRV – heart rate variability) je dána proměnlivostí (nerovnoměrným trváním) RR intervalů. HRV je hodnocena metodami lineárními či nelineárními, a to buď v režimu krátkodobého (5–15 minut) nebo dlouhodobého (24hodinového) monitorování.
Lineární metody
Mezi lineární metody patří časová, geometrická a frekvenční analýza. Standardy pro měření a hodnocení lineárními metodami byly publikovány odbornými společnostmi European Society of Cardiology and the North American Society of Pacing and Electrophysiology v roce 1996 [5].
Časová analýza je nejjednodušší formou hodnocení variability srdeční frekvence, která informuje o velikosti oscilací mezi RR intervaly. V konti-nuálním EKG záznamu se registrují vzdálenosti mezi jednotlivými R-kmity, zde se označují jako NN (Normal-to-Normal) a statistickými metodami se získávají indexy pro popis variability srdeční frekvence. Základním parametrem časové analýzy ukazujícím její celkovou hodnotu je SDNN (standard deviation of the NN-intervals).
Analýza série NN intervalů může být dále provedena geometrickými metodami, výsledkem je grafické rozložení hustoty vzorků se stejnou délkou intervalu nebo rozložení hustoty rozdílů mezi sousedními intervaly. Mezi nejčastější geometrické metody patří index triangularity a Poincarého graf.
Poslední, avšak v praxi dnes nejrozšířenější metodou je frekvenční (spektrální) analýza, při níž jsou časové údaje o rozdílech mezi po sobě jdoucími RR intervaly převedeny do frekvenčních hodnot, a to nejčastěji metodou rychlé Fourierovy transformace (FFT). Frekvenční analýza ukazuje amplitudu oscilací ve čtyřech frekvenčních pásmech, a to v oblasti vysoké (HF – high frequency 0,15–0,40 Hz), nízké (LF – low frequency 0,04–0,15 Hz), velmi nízké (VLF – very low frequency 0,003–0,04 Hz) a ultra nízké (ULF – ultra low frequency ≤ 0,003 Hz) frekvence. Aktivita v jednotlivých frekvenčních pásmech je vyjádřena v jednotkách výkonu (power) [ms2]. Základním parametrem frekvenční analýzy je celkový výkon (TP – total power), který představuje celkový index HRV [6]. Výkon v oblasti vysoké frekvence je odrazem vlivu dýchání na činnost srdce, který částečně koreluje s respirační sinusovou arytmií. Všeobecně je výkon v oblasti vysoké frekvence ukazatelem parasympatické (vagové) modulace srdeční činnosti [7]. Výkon v oblasti nízké frekvence je dán dominantně baroreflexem podmíněnými změnami v sympatické inervaci srdce. Aktivita v oblasti nízké frekvence je však taktéž ovlivněna vagem. Důkazem toho jsou studie, kdy nejen blokáda betaadrenergních receptorů, ale taktéž parasympatikolytika vedou k poklesu LF [8]. Poměr aktivity v těchto pásmech daný indexem LF/HF je ukazatelem celkové sympatiko-vagové rovnováhy. Výkon v oblasti VLF a ULF není v praxi příliš používán, protože k hodnocení je zapotřebí dlouhodobého (celodenního) záznamu. Výkon v oblasti VLF je podmíněn periferním vazomotorickým tonusem, který je ovlivněn termoregulací a systémem renin-angiotensin-aldosteron. Aktivita v ULF odráží cirkadiánní rytmus autonomního tonu [6].
Jak bylo zmíněno výše, frekvenční (spektrální) analýza je dnes v praxi nejrozšířenější metodou pro hodnocení variability srdeční frekvence. V České republice se vývojem a výrobou přístrojů k měření HRV od začátku 90. let minulého století zabývá olomoucká skupina doc. ing. Jiřího Salingera, CSc. Posledním vyvinutým diagnostickým systémem pro měření HRV je přístroj s označením DiANS PF8 z roku 2011, který se skládá z notebooku se softwarem k analýze HRV, modulem obsahujícím EKG zesilovač a elektrodami. Přístroj může hodnotit variabilitu srdeční frekvence jak časovou analýzou na základě funkčních testů Ewingovy kardiovaskulární baterie (test klidného a hlubokého dýchání, Valsalvův manévr, ortostatická zkouška a zkouška stisku ruky, tzv handgrip test), tak frekvenční (spektrální) analýzou, která umožňuje získat větší množství informací o funkci autonomního systému a jeho subsystémech sympatiku a parasympatiku. Prakticky se frekvenční (spektrální) analýza HRV vyšetřuje na podkladě kontinuálního 15minutového EKG záznamu, při kterém vyšetřovaný prvních pět minut leží, druhých stojí a posledních pět minut opět leží. Tyto aktivní změny polohy těla mají význam pro posouzení reflexních odpovědí sympatiku a vagu. Při posledním lehu dochází obvykle k zvýraznění vagové odpovědi, která může být při prvním lehu potlačena interferujícími faktory, jako např. stresem z vyšetření, a tak tento algoritmus měření citlivěji zachycuje aktivitu vagu [9].
Nelineární metody
Druhou skupinu metod analýzy variability srdeční frekvence tvoří metody nelineární. Tyto metody se blíží k reálnějšímu popisu biosignálu ze živého organismu, protože ten je sám o sobě nelineárním a dynamickým. Zdravý fyziologický systém generuje komplexní signál, který má vlastnosti nepravidelnosti a nepředvídatelnosti. Tuto komplexnost signálu matematicky modelují nelineární metody, kdy mezi základní patří metody entropie a fraktální analýzy [6]. Nelineární metody byly použity v mnohých studiích, avšak širšímu rozšíření do praxe vzhledem k absenci standardizovaných postupů zatím nedošlo.
Graf 1. Záznam vyšetření spektrální analýzy HRV při zkoušce leh-stoj-leh demonstrující velmi dobrou variabilitu srdeční frekvence 
Na ose x jsou znázorněny jednotlivé frekvence, na nichž dochází k oscilaci záznamu, na ose y jsou hodnoty výkonové spektrální hustoty (PSD) a osa z znázorňuje časový průběh záznamu představující jednotlivé fáze vyšetření s měnící se polohou pacienta (T1 = Leh 1, T2 = stoj, T3 = Leh 2). Z grafu jsou zřetelně vidět vysoké amplitudy v jednotlivých frekvenčních pásmech, které jsou podstatou dobré celkové variability srdeční frekvence. Aktivita v pásmu vagu je velmi dobrá a typicky zvýšená po změně polohy do lehu v čase T3. Měření provedeno na přístroji DiANS PF8 (verze 2013) společnosti DIMEA Group, s.r.o./Ltd., Olomouc. (Archiv autora) Graf 2. Záznam vyšetření spektrální analýzy HRV při zkoušce leh-stoj-leh demonstrující sníženou variabilitu srdeční frekvence 
Na ose x jsou znázorněny jednotlivé frekvence, na nichž dochází k oscilaci záznamu, na ose y jsou hodnoty výkonové spektrální hustoty (PSD) a osa z znázorňuje časový průběh záznamu představující jednotlivé fáze vyšetření s měnící se polohou pacienta (T1 = Leh 1, T2 = stoj, T3 = Leh 2). Z grafu je patrné snížení amplitud v jednotlivých frekvenčních pásmech a zřetelně je redukovaná aktivita ve frekvenčním pásmu vagu. Měření provedeno na přístroji DiANS PF8 (verze 2013) společnosti DIMEA Group, s.r.o./Ltd., Olomouc. (Archiv autora) VARIABILITA SRDEČNÍ FREKVENCE A PREDIKCE PEROPERAČNÍCH KOMPLIKACÍ
Predikce hypotenze po úvodu a během celkové anestezie
Hypotenze v průběhu celkové anestezie je častým nežádoucím účinkem léků podávaných k jejímu navození. Na regulaci krevního tlaku se významně podílí autonomní nervový systém, a to především prostřednictvím baroreflexu [10]. Přítomná dysfunkce autonomní regulace spolu s podávanými anestetiky může být příčinou závažného poklesu tlaku po úvodu a během celkové anestezie. Ovlivnění autonomního nervového systému jednotlivými anestetiky a opiáty bylo zkoumáno měřením variability srdeční frekvence. Většina celkových anestetik způsobuje pokles v aktivitě sympatiku (index LF power), avšak efekt na aktivitu parasympatiku (index HF power) se liší podle jednotlivých anestetik. Inhalační anestetika (izofluran, sevofluran a desfluran) především výrazně inhibují sympatickou aktivitu. Na druhou stranu rychlý vzestup jejich koncentrace, zvláště u zdravých dětí, vede k vzestupu srdeční frekvence, a to na podkladě zvýšeného sympatického cévního tonu a inhibicí parasympatické kardiální inervace [11]. U thiopentalu dochází k rovnoměrnému poklesu jak ve složce sympatické, tak parasympatické. Zatímco u propofolu je pokles parasympatického tonu nižší než sympatického, což vysvětluje zvýšenou tendenci k bradykardii během propofolové anestezie, u ketaminu je typický vzestup sympatické aktivity, který nejlépe reflektuje zvýšený poměr LF/HF. Etomidát reprezentuje anestetikum, u kterého nedochází k výraznějším změnám ve složce LF ani HF, a tak potvrzuje jeho užití jako anestetika volby u kardiálně limitovaných pacientů. Opiáty reprezentující analgetickou složku celkové anestezie všeobecně vedou k inhibici sympatiku a k udržení až zvýšení parasympatické aktivity [12].
Huang et al. předoperačně hodnotili variabilitu srdeční frekvence metodou frekvenční analýzy u 133 pacientů podstupujících plánovaný chirurgický výkon [13]. 46 pacientů mělo diagnózu diabetes mellitus, který je nejčastějším chronickým onemocněním vedoucím k významné autonomní dysregulaci. Je však nutno podotknout, že s určitým stupněm autonomní neuropatie se pojí většina chronických nemocí. Z kardivaskulárních onemocnění se jedná především o ischemickou chorobu srdeční, chronické srdeční selhání a hypertenzi, z plicních onemocnění o chronickou obstrukční plicní nemoc, z neurologických chorob sem patří většina degenerativních onemocnění, zejména Parkinsonova choroba, a závěrem taktéž nutno zmínit psychiatrické nemoci, a to především depresi [2]. Ve výše zmíněné studii Huanga et al. byl úvod a vedení celkové anestezie standardizováno a před úvodem byla podána prehydratace krystaloidním roztokem. Parametry frekvenční analýzy TP, LF a HF byly signifikantně nižší u všech pacientů, u kterých došlo k hypotenzi po úvodu do anestezie a kteří následně potřebovali podporu oběhu. Častější pokles tlaku byl ve skupině pacientů s diabetem. K hypotenzi došlo u 30 % diabetiků, ale pouze 6 % těchto pacientů mělo klinicky diagnostikovanou diabetickou autonomní neuropatii, u které bylo již dříve dokázáno, že je spojena s hemodynamickou nestabilitou a je faktorem zvyšujícím perioperační kardiovaskulární morbiditu diabetiků [14]. HRV se prokázala jako metoda, která je schopna identifikovat klinicky skrytou autonomní dysfunkci (neuropatii) [13]. Hanss et al. se ve své práci, zabývající vztahem variability srdeční frekvence a hypotenze po úvodu do celkové ane-stezie, zaměřili na hledání prahové hodnoty pro predikci výrazného poklesu tlaku po úvodu do anestezie. Do studie bylo zahrnuto 100 kardiovaskulárně rizikových pacientů (ASA III–IV) podstupujících plánovanou cévní nebo nitrobřišní operaci. Variabilita srdeční frekvence byla předoperačně zhodnocena metodou frekvenční analýzy, úvod a vedení anestezie byly standardizovány. Data prvních 50 pacientů byla analyzována retrospektivně. V prospektivní části, do které bylo zahrnuto druhých 50 pacientů, se hodnota TP < 500 ms2 potvrdila jako vysoce senzitivní a specifický index pro hypotenzi a taktéž bradykardii po úvodu do celkové anestezie [15].
Predikce hypotenze při subarachnoidální anestezii
Pokles tlaku patří k nejčastějším nežádoucím účinkům při subarachnoidální anestezii (SA). Hlavním mechanismem zodpovědným za hypotenzi je pokles systémové vaskulární rezistence na podkladě blokády pregangliových sympatických vláken [18]. Většina studií zabývajících se zhodnocením variability srdeční frekvence jako nástroje k předpovědi hypotenze při subarachnoidální anestezii byla zaměřena na pacientky podstupující plánovaný císařský řez. Subarachnoidální ane-stezie je dnes metodou volby u plánovaného císařského řezu a anestezií indukovaná hypotenze může mít závažné následky pro matku i dítě. Hanss et al. hodnotili předoperačně změřenou variabilitu srdeční frekvence retrospektivně u 41 pa-cientek a poté prospektivně u 19 pacientek podstupujících plánovaný císařský řez v subarachnoidální anestezii (do studie nebyly zařazeny pacientky s hypertenzí a preeklampsií). U všech pacientek byla provedena prehydratace 500 ml koloidního roztoku před aplikací vlastní subarachnoidální anestezie. V retrospektivní části studie byly podle závažnosti poklesu tlaku pacientky klasifikovány do tří skupin: mírná (systolický TK > 100 mm Hg), střední (100 mm Hg > sTK > 80 mm Hg) a závažná (sTK < 80 mm Hg) hypotenze. U pacientek, které vykazovaly signifikantně vyšší aktivitu sympatiku v poměru k parasympatiku (definováno zvýšeným poměrem LF/HF), došlo významně častěji ke střední a závažné hypotenzi. V prospektivní části studie byla zvýšená aktivita sympatiku definována prahovou hodnotou LF/HF > 2,5 potvrzena jako prediktor závažné hypotenze po subarachnoidální anestezii. Pozoruhodným faktem je, že pacientky, které zareagovaly na prehydrataci snížením sympatického tonu (tj. poklesem indexu LF/HF), vykazovaly při anestezii méně závažný pokles tlaku v porovnání s pacientkami, u kterých po podání bolusu tekutin nedošlo k měřitelné změně v aktivitě autonomního nervového systému [17]. Na základě těchto poznatků byla stejnými autory provedena intervenční studie, do které bylo zařazeno 80 pacientek před plánovaným císařským řezem v subarachnoidální anestezii. Do studie opět nebyly zařazeny pacientky s hypertenzí a preeklampsií. Variabilita srdeční frekvence byla měřena předoperačně, u všech pacientek byla provedena prehydratace 500 ml koloidního roztoku před aplikací vlastní subarachnoidální anestezie. Do kontrolní skupiny bylo zařazeno 40 pacientek, které byly podle prahové hodnoty LF/HF = 2,5 rozděleny do dvou podskupin: s převahou sympatické aktivity LF/HF > 2,5 (23 pacientek) a normální sympatiko-vagovou rovnováhou LF/HF < 2,5 (17 pacientek). Výskyt závažné hypotenze (sTK < 80 mm Hg) byl významně častější ve skupině pacientek se sympatikotonií, tedy s LF/HF > 2,5. K poklesu systolického tlaku pod 80 mm Hg došlo v této skupině u 20 z 23 pacientek, naproti tomu u pacientek s LF/HF < 2,5 pouze u 3 ze 17. Do intervenčního ramene studie bylo zařazeno 40 pacientek se sympatikotonií (LF/HF > 2,5) a tedy s identifikovaným rizikem závažné hypotenze. Následně byly tyto pacientky dále randomizovány do dvou skupin. U prvních 20 pacientek byly titrovaně podávány tekutiny do dosažení hodnoty LF/HF < 2,5. U druhých 20 pacientek byla zahájena infuze vazopresorů bezprostředně po podání lokálního anestetika. Výskyt hypotenze byl v obou intervenčních skupinách signifikantně nižší (3 z 20 v první skupině a pouze 1 z 20 ve druhé skupině) než v kontrolní skupině definované taktéž vysokým indexem LF/HF > 2,5. V intervenčním ramenu nebyly popsány žádné nežádoucí účinky vyplývající z tekutinové terapie či vazopresorické podpory. Měření variability srdeční frekvence umožnilo nejen identifikaci pacientek se zvýšeným rizikem závažných hemodynamických komplikací indukovaných subarachnoidální anestezií, ale i časnou a cílenou tekutinovou respektive vazoaktivní terapii [18].
VARIABILITA SRDEČNÍ FREKVENCE A PREDIKCE POOPERAČNÍCH KOMPLIKACÍ
Poprvé byla variabilita srdeční frekvence jako nástroj k předpovědi morbidity a mortality popsána koncem 80. let minulého století Kleigerem, který prokázal, že pacienti po infarktu myokardu se sníženou variabilitou srdeční frekvence mají vyšší mortalitu [19]. Následovaly studie, které jednak potvrdily, že snížená variabilita srdeční frekvence u pacientů po infarktu myokardu je spojena s vyšší mortalitou, a dále ukázaly, že měření variability srdeční frekvence je přesnějším nástrojem pro predikci dlouhodobé kardiální mortality než echokardiografické vyšetření [20].
V pooperačním období kardiovaskulární příhody patří k závažným komplikacím [21]. Předoperační monitorování variability srdeční frekvence k předpovědi pooperačního průběhu bylo hodnoceno v několika studiích. První z nich byly zaměřeny na pacienty podstupující kardiochirurgickou operaci (CABG – coronary artery bypass grafting). Pokles variability srdeční frekvence byl spojen s výskytem pooperační ischémie myokardu, pooperační fibrilace síní a prodlouženou délkou hospitalizace na jednotce intenzivní péče [22, 23, 24]. Další studie se již týkaly nekardiochirurgických operací. Mamo-de et al. zařadili do své prospektivní studie 297 pacientů podstupujících elektivní cévní výkon. Primárním sledovaným cílem byly kardiovaskulární komplikace (infarkt myokardu a náhlá srdeční smrt) do 30 dnů od operace. Snížená variabilita srdeční frekvence spolu s pozitivním perfuzním thaliovým skenem byly identifikovány jako nezávislé prediktory pooperačních kardiovaskulárních komplikací [25]. Filipovic et al. monitorovali roční mortalitu u 173 pacientů podstupujících nekardiochirurgickou operaci. S celkovou mortalitou silně korelovala před-operačně naměřená snížená variabilita srdeční frekvence a zvýšená hodnota troponinu I (TnI) v pooperačním období [26]. Tato skupina byla dále sledována do doby dvou let po operaci, snížená variabilita srdeční frekvence byla v tomto období v korelaci s výskytem závažných kardiálních komplikací a s celkovou mortalitou [27].
ZÁVĚR
Dysfunkce autonomní regulace představuje závažný zdroj anesteziologického rizika ovlivňující výsledný perioperační průběh. Při rutinně prováděném předoperačním anesteziologickém vyšetření nemusí být autonomní dysfunkce (neuropatie) rozpoznána, neboť klinické projevy bývají často nevýrazné. Dostupná data ukazují, že předoperační zhodnocení funkce autonomního nervového systému metodou měření variability srdeční frekvence je vyšetřením s potenciálem identifikovat pacienty se zvýšeným rizikem perioperačních komplikací. Již předoperační přípravu lze optimalizovat u předem zjištěných pacientů se sníženou variabilitou srdeční frekvence. Mazzeo doporučuje zvážit přidání betablokátorů, jakožto léků zvyšujících variabilitu srdeční frekvence [2]. Ve svém doporučení se odvolává na intervenční studii u pacientů po infarktu myokardu, kdy přidání betablokátorů vedlo ke zvýšení HRV a poklesu mortality [28]. Během operace u pacientů se sníženou variabilitou srdeční frekvence, tedy s vyšším rizikem hemodynamických komplikací, je výhodou zavedení hemodynamického monitorování, které racionalizuje podávání tekutin a vazoaktivních léků. V pooperačním období se zhodnocení variability srdeční frekvence ukázalo jako vysoce senzitivní parametr dlouhodobé morbidity a mortality [20]. Pacienti s prokázanou autonomní dysfunkcí by proto měli být častěji sledováni i v dlouhodobém časovém horizontu po operačním výkonu.
Konflikt zájmů: v průběhu psaní tohoto článku nedošlo ze strany autora a spoluautorů ke konfliktu zájmů.
Do redakce došlo dne 20. 12. 2014.
Do tisku přijato dne 23. 3. 2015.
Adresa pro korespondenci:
MUDr. Petr Reimer
Klinika anesteziologie, resuscitace a intenzivní medicíny
Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: petr.reimer@gmail.com
Zdroje
1. Tracey, K. J. Physiology and immunology of the cholinergic antiinflammatory pathway. J. Clin. Invest., 2007, 117, p. 289–296.
2. Mazzeo, A. T., La Monaca, E., Di Leo, R., Vita, G., Santamaria, L. B. Heart rate variability: a diagnostic and prognostic tool in ane-sthesia and intensive care. Acta Anaesthesiol. Scand., 2011, 55, p. 797–811.
3. Ernst, G. The autonomic nervous system. In Ernst, G. Heart rate variability. Springer, 2014, p. 27–47. ISBN 978-1-4471-4308-6.
4. Metelka, R. Heart rate variability – current diagnosis of the cardiac autonomic neuropathy. A review. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc Czech Repub., 2014, 158, 3, p. 327–338.
5. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart rate variability, standard of measurement, physiological interpretation and clinical use. Circulation, 1996, 93, p. 1043–1065.
6. Ernst, G. Methodological Issues. In Ernst, G. Heart rate variability. Springer, 2014, p. 51–118. ISBN 978-1-4471-4308-6.
7. Hedman, A. E., Hartikainen, J. E., Tahvanainen, K. U., Hakumaki, M. O. The high frequency component of heart rate variability reflects cardiac parasympathetic modulation rather than parasympathetic tone. Acta Physiol. Scand., 1995, 155, p. 267–273.
8. Malliani, A., Montano, N., Pagani, M. Physiological background of heart rate variability. Cardiac Electrophysiol. Rev., 1997, 3, p. 343–346.
9. Javorka, K., Salinger, J. Hodnotenie variability frekvencie srdca. In Javorka, K. Variabilita frekvencie srdca. Martin: Vydavateľstvo Osveta, 2008, s. 39–65. ISBN 978-80-8063-269-4.
10. Wehrwein, E. A., Joyner, M. J. Regulation of blood pressure by the arterial baroreflex and autonomic nervous system. In Buijs, R. M., Swaab, D. F. Autonomic Nervous System. Elsevier, 2013, p. 89–102. ISBN 9780444534910.
11. Wodey, E., Senhadji, L., Pladys, P., Carre, F., Ecoffey, C. The relationship between expired concentration of sevoflurane and sympathovagal tone in children. Anesth. Analg., 2003, 97,p. 377–382.
12. Jeanne, M., Logier, R., Tavernier, B. Effect of General Anesthesia on Heart Rate Variability. In Kamath, M. V., Watanabe, M. A., Upton, A. R. M. Heart Rate Variability Signal Analysis: Clinical Applications. CRC Press, 2013, p. 241–261. ISBN 978-1-4398-4980-4.
13. Huang, C. J., Kuok, C. H., Kuo, T. B. J., Hsu, Y. W., Tsai, P. S.Pre-operative measurement of heart rate variability predicts hypotension during general anesthesia. Acta Anaesthesiol. Scand., 2006, 50, p. 542–548.
14. Burgos, L. G., Ebert, T. J., Asiddao, C., Turner, L. A., Patisson, C. Z, Wang-Cheng, R. Increased intraoperative cardiovascular morbidity in diabetics with autonomic neuropathy. Anesthesiology, 1989, 70, p. 591–597.
15. Hanss, R., Renner, J., Ilies, C., Moikow, L., Buell, O., Steinfath, M.,Scholz, J., Bein, B. Does heart rate variability predict hypotension and bradycardia after induction of general anaesthesia in high risk cardiovascular patients? Anaesthesia, 2008, 63,p. 129–135.
16. Hanss, R., Ohnesorge, H., Kaufmann, M., Gaupp, R., Ledowski, T.,Steinfath, M. Changes in heart rate variability may reflect sympatholysis during spinal anaesthesia. Acta Anaesthesiol. Scand., 2007, 51, p. 1297–1304.
17. Hanss, R., Bein, B., Ledowski, T., Lehmkuhl, M., Ohnesorge, H.,Scherkl, W., Steinfath, M., Scholz, J., Tonner, P. Heart rate variability predicts severe hypotension after spinal anesthesia for elective cesarean delivery. Anesthesiology, 2005, 102,p. 1086–1093.
18. Hanss, R., Bein, B., Francksen, H., Scherkl, W., Bauer, M., Doerges, V., Steinfath, M., Scholz, J., Tonner, P. Heart rate variability – guided prophylactic treatment of severe hypotension after subarachnoid block for elective cesarean delivery. Anesthesiology, 2006, 104, p. 635–643.
19. Kleiger, R. E., Miller, J. P., Bigger, J. T., Moss, A. J. Decreased heart rate variability and its association with increased mortality after acute myocardial infarction. Am. J. Cardiol., 1987, 59, p. 256–262.
20. Laitio, T. Jalonen, J., Kuusela, T., Scheinin, H. The role of heartrate variability in risk stratification for adverse postoperative cardiac events. Anesth. Analg., 2007, 105, p. 1548–1560.
21. Devereaux, P. J., Goldman, L., Cook, D. J., Gilbert, K., Leslie, K.,Guyatt, G. H. Perioperative cardiac events in patients undergoing non-cardiac surgery: a review of the magnitutde of the problem, the pathophysiology of the events and methods to estimate and communicate risk. CMAJ, 2005, 173, p. 627–634.
22. Laitio, T. T., Huikuri, H. V., Kentala, E. S., Makikallio, T. H., Jalonen, J. R., Helenius, H., Sariola-Heinonen, K., Yli-Mayry, S., Scheinin, H. Correlation properties and complexicity of perioperative RR-interval dynamics in coronary artery bypass surgery patients. Anesthesiology, 2000, 93, p. 69–80.
23. Laitio, T. T., Makikallio, T. H., Huikuri, H. V., Kentala, E. S., Uotila, P., Jalonen, J. R., Helenius, H., Hartiala, J., Yli-Mayry, S., Scheinin, H. Relation of heart rate dynamics to the occurrence of myocardial ischemia after coronary artery bypass grafting. Am. J. Cardiol., 2002, 89, p. 1179–1181.
24. Wu, Z. K., Vikman, S., Laurika, J., Pehkonen, E., Iivainen, T., Huikuri, H., Tarkka, M. Nonlinear heart rate variability in CABG patients and the preconditioning effect. Eur. J. Cardio. Thoracic. Surg., 2005, 28, p. 109–113.
25. Mamode, N., Docherty, G., Lowe, G. D., Macfarlane, P. W., Martin, W., Pollock, J. G., Cobbe, S. M. The role of myocardial perfusion scanning, heart rate variability and D-dimers in predicting the risk of perioperative cardiac complications after peripheral vascular surgery. Eur. J. Vasc. Endovasc. Surg., 2001, 22, p. 499–508.
26. Filipovic, M., Jeger, R., Probst, C., Girard, T., Pfisterer, M., Gurke, L., Skarvan, K., Seeberger, M. D. Heart rate variability and cardiac troponin I are incremental and independent predictors of one-year all-cause mortality after major oncardiac surgery in patients at risk of coronary artery disease. J. Am. Coll. Cardiol., 2003, 42, p. 1767–1776.
27. Filipovic, M., Jeger, R., Girard, T., Probst, C., Pfister, M., Gurke, L., Studer, W., Seeberger, M. D. Predictors of long-term mortality and cardiac events in patients with known or suspected coronary artery disease who survive major non-cardiac surgery. Anaesthesia, 2005, 60, p. 5–11.
28. Lampert, R., Ickovics, J. R., Viscoli, C. J., Horwitz, R. I., Lee, F. A. Effects of propranolol on recovery of heart rate variability following acute myocardial infarction and relation in the beta blocker heart attack trial. Am. J. Cardiol., 2003, 91, p. 137–142.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2015 Číslo 3- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Programové prohlášení výboru ČSARIM 2015–2018
- Nové molekuly v rukou anesteziologa na porodním sále
- Předoperační vyšetření autonomního nervového systému měřením variability srdeční frekvence jako metoda predikce perioperačního průběhu
- Děložní hypotonie a přístup anesteziologa
- Biologická léčba a riziko komplikací v perioperačním období
- PRES (Posterior reversible encefalopathy syndrome) doprovázející preeklampsii u ženy s dvojčetným těhotenstvím– kazuistika
- Ultrazvuk a jeho současná role v rozhodovacích procesech a při intervencích v oblasti dýchacích cest
- Výzkum v oboru AIM, typy studií, randomizace, etické problémy, témata
- Fyziologie mozkomíšního moku
-
Postoperative Delirium in Older Adults: Best Practice Statement from the American Geriatrics Society
The American Geriatrics Society Expert Panel on Postoperative Delirium in Older Adults - Hodnocení neurologické prognózy dospělých pacientů po srdeční zástavě*
- The 50th anniversary of Prague’s Na Františku Hospital
- Vzpomínky na Nemocnici Na Františku
- Klinická anesteziologie
- Ohlednutí za slavnostním otevřením rekonstruovaného lůžkového resuscitačního oddělení Nemocnice Na Františku v roce 1999
-
Svědkové Jehovovi
Část druhá – eticko-právní problematika - Zápis ze schůze výboru Sekce porodnické anestezie a analgezie ČSARIM
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Děložní hypotonie a přístup anesteziologa
- PRES (Posterior reversible encefalopathy syndrome) doprovázející preeklampsii u ženy s dvojčetným těhotenstvím– kazuistika
- Biologická léčba a riziko komplikací v perioperačním období
- Předoperační vyšetření autonomního nervového systému měřením variability srdeční frekvence jako metoda predikce perioperačního průběhu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



