-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam TDM, fenotypizace a genotypizace pro správné dávkování léčiv
Significance of TDM, phenotyping and genotyping for the correct drug dosage
Therapeutic drug monitoring is a specific method of clinical pharmacology for monitoring of the therapy using measurement of drug serum concentrations followed by interpretation and good cooperation with clinician. It significantly helps to personalize and rationalize the treatment, to set individualized dosing, to minimize side effects, to decrease mortality and morbidity and to decrease the costs. Phenotyping and genotyping can increase therapeutic drug monitoring on higher level.
Key words:
therapeutic drug monitoring, individualization and personalization of drug dosing, phenotyping, genotyping.
Autoři: Milan Grundmann; Ivana Kacířová
Působiště autorů: Ostravská univerzita, Lékařská fakulta a Fakultní nemocnice Ostrava, Ústavy klinické farmakologie
Vyšlo v časopise: Čas. Lék. čes. 2010; 149: 482-487
Kategorie: Přehledový článek
Souhrn
Terapeutické monitorování hladin léčiv je specifická metoda klinické farmakologie pro monitorování terapie pomocí měření koncentrace léčiva v séru s následnou interpretací a akceptací klinikem. Je významným pomocníkem pro personalizovanou medicínu v oblasti individualizace dávkování, poněvadž umožňuje racionální terapii s minimalizací výskytu nežádoucích účinků, snížení mortality a morbidity a snížení nákladů. Fenotypizace a genotypizace mohou posunout terapeutické monitorování léčiv na vyšší kvalitativní úroveň.
Klíčová slova:
terapeutické monitorování, individualizace a personalizace dávkování léčiv, fenotypizace, genotypizace.Terapeutické monitorování hladin léčiv (TDM) je specifická metoda klinické farmakologie pro monitorování terapie pomocí měření koncentrace léčiva v séru (plazmě, krvi). Jejím základním předpokladem je existence úzkého vztahu mezi koncentrací léčiva v séru a jeho farmakologickým efektem. Klinická farmakologie má v této oblasti své vlastní specifické kódy (1).
Z hlediska léčiva je TDM vhodné v následujících případech:
- vztah hladiny a účinku je těsnější než dávky a účinku
- účinek léčiva je obtížně klinicky měřitelný
- léčivo má úzkou terapeutickou šíři
- farmakokinetika nultého řádu
- toxikologické důvody
Z hlediska pacienta je TDM vhodné v následujících případech:
- vyloučení non-compliance
- změny při fyziologických stavech (těhotenství, dětství, stáří)
- změny při chorobných stavech (onemocnění jater, ledvin, srdeční selhání, horečka)
- lékové interakce
- nastavení vhodné dávky
Praktické provedení TDM má tři základní části (obr. 1):
Obr. 1. Schéma správného terapeutického monitorování hladin léčiv (TDM) 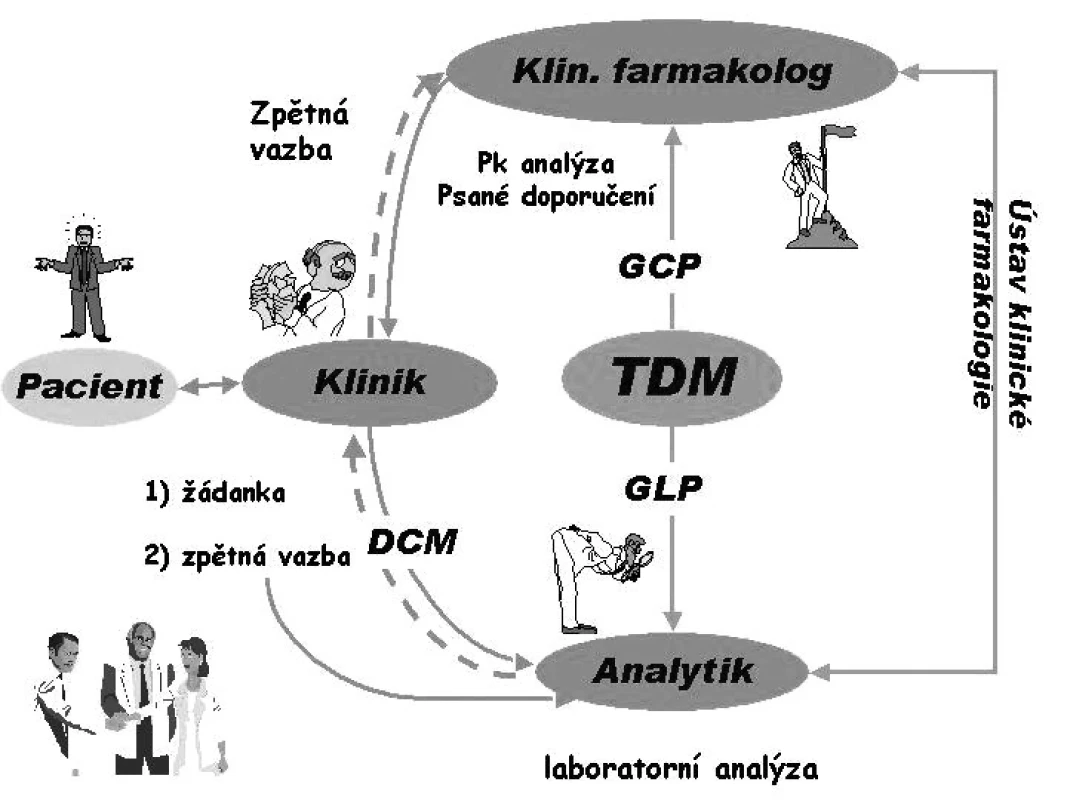
- Analýza léčiv podle zásad GLP (good laboratory practice) s použitím imunoanalytických enzymo-imunoanalytických metod, plynové chromatografie, kapalinová chromatografie a nejnověji kapalinové chromatografie ve spojení s hmotnostní spektrometrií. Klinik pro vyřešení neuspokojivých farmakoterapeutických výsledků odebere pacientovi krev a s vyplněnou podrobnou žádankou posílá materiál k laboratornímu vyšetření.
- Interpretace hladiny léčiva s případnou farmakokinetickou analýzou. Výsledek koncentrace léčiva je poslán z laboratoře klinickému farmakologovi, který na základě GCP pošle psané doporučení pro eventuální úpravu dávky nebo dávkového intervalu klinikovi.
- Zpětná vazba s klinikem. Zpětná vazba s klinikem má zásadní význam, jelikož jeho akceptace psaného doporučení a další kontrola podle tohoto doporučení zajistí změnu dávkování, a tím i racionální farmakoterapii. Pokud klinik nevyužije psané doporučení a výsledek založí do chorobopisu, jedná se pouze o sbírání známek a zbytečné zvyšování nákladů.
V současné době je nejvíce prováděno zejména na biochemických pracovištích takzvané DCM (drug concentration measurement), které splňuje zásady GLP, avšak nesplňuje zásady GCP. Nepoužívají se specializované žádanky, neprovádí se řádná intepretace, bývá špatná (nebo žádná) spolupráce s klinikem, takže přínos je výrazně nižší než náklady. TDM splňuje zásady GLP i GCP, pokud je prováděno podle schématu na obr 1. Vývoj v této oblasti vede k tzv. ATDM (advanced therapeutic drug monitoring), kdy se zavádí stanovování volné frakce léčiva a jeho metabolitů, koncentrace léčiv v cílových tkáních( např. imunosupresiva v lymfocytech) a pro zlepšení individualizace dávkování léčiv se stanovuje fenotyp a genotyp pacienta.
Použití TDM v nemocnici vede ke zkrácení doby hospitalizace, sníží se morbidita a mortalita, jsou nižší náklady. TDM je i dobrým ukazatelem interdisciplinární spolupráce tří různých oborů (analytik, klinický farmakolog, klinik). Výsledkem využívání TDM u ambulantních pacientů je méně hospitalizací, snížení pracovní neschopnosti a zvýšení kvality života. Při nesprávném používání TDM, kdy nejsou prováděny odpovídající změny v terapii a dochází ke zbytečným odběrům krve, zvyšujeme zbytečně náklady.
V současné době je pro kontrolu farmakoterapie využíváno TDM následujících skupin léčiv:
- antibiotika – aminoglykosidy (gentamicin, amikacin), vankomycin
- bronchodilatancia – teofylin
- antiepileptika – fenobarbital, primidon, fenytoin, etosuximid, karbamazepin, kyselina valproová, klonazepam, lamotrigin, topiramát, levetiracetam
- cytostatika – metotrexát, busulfan
- kardiaka – amiodaron, digoxin
- imunosupresiva – cyklosporin A, takrolimus, sirolimus, everolimus, mykofenolát
- psychofarmaka – lithium, diazepam, antidepresiva, antipsychotika
V některých případech je velmi vhodné stanovovat i základní metabolit mateřské látky:
- karbamazepin – 10, 11 epoxykarbamazepin
- primidon – fenobarbital
- amiodaron – desethylamiodaron
- diazepam – desmethyldiazepam
- metoprolol – hydroxymetoprolol
- cyklosporin – AM1, AM9, AM4N
Pro správnou interpretaci hladin léčiv potřebujeme správně vyplněnou specializovanou žádanku s následujícími údaji (www.fno.cz/ustav-klinicke-farmakologie/ustav-klinicke-farmakologie):
- dávková anamnéza, dávka, compliance, trvání terapie
- čas podání a odběru
- pacientův stav (věk, váha, výška, orgánové funkce)
- druh biologického vzorku (krev, plazma, sérum)
- klinický stav pacienta (kompenzace, nežádoucí účinky)
- léková anamnéza
Pro farmakokinetickou analýzu se používají různé software, v České republice je nejužívanější software MW - pharm 3.30 a vyšší. Při nálezu neočekávaných koncentrací je třeba uvažovat o použití nesprávné dávky, lékové interakci, nesprávném užití léků, poruchách vstřebávání, špatném času odběru, onemocnění ledvin a jater, změně vazebnosti na bílkoviny a o non-compliance pacienta (ať už se jedná o užití menší nebo vyšší dávky).
Pro ilustraci praktického provádění TDM jsou uvedeny příklady za použití software MW - pharm 3.30 pro predikci dávkování kardiotonika digoxinu (obr. 2 až 11). Digoxin je používán jako lék k léčbě chronického srdečního selhání a fibrilace síní v kombinační terapii. Vylučuje se ledvinami, jeho hlavní distribuční prostor je kosterní sval a nejčastěji je podáván u starých pacientů, kde dochází ke snižování renální funkce a úbytku svalové hmoty. Terapeutické rozmezí hladiny digoxinu bylo na našem pracovišti na základě výsledků studie DIG sníženo z původních 0,8–2,0 ng/ml na 0,5–1,2 ng/ml (2–8).
Obr. 2. Doporučení snížení dávky digoxinu s pomocí farmakokinetického servisu po 3. dávce Osmdesátiletému pacientovi se sníženou funkcí ledvin byl nasazen digoxin v dávce 0,125 mg p.o. 1× denně. 3. den byla změřena hladina digoxinu – 0,75 ng/ml, což je v terapeutickém rozmezí. Na základě farmakokinetického servisu bylo doporučeno snížení dávky na polovinu s následující kontrolou za týden – 0,73 ng/ml. Pokud by bylo pokračováno v původním vyšším dávkování, dostala by se hladina digoxinu do rozmezí, které zvyšuje mortalitu pacientů. 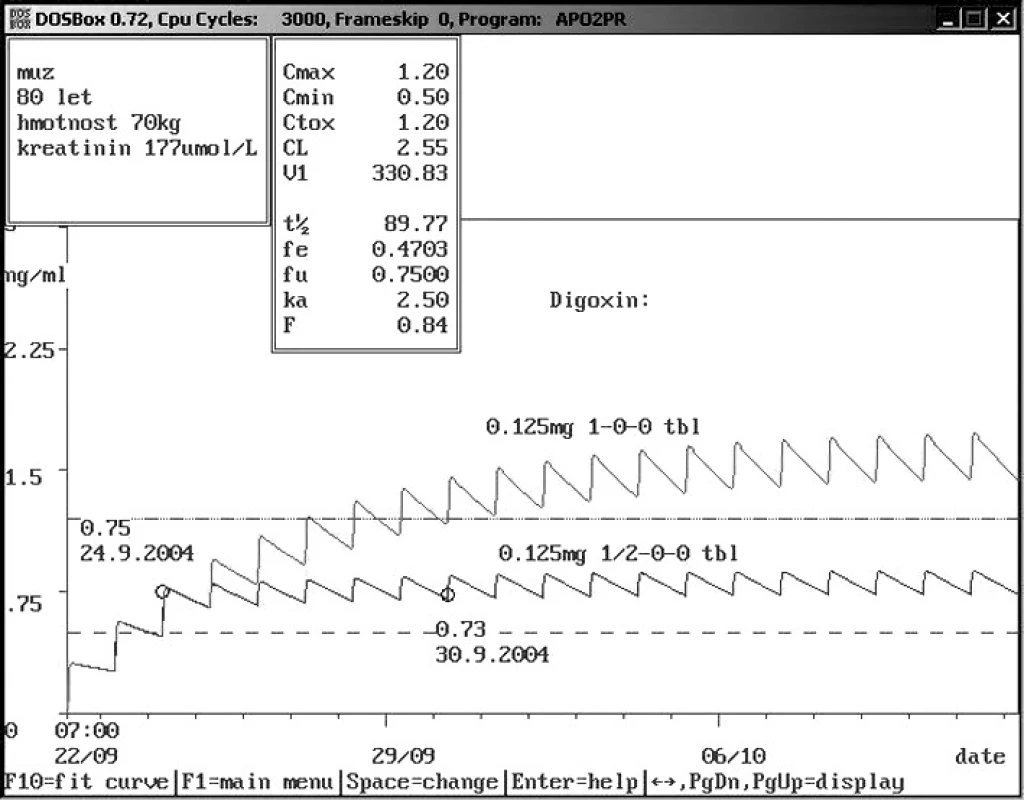
Obr. 3. Absolutní non-compliance pacienta při příjmu Sedmdesátičtyřletá žena přijata na Interní kliniku s údajným užíváním digoxinu 0,250 mg 1× denně. Analýza hladiny ukázala absolutní non-compliance. Podle populační křivky doporučeno v případě dalšího podávání snížení dávky na polovinu, jelikož původní dávka by vedla k toxickým koncentracím. 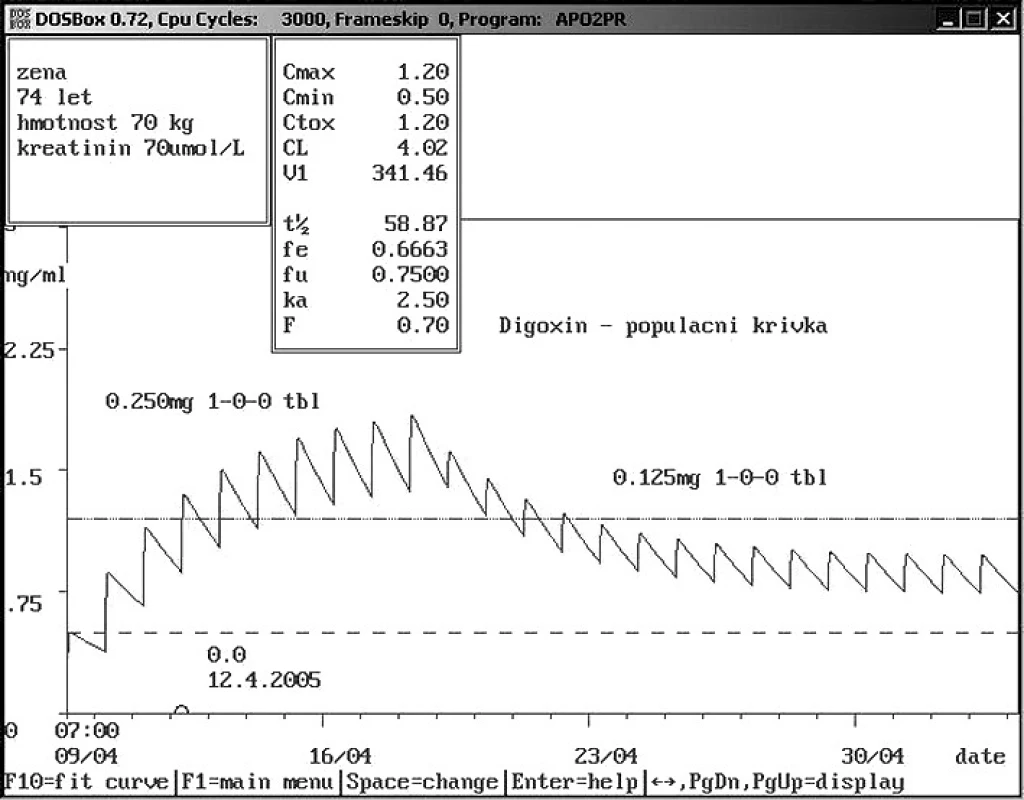
Obr. 4. Non-compliance pacienta při příjmu Padesítipětiletý muž se sníženou renální funkcí přijat na Interní kliniku s údajným dávkováním digoxin 0,12 5mg 1× denně. Změřená hladina digoxinu 0,5 ng/ml byla výrazně nižší než populační křivka, což vedlo k podezření s non-compliance, proto bylo doporučeno pravidelné užívání při hospitalizaci s následující kontrolou, která podezření potvrdila, jelikož další změřená hladina byla 1,0 ng/ml. 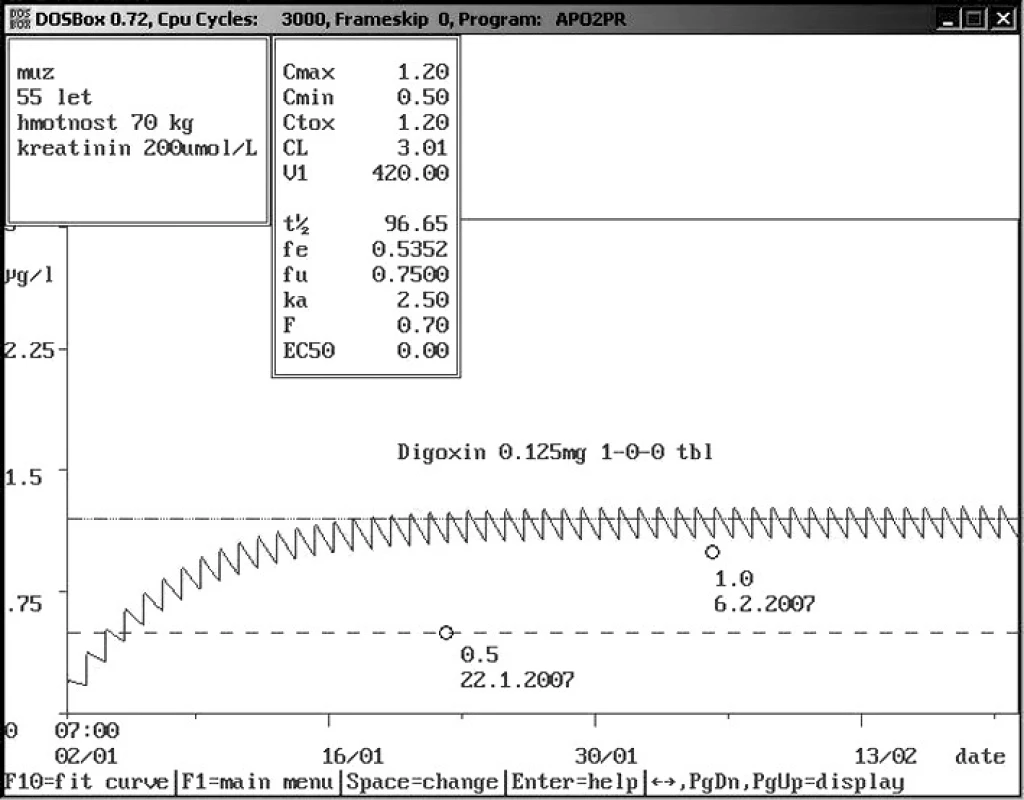
Obr. 5. Non-compliance ambulantního pacienta – užívání vyšší dávky Sedmdesátičtyřletému muži o hmotnosti 97 kg a sérovým kreatininem 144 μmol/l byl praktickým lékařem nasazen digoxin 0,250 mg 1× denně. Pacient se domníval, že dvojnásobným zvýšením dávky si zlepší účinek digoxinu. Výsledkem bylo snížení hmotnosti o 12 kg a zvýšení sérového kreatininu na 165 μmol/l při námi změřené hladině digoxinu 4,43 ng/ml. Bylo doporučeno vysazení digoxinu na týden a další podávání v dávce 0,125 mg 1× denně. Správnost doporučení dokázala kontrola hladiny digoxinu – 0,82 ng/ml. Jednalo se o typický příklad intoxikace digoxinem s nechutenstvím a poklesem hmotnosti způsobené dvojnásobným zvýšením původně indikované dávky, která by však sama o sobě způsobila hladinu digoxinu v toxických hodnotách. Farmakokinetický servis umožnil snížení dávky na čtvrtinu. 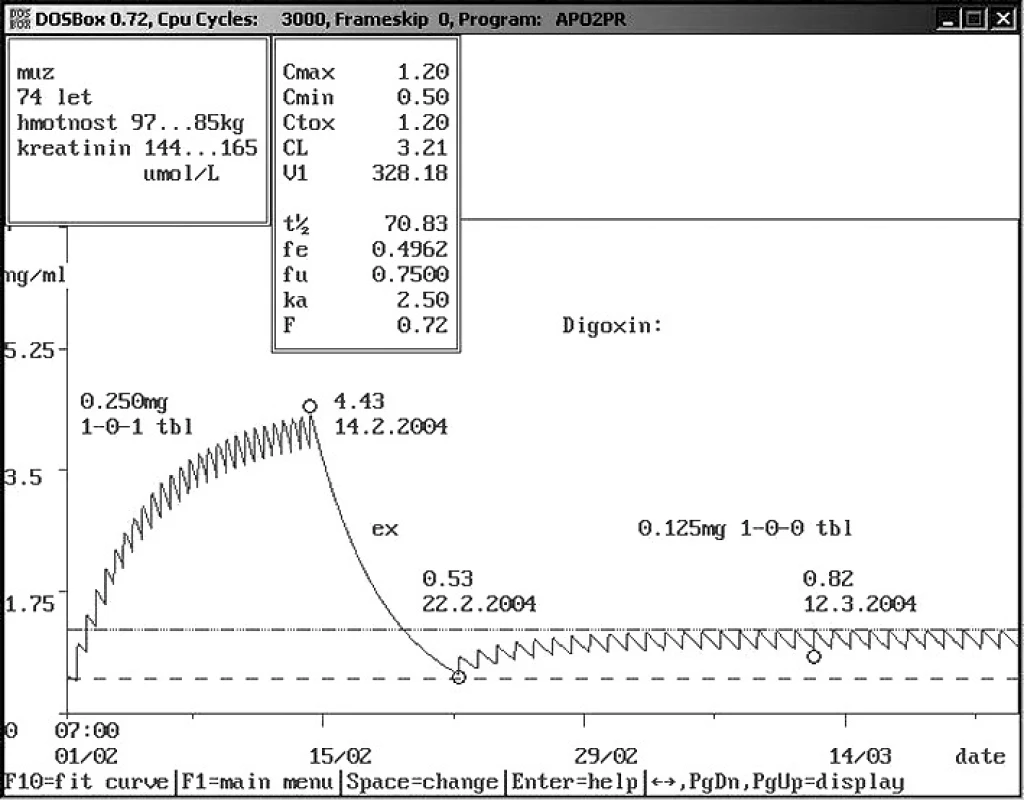
Obr. 6. Non-compliance hospitalizované pacientky – užívání vlastní medikace Sedmdesátiosmileté ženě přijaté na interní kliniku byla při příjmu stanovena hladina digoxinu 1,95 ng/ml. Pacientka udávala, že užívala digoxin v dávce 0,250 mg 1× denně. Doporučeno vysazení vzhledem k toxické hladině s kontrolou za 4 dny. V té době byla hladina digoxinu opět vysoká – 2,01 ng/ml, i když digoxin pacientce nebyl podáván. Při prohlídce nočního stolku pacientky zjištěno, že si pacientka tablety digoxinu přinesla z domu a sama je užívá. Doporučeno opět vysazení na 4 dny a snížení dávky na polovinu, při kontrolním odběru zjištěna hladina 0,81 ng/ml. 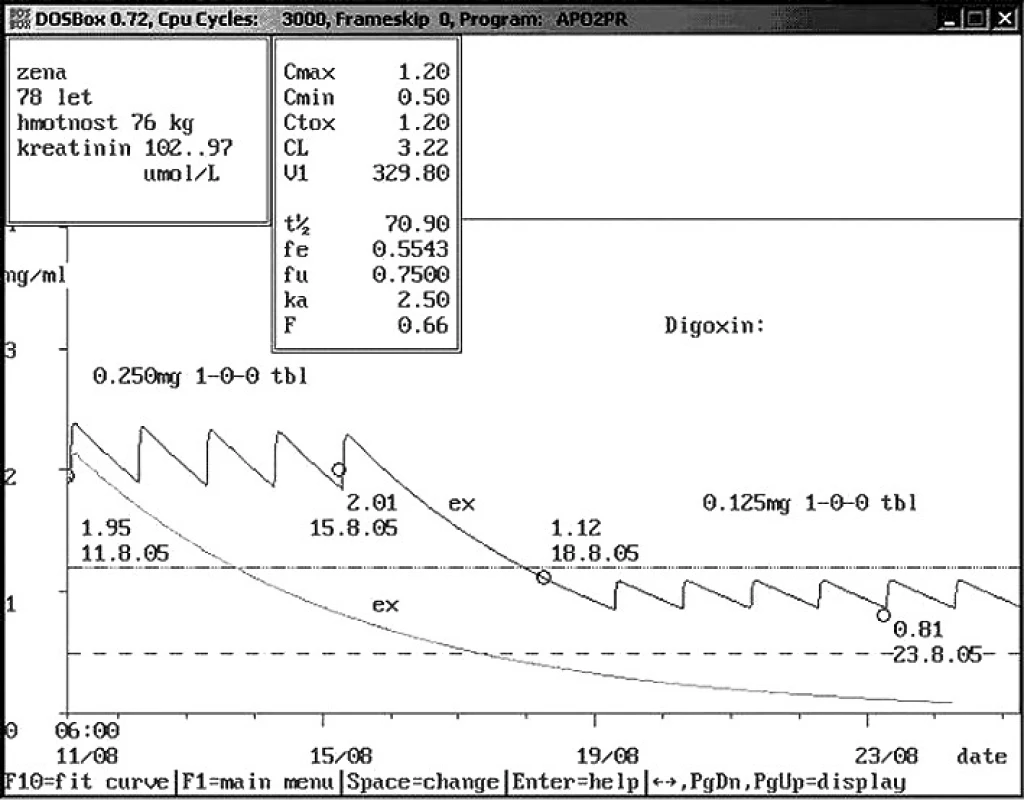
Obr. 7. Neakceptace doporučení klinického farmakologia s následnou intoxikací Osmdesátipětiletá žena se sníženou renální funkcí byl přijata na lůžkové oddělení s dávkou digoxinu 0,125 mg 1× denně, koncentrace digoxinu byla naměřena 1,82 ng/ml. Bylo doporučeno snížení dávky na polovinu, dávka však byla zvýšena dvojnásobně s výslednou toxickou hladin digoxinu 3,32 ng/ml. Doporučeno vysazení digoxinu na týden s následujícím dávkováním digoxinu 0,125 mg 1× 1/2 tbl, kontrolní hladina byla 0,95 ng/ml a potvrdila správnost predikce. 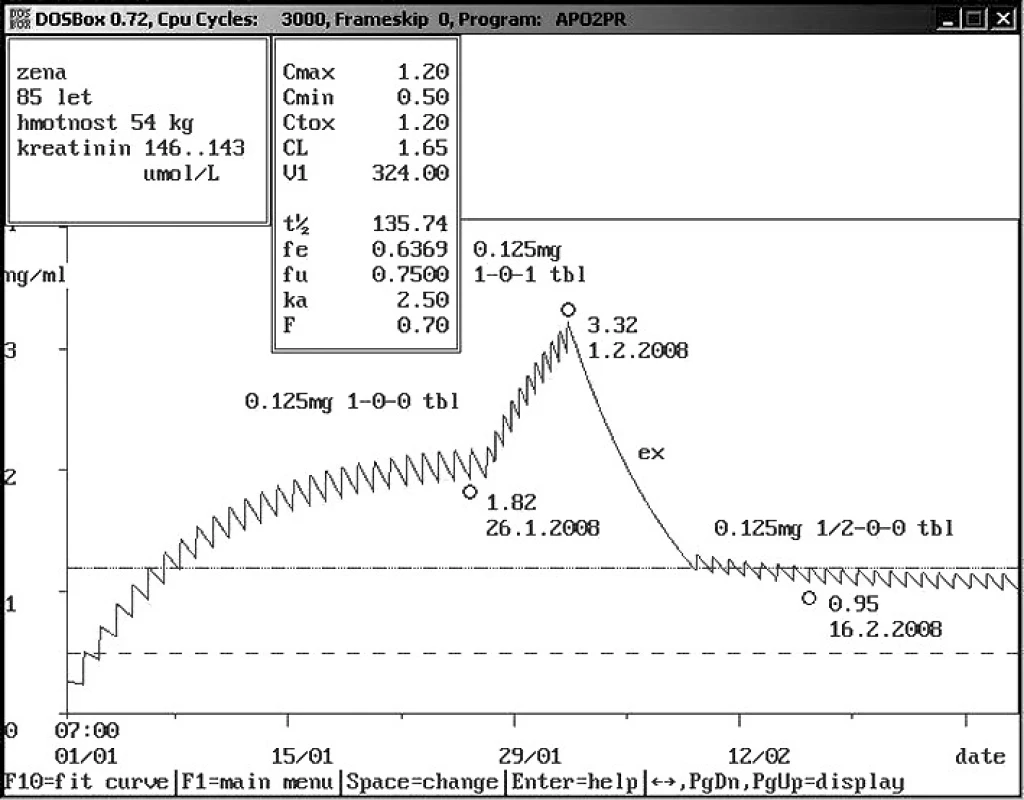
Obr. 8. Vysoká hladina digoxinu v důsledku chybného odběru Šedesátipětiletému pacientovi aplikován digoxin intravenózně v dávce 0,125 mg za 24 hodiny. Hladina digoxinu před podáním byla nízká – 0,36 ng/ml, avšak za 1 hodinu po podání byla vysoká – 2,39 ng/ml. Nejčastější chybou při intravenózní aplikaci s následnou vysokou hladinou bývá odběr z centrálního žilního katétru, kde zůstávají stopy podaného léčiva. Proto bylo doporučeno opakování odběrů z periferie, kontrolní hladiny digoxinu byly v normě. 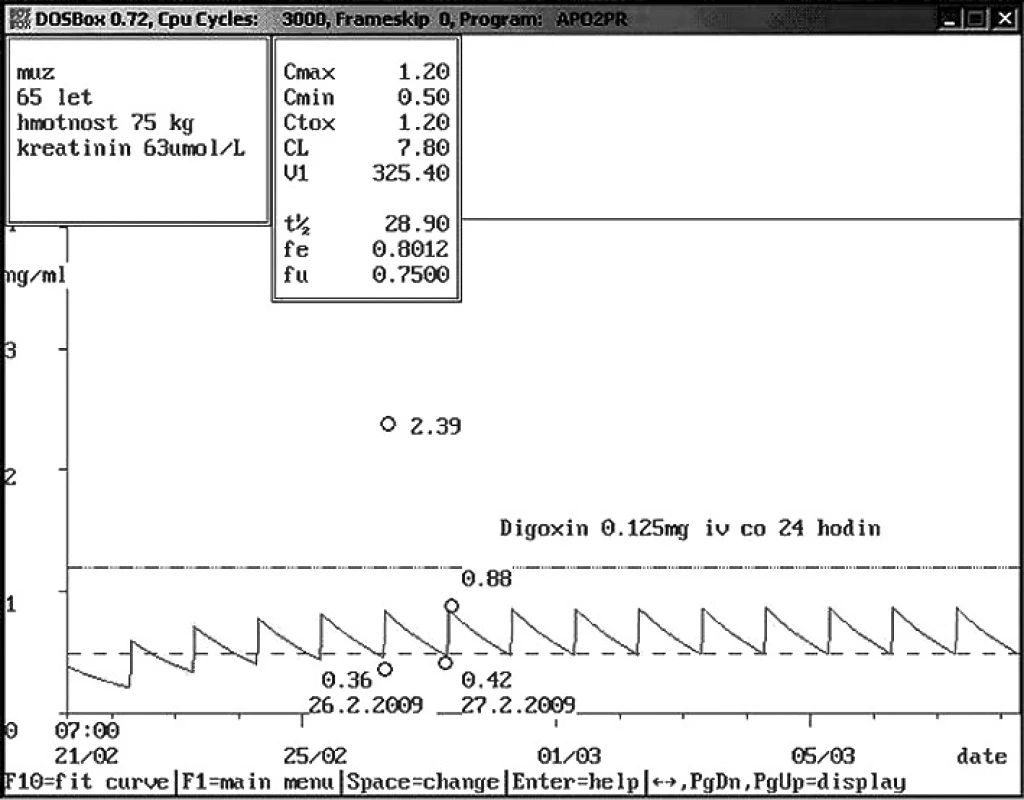
Obr. 9. Rozdíly hladin digoxinu u starých pacientů – dávka 0,250 mg 1× denně per os Sedmdesátidevítiletý muž s nízkou hmotností i sérovým kreatininem přijat s digoxinem v dávce 0,250 mg 1× denně s hladinou 0,99 ng/ml. Vzhledem k věku, vysoké dávce a relativně nízké hladině bylo pojato podezření na non-compliance a doporučena kontrola za týden při stejném dávkování, kontrolní odběr digoxinu – 1,05 ng/ml toto podezření nepotvrdil a ukázal na výborné vylučování digoxinu u tohoto pacienta. 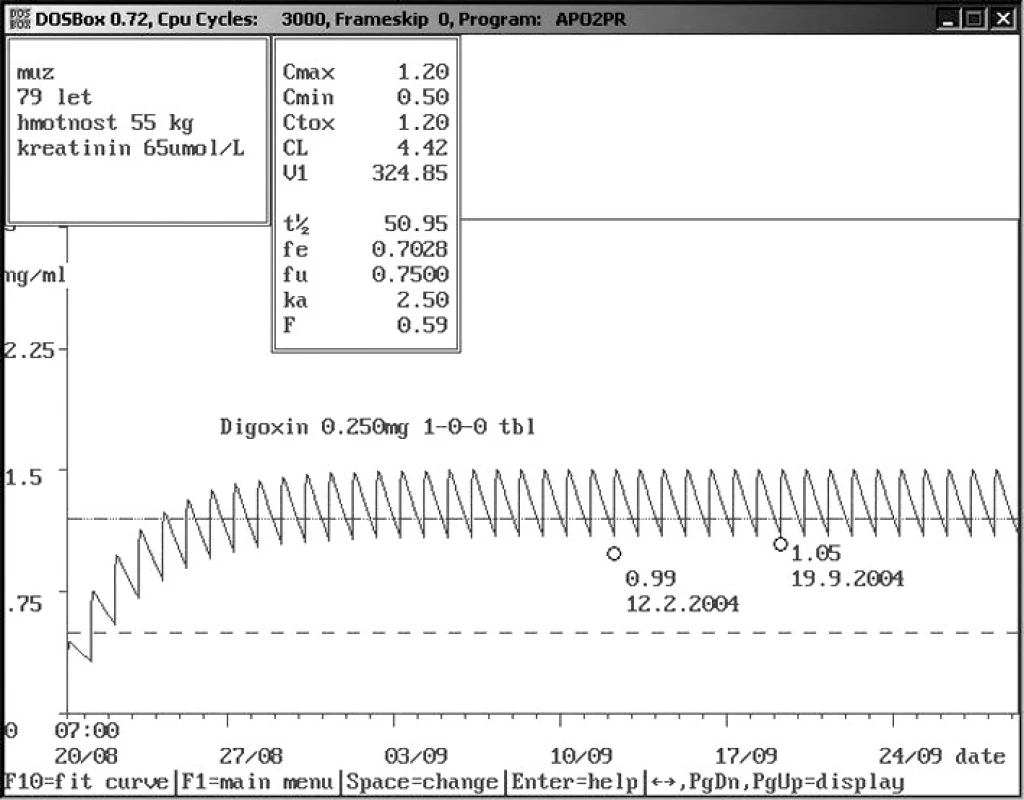
Obr. 10. Rozdíly hladin digoxinu u starých pacientů – dávka 0,125 mg 1× 1/2 tbl denně Sedmdesátipětiletá žena s hmotností 53 kg a mírně zvýšeným sérovým kreatininem byla přijata k hospitalizaci a po úvodní dávce 0,5 mg intravenózně byl nasazen digoxin 0,250 mg 1× denně per os. Sedmý den byla naměřena toxická hladin digoxinu 2,97 ng/ml. Doporučeno vysazení digoxinu na 6 dní a opětovné nasazení v dávce 0,125 mg 1× 1/2 tbl denně. Kontrolní odběr hladiny digoxinu 0,95 ng/ml ukázal správnost doporučení. 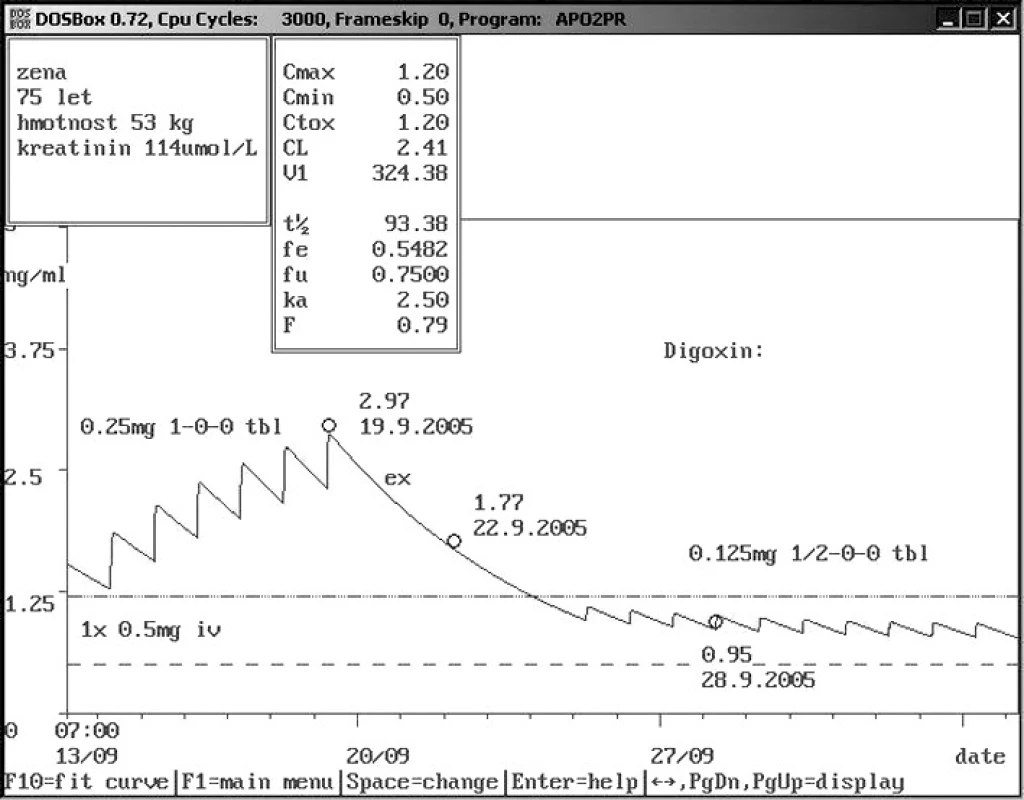
Obr. 11. Rozdíly hladin digoxinu u starých pacientů – dávka 0,125 mg 1× 1/2 tbl obden Osmdesátičtyřletá žena o hmotnosti 57 kg a sníženou renální funkcí je ambulantně léčena mimo jiné kombinací digoxinu a amiodaronu z důvodu chronického srdečního selhání spojeného s fibrilací síní. Nízká dávka digoxinu 0,03 mg/den udržuje hladinu digoxinu v terapetickém rozmezí kolem 0,5 ng/ml v důsledku lékové interakce s amiodaronem, nízké hmotnosti a snížení renální funkce. 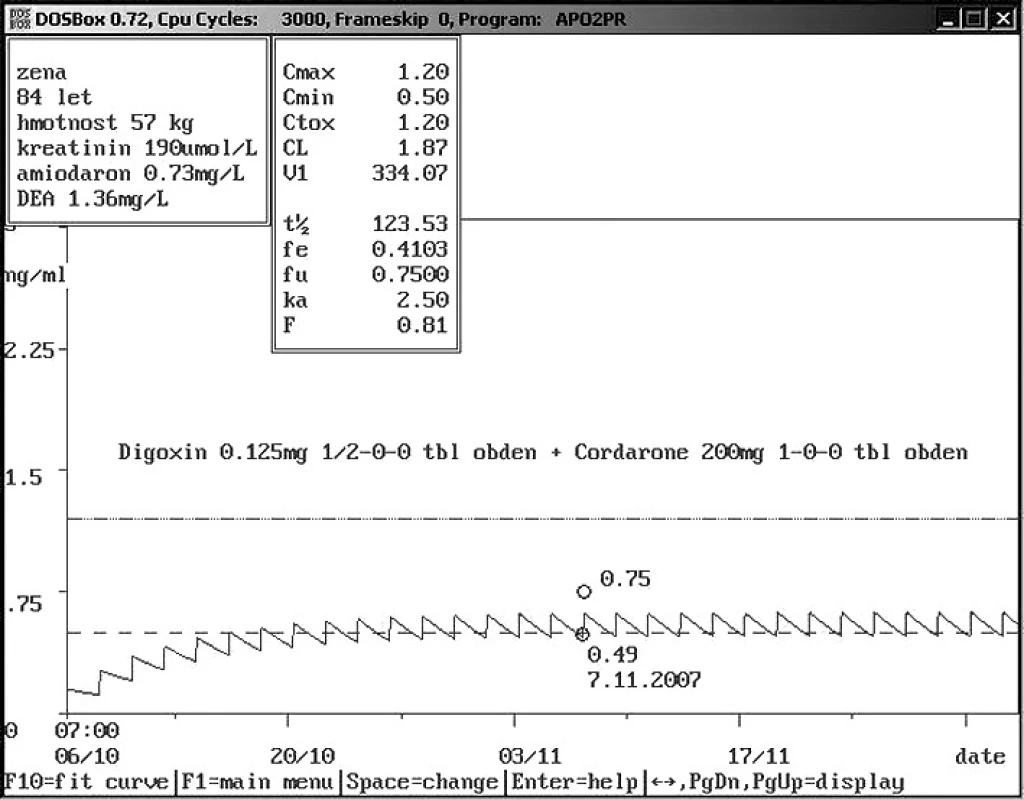
Na obrázcích 2 až 11 jsme ukázali, jakým způsobem je možné individualizovat a racionálně provádět dávkování digoxinu, zvláště u starých pacientů. K dosažení optimálního terapeutického rozmezí 0,5–1,2 ng/ml byly aplikovány dávky od 0,03 mg do 0,25 mg na den. Jejich použití není možno predikovat bez použití TDM, které je dle našeho názoru jedinou metodou umožňující přesnou individualizaci dávkování digoxinu dle věku a klinického stavu pacienta. Nesouhlasíme proto s tvrzením v guidelines České kardiologické společnosti, že stanovení sérové koncentrace digoxinu má pouze orientační význam a eventuální nutnou redukci denní dávky provádět nejlépe s použitím nomogramu nebo různých vzorců (8). Doporučujeme správné TDM digoxinu zařadit do závazných kardiologických doporučení.
Pro správné TDM je velice důležitá rychlá a specifická analytická metoda. U digoxinu se používá mikročásticová enzymová imunoanalýza (MEIA), kde nedochází vzhledem k nemetabolizaci digoxinu interferenci s metabolity. Daleko větší problém nastává například u imunosupresiva cyklosporinu A, který je významně metabolizován CYP3A4 a 3A5 na více než 30 metabolitů, které výrazně interferují s imunologickými metodami a nadhodnocují dosažené hladiny. My jsme tento jev popsali u specifické RIA metody, kdy nadhodnocení dosahovalo až 100 %. Zajímavé je, že na této nespecifické reakci se významně nepodílely hlavní metabolity, jako jsou AM1, AM9 a AM4N (11). V případě výrazně se metabolizujících látek je nezbytné použití chromatografických metod. My jsme nejdříve vyvinuli HPLC metodu, která je sice specifická, ale velmi pomalá (9). Výrazným pokrokem je použití kapalinové chromatografie s tandemovou hmotnostní spektrometrií, která je velmi rychlá a přesná a umožňuje stanovení nejen cyklosporinu A, ale všech ostatních imunosupresiv včetně metabolitů (10). Současně jsme v rámci ATDM vyvinuli metodu pro stanovení cyklosporinu A a jeho metabolitů v lymfocytech jako cílovém orgánu imunosuprese (10).
V poslední době se ukazuje jak velký význam pro vývoj plodu, resp. kojeného dítěte, má TDM antiepileptik v průběhu těhotenství (v séru matky) i v poporodním období (v séru matky, mléku a v séru kojeného dítěte) (12, 13). Nejčastěji užívanými antiepileptiky u těhotných epileptiček v posledních 15 letech jsou karbamazepin, kyselina valproová a lamotrigin (14). V souboru se zatím nejvyšším počtem těhotných žen s epilepsií užívajících lamotrigin se nám podařilo prokázat vysoce signifikantní korelaci mezi mateřskou a pupečníkovou koncentrací lamotriginu jak při monoterapii, tak při kombinaci s kyselinou valproovou s výraznou interindividuální variabilitu v poměru pupečníkové a mateřské koncentrace lamotriginu užívaného v monoterapii (více než 300 %) způsobenou pravděpodobně různou aktivitou placentárních UGT1A4 a 2B7 z důvodu genetického polymorfismu. Kyselina valproová významně snížila clearance lamotriginu o 65 %. Potenciální teratogenní efekt lamotriginu v kombinaci s kyselinou valproovou může být spojen s vyšší koncentrací lamotriginu a kyseliny valproové v plodu (15).
Většina lipofilních léčiv podléhá v těle metabolismu mikrozomálními enzymy lokalizovanými zejména v játrech a sliznici tenkého střeva. Exprese a aktivita metabolických enzymů cytochromu P450 vykazují širokou interindividuální variabilitu, která je z části podmíněna vlivem venkovního prostředí (indukce nebo inhibice současně užívanými léčivy nebo potravou, kouření, alkohol), věkem, pohlavím nebo patologickým stavem. Důležitým faktorem variability metabolismu léčiv je genetický polymorfismus CYP450. Z tohoto hlediska je nejvýznamnější CYP2D6, který metabolizuje přibližně 25 % klinicky užívaných léčiv (tab. 1) a je vysoce polymorfický. Na predikci individuální metabolické kapacity se používá metoda genotypování a fenotypování. Genotyp je možno určit analýzou DNA nejčastěji použitím metody polymerázové řetězové reakce (PCR). Výsledek genotypizace není ovlivnitelný faktory prostředí. Fenotypizace je založena buď na podání látky, která je pro určitý enzym vysoce specifická a je tímto exkluzivně metabolizována (tab. 2), nebo stanovením hlavního metabolitu studovaného léčiva. Výsledná metabolická aktivita se stanoví z metabolického poměru MR (mateřská látka/metabolit) v krvi nebo v moči. Podle toho je možno populaci rozdělit na pomalé, intermediální, extenzivní nebo ultrarychlé metabolizátory. Pomalí metabolizátoři mají nejvyšší hodnotu MR, naopak ultrarychlí metabolizátoři vykazují nejvyšší hodnotu MR (16). Na našem pracovišti jsme vyvinuli metodu na stanovení metoprololu a jeho metabolitu alfa-hydroxymetoprololu v séru metodou HPLC a používáme je jako modelovou látku pro fenotypizaci CYP2D6 (17). Mezi genotypem a fenotypem může dojít k výrazné diskrepanci, jak jsme prokázali u 66leté pacientky s arteriální hypertenzí, která v rámci antihypertenzní terapie dostávala metoprolol v dávce 200 mg/den a v další terapii byl též propafenon v dávce 600 mg/den. Podle genotypizace byla pacientka heterozygot s jednou defektní alelou 2D6*4 – intermediální metabolizátor. Při fenotypizaci metabolický poměr 104,3 zařadil pacientku mezi pomalé metabolizátory, po vysazení propafenonu se snížila hodnota MR na 1,4, což pacientku zařadilo mezi extenzivní metabolizátory. Zařazení pacientky mezi pomalé metabolizátory bylo způsobeno inhibičním účinkem propafenonu na CYP2D6. Tento výsledek ukazuje, že pro stanovení aktuální aktivity jednotlivých cytochromů pro individualizované dávkování léčiv je důležitější fenotypizace než genotypizace, která má význam spíše pro kvalitativní než kvantitativní použití (18).
Tab. 1. Léčiva metabolizovaná CYP2D6 (16) 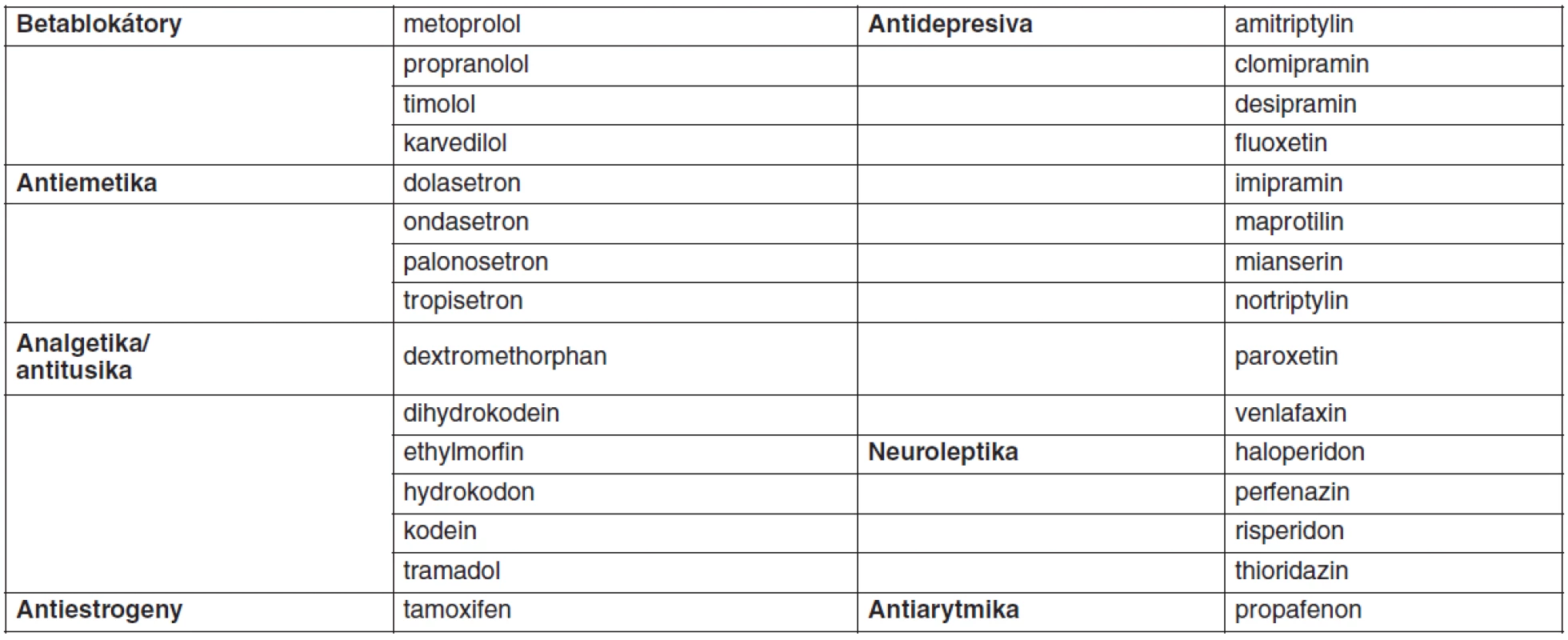
Tab. 2. Příklady specifických substrátů (modelových látek) na stanovení metabolického poměru (MR) (16) 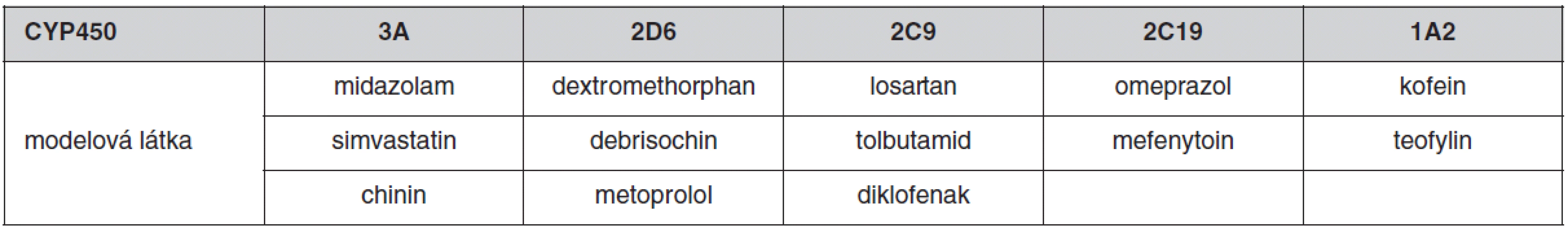
Závěrem tedy lze říci, že pro personalizovanou medicínu v oblasti individualizace dávkování léčiv je terapeutické monitorování hladin léčiv nezastupitelnou metodou, která je již používána dlouhodobě několik desítek let, ale v České republice mezi kliniky není dostatečně doceňována. Doplnění o fenotypizaci a eventuální genotypizaci může posunout TDM ještě o kvalitu výše.
Zkratky
ATDM – advanced therapeutic drug monitoring
CYP – cytochrom P450
DCM – drug concentration measurement
GCP – good clinical practice
GLP – good laboratory practice
HPLC – vysokoúčinná kapalinová chromatografie
MEIA – mikročásticová enzymová imunoanalýza
MR – metabolický poměr
PCR – polymerázová řetězová reakce
RIA – radioimunoanalýza
TDM – terapeutické monitorování hladin léčiv
UGT – uridin 5’-difosfát glukuronosyltransferáza
Adresa pro korespondenci:
doc. MUDr. Milan Grundmann, CSc.
Ústav klinické farmakologie LF OU a FNO
17. listopadu 1790, 708 00 Ostrava
fax: +420 597 374 393, e-mail: milan.grundmann@fno.cz
Zdroje
1. Grundmann M. 30 let klinické farmakologie ve zdravotnických zařízeních České republiky. Klin Farmakol Farm 2008; 22(4): 127–129.
2. Grundmann M. Problémy s podáváním léků ve stáří – I. Farmakokinetika ve stáří. Interní Med 2001; 1 : 30–32.
3. Grundmann M. Problémy s podáváním léků ve stáří – II. Nežádoucí účinky léků. Interní Med 2001; 2 : 82–83.
4. Grundmann M. Problémy s podáváním léků ve stáří – III. Compliance. Interní Med 2001; 3 : 136–137.
5. Květina J, Grundmann M. Farmakologické interakce. Klin Farmakol Farm 2003; 17(1): 17–21.
6. The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure. New Engl J Med 1997; 336 : 525–533.
7. Rathore SS, Curtis JP, Wang Y, et al. Association of serum digoxin concentration and outcomes in patients with heart failure. JAMA 2003; 289 : 871–878.
8. Špinar J, Hradec J, Meluzín J, Špác J, Špinarová L, Vítovec J, Lupínek P, Málek I. Doporučení pro diagnostiku a léčbu chronického srdečního selhání ČKS 2006. Cor Vasa 2007; 49(1):
9. Grundmann M, Peřinová I, Brozmanová H, Kořístková B, Šafarčík K. Significant discrepancy in cyclosporin A post-dose concentrations when analyzed with specific RIA and HPLC method. Int J Clin Pharmacol Ther 2010; 48 : 87–92.
10. Brozmanová H, Grundmann M, Šafarčík K, Jegorov A. High-performance liquid chromatographic method for therapeutic drug monitoring of cyclosporine a and its two metabolites in renal transplant patients. J Chromatography B 2000; 749 : 93–100.
11. Brozmanová H, Peřinová I, Halvová P, Grundmann M. Liquid chromatography-tandem mass spectrometry method for simultaneous determination of cyclosporine A and its three primary metabolites AM1, AM9 and AM4N in whole blood and isolated lymphocytes in renal transplant patients. J Sep Sci. 2010; 33(15): 2287–2293.
12. Kacířová I, Grundmann M. Antiepileptika a těhotenství. Neurol pro praxi 2008; 9(3): 182–188.
13. Kacířová I, Grundmann M. Antiepileptika a kojení. Neurol pro praxi 2008; 9(4): 252–257.
14. Kacířová I, Grundmann M, Kořístková B, Brozmanová H. Development of a treatment of pregnant women suffering from epilepsy in the region of Ostrava between the years 1991 and 2006. Čes slov Farm 2010; 59(4): 172–178.
15. Kacirova I, Grundmann M, Brozmanova H. Serum levels of lamotrigine during delivery in mothers and their infants. Epilepsy Res 2010, doi:10.1016/j.eplepsyres. 2010.07.007.
16. Ďuricová J, Grundmann M. CYP2D6 a jeho klinický význam. Klin Farmakol Farm 2007; 21(3-4): 133–135.
17. Peřinová I, Ďuricová J, Brozmanová H, Kacířová I, Grundmann M. Stanovení metoprololu a jeho metabolitu – hydroxymetoprololu v séru metodou HPLC s fluorescenční detekcí. Čes slov Farm 2008; 57(6): 254–259.
18. Grundmann M, Duricova J, Perinova I, Kacirova I, Jeziskova I, Jurckova N. Influence of propafenone on enzymatic activity of P450 2D6 in a patient on long term therapy with metoprolol. Basic Clin Pharmacol Toxicol 2009; 105(Suppl 1): 69.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- XXI. kongres České lékařské společnosti Jana Evangelisty Purkyně ve spolupráci s odbornými společnostmi ČLS JEP na téma PERSONALIZOVANÁ MEDICÍNA
- Personalizovaná medicína – realita, mýtus, fikce?
- Role patologie v prediktivní onkologii solidních nádorů
- Problematika personalizované medicíny v hematoonkologii – pohled patologa
- Kniha
- Dědičné trombofilie – doporučení k provádění genetických testů v klinické praxi
- Farmakogenetické aspekty současné medikamentózní léčby
- Farmakogenetika v léčbě kardiovaskulárních chorob aneb léčba podle guidelines či podle potřeb nemocného?
- Význam TDM, fenotypizace a genotypizace pro správné dávkování léčiv
- Genetické databáze a DNA banky
-
XXII. kongres ČLS JEP s mezinárodní účastí
Zobrazovací metody v medicíně - Motolský den zobrazovací diagnostiky onemocnění dětského věku
- Paliativní péče – tipy a triky pro klinickou praxi
- Závěry konference „Výživa a zdraví 2010“
- 24. Pečenkovy epidemiologické dny
- Oceněné Vědecké práce za rok 2009
- Spolek lékařů českých
- PLÁNOVANÉ AKCE ODBORNÝCH SLOŽEK čLS JEP
- Kniha
- Profesor MUDr. Jiří Homolka, DrSc. šedesátiletý
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Význam TDM, fenotypizace a genotypizace pro správné dávkování léčiv
- Profesor MUDr. Jiří Homolka, DrSc. šedesátiletý
- Dědičné trombofilie – doporučení k provádění genetických testů v klinické praxi
- Farmakogenetické aspekty současné medikamentózní léčby
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



