-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vztah sekrece a působení inzulínu – studium genetické determinace
Relation between insulin secretion and action – study of genetic determination
Background.
The disposition index represents insulin secretion related to the degree of insulin sensitivity, being constant for given degree of glucose tolerance. The aim of this study is to discern genetic determinants influencing the value of disposition index, e.g. predisposition to glucose intolerance.Methods and Results.
Two hundred and four non-diabetic subjects with varied glucose tolerance were divided into groups according to the values of disposition index. Glucose and lipid metabolism, anthropometric parameters and family history of type 2 diabetes mellitus (DM2) were examined. The genotype frequency of candidate genes was compared between the groups of individuals within the lowest (Q1) and the highest (Q4) quartiles of the disposition index values. Those groups were not different concerning age and female to male ratio. Fasting and stimulated parameters of glucose metabolism and lipid profile were worse in group Q1 compared to group Q4. Group Q1 is characterized with higher number of individuals with metabolic syndrome and family history of DM2. The examination of candidate genes revealed the differences in genotype frequency of B2AR (rs1042714), PPARA (rs1800206), KCNJ11 (rs5219), and SLC30A8 (rs13266634) between groups Q1 and Q4.Conclusions.
Low value of disposition index is related to the deterioration of glucose tolerance and other signs of metabolic syndrome. It is associated with genes affecting insulin secretion and genes related to energy metabolism and obesity.Key words:
type 2 diabetes mellitus, disposition index, insulin sensitivity, insulin secretion, type 2 diabetes candidate genes.
Autoři: Markéta Vaňková; Petra Lukášová; Olga Bradnová; Josef Včelák; Kateřina Dvořáková; Běla Bendlová
Působiště autorů: Endokrinologický ústav Praha
Vyšlo v časopise: Čas. Lék. čes. 2010; 149: 526-532
Kategorie: Původní práce
Souhrn
Východisko.
Dispoziční index vyjadřuje sekreci inzulínu vztaženou na stupeň inzulínové senzitivity a je pro daný stupeň glukózové tolerance konstantní. Cílem studie bylo odhalit genetické determinanty ovlivňující hodnotu dispozičního indexu, tedy predispozici ke glukózové intoleranci.Metody a výsledky.
Celkem 204 nediabetických jedinců s různou glukózovou tolerancí bylo rozděleno do skupin podle hodnot dispozičního indexu. Byly sledovány parametry glukózového a lipidového metabolismu, antropometrické parametry a údaje o rodinné anamnéze diabetu 2. typu. Mezi skupinami byly porovnány frekvence genotypů kandidátních genů. Skupiny jedinců v nejnižším (Q1) a nejvyšším (Q4) kvartilu hodnot dispozičního indexu se mezi sebou nelišily ve věku ani v poměru muži/ženy. Ve skupině Q1 byly zjištěny zhoršující se lačné i stimulované parametry glukózového metabolismu a lipidového profilu ve srovnání se skupinou Q4. Skupina Q1 je charakteristická vyšším počtem jedinců s metabolickým syndromem a lidí s rodinnou anamnézou diabetu. Rozdíly ve frekvencích genotypů kandidátních genů mezi skupinami Q1 a Q4 byly nalezeny u genů B2AR (rs1042714), PPARA (rs1800206), KCNJ11 (rs5219) a SLC30A8 (rs13266634).Závěry.
Nízká hodnota dispozičního indexu je spojená se zhoršenou glukózovou tolerancí i dalšími projevy metabolického syndromu. Je asociována s geny ovlivňujícími sekreci inzulínu a geny souvisejícími s obezitou a energetickým metabolismem.Klíčová slova:
diabetes mellitus 2. typu, dispoziční index, inzulínová senzitivita, sekrece inzulínu, kandidátní geny pro diabetes 2. typu.ÚVOD
Udržení hladiny glykémie v přísném koncentračním rozmezí je předpokladem metabolické homeostázy. Glukózová tolerance je dána vztahem mezi sekrecí inzulínu pankreatickými beta buňkami a inzulínovou senzitivitou cílových tkání. Jakmile dojde k nerovnováze mezi sekrecí a účinkem inzulínu a jedinec již není schopen kompenzovat sníženou senzitivitu tkání zvýšením sekrece inzulínu či naopak snížení sekrece zvýšením senzitivity, dochází ke zhoršování glukózové tolerance, které může vést až ke vzniku diabetes mellitus 2. typu (DM2). Stále není jasné, zda v patogenezi DM2 je primární příčinou inzulínová rezistence, nebo zhoršená funkce beta buněk. Pro dysfunkci beta buněk svědčí výsledky recentních celogenomových asociačních studií, kdy DM2 asocioval především s geny s potvrzeným či předpokládaným vlivem na funkci beta buněk (1). Nicméně geny ovlivňující inzulínovou senzitivitu, zejména ve vzájemné interakci a v interakci s vnějšími faktory (dietetické vlivy, fyzická aktivita, stres aj.) hrají jistě také důležitou roli (2, 3).
Ve většině studií jsou parametry inzulínové senzitivity a sekrece inzulínu hodnoceny empirickými metodami, nebo jsou založeny na matematickém modelování kinetiky glukózového metabolismu během funkčních testů. Jednoduchý a v diagnostice často využívaný je orální glukózový toleranční test (OGTT). Z hodnot glykémie a inzulínu po stimulaci glukózou lze spočítat indexy popisující inzulínovou senzitivitu, resp. rezistenci. Funkci beta buněk pankreatu lze z OGTT vyjádřit pomocí inzulinogenního indexu. Tento index detekuje abnormality v sekreci inzulínu (4), i když nevypovídá o mechanismech sekrece, např. o pulzní sekreci inzulínu. Inzulinogenní index silně koreluje s indexem odvozeným z intravenózního glukózového testu (5).
Vztah mezi inzulínovou senzitivitou a sekrecí není lineární, nejlépe ho vystihuje hyperbolická funkce (obr. 1). Pro daný stupeň glukózové tolerance platí, že násobek inzulínové senzitivity a sekrece je konstantní, tzn., že změna inzulínové senzitivity se projeví ve změně sekrece a naopak. Tento násobek se nazývá dispoziční index a jeho nelineární podstata byla popsána a publikována Kahnem et al. (6). Hodnota dispozičního indexu jedince je ovlivněna jak genetickými, tak vnějšími faktory. Výsledkem jejich interakcí může být změna hodnoty dispozičního indexu v průběhu života. Nižší hodnoty dispozičního indexu vypovídají o zhoršené glukózové toleranci a riziku DM2.
Obr. 1. Hyperbolický vztah mezi inzulínovou sekrecí a inzulínovou senzitivitou, označovaný jako dispoziční index DM2 – diabetes mellitus 2. typu, IGT – porušená glukózová tolerance, NGT – normální glukózová tolerance 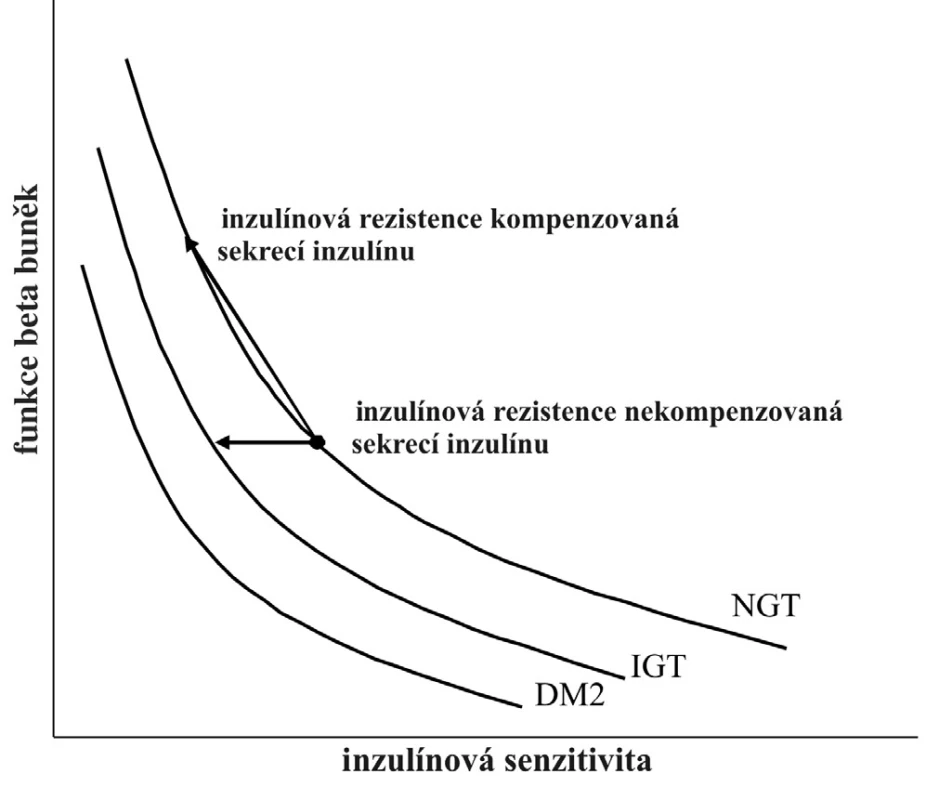
Cílem naší studie bylo odhalit genetické determinanty ovlivňující hodnoty dispozičního indexu, tedy predispozici jedince ke glukózové intoleranci.
SOUBOR NEMOCNÝCH A POUŽITÉ METODY
Do studie bylo zařazeno 204 nediabetických jedinců starších 30 let s různým stupněm glukózové tolerance, kteří se v letech 1999–2010 účastnili výzkumu genetického pozadí diabetu 2. typu v Endokrinologickém ústavu v Praze. Všichni účastníci studie byli podrobně seznámeni s protokolem vyšetření a podepsali informovaný souhlas schválený etickou komisí.
Medián věku byl 41,6 let (39,3–43,6) a BMI 25,4 kg/m2 (24,5–26,4). Rodinná anamnéza diabetu 2. typu byla zjišťována v dotazníku. Podle přítomnosti diabetu 2. typu v anamnéze rodičů byli jedinci rozděleni na potomky diabetiků, kde alespoň jeden z rodičů měl diagnostikovaný DM2 a na kontroly, jejichž oba rodiče byli zdrávi.
Antropometrické parametry byly měřeny za standardních vyšetřovacích podmínek. Měřena byla výška, váha, obvody pasu, boků a břicha (přes pupek) a ze zjištěných hodnot byl vypočítán index tělesné hmotnosti (BMI) a poměr pasu a boků (WHR). Množství podkožního tuku a celkové tělesné svaloviny bylo stanoveno podle Matiegkových rovnic (7).
U všech jedinců byly zjišťovány bazální parametry glukózového a lipidového metabolismu (glykémie, inzulín, triglyceridy, celkový cholesterol, HDL - a LDL-cholesterol, volné mastné kyseliny – postupy stanovení viz www.endo.cz, detailní popis metod k dispozici u autorů), dále byl proveden tříhodinový orální glukózový toleranční test s odběry krve v 30minutových intervalech. Ze stimulovaných hodnot glykémie a inzulínu byly vypočítány indexy funkce beta buněk (IGI), inzulínové senzitivity (ISIcomp) a plocha pod křivkou (AUC) glykémie.
Použitou empirickou metodou, vypočítávající inzulínovou senzitivitu z OGTT, byl index ISIcomp (8):
kde G0 (mmol/l) a I (mIU/l) jsou bazální hladiny glykémie a inzulínu a Gm a Im jsou průměry glykémie a inzulínu během OGTT. Vzorec je validován na protokol počítající s 0., 30., 60., 90. a 120. minutou testu. Index vypovídá o celotělové inzulínové senzitivitě, zahrnuje v sobě obojí, tj. jaterní inzulínovou senzitivitu i inzulínovou senzitivitu periferních tkání.
Funkce beta buněk pankreatu byla hodnocena pomocí inzulinogenního indexu (IGI). Je to poměr vzestupu inzulínu ke vzestupu glukózy po 30 minutách po podání glukózy:
kde I0 (mIU/l) a G (mmol/l) jsou bazální hodnoty inzulínu a glykémie a I30 a G30 jsou hodnoty inzulínu a glykémie ve 30. minutě OGTT.
Dispoziční index (DI) byl vypočítán jako součin inzulínové senzitivity a funkce beta buněk, tedy v našem případě jako ISIcomp*IGI. Na základě hodnoty DI byli jedinci rozděleni do čtyř kvartilů (Q1, Q2, Q3 a Q4). Vzájemně byly porovnávány extrémní kvartily, tj. Q1 odpovídající 25 % nejnižších hodnot a Q4 odpovídající 25 % nejvyšších hodnot indexu.
Přítomnost metabolického syndromu byla zjišťována podle definice NCEP ATP III (2001) (9). Metabolický syndrom je detekován při přítomnosti 3 a více z 5 následujících znaků: obvod pasu ≥ 94 cm u mužů a 80 cm u žen, hladina triglyceridů ≥ 1,7 mmol/l nebo léčba hypolipidemiky, hladina HDL‑cholesterolu < 1 mmol/l u mužů a < 1,3 mmol/l u žen nebo léčba hypolipidemiky, krevní tlak ≥ 130/85 mm Hg nebo léčba anti-hypertenzivy a hladina glukózy na lačno ≥ 5,6 mmol/l nebo léčba diabetu. Samostatně byla hodnocena vyšší lačná glykémie (IFG impaired fasting glucose), tj. glykémie ≥ 5,6 mmol/l a porušená glukózová tolerance (IGT impaired glucose tolerance), tj. glykémie ve 120. minutě OGTT 7,8 – 11 mmol/l.
Genetická část studie zahrnovala stanovení vybraných polymorfismů 19 kandidátních genů pro diabetes 2. typu. Stanovené polymorfismy uvádí tabulka 1. Z leukocytů periferní krve byla kitem QIAamp DNA Blood (Qiagene) vyizolována DNA, která byla amplifikována pomocí PCR (Biometra) a následně podrobena molekulárně genetické analýze. Ke genotypizaci bylo využito metod RFLP, SSCP (ALFexpres II, Amersham Pharmacia Biotech) nebo komerční TaqMan genotyping assays (Real-Time PCR LC-480 Roche, Applied Biosystems). Detailní popis jednotlivých metod je přehledně uveden např. v námi publikovaných kapitolách (10, 11).
Tab. 1. Polymorfismy studovaných kandidátních genů a metody jejich detekce U metod PCR-RFLP jsou v závorkách uvedeny použité restrikční endonukleázy. Gen 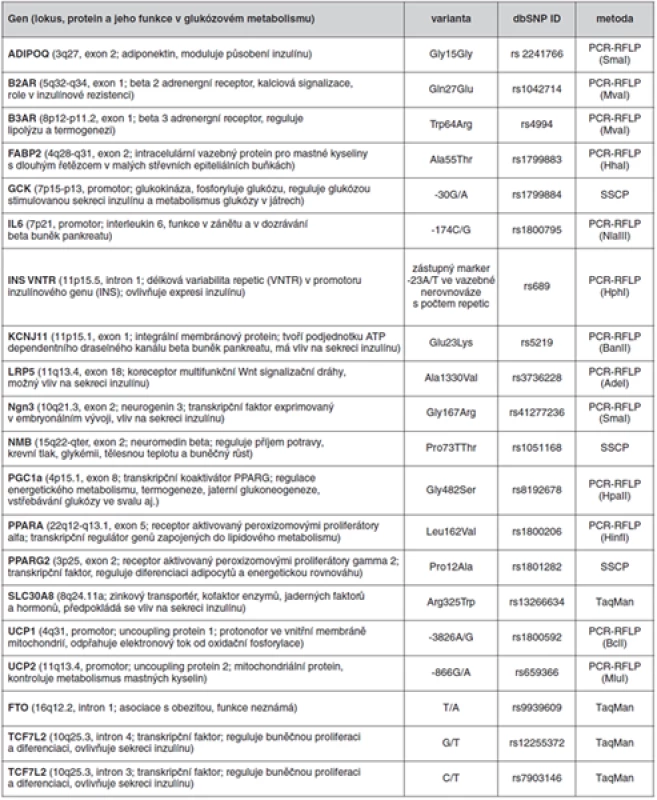
U metod PCR-RFLP jsou v závorkách uvedeny použité restrikční endonukleázy. Studované kandidátní geny lze rozdělit do následujících skupin:
- MODY (Maturity Onset Diabetes of the Young) geny a transkripční faktory (GCK, Ngn3, TCF7L2),
- inzulínová sekrece a senzitivita (IL6, INS VNTR, KCNJ11, LRP5, SLC30A8),
- lipidový metabolismus (FABP2, PPARA),
- energetický metabolismus (ADIPOQ, B2AR, B3AR, FTO, NMB, PPARG2, PGC1a, UCP1, UCP2).
Statistická analýza
Výsledky jsou uváděny jako mediány s LCL (low confidental limit) a UCL (upper confidental limit). Získaná data nemají normální rozdělení, proto byl pro porovnání mezi skupinami zvolen neparametrický Mann-Whitneyův test (NCSS 2004, Utah, USA). Četnosti výskytu různých genotypových konfigurací pro jednotlivé polymorfismy byly porovnávány mezi skupinami Fisherovým exaktním testem.
VÝSLEDKY
Ve sledovaném souboru bylo celkem 97 potomků diabetiků (63 žen a 34 mužů), medián jejich věku byl 41 let (38,9–45,1) a BMI 25,6 kg/m2 (24,6–26,1). Kontrolní soubor tvořilo 107 osob (68 žen a 39 mužů) s mediánem věku 41,7 let (37,9–44,3) a BMI 24,9 kg/m2 (23,7–26,4). Tyto skupiny se mezi sebou nelišily ve věku, BMI ani v zastoupení mužů a žen.
Biochemické a antropometrické parametry byly porovnávány mezi skupinami s nejnižším (kvartil Q1) a nejvyšším (kvartil Q4) dispozičním indexem (obr. 2, tab. 2).
Obr. 2. Dispoziční indexy (DI) osob v kvartilech Q1 a Q4 Číselně jsou na osách ISIcomp a IGI vyznačeny hranice kvartilů (Q) těchto indexů inzulínové senzitivity a funkce beta buněk. 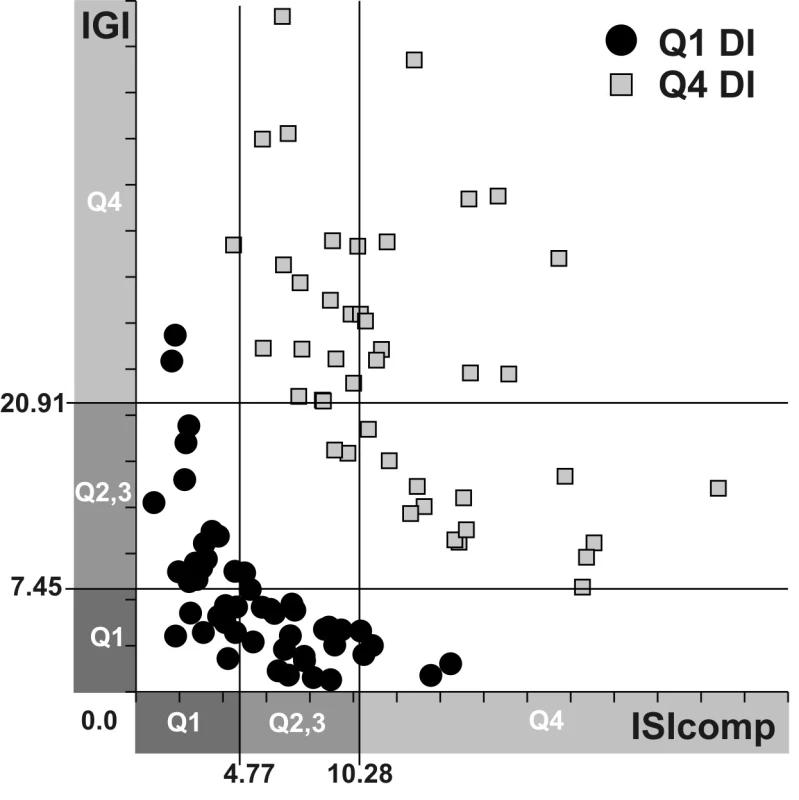
Tab. 2. Antropometrické a biochemické charakteristiky jedinců ve skupinách odpovídajících spodnímu (Q1) a hornímu (Q4) kvartilu dispozičního indexu 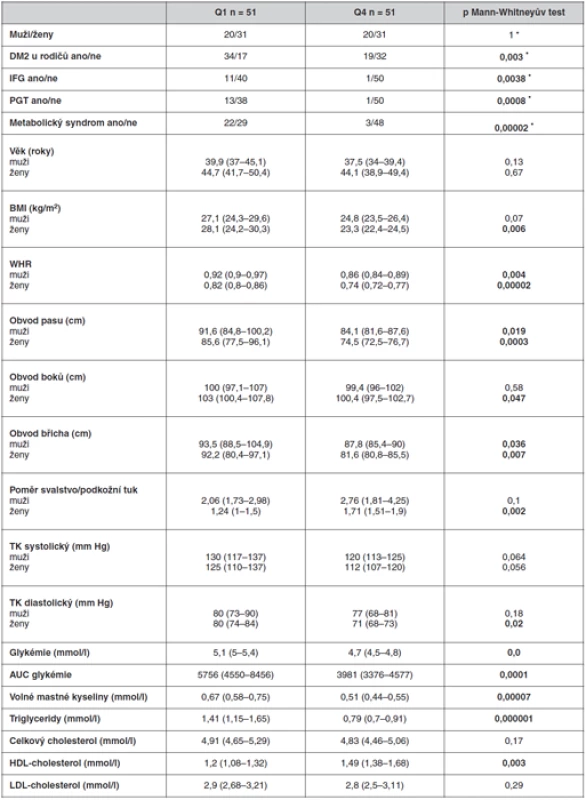
* χ2 test, resp. Fisher exact test Skupiny osob v kvartilech Q1 a Q4 se nelišily ve věku ani v zastoupení mužů a žen, ale jedinci v kvartilu Q1, tj. s nejnižšími hodnotami dispozičního indexu měli vyšší hodnoty BMI. Výrazněji se rozdíly v antropometrických parametrech projevily u žen. S nadváhou, případně obezitou v kvartilu Q1, souvisí i vyšší hladiny triglyceridů, volných mastných kyselin a nižší hladiny HDL-cholesterolu. Jedinci s nízkými hodnotami dispozičního indexu měli signifikantně vyšší hladiny lačné i stimulované glykémie oproti lidem s vyššími hodnotami dispozičního indexu a bylo mezi nimi více lidí s porušenou glukózovou tolerancí (IFG i IGT) a přítomností metabolického syndromu. V kvartilu Q1 se také nachází signifikantně více jedinců s diabetickými rodiči než v kvartilu Q4.
Signifikantní rozdíly ve frekvencích genotypů kandidátních genů pro DM2 mezi skupinami v kvartilech Q1 a Q4 jsou uvedeny v tabulce 3. Jedná se geny související s energetickým metabolismem (B2AR), lipidovým metabolismem (PPARA) a se sekrecí inzulínu (KCNJ11 a SLC30A8).
Tab. 3. Statisticky významné rozdíly ve frekvencích genotypů kandidátních genů mezi jedinci ve spodním (Q1) a horním (Q4) kvartilu dispozičního indexu 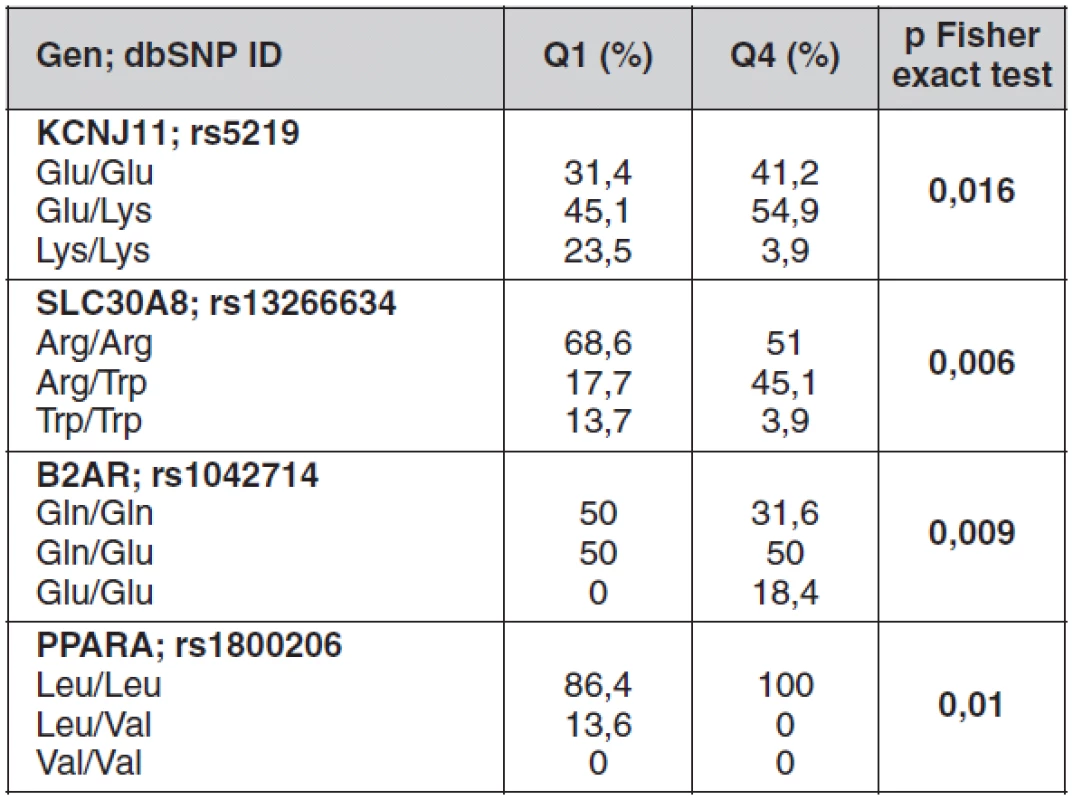
4. energetický metabolismus (ADIPOQ, B2AR, B3AR, FTO, NMB, PPARG2, PGC1a, UCP1, UCP2). DISKUZE
V celosvětovém měřítku narůstá počet lidí s DM2 a obezitou. Tato onemocnění představují významný medicínský problém, zejména proto, že jsou doprovázena závažnými zdravotními komplikacemi. Léčba diabetu či obezity je dlouhodobá a finančně nákladná. Alarmující je fakt, že kromě zvyšující se prevalence DM2 se významně zvyšuje i prevalence prediabetu, tj. počtu lidí s dysglykémií. Dysglykémie zahrnuje samostatnou lačnou hyperglykémii, postprandiální hyperglykémii, nebo kombinaci obou poruch. Postprandiální hyperglykémie, tj. porušená glukózová tolerance, souvisí především se snížením sekrece inzulínu po jídle (stimulace glukózou) a/nebo s inzulínovou rezistencí periferních tkání. Lačná hyperglykémie vypovídá více o poruše citlivosti zejména jaterních buněk na působení inzulínu.
Specifické funkční testy, na rozdíl od parametrů získaných z bazálních hodnot jako je HOMA nebo QUICKI, vypovídají o dynamice vztahu inzulínové senzitivity a sekrece. Zlatým standardem pro měření inzulínové senzitivity je euglykemický hyperinzulinemický clamp. Clamp však neposkytuje údaje o sekreci inzulínu a tak je nutné využít další testy, např. intravenózní glukózový toleranční test (IVGTT) nebo argininový stimulační test. Funkční testy, které poskytují údaje o inzulínové senzitivitě i sekreci jsou intravenózní glukózový test nebo orální glukózový toleranční test (12). V klinické praxi i v epidemiologických studiích se nejvíce používá OGTT, kdy je pacientovi podáno 75 g glukózy nalačno a v půlhodinových intervalech se po dobu 2–3 hodin měří hladiny glukózy a inzulínu, případně C-peptidu v krvi. Vztah inzulínové senzitivity a sekrece inzulínu popsaný dispozičním indexem je pro konkrétní stupeň glukózové tolerance konstantní veličina. Vypovídá o schopnosti organismu kompenzovat zhoršení sekrece inzulínu vyšší senzitivitou a naopak zvýšením sekrece vyrovnat nízkou senzitivitu tkání. Ztráta této kompenzační schopnosti vede ke snížení hodnoty dispozičního indexu.
Hodnota dispozičního indexu závisí na použitých indexech inzulínové sekrece a senzitivity. Je doporučováno počítat s indexy, které jsou na sobě co možno nezávislé, tzn. odvozené z různých funkčních testů. Prakticky se však běžně používají i indexy odvozené z jednoho testu, normy dispozičního indexu je třeba stanovit na základě kontrolní skupiny (13).
V této studii jsme na souboru nediabetických jedinců ukázali, že snižující se hodnota dispozičního indexu souvisí s vyšší hmotností, zhoršujícím se lipidovým profilem a vyšší lačnou i stimulovanou glykémií. Přestože se střední hodnoty sledovaných parametrů pohybovaly víceméně v normě, je jasné, že jedinci s nižšími hodnotami indexu jsou ve větším riziku rozvoje metabolického syndromu a DM2, na což poukazuje i zcela recentní přehledový článek (14).
Důležitým zjištěním v této studii je fakt, že nižší hodnoty dispozičního indexu, které jsou odrazem zhoršující se inzulínové senzitivity a funkce beta buněk, jsou charakteristické pro jedince s pozitivní rodinnou anamnézou DM2. Rodinné studie i studie dvojčat prokázaly heritabilitu jak indexu sekrece inzulínu (rozmezí stanovené heritability v různých studiích: 0,50–0,78), tak v menší míře i indexu inzulínové senzitivity (0,08–0,59) (15). V souladu s výsledky celogenomových studií zaměřených na DM2 jsme prokázali asociaci zhoršené glukózové tolerance (nízké hodnoty dispozičního indexu) s geny souvisejícími se sekrecí inzulínu, v našem případě KCNJ11 a SLC30A8.
Produkt genu KCNJ11 (Kir6.2 – potassium inward rectifier) je podjednotkou ATP dependentního draselného kanálu pankreatických beta buněk. Kanál je proteinovým komplexem složeným ze dvou podjednotek, podjednotky formující vlastní pór kanálu (Kir 6.2) a regulační podjednotky, která je sulfonylureovým receptorem (SUR 1). Je to kandidátní gen pro DM2 (16, 17). Polymorfismus Glu23Lys (rs5219) zvyšuje prahovou koncentraci ATP potřebnou pro zahájení sekrece inzulínu, a hraje tak významnou roli v glukózovém metabolismu. V rozsáhlých celogenomových analýzách (18) byla u tohoto polymorfismu potvrzena asociace s DM2.
Protein SLC30A8 je členem rodiny zinkových transportérů. Zinek je důležitý pro syntézu, skladování i sekreci inzulínu. Varianty v genu SLC30A8 mohou ovlivňovat akumulaci zinku v inzulínových granulích, a ovlivňovat tak stabilitu inzulínu a jeho uvolňování. Nezávisle na sobě potvrdilo několik studií silnou asociaci polymorfismu Arg325Trp (rs13266634) s DM2 (18–20).
Další signifikantní asociaci s nízkou hodnotou dispozičního indexu jsme nalezli u genů působících v energetickém a lipidovém metabolismu – B2AR a PPARA.
Beta-2 adrenergní receptor (B2AR) je hlavní lipolytický receptor v lidských tukových buňkách. Gen pro B2AR je proto kandidátním genem pro obezitu. Kromě tukové tkáně je exprimován také v kosterních svalech a pankreatických beta-buňkách. Může tak ovlivňovat i citlivost tkání k inzulínu a inzulínovou sekreci. Polymorfismus Gln27Glu (rs1042714) je asociován s obezitou (21), metabolickým syndromem (22) a různými dyslipidémiemi (23, 24). Nicméně závěry studií nejsou vždy jednoznačné, např. dánská studie u téměř 8000 lidí neukázala jednoznačnou asociaci polymorfismu Gln27Glu s obezitou, hypertenzí ani s diabetem (25).
Receptor aktivovaný peroxizomovými proliferátory alfa (PPARA) je exprimován zejména v játrech, ledvinách, srdci a příčně pruhovaném svalstvu. Experimentální studie prokázaly, že PPARA působí jako transkripční regulátor genů zapojených do lipidového metabolismu. Dříve publikované klinické studie poukázaly na vztah polymorfismu Leu162Val (rs1800206) k inzulínové senzitivitě (26) a lipidovému metabolismu (27). Asociační studie s diabetem 2. typu však nejsou jednoznačné. Zatímco Andrulionyte et al. (28) potvrdil asociaci plymorfismu Leu162Val s diabetem, Silbernagel et al. (29) neprokázal asociaci s diabetem ani s obezitou.
Asociace kandidátních genů pro diabetes, souvisejících se sekrecí inzulínu, se zdají být konzistentnější napříč publikovanými studiemi, u genů pro inzulínovou senzitivitu a dalších genů tato jednota neplatí. V naší práci jsme potvrdili zhoršující se glukózovou toleranci se dvěma geny, které mají vliv na sekreci inzulínu (KCNJ11, SLC30A8). U dalšího kandidátního genu TCF7L2 jsme zaznamenali tendenci k vyššímu zastoupení rizikových genotypů ve skupině s nižším dispozičním indexem, i když rozdíly nebyly statisticky významné (data nejsou uvedena). Stejně tak byla zřejmá, ale statisticky nevýznamná tendence k vyššímu zastoupení rizikových genotypů polymorfismů v genu FTO ve skupině s nízkým dispozičním indexem (data nejsou uvedena), což souvisí s vyššími hodnotami BMI a obvodovými rozměry v této skupině. Zbylé dva geny, u kterých jsme potvrdili asociaci s nižším dispozičním indexem, jsou geny zúčastněné v energetickém a lipidovém metabolismu (B2AR, PPARA).
Genetická náchylnost ke komplexnímu onemocnění, jakým je diabetes 2. typu, nebo glukózová intolerance obecně, je mozaikou složenou z genů zúčastněných v mnoha vývojových a metabolických drahách, je kombinací genů kandidátních nejen pro diabetes, ale i pro další metabolická onemocnění, např. pro obezitu. Naše studie potvrzuje nejen genetickou determinaci a heritabilitu sekrece inzulínu, ale ukazuje, že dispoziční index je ovlivněn i geny spojenými s energetickým a lipidovým metabolismem.
Zkratky
AUC – plocha pod křivkou glykémie
BMI – poměr tělesné hmotnosti vg a výšky v2
DI – dispoziční index
DM2 – diabetes mellitus 2. typu
HDL – vysokodenzitní lipoprotein
HOMA – Homeostatic Model Assessment
IFG – porušená lačná glykémie
IGI – inzulinogenní index
IGT – porušená glukózová tolerance
ISIcomp – index inzulínové senzitivity
IVGTT – intravenózní glukózový toleranční test
LDL – nízkodenzitní lipoprotein
MODY – Maturity Onset Diabetes of the Young
OGTT – orální glukózový toleranční test
PCR – polymerázová řetězová reakce
QUICKI – Quantitative Insulin Sensitivity Check Index
RFLP – polymorfismus délky restrikčních fragmentů
SSCP – polymorfismus jednovláknových řetězců
UCL – horní hranice konfidenčního intervalu
WHR – poměr obvodu pasu a obvodu boků
Podpořeno grantem IGA MZ ČR NS/10209-3/2009.
Všem lékařům a sestrám z oddělení funkční diagnostiky pod vedením prof. MUDr. K. Vondry, DrSc. děkujeme za technické zajištění funkčních testů. Děkujeme i všem dobrovolníkům za účast ve studii.
Adresa pro korespondenci
RNDr. Markéta Vaňková, Ph.D.
Endokrinologický ústav
Národní třída 8, 116 94 Praha 1
fax: +420 224 905 325, e-mail: mvankova@endo.cz
Zdroje
1. Zeggini E, et al. Meta-analysis of genome-wide association data and large-scale replication identifies additional susceptibility loci bor type 2 diabetes. Nat Genet 2008; 40 : 638–645.
2. Bendlova B, et al. Study of the genetic causes of polygeneticallv determined endocrinopathies-patience can bring success. Čas Lék čes 2007; 146 : 198–204.
3. Rich SS, Bergman RN. The genetic basis of glucose homeostasis. Curr Diabetes Rev 2005; 1(3): 221–226.
4. Phillips DI, et al. Understanding oral glucose tolerance: comparision of glucose or insulin measurements during the oral glucose tolerance test šity specific measurements of insulin resistance and insulin secretion. Diabetic Medicine 1994; 11 : 286–292.
5. Tura A, et al. Insulinogenic indices from insulin and C-peptide: comparison of beta-cell function from OGTT and IVGTT. Diabetes Res Clin pract 2006; 72 : 298–301.
6. Kahn SE, et al. Quantification of the relationship between insulin sensitivity and beta-cell function in human subjects. Evidence for a hyperbolic function. Diabetes 1993; 42 : 1663–1672.
7. Bláha P. ANTROPO - ein Programm fur automatische Bearbeitung antropologischer Daten. Wiss. Zeitschrift der Humboldt-Universitat zu Berlin 1991; 5 : 153–156.
8. Matsuda M, et al. Insulin sensitivity indices obtained from oral glucose testing: comparison with the euglycemic insulin clamp. Diabetes Care 1999; 22 : 1462–1470.
9. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive summary of the third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001; 285 : 2486–2497.
10. Bendlová B, Mazura I. Místo molekulární genetiky v endokrinologii. In: Stárka L. Aktuální endokrinologie. Praha: Maxdorf 1999; 42–52.
11. Bendlová B., Včelák J. DNA diagnostika. In: Kreze et al. Všeobecná a klinická endokrinológia. Bratislava: Academic Electronic Press 2004; 92–100.
12. Roden M. Clinical Diabetes Research: Methods and Techniques. Chichester: John Wiley & Sons 2007.
13. Pacini G, et al. Methods for clinical assessment of insulin sensitivity and ß-cell function. Best Pract Res Clin Endocrinol Metab 2003; 17 : 305–322.
14. Aschner P. Metabolic syndrome as a risk factor for diabetes. Expert Rev Cardiovasc Ther 2010; 8(3):407–412.
15. Stumvoll M, Goldstein B, Van Haeften TW. Type 2 diabetes: principles of pathogenesis and therapy. Lancet 2005; 365 : 1333–1346.
16. Riedel MJ, et al. Current status of the E23K Kir6.2 polymorphism: implications for type-2 diabetes. Hum Genet 2005; 116 : 133–145
17. Villareal DT, et al. Kir6.2 variant E23K increases ATP-sensitive K+ channel activity and is associated with impaired insulin release and enhanced insulin sensitivity in adults with normal glucose tolerance. Diabetes 2009; 58(8): 1869–1878.
18. Zeggini E, et al. Replication of genome-wide association signals in UK samples reveals risk loci for type 2 diabetes. Science 2007; 316(5829): 1336–1341. Erratum in: Science 2007; 317(5841): 1035–1036.
19. Sladek R, et al. A genome-wide association study identifies novel risk loci for type 2 diabetes. Nature 2007; 445(7130): 881–885.
20. Scott LJ, et al. A genome-wide association study of type 2 diabetes in Finns detects multiple susceptibility variants. Science 2007; 316(5829): 1341–1345.
21. Large V, et al. Human beta-2 adrenoceptor gene polymorphisms are highly frequent in obesity and associate with altered adipocyte beta-2 adrenoceptor function. J Clin Invest 1997; 100 : 3005–3013.
22. Dallongeville J., et al. The gly16-arg16 and gln27-glu27 polymorphisms of beta-2-adrenergic receptor are associated with metabolic syndrome in men. J Clin Endocr Metab 2003; 88 : 4862–4866.
23. Iwamoto N, et al. Gln27Glu beta2-adrenergic receptor variant is associated with hypertriglyceridemia and the development of fatty liver. Clin Chim Acta 2001; 314(1–2): 85–91.
24. Carlsson M, et al. Common variants in the beta2-(Gln27Glu) and beta3-(Trp64Arg)—adrenoceptor genes are associated with elevated serum NEFA concentrations and type II diabetes. Diabetologia 2001; 44(5): 629–636.
25. Gjesing AP, et al. Studies of the associations between functional beta2-adrenergic receptor variants and obesity, hypertension and type 2 diabetes in 7,808 white subjects. Diabetologia 2007; 50(3): 563–568.
26. Bossé Y, et al. Twelve type 2 diabetes susceptibility loci identified through large-scale association analysis. Nat Genet 2010; 42(7): 579–589.
27. Tai ES, et al. Polyunsaturated fatty acids interact with the PPARA-L162V polymorphism to affect plasma triglyceride and apolipoprotein C-III concentrations in the Framingham Heart Study. J Nutr 2005; 135(3): 397–403.
28. Andrulionyte L, et al. Single nucleotide polymorphisms of the peroxisome proliferator-activated receptor-alpha gene (PPARA) influence the conversion from impaired glucose tolerance to type 2 diabetes: the STOP-NIDDM trial. Diabetes 2007; 56(4): 1181–1186.
29. Silbernagel G, et al. The L162V polymorphism of the peroxisome proliferator activated receptor alpha gene (PPARA) is not associated with type 2 diabetes, BMI or body fat composition. Exp Clin Endocrinol Diabetes. 2009; 117(3): 113–118.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Současný stav stravování a pohybové aktivity ve vztahu k obezitě u sedmiletých dětí – studie WHOČlánek Pokroky v urogynekologiiČlánek 4. hematologický denČlánek Spolek lékařů českýchČlánek KnihaČlánek Laureáti Nobelovy ceny
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Prof. MUDr. RNDr. Luboslav Stárka, DrSc. osmdesátníkem
- Farmakoterapie obezity – současné možnosti a perspektivy
- Promotorový polymorfismus (TTTTA)n genu CYP11A1 v patogenezi syndromu polycystických ovarií
- Vztah sekrece a působení inzulínu – studium genetické determinace
- Současný stav stravování a pohybové aktivity ve vztahu k obezitě u sedmiletých dětí – studie WHO
- Redukce abdominální obezity a kardiometabolických rizik u obézních adolescentů krátkodobým lázeňským redukčním programem
- Změny plazmatických hladin obestatinu a ghrelinu po podání rozpustné vlákniny s glukózou a samotné vlákniny zdravým ženám a pacientkám s bulimia nervosa
- Primární hyperparatyreóza jako příčina hyperkalcémie u pacientky s karcinomem prsu
- 12. konference SRNT Europe (Evropská společnost pro léčbu závislosti na tabáku, Society for Research on Nicotine and Tobacco)
- Pokroky v urogynekologii
- 4. hematologický den
- Roční zkušenosti se stanovením PAI-1
- XIX. konference endoskopické sekce ČGPS ČLS JEP
- Setkání pediatrů, alergologů, dermatologů, urologů a dětských balneologů
- Spolek lékařů českých
- PLÁNOVANÉ AKCE ODBORNÝCH SLOŽEK ČLS JEP
- Kniha
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Farmakoterapie obezity – současné možnosti a perspektivy
- Primární hyperparatyreóza jako příčina hyperkalcémie u pacientky s karcinomem prsu
- Prof. MUDr. RNDr. Luboslav Stárka, DrSc. osmdesátníkem
- Vztah sekrece a působení inzulínu – studium genetické determinace
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy





