-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Deficit rastového hormónu a jeho vplyv na kostnú minerálnu denzitu a riziko osteoporotických fraktúr
Growth hormone deficiency, its influence on bone mineral density and incidence of osteoporotic fractures
Growth hormone (GH) is the most abundant hormone from all pituitary hormones. Linear bone growth increases as a result of complex hormonal reactions, in particular as an effect of insulin-like growth factor I (IGF I). GH has a key role in longitudinal bone growth and in reaching peak bone mass (PBM) during childhood and adolescence. PBM is a important risk predictor of osteoporotic fractures. Despite closure of epiphyseal growth plates, effect of GH/IGF on bone turnover, bone mass, bone density and strength lasts by regulation of bone remodelation. Many authors have observed low BMD in hypopituitarismus, especially in growth hormone deficient (GHD) patients. Initially reduction of BMD has been described after 6–12 months of therapy with growth hormone. When therapy continued, BMD has normalized or was even higher in comparison with the beginning of the therapy. Reduction in BMD results from increased remodelation space after enhanced activation of bone turnover during GH therapy. Decrease in bone growth and PBM also influences incidence of fractures in elderly patients. It has been shown, that 18–24 months of GH therapy slightly increased BMD in a group of adult men with adult onset of GHD (AO-GHD), whereas in women it has not significantly changed. Three previous studies have proved increased fracture risk in patients with GHD. Not only high number of patients, but also an applicable control group, confirmation of potential risk factors such as BMI, smoking, sex, calcium intake and physical activity are needed to estimate the risk of fractures. Holmer et al. have analysed fracture incidence in GHD patients on replacement therapy compared to normal population. No increase of fracture risk in AO GHD women has been observed, but GHD was associated with higher fracture risk in women with childhood onset of GHD (CO GHD). Men have even lower incidence of fractures matched with control group. There are also sexual differences in effects of GH on bone. Women have in general higher levels of GH secretion, but the normal range for serum IGF-I is similar in men and women. In a placebo controlled double blind study, where men and women with GHD received the same dose of GH on m2/body, the increase of serum IGF-I levels was higher in men. Possible explanation for sexual differences in response to GH therapy is that sexual hormones affect GH secretion.
Key words:
growth hormone, IGF-I, bone density, peak bone mass, fractures.
Autori: Martin Kužma; Juraj Payer
Pôsobisko autorov: Univerzita Komenského v Bratislave, Lekárska fakulta, V. interná klinika FNsP, Slovenská republika
Vyšlo v časopise: Čas. Lék. čes. 2010; 149: 211-216
Kategória: Přehledový článek
Súhrn
Rastový hormón (RH) je najviac zastúpeným hormónom hypofýzy spomedzi všetkých hormónov. Lineárny rast kostí zvyšuje ako výsledok komplexných hormonálnych reakcií, zahrňujúcich najmä efekt inzulínu podobného rastového faktora I (IGF-I). Počas detstva a adolescencie RH hrá kľúčovú rolu v logitudinálnom raste kosti pri docielení maximálnej kostnej masy (PBM). PBM sa ukázala ako signifikantný prediktor rizika osteoporotických fraktúr. Aj napriek uzáveru rastovej epifyzeálnej štrbiny, pretrvávajú účinky RH/IGF na kostný obrat, kostnú masu, denzitu a silu reguláciou kostnej remodelácie. Viacero autorov pozorovalo u pacientov s hypopituarizmom a deficitom RH nízku kostnú minerálnu denzitu (BMD). Bola opísaná iniciálna redukcia BMD po 6–12 mesiacoch terapie, ale pokiaľ sa pokračovalo v terapii, BMD sa normalizovala alebo bola vyššia v porovnaní so začiatkom. Počiatočná redukcia BMD rezultuje zo zvýšenia remodelačného priestoru počas zvýraznenej aktivácie kostného obratu počas terapie RH. Znížený rast kosti a pokles maximálnej kostnej masy počas rastu takisto dôležito vplýva na výskyt fraktúr v starobe. Bolo dokázane, že terapia RH počas 18–24 mesiacov viedla k miernemu vzostupu BMD u dospelých mužov s RH deficitom stanoveným v dospelosti, zatiaľ čo u žien to k signifikantným zmenám BMD neviedlo. Tri predošlé štúdie dokázali zvýšené riziko fraktúr u pacientov s RH deficitom. Adekvátne stanovenie rizika fraktúr nevyžaduje len vysoký počet pacientov, ale tiež kontrolnú skupinu pacientov a prispôsobenie pre potencionálne ďalšie faktory, ako je body mass index (BMI), fajčenie, príjem kalcia v diéte a fyzická aktivita. V štúdii Holmera et al. bola analyzovaná incidencia fraktúr u pacientov s deficitom RH na substitučnej liečbe RH v porovnaní s kontrolou z bežnej populácie. Žiadne zvýšenie rizika zlomenín nebolo pozorované u žien s AO GHD (adult onset growth hormone deficiency), ale bola asociovaná so zvýšeným rizikom fraktúr u žien s deficitom vzniknutým v detstve. Muži mali dokonca nižšiu incidenciu fraktúr v porovnaní s kontrolnou skupinou. Existujú tiež pohlavné rozdiely v efekte RH na kosť. Ženy majú vo všeobecnosti vyššie hladiny sekrécie RH ako muži, ale normálne rozmedzie koncentrácie séroveho IGF-I je podobné u dospelých mužov i žien. V placebom kontrolovanej dvojito slepej štúdii, kde RH deficientní muži a ženy dostávali rovnakú dávku RH na m2 povrchu tela, bolo zvýšenie sérových koncentrácií IGF-I väčšie u mužov. Jedno z možných vysvetlení pre pohlavné rozdiely v odpovedi na terapiu RH je, že rôzne zákonitosti sexuálnych hormónov majú vplyv na efekt RH.
Klúčové slová:
rastový hormón, IGF-I, kostná denzita, maximálna kostná masa, fraktúry.Rastový hormón (RH) je najviac zastúpeným hormónom hypofýzy spomedzi všetkých hormónov. RH produkujúce bunky sa vyskytujú v adenohypofýze v 50% zastúpení (1). RH sekrécia sa markantne znižuje s vekom. V strednom veku je sekrécia RH 15 % sekrécie v puberte. RH indukuje proteosyntézu a znižuje glukózovú toleranciu, stimuluje lipolýzu, vedúcu k zvýšeným hladinám cirkulujúcich mastných kyselín, podporuje retenciu sodíka, draslíka a vody zvyšuje hladiny anorganických fosfátov v sére (2).
Stavy spojené s deficitom RH u dospelých
- I. Ochorenia hypofýzy – viac ako 90 %, zvyčajne spôsobených tumorom hypofýzy (benígne – najčastejšie adenóm), chirurgickým zákrokom,alebo rádioterapiou tumoru hypofýzy.
- II. Iné príčiny – zahŕňajú traumu, tuberkulózu, histiocytózu X, hemochromatózu, lymphocytovú hypofysitídu, a infiltratívne ochorenia,ako je sarkoidóza.
- III.
Idiopatické – zriedkavé (1).
Lineárny rast kostí zvyšuje RH ako výsledok komplexných hormonálnych reakcií, zahrňujúcich najmä efekt inzulínu podobného rastového faktora I (IGF-I), ktorý stimuluje diferenciáciu epifyzeálnych prechondrocytov. Tieto prekurzorové bunky produkujú IGF-I lokálne a tiež odpovedajú na rastový hormón.
Počas detstva a adolescencie RH hrá kľúčovú rolu v longitudinálnom raste kosti pri docielení maximálnej kostnej masy (PBM). PBM je všeobecne definovaná ako najvyššia úroveň kostnej masy po ukončení rastu. Neskôr počas života strata kostnej hmoty prevyšuje kostnú formáciu, preto postupne kostná masa významne klesá (obr. 1). PBM sa ukázala ako signifikantný prediktor rizika osteoporotických fraktúr. Epidemiologické štúdie predpokladajú význam genetických faktorov v 50–80 %, ako hlavný determinant kostnej sily a odolnosti k fraktúram. Na PBM má vplyv tiež strava, fyzická aktivita, hmotnosť (BMI), telesná výška a hormonálny status (vrátane RH sekrécie) (tab. 1) (3).
Obr. 1. Kostná masa a vek u mužov a žien 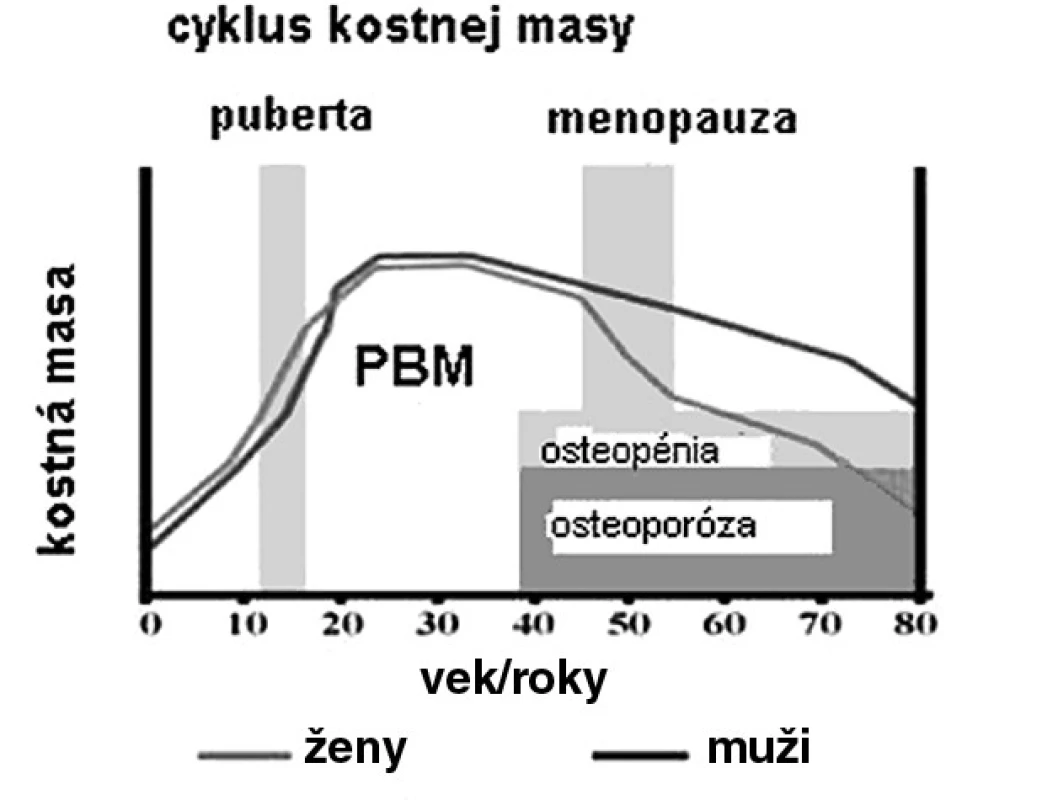
Tab. 1. Hlavné determinanty maximálnej kostnej masy (3) 
Početné hormóny a humorálne faktory (vrátane cytokínov) regulujú alebo modulujú rast kosti a remodeláciu. U kalciotropných hormónov, pohlavných steroidov, glukokortikoidov a tyroidálnych hormónov dobre poznáme účinky na kosť. Navyše, RH, či už priamo, alebo nepriamo cez generáciu IGF a IGF viažúcich proteínov, má takisto účinok na rastúci skelet ako aj vplyv na kostnú modeláciu účinkom na chondrocyty rastovej platničky a kostné bunky. Aj napriek uzáveru rastovej epifyzeálnej štrbiny, pretrvávajú účinky RH/IGF na kostný obrat a kostnú masu, denzitu a silu reguláciou kostnej remodelácie (4–6).
Viacero autorov pozorovalo u pacientov s hypopituarizmom a deficitom RH nízku kostnú minerálnu denzitu (BMD) (7, 8). BMD je takisto redukovaná u dospelých s idiopatickým deficitom RH stanoveným v detstve, v porovnaní so zdravými dospelými (8, 9). Stupeň poklesu denzity a ostatných metabolických efektov deficitu RH sa na základe meraní konvenčnej denzitometrie, zdá byť viac zvýraznený u deficitu RH stanoveného v detstve, na rozdiel od hypopituituarizmu stanoveného v dospelosti (10, 11).
Vo viacerých skorých štúdiach efektu RH na BMD pri deficite RH v dospelosti sa nepozoroval efekt na BMD (12–14). Iba v štúdiach dlhších ako 18–24 mesiacov bolo pozorované zvýšenie BMD. Vo viacerých štúdiach bola opísaná iniciálna redukcia BMD po 6–12 mesiacoch terapie, ale pokiaľ sa pokračovalo v terapii, BMD sa normalizovala alebo bola vyššia v porovnaní so začiatkom (obr. 2). Predpokladalo sa, že počiatočná redukcia BMD rezultuje zo zvýšenia remodelačného priestoru počas zvýraznenej aktivácie kostného obratu počas terapie RH. Neskorší vzostup BMD počas pokračujúcej alebo ukončenej terapie RH by sa vysvetlil ukončením remodelačných cyklov iniciovaných na začiatku terapie. V štúdiach zaoberajúcich sa kostnou minerálnou kapacitou (BMC) a BMD bolo pozorované relatívne veľké zvýšenie BMC v porovnaní s BMD. Ak BMD je rovná BMC, dá sa špekulovať, že relatívne väčšie zvýšenie BMC je spojené so zväčšením kosti. Túto teóriu podporilo niekoľko denzitometrických nálezov u pacientov po dlhodobej terapii RH. Nie je známe, či toto zistenie je podmienené limitáciou denzitometrického vyšetrenia alebo stimulačným efektom na periostálnu kostnú formáciu (14–23).
Obr. 2. Zmeny v totálnej BMD (hore) a BMC (dole) v porovnaní s bazálnou hodnotou počas liečby rekombinantným RH vs. placebo (bodkovaná čiara) 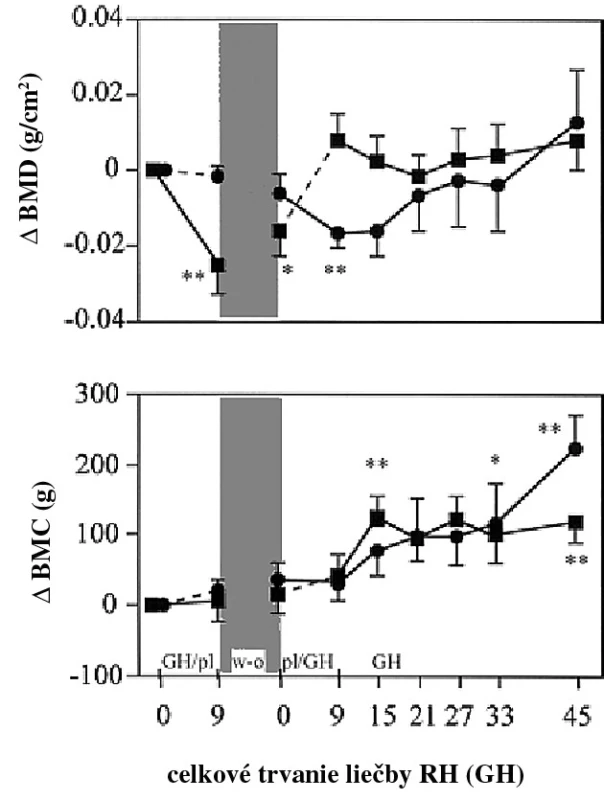
Štvorčeky reprezentujú pacientov, ktorí dostávali najskôr RH a potom placebo (GH/pl), krúžky reprezentujú pacientov, ktorí dostávali liečbu v opačnom poradí (pl/GH). Tieňovaná časť znamená 3 mesačnú „wash-out“ periódu (w-o) pred výmenou (15). Deficit RH a riziko fraktúr
Znížený rast kosti a pokles maximálnej kostnej masy (PBM) počas rastu takisto dôležito vplýva na výskyt fraktúr v starobe. Keďže sa terapia rekombinantným rastovým hormónom stala dostupná pre dospelých pacientov s deficitom RH, je dôležité stanoviť riziko fraktúr a kostnú denzitu počas obdobia bez liečby aj počas liečby RH. Bolo dokázané, že terapia RH počas 18–24 mesiacov viedla k miernemu vzostupu BMD u dospelých mužov s RH deficitom stanoveným v dospelosti, zatiaľ čo u žien to k signifikantným zmenám BMD neviedlo (24). Či sa riziko fraktúr u pacientov s RH deficitom odlišuje od rizika u bežnej populácie, nie je zatiaľ pevne stanovené. Tri predošlé štúdie (25–27) dokázali zvýšené riziko fraktúr u pacientov s RH deficitom. Rosén et al. (26) skúmali frekvenciu fraktúr u 107 pacientov (69 mužov, 53 žien) s hypopituitarizmom s deficitom RH v porovnaní s kontrolným súborom pacientov v počte 323. Pacienti dostávali rutinnú substitučnú terapiu hormónmi okrem RH. Prevalencia prítomnosti zlomenín bola stanovená na základe dotazníka. Celkový výskyt fraktúr bol vyšší v skupine s deficitom RH u mužov i žien (24,1 %) v porovnaní s kontrolnou skupinou (8,7 %) (obr. 3). U mužov bola frekvencia fraktúr (25 %) vyššia v porovnaní s kontrolami (7,8 %) ako u žien (21,7 %) v porovnaní s kontrolou (9,5 %).
Obr. 3. Celková frekvencia fraktúr u pacientov s deficitom RH v porovnaní s kontrolou. Celková frekvencia fraktúr bola vyššia u pacientov v porovnaní s kontrolou (p < 0,001) (26). 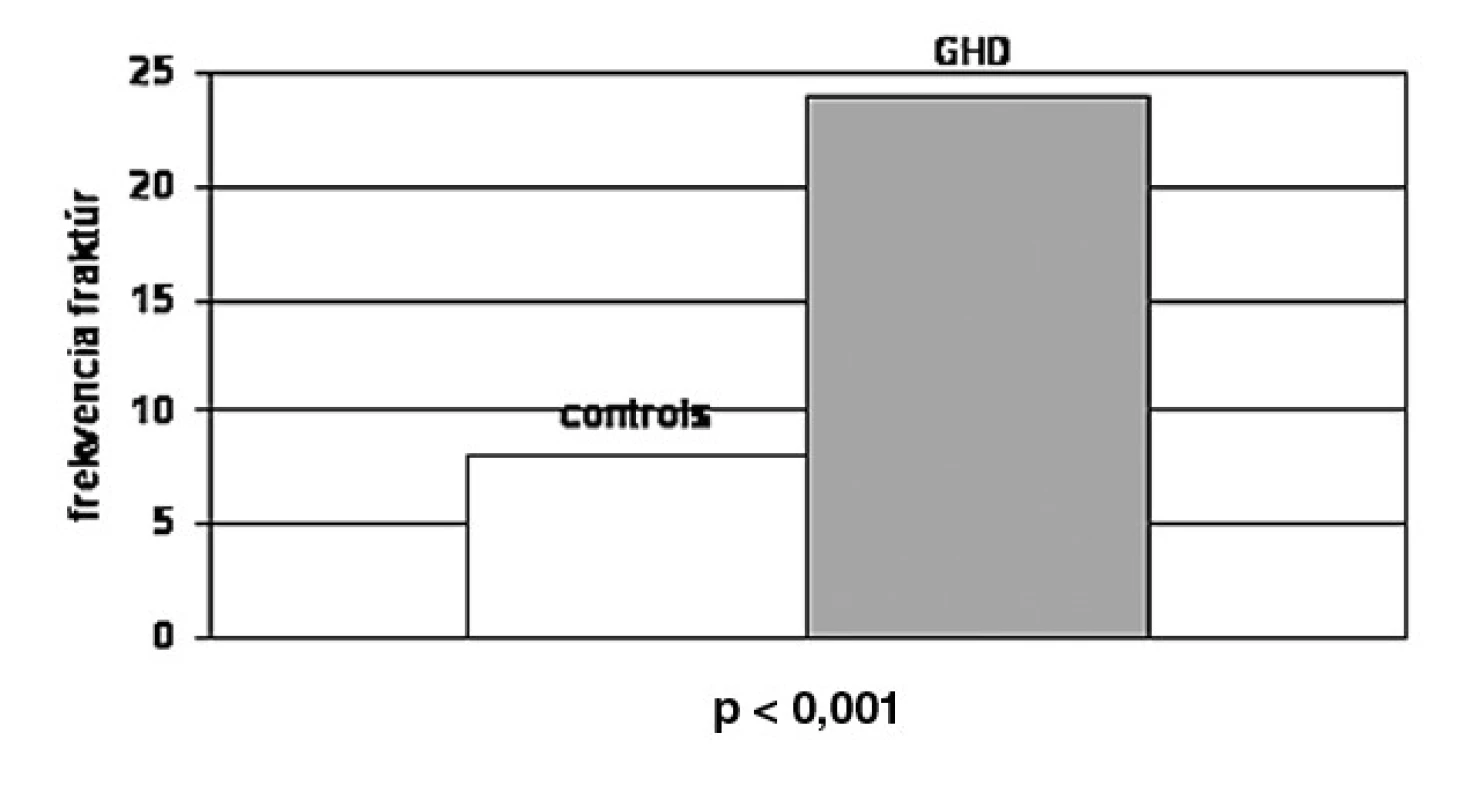
Adekvátne stanovenie rizika fraktúr nevyžaduje len vysoký počet pacientov, ale tiež kontrolnú skupinu pacientov a prispôsobenie pre potencionálne ďalšie faktory ako je BMI (28, 29), fajčenie (30), príjem kalcia v diéte (31) a fyzická aktivita (32–34). Takisto musia byť brané do úvahy modifikujúce faktory ako je vek a pohlavie. V štúdii Holmera et al. (35) bola analyzovaná incidencia fraktúr u pacientov s deficitom RH na substitučnej liečbe RH v porovnaní s kontrolou z bežnej populácie. Štúdia bola zložená z 832 pacientov (433 mužov, 399 žien), z ktorých 732 malo deficit zistený v dospelosti (AO GHD) a 100 malo deficit zistený v detstve (CO GHD). Najčastejšou príčinou deficitu RH bol adenóm hypofýzy u AO GHD a u CO GHD to bol idiopatický deficit RH. Ženy s deficitom RH nemali signifikantné zvýšenie rizika fraktúr, ale riziko bolo obmedzené len na ženy s CO GHD, ktoré mali viac ako dvojnásobne zvýšené riziko. Žiadne zvýšenie rizika zlomenín nebolo pozorované u žien s AO GHD (tab. 2). Perióda FHD (od stanovenia deficit prvého hormónu hypofýzy po 1. fraktúru) bola asociovaná so zvýšeným rizikom fraktúr u žien s deficitom vzniknutým v detstve. Muži s deficitom RH mali totálne odlišné výsledky (tab. 3). Mali dokonca nižšiu incidenciu fraktúr v porovnaní s kontrolnou skupinou. Podobná incidencia bola zistená u mužov s AO GHD i CO GHD, ale incidencia bola signifikantne znížená u mužov s deficitom RH zisteným v dospelosti (AO GHD). Kumulatívna incidencia CO GHD bola väčšia, pretože počet pacientov v tejto skupine bol proporčne nižší v porovnaní so skupinou pacientov s AO GHD.
Tab. 2. Incidencia fraktúr u 399 žien s deficitom RH v porovnaní s kontrolou z bežnej populácie vo vzťahu k deficitu zistenom v dospelosti (AO GHD) alebo v detstve (CO GHD) v rôznych observačných periódach (35) 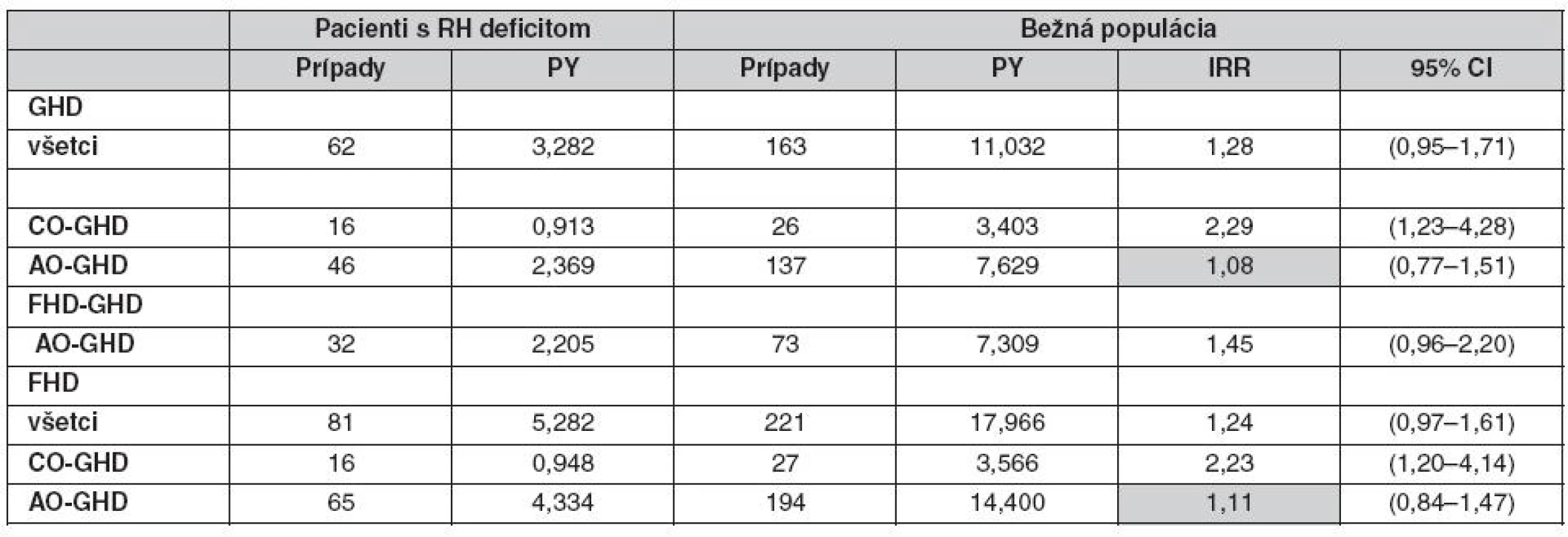
PY – person-years at risk – čas po objavenie sa fraktúry, IRR – incidence rate ratio – pomerný nárast nových prípadov Tab. 3. Incidencia fraktúr u 433 mužov s deficitom RH v porovnaní s kontrolou z bežnej populácie s ohľadom na to, či bol deficit zistený v dospelosti (AO GHD) alebo v detstve (CO GHD) v rôznych observačných periódach (36) Pozn.: GHD – od kalendárneho roku zistenia deficitu RH do kalendárneho roka 1. fraktúry alebo 31. dec. 2002 (ukončenie štúdie), FHDGHD – od začiatku deficitu prvého hormónu hypofýzy po 1. fraktúru alebo po kalendárny rok zistenia deficit RH, FHD – od začiatku deficitu prvého hormónu hypofýzy po 1. fraktúru alebo 31. dec. 2002 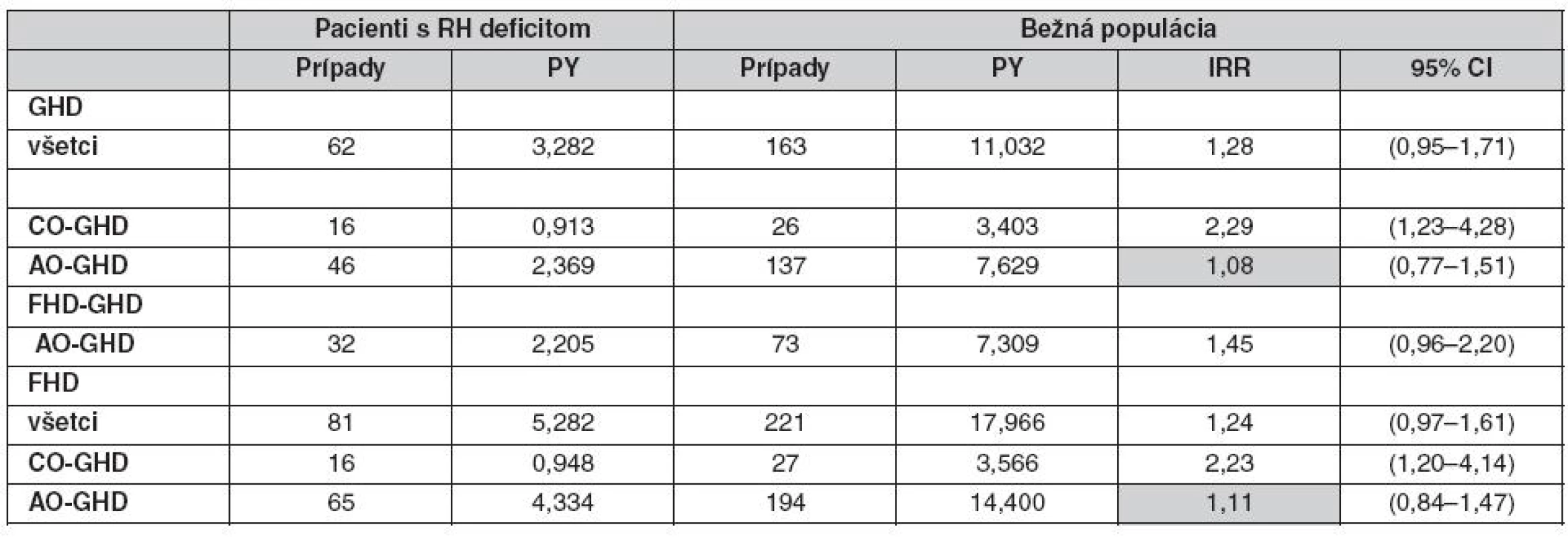
PY – person-years at risk – čas po objavenie sa fraktúry, IRR – incidence rate ratio – pomerný nárast nových prípadov Vplyv terapie RH na biochemické markery kostného metabolizmu
U pacientov s normálnou sekréciou RH, administrácia RH počas 4–7 dní signifikantne zvyšuje sérové a močové koncentrácie biochemických markerov kostnej formácie a resorpcie (37, 38).V niektorých štúdiách po 12 mesiacoch terapie deficitu RH bol pozorovaný pokles markerov kostného obratu až pokles na bazálne hodnoty. Nie je známe, či tieto zistenia poukazujú, že po určitom čase sa metabolizmus kostí adaptuje na vyššie sérové koncentrácie RH. V krátkodobých štúdiách zvýšenie markerov, v porovnaní s bazálnou hladinou, je závislé od dávky RH (15–18, 39, 40). Pre tieto zistenia sa môžu použiť kostné markery ako alternatíva k sérovým hladinám IGF-I pri monitorovaní compliance na substitučnú terapiu RH.
Pohlavné rozdiely v efekte RH na kosť
Ženy majú vo všeobecnosti vyššie hladiny sekrécie RH ako muži (41, 42), ale normálne rozmedzie koncentrácie sérového IGF-I je podobné u dospelých mužov i žien (43) naznačujúc určitý stupeň rezistencie na administráciu RH u žien. V placebom kontrolovanej dvojito slepej štúdii, kde RH deficientní muži a ženy dostávali rovnakú dávku RH na m2 povrchu tela, bolo zvýšenie sérových koncentrácií IGF-I väčšie u mužov (44). Takisto zvýšenie sérových markerov kostného metabolizmu bolo väčšie u mužov (obr. 4).
Obr. 4. Efekt 9-mesačnej terapie RH na biochemické kostné markery u mužov a žien s hypopituitarizmom a RH deficitom v placebom kontrolovanej štúdii. 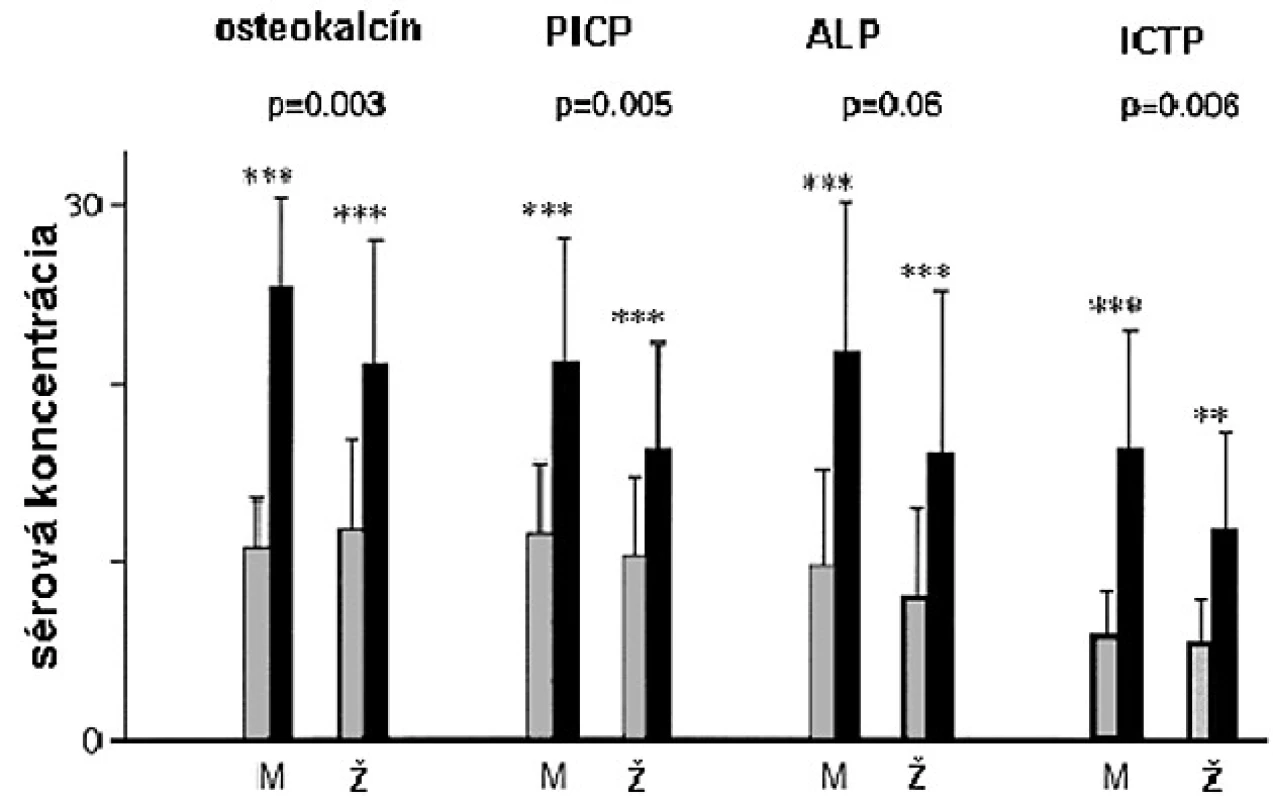
PICP – karboxyterminálny propeptid prokolagénu typu I, ICTP – karboxyterminálny telopeptid kolagénu typu I, M – muž, W – žena V inej štúdii, bola dávka RH nastavená tak, aby sérové koncentrácie IGF-I boli v normálnom rozmedzí, takže dávka u mužov bola signifikantne nižšia (15). Výsledkom, pokiaľ dávka bola značne vyššia u žien, je, že sérové koncentrácie IGF-I a sérové markery boli podobné u mužov i žien. Aj napriek faktu, že ženy dostávali vyššie dávky RH s adekvátnym zvýšením IGF-I, dlhodobý efekt na kostnú denzitu bol sklamaním. Iba u mužov bolo pozorované signifikantné zvýšenie kostnej denzity lumbálnej chrbtice a krčka femuru (obr. 5).
Obr. 5. Zmeny v BMD a BMC u RH deficientných mužov (biele) a žien (čierne) po 33 mesiacoch terapie RH (15) 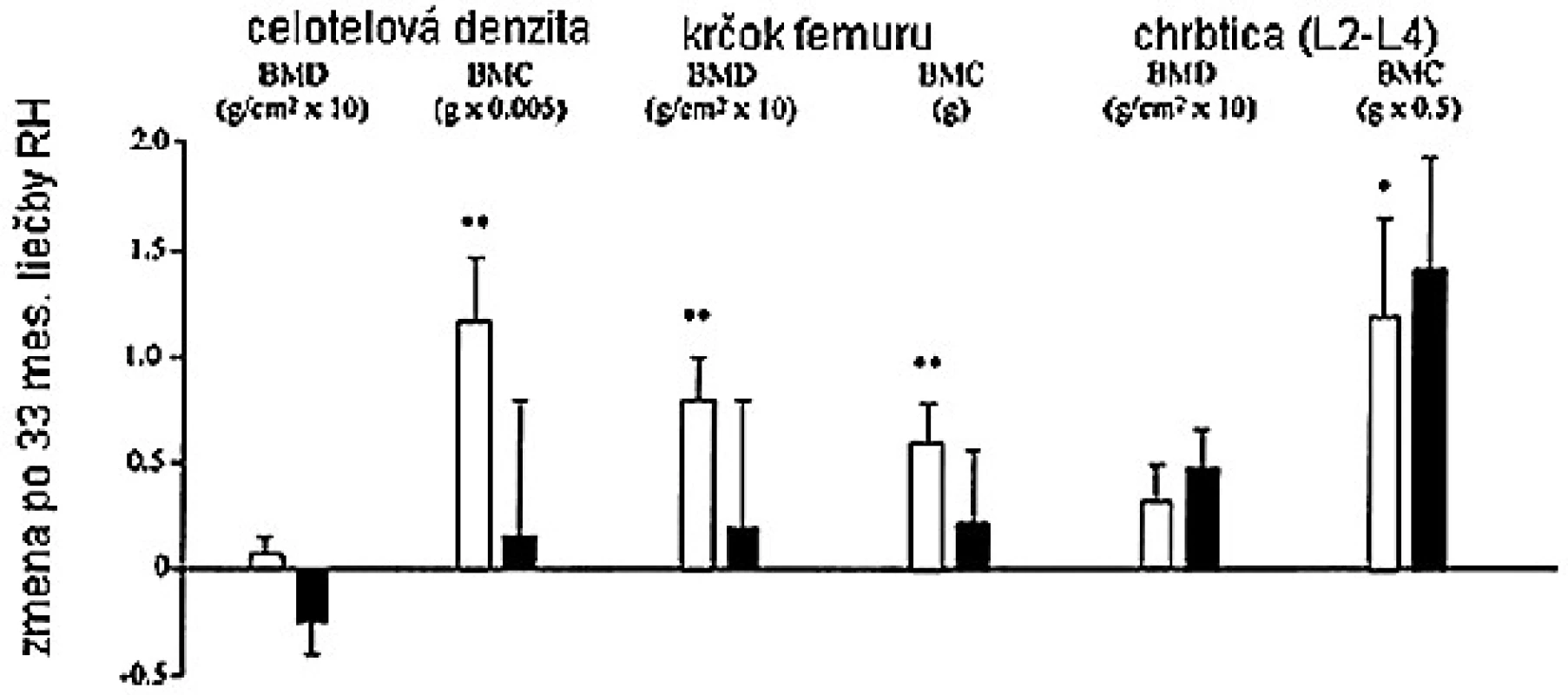
Valimaki et al. tiež nedávno uverejnil, že zvýšenie BMD rezultujúce z terapie RH bolo vyššie u RH deficientných mužov ako žien (18). Jedno z možných vysvetlení pre pohlavné rozdiely v odpovedi na terapiu RH je, že rôzne zákonitosti sexuálnych hormónov majú vplyv na efekt RH. V štúdii, kde ženy dostávali perorálnu estrogénovú substitučnú terapiu, sa ukázala potreba vyššej dávky RH na udržanie podobných koncentrácií IGF-I, v porovnaní so ženami, ktoré estrogény nedostávali (45), preto by sa nasledujúce štúdie mali určite diferencovať na základe pohlavia.
Záver
Existuje niekoľko štúdii zameraných na skúmanie vplyvu deficitu RH na kostnú denzitu a riziko fraktúr s veľkým počtom pacientov, kde bolo pozorované zníženie kostnej denzity i zvýšené riziko fraktúr u pacientov s RH deficitom, a zároveň sa potvrdil pozitívny vplyv substitučnej terapie RH. Naproti tomu, existujú štúdie, kde vplyv terapie RH má diskutabilný efekt. Preto je potrebné zohľadniť v štúdiách viacero parametrov, ako je BMI, fajčenie, príjem kalcia v strave, fyzickú aktivitu ako aj modifikujúce faktory, akými sú pohlavie a vek pacientov. Sú potrebné ďalšie dlhodobé štúdie vplyvu substitučnej terapie rastovým hormónom na kostnú denzitu a riziko fraktúr.
Skratky
AO GHD – adult onset growth hormone deficiency
BMD – kostná minerálna denzita
BMI – body mass index
CO GHD – childhood onset growth hormone deficiency
IGF-I – insulin like growth factor I
PBM – maximálna kostná masa (peak bone mass)
RH – rastový hormón
Adresa pro korespondenci:
MUDr. Martin Kužma
V. interná klinika LF UK a FNsP
Ružinovská 6, 826 06 Bratislava, SR
e-mail: kuzmuc@yahoo.com
Zdroje
1. Mohsen S, Eledrisi, MD. FACP, FACE, Consultant, Department of Internal Medicine, Division of Endocrinology and Metabolism. King Abdulaziz National Guard Medical Center, Saudi Arabia 2009
2. Kužma M, Payer J. Deficit rastového hormónu v dospelosti. Slovenský lekár, 2009; 19(33): 131–138.
3. Rizzoli R, Bonjour JP. Determinants of peak bone mass and mechanisms of bone loss. Osteoporos Int 1999; 9 (Suppl. 2): S17–S23.
4. Ohlsson C, Bengtsson BA, Isaksson OG, Andreassen TT, Slootweg MC. Growth hormone and bone. Endocr Rev 1998; 19(1): 55–79.
5. Bouillon R. Growth hormone and bone. Horm Res 1991; 36 (Suppl. 1): 49–55.
6. de Boer H, Blok GJ, van der Veen, EA. Clinical aspects of growth hormone deficiency in adults. Department of Endocrinology, Free University Hospital, Amsterdam, The Netherlands. Endocr Rev 1995; 16(1): 63–86.
7. Johansson AG, Burman P, Westermark K, Ljunghall S. The bone mineral density in acquired growth hormone deficiency correlates with circulating levels of insulin-like growth factor I. J Intern Med 1992; 232(5): 447–452.
8. Holmes SJ, Economou G, Whitehouse RW, Adams JE, Shalet SM. Reduced bone mineral density in patients with adult onset growth hormone deficiency. J Clin Endocrinol Metab 1994; 78(3): 669–674.
9. Kaufman JM, Taelman P, Vermeulen A, Vandeweghe M. Bone mineral status in growth hormone-deficient males with isolated and multiple pituitary deficiencies of childhood onset. J Clin Endocrinol Metab 1992; 74(1): 118–123.
10. Attanasio AF, Lamberts SW, Matranga AM, Birkett MA, Bates PC, Valk NK, Hilsted J, Bengtsson BA, Strasburger CJ. Adult growth hormone (GH)-deficient patients demonstrate heterogeneity between childhood onset and adult onset before and during human GH treatment. Adult Growth Hormone Deficiency Study Group. J Clin Endocrinol Metab 1997; 82(1): 82–88.
11. Rosén T, Hansson T, Granhed H, Szucs J, Bengtsson BA. Reduced bone mineral content in adult patients with growth hormone deficiency. Acta Endocrinol (Copenh) 1993; 129(3): 201–206.
12. Whitehead HM, Boreham C, McIlrath EM, Sheridan B, Kennedy L, Atkinson AB, Hadden DR. Growth hormone treatment of adults with growth hormone deficiency: results of a 13-month placebo controlled cross-over study. Clin Endocrinol (Oxf) 1992; 36(1): 45–52.
13. Binnerts A, Swart GR, Wilson JH, Hoogerbrugge N, Pols HA, Birkenhager JC, Lamberts SW. The effect of growth hormone administration in growth hormone deficient adults on bone, protein, carbohydrate and lipid homeostasis, as well as on body composition. Clin Endocrinol (Oxf) 1992; 37(1): 79–87.
14. Vandeweghe M, Taelman P, Kaufman JM. Short and long-term effects of growth hormone treatment on bone turnover and bone mineral content in adult growth hormone-deficient males. Clin Endocrinol (Oxf) 1993; 39(4): 409–415.
15. Johansson AG, Engström BE, Ljunghall S, Karlsson FA, Burman P. Gender differences in the effects of long term growth hormone (GH) treatment on bone in adults with GH deficiency. J Clin Endocrinol Metab 1999; 84(6): 2002–2007.
16. Johansson G, Rosen T, Bosaeus I, Sjostrom L, Bengtsson B‑A. Two zears of growth hormone treatment increases bone mineral content and density in hypopituitary patients with adult-onset GH deficiency. J Clin endocrinol Metab 1996; 81 : 2865–2873.
17. Baum HBA, Biller BMK, Finkelstein JS, Baker CK, Oppenhein DS, Schoenfeld DA, Hoskins MT, Wittink H, Klibanski A. Effects of physiologic growth hormone therapy on bone density and body composition in patients with adult onset growth hormone deficiency. A randomized, placebo-controlled trial. Ann Intern Med 1996; 125 : 883–890.
18. Välimäki MJ, Salmela PI, Salmi J, Viikari J, Kataja M, Turunen H, Soppi E. Effects of 42 months of GH treatment on bone mineral density and bone turnover in GH-deficient adults. Eur J Endocrinol 1999; 140(6): 545–554.
19. Janssen YJ, Hamdy NA, Frölich M, Roelfsema F. Skeletal effects of two years of treatment with low physiological doses of recombinant human growth hormone (GH) in patients with adult-onset GH deficiency. J Clin Endocrinol Metab 1998; 83(6): 2143–2418.
20. Longobardi S, Di Rella F, Pivonello R, Di Somma C, Klain M, Maurelli L, Scarpa R, Colao A, Merola B, Lombardi G. Effects of two years of growth hormone (GH) replacement therapy on bone metabolism and mineral density in childhood and adulthood onset GH deficient patients. J Endocrinol Invest 1999; 22(5): 333–339.
21. Kann P, Piepkorn B, Schehler B, Andreas J, Lotz J, Prellwitz W, Beyer J. Effect of long-term treatment with GH on bone metabolism, bone mineral density and bone elasticity in GH‑deficient adults. Clin Endocrinol (Oxf) 1998; 48(5): 561–568.
22. Holmes SJ, Whitehouse RW, Economou G, O’Halloran DJ, Adams JE, Shalet SM. Further increase in forearm cortical bone mineral content after discontinuation of growth hormone replacement. Clin Endocrinol (Oxf) 1995; 42(1): 3–7.
23. Rahim A, Holmes SJ, Adams JE, Shalet SM. Long-term change in the bone mineral density of adults with adult onset growth hormone (GH) deficiency in response to short or long-term GH replacement therapy. Clin Endocrinol (Oxf) 1998; 48(4): 463–469.
24. Seeman E, Hopper JL, Bach LA, Cooper ME, Parkinson E, McKay J, Jerums G. Reduced bone mass in daughters of women with osteoporosis. N Engl J Med 1989; 320(9): 554–558.
25. Wüster C, Slenczka E, Ziegler R. Increased prevalence of osteoporosis and arteriosclerosis in conventionally substituted anterior pituitary insufficiency: Is there a need for additional growth hormone substitution? (In German). Klin Wochenschr 1991; 69 : 769–773.
26. Rosén T, Wilhelmsen L, Landin-Whilhelmsen K, Lappas G, Bengtsson BA. Increased fracture frequency in adult patients with hypopituitarism and GH deficiency. Eur J Endocrinol 1997; 137 : 240–245.
27. Wüster C, Abs R, Bengtsson BĀ, Bennmarker H, Feldt-Rasmussen U, Hernberg-StĆhl E, Monson JP, Westberg B, Wilton P on behalf of the KIMS study group the KIMS international board. The influence of growth hormone deficiency, growth hormone replacement therapy and other aspects of hypopituitarism on fracture rate and bone mineral density. J Bone Miner Res 2001; 2 : 398–405.
28. Wang MC, Bachrach LK, Van Loan M, Hudes M, Flegal KM, Crawford PB. The relative contribution of lean tissue mass and fat mass to bone density in young women. Bone 2005; 37 : 474–481.
29. De Laet C, Kanis JA, Odén A, Johanson H, Johnell O, Delmas P, Eisman JA, Kroger H, Fujiwara S, Garnero P, McCloskey EV, Mellstrom D, Melton LJ III, Meunier PJ, Pols HAP, Reeve J, Silman A, Tenenhouse A. Body mass index as a predictor of fracture risk: A meta-analysis. Osteoporos Int 2005; 16 : 1330–1338.
30. Kiel DP, Zhang Y, Hannan MT, Anderson JJ, Baron JA, Felson DT. The effect of smoking at different life stages on bone mineral density in elderly men and women. Osteoporos Int 1996; 6 : 240–248.
31. Becker W, Pearson M. Riksmaten 1997–1998, National Food Administration 1998.
32. Slemenda CW, Miller JZ, Hui SL, Reister TK, Johnston CC Jr. Role of physical activity in the development of skeletal mass in children. J Bone Miner Res 1991; 6 : 1227–1233.
33. Davee AM, Rosen CJ, Adler RA. Exercise patterns and trabecular bone density in college women. J Bone Miner Res 1990; 5 : 245–250.
34. Margulies JY, Simkin A, Leichter I, Bivas A, Steinberg R, Giladi M, Stein M, Kashtan H, Milgrom C. Effect of intense physical activity on the bone-mineral content in the lower limbs of young adults. J Bone Joint Surg Am 1986; 68 : 1090–1093.
35. Holmer H, Svensson J, Rylander L, Johannsson G, Rosén T, Bengtsson BA, Thorén M, Höybye C, Degerblad M, Bramnert M, Hägg E, Engström BE, Ekman B, Thorngren KG, Hagmar L, Erfurth EM. Fracture incidence in GH-deficient patients on complete hormone replacement including GH. J Bone Miner Res 2007; 22(12): 1842–1850.
36. Holmer H, Svensson J, Rylander L, Johannsson G, Rosén T, Bengtsson BA, Thorén M, Höybye C, Degerblad M, Bramnert M, Hägg E, Engström BE, Ekman B, Thorngren KG, Hagmar L, Erfurth EM. Fracture incidence in GH-deficient patients on complete hormone replacement including GH. J Bone Miner Res 2007; 22(12): 1842–1850.
37. Brixen K, Nielsen HK, Mosekilde L, Flyvbjerg A. A short course of recombinant human growth hormone treatment stimulates osteoblasts and activates bone remodeling in normal human volunteers.J Bone Miner Res 1990; 5(6): 609–618.
38. Johansson AG, Lindh E, Blum WF, Kollerup G, SŅrensen OH, Ljunghall S. Effects of growth hormone and insulin-like growth factor I in men with idiopathic osteoporosis. J Clin Endocrinol Metab 1996; 81(1): 44–48.
39. Nielsen HK, JŅrgensen JO, Brixen K, Christiansen JS. Serum osteocalcin and bone isoenzyme alkaline phosphatase in growth hormone-deficient patients: dose-response studies with biosynthetic human GH. Calcif Tissue Int 1991; 48(2): 82–87.
40. Jensen LT, Jorgenssen JOL, Risteli J, Christiansen JS, Lorenzen I. Type I and III procolagen propeptides in growth hormone-deficient patients: Effects of increasing doses of GH. Acta Endocrinol (Copenh) 1991; 124 : 278–282.
41. Eden EB, Karlsson FA, Wide L. Marked gender differences in ambulatory morning growth hormone values in young adults. Clin Chem 1998; 44 : 1289–1295.
42. Jansson JO, Edén S, Isaksson O. Sexual dimorphism in the control of growth hormone secretion. Endocr Rev 1985; 6(2): 128–150.
43. Juul A, Bang P, Hertel NT, Main K, Dalgaard P, JŅrgensen K, Müller J, Hall K, Skakkebaek NE. Serum insulin-like growth factor-I in 1030 healthy children, adolescents, and adults: relation to age, sex, stage of puberty, testicular size, and body mass index. J Clin Endocrinol Metab 1994; 78(3): 744–752.
44. Burman P, Johansson AG, Siegbahn A, Vessby B, Karlsson FA. Growth hormone (GH)-deficient men are more responsive to GH replacement therapy than women. J Clin Endocrinol Metab 1997; 82(2): 550–555.
45. Cook DM, Ludlam WH, Cook MB. Route of estrogen administration helps to determine growth hormone (GH) replacement dose in GH-deficient adults. J Clin Endocrinol Metab 1999; 84(11): 3956–3960.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Shyův-Dragerův syndromČlánek Spolek lékařů českýchČlánek KnihaČlánek 5. ECCO kongresČlánek Fotoaging v lidské kůžiČlánek Laureáti Nobelovy ceny
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Deficit rastového hormónu a jeho vplyv na kostnú minerálnu denzitu a riziko osteoporotických fraktúr
- Celogenomové sekvencování v ústavu J. Hopkinse je prvním milníkem v individuální péči o pacienty s nádory
- Kontaktný ekzém a atopická dermatitída – vzácna komorbidita?
- Možnosti časné identifikace a následné péče o nestabilního nemocného
- Shyův-Dragerův syndrom
- Chrání kouření před Alzheimerovou demencí? Záleží na tom, koho se ptáte.
- Virus bez duše a ani v duších – úvod do ságy HIV viru
- Spolek lékařů českých
- Vývoj zdravotnej situácie v Českej republike a v Európskej únii
- Kniha
- Vztah terapie hyperglykémie a riziko ischemické choroby srdeční: rok 2010
- Nathaniel St. André a jeho osudová pacientka Mary Toft
- II. Snowderm aneb setkání členů Sekce mladých dermatovenerologů ČDS ČLS JEP
- Deset ročníků konference Tabák a zdraví v Lékařském domě, jedenáctý před námi
- Patnáctý ročník sympozia s názvem Onkologie v gynekologii a mammologii
- Mezioborové setkání alergologů
- Druhé výroční zasedání Společnosti pro lékařskou mikrobiologii ČLS JEP
- 5. ECCO kongres
- XXXV. angiologické dny 2010 s mezinárodní účastí
- 10. Kaprasův den – klinická genetika
- Za farmakologem doc. MUDr. Václavem Trčkou, DrSc.
- Zemřel profesor MUDr. Jiří Horáček, CSc.
- Čecho-kanaďan Josef Skála poctěn nejprestižnější cenou kanadské medicíny
- Fotoaging v lidské kůži
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Shyův-Dragerův syndrom
- Zemřel profesor MUDr. Jiří Horáček, CSc.
- Možnosti časné identifikace a následné péče o nestabilního nemocného
- Kontaktný ekzém a atopická dermatitída – vzácna komorbidita?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



