-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Adenokarcinom pankreatu – časné symptomy a screening
Pancreatic adenocarcinoma – early symptoms and screening
Pancreatic adenocarcinoma is a dismal disease with a very serious prognosis and a very low 5-year survival. Local symptoms are present at a late stage of the disease and in the majority of cases do not enable radical surgery. Intervention is possible only in locally restricted tumor and remains the only chance of significant survival. At present, two early symptoms of this growth are known. They include impaired glucose tolerance or diabetes similar to but not identical with diabetes type 2, and a decrease of the body mass. They precede by a period of 2–3 years local symptoms that are late and cause the bad prognosis. The earlier diagnosis of pancreatic adenocarcinoma represents an urgent and serious task. The project of a screening program based on the use of the early symptoms may move the diagnosis of pancreatic adenocarcinoma to the earlier stage of the disease. The key-players for the most important first step of this program are general practitioners and ambulatory diabetologists.
Keywords:
pancreatic adenocarcinoma – early symptoms – glucose homeostasis – body mass – screening program
Autori: Bohuš Bunganič; Přemysl Frič; Miroslav Zavoral
Pôsobisko autorov: Interní klinika 1. LF UK a ÚVN, Praha
Vyšlo v časopise: Čas. Lék. čes. 2014; 153: 267-270
Kategória: Přehledový článek
Súhrn
Adenokarcinom pankreatu je deprimující choroba se závažnou prognózou a velmi nízkým pětiletým přežitím. Lokální příznaky jsou přítomny až v pokročilé fázi onemocnění a ve většině případů neumožňují radikální chirurgickou terapii. Tato je možná pouze u lokálně nepokročilého nádoru a zůstává jedinou šancí na významné přežití. V současné době jsou známy dva časné symptomy adenokarcinomu pankreatu: porucha glukózové tolerance nebo diabetes podobný diabetu 2. typu s poklesem tělesné hmotnosti. Ty předcházejí o 2–3 roky výskyt symptomů, které jsou pozdní a jsou příčinou špatné prognózy tohoto onemocnění. Časnější diagnostika adenokarcinomu pankreatu je naléhavý a závažný úkol. Návrh screeningového programu s využitím časných symptomů může posunout diagnostiku adenokarcinomu pankreatu do časnějšího stadia. Klíčovými hráči jeho nejdůležitější první části jsou praktičtí lékaři a ambulantní diabetologové.
Klíčová slova:
adenokarcinom pankreatu – časné symptomy – homeostáza glukózy – tělesná hmotnost – screeningový programÚVOD
Adenokarcinom pankreatu (AKP) je nejčastější maligní onemocnění břišní slinivky a čtvrtý nejčastější zhoubný nádor ve vyspělých zemích. Jeho prognóza je mimořádně nepříznivá, neboť pětileté přežití činí 3–5 %. Lokální příznaky (bolest, cholestáza, ikterus) jsou pozdní. Moderní zobrazovací metody zpřesňují diagnostiku, ale vůbec nemění prognózu tohoto onemocnění. Hledání časných symptomů a specifických biomarkerů zůstává předmětem intenzivního zájmu. Toto sdělení se zabývá současnými znalostmi o časných symptomech AKP, za něž jsou považovány změny homeostázy glukózy a pokles tělesné hmotnosti. V závěrečné části autoři předkládají návrh screeningového programu AKP s cílem časnější diagnostiky před objevením lokálních symptomů.
ČASNÉ SYMPTOMY
Homeostáza glukózy
Schwarts (1) popsal již před 35 roky výskyt poruchy glykoregulace u nemocných s AKP. Cersosimo (2) upozornil na inzulinovou rezistenci u nemocných AKP a předpokládal poruchu funkce β-buněk. Další autoři popsali zlepšení glykoregulace po odstranění nádoru, rozdíly v inzulinové rezistenci u AKP nemocných s diabetem a bez diabetu, jakož i významné snížení syntézy glukagonu v tkáňových kulturách s extrakty AKP provázeného diabetem (3, 4). Gullo (5) jako první upozornil, že při AKP jde často o diabetes vzniklý nedávno a za jeho příčinu považoval nádor. V dalších letech byly provedeny metaanalýzy (6, 7), z nichž vyplývá, že význam diabetu při AKP se liší podle jeho trvání. Dlouhotrvající diabetes je nízkorizikový faktor AKP, kdežto nedávno vzniklý diabetes je možné považovat za časný symptom tohoto onemocnění.
Hlavní poznatky o této problematice shromáždili v posledních letech pracovníci Mayo kliniky (Rochester, Minnesota) pod vedením profesorů S. T. Chariho a R. Pannaly. V populační studii více než 2000 rezidentů ve věku 50 let a starších identifikovali 18 osob (0,85 %), u nichž byl diagnostikován AKP do 3 let od stanovení diagnózy diabetu. Autoři uzavírají, že přibližně 1 % diabetiků v tomto věkovém období onemocní AKP do 3 let od stanovení diagnózy diabetu (8). V dalším souboru 642 AKP-nemocných zjistili diabetes u 47 % nemocných (9). V epidemiologické studii srovnávali tito autoři výskyt diabetu u více než 700 nemocných AKP a 1875 kontrolních osob v jednoročním intervalu po dobu 5 let před stanovením diagnózy nádoru. Během 3 let před tímto datem a zejména v posledních 2 letech byl výskyt diabetu častější u osob, které onemocněly karcinomem než u kontrol (10). Pannala et al. (11) našli tento typ diabetu téměř u poloviny souboru 512 prospektivně diagnostikovaných AKP nemocných. Tento diabetes je způsoben nádorem, má stejné rizikové faktory jako běžný typ diabetu 2. typu a zlepšuje se po radikální operaci nádoru. Podobá se diabetu 2. typu (vyšší věk, vyšší BMI nebo obezita, rodinná anamnéza diabetu), ale není s ním identický.
Chari et al. (12) popsali podrobně vývoj této poruchy. U kontrolních osob a normoglykemických AKP nemocných byla periferní inzulinová rezistence zvýšená a funkce β-buněk byla normální. U AKP nemocných s poruchou glukózové tolerance byla funkce β-buněk významně snížená ve srovnání s normoglykemickými AKP nemocnými, ale inzulinová rezistence se významně nelišila mezi těmito dvěma skupinami. U AKP nemocných s diabetem bylo zjištěno další významné zvýšení periferní inzulinové rezistence, ale funkce β-buněk nebyla významně odlišná ve srovnání s předchozí skupinou.
Prevalence diabetu při AKP je významně vyšší ve srovnání s jinými orgánovými lokalizacemi karcinomu. Aggarwal et al. (13) prokázali tuto skutečnost srovnáním AKP nemocných (prevalence diabetu 68 %) s věkově odpovídajícími nemocnými s karcinomem plic (19,6 %), prsu (19,4 %), prostaty (14,8 %) a kolorekta (20,7 %). U 40 % AKP nemocných vznikl diabetes v období 36 měsíců před diagnostikou nádoru. V ostatních orgánových lokalizací karcinomu k tomu došlo u 3,3–5,7 % nemocných. Podobný nález učinil Li et al. (14) při analýze údajů získaných od téměř 400 000 dospělých Američanů.
Podle Aggarwala et al. (15) tyto nálezy dokládají, že nedávno vzniklý diabetes (méně než 36 měsíců před zjištěním AKP) může být úvodním symptomem AKP. V souboru 111 nemocných AKP mělo diabetes 52 (47 %) nemocných, z nichž u 30 (58 %) šlo o diabetes nově vzniklý. Dvacet čtyři (80 %) nemocných z této podskupiny nemělo žádný příznak svědčící pro AKP a medián následné diagnózy AKP byl 6,5 měsíce. U plné třetiny nemocných však zůstal diabetes nediagnostikován.
Situace se dále komplikuje tím, že metformin, který je hlavním terapeutikem diabetes mellitus 2. typu, významně zvyšuje protinádorové aktivity některých miRNA, zejména miRNA26a. Tato inhibuje buněčnou proliferaci, invazi, stimuluje apoptózu a onkogen HMGA1 je jejím cílovým objektem (16). Není zjištěno, zda tyto vlastnosti metforminu mohou interferovat s časnou diagnózou AKP s diabetem.
Nově vzniklý diabetes při AKP je považován podle posledních zpráv za paraneoplastický projev substancí produkovaných nádorovými buňkami. Jako první z nich byl identifikován adrenomedullin, který inhibuje glukózou stimulovanou sekreci inzulínu. Messenger RNA i protein adrenomedullinu jsou zvýšeny v AKP buňkách ve srovnání s kontrolami. Plazmatické hladiny adrenomedullinu jsou zvýšeny u AKP nemocných ve srovnání s běžným diabetem 2. typu a kontrolami. Nález je specifický pro AKP nemocné s diabetem (17). Adrenomedullin lze proto považovat za působek zprostředkující dysfunkci β-buněk u AKP nemocných s diabetem (18).
Tělesná hmotnost (THM)
Změny THM v dospělosti významně ovlivňují vývoj AKP. Nadváha a obezita je rizikovým faktorem AKP. Jejich přítomnost v dospělosti u mladých osob je rizikovým faktorem AKP a jeho dřívější manifestace. Obezita ve starším věku ovlivňuje nepříznivě celkové přežívání nemocných AKP (19).
Hart et al. (20) srovnávali soubor 29 AKP diabetiků a 43 diabetiků 2. typu, kteří měli opakovaně stanovenou glykémii nalačno a v době diagnózy diabetu neměli žádný specifický symptom AKP. Autoři zjistili, že běžný diabetes 2. typu je typicky spojen se zvýšením THM. Naopak u AKP diabetiků pokles THM často předchází objevení diabetu.
Screening
Diabetes AKP nemocných je kombinací výrazného poklesu funkce β-buněk a rezistence periferních tkání na inzulín (obr. 1). Je charakterizován progresivní hyperglykémií (přes antidiabetickou terapii), je provázen snížením tělesné hmotnosti, objevuje se 2–3 roky před objevením lokálních symptomů a diagnózou AKP. Tyto skutečnosti vytvářejí určité diagnostické okénko, které se zatím nevyužívá.
Časná diagnostika AKP je naléhavý a přetrvávající problém. Dlouhodobým tématem je hledání biomarkerů s citlivostí a specificitou, která by posunula diagnostiku do časnější fáze onemocnění. Neosvědčilo se stanovení amylinu (islet amyloid polypeptide, IAPP), který inhibuje vychytávání glukózy a syntézu glykogenu v kosterním svalu. Jeho citlivost je ve srovnání s CA-19.9 nižší (40 % vs. 75 %) (21). Další dva působky, N-terminální peptid proteinu S-100 A8 a connexin 26, navržené na podkladě experimentálních nálezů, dosud nebyly testovány v klinických studiích (22, 23). Větší pozornost nevzbudily ani komparativní testy srovnávající podíl některých pankreatických hormonů a C-peptidu. Takto byl testován poměr proinzulin/C-peptid (24), IAPP/inzulin (25), glukagon/inzulin (26). Byla zjištěna také zvýšená hodnota podílu dalších hormonů (adiponektin/leptin) (27). Zvýšené hodnoty těchto komparativních testů nebyly vysvětleny. Možností je předpokládaná zvýšená aktivita povrchových proteáz (DPP-4, FAP-α) u těchto nemocných (28).
Poruk et al. (29) se zabývají velmi podrobně různými metodami screeningu karcinomu pankreatu. Hodnotí biomarkery současné a nové (miRNA, cirkulující nádorové buňky a hypermetylovaná DNA), zobrazovací metody a identifikaci významných prekanceróz (pankreatická intraepiteliální neoplazie a intraduktální papilární mucinózní neoplazie). Jejich screening pokročil podle autorů nejdále, neboť je vypracován určitý konsenzus (30). Pokud jde o sporadický karcinom pankreatu, soudí, že v současné době není k dispozici žádný biomarker s vysokou citlivostí a specificitou pro screening, který vnímají jako jednostupňovou metodu. Možnost využít časné symptomy pro screening AKP však neuvádějí.
Naproti tomu Lee et al. (31) na podkladě srovnání souboru 151 nemocných AKP s nově vzniklým diabetem a 302 nemocných s nově vzniklým diabetem bez AKP doporučuji screening AKP. Jeho kritéria stanovují takto: věk 65 roků a více, diabetes vzniklý v období předchozích 2 let, před onemocněním váhový úbytek více než 2 kg nebo BMI méně než 25 a negativní rodinná anamnéza diabetu. Tato kritéria umožnila odlišit v jejich souboru AKP s diabetem nedávno vniklým od nově vzniklého diabetu 2. typu (senzitivita 81% specificita 68%).
Obr. 1. Vývoj homeostázy glukózy (HOMA metoda) u nemocných s adenokarcinomem pankreatu (PAC) (podle Chari T, et al. Pancreatology 2005; 5: 229–233) BCF – funkce beta buněk, IR – inzulinová rezistence, gly – glykémie nalačno 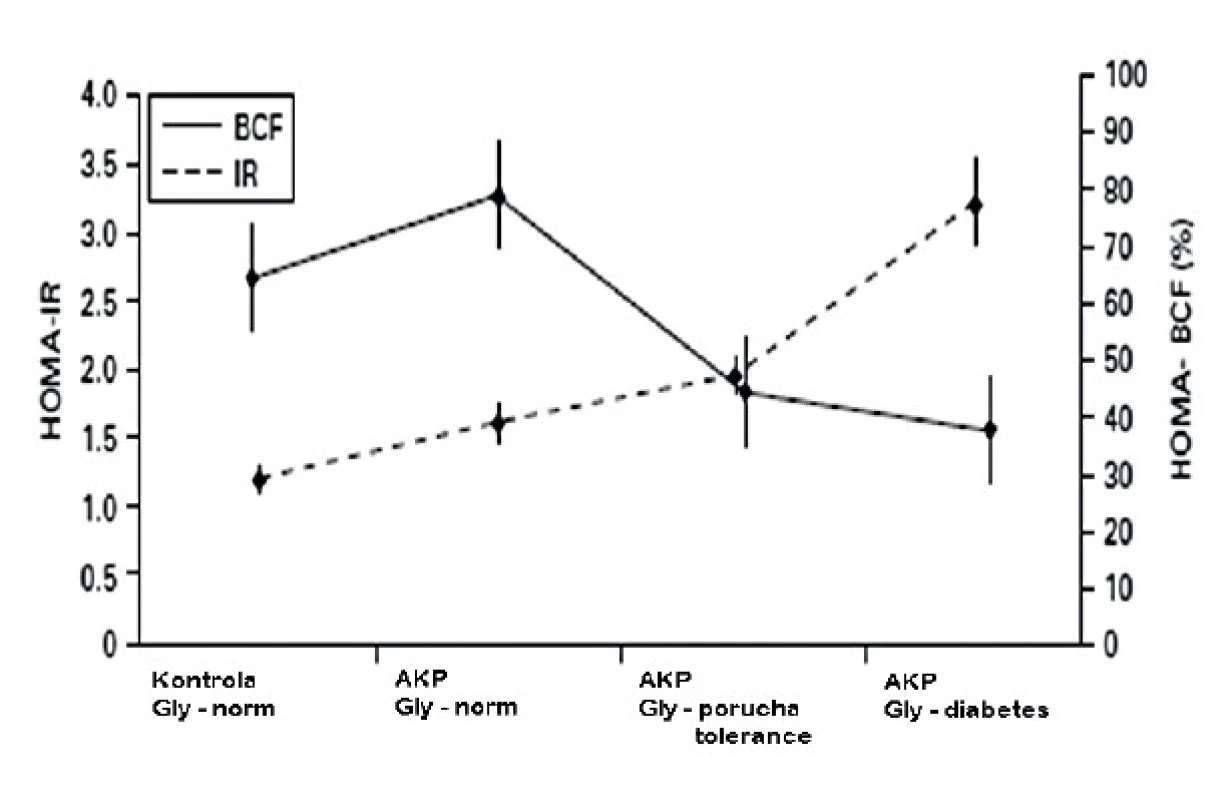
Návrh screeningového programu
Současný stav diagnostiky AKP je v řadě zemí včetně České republiky zcela neuspokojivý, neboť je založen na přítomnosti lokálních příznaků. Ty jsou projevem pokročilého onemocnění a u naprosté většiny pacientů nedovolují radikální chirurgickou terapii, která je jedinou šancí na významnější prodloužení života. Návrh screeningového programu aplikuje znalosti o časných symptomech tohoto onemocnění: 1. přítomnost recentního diabetu 2. typu u starších osob, 2. případný pokles THM již před jeho objevením, 3. atypická reakce na antidiabetickou terapii; hodnoty glykémie nalačno se neupravují nebo se dokonce zvyšují a THM se nezvyšuje, ale naopak klesá. Tento režim považujeme za vhodný pro obě pohlaví ve věku 55–75 roků. Dolní věkovou hranici doporučujeme ve srovnání s kritérii uvedenými Lee et al. (31) snížit, neboť předpokládáme zvýšený výskyt rizikových faktorů v české populaci (obezita, alkohol, kouření).
Obsahem první fáze programu je pouze častější kontrola glykémie nalačno a THM než dosud v prvních 2–3 letech od prvního stanovení kritérií diabetu. U osob splňujících výše uvedená kritéria doporučujeme vyloučit asymptomatický AKP prostřednictvím zobrazovacích metod (kontrastní CT břicha, endoskopická ultrasonografie), které tvoří další část programu. Klíčovými hráči v první etapě screeningového programu jsou praktičtí lékaři, kteří diagnostikují a sledují diabetiky 2. typu. Mezi nimi se totiž v současné době skrývají i pacienti s kombinovanou poruchou funkce β-buněk a zvýšenou periferní inzulinovou rezistencí, které jsou časnými symptomy AKP (AKP asociovaný diabetes). Doporučujeme, aby tento návrh byl považován za základ pro další jednání o realizaci programu. Gastroenterologové, specialisté dalších diagnostických oborů a chirurgové vstupují do programu v jeho druhé a dalších fázích. Základní program je odborně i finančně nenáročný, takže splňuje předpoklady výhodnosti v pojmech náklady-účinek a náklady-užitek. Proto předpokládáme i racionální přístup ministerstva zdravotnictví a zdravotních pojišťoven. Obě odborné společnosti angažované v základním programu se podílejí na probíhajících preventivních programech a systém veřejného zdravotnictví založený na principu solidarity vytvářejí základní podmínky pro širokou aplikaci tohoto návrhu screeningového programu, který může podle současných znalostí posunout diagnostiku AKP do časnější fáze s lepší perspektivou nemocných.
Seznam použitých zkratek
AKP adenokarcinom pankreatu
BMI body mass index
CA-19.9 carbohydrate antigen 19-9
CT computer tomography
DNA deoxyribonucleic acid
HMGA1 High Mobility Group AT-Hook 1
IAPP islet amyloid polypeptide
miRNA micro ribonucleic acid
RNA ribonucleic acid
THM tělesná hmotnost
Práce podpořena granty IGA ministerstva zdravotnictví ČR NT 13638 a MO 1012.
ADRESA PRO KORESPONDENCI:
MUDr. Bohuš Bunganič
Interní klinika 1. LF UK a ÚVN
Oddělení gastrointestinální endoskopie
Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha
U Vojenské nemocnice 1200, 169 02 Praha 6
e-mail: bohus.bunganic@uvn.cz
Zdroje
1. Schwarts SS, Zeidler A, Moossa AR, et al. A prospective study of glucose tolerance, insulin, C-peptide, and glucagon responses in patients with pancreatic carcinoma. Am J Dig Dis 1978; 23 : 1107–1014.
2. Cersosimo E, Pisters PW, Pesola G, et al. Insulin secretion and action in patients with pancreatic cancer. Cancer 1991; 67 : 486–493.
3. Permert J, Ihse I, Jorfeldt L, et al. Improved glucose metabolism after subtotal pancreatectomy for pancreatic cancer. Br J Surg 1993; 80 : 1047–1050.
4. Permert J, Adrian TE, Jacobsson P, et al. Is profound peripheral insulin resistance in patients with pancreatic cancer caused by a tumor associated factor? Am J Surg 1993; 165 : 61–66.
5. Gullo L, Pezilli R, Morselli-Labate AM, et al. Diabetes and the risk of pancreatic cancer. N Engl J Med 1994; 331 : 81–84.
6. Everhart J, Wright D. Diabetes mellitus as a risk factor for pancreatic cancer. A meta-analysis. JAMA 1995; 273 : 1605–1609.
7. Huxley R, Ansary-Moghaddam A, Berrington de González, et al. Type II diabetes in pancreatic cancer: a meta-analysis of 36 studies. Brit J Cancer 2005; 92 : 2076–2083.
8. Chari ST, Leibson CL, Rabe KG, et al. Probability of pancreatic cancer following diabetes: A population based study. Gastroenterology 2005; 129 : 504–511.
9. Pannala R, Basu A, Petersen GM, et al. New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer. Lancet Oncology 2009; 10 : 88–95.
10. Chari ST, Leibson CL, Rabe KG, et al. Pancreatic cancer-associated diabetes mellitus: prevalence and temporal association with diagnosis of cancer. Gastroenterology 2008; 134 : 95–101.
11. Pannala R, Leibson CL, Rabe KB, et al. Temporal association of changes in fasting glucose and body mass index with diagnosis of pancreatic cancer. Am J Gastroenterol 2009; 104 : 2318–2325.
12. Chari ST, Zapiach M, Yadav D, et al. Beta-cell function and insulin resistance evaluated by HOMA in pancreatic cancer subjects with varying degrees of glucose intolerance. Pancreatology 2005; 5 : 229–233.
13. Aggarwal G, Kamada P, Chari ST. Prevalence of diabetes mellitus in pancreatic cancer compared to common cancers. Pancreas 2013; 42 : 198–201.
14. Li C, Balluz LS, Ford ES, et al. Association between diagnosed diabetes and self-reported cancer among US. adults: Findings from the 2009 Behavorial Risk Factor Surveillance system. Diabetes Care 2011; 34 : 1365–1368.
15. Aggarwal G, Rabe KG, Petersen GM, et al. New-onset diabetes in pancreatic cancer: a study in the primary care setting. Pancreatology 2012; 12 : 156 : 161.
16. Li W, Yuan Y, Huang L, et al. Metformin alters expression profiles of microRNAs in human pancreatic cancer cells. Diabetes Res Clin Pract 2012; 96 : 187–195.
17. Aggarwal G, Ramachandran V, Javeed N, et al. Adrenomedullin is up-regulated in patients with pancreatic cancer and causes insulin resistance in β cells and mice. Gastroenterology 2012; 143 : 1510–1517.
18. Sah RP, Nagpal SJ, Mukhopadhyay, et al. New insights into pancreatic cancer-induced paraneoplastic diabetes. Nat Rev Gastroenterol Hepatol 2013; 10 : 423–433.
19. Li D, Morris JS, Liu J, et al. Body mass index, age of onset, and survival in patients with pancreatic cancer. JAMA 2009; 301 : 2553–2562.
20. Hart PA, Kamada P, Rabe KG, et al. Wight loss precedes cancer-specific symptoms in pancreatic cancer-associated diabetes mellitus. Pancreas 2011; 40 : 768–772.
21. Chari ST, Klee GG, Miller LJ, et al. Islet amyloid polypeptide is not a satisfactory marker for detecting pancreatic cancer. Gastroenterology 2001; 121 : 640–645.
22. Basso D, Greco E, Fogar P, et al. Pancreatic cancer – derived S-100A8 N-terminal peptide: a diabetes cause? Clin Chim Acta 2006; 372 : 120–128.
23. Pfeffer F, Koczan D, Adam U, et al. Expression of connexin26 in islets of Langerhans is associated with impaired glucose tolerance in patients with pancreatic adenocarcinoma. Pancreas 2004; 29 : 284–290.
24. Nakamori S, Ichikawa O, Ogihashi H, et al. Increased blood proinsulin and decreased C-peptide levels in patients with pancreatic cancer. Hepatogastroenterology 1999; 46 : 16–24.
25. Mäkimatilla S, Hietaniemi K, Timonen T, et al. In vivo glucose stimulated amylin secretion is increased in nondiabetic patients with pancreatic cancer. .Metabolism 2001; 50 : 1036–1042.
26. Kolb A, Rieder S, Born D, et al. Glucagon/insulin ratio as a potential biomarker for pancreatic cancer in patients with new-onset diabetes mellitus. Cancer Biol Ther 2009; 8 : 1527–1533.
27. Krechler T, Zeman M, Vecka M, et al. Leptin and adiponectin in pancreatic cancer: connection with diabetes mellitus. Neoplasma 2011; 58 : 58–64.
28. Frič P, Zavoral M. Early diagnosis of pancreatic adenocarcinoma. Role of stroma, surface proteases, and glucose-homeostatic agents. Pancreas 2012; 41 : 663–670.
29. Poruk KE, Firpo MA, Adler DG, et al. Screening for pancreatic cancer-why, how, and who? Annal Surg 2013; 257 : 17–26.
30. Tanaka M, Chari S, Adsay V, et al. International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology 2006; 6 : 17–32.
31. Lee JH, Kim SA, Park HY, et al. New-onset diabetes patients need pancreatic cancer screening? J Clin Gastroenterol 2012; 46: e58–61.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Adenokarcinom pankreatu – časné symptomy a screening
- Cenzura v medicíně a ztráta soudnosti
- Prevalence nadváhy, obezity a podváhy u sedmiletých dětí v České republice od roku 1951*
-
Je závažná obezita nepříznivým prognostickým faktorem u chřipkového zánětu plic?
Poučení z komplikujícího průběhu onemocnění H1N1 - PLÁNOVANÉ AKCE SLOŽEK ČLS JEP
- 140 let od narození prof. MUDr. Karla Weignera
- Onkochirurgické problematiky řešené na klinice plastické chirurgie 1. LF UK a Nemocnice Na Bulovce
- Genetika v klinické praxi
- UPCP 2014 (Up Close and Personalized) 3. mezinárodní kongres personalizované medicíny
- Profesor Jaroslav Koutecký osmdesátiletý
- Prof. Albert Stunkard, MD (1922–2014)
- Rejstříky
- Udělení cen České lékařské společnosti JEP za nejlepší publikace v roce 2013
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Adenokarcinom pankreatu – časné symptomy a screening
- Prevalence nadváhy, obezity a podváhy u sedmiletých dětí v České republice od roku 1951*
- 140 let od narození prof. MUDr. Karla Weignera
-
Je závažná obezita nepříznivým prognostickým faktorem u chřipkového zánětu plic?
Poučení z komplikujícího průběhu onemocnění H1N1
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



