-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
15 let zkušeností s biologickou léčbou zánětlivých revmatických onemocnění v národním registru ATTRA
15 years’ experience with biological therapy of inflammatory rheumatic diseases in Czech national register ATTRA
The publication is summarizing application of biological DMARDs in autoimmune inflammatory rheumatic diseases.
Up to now conventional therapy, which for example in rheumatoid arthritis was application of methotrexate (MTx) in combination with glucocorticoids, was effective, but the remission as a target was achieved in small proportion of patients and also there was little effect on structural progression of diseases. Biological therapy was great advance because response was achieved in ¾ patients who failed MTx. At present time 8 biological drugs are available. 5 are inhibitors of TNFα and 3 have different move of action. In psoriatic arthritis are beside TNF blockers available blocker of IL 17 (secukinumab, ustekinumab, apremilast). For ankylosing spondylitis is registered secukinumab.
Anti-TNF therapy is relative safe but rarely serious adverse events can occur. The most important are serious infections, opportunistic infections and tuberculosis. Other adverse event includes allergic reactions and local intolerance. Increase incidence of lymphomas was not confirmed. There is probably minimal increased risk of skin melanoma and non-melanoma tumors. Benefit/risk ratio is still very positive.
National registry of biological therapy ATTRA was founded 15 years ago and includes patients with rheumatoid arthritis, ankylosing spondylitis, psoriatic arthritis and juvenile idiopathic arthritis. In June 2016 over all 6800 patients with those diagnoses was included and actually 5194 have been treated. In registry patients are regularly followed for activity, efficacy of the drug and other events. Results of registry are sent payers for evaluations of pharmacologic parameters.Keywords:
biological therapy, registry, inflammatory rheumatic diseases
Autoři: Karel Pavelka; Liliana Šedová; Karel Hejduk; Ladislav Dušek
Působiště autorů: Institut biostatistiky a analýz MU ; Revmatologický ústav
Vyšlo v časopise: Čas. Lék. čes. 2016; 155: 285-293
Kategorie: Původní práce
Souhrn
Článek shrnuje zkušenosti s aplikací biologické léčby u autoimunitních zánětlivých revmatických onemocnění.
Dosavadní konvenční léčba, která například u revmatoidní artritidy znamenala většinou aplikaci methotrexátu v kombinaci s glukokortikoidy, sice byla účinná, ale žádoucího stavu, tzn. navození remise, bylo dosaženo jen zřídka a jen velmi málo tato terapie ovlivňovala strukturální progresi onemocnění. Velký pokrok přinesla biologická léčba, která u 3/4 pacientů s nedostatečným efektem methotrexátu dociluje odpovědi a zlepšení klinického stavu.
V současné době je k dispozici pro léčbu revmatoidní artritidy 8 biologických léků, přičemž 5 inhibuje anti-TNF a 3 mají jiný mechanismus účinku. U psoriatické artritidy jsou kromě anti-TNF blokátorů dostupné ještě blokátor IL-17 (secukinumab), blokátor IL-12 a 23 (ustekinumab) a inhibitor fosfodiesterázy 4 (apremilast). Pro léčbu ankylozující spondylitidy je registrován secukinumab.
Anti-TNF léčba je relativně bezpečná, ale vzácně se mohou vyskytnout i závažné nežádoucí účinky. Jde především závažnější infekce, oportunní infekce a tuberkulózu. Objevují se také případy alergických reakcí a lokální nesnášenlivosti. Zvýšený výskyt lymfomů se nepotvrdil. Pravděpodobné je minimální zvýšení rizika kožních, melanomových i nemelanomových nádorů. Poměr účinnost/riziko však zůstává vysoce pozitivní.Klíčová slova:
biologická léčba, registr, zánětlivá revmatická onemocněníÚvod
Zánětlivá autoimunitní onemocnění jsou systémové choroby spojené s imunitní dysregulací, jejichž etiologie však zatím není zcela objasněná. Nejčastějším onemocněním je revmatoidní artritida (RA), která postihuje asi 1 % populace (cca 100 000 pacientů v Česku), a výskyt spondyloartritid (SpA) se pohybuje v rozmezí 0,5−0,8 %. Tato onemocnění jsou příčinou výrazné morbidity i zvýšené mortality svých nositelů. Revmatoidní artritida např. zkracuje život pacientů o 6−10 let. Příčin je řada: zvýšené kardiovaskulární riziko (1), častější výskyt infekcí a nádorů, snížená fyzická aktivita, nežádoucí účinky léků (nesteroidních antirevmatik, glukokortikoidů, chorobu modifikujících léků, imunosupresiv). Revmatoidní artritida výrazně zhoršuje kvalitu života svých nositelů, značně snižuje funkční schopnosti a je příčinou neschopnosti pracovat krátkodobě i dlouhodobě; po 10 letech nemoci je až polovina pacientů v invalidním důchodu (2). Novější epidemiologické studie prokazují, že disabilita a zvýšené kardiovaskulární riziko je u nemocných se spondyloartritidami obdobná (3). Ekonomické dopady na společnost jsou proto enormní, a to jak v oblasti zdravotnické, tak sociální.
Nástup biologických preparátů a mechanismus jejich účinku
Naprosto zásadní změnu do léčby zánětlivých revmatických onemocnění přinesly tzv. biologické léky, které byly zavedeny do širší klinické praxe v roce 2000. V té době se k léčbě RA používaly především tzv. konvenční syntetické chorobu modifikující léky (csDMARD − conventional synthetic disease modifying antirheumatic drugs) v kombinaci s glukokortikoidy. Nejčastěji šlo o methotrexát (MTX), dále sulfasalazin, leflunomid a antimalarika; ostatní DMARD včetně solí zlata se už prakticky přestaly užívat. Efekt sDMARD byl však především symptomatický, navození remise bylo vzácné, potlačení zánětlivého procesu nedostatečné a se slabým ovlivněním rentgenové progrese. Navíc tolerance sDMARD není dlouhodobě dobrá a nezřídka vedla k přerušení léčby.
Biologické léky (bDMARD) jsou produkty živých buněk, zpravidla proteiny získané rekombinantní technologií. Jedná se nejčastěji o monoklonální protilátky nebo o konstrukty solubilních receptorů s imunoglobuliny. Vývoj bDMARD byl umožněn dvěma paralelními směry výzkumu. Na jedné straně hlubším pochopením imunopatologického děje u autoimunitních onemocnění a identifikací možných cílů léčby (tzv. targets), na druhé straně možnostmi genetického inženýrství tyto léky vyrobit.
Jako nejvýznamnější cytokin zodpovědný za chronický zánětlivý kloubní proces byl identifikován tumor nekrotizující faktor alfa (TNF-α). Blokáda TNF monoklonálními protilátkami nebo solubilním receptorem prokázala výrazný protizánětlivý a imunosupresivní účinek u zvířecích modelů RA a později ve všech fázích klinického hodnocení (4). Proto byla v roce 1999 registrována regulačními agenturami pro léčbu revmatoidní artritidy a později i spondyloartritid (5). V další dekádě pak byly registrovány další tři biologické léky s odlišným mechanismem účinku, konkrétně s vlivem na depleci B buněk, ovlivněním kostimulace aktivace T lymfocytů a inhibicí aktivity receptoru pro interleukin 6. V současné době je tedy registrováno a k dispozici pro běžnou klinickou praxi 8 biologických léků (viz tab. 1).
Tab. 1. Biologické léky registrované v České republice pro léčbu revmatických onemocnění 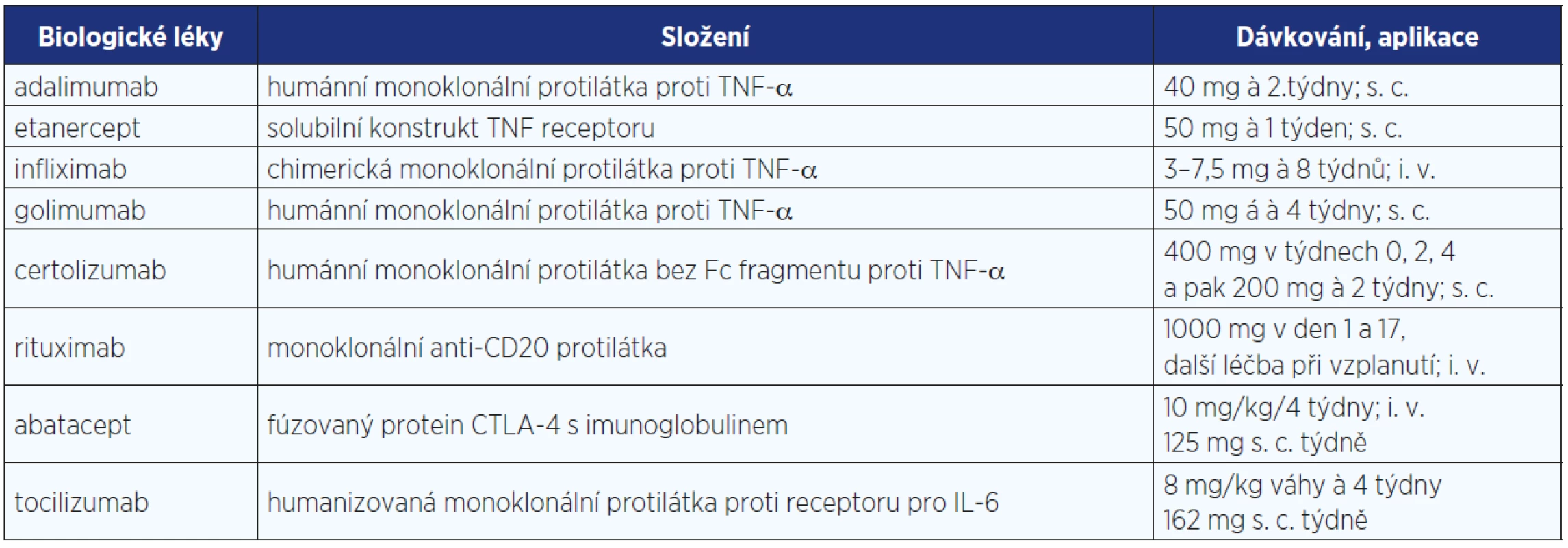
Biologické léky jsou účinnější v kombinaci s MTX než MTX samotný a častěji navozují remisi a zlepšení kvality života. Navíc zpomalují až zastavují rentgenovou progresi RA a tím i s ní spojenou disabilitu (6). U pacientů s nedostatečným efektem MTX jsou schopny v 70−80 % případů navodit odpověď na léčbu a docílit stavu nízké aktivity či remise (7).
Význam registrů biologické léčby
Účinnost biologických léků byla prokázána ve stovkách randomizovaných, klinických studií (RCT), otevřených dlouhodobých prodloužení těchto studií, dále pak v observačních studiích. Zvláštní význam však byl kladen od začátku na výsledky z registrů biologické léčby. Registry byly silně doporučeny Evropskou lékovou agenturou (EMA) především z důvodu získávání bezpečnostních dat o léčbě, která je sice na straně jedné silně účinná, ale tím, že zasahuje do imunitního procesu, může vyvolávat i potenciálně závažné nežádoucí účinky (viz tab. 2). Bylo přitom jasné, že data z RCT dostupná v době registrace léku nemohou dát stoprocentní odpověď na všechny otázky − jako příklad může sloužit výskyt nádorů při biologické léčbě, což vyžaduje desetiletá data a soubory o desítkách tisíc pacientů.
Tab. 2. Nežádoucí účinky při anti-TNF léčbě 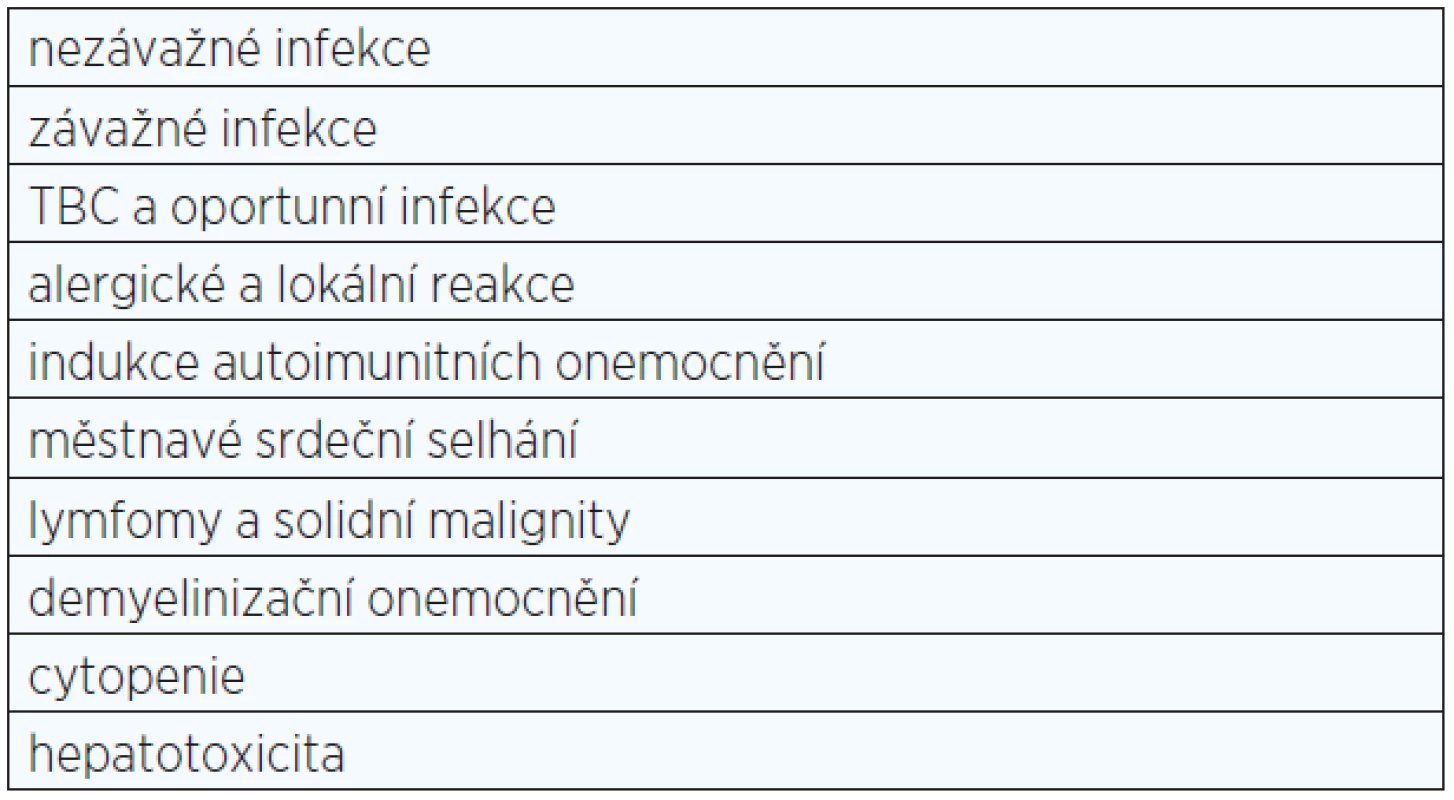
Užitečnost registrů se ukázala poměrně brzy. Z analýzy registrů vyplynulo, že aplikace anti-TNF léčby zvyšuje riziko vzniku tuberkulózy (buď aktivace latentní TBC, nebo vznik nového onemocnění). Toto riziko nebylo v době registrace uváděno. Začalo být evidentní, že registry přinášejí významná doplňující data k výsledkům RCT. Zatímco pro průkaz účinnosti léčby jsou důležitější data z RCT, zlatým standardem pro hodnocení bezpečnosti jsou data z velkých registrů.
RCT jsou sice nejdůležitější komponentou dokladů o účinnosti léčby a tím i pilířem medicíny založené na důkazech, ale v oblasti bezpečnosti mají své limity: omezený počet pacientů, velmi přísná vstupní kritéria, řadu vylučujících kritérií a omezenou dobu léčby. Jako příklad lze uvést věkové kritérium – řada RCT má horní limit pro vstup do studie 65 let, ale v reálné klinické praxi je mnoho pacientů starších, přičemž bezpečnostní data u těchto nemocných nejsou známa. Ze studií bývají vyloučeni i pacienti s řadou komorbidit, kteří jsou pak ale v reálné praxi léčeni.
Na druhé straně je třeba si uvědomit rovněž limitace registrů. Jde v principu o otevřené, nerandomizované, observační studie. Skupiny pacientů nemusejí být srovnatelné a uvádění zvláště komparativních výsledků musí být velmi obezřetné. Je možné uvést příklad: jestliže vznikne dojem, že výskyt nádorů je nižší po léku A než po léku B, jsou pacienti s anamnézou či rizikem nádoru zaváděni na lék A, který pak může mít paradoxně v dlouhodobém sledování horší výsledky.
Většina registrů biologické léčby v západní Evropě vznikla na začátku nového tisíciletí a zpočátku se týkaly především RA; registry se SpA vznikaly o 3−5 let později. Tři největší registry v Evropě fungují v Německu (RABBIT), Velké Británii (BSRBR) a Švédsku (ARTIS); nejdůležitější bezpečnostní data např. o výskytu lymfomů při léčbě pocházejí právě z těchto registrů, přičemž někdy dochází i k metaanalýze prvotních dat. Metodologicky skvěle vedené jsou rovněž registry v Dánsku (DANBIO) a v USA (CORRONA).
Český národní registr ATTRA
Český národní registr vznikl v roce 2001, a to iniciativou výboru České revmatologické společnosti ČLS JEP (ČRS), která je dodnes jeho majitelem a provozovatelem. Při formulaci cílů registru a jeho praktické realizace se konalo několik kulatých stolů, kde kromě členů výboru odborné společnosti zasedli i zástupci české lékové agentury (SÚKL), plátců (pojišťoven) a ministerstva zdravotnictví. Velmi šťastným rozhodnutím bylo pověřit vedením registru Institut biostatistiky a analýz Masarykovy univerzity v Brně, který má s vedením registrů v Česku největší zkušenosti a disponuje i velmi kvalitním analytickým týmem. Registr byl nazván ATTRA (Anti-TNF Therapy of RA).
Motivace k založení registru ATTRA byly podobné jako u jiných – získávání dlouhodobých dat o účinnosti a bezpečnosti léčby. Na rozdíl od jiných registrů jsme se od začátku více soustředili na účinnost léčby a zavedli nadstandardní množství sledovaných ukazatelů účinnosti, což nám umožnilo odpovídat i na otázky ohledně predikce úspěšnosti léčby, vytipovat pacienty s větší šancí na terapeutickou odpověď a získat řadu farmakoekonomických dat. Protože biologická léčba je stále poměrně drahá, tato data se v podmínkách slabší české ekonomiky (v porovnání se západní Evropou a USA) stala významným zdrojem informací pro pojišťovny, kterým je každoročně předávána analýza účinnosti léčby.
Na začátku práce s registrem bylo nutné provést některé zásadní kroky:
- Bylo nutné publikovat doporučení pro léčbu RA (a později i PsA a SpA), podle kterých budou pacienti léčeni, zaváděni do registru a také hrazeni (8). V doporučeních ČRS jsou uvedeny indikace k terapii, sledování odpovědi na léčbu, intervaly sledování, dávky léků, vhodnost komedikace a definovány nežádoucí účinky (viz tab. 3). Indikovaní k léčbě jsou pacienti s RA s vysokou aktivitou nemoci (definovanou jako DAS28 > 5,1), kteří selhali na léčbě MTX v maximální tolerované dávce (25 mg týdně) nebo alternativně jiným sDMARDs po 3−6 měsících léčby. Odpovědí na léčbu má být pokles DAS28 o > 1,2. Tato kritéria přijal SÚKL a jsou platná dodnes, přestože již zcela neodpovídají současným mezinárodním standardům (např. doporučení EULAR) (9) ani inovovaným doporučením ČRS včetně doporučení pro monitorování bezpečnosti bDMARDs (10). V čem především tedy nevyhovují? Zaprvé jsou indikováni stále jen pacienti s vysokou aktivitou nemoci (DAS28 > 5,1), přičemž nemocní se střední aktivitou (DAS28 3,2−5,1) tuto léčbu dostat nemohou, přestože bylo prokázáno, že i oni jsou ohroženi vysokým rizikem strukturální progrese a anti-TNF léčba dosahuje lepších výsledků (počet remisí) u této skupiny častěji než u skupiny s vysokou aktivitou. Navrhované snížení prahu aktivity pro RA na 3,9 zatím nebylo akceptováno. Druhým problémem je hodnocení odpovědi na léčbu. V původních kritériích bylo pouze snížení aktivity DAS28 o 1,2, takže např. pacient s iniciálním DAS28 7,5 je při poklesu na 5,5 úspěšně léčen, přestože zůstává ve stavu vysoké aktivity. Aktuálně je nejdůležitějším principem léčby RA navození stavu remise či stavu nízké aktivity, formulované v principu „léčba k cíli“ (treat to target) (12). Jinak řečeno, cílem je dosažení určitého stavu a nikoli změna o určitou hodnotu. V praxi to znamená regulérní hodnocení aktivity v určitých intervalech a v případě nedosažení odpovědi změnu (adjustaci) léčby, kterou může být mimo jiné i změna biologické terapie, výše dávky, intervalu léčby a podobně.
- Druhou podmínkou pro zahájení činnosti registru bylo definování center biologické léčby. Plátci původně souhlasili s 6 centry při univerzitních a velkých nemocnicích, kde byly k dispozici největší kohorty pacientů, nejvíce zkušených specialistů a zázemí pro vedení centra. Postupně se počet center zvyšoval, protože se ukázalo, že pohybově hendikepovaní pacienti nemohou za léčbou dojíždět na velké vzdálenosti. Je třeba zdůraznit, že výbor ČRS může pouze doporučit, rozhodující je uzavření zvláštní smlouvy s pojišťovnami. Výbor ČRS se snaží dávat taková doporučení, aby kvalita léčby byla optimální a využití finančních prostředků co nejefektivnější. V současné době je činných 27 center biologické léčby pro dospělé a 3 pro dětské pacienty. Při hodnocení žádostí o nové centrum výbor hodnotí především následující aspekty: kvalifikace žadatele (samozřejmě nejvyšší kvalifikace v oboru, zkušenosti z praxe, účast na kontinuálním vzdělávání pasivní i aktivní, participace v projektech, jazykové schopnosti, ochota spolupracovat v síti atd.), dále pak vybavení zařízení (prostory pro i. v. aplikaci, schopnost zvládat akutní, život ohrožující infuzní a alergické situace, přítomnost vzdělané specializované sestry, schopnost vést elektronické dotazníky v registru). Druhým aspektem je regionální potřebnost centra. Rozložení center bohužel není optimální, protože nastala určitá živelnost při jejich schvalování. Víme o oblastech, kde by bylo vhodné zřídit nová centra: pouze 1 centrum je v Jihočeském kraji, vhodné by bylo centrum na Karlovarsku, Děčínsku, Vysočině a v Praze (zde pouze 3 centra). Předpokládáme pomalý nárůst center k počtu 50−60 do 5 let. Výhodná by byla větší angažovanost MZ při organizaci centrové péče v revmatologii, např. uvedením center do vyhlášky, o čemž v současné době jednáme.
Tab. 3. Indikační kritéria ČRS pro iniciaci anti TNF léčby <em>(dle: Pavelka K, Vencovský J. Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Česká revmatologie 2010; 18: 182–191)</em> 
Výsledky léčby
Revmatoidní artritida
Do registru bylo v letech 2001−2016 zařazeno celkem 3402 pacientů (viz obr. 1), přičemž aktivně je jich léčeno 2669. V posledních 5 letech vidíme celkem rovnoměrný nárůst, v průměru 326 pacientů ročně. Aktuálně je v léčbě RA nejvíce používán adalimumab (25,8 %), dále etanercept (19,6 %), tocilizumab (12 %), certolizumab (9,7 %), rituximab (9,7 %), golimumab (8,9 %) a abatacept (6,0 %). Originální infliximab má zastoupení 4,5 % a biosimilární infliximab 3,9 %.
Obr. 1. Přehled počtu záznamů v registru ATTRA-RA 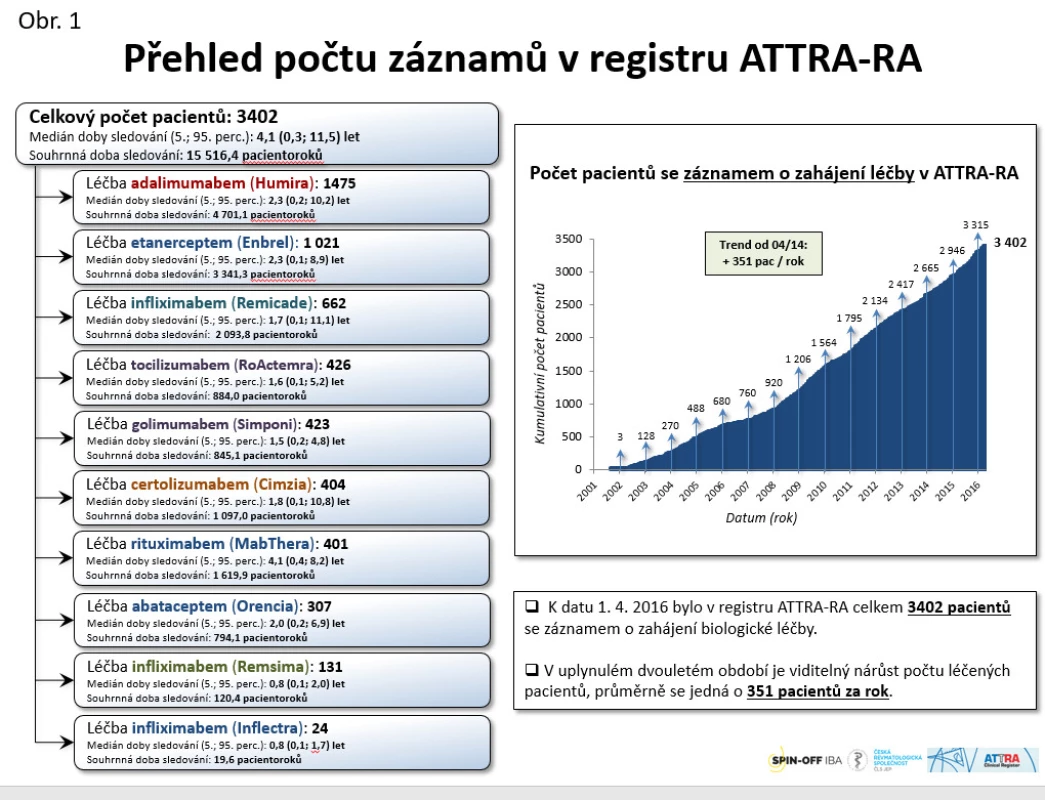
Biologická léčba je velmi účinná. Při analýze 831 pacientů byl zjištěn po roce léčby pokles průměrného DAS 28 z 6,4 na 3,8 po roce léčby (p < 0,001) a průměrného CRP z 19,0 na 4,0 mg/l (p < 0,001) (11). Odpovědi na léčbu dle EULAR dosahuje až kolem 80 % pacientů. Remise a stavu nízké aktivity dosaženo u 62,6 % pacientů (viz obr. 2). Docházelo k velmi výraznému zlepšení kvality života, když byly signifikantně ovlivněny všechny domény dotazníku SF-36, a v některých doménách (např. duševního zdraví) bylo dokonce dosaženo věkově standardizovaných hodnot vzorku všeobecné české populace (viz obr. 3). Na menším vzorku populace jsme také prokázali zpomalení rentgenové progrese RA, když ve skupině léčené anti-TNF byla progrese rentgenového skóre dle Larsena během 2 let 0,39 + 1,06 vs. 1,98 + 1,98 (p = 0,029) (12). Byly také zkoumány prediktivní faktory odpovědi na léčbu anti-TNF preparáty. Mezi faktory, které pozitivně predikovaly terapeutickou odpověď, byly věk < 35 let, trvání nemoci < 10 let, počáteční DAS 28 < 4,5 a aplikace etanerceptu oproti monoklonálním protilátkám. Faktory, které neměly prediktivní význam, byly pozitivita revmatoidních faktorů a současná léčba methotrexátem (13).
Obr. 2. Účinnost biologické léčby: dosažení remise a nízké aktivity onemocnění 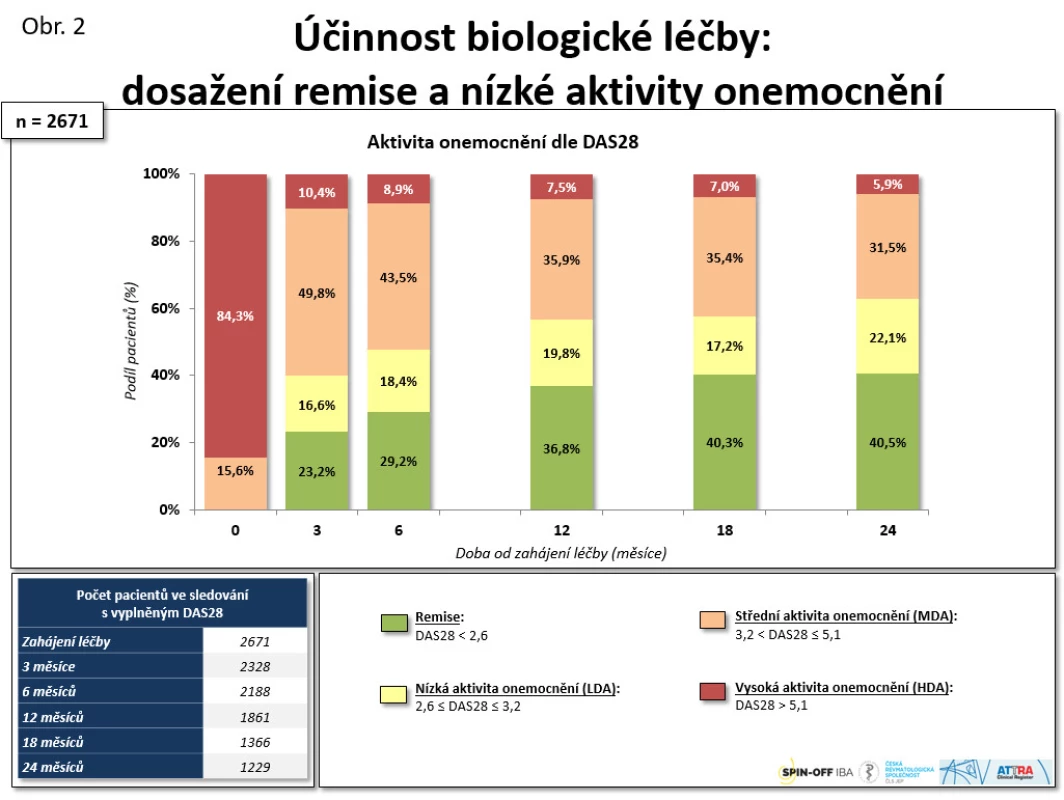
Obr. 3. Srovnání jednotlivých domén SF-36 u pacientů s RA s obecnou populací ČR před a po léčbě 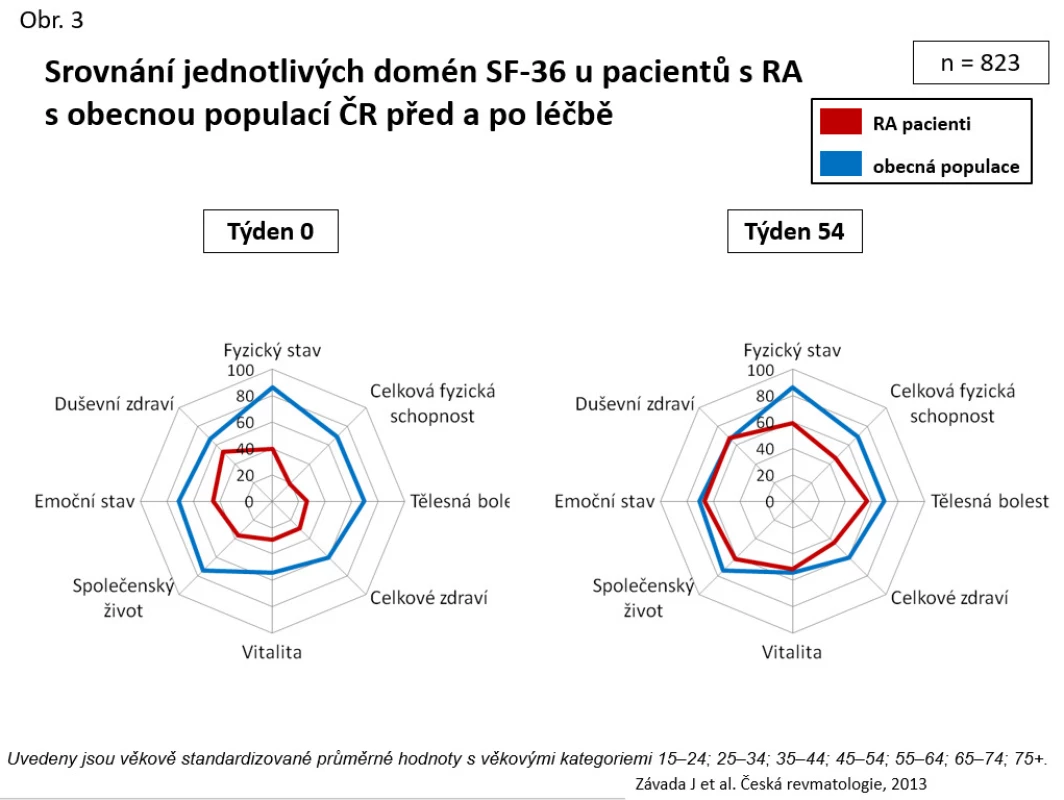
U části nemocných s RA léčených anti-TNF preparátem nedochází k dosažení terapeutického cíle. Jednou z možností jak postupovat u těchto pacientů je zvýšení dávky anti-TNF preparátu, přičemž nejčastěji byl tento postup navrhován u infliximabu, kde je doporučované dávkové rozmezí 3−7,5 mg/kg à 8 týdnů i. v. Prokázali jsme však v randomizované studii, že při nedostatečném efektu dávky 3 mg/kg zvýšení dávky na 5 mg/kg nepřináší významné zlepšení (14). Proto je u těchto pacientů vhodnějším postupem změnit biologický lék (tzv. switching).
Dalším biologickým lékem, u kterého byly hodnoceny prediktivní faktory odpovědi, byl tocilizumab. Jediným prediktivním faktorem odpovědi byl počet oteklých kloubů na začátku léčby. Nebyl rozdíl v účinnosti léčby monoterapií tocilizumabem a kombinaci tocilizumabu s DMARD (14). Na základě těchto výsledků bylo doporučeno používat v nutné monoterapii bDMARD jako lék první volby právě tocilizumab. Dalším biologickým lékem s jiným mechanismem účinku než anti-TNF byl abatacept. Bylo prokázáno dobré přežívání na léčbě, když po roce terapie v ní stále pokračovalo 82 % pacientů. Remise bylo dosaženo pouze v 21 % případů, což je ve 2. linii a vysoké vstupní aktivitě obvyklé (15).
Výsledky z registru ATTRA byly také zařazeny a zveřejněny v rámci mezinárodní spolupráce CERERRA. Zde se spojilo k analýze celkem 10 evropských registrů. Byla publikována řada důležitých výstupů. Prvním z nich bylo zjištění, že účinnost rituximabu je lepší u pacientů s pozitivitou revmatoidních faktorů nebo anti-CCP protilátek, eventuálně při dvojité pozitivitě (16) (viz obr. 4). Dalším zjištěním z analýzy CERRERA byl fakt, že účinnost leflunomidu v kombinaci s rituximabem byla větší než v kombinaci s MTX (17).
Obr. 4. Srovnání účinnosti rituximabu u pacientů s pozitivními a negativními protilátkami u revmatoidní artritidy (dle: Chatcizionysiu et al., 2011 [16]) ![Srovnání účinnosti rituximabu u pacientů s pozitivními a negativními protilátkami u revmatoidní artritidy (dle: Chatcizionysiu et al., 2011 [16])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/9552d623e81c91e7b83835b0b8939084.jpg)
Při biologické léčbě mohou vznikat také nežádoucí účinky, které jsou uvedeny v tab. 3. V našem sledování jsme se věnovali především vzniku závažných infekcí. V prvních letech fungování registru jsme zaznamenali řadu případů vzniku tuberkulózy. Po zavedení přísných screeningových vyšetření k vyloučení latentní tuberkulózy její výskyt dramaticky poklesl. Při sledování výskytu závažných infekcí jsme zjistili hraničně vyšší výskyt závažných infekcí u pacientů s RA než u AS a PsA (2,5 vs. 1,3 vs. 1,5 %; p = 0,067). Nebyly zjištěny významné rozdíly ve výskytu infekcí mezi jednotlivými anti-TNF preparáty (18). Nebyly také zjištěny signifikantní rozdíly ve výskytu herpes zoster mezi jednotlivými preparáty.
Byl sledován i výskyt dalších závažných nežádoucích efektů, jako jsou nádory, oportunní infekce, autoimunitní a neurologická onemocnění. Nebyl zaznamenán žádný nový signál oproti známým výskytům z klinických hodnocení a registrů, ale zde je nutno vidět limitace registru ATTRA, který není dostatečně velký k validnímu vyhodnocení těchto řídkých jevů a především nemá kontrolní skupinu.
Ankylozující spondylitida
Do registru ATTRA AS bylo v letech 2004−2016 zařazeno celkem 2207 pacientů. V posledních 3 letech je ročně zařazováno 244 nových pacientů. Aktuálně je léčeno celkem 1935 pacientů. Nejčastěji zařazovaným preparátem je adalimumab (36,2 %), dále etanercept (23,4 %) a golimumab (18 %), podíl biosimilars činil v polovině minulého roku asi 5 %.
Výsledky z registru ATTRA potvrzují data z RCT, když dochází k významnému, rychlému, ale I dlouhodobému poklesu všech ukazatelů aktivity: např. u ukazatele BASDAI z iniciální průměrné hodnoty 6,6 na 2,1 a u CRP z iniciální hodnoty 23,1 na 4,5 mg/l po roce léčby (viz obr. 5).
Obr. 5. ATTRA – účinnost léčby během 24 měsíců: BASDAI, CRP a aktivita nemoci 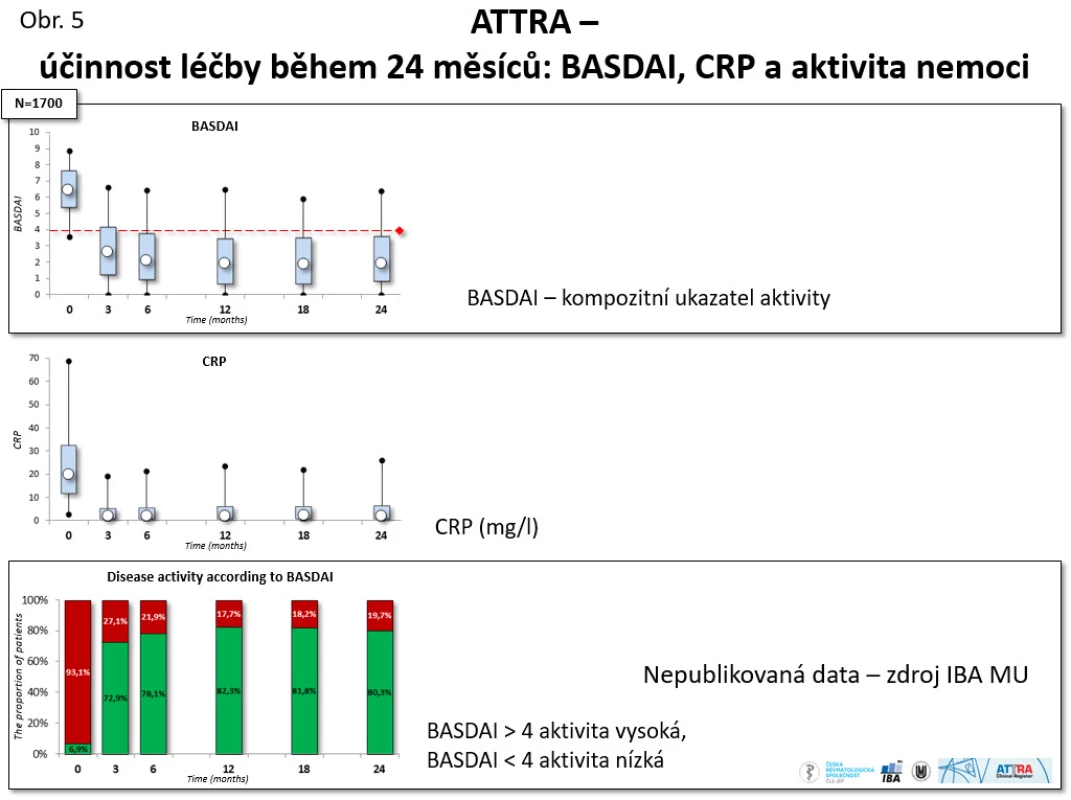
Při léčbě pomocí anti-TNF také docházelo k významnému zlepšení všech dimenzí kvality života, přičemž poměrné zlepšení kvality života u AS bylo významnější než u RA. Vyhodnocovali jsme např. účinnost druhého anti-TNF po selhání prvního anti-TNF (tzv. switching). Účinnost druhého anti-TNF je velmi dobrá, i když slabší než u anti-TNF prvního, a rovněž přežívání na léčbě u druhého anti-TNF je kratší než po prvním anti-TNF (81 vs. 92 % po roce léčby, 48 vs. 78 % po 4 letech léčby (19).
Velmi významná data byla získána při sledování práceschopnosti u nemocných s AS. Během 2 let léčby pomocí anti-TNF došlo k obnovení práceschopnosti u 44,4 % pacientů, u 14,1 % naopak došlo ke ztrátě. Došlo tedy k 30 % navýšení schopnosti pracovat, což má obrovský farmakoekonomický význam a zasluhuje další analýzu (viz obr. 6).
Obr. 6. Účinnost biologické léčby: práceschopnost pacientů 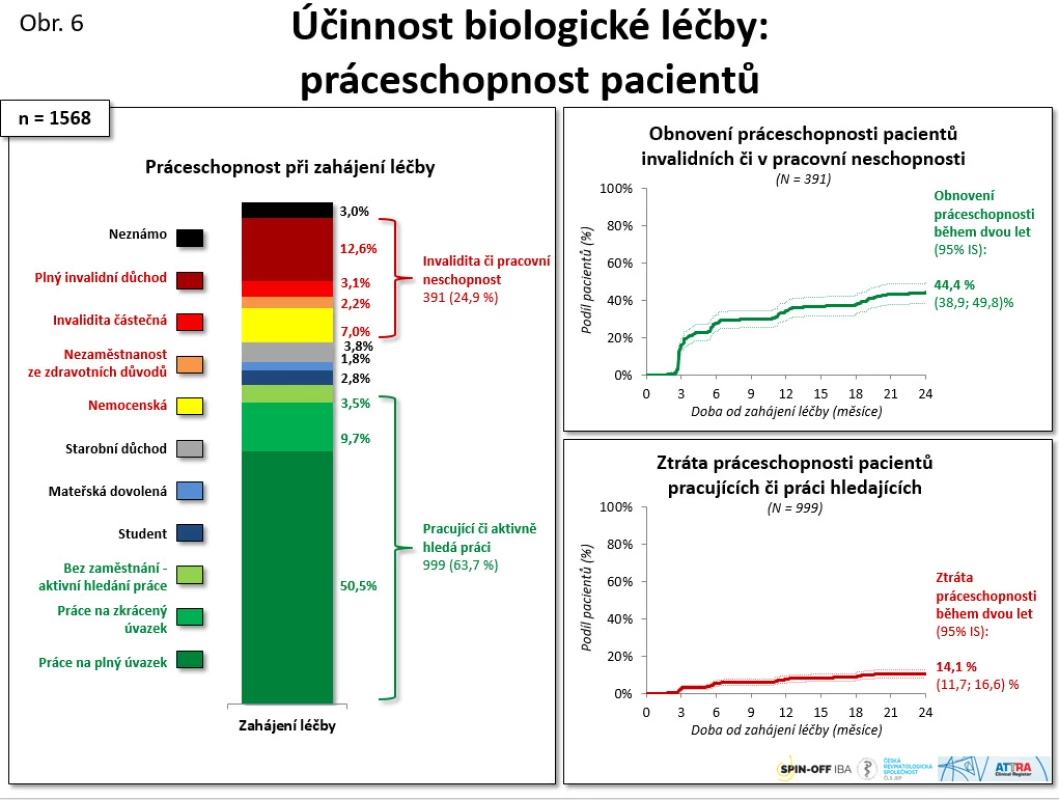
Další důležitou otázkou, které jsme se věnovali, byl problém, jak postupovat v dlouhodobé léčbě u pacientů s AS, u kterých bylo dosaženo remise nebo stavu nízké aktivity. Z praxe a literatury je známo, že po vysazení biologické léčby u AS dochází poměrně rychle až u 80 % pacientů ke vzplanutí aktivity nemoci. Vyslovili jsme tedy hypotézu, že optimálním řešením nebude vysazení anti-TNF, nýbrž redukce dávky či prodloužení intervalu aplikace anti-TNF. Podařilo se nám v otevřené, ale randomizované studii prokázat, že při snížení dávky (průměrně o 40 %) nedochází u pacientů v remisi ke vzplanutí aktivity onemocnění. Náklady na léčbu se ovšem výrazně snižují (20).
Psoriatická artritida
Do registru bylo v období 2004−2015 zařazeno celkem 708 pacientů, přičemž aktivně je jich léčeno 590. Souhrnná doba sledování za toto období činí 2737 pacientoroků. V posledních letech vidíme celkem rovnoměrný nárůst, 98 pacientů ročně. Procentuálně nejvíce bylo pacientů na adalimumabu (38,8 %), etanerceptu (24,2 %) a golimumabu (16,6 %). Biosimilární infliximab byl nasazen jako první lék v 5,6 % případů.
Účinnost biologické léčby byla i u této diagnózy vysoká. Při analýze 547 pacientů byl po roce léčby pokles průměrného DAS28 z 5,2 na 2,4 po roce léčby (p < 0,001). Dobré odpovědi na terapii dle EULAR dosahuje po 1 roce přes 75 % pacientů a střední odpovědi přes 17 %. Jen 7 % pacientů neodpovídá na první preparát a je třeba „switchovat“ na jiný. Docházelo k výraznému zlepšení kvality života ve všech doménách dotazníku SF-36 a v některých doménách např. duševního zdraví bylo stejně jako u pacientů s revmatoidní artritidou dosaženo věkově standardizovaných hodnot vzorku všeobecné české populace, a to i přesto, že přes 61 % nemocných mělo nejen kloubní, ale i kožní postižení, přičemž 56 % z nich mělo postižení středně těžké až závažné.
Mezi další sledované parametry v registru ATTRA patří invalidita a práceschopnost. K obnovení práceschopnosti došlo u 30 % ze 150 pacientů invalidních či v pracovní neschopnosti.
Závěr
Registr ATTRA je jediným plně funkčním registrem biologické léčby u zánětlivých revmatických onemocnění v zemích bývalého východního bloku. Přináší cenné výsledky o účinnosti a bezpečnosti biologické léčby v běžné klinické praxi. Je ceněn i v zahraničí, protože cílová léčená populace se od západní populace liší v řadě aspektů, jako je vstupní aktivita, předcházející léčba, dále jsou zde rozdíly např. v dostupnosti biologik, místních formách úhrady, znalostech lékařů a epidemiologické situaci např. z hlediska výskytu tuberkulózy, která je navíc nyní modifikována zvýšenou migrací.
Výsledky ukazují, že léčba biologickými léky je dlouhodobě účinná, ovlivňuje symptomy, jako je bolest a ztuhlost, ale i další aspekty kvality života.
Řada poznatků z ATTRA pomohla k lepší definici pacientů s větší pravděpodobností léčebné odpovědi. Dále pomohla definovat strategie léčby, jako je switching a deeskalace dávky, nebo úlohu komedikace DMARDs s biologickými léky. Dále byla získána data, která potvrzují, že léčba anti-TNF je přes svoji vysokou cenu farmakoekonomicky výhodná, protože výrazně snižuje nepřímé náklady na tato závažná, chronická a invalidizující onemocnění. Výsledky léčby ukazují zvýšení práceschopnosti pacientů s AS až o 30 %, u AS jsou postiženi především mladší muži, a proto zpravidla tento ukazatel bývá ovlivněn anti-TNF terapií více.
Výsledky léčby z registrů mají vždy své limitace, které je nutné si uvědomovat při interpretaci výsledků. Jde o otevřené klinické observační studie. Opatrně je nutné interpretovat například srovnávací data mezi jednotlivými léky, protože při zavádění pacientů na jednotlivé preparáty mohou existovat rozdíly, takže jednotlivé kohorty nemusejí být identické. Problémem mohou být rovněž chybějící data. Nicméně při porovnávání údajů z databází pojišťoven a z ATTRA byla získána významná shoda, která ATTRA hodnotí jako jeden z nejlepších registrů v Česku.
Poděkování:
Podpořeno projektem Ministerstva zdravotnictví ČR − koncepční rozvoj výzkumné organizace 023728 (Revmatologický ústav)
Adresa pro korespondenci:
prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav
Revmatologická klinika 1. LF UK
Na Slupi 4
128 50 Praha 2
Tel.: 234 075 111
e-mail: pavelka@revma.cz
Zdroje
1. Pincus T, Callahan LF, Sale WG et al. Severe functional declines, work disability and increased mortality in seventy-five rheumatoid arthritis patients studied over nine years. Arthritis Rheum 1984; 27 : 864–872.
2. Lundkvist J, Kasteng F, Kobelt G. The burden of rheumatoid arthritis and access to treatment: health burden and costs. Eur J Health Econ 2008; 8(Suppl: 2): S49–S60.
3. Szabo SM, Levy AR, Sao SR et al. Increased risk of cardiovascular and cerebrovascular diseases in individuals with ankylosing spondylitis: a population-based study. Arthritis Rheum 2011; 63 : 3294–3304.
4. Nam J, Ramiro S, Gaujox-Viala C et al. Efficacy of biological disease modifying antirheumatic drugs: A systematic literature review informing the 2013 update of the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis 2014; 73 : 516–528.
5. Zochling J, van der Heijde D, Vargas RB et al. ASAS/EULAR recommendations for the management of ankylosing spondylitis. Ann Rheum Dis 2006; 65 : 442–452.
6. Pavelka K, Gatterová J, Tegzová D et al. Radiographic progression of rheumatoid arthritis in patients from the Czech National Registry receiving infliximab treatment. Clin Exp Rheumatol 2007; 25 : 540–545.
7. Wolfe F, Boers M, Felson D. Remission in rheumatoid arthritis, physician and patient perspectives. J Rheumatol 2009; 36 : 930–933.
8. Pavelka K, Vencovský J. Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Česká revmatologie 2010; 18 : 182–191.
9. Smolen JS, Landewé R, Breedveld FC et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann Rheum Dis 2014; 73(3): 492–509.
10. Šedová L, Štolfa J, Horák P, Pavelka K. Doporučení České revmatologické společnosti pro monitorování bezpečnosti léčby revmatoidní artritidy. Česká revmatologie 2009; 17(1): 4–15.
11. Závada J, Uher M, Hejduk K et al. Zdravím podmíněná kvalita života u pacientů s revmatoidní artritidou v průběhu prvního roku anti-TNF léčby. Česká revmatologie 2013; 21(3): 123–130.
12. Pavelka K, Gatterová J, Vencovský L et al. Rentgenová progrese revmatoidní artritidy v běžné klinické praxi – výsledky z českého registru ATTRA. Rheumatologia 2009; 23(1): 7–11.
13. Pavelka K, Chroust k, Němec P. Faktory ovlivňující účinnost anti-TNF terapie v klinické praxi: zkušenosti z národního registru ATTRA. Česká revmatologie 2014; 22(4): 115–123.
14. Pavelka K, Hejduk K, Mann H. Jaké jsou prediktivní faktory odpovědi na léčbu tocilizumabem v běžné klinické praxi? Zkušenosti z Českého národního registru ATTRA. Česká revmatologie 2013; 21(3): 132–139.
15. Horák P, Skácelová M, Hejduk K. Abatacept and its use in the treatment of rheumatoid arthritis (RA) in the Czech Republic – data from the ATTRA registry. Clin Rheumatol 2013; 32 : 1451–1458.
16. Chatzidionysiu K, Lie E, Nasonov E et al. Highest clinical effectiveness of rituximab in autoantibody-positive patients with rheumatoid arthritis and in those for whom no more than one previous TNF antagonist has failed: pooled data from 10 European registries. Ann Rheum Dis 2011; 70 : 1575–1580.
17. Chatzidionysiu K, Lie E, Nasonov E et al. Effectiveness of disease - modifying antirheumatic drug co-therapy with methotrexate and leflunomide in rituximab-treated rheumatoid arthritis patients: results of a 1-year follow-up study from the CERERRA collaboration. Ann Rheum Dis 2012; 71 : 374–377.
18. Šléglová O, Burešová L, Vencovský J, Pavelka K. Výskyt infekcí při léčbě antagonisty TNF alfa v registru ATTRA. Česká revmatologie 2011; 19(2): 86–91.
19. Pavelka K, Fojtíková M, Hejduk K. Efficacy of the first and subsequent courses of anti-TNF therapy in patients with ankylosing spondylitis – results from the Czech National Registr ATTRA. Rheumatologia 2012; 50(4): 294–306.
20. Závada J, Uher M, Sisol K et al. A tailored approach to reduce dose of anti TNF drugs may be equally effective, but substantially less costly than standard dosing in patients with ankylosing spondylitis over 1 year: a propensity score-matched cohort study. Ann Rheum Dis 2016; 75(1): 96–102.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek EditorialČlánek Osteoartróza ručních kloubůČlánek Raynaudův fenoménČlánek Jubilanti – listopad 2016
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
-
Všetky články tohto čísla
- Editorial
- 15 let zkušeností s biologickou léčbou zánětlivých revmatických onemocnění v národním registru ATTRA
- Časná diagnostika spondyloartritid
- Diferenciální diagnostika monoartritid
- Osteoartróza ručních kloubů
- Raynaudův fenomén
- Imunitně zprostředkovaná nekrotizující myopatie asociovaná s léčbou statiny
- Kardiovaskulární riziko u revmatických onemocnění
- Vybrané kapitoly z intenzivní péče
- Ceny předsednictva ČLS JEP za nejlepší vědecké práce za rok 2015
- 70 let profesora Vladimíra Paličky
- Životní jubileum prof. MUDr. Rostislava Koďouska, DrSc.
- Zemřel prof. MUDr. PhDr. Eugen Strouhal, DrSc.
- Jubilanti – listopad 2016
- Přednáškové večery Spolku českých lékařů (listopad − prosinec 2016)
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Diferenciální diagnostika monoartritid
- Osteoartróza ručních kloubů
- Raynaudův fenomén
- Imunitně zprostředkovaná nekrotizující myopatie asociovaná s léčbou statiny
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



