-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Raynaudův fenomén
Raynaud's phenomenon
Raynaud's phenomenon (RP) is a very common sign which can usually be seen across all medical specialties. It is characterized by episodic color changes of acral parts of the body (palor, cyanosis, rubor) lasting from a few minutes to hours, which are usually triggered by cold temperature and/or stress. The primary RP occurs alone, without concomitant diseases, is usually benign and has favorable prognosis. Secondary RP occurs in a variety of diseases with a very variable progression and prognosis, mostly unfavorable one due to the development of ischemic tissue necrosis and gangrene. This work provides a comprehensive overview of the history, current knowledge about the epidemiology and pathogenesis and the recommended evaluation and treatment of RP.
Keywords:
Raynaud's phenomenon, primary, secondary, capillaroscopy, treatment
Autoři: Michal Tomčík
Působiště autorů: Revmatologický ústav a Revmatologická klinika 1. LF UK
Vyšlo v časopise: Čas. Lék. čes. 2016; 155: 310-318
Kategorie: Přehledový článek
Souhrn
Raynaudův fenomén (RF) je velmi častým příznakem, se kterým se dá běžně setkat napříč všemi odbornostmi medicíny. Je charakterizován epizodickými barevnými změnami akrálních částí těla (zbělení, zfialovění, zčervenání) trvajících několik minut až hodin, které nejčastěji vyvolává chlad a/nebo stres. Primární RF se vyskytuje samostatně, bez průvodního onemocnění, má většinou benigní průběh a příznivou prognózu. Sekundární RF se vyskytuje u různých onemocnění, jeho průběh a prognóza jsou velmi variabilní, ale většinou nepříznivé v důsledku rozvoje ischemické tkáňové nekrózy a gangrény. Tato práce poskytuje ucelený přehled o RF od historie přes současné poznatky o epidemiologii a pohledy na patogenezi až po doporučované postupy jeho hodnocení a léčby.
Klíčová slova:
Raynaudův fenomén, primární, sekundární, kapilaroskopie, léčbaÚvod
Raynaudův fenomén (RF), dříve také nazývaný Raynaudův syndrom nebo Raynaudova nemoc, je charakterizován epizodickými barevnými změnami aker (zejména prstů horních a dolních končetin a uší s typickou stranovou symetrií, dále nosu a jazyka) vyvolanými nejčastěji chladem a/nebo stresem a trvajícími několik minut až hodin.
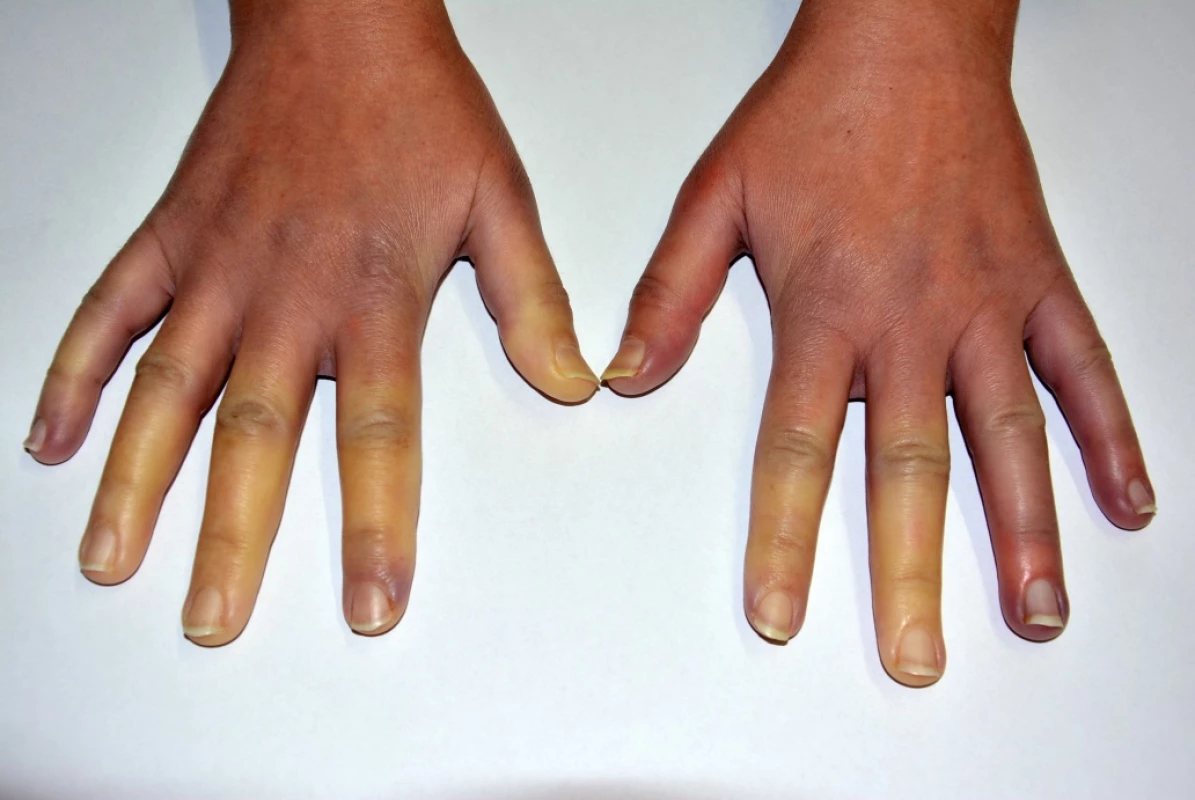
Pro RF je typický sled 3 (někdy pouze 2) fází barevných změn (viz obr. 1):
- palor (zbělení) – jenž je nejspecifičtější fází a je dán vazospasmem;
- cyanóza (zfialovění) – která je způsobena tkáňovou hypoxií až anoxií a spolu se zbělením je provázena pocitem tuposti, necitlivosti a bolestí,
- rubor (zčervenání) – který je nejméně specifickou fází, je zapříčiněn reperfuzní hyperemií a je pacientem pociťován jako pálení, píchání anebo brnění.
Barevné změny v typické lokalizaci, tj. na prstech rukou nebo nohou, mohou postihovat od jednoho až po všechny prsty, od špičky často až k bazi prstu. Palce bývají obvykle ušetřeny a jejich postižení bývá typické pro sekundární etiologie RF. Většina atak RF odezní během 15−20 minut po opětovném vystavení postiženého akra teplu.
RF klasifikujeme na primární a sekundární. Primární RF se vyskytuje samostatně, bez průvodního onemocnění, má většinou benigní průběh a příznivou prognózu a dle dřívější nomenklatury se pro něj používal název „Raynaudova nemoc“. Sekundární RF se vyskytuje u různých onemocnění, jeho průběh a prognóza jsou velmi variabilní, ale většinou nepříznivější v důsledku rozvoje ischemické tkáňové nekrózy a gangrény vedoucí k amputacím a ztrátě funkce končetiny (viz obr. 2); dle starší nomenklatury byl označován termínem „Raynaudův syndrom“. V současném pohledu na patofyziologii RF sehrává centrální roli zvýšená vazokonstrikce digitálních arterií a kožních arteriol v důsledku lokálního poškození normální cévní odpovědi (1−4).
Obr. 2. Digitální ulcerace a suchá gangréna u pacienta se systémovou sklerodermií 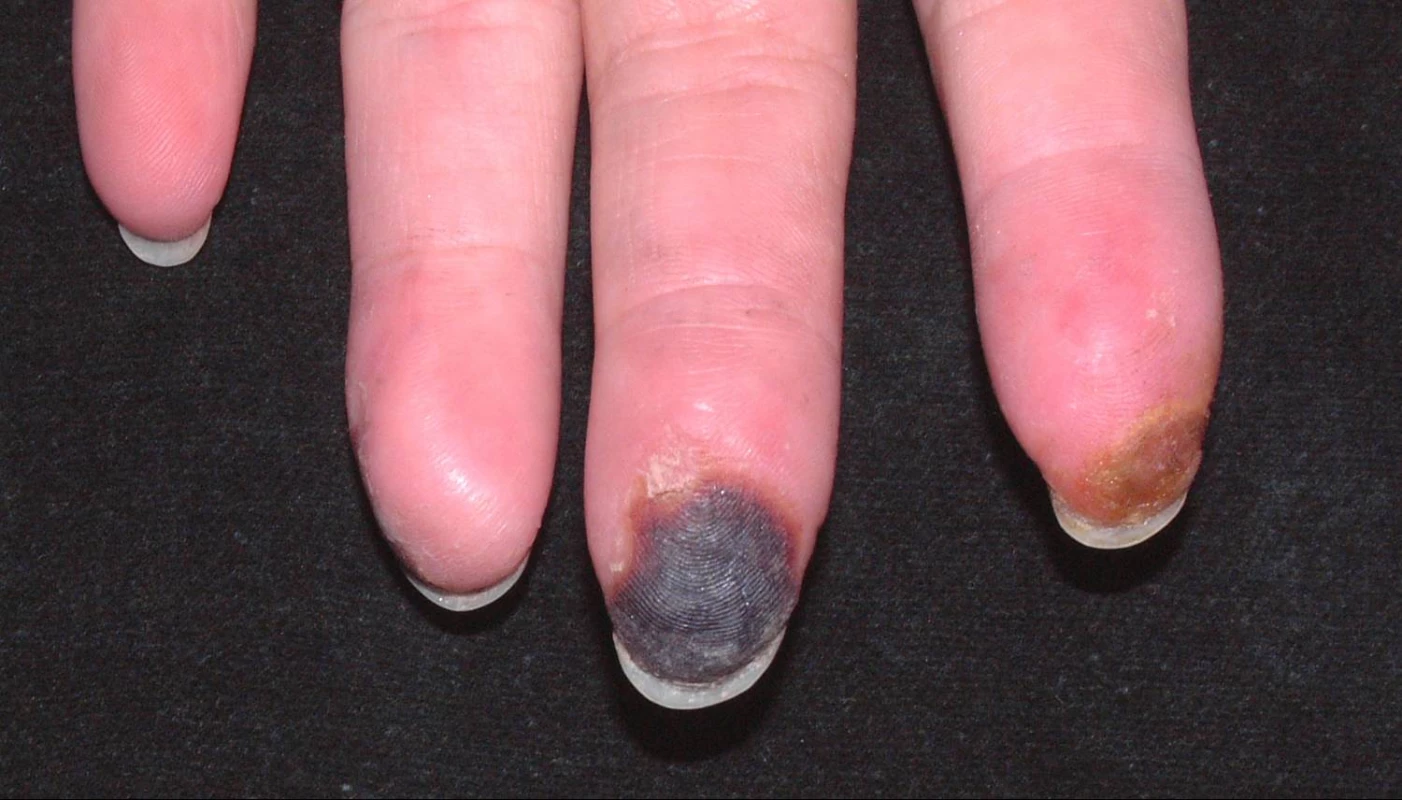
Definice, nomenklatura a kritéria
V roce 1862 popsal francouzský student medicíny Maurice Raynaud ve své diplomové práci 25 pacientů se spontánní symetrickou gangrénou končetin, z nichž někteří udávali v předchorobí záchvaty „mrtvých prstů“ vyvolané chladem nebo emočním stresem. Tyto ataky trvaly od několika minut až po několik hodin a byly charakterizovány až mrtvolným zblednutím, někdy dokonce žluté barvy, v těžších případech následnou změnou v barvu fialovou a zakončeny zčervenáním s návalem horka. Samotný Maurice Raynaud si již uvědomoval, že záchvaty barevných změn aker mohou být manifestací různých patologických stavů a lze je nalézt u heterogenní skupiny onemocnění. Proto se je snažil co nejpřesněji definovat a pro tyto účely navrhl 4 kritéria:
- a) diskrétní epizody změny barvy vazospastického typu indukované chladem nebo emočním stresem,
- b) bilaterální postižení,
- c) normální pulzace při palpaci,
- d) absence gangrény nebo jen minimální stupeň gangrény kůže (viz obr. 2) (1, 5).
Obr. 3. Jamkovité jizvičky na bříškách prstů u pacienta se systémovou sklerodermií 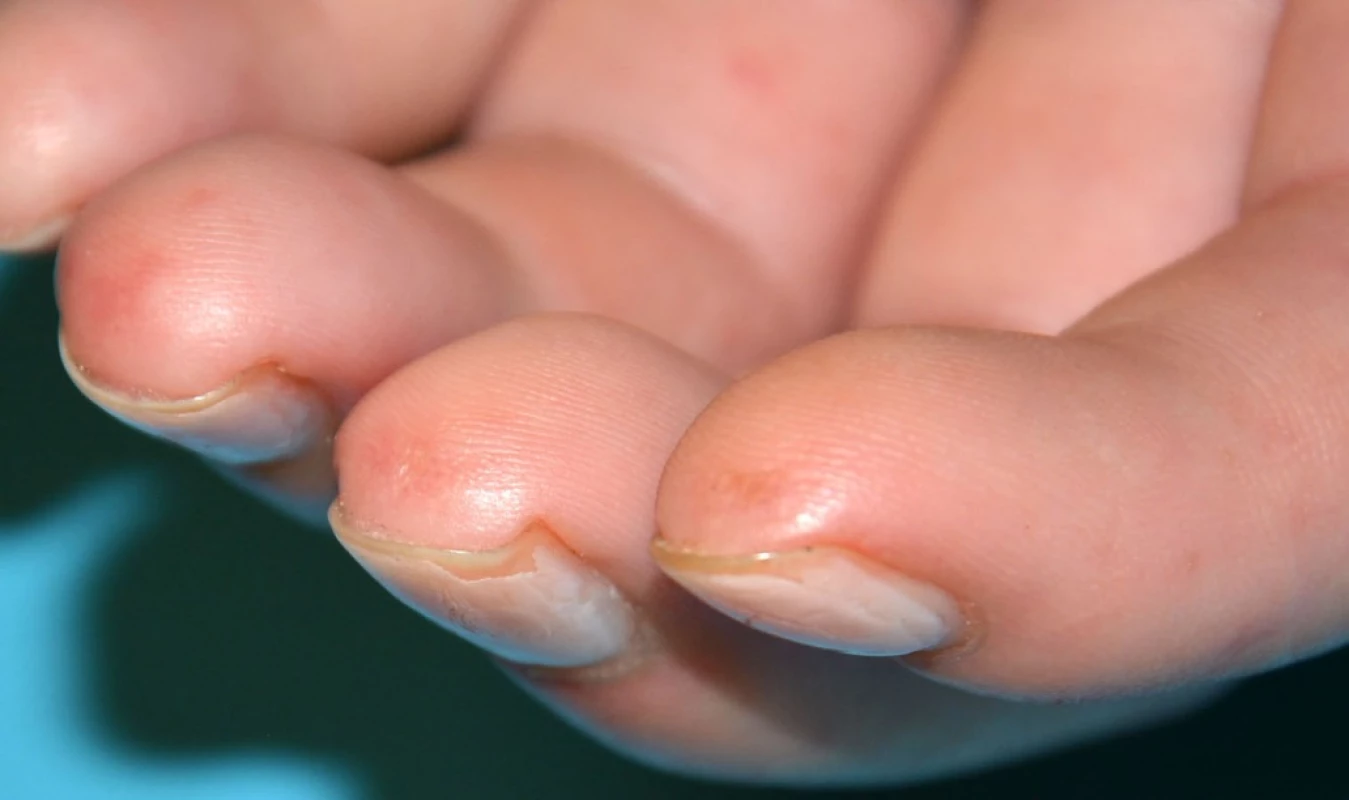
V roce 1888 byla tato diplomová práce přeložena do angličtiny a Sir Jonathan Hutchinson o rok později pojmenoval v ní zmíněný digitální vazospastický fenomén jako „Raynaudovu nemoc“. Sir Hutchinson poté v roce 1901 navrhl termín „Raynaudův fenomén“ místo názvu „Raynaudova nemoc“ vzhledem k možné sekundární etiologii atak vazospasmu. Dále zdůraznil, že RF může vznikat například na podkladě obstrukce tepenního řečiště nebo naopak existovat bez její přítomnosti (6).
Tato pozorování vedla v roce 1932 dvojici autorů Allena a Browna ke změně nomenklatury, k revizi a modifikaci původních kritérií Maurice Raynauda pro „Raynaudovu nemoc“ a k definici kritérií pro „primární Raynaudův fenomén“:
- a) vazospastické ataky vyvolané chladem,
- b) bilaterální postižení končetin,
- c) absence gangrény nebo pouhé postižení kůže konečků prstů,
- d) anamnéza příznaků po dobu nejméně 2 let bez průkazu jiného základního onemocnění způsobujícího RF.
Termín „sekundární Raynaudův fenomén“ byl poté použit pro ataky RF asociované s tkáňovou nekrózou nebo s cévní patologií na podkladě lokální arteriální obstrukce (7).
V průběhu 20.století vedly nové poznatky a vývoj nových diagnostických metod k lepší identifikaci sekundárních příčin RF, což bylo zohledněno LeRoyem a Medsgerem do nových klasifikačních kritérií pro primární a sekundární RF, jež jsou používána dodnes (viz tab. 1). U primárního RF přibyl k typickým charakteristikám z dřívějších kritérií normální nález na kapilaroskopickém vyšetření nehtového valu (viz obr. 4a), negativita antinukleárních protilátek (ANA) a normální hladina zánětlivých parametrů. Autoři dále definovali, že téměř jakákoli abnormalita typická pro nediferencované onemocnění pojiva (UCTD) nebo systémovou sklerodermii (SSc) a jí podobná onemocnění vede ke klasifikaci vazospastických atak jako sekundárního RF (viz tab. 1) (8).
Tab. 1. Klasifikační kritéria pro primární a sekundární RF <em>(dle: LeRoy, Medsger, 1992 [8])</em> ![Klasifikační kritéria pro primární a sekundární RF <em>(dle: LeRoy, Medsger, 1992 [8])</em>](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4f29f331c04212b11101ba1bbd0b5926.png)
Platnost klasifikačních kritérií LeRoye a Medsgera z roku 1992 byla potvrzena v roce 2014 panelem 12 odborníků v oblasti RF, kteří kombinací zmíněných kritérií navrhli diagnostická kritéria obecně pro RF (kroky 1−3) a dodatečně po jejich splnění i pro primární RF (kroky 4−7) (viz tab. 2) (9).
Tab. 2. Diagnostická kritéria pro RF obecně a pro primární RF <em>(dle: Maverakis et al., 2014 [9])</em> ![Diagnostická kritéria pro RF obecně a pro primární RF <em>(dle: Maverakis et al., 2014 [9])</em>](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f764958d9624ceca0ff143fe7ab16330.png)
Jelikož je pocit chladných rukou a nohou (zimomřivost) velmi obvyklým subjektivně vnímaným a udávaným steskem v běžné populaci (udává se až u 50 % žen), je nutné jej odlišit od RF. Vystavení chladu u zdravých jedinců bez RF většinou způsobuje pocit chladu a u některých se mohou objevovat i skvrny na kůži, ale nemělo by docházet k ostře ohraničenému zbělení nebo zfialovění prstů, které vídáme u RF (viz obr. 1). Pro rychlý screening v klinické praxi proto Wigley navrhl 3 základní otázky, které může snadno položit každý lékař svému pacientovi:
- Jste citlivější na chlad než jiní lidé?
- Pozorovali jste barevné změny na kůži?
- Vypadají Vaše prsty bíle nebo modře (fialově) při vystavení chladu?
V případě pozitivní odpovědi na všechny tři otázky lze potvrdit diagnózu RF a následně zhodnotit, zdali se jedná o primární nebo sekundární RF podle kritérií uvedených v tab. 1 a 2 (1).
Epidemiologie a etiologie
Ve většině studií zkoumajících RF v běžné populaci se udává jeho prevalence v rozmezí 3−5 %. Primární RF představuje 80−90 % všech případů RF a jeho prevalence se ve studiích pohybuje mezi 2 a 21 % u žen a 1 a 12 % u mužů (10). Prevalence primárního RF se v jednotlivých studiích liší zejména s rozdílnými klimatickými podmínkami – od 2,1 % v italské populaci přes 5,9 % v Turecku, 7,2 % v USA, 11,5 % na Novém Zélandu až po 21 % žen a 16 % mužů ve Velké Británii (11−15). Incidence primárního RF byla jen ojediněle zkoumána, ale u téměř 1400 zdravých jedinců z Framinghamské kohorty sledovaných po dobu 7 let byl stanoven výskyt nových případů RF na 2,2 % u žen a 1,5 % u mužů ročně (16). Výsledky jednotlivých studií lze jen těžko generalizovat vzhledem k použití různých klasifikačních nebo diagnostických kritérií či hodnoticích dotazníků pro RF.
Pro rozvoj primárního RF bylo popsaných několik rizikových faktorů – řadí se mezi ně věk, pohlaví, environmentální a genetické faktory. První příznaky primárního RF se sice mohou objevit v jakémkoli věku, ale jsou až 3× častější ve věku do 40 let a jen ve 3 % k nim dochází u lidí starších 60 let. Přítomnost RF v rodinné anamnéze je rovněž častější u lidí se začátkem RF do 40 let než po 40. roku, kdy se také zvyšuje pravděpodobnost sekundární etiologie RF (1, 17). Prevalence primárního RF je až 4× vyšší u žen než u mužů napříč studiemi, což obzvlášť platí pro osoby mladší 40 let. Rozdíly lze dále nalézt v rizikovém profilu u obou pohlaví. U žen bylo popsáno zvýšené riziko spojené s emočním stresem (např. rozchod, rozvod, ovdovění), užíváním alkoholu a nízkým BMI (body mass index) a u mužů zvyšovalo riziko rozvoje primárního RF kouření, vibrace a jiné formy vaskulární traumatizace a podobně i nízký BMI (18−20). Environmentálním faktorům dosud nebyl věnován dostatek pozornosti, ale některé práce dokládají zvýšenou prevalenci primárního RF v chladnějším podnebí a u lidí pracujících s vibračními nástroji nebo rozpouštědly (21−23). Až 50 % jedinců s primárním RF má v rodinné anamnéze výskyt RF u příbuzných prvního stupně. To platí zejména u žen a při začátku RF v mladším věku. Rovněž byla prokázána vyšší konkordance u monozygotních než u dizygotních dvojčat ženského pohlaví jak pro vnímání chladu, pro RF, tak i pro závažný RF (24−26).
Prevalence sekundárního RF je variabilní a závisí na typu základního onemocnění − přehled je uveden v tab. 3. Nejčastěji se sekundární RF vyskytuje u systémových onemocnění pojiva, jejichž nástup může RF předcházet až o řadu let. Další nemoci se podílejí jen na malém procentu sekundárního RF. Incidence sekundárního RF je neznámá, ale dle jedné studie u 112 pacientů s RF sledovaných po dobu 5 let byl popsán roční výskyt nového konkomitantního onemocnění, které potvrzuje sekundární etiologii RF, 1,4 % (27, 28).
Tab. 3. Přehled nejčastějších příčin a známé prevalence sekundárního RF u některých průvodních onemocnění <em>(upraveno dle: Harrisons Internal Medicine a Lukáč V a kol. Systémové choroby spojivového tkaniva)</em> 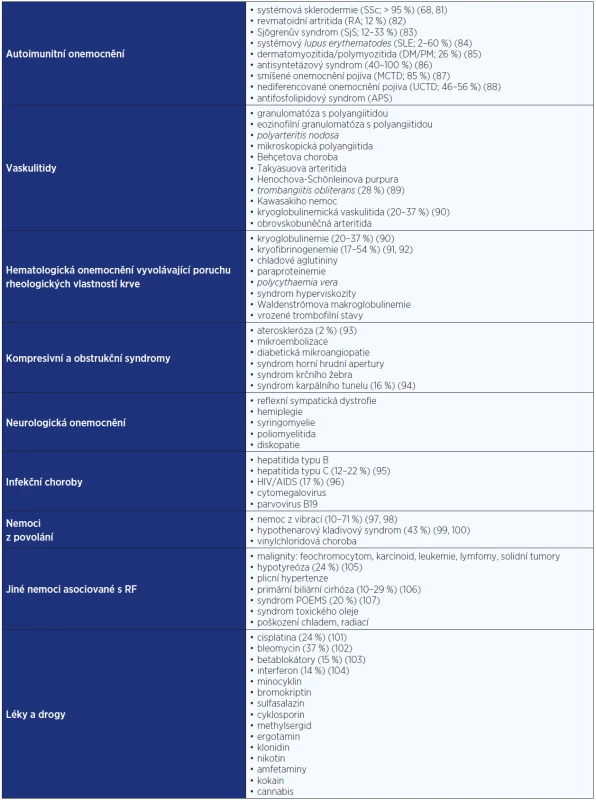
Pravý primární RF může vymizet až u 64 % žen i mužů v průběhu let (16). Naopak dvě práce na velkém počtu pacientů (celkem 3600) s původně diagnostikovaným primárním RF, kteří byli prospektivně sledováni po dobu 4−5 let, prokázaly na konci doby hodnocení definitivní stanovení diagnózy systémového onemocnění pojiva až ve 14−37 %, z čehož 93 % mělo systémovou sklerodermii (29, 30). Roční incidence progrese původně diagnostikovaného primárního RF do systémové sklerodermie nebo jiného základního onemocnění byla stanovena na 1−3 % (31, 32).
Mezi prokázané faktory, jež zvyšují riziko vývoje RF do autoimunitního onemocnění, patří:
- nástup RF po 40. roku života,
- krátká anamnéza RF,
- zhoršující se ataky RF,
- pozitivita ANA > 1 : 320,
- zvýšená sedimentace erytrocytů,
- abnormální nález na kapilaroskopii nehtového valu (viz obr. 4b, c) (29-31).
Naopak nejvyšší negativní prediktivní hodnota pro zmíněnou progresi RF v autoimunitní onemocnění byla nalezena pro:
- normální nález na kapilaroskopii (viz obr. 4a),
- negativitu ANA,
- absenci difuzního otoku prstů, teleangiektázií a sklerodaktylie (29, 32).
V průběhu čtyřletého sledování téměř 600 jedinců s primárním RF došlo k rozvoji a definitivnímu stanovení diagnózy systémové sklerodermie (SSc) u:
- 1,8 % pacientů s normálním kapilaroksopickým nálezem a bez pozitivity protilátky specifické pro SSc,
- 25,8 % pacientů s abnormálním kapilaroskopickým nálezem,
- 35,4 % pacientů s pozitivitou protilátky specifické pro SSc,
- 79,5 % pacientů s abnormálním kapilaroskopickým nálezem a pozitivitou protilátky specifické pro SSc (29).
Italští autoři popsali, že až u 16 % pacientů s primárním RF došlo v průběhu 5 let k rozvoji abnormálního nálezu na kapilaroskopii (viz obr. 4b, c) (33).
Obr. 4. Kapilaroskopie nehtových valů: a) normální nález; b, c) patologický nález charakteristický pro SSc 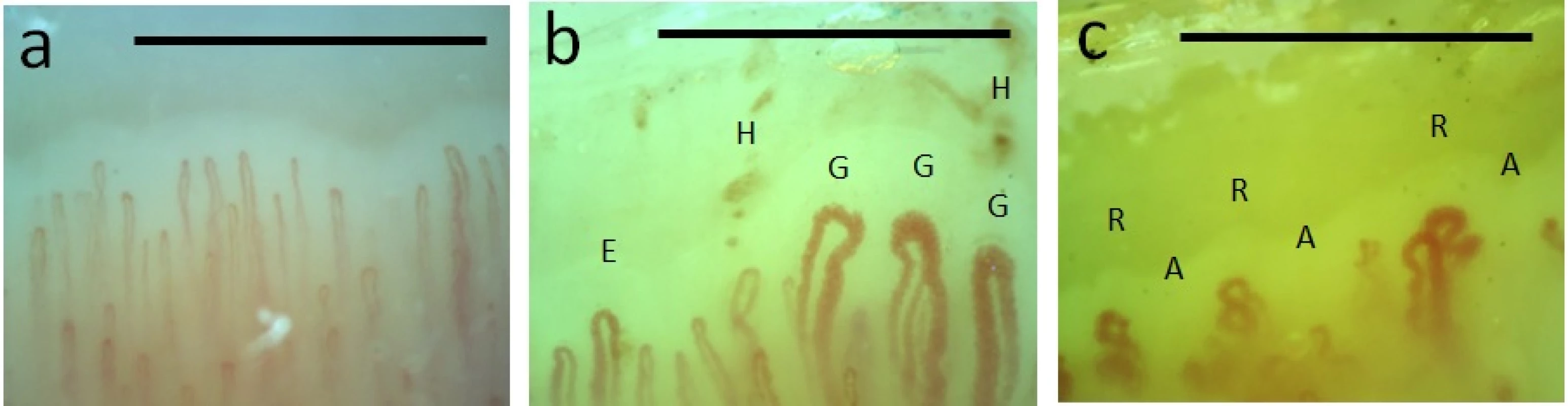
Pozn.: E = ektázie; G = gigant/megakapilára; H = mikrohemoragie; A = avaskulární zóna; R = ramifikace (známka neoangiogeneze); horizontální linie odpovídá 1 mm. Patofyziologie
V patofyziologii RF se uplatňuje několik procesů. U zdravých jedinců vystavených chladu se jejich tělo snaží udržet normální teplotu jádra zabráněním tepelných ztrát, a to pomocí snížení průtoku krve kůží (vazokonstrikcí) a zvýšenou produkcí tepla (např. třesem). Chladem indukovaná vazokonstrikce u zdravých jedinců bez RF se odehrává selektivně v arteriovenózních anastomózách (AVA − spojení mezi arteriolami a venulami, která obcházejí nutriční kapiláry kůže), zatímco nutriční kapilární oběh kůže zůstává průchodný a neomezen a vazokonstrikce je dále amplifikována zvýšenou aktivitou sympatiku indukovanou chladem.
Cévní řečiště u žen je obzvlášť senzitivní na tepelné podněty (chlad a teplo), což je pravděpodobně dáno vlivem estrogenů na cévní stěnu (34−38). Na rozdíl od zdravé populace lze u jedinců s RF už za termoneutrálních podmínek detekovat nižší krevní průtok digitálními arteriemi; ten se ještě dramaticky snižuje při vystavení chladu (36, 39, 40). Vazokonstrikce indukovaná chladem není u RF omezena jen na AVA, ale postihuje i nutriční kapiláry. I když je reflexní zvýšení aktivity sympatiku indukované chladem u obou typů RF podobné, výsledná vazokonstrikce a amplifikace odpovědi na aktivaci sympatiku je u RF výraznější, což může být zprostředkováno zvýšenou aktivitou α2-adrenergních receptorů v hladkých svalech cévní stěny u RF a dysbalancí vazoaktivních mediátorů (např. sníženou tvorbou vazodilatačně působícího prostacyklinu PGI2 a naopak zvýšenou tvorbou vazokonstrikčně působících mediátorů endotelinu 1, serotoninu či tromboxanu A2) (40−44). U sekundárního RF se k výše popsaným změnám přidávají dysfunkce endotelové průtokem zprostředkované dilatace a zejména progresivní strukturální změny nutričních kapilár (tvar, velikost, počet a uspořádání), které lze detekovat kapilaroskopií nehtového valu (viz obr. 4b,c), a dále systémová vaskulopatie (45, 46).
Významná role u RF je také připisována změně hemoreologických parametrů krve, která může být podmíněná zvýšenou agregabilitou erytrocytů a trombocytů nebo zvýšenou viskozitou plazmy na vrub vyšší hladiny kryoglobulinů, imunoglobulinů, imunokomplexů a fibrinogenu (47, 48).
Vyšetřovací metody
Diagnóza RF se opírá zejména o anamnézu charakteristických barevných změn na prstech rukou (viz podrobněji výše v oddílu Definice, nomenklatura a kritéria). Jelikož je vazokonstrikce indukovaná chladem důležitou komponentou fyziologické termoregulace, většina běžné populace se ve svém životě setká s RF v menším nebo větším rozsahu. Stanovení diagnózy jen na základě pacientova sdělení a pozorování však s sebou nese riziko nesprávné diagnózy nebo nedostatečné kontroly v průběhu onemocnění, jakým je např. systémová sklerodermie (SSc). Proto bylo vynaloženo velké úsilí k vytvoření vhodných objektivních metod ke zhodnocení a diagnóze RF. I přes velké pokroky a množící se publikace však dosud stále neexistuje optimální objektivní metoda ke zhodnocení digitální mikrovaskulární perfuze, která by byla panelem odborníků doporučena pro použití v klinických zkouškách u pacientů s RF (49, 50).
U všech metod objektivně hodnotících vaskulární strukturu či funkci by měl být dodržen standardizovaný postup − pacienti by se měli vyvarovat vazoaktivních mediátorů, mezi které patří z běžného života např. alkohol, intenzivnější cvičení, kofein a nikotin, a to aspoň po dobu 4 hodin před vyšetřením. To by mělo probíhat za standardizovaných podmínek v místnostech se stálou teplotou 23 °C po minimálně 20 minut trvající aklimatizaci pacienta. Pro účely průřezových anebo longitudinálních studií by pak měly být rovněž zhodnoceny možné vlivy věku, pohlaví, cirkadiánní a sezónní vlivy a vliv ženských hormonálních změn (49, 50).
Mezi nejčastěji používané provokační testy patří chladové stresové testy, které byly vyvinuty ke zhodnocení vazokonstrikce indukované zvýšenou aktivitou sympatiku při vystavení chladu. Používají se častěji lokální testy, kdy se ruce v rukavicích ponořují do vody o definované teplotě 15−20 °C, a méně často pak celotělové testy (51, 52).
V poslední době jsme svědky výrazného nárůstu počtu studií s různými neinvazivními zobrazovacími technikami, které lze použít k hodnocení struktury a/nebo funkce (mikro)vaskulatury – z těch nejčastěji publikovaných se jedná zejména o infračervenou termografii (IRT), techniky používající laser doppler (LDI – laser doppler imaging; LDF – laser doppler flowmetry; LSCI - laser speckle contrast imaging), dopplerovský ultrazvuk a pletysmografii. Zmíněné techniky dokáží rozlišit primární a sekundární RF, ozřejmit jejich patofyziologii a sledovat odpověď na léčbu, ale nedostatek konsenzu ve standardizaci jejich protokolů a jejich náročnost na finanční náklady a obsluhu dosud brání jejich srovnání, validizaci a reprodukovatelnosti v běžné klinické praxi. Proto bývají většinou vyhrazeny pro výzkumné účely (49, 50, 53–57).
Při klinickém podezření na onemocnění velkých tepen jako možné příčiny sekundárního RF je doporučeno vyšetření cév jednou z výše popsaných neinvazivních metod a v případě patologického nálezu její ověření pomocí jedné ze zobrazovacích metod – např. digitální subtrakční angiografie (DSA), MRI angiografie (MRA) nebo CT angiografie (CTA). Jednotlivé metody mají své výhody a nevýhody, jako jsou např. přesnější zhodnocení lumen či stěny cév, invazivita, časová náročnost či možnost současného provedení endovaskulární intervence (58–60).
Významné postavení mezi neinvazivními metodami hodnotícími morfologii mikrovaskulatury má kapilaroskopie nehtových valů, která rovněž dokáže odlišit primární RF od sekundárního. Lze k ní použít přístroje s malým zvětšením (20–100× – stereomikroskop, dermatoskop, oftalmoskop) pro přehledné zhodnocení celého nehtového valu nebo s větším (200–400× – videokapilaroskop) pro detailní zhodnocení jednotlivých kapilár (viz obr. 4). Pomocí kapilaroskopie lze snadno odlišit normální strukturu kapilár (pravidelné uspořádání tenkých kapilár) (viz obr. 4a) či mírné nespecifické abnormality normy (např. vinutost a křížení kapilár a drobná rozšíření) typické pro zdravé jedince bez RF a primární RF od patologických morfologických změn (např. tvorba megakapilár, přítomnost mikrohemoragií, avaskulárních zón a známek neoangiogeneze), specifických pro SSc a další systémová onemocnění pojiva (např. UCTD, MCTD, dermatomyozitidu) dokládajících sekundární etiologii RF (viz obr. 4b, c). Časová (10 minut) a finanční nenáročnost, standardizace, validita a reprodukovatelnost kapilaroskopického vyšetření v běžné klinické praxi vedla nedávno k začlenění této metody do nových klasifikačních kritérií pro SSc a diagnostických kritérií pro velmi časnou diagnózu SSc (45, 61, 62). Při pátraní po sekundární etiologii RF (viz tab. 3) je nutné se řídit klinickými příznaky a doplnit další potřebná vyšetření, mezi kterými by však nemělo chybět vyšetření sedimentace erytrocytů, krevního obrazu, antinukleárních protilátek, rentgenový snímek hrudníku a krční páteře.
Léčba
Řada jedinců s primárním RF ani nevyhledá lékařskou pomoc a většina z nich nevyžaduje žádnou léčbu. V případě stanovení diagnózy primárního RF je zásadní ujistit pacienta, že nebyly nalezeny známky možné sekundární etiologie, a poučit jej, že primární RF má příznivou prognózu a nevede k závažným zdravotním komplikacím. Cílem terapie je minimalizace symptomů, k čemuž jsou k dispozici režimová opatření a farmakologická léčba.
Z režimových opatření má zcela zásadní význam minimalizace expozice vlivům, které vyvolávají nebo zhoršují RF (většinou chlad a stres), a snaha redukovat jeho frekvenci, intenzitu a trvání na minimum. Je zcela zásadní upozornit pacienta, aby si před chladem chránil jak periferii (teplé rukavice, ponožky, elektrické vyhřívání do rukavic/bot, gelové ohřívače, čepice atd.), tak jádro těla. Dále je nutné zdůraznit, aby zanechal kouření (škodí i pasivní), a vyhýbal se lékům s vazokonstrikčním účinkem, pokud je to možné. V současné době neexistují důkazy z kvalitních klinických hodnocení, které by podporovaly účinnost behaviorální terapie nebo výživových doplňků či různých prostředků alternativní medicíny na snížení frekvence a intenzity atak RF (1, 2, 63).
V případě nedostatečného efektu režimových opatření by mělo být zváženo nasazení dihydropyridinových blokátorů kalciových kanálů (BKK: nifedipin, amlodipin, nikardipin, felodipin) jako léku první volby, ideálně s prodlouženým uvolňováním, zahájeným v nízké dávce, s postupným navýšením dávky dle tolerance (63). Dle recentní cochraneovské analýzy 7 randomizovaných studií (4 s nifedipinem a 3 s nikardipinem) u téměř 300 pacientů vedly BKK k redukci atak RF o 1,72 týdně oproti placebu (95 % CI 0,60−2,84) (64). Pro jiná farmaka existuje ještě méně důkazů než pro BKK , ale v případě intolerance nebo nedostatečného efektu BKK lze dále zkusit blokátory receptorů pro angiotenzin II (ARB: losartan), selektivní α1-sympatolytika (prazosin), inhibitory zpětného vychytávání serotoninu (SSRI: fluoxetin) (65, 66). Výjimečně bývají u závažnějšího primárního RF používány inhibitory fosfodiesterázy-5 (PDE-5i: např. sildenafil) a intravenózní analoga prostacyklinu (PGI2: iloprost, epoprostenol; PGE1: alprostadil) (65, 67).
Pro sekundární RF platí stejná režimová opatření, jejichž dodržování a edukace je však zcela zásadní vzhledem k nepříznivější prognóze a vyššímu riziku rozvoje tkáňové nekrózy. Farmakoterapeutické principy uvedené u primárního RF lze aplikovat i u sekundárního RF, avšak s určitými rozdíly. Dle výsledků studií a klinické praxe se dá obecně říct, že farmakoterapie je méně účinná obvykle u závažnějších atak sekundárního RF. Proto je u sekundárního RF často nutná kombinace dvou preparátů – nejčastěji BKK a ARB anebo BKK a PDE-5i (63, 67, 68).
Antiagregační a antitrombotické strategie sice nemají dostatečnou podporu v klinických studiích u sekundárního RF, ale vzhledem k přítomnosti endotelové dysfunkce, vaskulopatie a rizika mikrotrombotizace u některých systémových onemocnění pojiva (SSc, SLE, APS, UCTD, MCTD) se někdy v běžné praxi používá kyselina acetylsalicylová, klopidogrel a hydroxychlorochin (69, 70). Data z jedné klinické studie podporují používání atorvastatinu u RF asociovaného se SSc, avšak výsledky z klinické praxe nejsou tak přesvědčivé a bude zapotřebí dalších studií k potvrzení jeho indikace u sekundárního RF mimo pacienty se zvýšeným kardiovaskulárním rizikem (71). Neselektivní antagonista endotelinových receptorů bosentan je sice používán v prevenci digitálních ulcerací u pacientů se SSc, avšak nevedl k redukci frekvence, trvání či intenzity RF (72).
Pro nejzávažnější případy sekundárního RF (zejména asociovaného se SSc) s hrozící závažnou ischemií, nekrózou a gangrénou jsou vyhrazena intravenózně podávaná analoga prostacyklinu (PGI2, PGE1), dále perkutánní techniky blokády sympatiku bupivakainem, digitální sympatektomie (adventektomie), radiální či ulnární adventektomie nebo thorakoskopická hrudní sympatektomie (častokrát s rekurencí: 16 % u periferních a až 100 % u centrálních sympatektomií) (73−78). V případě gangrén je indikovaná amputace článků nebo celých prstů. V zahraničí se rovněž používá poněkud bolestivá lokální aplikace botulotoxinu do okolí digitálních arterií nebo autologní transplantace tukové tkáně do postižených oblastí – pro tyto metody však existuje jen minimum literárních důkazů účinnosti (79, 80).
Závěr
Raynaudův fenomén je velmi častým příznakem, se kterým se dá běžně setkat napříč všemi odbornostmi medicíny. Od jeho prvního popisu Mauricem Raynaudem v 19. století bylo navrženo několik změn nomenklatury, definicí a kritérií, jež zohledňují nové poznatky a mají za cíl usnadnit lékařům jeho poznání a vyloučení sekundární etiologie, která je většinou spojena s horší prognózou. I v dnešní době představuje klinické zhodnocení anamnézy a fyzikálního vyšetření zlatý standard pro stanovení diagnózy RF. V posledních třech dekádách vyvinuli odborníci na RF velké úsilí směřující k upřesnění jeho klasifikace, odhalení specifických molekulárních patologických mechanismů, které jsou podkladem dysregulace vazomotorické odpovědi, a k identifikaci účinnějších způsobů léčby. Nové poznatky snad brzo zaplní mezery v porozumění mechanismům RF a poskytnou nové možnosti pro úlevu a pomoc pacientům s těmito zdánlivě neškodnými epizodickými barevnými změnami akrálních částí těla.
Poděkování:
Práce vznikla za podpory grantu AZV16-33542A a MZ ČR – Institucionální podpora, Koncepční rozvoj výzkumné organizace č. MZO 023728.
Fotografie byly pořízeny paní Alenou Swientekovou a laskavě poskytnuty ze sbírky doc. MUDr. Radima Bečváře, CSc., v Revmatologickém ústavu v Praze.
Seznam použitých zkratek
AIDS syndrom získaného selhání imunity
ANA antinukleární protilátky
APS antifosfolipidový syndrom
ARB blokátory receptorů pro angiotenzin II
AVA arteriovenózní anastomózy
BMI body mass index
BKK blokátory kalciových kanálů
CT výpočetní tomografie
CTA CT angiografie
DM dermatomyozitida
DSA digitální subtrakční angiografie
HIV virus lidské imunodeficience
IRT infračervená termografie
LDF laser doppler flowmetry
LDI laser doppler imaging
LSCI laser speckle contrast imaging
MCTD smíšené onemocnění pojiva
MRI magnetická rezonance
MRA MRI angiografie
PDE-5i inhibitory fosfodiesterázy-5
PGE1 prostaglandin E1
PGI2 prostaglandin I2
PM polymyozitida
POEMS polyneuropatie, organomegalie, endrokrinopatie, monoklonální gamapatie, kožní změny (syndrom)
RA revmatoidní artritida
RF Raynaudův fenomén
SjS Sjögrenův syndrom
SLE systémový lupus erythematodes
SSc systémová sklerodermie
SSRI inhibitory zpětného vychytávání serotoninu
UCTD nediferencované onemocnění pojiva
Adresa pro korespondenci:
MUDr. Michal Tomčík, Ph.D.
Revmatologický ústav
Revmatologická klinika 1. LF UK
Na Slupi 4
128 50 Praha 2
Tel.: 234 075 101, 605 808 126
e-mail: tomcik@revma.cz
Zdroje
1. Wigley FM. Clinical practice. Raynaud’s Phenomenon. N Engl J Med 2002; 347(13): 1001–1008.
2. Hughes M, Herrick AL. Raynaud’s phenomenon. Best Pract Res Clin Rheumatol 2016; 30(1): 112–132.
3. Flavahan NA. A vascular mechanistic approach to understanding Raynaud phenomenon. Nat Rev Rheumatol 2015; 11(3): 146–158.
4. Cappelli L, Wigley FM. Management of Raynaud Phenomenon and Digital Ulcers in Scleroderma. Rheum Dis Clin North Am 2015; 41(3): 419–438.
5. Raynaud M. De l’asphyxie locale et de la gangrene symetrique des extremites. Thesis. L. Leclerc, Libraire-Editeur, Paris, 1862.
6. Hutchinson J. Raynaud’s phenomena. Med Press Circ 1901; 123 : 402–405.
7. Allen EV, Brown GE. Raynaud’s disease: a critical review of minimal requisities for diagnosis. Am J Med Sci 1932; 183 : 187–200.
8. LeRoy EC, Medsger TA jr. Raynaud’s phenomenon: a proposal for classification. Clin Exp Rheumatol 1992; 10(5): 485–488.
9. Maverakis E, Patel F, Kronenberg DG et al. International consensus criteria for the diagnosis of Raynaud’s phenomenon. J Autoimmun 2014; 48–49 : 60–65.
10. Riera G, Vilardell M, Vaque J et al. Prevalence of Raynaud’s phenomenon in a healthy Spanish population. J Rheumatol 1993; 20(1): 66–69.
11. De Angelis R, Salaffi F, Grassi W. Raynaud’s phenomenon: prevalence in an Italian population sample. Clin Rheumatol 2006; 25(4): 506–510.
12. Onbasi K, Sahin I, Onbasi O et al. Raynaud’s phenomenon in a healthy Turkish population. Clin Rheumatol 2005; 24(4): 365–369.
13. Brand FN, Larson MG, Kannel WB et al. The occurrence of Raynaud’s phenomenon in a general population: the Framingham Study. Vasc Med 1997; 2(4): 296–301.
14. Purdie G, Harrison A, Purdie D. Prevalence of Raynaud’s phenomenon in the adult New Zealand population. N Z Med J 2009; 122(1306): 55–62.
15. Silman A, Holligan S, Brennan P et al. Prevalence of symptoms of Raynaud’s phenomenon in general practice. BMJ 1990; 301(6752): 590–592.
16. Suter LG, Murabito JM, Felson DT et al. The incidence and natural history of Raynaud’s phenomenon in the community. Arthritis Rheum 2005; 52(4): 1259–1263.
17. Planchon B, Pistorius MA, Beurrier P et al. Primary Raynaud’s phenomenon. Age of onset and pathogenesis in a prospective study of 424 patients. Angiology 1994; 45(8): 677–686.
18. Fraenkel L. Raynaud’s phenomenon: epidemiology and risk factors. Curr Rheumatol Rep 2002; 4(2): 123–128.
19. Keil JE, Maricq HR, Weinrich MC et al. Demographic, social and clinical correlates of Raynaud phenomenon. Int J Epidemiol 1991; 20(1): 221–224.
20. Fraenkel L, Zhang Y, Chaisson CE et al. Different factors influencing the expression of Raynaud’s phenomenon in men and women. Arthritis Rheum 1999; 42(2): 306–310.
21. Maricq HR, Carpentier PH, Weinrich MC et al. Geographic variation in the prevalence of Raynaud’s phenomenon: a 5 region comparison. J Rheumatol 1997; 24(5): 879–889.
22. Maricq HR, Carpentier PH, Weinrich MC et al. Geographic variation in the prevalence of Raynaud’s phenomenon: Charleston, SC, USA, vs Tarentaise, Savoie, France. J Rheumatol 1993; 20(1): 70–76.
23. Purdie GL, Purdie DJ, Harrison AA. Raynaud’s phenomenon in medical laboratory workers who work with solvents. J Rheumatol 2011; 38(9): 1940–1946.
24. Freedman RR, Mayes MD. Familial aggregation of primary Raynaud’s disease. Arthritis Rheum 1996; 39(7): 1189–1191.
25. Smyth AE, Hughes AE, Bruce IN et al. A case-control study of candidate vasoactive mediator genes in primary Raynaud’s phenomenon. Rheumatology (Oxford) 1999; 38(11): 1094–1098.
26. Cherkas LF, Williams FM, Carter L et al. Heritability of Raynaud’s phenomenon and vascular responsiveness to cold: a study of adult female twins. Arthritis Rheum 2007; 57(3): 524–528.
27. Pope JE. Raynaud’s phenomenon (primary). BMJ Clin Evid 2011; 2011.
28. Hirschl M, Kundi M. Initial prevalence and incidence of secondary Raynaud’s phenomenon in patients with Raynaud’s symptomatology. J Rheumatol 1996; 23(2): 302–309.
29. Nagy Z, Czirjak L. Predictors of survival in 171 patients with systemic sclerosis (scleroderma). Clin Rheumatol 1997; 16(5): 454–460.
30. Walker UA, Tyndall A, Czirjak L et al. Clinical risk assessment of organ manifestations in systemic sclerosis: a report from the EULAR Scleroderma Trials And Research group database. Ann Rheum Dis 2007; 66(6): 754–763.
31. Hartmann P, Mohokum M, Schlattmann P. The association of Raynaud’s syndrome with rheumatoid arthritis – a meta-analysis. Clin Rheumatol 2011; 30(8): 1013–1019.
32. Lin DF, Yan SM, Zhao Y et al. Clinical and prognostic characteristics of 573 cases of primary Sjogren's syndrome. Chin Med J (Engl) 2010; 123(22): 3252–3257.
33. Gronhagen CM, Gunnarsson I, Svenungsson E et al. Cutaneous manifestations and serological findings in 260 patients with systemic lupus erythematosus. Lupus 2010; 19(10): 1187–1194.
34. Mustafa KN, Dahbour SS. Clinical characteristics and outcomes of patients with idiopathic inflammatory myopathies from Jordan 1996–2009. Clin Rheumatol 2010; 29(12): 1381–1385.
35. Solomon J, Swigris JJ, Brown KK. Myositis-related interstitial lung disease and antisynthetase syndrome. J Bras Pneumol 2011; 37(1): 100–109.
36. Grader-Beck T, Wigley FM. Raynaud’s phenomenon in mixed connective tissue disease. Rheum Dis Clin North Am 2005; 31(3): 465–481, vi.
37. De Angelis R, Cerioni A, Del Medico P et al. Raynaud’s phenomenon in undifferentiated connective tissue disease (UCTD). Clin Rheumatol 2005; 24(2): 145–151.
38. Hartmann P, Mohokum M, Schlattmann P. The association of Raynaud syndrome with thromboangiitis obliterans – a meta-analysis. Angiology 2012; 63(4): 315–319.
39. Monti G, Galli M, Invernizzi F et al. Cryoglobulinaemias: a multi-centre study of the early clinical and laboratory manifestations of primary and secondary disease. GISC. Italian Group for the Study of Cryoglobulinaemias. QJM 1995; 88(2): 115–126.
40. Soyfoo MS, Goubella A, Cogan E et al. Clinical significance of Cryofibrinogenemia: possible pathophysiological link with Raynaud’s phenomenon. J Rheumatol 2012; 39(1): 119–124.
41. Saadoun D, Elalamy I, Ghillani-Dalbin P et al. Cryofibrinogenemia: new insights into clinical and pathogenic features. Am J Med 2009; 122(12): 1128–1135.
42. Knapik-Kordecka M, Wysokinski WE. Clinical spectrum of Raynaud’s phenomenon in patients referred to vascular clinic. Cardiovasc Surg 2000; 8(6): 457–462.
43. Hartmann P, Mohokum M, Schlattmann P. The association of Raynaud’s syndrome with carpal tunnel syndrome: a meta-analysis. Rheumatol Int 2012; 32(3): 569–574.
44. Stefanova-Petrova DV, Tzvetanska AH, Naumova EJ et al. Chronic hepatitis C virus infection: prevalence of extrahepatic manifestations and association with cryoglobulinemia in Bulgarian patients. World J Gastroenterol 2007; 13(48): 6518–6528.
45. Rogeaux O, Fassin D, Gentilini M. [Prevalence of rheumatic manifestations in human immunodeficiency virus infection]. Ann Med Interne (Paris) 1993; 144(7): 443–448.
46. Bovenzi M. A follow up study of vascular disorders in vibration-exposed forestry workers. Int Arch Occup Environ Health 2008; 81(4): 401–408.
47. Letz R, Cherniack MG, Gerr F et al. A cross sectional epidemiological survey of shipyard workers exposed to hand-arm vibration. Br J Ind Med 1992; 49(1): 53–62.
48. Cooke RA. Hypothenar hammer syndrome: a discrete syndrome to be distinguished from hand-arm vibration syndrome. Occup Med (Lond) 2003; 53(5): 320–324.
49. Marie I, Herve F, Primard E et al. Long-term follow-up of hypothenar hammer syndrome: a series of 47 patients. Medicine (Baltimore) 2007; 86(6): 334–343.
50. Mohokum M, Hartmann P, Schlattmann P. The association of Raynaud’s syndrome with cisplatin-based chemotherapy – a meta-analysis. Eur J Intern Med 2012; 23(7): 594–598.
51. Vogelzang NJ, Bosl GJ, Johnson K et al. Raynaud’s phenomenon: a common toxicity after combination chemotherapy for testicular cancer. Ann Intern Med 1981; 95(3): 288–292.
52. Mohokum M, Hartmann P, Schlattmann P. The association of Raynaud syndrome with beta-blockers: a meta-analysis. Angiology 2012; 63(7): 535–540.
53. Mohokum M, Hartmann P, Schlattmann P. Association of Raynaud’s syndrome with interferons. A meta-analysis. Int Angiol 2012; 31(5): 408–413.
54. Nielsen SL, Parving HH, Hansen JE. Myxoedema and Raynaud’s phenomenon. Acta Endocrinol (Copenh) 1982; 101(1): 32–34.
55. Shen M, Zhang F, Zhang X. Pulmonary hypertension in primary biliary cirrhosis: a prospective study in 178 patients. Scand J Gastroenterol 2009; 44(2): 219–223.
56. Miest RY, Comfere NI, Dispenzieri A et al. Cutaneous manifestations in patients with POEMS syndrome. Int J Dermatol 2013; 52(11): 1349–1356.
57. Koenig M, Joyal F, Fritzler MJ et al. Autoantibodies and microvascular damage are independent predictive factors for the progression of Raynaud’s phenomenon to systemic sclerosis: a twenty-year prospective study of 586 patients, with validation of proposed criteria for early systemic sclerosis. Arthritis Rheum 2008; 58(12): 3902–3912.
58. Pavlov-Dolijanovic S, Damjanov NS, Vujasinovic Stupar NZ et al. Late appearance and exacerbation of primary Raynaud’s phenomenon attacks can predict future development of connective tissue disease: a retrospective chart review of 3,035 patients. Rheumatol Int 2013; 33(4): 921–926.
59. Hirschl M, Hirschl K, Lenz M et al. Transition from primary Raynaud’s phenomenon to secondary Raynaud’s phenomenon identified by diagnosis of an associated disease: results of ten years of prospective surveillance. Arthritis Rheum 2006; 54(6): 1974–1981.
60. Spencer-Green G. Outcomes in primary Raynaud phenomenon: a meta-analysis of the frequency, rates, and predictors of transition to secondary diseases. Arch Intern Med 1998; 158(6): 595–600.
61. Cutolo M, Pizzorni C, Sulli A. Identification of transition from primary Raynaud’s phenomenon to secondary Raynaud’s phenomenon by nailfold videocapillaroscopy: comment on the article by Hirschl et al. Arthritis Rheum 2007; 56(6): 2102–2103; author reply 2103–2104.
62. Bartelink ML, De Wit A, Wollersheim H et al. Skin vascular reactivity in healthy subjects: influence of hormonal status. J Appl Physiol (1985) 1993; 74(2): 727–732.
63. Bergersen TK, Eriksen M, Walloe L. Local constriction of arteriovenous anastomoses in the cooled finger. Am J Physiol 1997; 273(3 Pt 2): R880–886.
64. Bollinger A, Schlumpf M. Finger blood flow in healthy subjects of different age and sex and in patients with primary Raynaud’s disease. Acta Chir Scand Suppl. 1976; 465 : 42–47.
65. Braverman IM. The cutaneous microcirculation. J Investig Dermatol Symp Proc 2000; 5(1): 3–9.
66. Cankar K, Finderle Z, Strucl M. The role of alpha1 - and alpha2-adrenoceptors in gender differences in cutaneous LD flux response to local cooling. Microvasc Res 2004; 68(2): 126–131.
67. Carter SA, Dean E, Kroeger EA. Apparent finger systolic pressures during cooling in patients with Raynaud’s syndrome. Circulation 1988; 77(5): 988–996.
68. Coffman JD, Cohen AS. Total and capillary fingertip blood flow in Raynaud’s phenomenon. N Engl J Med 1971; 285(5): 259–263.
69. Coffman JD. Pathogenesis and treatment of Raynaud’s phenomenon. Cardiovasc Drugs Ther 1990; 4(Suppl. 1): 45–51.
70. Cooke JP, Creager SJ, Scales KM et al. Role of digital artery adrenoceptors in Raynaud’s disease. Vasc Med 1997; 2(1): 1–7.
71. Dorffler-Melly J, Luscher TF, Wenk M et al. Endothelin-1 and cold provocation in health, primary Raynaud’s phenomenon, and progressive systemic sclerosis. Microvasc Res 1996; 52(2): 193–197.
72. Fagius J, Blumberg H. Sympathetic outflow to the hand in patients with Raynaud’s phenomenon. Cardiovasc Res 1985; 19(5): 249–253.
73. Cutolo M, Sulli A, Smith V. Assessing microvascular changes in systemic sclerosis diagnosis and management. Nat Rev Rheumatol 2010; 6(10): 578–587.
74. Cutolo M, Ferrone C, Pizzorni C et al. Peripheral blood perfusion correlates with microvascular abnormalities in systemic sclerosis: a laser-Doppler and nailfold videocapillaroscopy study. J Rheumatol 2010; 37(6): 1174–1180.
75. Goodfield MJ, Orchard MA, Rowell NR. Whole blood platelet aggregation and coagulation factors in patients with systemic sclerosis. Br J Haematol 1993; 84(4): 675–680.
76. Herrick AL. Pathogenesis of Raynaud’s phenomenon. Rheumatology (Oxford) 2005; 44(5): 587–596.
77. Brennan P, Silman A, Black C et al. Validity and reliability of three methods used in the diagnosis of Raynaud’s phenomenon. The UK Scleroderma Study Group. Br J Rheumatol 1993; 32(5): 357–361.
78. Linnemann B, Erbe M. Raynauds phenomenon – assessment and differential diagnoses. Vasa 2015; 44(3): 166–177.
79. Bartelink ML, Wollersheim H, Leesmans E et al. A standardized finger cooling test for Raynaud’s phenomenon: diagnostic value and sex differences. Eur Heart J 1993; 14(5): 614–622.
80. Lau CS, Khan F, Brown R et al. Digital blood flow response to body warming, cooling, and rewarming in patients with Raynaud’s phenomenon. Angiology 1995; 46(1): 1–10.
81. Ring EF. Quantitative thermal imaging. Clin Phys Physiol Meas 1990; 11 Suppl A: 87–95.
82. Briers JD. Laser Doppler, speckle and related techniques for blood perfusion mapping and imaging. Physiol Meas 2001; 22(4): R35–66.
83. Seifalian AM, Stansby G, Jackson A et al. Comparison of laser Doppler perfusion imaging, laser Doppler flowmetry, and thermographic imaging for assessment of blood flow in human skin. Eur J Vasc Surg 1994; 8(1): 65–69.
84. Toprak U, Hayretci M, Erhuner Z et al. Dynamic Doppler evaluation of the hand arteries to distinguish between primary and secondary raynaud phenomenon. Am J Roentgenol 2011; 197(1): W175–180.
85. Hahn M, Hahn C, Junger M et al. Local cold exposure test with a new arterial photoplethysmographic sensor in healthy controls and patients with secondary Raynaud’s phenomenon. Microvasc Res 1999; 57(2): 187–198.
86. Kim YH, Ng SW, Seo HS et al. Classification of Raynaud’s disease based on angiographic features. J Plast Reconstr Aesthet Surg 2011; 64(11): 1503–1511.
87. Allanore Y, Seror R, Chevrot A et al. Hand vascular involvement assessed by magnetic resonance angiography in systemic sclerosis. Arthritis Rheum 2007; 56(8): 2747–2754.
88. Jens S, Koelemay MJ, Reekers JA et al. Diagnostic performance of computed tomography angiography and contrast-enhanced magnetic resonance angiography in patients with critical limb ischaemia and intermittent claudication: systematic review and meta-analysis. Eur Radiol 2013; 23(11): 3104–3114.
89. van den Hoogen F, Khanna D, Fransen J et al. 2013 classification criteria for systemic sclerosis: an American college of rheumatology/European league against rheumatism collaborative initiative. Ann Rheum Dis 2013; 72(11): 1747–1755.
90. Bellando-Randone S, Matucci-Cerinic M. From Raynaud’s phenomenon to very early diagnosis of systemic sclerosis – The VEDOSS approach. Curr Rheumatol Rev 2013; 9(4): 245–248.
91. Herrick AL. The pathogenesis, diagnosis and treatment of Raynaud phenomenon. Nat Rev Rheumatol 2012; 8(8): 469–479.
92. Ennis H, Hughes M, Anderson ME et al. Calcium channel blockers for primary Raynaud’s phenomenon. Cochrane Database Syst Rev 2016; 2: CD002069.
93. Pope J. Raynaud’s phenomenon (primary). BMJ Clin Evid 2013; 2013 : 1119.
94. Stewart M, Morling JR. Oral vasodilators for primary Raynaud’s phenomenon. Cochrane Database Syst Rev 2012(7): CD006687.
95. Roustit M, Hellmann M, Cracowski C et al. Sildenafil increases digital skin blood flow during all phases of local cooling in primary Raynaud’s phenomenon. Clin Pharmacol Ther 2012; 91(5): 813–819.
96. Pauling JD, O'Donnell VB, McHugh NJ. The contribution of platelets to the pathogenesis of Raynaud’s phenomenon and systemic sclerosis. Platelets 2013; 24(7): 503–515.
97. Cairoli E, Rebella M, Danese N et al. Hydroxychloroquine reduces low-density lipoprotein cholesterol levels in systemic lupus erythematosus: a longitudinal evaluation of the lipid-lowering effect. Lupus 2012; 21(11): 1178–1182.
98. Abou-Raya A, Abou-Raya S, Helmii M. Statins: potentially useful in therapy of systemic sclerosis-related Raynaud’s phenomenon and digital ulcers. J Rheumatol 2008; 35(9): 1801–1808.
99. Nguyen VA, Eisendle K, Gruber I et al. Effect of the dual endothelin receptor antagonist bosentan on Raynaud’s phenomenon secondary to systemic sclerosis: a double-blind prospective, randomized, placebo-controlled pilot study. Rheumatology (Oxford) 2010; 49(3): 583–587.
100. Belch JJ, Newman P, Drury JK et al. Intermittent epoprostenol (prostacyclin) infusion in patients with Raynaud’s syndrome. A double-blind controlled trial. Lancet 1983; 1(8320): 313–315.
101. Pope J, Fenlon D, Thompson A et al. Iloprost and cisaprost for Raynaud’s phenomenon in progressive systemic sclerosis. Cochrane Database Syst Rev 2000(2): CD000953.
102. Bartolone S, Trifiletti A, De Nuzzo G et al. Efficacy evaluation of prostaglandin E1 against placebo in patients with progressive systemic sclerosis and significant Raynaud’s phenomenon. Minerva Cardioangiol 1999; 47(5): 137–143.
103. Hashem M, Lewis R. Successful long-term treatment of a patient with long-standing Raynaud’s disease by an extradural bupivacaine block. Anaesth Intensive Care 2007; 35(4): 618–619.
104. Claes G, Drott C, Gothberg G. Thoracoscopic sympathicotomy for arterial insufficiency. Eur J Surg Suppl 1994(572): 63–64.
105. Kotsis SV, Chung KC. A systematic review of the outcomes of digital sympathectomy for treatment of chronic digital ischemia. J Rheumatol 2003; 30(8): 1788–1792.
106. Bank J, Fuller SM, Henry GI et al. Fat grafting to the hand in patients with Raynaud phenomenon: a novel therapeutic modality. Plast Reconstr Surg 2014; 133(5): 1109–1118.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Editorial
- 15 let zkušeností s biologickou léčbou zánětlivých revmatických onemocnění v národním registru ATTRA
- Časná diagnostika spondyloartritid
- Diferenciální diagnostika monoartritid
- Osteoartróza ručních kloubů
- Raynaudův fenomén
- Imunitně zprostředkovaná nekrotizující myopatie asociovaná s léčbou statiny
- Kardiovaskulární riziko u revmatických onemocnění
- Vybrané kapitoly z intenzivní péče
- Ceny předsednictva ČLS JEP za nejlepší vědecké práce za rok 2015
- 70 let profesora Vladimíra Paličky
- Životní jubileum prof. MUDr. Rostislava Koďouska, DrSc.
- Zemřel prof. MUDr. PhDr. Eugen Strouhal, DrSc.
- Jubilanti – listopad 2016
- Přednáškové večery Spolku českých lékařů (listopad − prosinec 2016)
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Diferenciální diagnostika monoartritid
- Osteoartróza ručních kloubů
- Raynaudův fenomén
- Imunitně zprostředkovaná nekrotizující myopatie asociovaná s léčbou statiny
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy