-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Metabolický syndrom u nemocných vyššího věku
Metabolic syndrome in older patients
The paper provides a summary of metabolic syndrome definitions and criteria defining the diagnosis. Pathological and physiological aspects of the component parts of metabolic syndrome – insulin resistance and type 2 diabetes mellitus, hypertension, atherogenic hyperlipidaemia – are explored; the association between hyperuricaemia and metabolic syndrome is also discussed. The paper further includes our own research results – studies on metabolic syndrome incidence in senior populations living in their own homes. Collaboration between general practitioners of the south-western Moravian regions and the Internal Medicine, Geriatric and General Medicine Clinic of the Faculty of Medicine Masaryk University and University Hospital Brno enabled assessment of 147 seniors; the diagnosis of metabolic syndrome, as defined by the IDF, was confirmed in the total of 23 clients, i.e. 15.7% of the sample. In addition, a significant proportion of the sample fulfilled 3 criteria - 18 clients, 12.1%. A notable correlation was identified between the incidence of metabolic syndrome and age – r = –1.10, p > 0.05 – i. e. a trend towards lower incidence in higher age. The incidence of metabolic syndrome showed significant negative correlation with cognitive functioning (MMSE) - r = –0.44 and self-sufficiency (ADL) – r = –0.44. Depending on the applied clinical criteria, the incidence of metabolic syndrome in older patients is about 20–40 %. The incidence of metabolic syndrome in older population is significantly negatively associated with cognitive functioning, self-sufficiency and incidence of depression.
Keywords:
metabolic syndrome – hypertension – insulin resistance – diabetes mellitus – obesity – hyperlipidaemia – cognitive impairment – self-sufficiency – depression
Autoři: H. Matějovská Kubešová; J. Matějovský; I. Bychler; Z. Čejglová; F. Dvorský; I. Leixner; M. Navratilova; P. Tomeček; H. Meluzínová
Působiště autorů: Klinika interní, geriatrie a praktického lékařství LF MU a FN Brno
Vyšlo v časopise: Čes Ger Rev 2009; 7(3-4): 110-116
Souhrn
Sdělení předkládá přehled definic metabolického syndromu a kritérií pro stanovení této diagnózy. Jsou rozebrány patologicko‑fyziologické aspekty jednotlivých složek metabolického syndromu – inzulinové rezistence a diabetu mellitu II. typu, hypertenze, aterogenní hyperlipidemie, diskutován je i vzájemný vztah hyperurikemie a metabolického syndromu. Sdělení je doplněno vlastními výsledky – studií výskytu metabolického syndromu v seniorské populaci žijící ve vlastním prostředí. Ve spolupráci s praktickými lékaři okresů na jihovýchodě Moravy a s geriatrickou ambulancí Kliniky interní, geriatrie a praktického lékařství LF MU a FN Brno bylo vyšetření 147 seniorů, diagnózu metabolického syndromu splňovalo celkem 23 klientů, tedy 15,7 % sledovaného souboru dle definice IDF. Poměrně značná část sledovaného souboru však dosáhla tří kritérií – 18 klientů, 12,1 %. Byla zjištěna významná závislost výskytu metabolického syndromu na věku – r = – 0,10, p > 0,05 – tedy spíše trend k nižšímu výskytu ve vyšším věku. Výskyt metabolického syndromu jevil signifikantní negativní korelaci s kognitivním výkonem (MMSE) – r = – 0,44 a soběstačností (ADL) – r = – 0,44. Metabolický syndrom se vyskytuje přibližně u 20 – 40 % nemocných vyššího věku v závislosti na použitých klinických kritériích. Výskyt metabolického syndromu ve starší populaci významným způsobem ovlivňuje negativně kognitivní funkce, soběstačnost starších nemocných i výskyt deprese.
Klíčová slova:
metabolický syndrom – hypertenze – inzulinová rezistence – diabetes mellitus – obezita – hyperlipidemie – kognitivní porucha – soběstačnost – depreseÚvod
Nepříznivého vlivu kombinace vysokého krevního tlaku, poruchy metabolizmu lipidů, nadváhy, obezity a dny na další vývoj celkového zdravotního stavu nemocných, zvláště ve smyslu urychlení rozvoje aterosklerotického postižení a zvýšení kardiovaskulární morbidity i mortality, si klinici všímali již před desetiletími. Reavenův syndrom či syndrom X či Kaplanův smrtící kvartet je možno v literatuře zachytit již od poloviny minulého století [1–3]. Další užívaná synonyma jsou aterotrombogenní syndrom, metabolický kardiovaskulární syndrom, syndrom inzulinové rezistence [4]. S prodlužující se délkou života, ale také s rozvojem nových léčebných metod umožňujících překonat některá ze závažných vaskulárních postižení nabývá řešení metabolického syndromu na významu právě z hlediska předcházení těm typům postižení, která současná míra poznání ještě řešit nedovoluje a která mají zásadní negativní vliv na soběstačnost a celkovou kvalitu života seniorů.
Definice metabolického syndromu se postupně vyvíjela implementací výsledků jednotlivých studií hodnotících význam jednotlivých složek metabolického syndromu od spíše skupinového označení jednotlivých složek (dyslipidemie, obezita) po zcela přesná číselně vyjádřená kritéria, užívaná v současné době.
V současné době jsou nejčastěji užívané dvě definice – první podle International Diabetes Federation (IDF) a druhá podle The National Cholesterol Education Program (NCEP) – Adult Treatment Panel III (ATP III).
Podle dnešních definic tedy trpí metabolickým syndromem jedinec, který dosahuje patologických hodnot nejméně ve třech z kritérií zobrazených v tab. 1 [5]. Definice dle IDF považuje za hlavní kritérium abdominální obezitu a další kriteria k ní přiřazuje (tab. 2).
Každá složka metabolického syndromu představuje určitý mechanizmus poškození, přičemž jednotlivé typy poškození se povětšinou vzájemně sčítají až potencují. Nověji se hovoří o možnosti připojení zvýšené sérové hladiny leptinu jako další složky metabolického syndromu – byla prokázána významná souvislost mezi touto veličinou a intenzitou metabolického syndromu [6].
K základnímu klinickému a biochemickému obrazu se potom sekundárně přiřazují další poruchy – endoteliální dysfunkce, hyperhomocystinemie, odchylky v metabolizmu steroidů apod.
Syndrom inzulinové resistence
Inzulin působí v řadě tkání řadou mechanizmů, v jejich centru stojí komplikovaný signální celulární mechanizmus spočívající v autofosforylaci tyrozinkinázy beta‑podjednotky inzulinového receptoru. Následně se rozbíhá řetězec reakcí specifický pro danou buňku, potažmo tkáň. Inzulinová resistence znamená neschopnost buňky či tkáně reagovat příslušnou metabolickou odpovědí na běžné sérové koncentrace inzulinu, a to na úrovni samotného receptoru či na úrovni postreceptorové. V rámci udržení homeostázy dochází ke kompenzatorní hyperinzulinemii, charakterizované zvláště opožděným nástupem sekrece po glukózové zátěži a následnou dlouhodobě přetrvávající zvýšenou sekrecí [7].
Z hlediska možných příčin je předpokládaná polygenní dědičnost – inzulinová resistence primární, v obecné populaci je však nepochybně nejčastější inzulinová resistence sekundární způsobená nadměrným příjmem energie, nízkým výdejem energie, nevhodným složením stravy, stresem, kouřením i některými medikamenty.
Důsledkem inzulinové resistence jsou specifické změny v metabolizmu lipidů – hypertriglyceridemie, snížení sérové koncentrace HDL‑cholesterolu, vyšší vzestupy hladin lipidů postprandiálně, retence vody a sodíku, snížená schopnost syntézy oxidu dusnatého, aktivace sympatiku inzulinem. Tento soubor vede k rozvoji typických klinických příznaků metabolického syndromu. V posledních letech dokonce i sám GM Reaven, podle něhož je metabolický syndrom také nazván, zdůrazňuje inzulinovou resistenci jako původce celého dalšího řetězce a pokládá otázku, zda diagnózu metabolického syndromu vůbec ještě potřebujeme.
Hypertenze
V odhalování etiologie vzniku hypertenze se v současné době považuje za jeden z hlavních faktorů endoteliální dysfunkce se snížením tvorby NO a následnou převahou vazokonstrikčních mechanizmů. Ve vyšším věku vstupuje do celého procesu ateroskleróza, na jejímž rozvoji se podílí mimo jiné i podíl sterilního zánětu v cévní stěně jako reakce na přítomnost noxy, CRP jako mediátor zánětu dále přispívá endoteliální dysfunkci inhibicí tvorby NO [8].
Dalším zásadním faktorem je postupná převaha vazokonstrikčních stimulů v podobě endotelinu, tromboxanu A2 a angiotenzinu II nad vazodilatačními – prostacyklin, endoteliální hyperpolarizující faktor a oxid dusnatý. Zvláště nízká aktivita NO syntetázy s následnou nízkou produkcí NO jako protizánětlivého, vazodilatačního a antitrombotického faktoru je v současné době považována za další z hlavních stimulů proaterogenních pochodů [9].
Nověji se objevují zmínky o synergním či antagonistickém působení dalších substancí na arteriální systém – aktivace arginázy vede ke snížení dostupnosti L-argininu jako podpůrného faktoru syntetázy NO s následným poklesem jeho produkce a snížením vazodilatačního účinku [10].
Z výše uvedených hledisek může samozřejmě vyvstat otázka, zda je u nemocných vyššího věku opravdu prvotním efektem zvýšení krevního tlaku a teprve sekundárně vzniká poškození cévní, či zvýšení krevního tlaku je jev sekundárně nasedající na probíhající změny v cévní stěně. Odlišný charakter hypertenze ve vyšším věku by spíše nasvědčoval druhé možnosti. Tento názor podporuje i podstatně slabší prediktivní hodnota hypertenze pro vývoj metabolického syndromu ve srovnání s abdominální obezitou či vyšší sérovou hladinou triglyceridů [11]. Klinická zkušenost říká, že řada jedinců s celoživotní nadváhou nemá v mladším věku problém s vyššími hodnotami krevního tlaku, jakmile však dospějí do seniorského věku, objevuje se u nich hypertenze, většinou systolická. Komplikace dlouhodobě špatně léčené hypertenze jsou následně jednou z hlavních příčin disability [12]. Pro výše uvedený mechanizmus svědčí i výsledky studie na ledvinách odejmutých jejich nositelům pro Grawitzův tumor. Ledvinný cévní systém nemocných s metabolickým syndromem podle panelu ATP III vykazoval podstatně pokročilejší změny ve smyslu aterosklerózy oproti nemocných bez metabolického syndromu [13].
Obezita
Obezita jako klinický příznak je při celkovém hodnocení nemocného známkou nerovnováhy mezi příjmem a výdejem energie, což při současném převažujícím životním stylu znamená ve většině případů přejídání se. Zvláště významným rizikovým faktorem je obezita viscerální – abdominální – omentální, která znamená nadprodukci dipeptidylpeptidázy, zvýšenou aktivaci inkretinového systému, nadprodukci inzulinu a následný vznik inzulinové resistence. Proto se v současné době hodnotí jako významnější rizikový faktor pozitivita antropometrických veličin jako parametr hodnotící právě viscerální obezitu. Studie zabývající se významem jednotlivých antropometrických parametrů pro hodnocení metabolického syndromu seřadila jejich senzitivitu. Jako nejcitlivější se jevil poměr objemu pasu a výšky nemocného – weist : height ratio (WHtr), na druhém místě byla hodnota BMI a objemu pasu – waist circumference (WC), teprve jako třetí byl vyhodnocen dříve často používaný poměr objemu pasu a objemu boků – whist : hip ratio (WHpR) a objem boků – hip circumference (HC) [14].
Na druhé straně existuje i skupina nemocných nesplňujících kritéria celkové ani viscerální-abdominální obezity, přesto však metabolicky výrazně rizikových z hlediska rozvoje kardiovaskulárního postižení [15]. Tento rozpor vede k diskuzím o možných příčinách, předpokládaný genetický vliv však zatím potvrzen nebyl [16]. Ovlivnění obezity podáváním antiobezitik a snahou o změnu stravovacích návyků se také zatím nejeví jako úspěšné – studie, jejímž cílem bylo navodit u obézních nemocných s metabolickým syndromem změnu stravovacích návyků podáváním orlistatu, sice prokázala po dvouletém trvání snížení příjmu tuků, nicméně energetický příjem byl doplňován zvýšením podílu sacharidů ve stravě [17].
Povzbudivějších výsledků bylo dosaženo ročním zařazením nemocných – žen průměrného věku 69 let – s metabolickým syndromem do tréningového programu – oproti kontrolní skupině došlo k významnému snížení celkového tělesného tuku, obvodu boků, hladiny celkového cholesterolu, triglyceridů, ke zvýšení hladiny HDL‑cholesterolu. Proti očekávání nebyla ovlivněna glykemie, sérová koncentrace CRP, objem pasu a hodnota krevního tlaku [18]. Snížení hmotnosti vlivem hypokalorické diety také vedlo k úpravě utlumené reaktivity sympatoadrenálního systému na příjem glukózy u inzulinresistentních nemocných s metabolickým syndromem – tento jev je autory pokládán za projev efektivnějšího postprandiálního zpracování energie [19].
Abdominální obezita se ukázala být velmi silným prediktivním faktorem vzniku metabolického syndromu při dlouhodobém sledování v rámci Baltimorské studie [11].
Aterogenní hyperlipidemie
Jako nejzávažnější kombinace pro urychlení cévního postižení se jeví v současné době zvýšení hladiny triglyceridů společně s nižší hladinou HDL‑cholesterolu. Tato kombinace znamená trvale vyšší zátěž endotelu a celé cévní stěny vlivem nedokonalého transportu [20]. Pokles HDL‑cholesterolu v rámci inzulinové resistence je vysvětlován zvýšením hladiny triglyceridů, které jsou rychle směňovány za estery cholesterolu, nedostatečnou blokací lipolýzy v tukové tkáni dochází ke zvýšení hladin volných mastných kyselin. Volné mastné kyseliny inhibují na úrovni všech inzulinsenzitivních tkání inzulinem stimulované vychytávání glukózy a bludný kruh se tak uzavírá [20].
Zajímavé je, že hlavní příčinou zvyšování hladiny triglyceridů v rámci metabolického syndromu je nejpravděpodobněji právě inzulinová rezistence, protože opatření snižující inzulinovou rezistenci vedou ke snížení hladiny triglyceridů, ale naopak snížení triglyceridemie farmakologicky nevede ke snížení inzulinorezistence [4].
Pokles sérové koncentrance HDL‑cholesterolu a vzestup triglyceridemie byly již dříve odhaleny jako nezávislé rizikové faktory vzniku ischemické choroby srdeční [21].
Hyperurikemie
Zvýšení hladiny kyseliny močové bylo dlouhou dobu považováno za jednu ze standardních součástí metabolického syndromu, v posledních letech jsou však vedeny na toto téma diskuze. V současné době je hyperurikemie považována za spíše sekundární projev doprovázející metabolický syndrom způsobený snížením renální exkrece kyseliny močové vlivem inzulinorezistence, na druhé straně je stále uznáván vliv hyperurikemie na zvýšení inzulinové rezistence [2]. Kyselina močová samotná má prokázané antioxidační účinky, tedy se zvažuje dokonce i její role protektivní. Dalším pozoruhodným momentem je pozorovaná normalizace hladin kyseliny močové při propuknutí diabetu 2. typu, zatímco po dobu porušené glukózové tolerance byla její hladina vyšší.
Metabolický syndrom u seniorů žijících ve vlastním prostředí – vlastní výsledky
Cílem našeho sledování bylo zjistit zastoupení metabolického syndromu v seniorské populaci žijící ve vlastním prostředí ve věku nad 65 let, která je v péči praktických lékařů a geriatrů. Celý soubor seniorů byl vyšetřován ve spolupráci s praktickými lékaři okresu Hodonín, Uherské Hradiště, Zlín a geriatrickou ambulancí Kliniky interní geriatrie a praktického lékařství (KIGPL) FN Brno Bohunice.
Vyšetření sledovaného souboru zahrnovalo základní anamnestické a fyzikální vyšetření, základní laboratorní vyšetření, základní geriatrické testy – MMSE (Mini Mental State Examination), ADL (Acitivites of Daily Living), IADL (Instrumental Activities of Daily Living) a geriatrickou škálu deprese, zjištění všech diagnóz, pro které se senior léčí a všech léků, které senior pravidelně užívá.
Všichni senioři jsou vyšetřeni podle jednotného protokolu. Praktičtí lékaři, lékaři geriatrické ambulance a jejich sestry byli instruováni ve smyslu jednotného postupu vyplňování dotazníků, protokolu vyšetření.
Ve sledovaném souboru byl vyhodnocen výskyt jednotlivých složek metabolického syndromu, dále byl zjištěn počet klientů splňujících kritéria pro diagnózu metabolického syndromu a byl vyhodnocen vliv přítomnosti metabolického syndromu na celkový zdravotní a funkční stav seniorů sledovaného souboru. Pro stanovení diagnózy metabolického syndromu byla využita kritéria IGF vzhledem k již probíhající terapii dyslipidemií, diabetu a hypertenze.
Pro vyhodnocení získaných dat byly použity základní statistické metody charakterizující soubor a dále Studentův T test, χ-kvadrát a korelační analýza.
Výsledky
Soubor zahrnoval celkem 147 klientů, z toho 55 mužů a 92 žen, průměrný věk sledovaných klientů byl 72,8 ± 6,29 roku, v rozmezí 65–98 roků. Sledovaní klienti se léčili v průměru pro 5,8 ± 2,73 diagnózy, rozmezí 0–11 diagnóz a pravidelně užívali v průměru 4,9 ± 2,70 druhů léků, rozmezí 0–11 druhů léků.
Porušená glukózová tolerance či diabetes mellitus 2. typu se vyskytoval u 45 klientů, tedy u 30,3%, 25 z nich bylo léčeno medikamentózně, u 5 z nich byla aktuálně naměřena glykemie nad 10 mmol/l.
Hypertenze se vyskytovala u 131 klientů sledovaného souboru, tedy u 88,5%, u 10 byly naměřeny hodnoty svědčící pro neuspokojivou kompenzaci.
Dyslipidemie byla nalezena u 116 klientů sledovaného souboru, tj. 78%, z toho bylo léčených medikamentózně 64, fibráty užívalo 6 nemocných, statiny 58 nemocných.
Nadváha se vyskytovala u 71 klientů, tj. u 48%, obezita u 37 klientů – 25,3%. Průměrná hodnota BMI celého souboru byla 27,5 ± 4,09, rozmezí 17,9–43,9.
Hyperurikemie či dna byla diagnostikována u 46 klientů, tedy 31,5%, léčeno medikamentózně bylo 23 klientů. Celkový přehled (obr. 1).
Obr. 1. Výskyt složek metabolického syndromu u klientů sledovaného souboru. 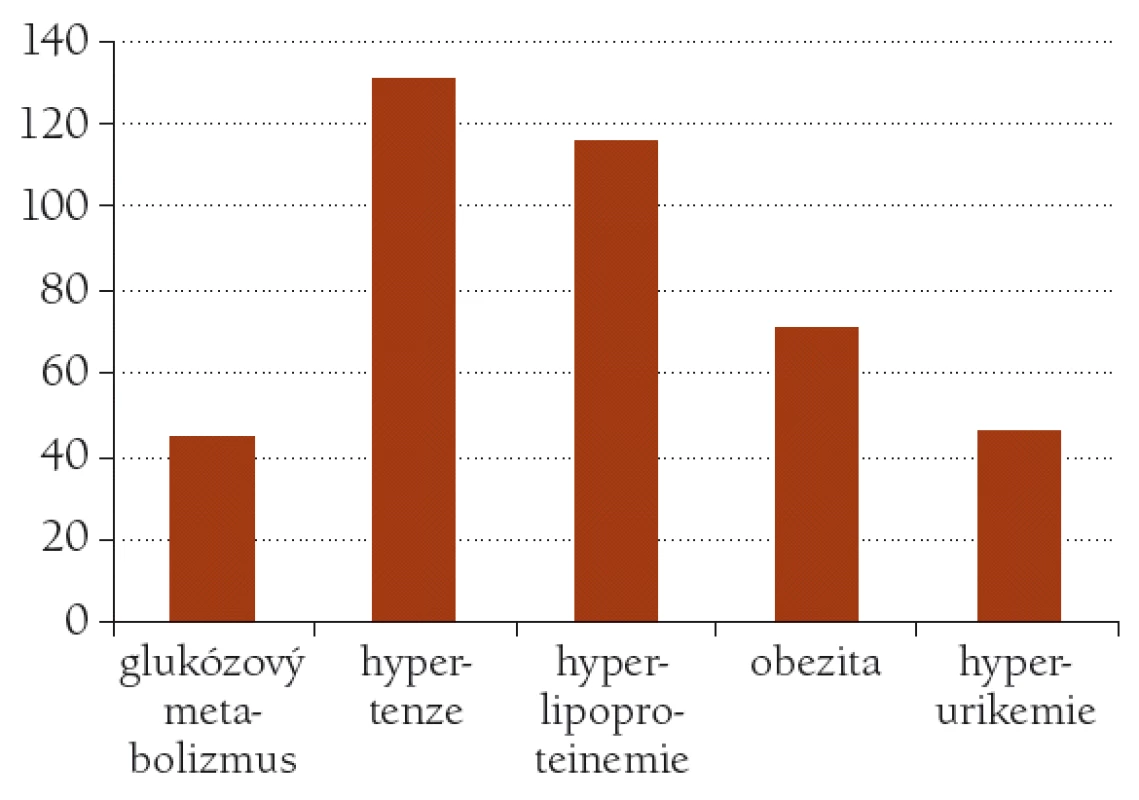
Kritéria metabolického syndromu dle IDF (obezita společně s dalšími nejméně dvěma znaky) splňovalo celkem 23 klientů, tedy 15,7% klientů sledovaného souboru. Poměrně značná část sledovaného souboru však dosáhla tří kritérií – 18 klientů, 12,1%. Nicméně vzhledem k absenci abdominální obezity nelze u nich diagnózu metabolického syndromu podle IDF stanovit. U stejného počtu klientů nebylo zjištěno zastoupení žádné složky metabolického syndromu. Procentuální zastoupení počtu složek metabolického syndromu u nemocných sledovaného souboru ukazuje obr. 2.
Obr. 2. Procentuální zastoupení složek metabolického syndromu u klientů sledovaného souboru. MS – metabolický syndrom 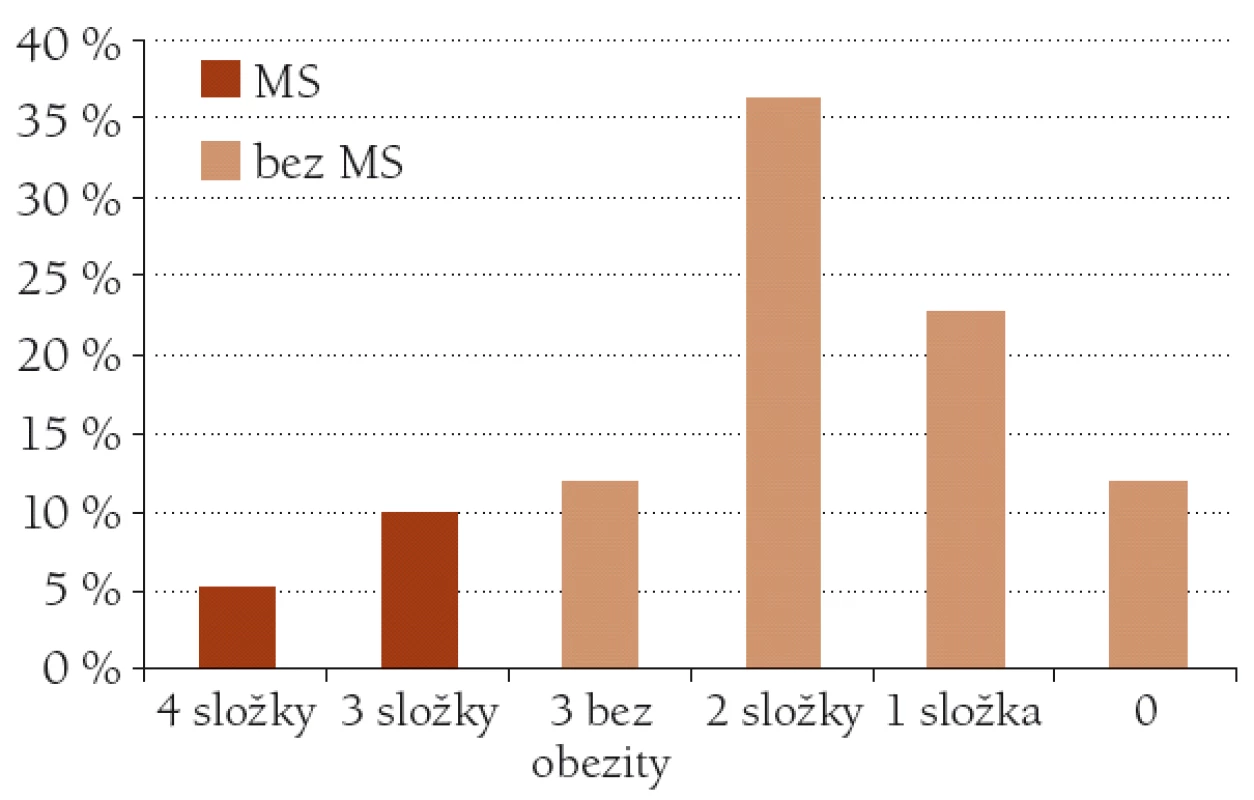
Z hlediska ovlivnění celkového zdravotního a funkčního stavu seniorů nebyla ve sledovaném souboru zjištěna významná závislost výskytu metabolického syndromu na věku – r = –0,10, p > 0,05 – tedy spíše trend k nižšímu výskytu ve vyšším věku, klienti s metabolickým syndromem byli statisticky významně mladší než klienti, kteří nesplňovali kritéria metabolického syndromu – 69,8 ± 3,58 vs 73,2 ± 6,65, p < 0,01. Postižení kognitivních funkcí vyjádřené výsledkem testu MMSE jevilo významnou závislost na výskytu metabolického syndromu – r = –0,44, p < 0,05 (obr. 3). Podobná závislost byla zjištěna také mezi výskytem metabolického syndromu a výsledkem testu ADL – r = –0,44, p < 0,05. Další významná souvislost byla odhalena při vyhodnocení výsledku geriatrické škály deprese a výskytem složek metabolického syndromu – zvyšující se počet zastoupených složek vedl k horším výsledkům škály deprese – r = 0,21, p < 0,05.
Obr. 3. Závislost výsledku testu MMSE na výskytu metabolického syndromu MS. n = 23, r = 44, p < 0,05 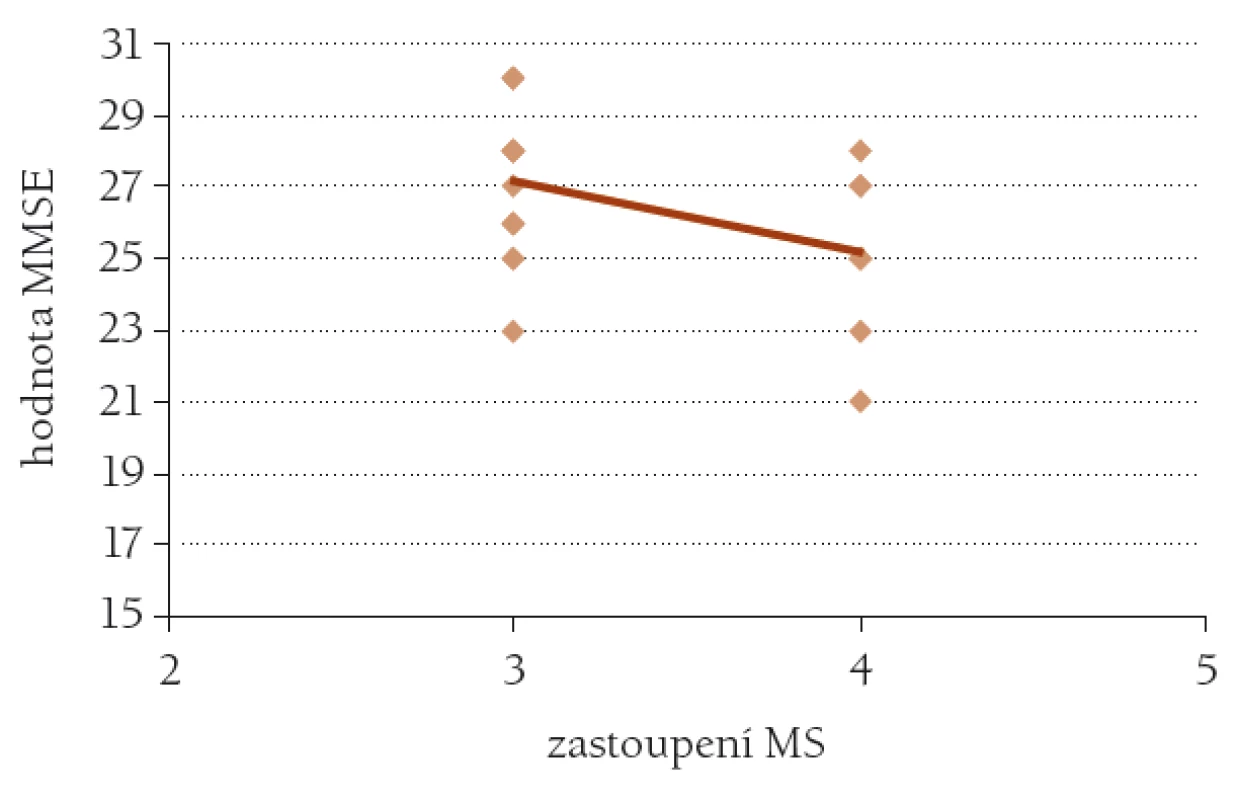
Významnější souvislost byla nalezena při zkoumání ovlivnění soběstačností a tělesné hmotnosti či BMI. Zde byla nalezena překvapivě pozitivní závislost hodnoty BMI a IADL – r = 0,18, p < 0,05 (obr. 4). Závislost věku samotného a hmotnosti, resp. BMI, se ukázala významně reciproční – r = –0,35, p < 0,01, resp. r = –0,24, p < 0,01.
Obr. 4. Závislost hodnoty IADL na hodnotě BMI. n = 147, r = 0,18, p < 0,05 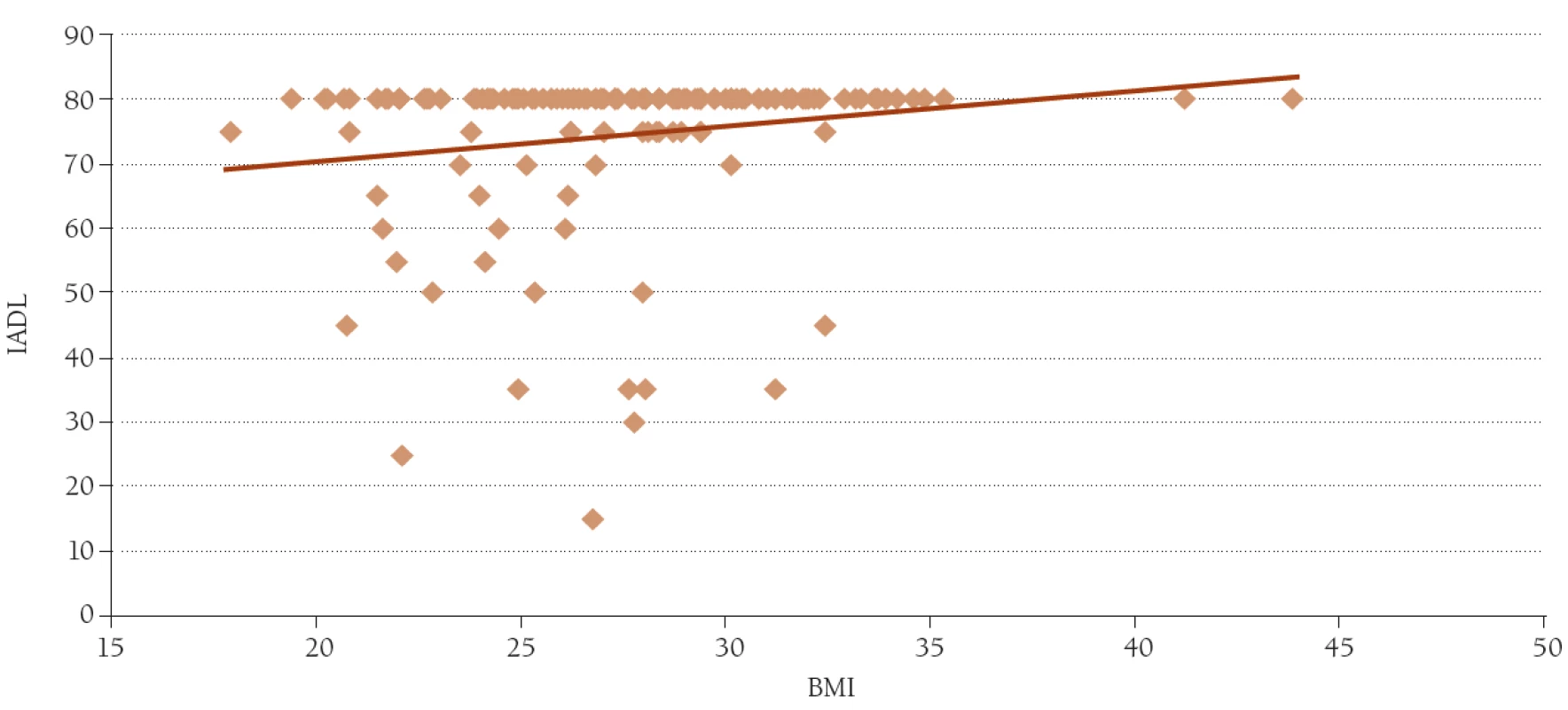
Při vyhodnocování laboratorních nálezů jevily podle očekávání zřetelnou závislost hodnoty sérových triglyceridů a tělesné hmotnosti či BMI – r = 0,31, p < 0,01, resp. r = 0,22, p < 0,01. Ještě výraznější byla závislost sérových hladin triglyceridů a glykemie – r = 0,35, p < 0,01. Vyhodnocení vztahu sérové hladiny kyseliny močové k složkám metabolického syndromu ukázalo zřetelně, že hyperurikemie s výskytem metabolického syndromu významně souvisí, a to jak ve vztahu k zvýšené hladině triglyceridů, tělesné hmotnosti či BMI – r = 0,24, p < 0,01, r = 0,41, p < 0,01, r = 0,25, p < 0,01, tak o něco méně těsně ke glykemii – r = 0,20, p < 0,05.
Diskuze
Ve sledovaném souboru byly dle očekávání zastoupeny ve větším počtu ženy, průměrný počet diagnóz ani průměrný počet užívaných léků se nelišil od našich dříve získaných dat [22]. Ve sledovaném souboru se vyskytovaly některé ze složek metabolického syndromu ve zřetelně vyšším procentu než je udáváno v běžné populaci – hypertenze u téměř 90%, poruchy metabolizmu tuků u téměř 80%, přesto však byl výskyt metabolického syndromu u 18% klientů sledovaného souboru podle příslušných kritérií spíše nižší ve srovnání s různými studiemi hodnotícími výskyt metabolického syndromu, kdy reference o výskytu kolísají od 15 do 40%. K diskuzi však stále zůstává skupina nemocných se zastoupením tří složek metabolického syndromu, avšak bez centrální obezity, tedy nesplňujících kritéria metabolického syndromu, na jejich rizikovost je však v literatuře poukazováno [15].
Příčinou může být celková tendence ke snižování hmotnosti se zvyšujícím se věkem, vzhledem k tomu, že se jedná o průřezovou studii, je možno tento jev pokládat za další nepřímý důkaz o tom, že se klienti s nižším výskytem metabolického syndromu dožívají vyššího věku.
Ve sledovaném souboru jsme nepotvrdili souvislost přítomnosti metabolického syndromu s pozitivitou zánětlivých parametrů jako často referované integrální součásti rozvoje endoteliálního poškození [23,8]. Vysvětlením může být fakt vyššího věku, a tím snížené schopnosti zánětlivé reakce, ale také samotný patofyziologický mechanizmus, kdy se podíl zánětlivé složky na vzniku endoteliálního poškození přepodkládá spíše na počátku [24]. Další příčinou může samozřejmě být i výběr příslušného markeru, kdy obecně používané CRP může být pro tuto situaci nedostatečně senzitivní metodou [25].
Ve shodě s literárními údaji byla i nalezená pozitivní závislost výsledků geriatrické škály deprese a narůstajícího počtu přítomných složek metabolického syndromu [26].
Zajímavé jsou diskuze týkající se hyperurikemie jako součásti metabolického syndromu či jako sekundárně vyvolaného jevu. Naše výsledky potvrdily těsnou závislost sérové hladiny kyseliny močové a výskytu hypertriglyceridemie, diabetu i BMI. Vysvětlením může být jednak důsledek zvýšeného příjmu stravy obecně včetně potravin bohatých na puriny, ale také potenciace tkáňové inzulinové rezistence zvýšenou hladinou kyseliny močové [27].
Závěry pro praxi
Metabolický syndrom se vyskytuje přibližně u 20–40% nemocných vyššího věku v závislosti na použitých klinických kritériích.
Výskyt metabolického syndromu ve starší populaci významným způsobem ovlivňuje negativně kognitivní funkce, soběstačnost starších nemocných, výskyt deprese.
Při průkazu přítomnosti některé ze složek metabolického syndromu je nutno aktivně pátrat po přítomnosti i složek dalších, aby bylo možno včas intervenovat a zpomalit tak progresi celého patofyziologického komplexu.
Doručeno do redakce 13. 8. 2009
Přijato k publikování 17. 9. 2009
prof. MUDr. Hana Matějovská Kubešová, CSc.,
Mgr. Jan Matějovský, MUDr. Igor Bychler, MUDr. Zdenka Čejglová, MUDr. František Dvorský, MUDr. Ivan Leixner, MUDr. Marie Navrátilová, MUDr. Pavel Tomeček, MUDr. Hana Meluzínová
Klinika interní, geriatrie a praktického lékařství LF MU a FN Brno
hkubes@med.muni.cz
Zdroje
1. Reaven GM. Banting lecture 1988. Role of insulin resistance in human disease. Diabetes 1988; 37(12): 1595–1607. Review.
2. Fisher NDL, Williams GH. Hypertensive Vascular Disease. In: Kasper DL, Fauci AS, Longo DL et al (eds). Harrison‘s principles of internal medicine. 16th ed. New York: McGraw-Hill 2005.
3. Klener P et al. Vnitřní lékařství. Praha: Galén. 2. dopl. vyd. 2001 : 711 – 731.
4. Pelikánová T. Syndrom inzulinové rezistence. Postgrad Med 2002; 1 : 7 – 13.
5. Expert Panel on Detection, Evaluation, and treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP). Expert Panel on Detection, Evaluation and treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001; 344 (19): 2486–2497.
6. Ding XY, Mi J, Chen, H et al. The relationship between serum leptin level and metabolic syndrome among a middle-aged Chinese population. Zhonghua Yu Fang Yi Xue Za Zhi 2007, 41 (4): 281 – 284.
7. Reaven G. The metabolic syndrome: is this diagnosis necessary? Am J Clin Nutr 2006; 83 (6): 1237–1247.
8. Nagaoka T, Kuo L, Ren Y et al. C-reactive protein inhibits endotelium-dependent nitric oxide-mediated dilation of retinal arterioles via enhanced superoxide production. Invest Ophthamol Vis Sci 2008; 49 (5): 2053–2060.
9. Kalvach Z, Zadák Z, Jirák R et al. Geriatrie a gerontologie. 1. vyd. Praha: Grada 2004.
10. Santhanam L, Christianson DW, Nyhan D et al. Arginase and Vascular Aging. J Appl Physiol 2008; 105 (5):1632–1642.
11. Scuteri A, Morrell CH, Najjar SS et al. Longitudinal paths to the metabolic syndrome: can the incidence of the metabolic syndrome be predicted? The Baltimore Longitudinal Study of Aging. J Gerontol A Biol Sci 2009; 64 (5): 590–598.
12. Denys K, Cankurtaran M, Janssens W et al. Metabolic syndrome in the elderly: an overview of the evidence. Acta Clin Belg 2009; 64 (1): 23–34.
13. Alexander MP, Patel TV, Farag YM et al. Kidney pathological changes in metabolic syndrome: a cross-sectional study. Am J Kidney Dis 2009; 53 (5): 751–759.
14. Can AS, Bersot TP, Gönen M. Anthropometric indices and their relationship with cardiometabolic risk factors in a sample of Turkish adults. Public Health Nutrition 2009; 12 (4): 538–46.
15. Beck E, Scheen AJ. Metabolically obese with normal weight individuals: an intriguing phenotype. Rev Med Liege 2009; 64 (1): 16–24.
16. Bouchard L, Faucher G, Tchernof A et al. Comprehensive genetic analysis of the dipeptidyl peptidase-4 gene and cardiovascular disease risk factors in obese individuals. Acta Diabetol 2009; 46 (1): 13–21.
17. Svendsen M, Helgeland M, Tonstad S. The long‑term influence of orlistat on dietary intake in obese subjects with components of metabolic syndrome. J Hum Nutr Diet 2009; 22 (1): 55–63.
18. Kemmler W, Von Stengel S, Engelke K et al. Exercise decreases the risk of metabolic syndrome in elderly females. Med Sci Sports Exer 2009; 41 (2): 297–305.
19. Straznicky NE, Lambert GW, McGrane MT et al. Weight loss may reverse blunted sympathetic neural responsiveness to glucose ingestion in obese subjects with metabolic syndrome. Diabetes 2009; 58 (5): 1126–1132.
20. Ďurovcová V, Haluzík M, Wenchich L et al. Mitochondrie a patogeneze diabetes mellitus 2. typu na úrovní pankreatu a jednotlivých inzulin senzitivních tkání. Diebatologie, metabolismus, endokrinologie, výživa 2009; 2 : 65–70.
21. Hokanson JE, Austin MA. Plasma triglyceride level as a risk factor for cardiovascular disease independent of high‑density lipoprotein cholesterol level: a meta‑analysis of population based prospective studies. J Cardiovasc Risk 1996; 3 (2): 213–219.
22. Kubešová H, Holík J, Šipr K et al. Odraz vědeckých poznatků v léčbě starších klientů praktického lékaře. Praktický lékař 2000; 9 (80): 509–513.
23. Rizzo M, Rizvi A, Rini GB et al. The terapeutic modulation of aterogenic dyslipidemia and inflammatory markers in the metabolic syndrome: What is the clinical relevance? Acta diabetol 2009; 46 (1): 1–11.
24. McIntyre RS, Rasgon NL, Kemp DE et al. Metabolic syndrome and major depressive disorder: co-occurence and pathophysiologic overlap. Curr Diab Rep 2009; 1 (1): 51–59.
25. Jurašková B, Solichová D, Bláha V et al. Význam monitorování antioxidační kapacity a metabolizmu lipidů v procesu stárnutí. Čes Ger Rev 2006; 4 (2): 72–76.
26. Bo S, Rosato R, Ciccone G et al. What predicts the metabolic syndrome occurence in a population based kohort of adult healthy subjects? Diabetes Metab Res Rev 2009; 25 (1): 75–82.
27. Wortmann RL. Disorders of purine and pyrimidine metabolism. In: Kasper DL, Fauci AS, Longo DL et al (eds). Harrison‘s principles of internal medicine. 16th ed. New York: McGraw-Hill; 2005.
Štítky
Geriatria a gerontológia Praktické lekárstvo pre dospelých
Článek PHDR. MGR. DAGMAR ČECHOVÁČlánek PHDR. MARIE HERMANOVÁČlánek MUDR. MGR. JAN LUŽNÝČlánek MGR. MARTINA BÍLOVÁČlánek MGR. MARTINA MÁTLOVÁČlánek Úvodní slovoČlánek MUDR. SOŇA ŠTĚPÁNKOVÁ
Článok vyšiel v časopiseČeská geriatrická revue
Najčítanejšie tento týždeň
2009 Číslo 3-4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
-
Všetky články tohto čísla
- Úvodní slovo
- Metabolický syndrom u nemocných vyššího věku
- PROF. MUDR. HANA KUBEŠOVÁ, CSC.
- Novinky v léčbě hypertenze starších pacientů v rámci metabolického syndromu
- PROF. MUDR. MIROSLAV SOUČEK, CSC.
- Diabetická nefropatie a doprovodné postižení ledvin ve stáří
- MUDR. SOŇA ŠTĚPÁNKOVÁ
- Geriatrický pacient a dietoterapie v léčbě metabolického syndromu
- PHDR. MGR. DAGMAR ČECHOVÁ
- Možnosti ovlivnění poruch chování ve stáří
- Výše příspěvku na péči u seniorů se syndromem demence
- PHDR. MARIE HERMANOVÁ
- Poruchy spánku a jejich léčba na gerontopsychiatrických odděleních psychiatrické léčebny v Kroměříži – průřezová studie
- MUDR. MGR. JAN LUŽNÝ
- Následky dopravních nehod seniorů na jízdních kolech
- MGR. MARTINA BÍLOVÁ
- Dny paměti – jak na včasnou diagnózu Alzheimerovy choroby
- MGR. MARTINA MÁTLOVÁ
- XI. brněnský geriatrický den a 15. výroční kongres ČGGS 19.–20. 3. 2009
- Zpráva z kongresu EUGMS a z jednání evropského výboru EUGMS
- Česká geriatrická revue
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Výše příspěvku na péči u seniorů se syndromem demence
- MUDR. MGR. JAN LUŽNÝ
- Možnosti ovlivnění poruch chování ve stáří
- Poruchy spánku a jejich léčba na gerontopsychiatrických odděleních psychiatrické léčebny v Kroměříži – průřezová studie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy





