-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Neinvazivní detekce gonozomálních DNA sekvencí v plazmě gravidních žen s využitím kapilární elektroforézy
Noninvasive Fetal Sex Detection from Maternal Plasma in Pregnant Women
Objective:
Objective of our study was optimization of noninvasive fetal sex detection from maternal plasma in pregnant women.Study design:
Molecular DNA quantitative analyses in gonosomal loci.Setting:
The study was performed at Department of Medical Genetics and Fetal Medicine, University Hospital Olomouc.Methods:
Together 475 DNA samples isolated from maternal plasma in different weeks of pregnancy ranging from 4th w.g. to 37th w.g. Y chromosomal sequences in AMELY and TSPY were tested by refined quantitative fluorescent PCR using capillary electrophoresis.Results:
The method is able to distinguish 1 % of Y chromosomal sequences of artificial mixtures. Investigation and assessment in cell free fetal DNA samples achieved 4.05% of false positivity and 7.15% of false negativity in Y sequence detection.Conclusion:
Established method allows detecting fetal sex with high sensitivity and specificity. The method is possible to use also for quantitative purposes.Key words:
cell free fetal DNA, maternal plasma, fetal sex detection, QF PCR, Y chromosomal sequences.
Autori: R. Vodička; R. Vrtěl; E. Schneiderová; D. Vrbická; M. Procházka; I. Dhaifalah; A. Šantavá; J. Šantavý
Pôsobisko autorov: Ústav lékařské genetiky a fetální medicíny, Fakultní nemocnice Olomouc, vedoucí pracoviště prof. MUDr. J. Šantavý, Ph. D.
Vyšlo v časopise: Ceska Gynekol 2008; 73(3): 150-153
Súhrn
Cíl studie:
Cílem této práce byla optimalizace neinvazivní detekce pohlaví plodu z maternální plazmy.Typ studie:
Molekulární kvantitativní analýza pomocí gonozomálních sekvencí plodu z plazmy gravidních žen.Název a sídlo pracoviště:
Ústav lékařské genetiky a fetální medicíny, Fakultní nemocnice Olomouc.Metodika:
Do projektu bylo zahrnuto 475 vzorků DNA izolovaných z maternální plazmy periferní krve u žen v různých týdnech gravidity v rozmezí 4. t.g . – 37. t.g.
Y chromozomální sekvence v lokusech AMELX/Y a TSPY byly testovány pomocí upravené kvantitativní fluorescenční PCR s využitím laserem indukované fluorescence a kapilární elektroforézy.Výsledky:
Na základě hodnocení artificiálních genotypických směsí je metodika schopna rozlišt i 1% příměs Y chromozomálních sekvencí. Při vyšetřování vlastních vzorků bylo dosaženo ve 4,05 % falešné pozitivity a v 7,15 % falešné negativity zachycení Y sekvencí v maternální plazmě.Závěr:
Vypracovaná metoda umožňuje s velkou citlivostí stanovit fetální pohlaví a je jí také možno dále využít k relativním kvantifikacím.Klíčová slova:
fetální DNA, maternální plazma, stanovení pohlaví, QF PCR, Y chromozomální sekvence.ÚVOD
Analýzu fetálních molekul v maternálních tkáních lze rozdělit na 5 možných úrovní:
- Analýza fetálních buněk kolujících v maternálním krevním řečišti - nejčastěji jde o fetální erytroblasty, kdy koncentrace těchto buněk je uváděna 1 : 103-107 [3, 8, 13]. Poměr fetálních buněk může být zvětšen až na 1-10 : 100. Nejčastěji se používá metodika MACS (magnetic cell sorting ) nebo FACS (fluorescence activated cell sorting) [1, 3, 7, 16]. K vlastní vizualizaci je používána metoda FISH. Největším úskalím FISH je, že 1–2 % normálních diploidních buněk dává 3 signály a 10–20 % trizomických buněk dává pouze 2 signály [12].
- Dalším zdrojem fetálního materiálu mohou být fetální buňky v apoptóze. Tyto buňky lze rozlišit a detekovat pomocí některého z postupů ke zviditelnění apoptických buněk (Komet test, TUNEL test, Systémy založené na detekci kaspázové aktivity) [15].
- Slibnou zvýšenou koncentraci fetálních molekul nabízí volná fetální DNA v maternálním plazmě (séru). Tato koncentrace je závislá na délce těhotenství a v průměru se pohybuje kolem 5 %. Tato koncentrace fetální DNA ve volné formě je téměř 1000krát větší než DNA v intaktních fetálních buňkách cirkulujících v maternální periferní krvi [10, 11].
- V maternálních tkáních byla také prokázána RNA fetálního původu [2, 4, 5].
- Za již rutinně a screeningově využívané diagnostické markery lze také považovat proteiny fetálního a placentálního původu v maternálním krevním oběhu (AFP, PAPPA, volná beta-podjednotka hCG apod).
Pro účely rozlišení a stanovení pohlaví neinvazivním přístupem lze poměrně snadno detekovat Y chromozomální sekvence u plodu mužského pohlaví. Většina technik, která detekuje tyto sekvence, je založena na Real-time PCR. Spolehlivé a rutinní stanovení pohlaví těmito metodami se stává již součástí praxe většiny špičkových pracovišť, které se zabývají neinvazivní prenatální diagnostikou. Cílem této studie bylo vypracování metodiky detekce gonozomálních sekvencí na kapilární elektroforéze, dále vlastní analýza na souboru těhotných žen a posouzení vhodnosti kapilární elektroforézy k této diagnostice.
MATERIÁL A METODIKA
V průběhu projektu bylo shromážděno celkem 475 vzorků DNA izolovaných z maternální plazmy periferní krve u žen v různých týdnech gravidity v rozmezí 4. t.g. až 37. t.g.
Všechny vzorky byly odebrány a vyšetřeny po informovaném souhlasu schváleném Etickou komisí FN Olomouc. Jednotlivé počty vzorků vzhledem k délce gravidity jsou znázorněny v grafu 1.
Izolace DNA z plazmy
Dvojnásobná centrifugace plné krve 10 min při 1500 RPM a poté 20 min při 2500 RPM. Vzorky byly zamraženy do dalšího zpracování při – 20 °C. Následovala izolace DNA kitem QiaAmp DNA mini kit (Qiagene). U každého vzorku byla měřena koncentrace pomocí spektrofotometru Beckman Coulter DU 530.
Použité gonozomální sekvence AMELX, AMELY, TSPY. Sekvence primerů a jejich lokalizace jsou volně dostupné na www.gdb.org. Pro detekci všech lokusů byly použity primery značené FAM a TET fluorofory.
K amplifikaci plazmatické DNA byl používán pouze termocykler MJ Research.
Amplifikace volné DNA izolované z maternální plazmy
K amplifikaci DNA z plazmy byly testovány polymerázy: Taq DNA Polymerase od firmy Fermentas, dále Combi PPP Master Mix od firmy Top Bio a Restorase polymerase od firmy Sigma Aldrich. Pro vlastní analýzu byla zvolena Restorase polymeráza vzhledem ke spolehlivosti, reproducibilitě a množství naamplifikovaného PCR produktu. Z důvodů restorázové aktivity použitého enzymu bylo nutné zavést primery typu Big Band (Sigma Aldrich).
50 μl PCR směs obsahovala 5 μl pufru, 1 μl 5U polymerázy, 1 μl 10mMdNTPs, 1 μl 10pM primery, 20 μl templátové DNA, 22 μl deionizované vody.
PCR podmínky
94 °C/3 min, (94 °C/60 sec, 55 °C/90 sec, 72 °C/2 min) 40-60x opakování, 72 °C/7 min, 10 °C inkubace.
Pro separaci v kapiláře byl využit genetický analyzátor ABI PRISM 310. Jako separační gel byl použit polymer POP4 TM (Applied Biosystems). Separace probíhala ve 47 cm dlouhé kapiláře o průměru 50 μm.
Podmínky elektroforézy
Nasátí vzorku: 3 kV – 15 kV po dobu 5 s – 15 s. Vlastní elektroforéza: 25 min při teplotě 60 °C při napětí 15kV. Pro stanovení velikosti jednotlivých fragmentů byly analyzované vzorky smíchány s velikostním standardem Tamra 500. Ke snímání a digitalizaci hrubých dat fluorescence byl používán software ABI PRISM 310 Data Collection. K vlastní analýze snímaných dat byl využíván software 310 GeneScan 3.1.2 (Applied Biosystems). Ke kvantitativním analýzám byl použit parametr RFU (relativní fluorescenční jednotka) vyjádřený výškou peaku.
VÝSLEDKY
Množství izolované plazmatické DNA se pohybovalo v rozmezí od 14 ng/μl do 180 ng/μl s mediánem 46,5 ng/μl. Z grafu 2 vyplývá, že přímý vliv délky těhotenství na kvantitu izolované DNA z maternální plazmy nebyl spektrofotometrickým měřením koncentrace DNA prokázán (graf 2).
Graf 2. Koncentrace izolované plazmatické DNA v závislosti na délce těhotenství 
Optimalizace
Gonozomální sekvence byly optimalizovány a posuzovány s využitím lokusů v genech AMELX, AMELY a TSPY. Velikosti molekul byly zvoleny: AMELX 103bp, AMELY 109bp a TSPY 398bp. Graf 3 posuzuje možnosti rozlišit od sebe genotypy u 1 %, 2 %, 5 %, 10 % a 20 % XY příměsí v genotypu XX. Jednotlivé parametry byly posuzovány průměrem 4 nezávisle analyzovaných vzorků (graf 3).
Graf 3. Závislost podílu RFU AMX/RFU AMY na množství Y v sekvenci 
Obrázek 1 představuje ukázku elektroforetogramu genotypů XX/XY v poměru 49/1.
Obr. 1. Elektroforetogram artificiální genotypické směsi v poměru 1:49 Ukázka elektroforetogramu genotypů XX/XY v poměru 49/1. 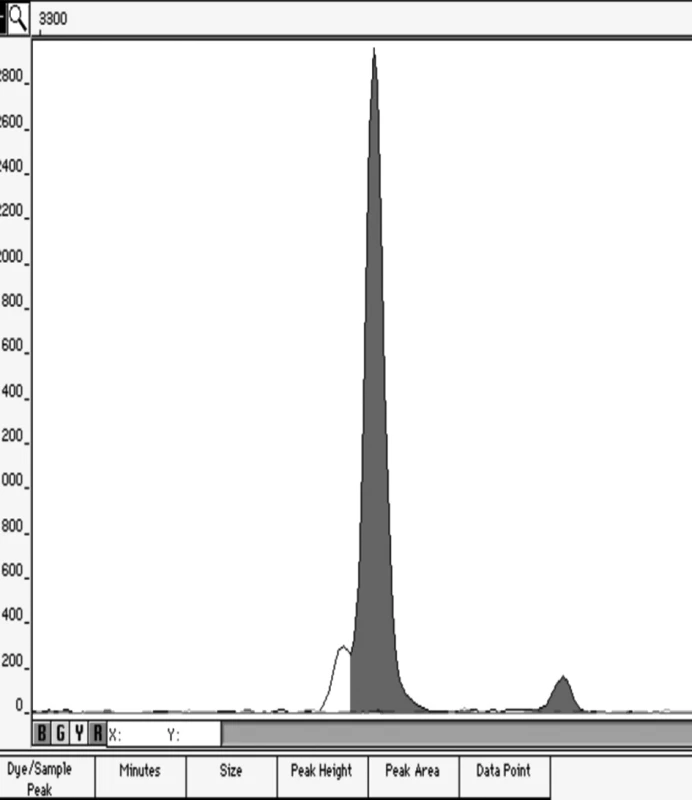
Vlastní detekce
Celkem bylo ze 475 vzorků analyzováno 253 plazmatických DNA s obsahem plodu mužského pohlaví a 222 plazmatických DNA s obsahem plodu ženského pohlaví (obr. 2).
Obr. 2. Průkaz fetální DNA v lokusu AMELY. Vzorek 1 představuje PCR produkt DNA izolované z maternální plazmy, kdy plod je ženského pohlaví bez přítomnosti Y sekvencí a 2. vzorek představuje PCR produkt DNA izolované z plazmy, kdy plod je mužského pohlaví (lokusy AMELY a TSPY jsou označeny šipkou). 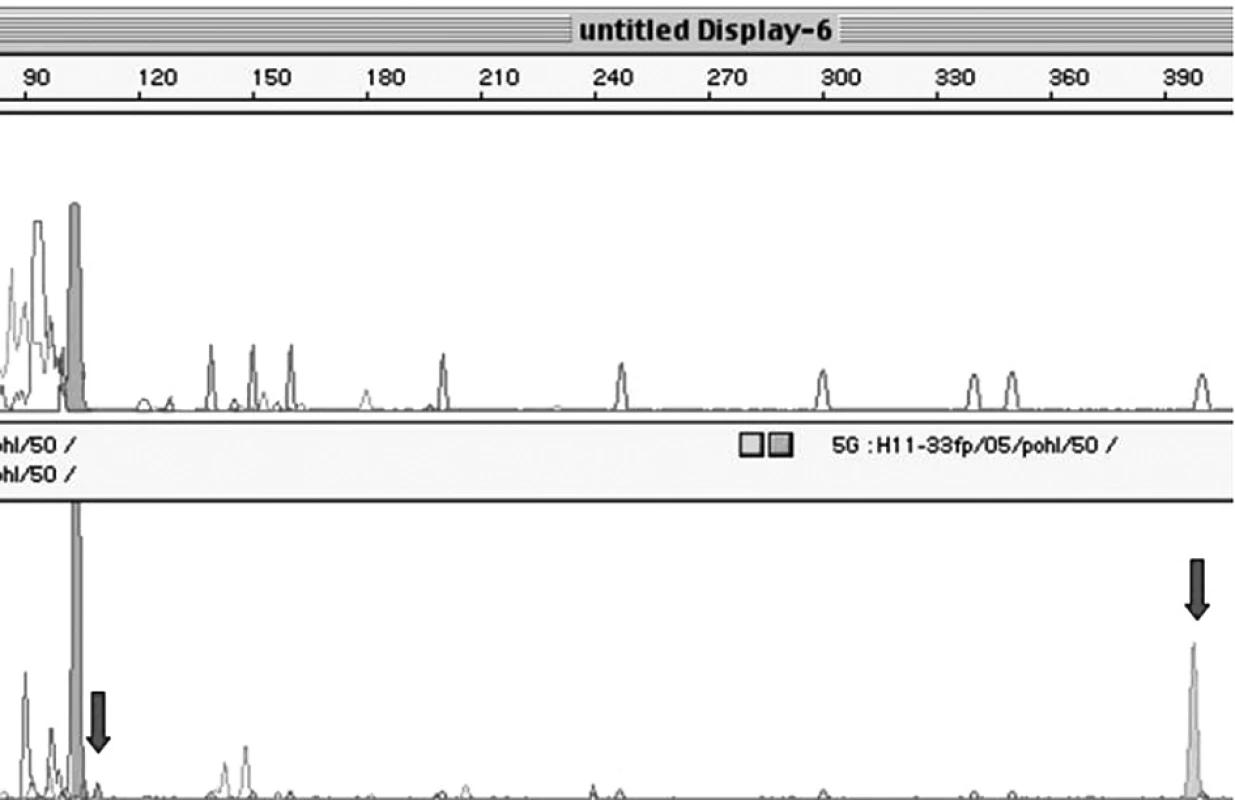
Pohlaví bylo ověřeno pomocí:
- detekce gonozomů z plodové vody nebo choriových klků,
- kontrolního UZ vyšetření,
- dotazem po porodu.
Shoda ženského pohlaví byla počítána na základě předpokladu alespoň jedné nulové hodnoty AMELY nebo TSPY pro ženské pohlaví a shoda mužského pohlaví byla posuzována podle zastoupení AMELY a TSPY ve všech vzorcích. Neshoda byla v případě ženského pohlaví nalezena ve 4,05 % a v případě mužského pohlaví v 7,15 %.
DISKUSE
Kvantitativní analýzy našeho souboru vykazovaly velkou heterogenitu a interindividuální variabilitu, která je v souhlasu s publikovanými pracemi [7, 8].
Vzhledem k možné chybné interpretaci a falešné pozitivitě je správné odečtení minoritního paeku rozhodující pro další výpočty. Kritéria hodnocení by měla být nastavená tak, aby byla možnost misinterpretace minimalizována:
- peak se shoduje velikostně s paternální alelou s tolerancí Ī 1 báze;
- výška peaku je prokazatelně minimálně 1,5násobkem pozadí, které je počítáno pro analyzovanou barvu v okolí Ī 15bp jako průměrná hodnota všech fluorescenčních peaků při maximálním roztažení dat.
Metodika vykazuje velmi vysokou citlivost detekce, která je srovnatelná s citlivostí Real-Time PCR metodiky [6, 9, 14].
Hlavní příčiny falešné pozitivity záchytu mužského pohlaví (4,05 %) spočívají především v možné kontaminaci vzorků během vlastního odběru a v průběhu izolačního postupu. Minimalizace jakékoli kontaminace patří mezi elementární při citlivých DNA analýzách, ve kterých je nutné zachytit genotyp v množství kolem 5 %. Zabezpečení spolehlivé izolace umožňuje např. některý z automatických izolačních přístrojů.
Do neshody mužského pohlaví (falešně negativní výsledky) je nutné započítat i testy z raných fází těhotenství, kdy je množství volné fetální DNA na hranici detekovatelnosti, takže spíše než neshoda by mohly být tyto výsledky posuzovány jako nezachycení fetální DNA.
Kapilární elektroforéza se ukázala jednoznačně jako schopná zachytit i 1% genotypovou příměs. Výsledek vlastních vyšetření na uvedeném souboru těhotných žen lze považovat za velmi uspokojivý. Metodika je připravená k praktickému využití, přesto dalším zdokonalováním a automatizací laboratorních postupů může být specificita, senzitivita i kvantita fetální DNA ještě upřesněna.
Práce byla podpořena grantem IGA MZ ČR NR7817-3.
RNDr. Radek Vrtěl, Ph.D.
Vedoucí DNA laboratoře
Ústav lékařské genetiky a fetální medicíny
Fakultní nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail vrtel@fnol.cz
Zdroje
1. Al-Mufti, R., Hambley, H., Farzaneh, F., et al. Investigation of maternal blood enriched for fetal cells: Role in screening and diagnosis of fetal trisomies. Am J Med Genet, 1999, 85, p. 66–75.
2. Al-Mufti, R., Howard, C., Overton, T., et al. Detection of fetal messenger ribonucleic acid in maternal blood to determine fetal RhD status as a strategy for noninvasive prenatal diagnosis. Am J Obstet Gynecol, 1998, 179, 1, p. 210-214.
3. Bianchi, DW., Flint, AF., Pizzimenti, MF., et al. Isolation of fetal DNA from nucleated erythrocytes in maternal blood. Proc Natl Acad Sci USA, 1990, 87, p. 3279–3283.
4. Chiu, RW., Lui, WB., Cheung, MC., et al. Time profile of appearance and disappearance of circulating placenta-derived mRNA in maternal plasma. Clin Chem, 2006, 52, 2, p. 313–316.
5. Costa, JM., Benachi, A., Olivi, M., et al. Fetal expressed gene analysis in maternal blood: a new tool for noninvasive study of the fetus. Clin Chem, 2003, 49, p. 981–983.
6. Farina, A., Caramelli, E., Concu, M., et al. Testing normality of fetal DNA concentration in maternal plasma at 10-12 completed weeks’ gestation: a preliminary approach to a new marker for genetic screening. Prenat Diagn, 2002, 22, 2, p. 148–152.
7. Ganshirt-Ahlert, D., Burschyk, M., Garritsen, HSP., et al. Magnetic cell sorting and the transferrin receptor as potential means of prenatal diagnosis from maternal blood. Am J Obstet Gynecol, 1992, 166, p. 1350–1355.
8. Hamada, H., Arinami, T., Kubo, T., et al. Fetal nucleated cells in maternal peripheral blood: frequency and relationship to gestational age. Hum Genet, 1993, 91, p. 427–432.
9. Honda, H., Miharu, N., Ohashi, Y., et al. Fetal gender determination in early pregnancy through qualitative and quantitative analysis of fetal DNA in maternal serum. Hum Genet, 2002, 110, p. 75–79.
10. Lo, YMD., Corbetta, N., Chamberlain, PF., et al. Presence of fetal DNA in maternal plasma and serum. Lancet, 1997, 350, p. 485–487.
11. Lo, YMD., Tein, MS., Lau, TK., et al. Quantitative analysis of fetal DNA in maternal plasma and serum: implications for noninvasive prenatal diagnosis. Am J Hum Genet, 1998, 62, p. 768–765.
12. Pandya, PP., Kuhn, P., Brizot, M., et al. Rapid detection of chromosome aneuploides in fetal blood and chorionic villi by fluorescence in situ hybridisation (FISH). Br J Obstet Gynaecol, 1994, 101, p. 493–497.
13. Price, JO., Elias, S., Wachtel, S., et al. Prenatal diagnosis with fetal cells isolated from maternal blood by multiparameter flow cytometry. Am J Obstet Gynecol, 1991, 165, p. 1731–1737.
14. Sekizawa, A., Kondo, T., Iwasaki, M., et al. Accuracy of fetal gender determination by analysis of DNA in maternal plasma. Clin Chem, 2001, 10, p. 1856-1858.
15. Sekizawa, A., Samura, O., Zhen, DK., et al. Apoptosis in fetal nucleated erythrocytes circulating in maternal blood. Prenat Diagn, 2000, 20, 11, p. 886-889.
16. Wachtel, S., Elias, S., Price, J., et al. Fetal cells in the maternal circulation: isolation by multiparameter flow cytometry and confirmation by polymerase chain reaction. Hum Reprod, 1991, 6, p. 1466–1469.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2008 Číslo 3- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Význam PET v radioterapii karcinomu děložního hrdla – výsledky pilotní studie
- Chemorezistence/chemosenzitivita ovariálního karcinomu – kazuistika
- Pokroky v léčbě karcinomu děložního hrdla – 3D plánování HDR brachyterapie pomocí CT/MR
- Neinvazivní detekce gonozomálních DNA sekvencí v plazmě gravidních žen s využitím kapilární elektroforézy
- Předčasný odtok plodové vody a Ureaplasma urealyticum
- Možnosti screeningu Downova syndromu v České republice
- Přežívání dětí narozených s vrozenou vadou v průběhu 1. roku života
- Prenatální diagnostika vybraných typů vrozených vad v České republice: 1994 - 2006
- Rekurentní vulvovaginální kandidóza – současný stav problematiky a léčebné možnosti
- Současné poznatky o etiopatogenezi děložních myomů
- Sklerozující stromální tumor – vzácný gonadostromální nádor ovaria
- Poporodní netraumatická zlomenina křížové kosti: kazuistika a biomechanické poznámky
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Předčasný odtok plodové vody a Ureaplasma urealyticum
- Poporodní netraumatická zlomenina křížové kosti: kazuistika a biomechanické poznámky
- Sklerozující stromální tumor – vzácný gonadostromální nádor ovaria
- Současné poznatky o etiopatogenezi děložních myomů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




