-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Detekce placentárně specifických mikroRNA v mateřské cirkulaci
Detection of placenta-specific microRNAs in maternal circulation
Objective:
We focused on the detection of microRNAs in maternal circulation during the course of physiological pregnancy. We tested initially microRNAs (mir-135b and miR-517a) which presence in maternal circulation had been previously demonstrated and those microRNAs (miR-518b and miR-517a) with up-regulated expression profile in placentas derived from pregnancies during the onset of preeclampsia. Further we selected those microRNAs, which were reported to be placenta specific according to the miRNAMap database (these microRNAs were significantly expressed in the placenta and simultaneously showed no or minimal expression in other tissues).Setting:
Division of Molecular Biology and Cell Pathology, Department of Gynaecology and Obstetrics, Third Faculty of Medicine, Charles University, Prague.Methods:
RNA enriched for small RNAs (including microRNAs) was isolated from 1ml of maternal plasma during the 12th, 16th and 36th week of gestation and 200 μl of peripheral blood derived from healthy non-pregnant women. Consequently relevant microRNA was transcribed into cDNA using specific stem-loop primer and detected by specific real-time PCR assay.Results:
From the cohort of tested microRNAs we excluded those ones, which were not detectable in maternal circulation during pregnancy (miR-136 and miR-519a) and/or were demonstrated in peripheral blood of healthy non-pregnant women (miR-34c, miR-224, miR-512-5p, miR-515-5p, miR-516-5p, miR-518f*, miR-519d, miR-519e).Conclusion:
On the base of the current study results we finally selected 6 most suitable microRNAs (miR-517*, miR-518b, miR-520a*, miR-520h, miR-525 and miR-526a) for subsequent studies concerning the follow-up of placenta specific microRNAs in maternal circulation during pregnancy and the differentiation between normal and pathologic pregnancies (preeclampsia, IUGR) within the same gestational age.Key words:
microRNA, pregnancy, placenta, plasma, real-time PCR.
Autoři: I. Hromadníková 1; K. Kotlabová 1; J. E. Jirásek 3; J. Doucha 2
Působiště autorů: Oddělení molekulární biologie a patologie buňky, Gynekologicko-porodnická klinika 3. LF UK a FN KV, Praha, vedoucí pracoviště doc. MUDr. B. Svoboda, CSc. 1; Gynekologicko-prorodnická klinika, 2. LF UK a FN Motol, Praha, přednosta prof. MUDr. L. Rob, CSc. 2; Ústav péče o matku a dítě, Praha, ředitel doc. MUDr. J. Feyereisl, CSc. 3
Vyšlo v časopise: Ceska Gynekol 2010; 75(3): 252-256
Souhrn
Cíl studie:
Zaměřili jsme se na detekci mikroRNA v mateřské cirkulaci v průběhu fyziologického těhotenství. Do studie jsme zahrnuli mikroRNA (miR-135b a miR-517a), jejichž přítomnost byla již dříve popsána v mateřské cirkulaci, mikroRNA (miR-518b, miR-517a) se zvýšenou expresí v placentách pacientek v době klinické manifestace preeklampsie a dále všechny mikroRNA, které byly dle databáze miRNAMap placentárně specifické (vykazovaly významnou expresi v placentě a nulovou nebo minimální expresi v ostatních tkáních).Typ studie:
Pilotní studie.Název a sídlo pracoviště:
Oddělení molekulární biologie a patologie buňky, Gynekologicko-porodnická klinika, 3. lékařská fakulta Univerzity Karlovy, Praha.Metodika:
Z 1 ml mateřské plazmy získané ve 12., 16. a 36. gestačním týdnu a 200 μl periferní krve zdravých žen bez známek těhotenství byla izolována RNA obohacená o frakci malých RNA (včetně mikroRNA). Následně byla příslušná mikroRNA přepsána do cDNA pomocí specifického stem-loop primeru a detekována pomocí PCR v reálném čase.Výsledky:
Ze souboru testovaných mikroRNA byly vyloučeny mikroRNA, které nebyly detekovány v mateřské cirkulaci v průběhu těhotenství (miR-136, miR-519a) a rovněž mikroRNA, které byly detekovány v periferní krvi zdravých žen bez známek těhotenství (miR-34c, miR-224, miR-512-5p, miR-515-5p, miR-516-5p, miR-518f*, miR-519d, miR-519e).Závěr:
Pro další sledování přítomnosti placentárně specifických mikroRNA v mateřské cirkulaci v průběhu gravidity a pro diferenciaci mezi fyziologickým a patologickým průběhem gravidity (preeklampsie, IUGR) ve stejném gestačním stáří bylo na základě těchto výsledků vybráno 6 mikroRNA (miR-517*, miR-518b, miR-520a*, miR-520h, miR-525, miR-526a).Klíčová slova:
mikroRNA, těhotenství, placenta, plazma, PCR v reálném čase.ÚVOD
MikroRNA (mikroRNA, miRNA) jsou krátké jednořetězcové molekuly, které patří do rodiny tzv. nekódujících ribonukleových kyselin, jejichž velikost se pohybuje v rozmezí 18 až 25 nukleotidů [13, 14]. Vznikají kaskádou dějů z primárního vlásenkového transkriptu (pri-miRNA) [5, 9, 16, 19, 24] a v cytoplazmě buněk se stávají součástí miRISC (microRNA-induced silencing comlex) komplexu [10], který se přes miRNA váže na 3’UTR (untranslated region) oblast cílové mRNA a ovlivňuje její další funkce v organismu [22]. Nedávné experimentální práce upozornily na významnou roli mikroRNA v posttranskripční regulaci exprese genů [7, 8, 11, 14]. Primárním úkolem mikroRNA v organismu je regulace genové exprese klíčových biologických dějů, nejčastěji inhibicí translace mRNA [8] s následným útlumem proteosyntézy, méně obvykle přímou degradací mRNA [10, 18, 20, 23]. Vliv mikroRNA byl prokázán v mnoha fyziologických a patologických procesech (např. buněčný vývoj, diferenciace, proliferace, apoptóza, mezibuněčná komunikace, karcinogeneze, rozvoj kardiovaskulárních onemocnění atd.) [2, 3, 12, 21].
V lidském organismu bylo doposud identifikováno přibližně 750 různých mikroRNA, přičemž tento počet není pravděpodobně konečný [13, 15, 17]. Každý typ mikroRNA reguluje genovou expresi desítek až stovek genů, přičemž se předpokládá, že mikroRNA se podílejí na mechanismu kontroly genové exprese zhruba jednou třetinou. Vzhledem k široké paletě dějů, které mikroRNA v organismu ovlivňují, je věnována velká pozornost výzkumu identifikace charakteristických profilů mikroRNA u jednotlivých onemocnění a jejich potenciální využití pro diagnosticko-prognostické a terapeutické účely. Za objev mechanismu RNA interference (indukce degradace mRNA transkriptů pomocí dvoušroubovicové krátké RNA molekuly) u C. elegans byla v roce 2006 udělena Nobelova cena za fyziologii a medicínu (Andrew Z. Fire; Craig C. Mello) [1, 6, 22].
Nedávno publikované pilotní studie [4] popsaly přítomnost některých mikroRNA v periferní krvi těhotných žen (miR-141, miR-149, miR-299-5p, miR-135b a miR-517a), které byly po porodu v mateřské cirkulaci nedetekovatelné.
V naší pilotní studii jsme se zaměřili na detekci mikroRNA v mateřské cirkulaci v průběhu fyziologického těhotenství. Do studie jsme zahrnuli některé mikroRNA (miR-135b a miR-517a), jejichž přítomnost byla již dříve popsána v mateřské cirkulaci [4], mikroRNA (miR-518b, miR-517a) se zvýšenou expresí v placentách pacientek v době klinické manifestace preeklampsie [25] a dále všechny mikroRNA, které podle databáze miRNAMap (http://mirnamap.mbc.nctu.edu.tw) byly placentárně specifické (vykazovaly významnou expresi v placentě a nulovou nebo minimální expresi v ostatních tkáních) (tab. 1).
Tab. 1. Charakteristika mikroRNA testovaných v mateřské cirkulaci u fyziologických gravidit 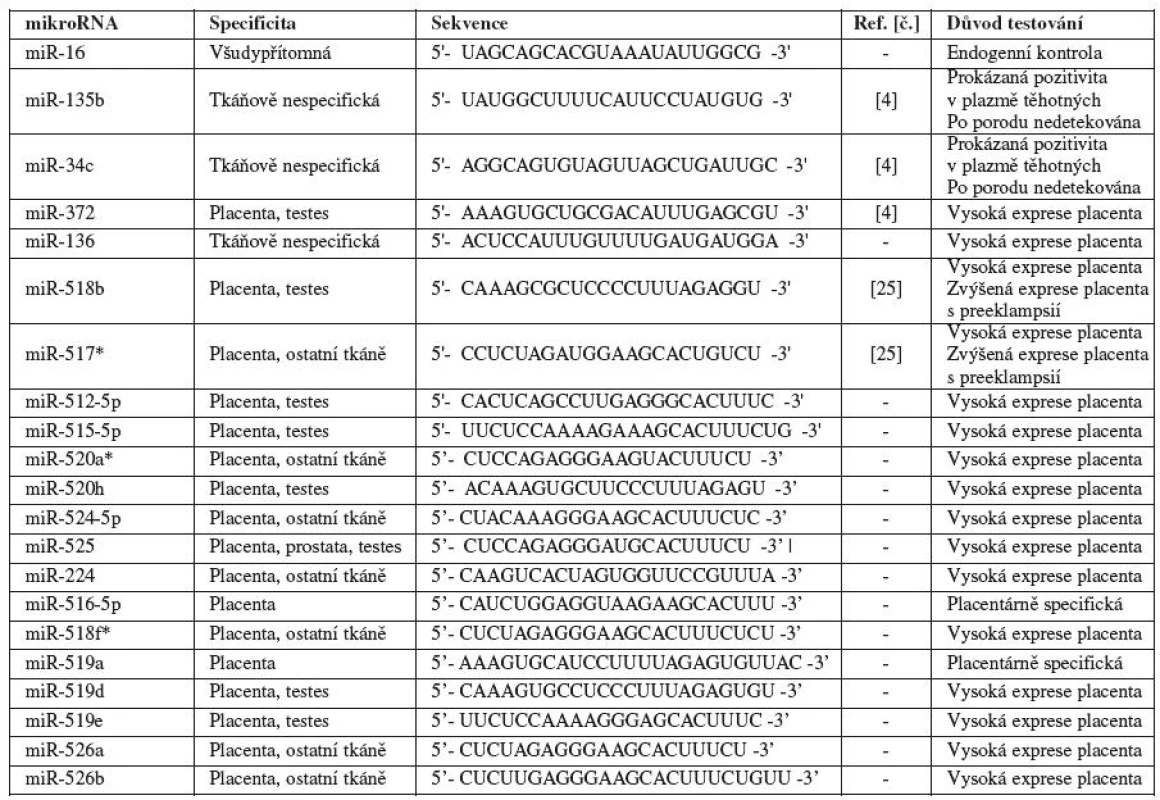
SOUBOR A METODIKA
Soubor pacientek
Celkem bylo testováno 23 těhotných žen v 12., 16. a 36. gestačním týdnu s fyziologickým průběhem gravidity a 5 zdravých žen bez známek těhotenství. Všechny pacientky poskytly informovaný souhlas s odběrem periferní krve pro toto vyšetření.
Metodika
Izolace plazmy z periferní krve matky
Plazma byla připravena z 5 ml nesrážlivé periferní krve (EDTA) nejpozději 24 hodin po odběru centrifugací při 1200 g po dobu 10 minut. Poté byla plazma stočena znovu a skladována při –80 °C až do dalšího zpracování.
Abychom minimalizovali riziko kontaminace vzorků, prováděli jsme veškeré zpracování biologického materiálu v laminárním boxu třídy II. a pro pipetaci jsme používali aerosol resistentní špičky.
Izolace mikroRNA z mateřské plazmy a přepis do cDNA
1 ml mateřské plazmy byl inkubován s 3 ml Trizol LS Reagent (Invitrogen, Carlsbad, Kalifornia, USA) po dobu 5 minut při pokojové teplotě. Po 10minutové inkubaci při pokojové teplotě s 0.8 ml chloroformu následovala 15minutová centrifugace při 12 000 g a 4 °C. Vodná fáze byla přenesena do nové zkumavky a RNA byla vysrážena po přidání 1/3 násobku objemu 100 % ethanolu. Následně byla získána RNA obohacená o frakci malých RNA pomocí mirVanaTM miRNA Isolation Kitu (Ambion, Austin, Texas, USA) dle originálního protokolu výrobce. RNA byla eluována 100 μl elučního pufru. Reziduální DNA byla odstraněna pomocí 5 μl DNAázy (Dnase I, Fermentas International, Ontario, Canada).
16,7 μl eluátu bylo použito pro přepis RNA do cDNA s využitím specifického komerčního „stem-loop“ primeru pro konkrétní mikroRNA a TaqMan MicroRNA Reverse Transcription kitu (Applied Biosystem, Branchburg, New Jersey, USA) za následujících podmínek 30 minut 16 °C, 30 minut 42 °C, 5 minut 85 °C a 15 minut 4 °C na 7500 real-time PCR system (Applied Biosystem, Branchburg, New Jersey, USA). Koncentrace a čistota celkové RNA a RNA obohacené o frakci malých RNA byla stanovena na spektrofotometru NanoDrop ND-1000 (NanoDrop Technologies, Wilmington, DE, USA).
Detekce mikroRNA v mateřské plazmě pomocí PCR v reálném čase
Detekce byla provedena na 7500 real-time PCR system (Applied Biosystem, Branchburg, New Jersey, USA) s využitím TaqMan Universal PCR Master Mixu a komerčních setů pro jednotlivé mikroRNA obsahujících specifické primery a 5’ - FAM, 3’ - MGB značenou sondu (Applied Biosystem, Branchburg, New Jersey, USA) v reakčním objemu 35 μl s 15 μl cDNA. Podmínky PCR reakce byly nastaveny podle manuálu výrobce [10-min preinkubace při 95 °C nutná pro aktivaci AmpliTaq Gold DNA polymerázy; dále 40 cyklů při 95 °C 15 s (denaturace DNA) a 60 °C 1 min (anelace a syntéza DNA)]. Každý vzorek byl analyzován v 8jamkových stripech ve 3 replikátech. Pozitivní výsledek byl hodnocen jako detekce fluorescenčního signálu v jamce před 40. cyklem (Ct < 40). Jako pozitivní kontrola byla využita frakce RNA obohacená o mikroRNA izolovaná z fetální části placenty. Každá analýza zahrnovala negativní kontroly (bez přítomnosti cDNA templátu a/nebo reverzní transkriptázy).
VÝSLEDKY
Intra - a inter-assay variabilita pro jednotlivé mikroRNA systémy
Koeficient variability pro jednotlivé mikroRNA systémy v rámci jedné analýzy se pohyboval v rozmezí 0 % – 1,6 % (intra-assay variabilita). Koeficient variability pro jednotlivé mikroRNA systémy v rámci různých analýz provedených v různých dnech dosahoval hodnot 0,4 % – 6,8 % (inter-assay variabilita).
Detekce jednotlivých mikroRNA v mateřské cirkulaci u těhotenství s fyziologickým průběhem a kontrolní skupiny (zdravé ženy bez známek těhotenství)
Metodika izolace a detekce mikroRNA v placentě a mateřské plazmě byla zavedena a optimalizována s využitím všudypřítomné tkáňově nespecifické miR-16, kterou jsme dále používali jako kontrolu pro ověření přítomnosti mikroRNA v RNA obohacené o frakci malých RNA.
Všechny testované mikroRNA byly spolehlivě detekovány ve fetální části placenty v rozmezí 16,2 – 35,2 cyklu. MikroRNA (miR-136 a miR-519a) s pozdější amplifikací v placentární tkáni (Ct 31,0 a 35,2) nebyly detekovatelné v mateřské cirkulaci v průběhu gravidity.
Některé mikroRNA (miR-34c, miR-224, miR-512-5p, miR-515-5p, miR-516-5p, miR-518f*, miR-519d a miR-519e), které vykazovaly podle databáze miRNAMap významnou expresi v placentě a nulovou nebo minimální expresi v ostatních tkáních, byly detekovány i v periferní krvi zdravých žen bez známek těhotenství. Tyto mikroRNA jsme se rozhodli dále netestovat, přestože mateřská plazma vykazovala vyšší koncentrace některých mikroRNA (miR-512-5p, miR-515-5p, miR-516-5p a miR-519d) v plazmách těhotných žen (zejména ve 3. trimestru gravidity) než v periferní krvi zdravých žen bez známek těhotenství.
Pouze 6 mikroRNA (miR-517*, miR-518b, miR-520a*, miR-520h, miR-525 a miR-526a) nebylo detekováno v periferní krvi zdravých žen bez známek těhotenství a současně byly spolehlivě detekovány v plazmách těhotných žen (pozitivní signál amplifikace ve většině replikátů v dřívějších amplifikačních cyklech Ct) v průběhu těhotenství.
Z hodnot amplifikačních cyklů je zřejmé, že množství některých z těchto mikroRNA (miR-517*, miR-518b, miR-520a*, miR-520h a miR-525) se kontinuálně zvyšuje v mateřské cirkulaci s postupujícím těhotenstvím, neboť nejvyšší koncentrace byly nalezeny právě v 36. týdnu těhotenství (obr. 1). Mir-135b byla spolehlivě detekovatelná v mateřské cirkulaci pouze ve 3. trimestru gravidity. Výsledky analýzy jsou shrnuty v tabulce 2.
Obr. 1. Detekce mikroRNA ve fetální části placenty a v mateřské cirkulaci u těhotenství s fyziologickým průběhem, miR-520h (12., 16. a 36. týden gravidity) 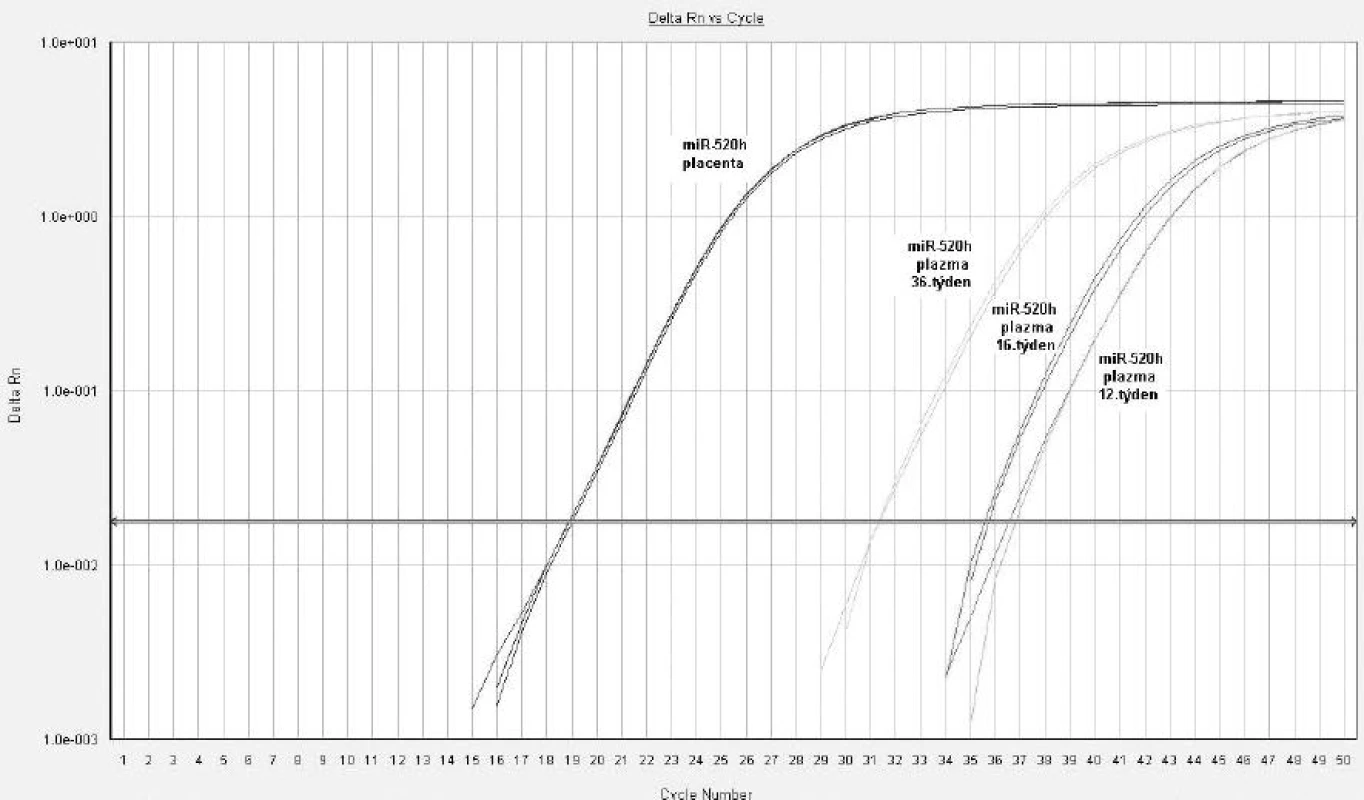
Tab. 2. Detekce jednotlivých mikroRNA v mateřské cirkulaci u těhotenství s fyziologickým průběhem a kontrolní skupiny (zdravé ženy bez známek těhotenství) 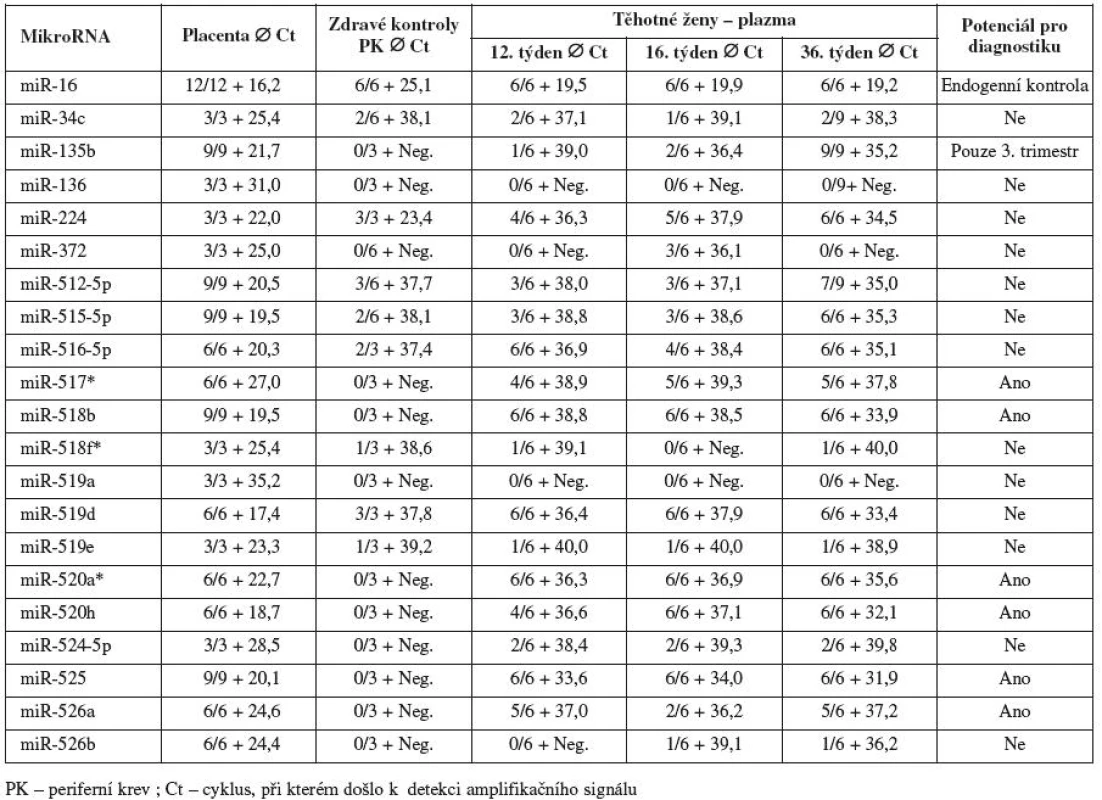
DISKUSE
Metodika byla optimalizována tak, aby bylo možné vyšetřit z 1 ml mateřské plazmy alespoň 6 různých mikroRNA. Pouze ty mikroRNA (miR-517*, miR-518b, miR-520a*, miR-520h, miR-525 a miR-526a), které nebyly detekovatelné v periferní krvi zdravých žen bez známek těhotenství a současně byly spolehlivě detekovány v plazmách těhotných žen, byly vybrány pro další sledování kvantitativních změn v průběhu gravidity a jako potenciální markery pro diferenciaci mezi fyziologickým a patologickým průběhem gravidity souvisejícím s placentární insuficiencí (preeklampsie a/nebo intrauterinní růstová retardace).
Vycházíme z předpokladu, že těhotenské komplikace související s placentární insuficiencí (preeklampsie a intrauterinní růstová retardace - IUGR) lze charakterizovat unikátním profilem up-regulovaných a down-regulovaných placentárně specifických mikroRNA, které lze detekovat v mateřské cirkulaci jako součást apoptotických tělísek trofoblastu. Předpokládáme, že přítomnost a koncentrace jednotlivých placentárně specifických mikroRNA v mateřské cirkulaci se mohou významně lišit mezi těhotenstvím s fyziologickým a patologickým průběhem ve stejném gestačním stáří. Předpokládáme, že by bylo v budoucnu možné sledovat profil a koncentrace placentárně specifických mikroRNA v mateřské cirkulaci u těhotných žen s rizikem pozdějšího rozvoje závažné preeklampsie a IUGR.
Tato práce vznikla za podpory výzkumného záměru MŠMT MSM 0021620806 a projektu specifického vysokoškolského výzkumu grantové agentury UK 260707/SVV/2010.
Doc. RNDr. Ilona Hromadníková, Ph.D.
Oddělení molekulární biologie a patologie buňky
3. lékařská fakulta Univerzity Karlovy
Ruská 87
100 00 Praha 10
e-mail: ilona.hromadnikova@lf3.cuni.cz
Zdroje
1. Bernstein, E., Caudy, AA., Hammond, SM., Hannon, GJ. Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature, 2001, 409(6818), p. 363-366.
2. Calin, GA., Dumitru, CD., Shimizu, M., et al. Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc Natl Acad Sci USA, 2002, 99(24), p. 15524-15529.
3. Chen, CZ., Li, L., Lodish, HF., et al. MicroRNAs modulate hematopoietic lineage differentiation. Science, 2004, 303(5654), p. 83-86.
4. Chim, SSC., Shing, TKF., Hung, ECW., et al. Detection and characterization of placenta microRNAs in maternal plasma. Clin Chem, 2008, 54(3), p. 482-490.
5. Elbashir, SM., Harborth, J., Lendeckel, W., et al. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature, 2001, 411, p. 494-498.
6. Fire, A., Xu, S., Montgomery, MK., et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature, 1998, 391, p. 806-811.
7. Grishok, A., Pasquinelli, AE., Conte, D., et al. Genes and mechanisms related to RNA interference regulate expression of the small temporal RNAs that control C. elegans developmental timing. Cell, 2001, 106, p. 23-34.
8. Hammond, SM., Bernstein, E., Beach, D., et al. An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells. Nature, 2000, 404, p. 293-296.
9. Hutvágner, G., McLachlan, J., Pasquinelli, AE., et al. A cellular function for the RNA-interference enzyme Dicer in the maturation of the let-7 small temporal RNA. Science, 2001, 293, p. 834-838.
10. Hutvágner, G., Zamore, PD. A microRNA in a multiple-turnover RNA enzyme complex. Science, 2002, 297, p. 2056-2060.
11. Ketting, RF., Fischer, SE., Bernstein, E., et al. Dicer functions in RNA interference and in synthesis of small RNA involved in developmental timing in C. elegans. Genes Dev, 2001, 15, p. 2654-2659.
12. Krichevsky, AM., King, KS., Donahue, CP., et al. A microRNA arrays reveals extensive regulation of microRNAs during brain development. RNA, 2003, 9(10), p. 1274-1281.
13. Lagos-Quintana, M., Rauhut, R., Lendeckel, W., Tuschl, T. Identification of novel genes coding for small expressed RNAs. Science, 2001, 294(5543), p. 853-858.
14. Lau, NC., Lim, LP., Weinstein, EG., Bartel, DP. An abundant class of tiny RNAs with probable regulatory roles in Caenorhabditis elegans. Science, 2001, 294, p. 858-862.
15. Lee, PL., Glasner, ME., Yekta, S., et al. Vertebrate microRNA genes. Science, 2003, 299(5612), p.1540.
16. Lee, Y., Jeon, K., Lee, TJ., et al. MicroRNA maturation : stepwise procesing and subcellular localization. EMBO J, 2002, 21, p. 4663-4670.
17. Lewis, BP., Shih, IH., Jones-Rhoades, MW., et al. Prediction of mammalian microRNA targets. Cell, 2003, 115(7), p. 787-798.
18. Llave, C.,Xie, Z., Kasschau, KD., Carrington JC. Cleavage of Scarecrow-like mRNA targets directed by a class of Arabidopsis miRNA. Science, 2002, 297, p. 2053-2056.
19. Lund, E., Güttinger, S., Calado, A., et al. Nuclear export of microRNA precursors. Science, 2004, 303(5654), p. 95-98.
20. Martinez, J., Patkaniowska, A., Urlaub, H., et al. Single-stranded antisense siRNAs guide target RNA cleavage in RNAi. Cell, 2002, 110, p. 563-574.
21. Michael, MZ., O’Connor, SM., van Holst Pellekaan, NG., et al. Reduced accumulation of specific microRNAs in colorectal neoplasia. Mol Cancer Res., 2003, 1(12), p. 882-891.
22. Wightman, B., Ha, I., Ruvkun, G. Posttranscriptional regulation of the heterochromatic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans. Cell, 1993, 75, p. 855-862.
23. Zamore, PD., Tuschl, T., Sharp, PA., Bartel, DP. RNAi : double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals. Cell, 2000, 101(1), p. 25-33.
24. Zhang, H., Kolb, FA., Brondani, V., et al. Human Dicer preferentially cleaves dsRNAs at their termini without a requirement for ATP. EMBO J, 2002, 21, p. 5875-5885.
25. Zhu, XM., Han, T., Sargent, IL., et al. Differential expression profile of microRNAs in human placenta from preeclamptic pregnancies vs normal pregnancies. Am J Obstet Gynecol, 2009, 200, p. 661.e1-661.e7.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek G bod – mýty a realitaČlánek Dopis redakci
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2010 Číslo 3- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- K nedožitým třiašedesátinám prim. doc. MUDr. Zdeňka Holuba, CSc.
- Porovnání exprese imunohistochemických markerů ve vzorcích z hysteroskopie a hysterektomie u pacientek s karcinomem endometria
- Sexuální morbidita po chirurgické léčbě zhoubných gynekologických nádorů
- Technika radioterapie s modulovanou intenzitou záření v léčbě gynekologických malignit
- Rezistence/senzitivita in vitro u pacientek s karcinomem ovaria
- Některé charakteristiky žadatelek o umělé ukončení těhotenství
- Prognostický význam klinickopatologických a vybraných imunohistochemických faktorů u karcinomu endometria
- Modifikovaná klasifikace mikroskopického hodnocení poševních infekcí
- Výskyt preperitoneálního tuku a hernia obturatoria v canalis obturatorius
- G bod – mýty a realita
- Německý gynekolog a porodník Christian Gerhard Leopold (1846-1911)
- Incidence vrozených srdečních vad v České republice – aktuální data
- Průběh a výsledky 34 těhotenství komplikovaných syndromem HELLP
- Burkittův lymfom v těhotenství – kazuistika
- Detekce placentárně specifických mikroRNA v mateřské cirkulaci
- Životní jubileum prim. MUDr. Jana Machače
- Profesor MUDr. Jan Hořejší, DrSc., sedmdesátníkem
- Návrh České lékařské společnosti J. E. Purkyně na novelizaci vyhlášky 185/2009 Sb. o specializačním vzdělávání lékařů
- Konsenzuální návrh české lékařské společnosti J. E. Purkyně
- Dopis redakci
- Příběhy pacientů z internetových stránek
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- G bod – mýty a realita
- Incidence vrozených srdečních vad v České republice – aktuální data
- Výskyt preperitoneálního tuku a hernia obturatoria v canalis obturatorius
- Modifikovaná klasifikace mikroskopického hodnocení poševních infekcí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



