-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Rezistence/senzitivita in vitro u pacientek s karcinomem ovaria
Resistance/sensitivity in vitro in ovarian cancer patients
Objective:
To assay resistance/sensitivity by MTT test in solid tumor or ascitic fluid in ovarian cancer patients.Design:
Prospective study.Setting:
Department of Gynecology and Obstetrics, Medical Faculty Charles University, Prague and University Hospital, Hradec Králové.Methods:
MTT – (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide) chemosensitivity assay was performed in 32 samples of ovarian cancer tissue and 26 samples of ascitic fluid in ovarian cancer patients. We studied the in vitro drug resistance profiles of ovarian cancer specimens exposed to cisplatin, carboplatin, paclitaxel, topotecan, gemcitabin, etoposid.Results:
The highest frequency of resistance in vitro occured for etoposid, gemcitabin and paclitaxel and the most effective chemotherapeutical agents in vitro were cisplatinum and topotecan. Cisplatin had the lowest incidence of drug resistance in vitro than carboplatin.Conclusion:
Resistance/sensitivity assay would improve the treatment and prognosis of ovarian cancer patients.Key words:
ovarian cancer, resistance, sensitivity, chemotherapeutic agent, MTT assay.
Autoři: I. Sedláková 1; J. Tošner 1; A. Řezáč 1; M. Červinka 2; K. Brigulová 2; J. Špaček 1; M. Tomšová 3; P. Škapinec 1
Působiště autorů: Porodnická a gynekologická klinika LF UK a FN, Hradec Králové, přednosta doc. MUDr. J. Tošner, CSc. 1; Ústav biologie a lékařské genetiky, Lékařská fakulta v Hradci Králové UK Praha, přednosta prof. MUDr. RNDr. M. Červinka, CSc. 2; Fingerlandův patologický ústav FN, Hradec Králové, přednosta prof. MUDr. A. Ryška, Ph. D. 3
Vyšlo v časopise: Ceska Gynekol 2010; 75(3): 182-187
Souhrn
Cíl studie:
Zhodnocení rezistence/senzitivity ovariálních nádorových buněk ze solidního nádoru a ascitu in vitro u pacientek s karcinomem ovaria.Typ studie:
Prospektivní klinická studie.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika, LF UK a FN Hradec Králové.Metodika:
Pomocí tetrazoliového (MTT) testu jsme stanovili rezistenci/senzitivitu in vitro u 32 vzorků ovariální nádorové tkáně a 26 vzorků ascitu pacientek s karcinomem ovaria. Testovali jsme paclitaxel, cisplatinu, karboplatinu, topotecan, gemcitabin a etoposid.Výsledky:
Rezistenci in vitro jsme nejčastěji prokázali u etoposidu, gemcitabinu a paclitaxelu. Nejvyšší senzitivitu in vitro jsme zjistili u cisplatiny a topotecanu. Zaznamenali jsme rozdíly v rezistenci/senzitivitě in vitro u cisplatiny a karboplatiny.Závěr:
Testování rezistence/senzitivity ovariálních nádorových buněk by mohlo přispět k lepšímu pochopení nádorové biologie a následně ke zvýšení úspěšnosti léčby pacientek s karcinomem ovaria.Klíčová slova:
ovariální karcinom, rezistence, senzitivita, cytostatika, MTT test.ÚVOD
Léková rezistence na cytostatika je hlavním klinickým problémem současné cytostatické léčby ovariálního karcinomu. Jejím následkem je selhání léčby. Molekulární podstata lékové rezistence ještě není přesně definována. Cytostatika, jako cisplatina a paclitaxel, vedla k lepší léčebné odpovědi, nicméně pětileté přežití je stále pouze 20-30 % u pacientek s pokročilým ovariálním karcinomem. A to i přes skutečnost, že většina žen má chemosenzitivní onemocnění na primární léčbu [3].
V systémové chemoterapii nádorových onemocnění se standardně využívají v klinických studiích ověřené režimy a statisticky nejúspěšnější terapie je vnímána jako nejlepší léčebný postup. Teprve při selhání léčby první event. druhé linie je výběr chemoterapie omezen a volba léčby není standardně určena. Nicméně ani statisticky nejefektivnější způsob terapie není zárukou úspěšné léčby a vždy existuje podíl případů dané diagnózy, u nichž není dosaženo očekávaného účinku chemoterapie [9]. Díky rychlému rozvoji molekulárně-biologických a imunohistochemických metod je zřejmé, že každý nádor, přestože jednotně morfologicky klasifikován, je tvořen heterogenními populacemi buněk, které mohou disponovat rozdílnými molekulárními vlastnostmi předurčujícími jejich proliferační aktivitu, pohotovost k apoptóze, metastatický potenciál a taktéž stupeň citlivosti k aplikované terapii [7]. Získaná chemorezistence ovariálních nádorových buněk je vztahována k alteracím v apoptóze [11]. Apoptóza oddálená či inhibovaná je charakteristická pro maligní onemocnění. Bývá pro ni typická přílišná exprese anti-apoptotických faktorů nebo mutace v genech proteinů zprostředkovávajících vnitřní část apoptoptické kaskády [2].
Účinek cytostatik není přísně specifický a cytostatika nepůsobí selektivně pouze na nádorové buňky, nýbrž svými toxickými účinky postihují více či méně i buňky zdravé. Respektování faktorů individuality a zavádění „personalizované medicíny“ je směr, jehož cílem je co nejvíce zvýšit účinnost terapie s minimálním zatížením pacienta. Jedním z přístupů individualizované chemoterapie je snaha o výběr cytostatik s maximální účinností pro daný nádor za současné eliminace těch, k nimž je nádor vysoce rezistentní, a to na základě hodnocení citlivosti nádorové populace k cytostatikům v ex vivo podmínkách [9]. Nejrozšířenější metodou in vitro stanovení chemorezistence/chemosenzitivity k cytostatikům je tetrazoliový test (MTT test).
Cílem této práce bylo zhodnotit chemorezistenci/chemosenzitivitu in vitro v solidní nádorové tkáni či ascitu u pacientek s ovariálním karcinomem pomocí MTT (WST-1) testu.
METODIKA
Vzorek nádorové ovariální tkáně či ascitu odebraného peroperačně na Porodnické a gynekologické klinice Fakultní nemocnice v Hradci Králové byl zpracován v Ústavu lékařské biologie a genetiky Lékařské fakulty v Hradci Králové. Suspenze nádorových buněk byla získána z dodaných vzorků použitím enzymatického trávení a gradientovou centrifugací na hustotním gradientu Ficoll-Metatrizoát.
Na začátku studie byl ověřován způsob enzymatického rozvolňování a optimální složení kultivačního média. Buňky byly dvakrát promyty v RPMI 1640 (2mM glutamin, bikarbonát sodný, penicilin (100 U/ml) a streptomycin (100 mg/ml)). Po druhém promytí byla buněčná paleta suspendována v kultivačním médiu [RPMI 1640 s 2mM glutaminem bikarbonátem sodným, penicilinem (100 U/ml) a streptomycinem (100 mg/ml), 15% fetální hovězí sérum, 5 mg/ml inzulinu a 5 mg/ml transferinu] v konečné koncentraci 1-2 miliony buněk na mililitr. Na začátku studie byla také ověřována heterogenita buněčné populace. Buňky byly nasazeny 6 hodin v kultivační lahvi. Po 6 hodinách bylo medium odsáto, neadherované buňky byly shromážděny centrifugací při 500 ot/min a využity pro pararelní stanovení. Při hodnocení senzitivity bylo použito třídenního MTT (WST-1) testu. Buněčná suspenze byla pipetována do 96jamkových destiček v koncentraci 6000–10 000 buněk na jamku a byla ponechána přes noc v inkubátoru. Druhý den bylo k buňkám přidáno médium s naředěným cytostatikem. Rezistence/senzitivita byla testována u cisplatiny, paclitaxelu, karboplatiny, topotecanu, gemcitabinu a etoposidu. Aby bylo možné stanovit inhibiční koncentraci IC50, byly nádorové buňky vystaveny působení každého cytostatika v šesti různých koncentracích po dobu tří dnů při 37 st.C, 5 % CO2 a pokusy byly nejméně dvakrát opakovány. Kontrolní nádorové buňky byly kultivovány bez použití cytostatik. Na závěr kultivace bylo ke každé jamce přidáno 100 mikrolitrů WST-1 rozpuštěného v kultivačním médiu a bylo inkubováno další dvě hodiny. V případě živých buněk je tetrazoliová sůl redukována mitochondriálními dehydrogenázami na formazan. Tato kolorimetrická reakce byla sledována fotometrickým měřením při 450 nm s referenční vlnovou délkou 690 nm. Přežívání nádorových buněk (tumor cell survival, TCS) bylo vypočítáno pomocí následujícího vzorce:
TCS50 (EC50) hodnota je koncentrace daného cytostatika, která je letální pro 50 % nádorových buněk a byla vypočítána ze získaných křivek dávkové závislosti (tab. 1). Stejným způsobem byly zpracovány i opakované odběry ascitu či solidní tkáně u pacientek s ovariálním karcinomem.
Tab. 1. Hodnoty EC 50 pro jednotlivá cytostatika 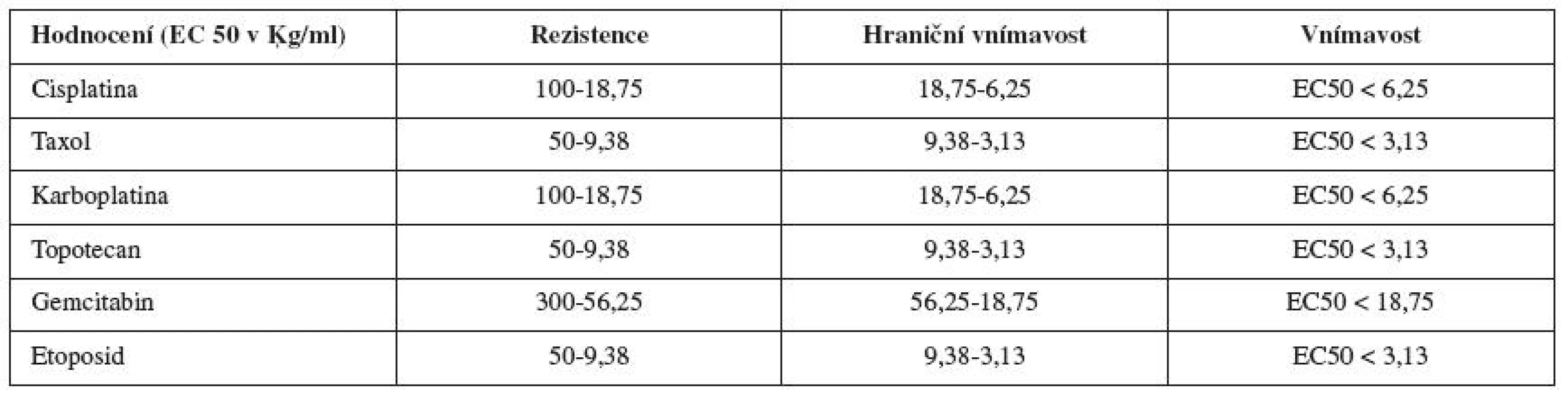
SOUBOR PACIENTEK
Chemorezistenci/chemosenzitivitu pomocí MTT testu jsme stanovili celkem u 32 vzorků ovariální nádorové tkáně a 26 vzorků ascitu pacientek s epiteliálním ovariálním karcinomem. Odběry z nádoru pro zpracování MTT testem jsme provedli u 22 žen se serózním cystadenopapilokarcinomem, 2 žen s mucinózním karcinomem, 7 žen s endometroidním karcinomem ovaria a u 1 pacientky se světlobuněčným karcinomem ovaria. Z ascitu jsme nádorové buňky získali u 18 žen se serózním cystadenopapilokarcinomem, 6 žen s endometroidním karcinomem ovaria, 1 pacientky s mucinózním a 1 pacientky se světlobuněčným ovariálním karcinomem. Pacientky byly zařazeny do souboru bez ohledu na pokročilost onemocnění a grading. Odběry byly odebírány během radikální operace pro karcinom ovaria, nádorovou tkáň identifikoval patolog přítomný na operačním sále a materiál pak byl neprodleně odvezen do laboratoře ke zpracování. Průměrný věk testovaných nemocných byl 56,1 roku. Bližší popis souboru viz tab. 2.
Tab. 2. Charakteristika souboru pacientek 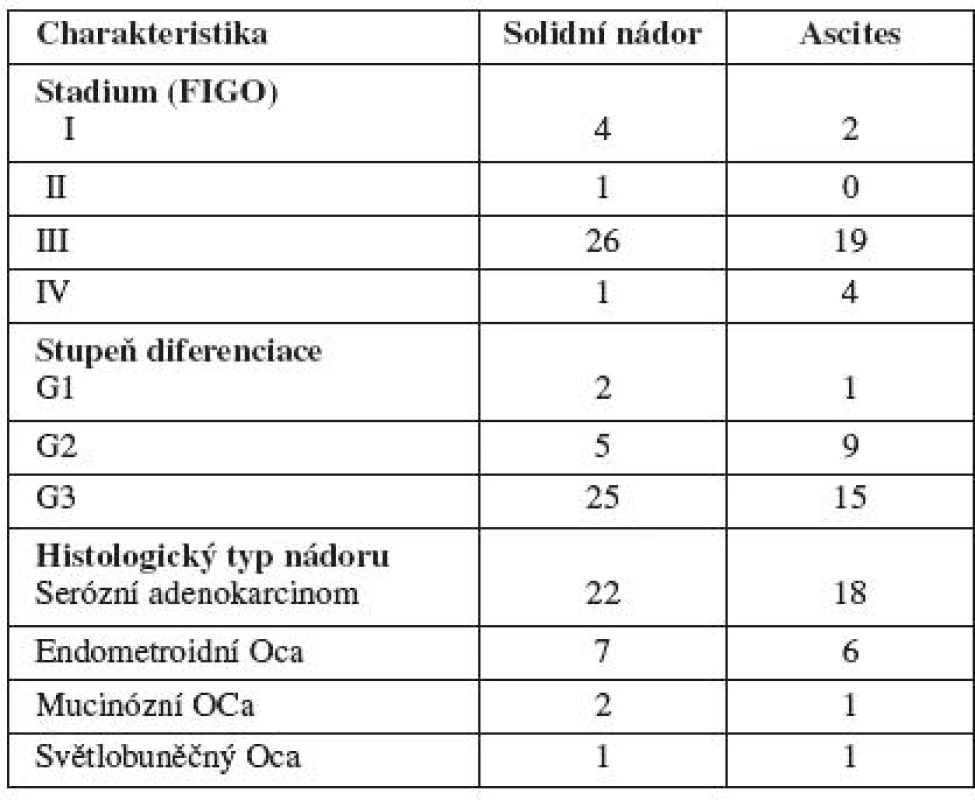
VÝSLEDKY
Rezistenci in vitro pomocí MTT testu jsme stanovili: na paclitaxel z tumoru u 10 pacientek (13,9 %), z ascitu u 13 pacientek (21,7 %), na cisplatinu z tumoru u 3 pacientek (4,2 %), z ascitu u 1 pacientky (1,7 %), na karboplatinu z tumoru u 12 pacientek (16,6 %), z ascitu u 9 pacientek (15,0 %), na topotecan z tumoru u 4 pacientek (5,6 %), z ascitu u 1 pacientky (1,7%), na etoposid z tumoru u 22 pacientek (30,6 %), z ascitu u 20 pacientek (33,3 %), na gemcitabin z tumoru u 21 pacientek (29,1 %), z ascitu u 16 pacientek (26,6 %).
Hraniční senzitivitu in vitro jsme zaznamenali: na paclitaxel z tumoru u 13 pacientek (46,4 %), z ascitu u 9 pacientek (32,2 % ), na cisplatinu z tumoru u 3 pacientek (10,7 %), z ascitu u 2 pacientek (7,7 %), na karboplatinu z tumoru u 9 pacientek (32,1 %), z ascitu u 12 pacientek (42,8 %), na topotecan z tumoru u 1 pacientky (3,6 %), z ascitu u 1 pacientky (3,6 %), na etoposid z tumoru u 1 pacientky (3,6 %), z ascitu u 1 pacientky (3,6 %), na gemcitabin z tumoru u 1 pacientky (3,6 %), z ascitu u 3 pacientek (10,7 %).
Senzitivitu in vitro jsme zjistili: na paclitaxel z tumoru u 9 pacientek (13,2 %), z ascitu u 4 pacientek (6,4 %), na cisplatinu z tumoru u 25 pacientek (36,8 %), z ascitu u 23 pacientek (36,6 %), na karboplatinu z tumoru u 10 pacientek (14,7 %), z ascitu u 5 pacientek (7,9 % ), na topotecan z tumoru u 20 pacientek (29,3 %), z ascitu u 22 pacientek (35 %), na etoposid 1 pacientka (1,5 %) byla in vitro senzitivní z tumoru a 3 pacientky měly prokázanou senzitivitu in vitro z ascitu (4,8 %), na gemcitabin z tumoru u 3 pacientek (4,4 %), z ascitu u 6 pacientek (9,4 %) (tab. 3).
Tab. 3. Výsledky MTT testu u vybraných cytostatik s použitím ovariálních nádorových buněk ze solidního tumoru a ascitu 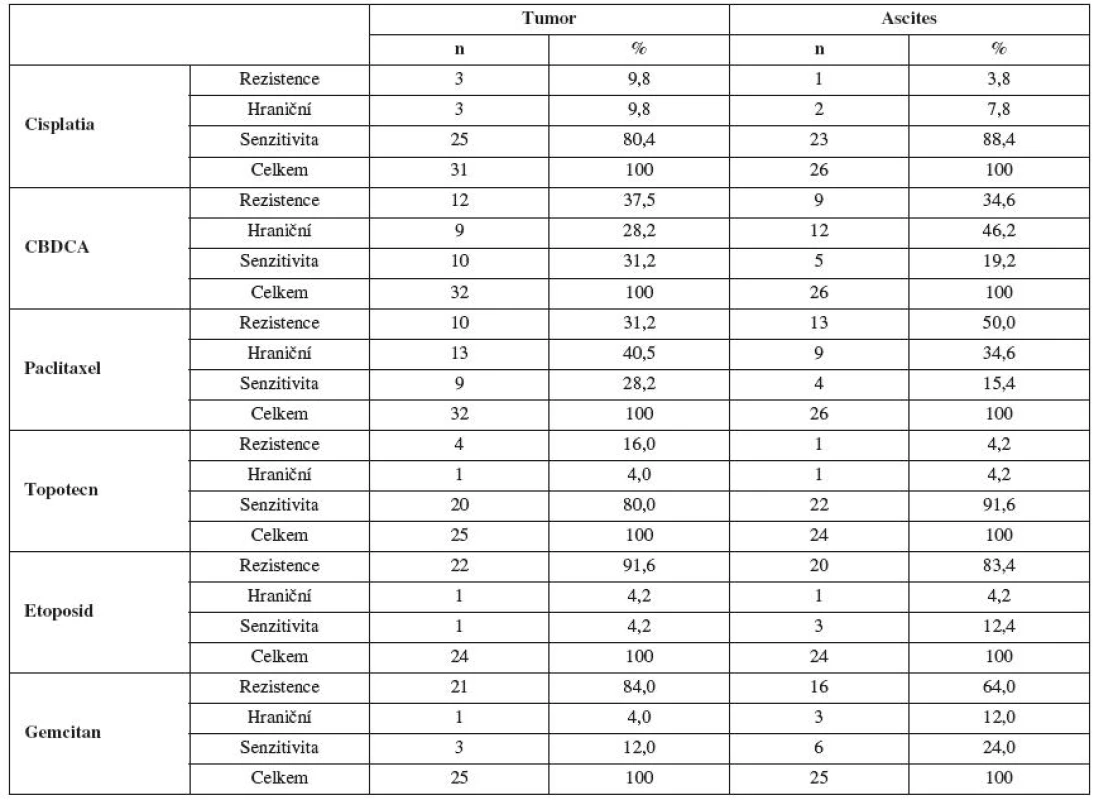
Nejčastěji vykazoval rezistenci in vitro zjištěnou MTT testem etoposid, gemcitabin a paclitaxel, a naopak nejméně často jsme rezistenci in vitro prokázali u cisplatiny a topotecanu. Nejvyšší senzitivitu in vitro vykazovala cisplatina následovaná topotecanem. Naopak nejnižší senzitivitu in vitro jsme zaznamenali u etoposidu, gemcitabinu a paclitaxelu. Zajímavé bylo zjištění výrazně rozdílného chování ovariálních nádorových buněk in vitro při testování MTT testem na karboplatinu a cisplatinu, kde jsme zjistili podstatně vyšší počet rezistencí in vitro, a to jak v solidním nádoru, tak i v ascitu u karboplatiny v porovnání s cisplatinou (graf 1 a 2).
Graf 1. Znázornění výsledků MTT testu ze solidního nádoru u jednotlivých cytostatik 
Graf 2. Znázornění výsledků MTT testu z ascitu u jednotlivých cytostatik 
DISKUSE
Za nejvýznamnější výsledky této práce považujeme zjištění poměrně vysokého procenta citlivosti ovariálních nádorových buněk in vitro na cisplatinu a topotecan (obr. 1 a 2).
Obr. 1. Nádorové buňky získané z ascitu (zvětšení 20x) 
Obr. 2. Buňky získané z ascitu, stejné místo snímané 1, 12, 24, 36, 48 a 72 hodin po začátku působení topotecanu v koncentraci 3,2 mg/ml; zvětšení 20x. 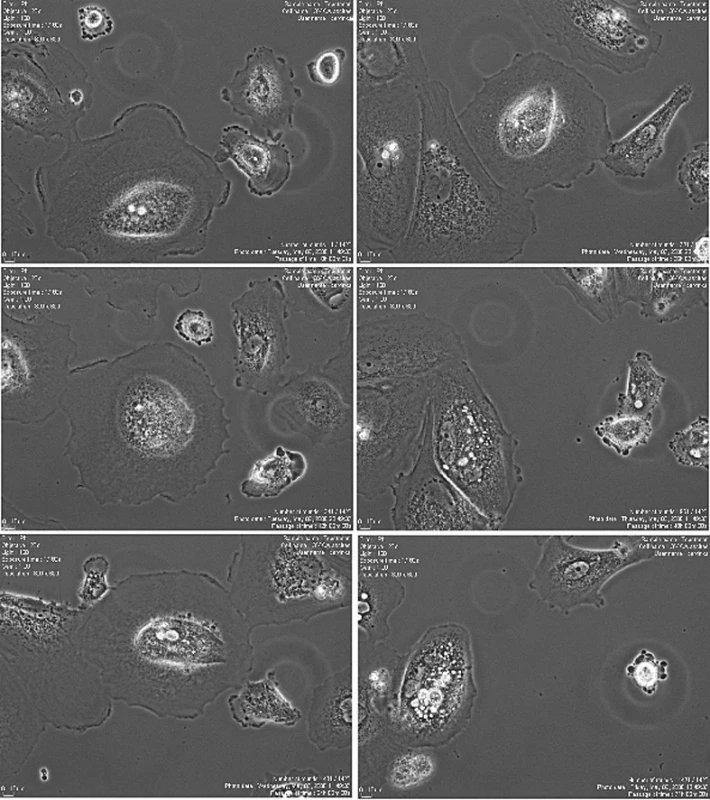
Na významnou citlivost ovariálních nádorových buněk u těchto cytostatik upozornily již dřívější studie [1, 6]. Překvapivě karboplatina nevychází v porovnání s cisplatinou při testování rezistence/senzitivity in vitro zcela jednotně. U karboplatiny jsme zaznamenali častější výskyt rezistence v porovnání s cisplatinou. Studie GOG 158 jednoznačně prokázala stejný efekt karboplatiny a cisplatiny při menším procentu komplikací při podání karboplatiny [10]. V práci publikované v roce 2004 v Gynecologic Oncology byla však zjištěna častější rezistence in vitro u karboplatiny v porovnání s cisplatinou [1].
Karboplatina a paclitaxel vykazovaly v naší práci poměrně častou rezistenci in vitro. Podle doporučených postupů se v první linii chemoterapie podává kombinace platinového preparátu s paclitaxelem u pacientek s pokročilým ovariálním karcinomem, není-li určeno jinak. Biologická odlišnost jednotlivých nádorů a jednotlivých nositelů je ale tak pestrá, že jeden léčebný režim maximálně s mírnou obměnou nemůže být ten nejlepší pro všechny pacientky s karcinomem ovaria. Stále více prací je věnováno testování citlivosti nádorů a onkologická léčba je směřována k individualizaci nádorové chemoterapie.
Geisler et al. v Gynecologic Oncology v roce 2007 publikovali výsledky své práce věnované extrémní lékové rezistenci u pacientek po předchozí aplikaci paclitaxelu. Pouze malé procento žen (10,3 %) ukázalo, že jejich nádor nebyl rezistentní na paclitaxel. Malý počet nízké lékové rezistence a vysoké procento extrémní lékové rezistence nalezené na paclitaxel v této práci po předchozí aplikaci karboplatiny a paclitaxelu otevírá otázku opakovaného užití paclitaxelu při recidivě u těchto pacientek [4]. Holloway et al. publikovali, že ženy léčené cytostatiky spadajícími do skupiny extrémní lékové rezistence při testování in vitro měly signifikantně kratší přežití ve srovnání s ženami, které dostaly cytostatika s nízkou rezistencí zjištěnou in vitro. Tato studie 119 vzorků epiteliálních ovariálních karcinomů nalezla extrémní lékovou rezistenci v 89 % případů [5].
Tradičně používané parametry k predikci klinického chování epiteliálních ovariálních karcinomů jsou nedostačující pro stanovení odpovědi na chemoterapii a přežití u jednotlivých pacientek. Zatímco některé pacientky s pokročilým ovariálním karcinomem mají kompletní odpověď na chemoterapii a další léčbu, u další pacientky se stejným rozsahem onemocnění dojde k progresi onemocnění a zhoršení celkového stavu. Jsou pacientky, které na současnou „standardní“ léčbu první linie vůbec nereagují a nebo u nich dochází k rychlé progresi onemocnění při zhoršující se kvalitě života [12]. Je-li daný nádor vůči podávanému cytostatiku rezistentní, pak bez ohledu na statistické výsledky randomizovaných studií nelze u daného jednotlivce očekávat léčebný efekt. Průběh onemocnění může být i zhoršen oslabením metabolismu a přirozených obranných mechanismů, případně vznikem dalších mutací nádoru [13].
ZÁVĚR
Při hodnocení rezistence/senzitivity in vitro ovariálních nádorových buněk vykazovala jednotlivá cytostatika značné odlišnosti. Nejvyšší senzitivita in vitro byla zaznamenána u cytostatik, která se běžně nepoužívají při standardní léčbě první linie chemoterapie. Závěrem lze tedy konstatovat, že lepší pochopení nádorové biologie a faktorů spojených s chemorezistencí by mohlo přispět ke zvýšení úspěšnosti léčby pacientek s karcinomem ovaria.
Tato práce vznikla za podpory grantu IGA MZ NS 9737-3.
MUDr. Iva Sedláková, Ph.D.
Porodnická a gynekologická klinika FN
Sokolská 581
500 05 Hradec Králové
e-mail: sedlakiva@seznam.cz
Zdroje
1. Cloven, NG., Kyshtoobayeva, A., Burger, AR., et al. In vitro chemoresistance and biomarker profiles are unique for histologic subtypes of epithelial ovarian cancer. Gynecol Oncol, 2004, 92, p. 160-166.
2. Dvorská, M., Driák, D., Švandová, I. Apoptóza v gynekologii a porodnictví. Gynekolog, 2008, 4, s. 132-140.
3. Fruehauf, JP., Alberts, SD. In vitro drug resistance versus chemosensitivity: Two sides of different coins. J Clin Oncol, 2005, 23, p. 3641-3643.
4. Geisler, JP., Linnemeier, CG., Thomas, JA,. et al. Extreme drug resistance is common after prior exposure to paclitaxel. Gynecol Oncol, 2007, 106, p. 538-540.
5. Holloway, RW., Mehta, RS., Finkler, NJ., et al. Association between in vitro platinum resistance in the EDR assay and clinical outcomes for ovarian cancer patients. Gynecol Oncol, 2002, 87, p. 8-16.
6. Kostečka, A., Vagundová, M. Prediktivní testy chemorezistence in vitro. Souhrnná roční zpráva o řešení výzkumného záměru MOÚ v Brně, 2003, s. 36-38.
7. Lichý, JH., Dalbergue, F., Washington, C., et al. Genetic heterogenity in ductal carcinoma of the breast. LabInvest, 2000, 80, p. 291-301.
8. Metzinger, SD., Taylor, DD., Taylor, GC. Induction of p53 and drug resistance following treatment with cisplatin or paclitaxel in ovarian cancer cell lines. Cancer Letters, 2006, 236, p. 302-308.
9. Michalová, E., Poprach, A., Němečková, I., et al. Predikce citlivosti nádorových buněk k chemoterapeutikům ex vivo – úskalí a limitace vlastní metody. Klin Onkol, 2008, 21, s. 93-97.
10. Ozols, FR. Paclitaxel(Taxol)/carboplatina combination chemotherapy in the treatment of advanced ovarian cancer. Seminars in Oncology, 2000, 3, p. 3-7.
11. Perez, RP. Cellular and molecular determinants of cisplatin resistance. Eur J Cancer, 1998, 34, p. 1535-1542.
12. Sedláková, I., Tošner, J., Špaček, J., et al. Chemorezistence/chemosenzitivita ovariálního karcinomu – kazuistika. Čes Gynek, 2008, 3, s. 140-143.
13. Talač, R., Žaloudík, J., Hajdúch, M., et al. Hodnocení lékové rezistence in vitro a její klinické implikace. Klin Onkol, 2002, 2, s. 2-3.
14. Tewari, SK., Mehta, SR., Burger, AR., et al. Conservation of in vitro drug resistance patterns in epithelial ovarian carcinoma. Gynecol Oncol, 2005, 98, p. 360-368.
15. Wu, H., Cao, Y., Weng, D., et al. Effect of tumor suppressor gene PTEN on the resistance to cisplatin in human ovarian cancer cell lines and related mechanisms. Cancer Letters, 2008, 271, p. 260-271.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek G bod – mýty a realitaČlánek Dopis redakci
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2010 Číslo 3- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- K nedožitým třiašedesátinám prim. doc. MUDr. Zdeňka Holuba, CSc.
- Porovnání exprese imunohistochemických markerů ve vzorcích z hysteroskopie a hysterektomie u pacientek s karcinomem endometria
- Sexuální morbidita po chirurgické léčbě zhoubných gynekologických nádorů
- Technika radioterapie s modulovanou intenzitou záření v léčbě gynekologických malignit
- Rezistence/senzitivita in vitro u pacientek s karcinomem ovaria
- Některé charakteristiky žadatelek o umělé ukončení těhotenství
- Prognostický význam klinickopatologických a vybraných imunohistochemických faktorů u karcinomu endometria
- Modifikovaná klasifikace mikroskopického hodnocení poševních infekcí
- Výskyt preperitoneálního tuku a hernia obturatoria v canalis obturatorius
- G bod – mýty a realita
- Německý gynekolog a porodník Christian Gerhard Leopold (1846-1911)
- Incidence vrozených srdečních vad v České republice – aktuální data
- Průběh a výsledky 34 těhotenství komplikovaných syndromem HELLP
- Burkittův lymfom v těhotenství – kazuistika
- Detekce placentárně specifických mikroRNA v mateřské cirkulaci
- Životní jubileum prim. MUDr. Jana Machače
- Profesor MUDr. Jan Hořejší, DrSc., sedmdesátníkem
- Návrh České lékařské společnosti J. E. Purkyně na novelizaci vyhlášky 185/2009 Sb. o specializačním vzdělávání lékařů
- Konsenzuální návrh české lékařské společnosti J. E. Purkyně
- Dopis redakci
- Příběhy pacientů z internetových stránek
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- G bod – mýty a realita
- Incidence vrozených srdečních vad v České republice – aktuální data
- Výskyt preperitoneálního tuku a hernia obturatoria v canalis obturatorius
- Modifikovaná klasifikace mikroskopického hodnocení poševních infekcí
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




