-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Onkofertilita – nový směr reprodukční medicíny
Oncofertility – a new trend in reproductive medicine
Effective treatment of cancer often causes patients irreversible damage of reproductive abilities. New trend in reproductive medicine commonly described as oncofertility offers cancer patients not only infertility treatment, but also potent prevention of irreversible damage of reproductive organs and functions. Efficacious methods of women reproductive function damage prevention has been developed at Brno University Hospital Department of Obstetrics and Gynecology since year 2004. The paper describes current oncofertility techniques implemented to clinical practice – embryo and oocyte banking, ovarian tissue cryopreservation including further possibility of its orthotopic autotransplantation and administration of gonadoliberin analogues for ovarian protection. During past 6 years expert consultation before start of gonadotoxic treatment has been provided to 195 young women with newly diagnosed cancer or autoimmune disease. Attention is applied to pro and contras of previously described methods of ovarian protection in the discussion. Limitations regarding implementation of oncofertility techniques in practice are mentioned. Furthermore short recommendations regarding pre-treatment oncofertility consultation with patients are given.
Key words:
infertility, oncofertility, ovarian tissue cryopreservation, vitrification, oocyte cryopreservation.
Autoři: Martin Huser
; I. Crha
; J. Žáková; P. Ventruba
Působiště autorů: Gynekologicko-porodnická klinika LF MU a FN Brno, přednosta prof. MUDr. P. Ventruba, DrSc.
Vyšlo v časopise: Ceska Gynekol 2011; 76(2): 91-99
Souhrn
Cíl studie:
Představení technik reprodukční ochrany u pacientů s nově diagnostikovaným onkologickým onemocněním dokumentované vlastními zkušenostmi z praxe.Typ studie:
Literární přehled a vlastní zkušenosti.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika LF MU a FN Brno.Předmět a metodika:
Práce prezentuje možnosti ochrany reprodukčních funkcí u pacientů s nově diagnostikovaným onkologickým onemocněním v reprodukčním věku. Autoři popisují jednotlivé techniky reprodukční ochrany a možnosti jejich využití v klinické praxi, které jsou dokumentovány vlastními praktickými zkušenostmi.Závěr:
Onkofertilita jako nová medicínská disciplína nabízí moderní, ale zároveň reálnou možnost podpůrné léčby mladým lidem, kteří musí bojovat s rakovinou. Zatím neexistuje efektivní a univerzální technika reprodukční ochrany vhodná pro každého pacienta. Poskytování těchto specializovaných poradenských služeb by mělo být směrováno do center, kde je možné pacientovi nabídnout celé portfolio metod reprodukční ochrany.Klíčová slova:
neplodnost, onkofertilita, kryokonzervace ovariální tkáně, vitrifikace, kryokonzervace oocytů.ÚVOD
Rakovina se stává v moderní medicíně onemocněním, které je možné úspěšně a trvale vyléčit. Navzdory využití nejmodernějších metod onkologické léčby, může být snaha o vyléčení pacienta vykoupena celou řadou nežádoucích účinků a někdy i trvalých následků. Trvalá ztráta reprodukční schopnosti, s často dlouhodobými psychickými dopady na pacienta a jeho kvalitu života, představuje jeden ze závažných dlouhodobých následků moderní protinádorové léčby.
Ochrana reprodukčních funkcí a orgánů se v onkologii v posledních letech stala velmi frekventovaným tématem, zejména z důvodu významných úspěchů v onkologické léčbě. Důvody jsou také sociální, dané silným tlakem na posun rodinného života do pozdějšího věku, kdy schopnost fertility zejména u žen poměrně rychle klesá s postupujícím věkem. Pokroky v léčbě rakoviny zlepšily dlouhodobé přežívání mladých pacientů trpících závažnými formami tohoto onemocnění. Mnoho generalizovaných forem rakoviny (leukémie, lymfomy i řada solidních maligních tumorů) je dnes trvale vyléčitelná. V posledním desetiletí bylo v oblasti reprodukčního stárnutí učiněno mnoho nových poznatků. Také tyto vědomosti nám umožňují nabídnout ženám postupy, které mohou zachovat či účinně ochránit jejich reprodukční zdraví [1].
Otázka zachování reprodukčního potenciálu je důležitá také pro ženy trpící některými chronickými nenádorovými chorobami. Ovarium je jediným a bohužel neobnovitelným rezervoárem pohlavních buněk v organismu ženy. Existuje mnoho nemocí, jejichž léčba neopravitelně poškozuje jeho funkce. Jde například o ženy s těžkou formou endometriózy, u nichž selhaly medikamentózní a konzervativní chirurgické možnosti léčby. U žen v reprodukčním věku jsou stále častěji diagnostikovány různé formy systémových autoimunitních onemocnění, nejčastěji systémový lupus erythematodes. Pokud toto nebezpečné a progredující systémové onemocnění začne postihovat životně důležité orgány (zejména ledviny a nervovou soustavu), je nutná vysoce gonadotoxická imunosupresivní léčba cyklofosfamidem [2].
Pojem onkofertilita
Otázky fertility onkologických pacientů jsou náplní nového medicínského směru označovaného stále častěji pojmem onkofertilita. Tento výstižný termín, navržený v roce 2003 skupinou amerických odborníků na reprodukční medicínu v čele s prof. Teresou K. Woodruff z Northwestern University v Chicagu, se postupně zažil a nyní se již celosvětově používá. V českém prostředí je tento pojem poměrně málo známý, ale jistě o něm v budoucnu uslyšíme více. Pojem onkofertilita je definován jako vývoj a klinická aplikace metod reprodukční ochrany u pacientů s onkologickým onemocněním. U mužů je zlatým standardem metoda kryokonzervace spermatu před onkologickou léčbou, která je v ČR běžně nabízena a je již dobře zavedená do povědomí odborné veřejnosti [3]. Nové techniky onkofertility se ovšem rozvíjejí také u žen. Mezi moderní postupy dnes řadíme zejména embryologické kryokonzervační metody uchovávání embryí, oocytů nebo ovariální tkáně. Do klinické praxe také postupně proniká protektivní aplikace analog gonadoliberinu (GnRH-a) během systémové onkologické léčby. Mezi dosud experimentální metody patří také proces in vitro kultivace ovariálních folikulů, s cílem vytvořit v laboratorních podmínkách haploidní oocyt kompetentní k fertilizaci. Výzkum je prováděn zejména na zvířecích modelech (myši, králíci, opice), ale již také na lidské ovariální tkáni. V klinické praxi vznikají v posledních letech specializovaná pracoviště, tzv. centra reprodukční ochrany, jejichž hlavním smyslem je poskytování konzultační činnosti pacientům s nově diagnostikovaným onkologickým onemocněním s využitím výše zmíněných metod. Tato centra se také zapojují do vědecko-výzkumné činnosti při vývoji některých zatím experimentálních možností reprodukční ochrany, jako je in vitro kultivace ovariálních folikulů, vitrifikace oocytů či ovariální tkáně nebo xeno-transplantace tkáně ovaria. Tato činnost vyžaduje zapojení do mezinárodních konsorcií či odborných sdružení, jako je například Mezinárodní společnost reprodukční ochrany (International Society for Fertility Preservation, www.isfp-fertility.org) nebo Oncofertility Consortium (www.oncofertility. northwestern.edu).
Centrum reprodukční ochrany bylo v roce 2009 formálně založeno také na Gynekologicko porodnické klinice LF MU a FN Brno a nabízí své služby pacientům z celé České republiky a v poslední době i na Slovensku. Dalším významným úkolem odborníků, kteří se zabývají otázkami reprodukčního stárnutí a možnostmi jeho iatrogenního urychlení, je edukace odborné i laické veřejnosti v problematice onkofertility. Integrální součástí oboru onkofertility jsou i etické, právní a sociální otázky, které vznikají v souvislosti s rozvojem tohoto nového směru reprodukční medicíny [4].
MOŽNOSTI REPRODUKČNÍ OCHRANY U MUŽŮ
U muže (na rozdíl od ženy) dochází k trvalé obnově gamet v průběhu jeho reprodukčního života procesem spermatogeneze. Zhoršení kvality spermatu je popisováno u pacientů již před onkologickou léčbou, pravděpodobně v důsledku negativního působení primárního maligního onemocnění. Kryokonzervace spermatu je standardně užívanou metodou prevence poškození testes vlivem onkologické léčby. Jedná se o metodu poměrně jednoduchou, bezpečnou a relativně levnou [3]. V počátečních fázích vývoje metody se zamrazoval celý objem ejakulátu muže. V současnosti se před vlastní kryokonzervací spermie zpracovávají a koncentrují do tzv. kryodávek, které je možné použít ihned po rozmražení. Spermie je dnes možné získat také extrakcí přímo z varlete či nadvarlete pomocí moderních chirurgických technik – microepididymal sperm aspiration (MESA), testicular sperm extraction (TESE) nebo testicular fine needle aspiration (TEFNA) [5]. Mikromanipulační metoda injekce spermie do oocytu (ICSI) umožňuje dosáhnout oplození také u pacientů s velmi špatnou kvalitou spermiogramu, kde jsou přítomny pouze ojedinělé či imobilní spermie [3]. Výsledky fertilizace pomocí těchto technik jsou dnes srovnatelné s výsledky oplození semenem mužů s normálními parametry spermiogramu. Bylo by logické tvrdit, že úspěšnost oplození (fertilization rate) a početí (pregnacy rate) bude nižší při použití spermií, které byly zamraženy a následně rozmraženy. Komparativní studie dávají na tuto otázku rozporuplné odpovědi. Některé z nich tuto hypotézu potvrzují, jiné vyvracejí. Kumulativní pregnancy rates při inseminaci zamraženými/rozmraženými spermiemi se pohybují v rozmezí 70–75 % [6]. Častá bývá také otázka, zda během procesu kryokonzervace nedochází k poškození DNA spermie. Takto poškozené spermie by mohly zvyšovat riziko potratu nebo incidenci vrozených vývojových vad u případného potomka. Dosud publikovaná data o dětech počatých a narozených s použitím kryokonzervovaných spermií neukazují genotypové či fenotypové abnormality. Incidence vrozených vývojových vad či abnormálního vývoje takto počatých dětí nejsou vyšší než v běžné populaci [7].
Technika kryokonzervace spermatu má ovšem také své limity a nelze ji například použít u prepubertálních pacientů, jejichž testes ještě neprodukují zralé spermie. Zde je možnost zamražení nezralých spermatid po jejich extrakci výše zmíněnými chirurgickými technikami. V posledních pěti letech byly zaznamenány úspěchy v oblasti kryoprezervace nezralých spermatických buněk, jejich následné maturace in vitro a auto-transplantace do oblasti testes. Tyto metody jsou zatím stále experimentální a vyžadují další výzkum a upřesnění, aby mohly být rutinně používány v praxi.
Pacient před onkologickou léčbou často vůbec neví o možnosti zamražení spermií nebo se o ní dozví až v průběhu léčby. Většinou přichází do centra asistované reprodukce až za několik let po vyléčení nádorového onemocnění, kdy již není možné získat spermie vhodné k oplození ani za použití invazivních chirurgických technik. Existující spermobanky jsou často využívány jen pro účely asistované reprodukce a nenabízejí své služby v oblasti onkofertility. Pacient je poté odkázán pouze na využití darovaných gamet – oplození oocytů pomocí spermatu dárce. Využití spermií dárce u těchto pacientů je v praxi často komplikováno celou řadou technických, právních i etických problémů. Jejich detailní rozbor ovšem přesahuje zaměření této práce [8, 9].
Proto se intenzivně hledají postupy, jak ochránit spermatogonie již před zahájením onkologické léčby nebo v průběhu ní a zlepšit kvalitu spermatogeneze po jejím ukončení. Bylo klinicky prokázáno, že kvalita spermiogramu pacientů po onkologické léčbě je lepší u prepubertálních chlapců než u mužů v reprodukčním věku [10]. Tato fakta vedla k hypotéze, že suprese testikulárních funkcí v průběhu protinádorové léčby povedou k určitému stupni ochrany spermatogonií před chemoterapeutickým inzultem. Data získaná na animálních studiích byla povzbuzující [11]. Podobné pozitivní výsledky byly prokazovány při použití testosteronu, antagonisty testosteronu flutamidu a kombinace testosteronu s estrogeny či analogy gonadoliberinu. Protektivní efekt byl vysvětlován pozitivním působením hormonálních léků na přežívání spermatogonií typu A [12]. Ani přes pozitivní výsledky animálních studií nebyl protektivní efekt podobné léčby na lidské spermatogonie potvrzen. K podpůrné léčbě byly používány většinou GnRH analoga v kombinaci s testosteronem [13].
MOŽNOSTI REPRODUKČNÍ OCHRANY U ŽEN
Fertilitu ženy ovlivňuje mnoho faktorů – věk, životní prostředí, expozice radiačním nebo chemickým agens či lékařské intervence. Hlavním rozdílem fertility žen (na rozdíl od mužů) je trvalý pokles počtu primordiálních folikulů. U člověka, podobně jako u mnoha druhů jiných savců, je počet primordiálních folikulů předem determinován při narození a postupně exponenciálně klesá. Souvislost mezi poškozením ovariálního poolu folikulů a onkologickou léčbou je známa již několik desetiletí. S narůstající úspěšností onkologické léčby roste význam těchto negativních dopadů onkologické léčby na fertilitu. Každá dvacátá žena podstupuje v průběhu dětství a reprodukčního života onkologickou léčbu pro diagnózu rakoviny [14]. Níže popsané metody ovariální protekce, mohou významným způsobem ovlivnit reprodukční funkce žen podstupujících protinádorovou léčbu. Volba optimálního postupu je u každého pacienta velmi individuální. Konzultace s odborníkem v problematice onkofertility je ke správnému rozhodnutí pacienta velmi důležitá.
Kryokonzervace embryí
Kryokonzervace nadbytečných embryí, které nebudou transferovány do dělohy, je rutinním postupem v moderní reprodukční medicíně. Cílem kryokonzervace přebytečných embryí je zvýšení šancí na otěhotnění v průběhu cyklu in vitro fertilizace (IVF). První těhotenství po transferu zamražených a rozmražených embryí (tzv. kryoembryotransferu, KET) na světě bylo popsáno v roce 1983 [15]. Česká republika také nezaostala za světem a prvního těhotenství po KET bylo dosaženo na Gynekologicko-porodnické klinice LF MU v Brně v březnu roku 1994 a k porodu prvního zdravého dítěte po KET došlo 15. 3. 1996 na stejném pracovišti [16]. V posledním desetiletí jsou tyto postupy používány také k záchraně fertility žen, které onemocní rakovinou a vyžadují náročnou gonadotoxickou léčbu.
Embrya mohou být teoreticky zamražena libovolně dlouhou dobu. Těhotenské výsledky jsou samozřejmě horší, než je tomu po transferu čerstvých embryí – procento klinických gravidit je zhruba poloviční. Při rozvinutých technikách kryokonzervace a dobré kontrole kvality laboratoře je dosahováno pregnancy rates 20–25 % na jeden KET. Zvýšení úspěšnosti implantace je možné dosáhnout využitím asistovaného hatchingu (AH). U dětí narozených po této metodě nebyl prokázán vyšší výskyt vrozených vývojových vad ani jiných odchylek od normálního vývoje dítěte [17]. Mezi faktory nejvíce ovlivňující úspěšnost kryokonzervace patří tvorba ledových krystalů vně a uvnitř buněk, toxicita kryoprotektantů a osmotické změny v buňce související se změnami jejího objemu. Ke kryokonzervaci se zpravidla používají programovatelné mrazicí přístroje.
V posledních letech se stále více prosazuje v embryologii technika ultrarychlého zmražení, tzv. vitrifikace. Vitrifikace znamená přechod roztoku do pevného skupenství bez tvorby tekutých krystalů. Procesu lze docílit ponořením vzorku přímo do tekutého dusíku o teplotě -196 °C, kdy dochází k ultra-rychlému poklesu teploty rychlostí až 20 000°C/min. V závislosti na míře kontaktu zamrazovaného vzorku s tekutým dusíkem, rozlišujeme v praxi tzv. otevřené a uzavřené vitrifikační systémy. V Evropské unii je při manipulaci s lidským buňkami a tkáněmi povoleno pouze využití uzavřených systémů (Evropská Direktiva 2004/ /23/EC). Procento přežívání embryí zpracovaných touto technikou je velmi vysoké a pohybuje se nad 90 % i v pozdějších stadiích vývoje embrya včetně blastocyst [18]. Další významnou výhodou vitrifikace ve srovnání s pomalým zamrazováním, je její technická jednoduchost a menší finanční nákladnost. Embrya mohou být kryokonzervována nejdříve za 24 hodin kultivace ve stadiu prvojader nebo později během dělení buněk embrya, nejpozději však po 5-6 dnech kultivace ve stadiu blastocysty. K zajištění úspěšné implantace embryí po jejich rozmražení je nutné připravit v děloze receptivní endometrium pomocí steroidní hormonální léčby. U pacientů po onkologické léčbě, u nichž je ovariální steroidogeneze narušena, je tato hormonální příprava nezbytně nutná.
Kryokonzervace oocytů
Technika kryokonzervace oocytů (KO) doznala v posledních letech řady inovací, které významně zvýšily její úspěšnost a zařadily tento postup do klinické praxe. Technika byla na dlouhou dobu opuštěna pro svou nízkou úspěšnost ve srovnání s kryokonzervací embryí. V 90. letech minulého století se počet klinických gravidit na embryotransfer při využití tohoto postupu pohyboval mezi 1–2 %. Nový zájem o tuto technologii byl vyprovokován také v důsledku jejího klinického potenciálu v oblasti onkofertility.
Příčinou prvotních neúspěchů této metody byla extrémní senzitivita lidských oocytů a jejich organel na proces kryokonzervace. Šlo zejména o poškození zona pellucida (zona pellucida hardening) a mikrotubulů cytoskeletálního aparátu oocytu. Významným faktorem vedoucím ke zlepšení výsledků bylo využití kryoprotektantů stabilizujících buněčné membrány (kyselina linolová, albumin, sucróza) a také rozvoj techniky vitrifikace popsané výše. S využitím moderních kryokonzervačních postupů lze nyní dosáhnout velmi dobrých výsledků v přežívání i schopnosti oplození takto uchovávaných oocytů. Katayama uvádí ve své pilotní práci 94% přežívání oocytů a 91% fertilization rate [19]. Procento klinických gravidit po transferu embryí vzniklých po oplození dříve vitrifikovaných oocytů se pohybuje mezi 50–65 %. Práce dalších autorů v posledních třech letech uvádějí podobné velmi dobré výsledky [20, 21]. Do konce roku 2009 bylo v literatuře popsáno více než 800 dětí narozených za pomoci této techniky bez zvýšeného rizika výskytu vrozených vývojových vad [22]. Recentní studie Ciottiho porovnávala metodu vitrifikace oocytů s referenční technikou pomalého zmrazování. Jako srovnávací parametr byla zvolena míra poškození mikrotubulů mitotického vřeténka oocytu. Výsledky studie ukazují možný protektivní efekt vitrifikace na mitotické vřeténko [23].
Díky technickým vylepšení a vysoké klinické úspěšnosti se metoda kryokonzervace oocytů stává velmi významným konkurentem tradiční kryokonzervace embryí. Je velmi pravděpodobné, že do budoucna vytlačí konvenční metody uchovávání lidských embryí mající daleko delší tradici. Možnost uchovávání lidských oocytů má velký význam nejen pro onkologické pacientky. Kryokonzervace oocytů přináší velký komerční potenciál také u jinak zdravých žen rozhodnutých posunout své mateřství do pozdějšího věku. S využitím těchto technik je možné vytvořit komplexní genetickou banku zárodečných buněk obsahující spermie i oocyty.
Kryokonzervace ovariální tkáně
Kryokonzervace ovariální tkáně (KOT) představuje jedinou možnost reprodukční ochrany u pacientek, u nichž nelze oddalovat zahájení onkologické léčby pro riziko progrese základního onemocnění. Hlavním cílem této strategie je zachovat tkáň ovariálního kortexu obsahující primordiální folikuly do doby, kdy je onkologické onemocnění pacientky trvale vyléčeno nebo je v dlouhodobé klinické remisi [24]. Kryokonzervovaná tkáň může být po rozmražení buď transplantována zpět do organismu ženy, nebo využita jako zdroj primordiálních folikulů k jejich kultivaci in vitro [25]. Podle místa uložení štěpu rozlišujeme transplantaci do oblasti malé pánve (ortotopická lokalizace) nebo do jiného, většinou lépe přístupného místa v organismu ženy (heterotopická lokalizace) [26]. Největší klinické zkušenosti existují s kryokonzervací a následnou ortotopickou auto-transplantací fragmentů (proužků) ovariálního kortexu.
Kryokonzervační protokoly zajišťující dobré výsledky přežití a funkčnost později transplantovaných vzorků se vyvíjely od 90. let minulého století. Na rozdíl od kryokonzervace embryí či oocytů je ovariální tkáň daleko komplexnější a obsahuje více druhů buněk – stromální buňky, folikulární buňky a oocyty. Standardní metodou kryokonzervace ovariální tkáně je technika pomalého mražení v médiu obsahujícím lidský sérový albumin a sucrósu s využitím propandiolu, dimethylsulphoxidu či ethylenglykolu jako kryoprotektantů [27]. Ke kryokonzervaci ovariální tkáně je také možné využít výše popsanou techniku vitrifikace. Využitím moderních kryokonzervačních technik je dosahováno přežívání 70–80 % primordiálních folikulů [28].
Zamražená ovariální tkáň po rozmražení může být použita k transplantaci u vyléčené onkologické pacientky. První porod zdravého dítěte po transplantaci zamražené ovariální tkáně popsal Belgičan Donnez v roce 2004 u 25leté ženy dříve léčené chemoradioterapií pro Hodgkinův lymfom v pokročilém IV. stadiu [24]. Jiní autoři poté publikovali dalších 10 případů těhotenství a porodu zdravého dítěte po autotransplantaci zamražené ovariální tkáně u onkologických pacientek [29, 30, 31, 32]. Ve všech dosud publikovaných případech došlo k obnově menstruačního cyklu a průkazu vývoje ovulačních folikulů v transplantátu za 4–8 měsíců od transplantace. Zajímavá je také perzistence poměrně vysokých hladin FSH ve folikulární fázi menstruačních cyklů proběhlých po autotransplantaci. Hodnoty FSH se běžně pohybovaly nad hranicí 25 IU/l. Tyto vysoké hodnoty FSH mohou být důsledkem poměrně malého počtu přeživších primordiálních folikulů v transplantátu. Je otázkou, jak velká je ovariální rezerva vzniklá po autotransplantaci a na jak dlouhou dobu pacientce může stačit k zajištění menstruačního nebo ovulačního cyklu. Transplantace ovariální tkáně je prováděna s cílem zajistit fertilitu ženy po onkologické léčbě. Nemůže zatím sloužit k dlouhodobému zajištění produkce ovariálních steroidů u žen s předčasným ovariálním selháním po chemoterapii. Relevantní data zabývající se délkou hormonálního fungování transplantátu v literatuře zatím chybějí.
Hlavním problémem transplantace ovariální tkáně je ischemické trauma v době časně po transplantaci. V tomto období dosud není procesem neovaskularizace vytvořena kapilární síť zásobující štěp. Redukce délky tohoto ischemického intervalu je tedy zásadní pro lepší přežívání folikulárních buněk. Ke snížení délky ischémie štěpu se teoreticky jeví jako velmi efektivní transplantace celého ovaria s vaskulární anastomózou. Technika byla úspěšně vyzkoušena u menších i větších savců [33, 34]. Problémem této metody u větších savců je zajištění adekvátní difuze kryoprotektantu do celého orgánu a poškození kapilár ledovými krystaly. Dalším technickým problémem metody je vysoké riziko trombózy v re-anastomozovaném vaskulárním pelikulu [35]. Ve většině animálních studií byla prokázána vitalita štěpu po dobu minimálně dvou let [36]. Autotransplantaci kryokonzervovaného celého lidského ovaria s mikroanastomózou v roce 2004 úspěšně realizoval Martinez--Madrid a v transplantátu prokázal přežívání až 75 % folikulů [37].
Na rozdíl od ovariální tkáně jsou izolované primordiální folikuly (PMF) velmi rezistentní k poškození nízkými teplotami – mají relativně inaktivní metabolismus, malou velikost (30-40 mikrometrů) a absenci cytoskeletu. Izolace PMF ovšem není jednoduchá. Používá se kombinace techniky mechanické mikrodissekce a enzymatické digesce pomocí enzymu kolagenázy či její purifikované (endotoxinu zbavené) formy, tzv. liberázy [38]. Izolované PMF je možné dále kultivovat in vitro. V roce 2006 přišel Xu s nápadem využít materiálů a metod tkáňového inženýrství a zavedl metodu kultivace PMF v trojrozměrné uměle vytvořené matrix z hydrogelu alginátu. Alginát je extrakt připravený z buněčné stěny hnědých mořských řas používaný již několik desetiletí v potravinářském průmyslu jako emulgátor. Struktura alginátu vytváří pro PMF prostředí podobající se podmínkám in vivo a udržuje mezibuněčné vazby mezi oocytem a vrstvou granulózových buněk folikulů. V létě 2009 stejný kolektiv vědců z Chicaga publikoval první úspěšnou kultivaci lidských PMF v alginátové matrix. Lidské ovariální folikuly byly izolovány z ovariální tkáně pacientky s nově diagnostikovaným nádorovým onemocněním a kultivovány in vitro po dobu 30 dnů. Folikuly byly po kultivaci steroidogenně aktivní a vyvinuly se až do antrálního stadia. Tyto folikuly obsahovaly haploidní zralý oocyt plně kompetentní k oplození pomocí standardních metod asistované reprodukce [39]. Tato práce ukázala, že je dnes již technicky možné in vitro kultivovat lidské ovariální folikuly získané z ovariální tkáně, a to až do stadia folikulogeneze, které je pro fertilizaci dostatečné. Je pravděpodobně jen otázkou času, kdy takto vzniklý oocyt bude použit k oplození a k možnosti narození zdravého dítěte.
Zajímavá je také myšlenka využití laboratorních zvířat jako inkubačních médií k maturaci lidské ovariální tkáně. Imonodeficientní myši jsou nejčastěji využívány jako recipientní organismy při xeno-transplantaci lidské ovariální tkáně. Nejlepší výsledky byly popsány při transplantaci lidské ovariální tkáně do peritoneální dutiny a renální kapsuly [40]. O kvalitě a reprodukčním potenciálu lidských oocytů získaných po xenotransplantaci existuje ovšem jen velmi málo literárních údajů. Je ovšem jasné, že i v případě klinického úspěchu v podobě vzniku euploidního embrya vyvolává tento způsob uchovávání a maturace lidských zárodečných buněk celou řadu právních a etických otázek.
Prevence ovariálního poškození pomocí analog gonadoliberinu
Za normálních okolností 99 % všech oocytů vytvořených během gametogeneze degeneruje v průběhu fetálního nebo postnatálního vývoje procesem apoptózy [41]. Apoptóza folikulů v ovariu je regulována celou řadou mechanismů, které byly popsány v našich předchozích pracích [1]. Na její regulaci se podílí také hypotalamo-hypofyzární systém a jeho hormonální produkty [42]. Řada studií se zabývala potenciálně protektivním účinkem analog gonadoliberinu (GnRH-a) na ovariální folikuly vystavené nepříznivému vlivu chemoterapie.
Metoda vychází z předpokladu, že ovarium v prepubertálním stavu v důsledku aplikace GnRH analog je méně citlivé k cytotoxickému účinku chemoterapie [43]. Protektivní vliv aplikace GnRH analog byl opakovaně prokázán na animálních modelech [44]. Také četné humánní studie prokázaly prospěch těchto léčiv při ochraně ovariálních funkcí [45, 46, 47]. Jejich výsledky byly ovšem kritizovány z důvodu heterogenity souboru pacientek a nejednotného sledovacího protokolu s využitím různých režimů a délky použité chemoterapie. Novější humánní studie publikované v posledních třech letech byly lépe navrženy a zabývaly se homogennějšími skupinami pacientek. Tyto práce prokázaly příznivý vliv aplikace GnRH analog v průběhu chemoterapie na funkci vaječníků a statisticky signifikantní snížení rizika předčasného ovariálního selhání [48, 49]. Také námi publikovaná prospektivní kohortová studie prokázala protektivní účinek GnRH analog na riziko ovariálního poškození v důsledku chemoterapie u žen léčených pro Hodgkinův lymfom. Při celkovém srovnání bylo ve skupině žen s aplikací GnRH analog během chemoterapie prokázáno statisticky signifikantně méně případů POS než v kontrolním souboru v obou sledovaných obdobích 6 a 12 měsíců po ukončení chemoterapie. Při analýze rizika vzniku POS v závislosti na cytotoxicitě použitého režimu chemoterapie byly výsledky statisticky signifikantně lepší u méně agresivních léčebných protokolů. Studie tedy prokázala malý ochranný vliv aplikace GnRH-a na funkci ovarií při nutnosti použití vysokodávkovaných a kombinovaných chemoterapeutických režimů v pokročilých stadiích onkologického onemocnění [50]. Také nedávno publikovaná metaanalýza dosud publikovaných prací, které se zabývají problematikou ochranného vlivu GnRH analog na riziko ovariálního poškození, potvrzuje účinnost těchto léků zejména u méně agresivních typů chemoterapie [51]. V současné době probíhají dvě prospektivní randomizované studie, které by měly tyto výsledky definitivně potvrdit.
VLASTNÍ ZKUŠENOSTI V OBLASTI ONKOFERTILITY
V období 6 let (2004–2010) jsme na našem pracovišti poskytli odbornou konzultaci před zahájením gonadotoxické léčby 195 pacientkám s nově diagnostikovaným nádorovým či autoimunitním onemocněním. Základní charakteristiku pacientek shrnuje tabulka 1. Průměrný věk pacientek zařazených do souboru byl 29,4 let. Ve všech případech šlo o ženy středoevropské rasy. Průměrný index tělesné hmotnosti (BMI) pacientek ve sledovaném souboru byl 23,8 kg/m2. Ve většině případů sledovaných žen šlo o nulipary či primipary. Průměrná parita v souboru byla 0,7 dítěte v anamnéze. Délka systémové chemoterapie či imunoterapie činila průměrně 5,2 měsíců. Průměrný čas na uskutečnění některé z metod ovariální protekce zbývající do zahájení onkologické léčby nepřesahoval 14 dní.
Tab. 1. Základní charakteristika pacientek před gonadotoxickou léčbou s nově diagnostikovaným nádorovým či autoimunitním onemocněním (Gynekologicko-porodnická klinika LF MU a FN Brno, 2004 – 2010) 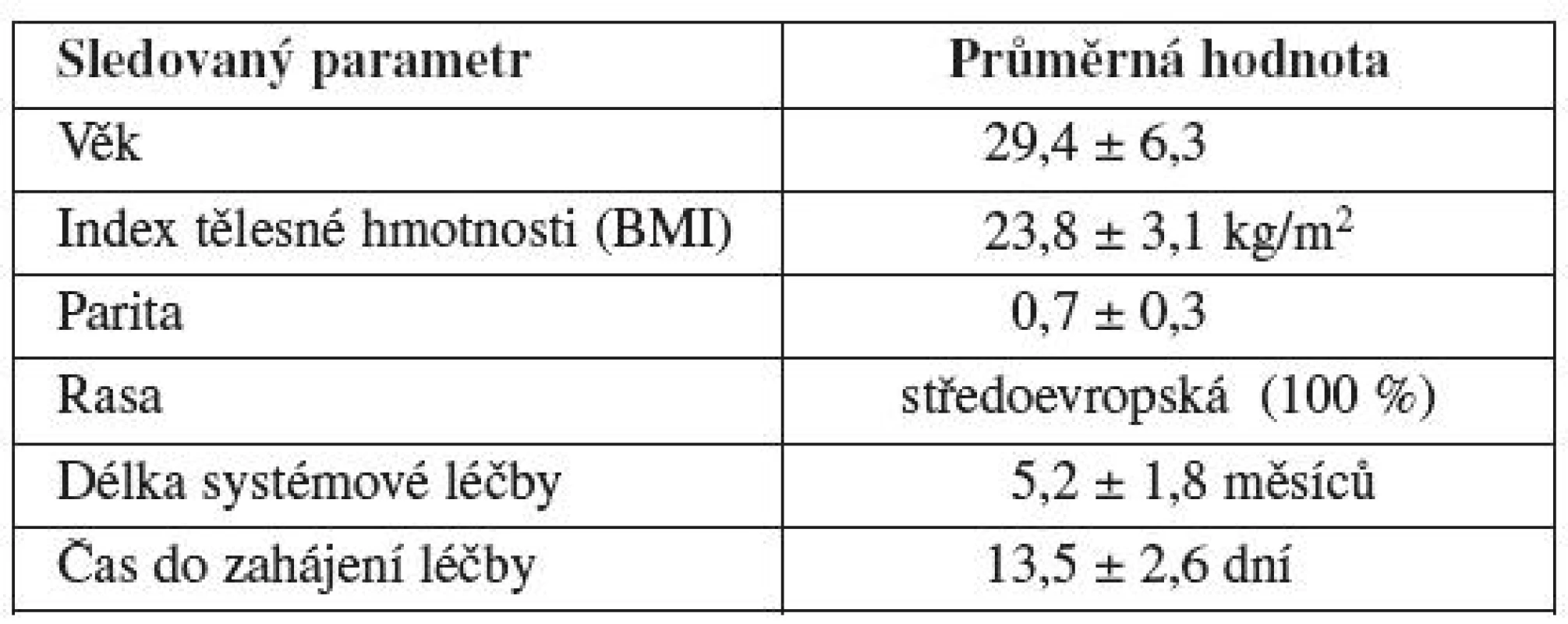
Spektrum onkologických a revmatologických diagnóz referovaných pacientek přehledně vyjadřuje tabulka 2. Největší část léčených pacientek trpěla nově diagnostikovaným zhoubným nádorem mízního systému či krvetvorby. Nejčastěji se vyskytující základní diagnózu v celém souboru představuje Hodgkinův lymfom. Jedná se o maligní onemocnění s dobrou prognózou quod vitam – 5leté přežití se pohybuje mezi 85–98 % [52]. Další významně zastoupené diagnózy v našem souboru byly: systémový lupus erythematodes s orgánovým postižením, zhoubné nádory mamy, gynekologické zhoubné nádory a maligní novotvary hlavy a krku.
Tab. 2. Spektrum diagnóz referovaných pacientek před gonadotoxickou léčbou (Gynekologicko-porodnická klinika LF MU a FN Brno, 2004 –2010) 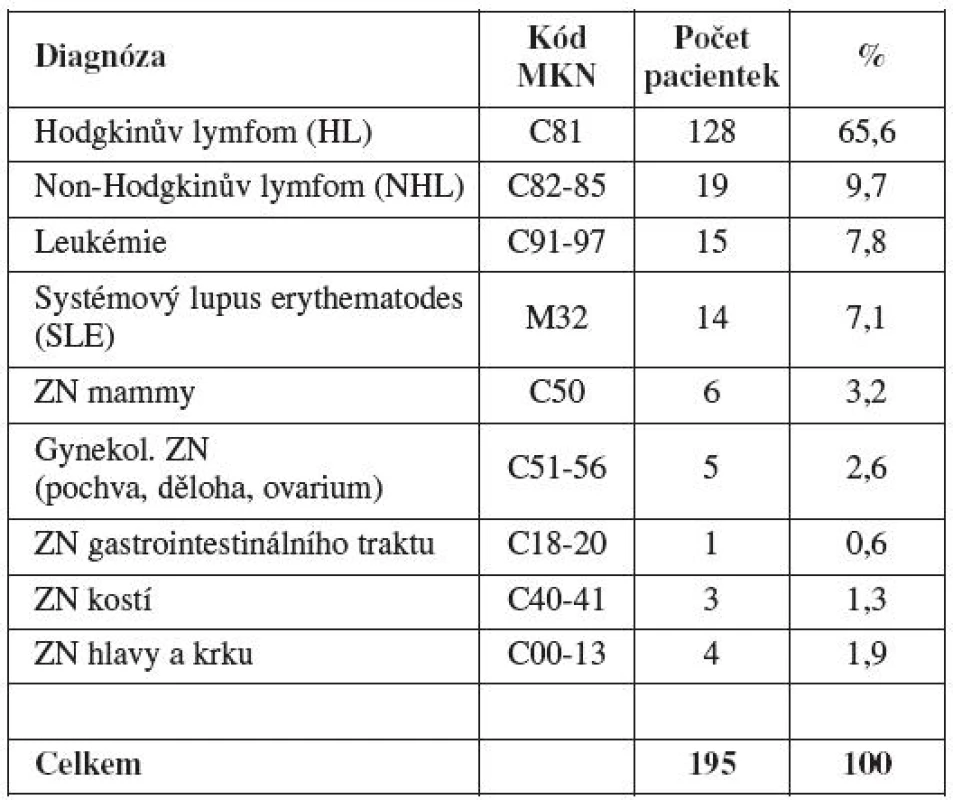
ZN – zhoubné nádory Každé pacientce byla na základě individuálního zhodnocení rizika gonadotoxického poškození navržena některá z výše popsaných metod ovariální protekce: kryokonzervace embryí, kryokonzervace oocytů, kryokonzervace ovariální tkáně či aplikace analog gonadoliberinu v průběhu gonadotoxické léčby. Tabulka 3 shrnuje počet a procentuální zastoupení jednotlivých metod ovariální ochrany, vybraných na základě pohovoru pacientky s lékařem. Nejčastěji využívanou metodou ovariální protekce byla aplikace analog gonadoliberinu v průběhu gonadotoxické léčby (82 %). Druhou nejčastěji preferovanou techniku gonadální ochrany představovala kryokonzervace ovariální tkáně před zahájením chemoterapie (10 %). V některých případech (12 %) byla ženám na základě individuálního posouzení nabídnuta kombinace více metod ovariální protekce. Vždy šlo o některou z embryologických technik (kryokonzervace oocytů, embryí či ovariální tkáně) spolu s aplikací analog gonadoliberinu v průběhu chemoterapie či imunoterapie. V některých případech (4 %) se pacientky rozhodly nevyužít žádnou z nabízených metod této podpůrné onkologické léčby.
Tab. 3. Počet a procentuální zastoupení jednotlivých metod ovariální ochrany (Gynekologicko-porodnická klinika LF MU a FN Brno, 2004 – 2010) 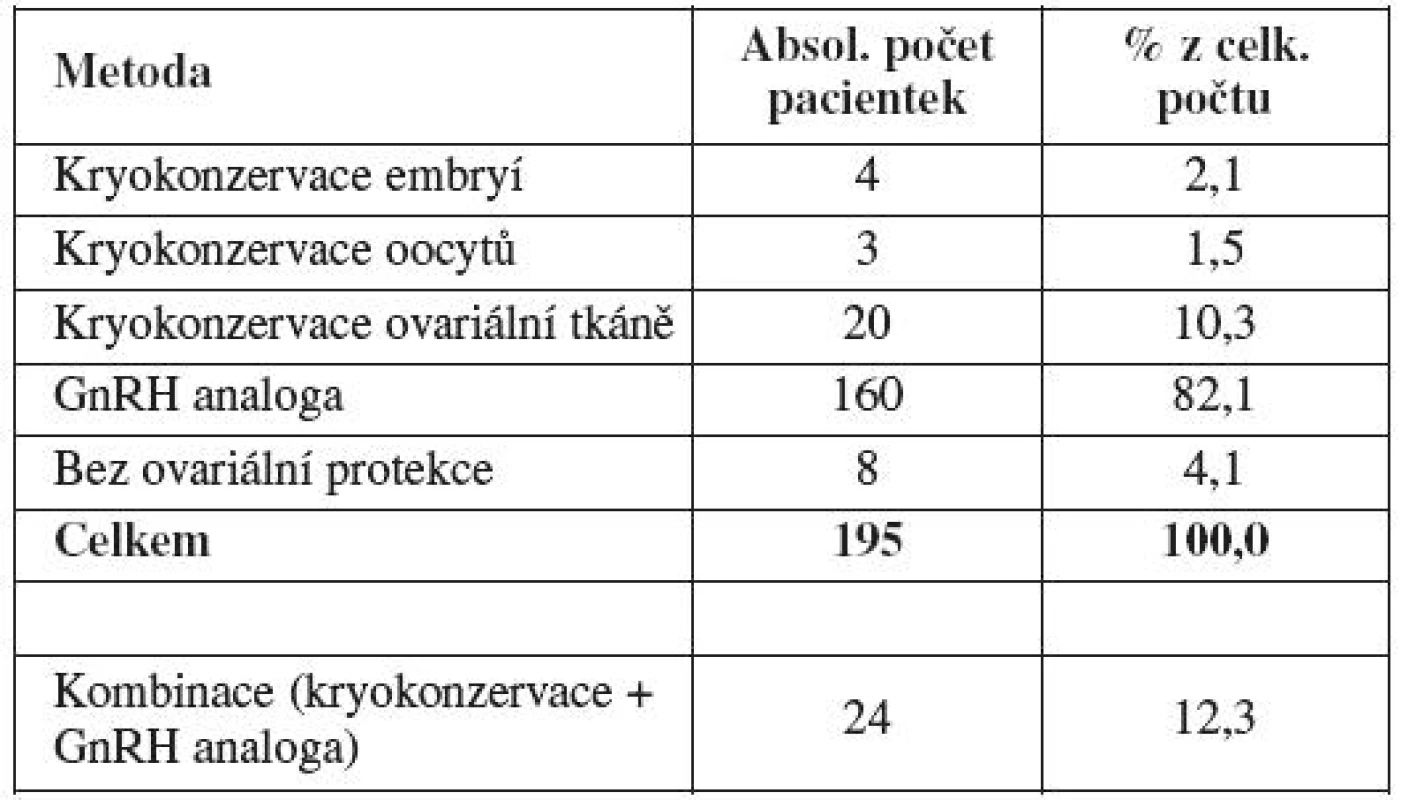
DISKUSE
Každá z výše uvedených metod ochrany reprodukčních funkcí, má své výhody a limity. K výběru vhodné metody reprodukční ochrany je nezbytně nutný vysvětlující pohovor s pacientkou a případně i jejím partnerem časně po stanovení diagnózy maligního onemocnění, ale ještě před zahájením vlastní onkologické léčby. V některých případech je možné současné onkofertilitní techniky kombinovat s cílem zvýšit šance na budoucí fertilitu pacientky. V průběhu indikace optimální strategie ovariální protekce je nutné dobře vyhodnotit zejména následující faktory: onkologická diagnóza a stadium onemocnění, plán onkologické léčby (modalita, typ, dávka, délka), věk pacientky, gynekologická anamnéza (parita, menstruační cyklus), předchozí onkologická léčba, celkový stav pacientky, psychická kondice a možné riziko ovariální infiltrace nádorem.
Technika kryokonzervace embryí je používána v praxi většiny center asistované reprodukce. Jde o technicky dobře propracovanou metodu s rozsáhlými zkušenostmi v klinické praxi a poměrně vysokou úspěšností z hlediska dosažení gravidity. Tento postup se ale poměrně obtížně aplikuje v praxi u pacientek s nově diagnostikovaným onkologickým onemocněním, kde bývá rozhodující zejména časové hledisko a celkový zdravotní stav pacientky. K získání oocytů vhodných k oplození a následnému zamražení je nutná ovariální stimulace gonadotropiny, která může v závislosti na fázi menstruačního cyklu trvat i několik týdnů. Bohužel u většiny nově diagnostikovaných malignit je nanejvýš vhodné zahájit onkologickou léčbu co nejdříve po stanovení diagnózy. Zpravidla nezbývá dostatek času k provedení ovariální stimulace ani s využitím krátkých stimulačních protokolů. Ovariální stimulace funguje na podkladě hormonálních vlivů indukovaných gonadotropiny a navozuje v organismu stimulované ženy hyperestrinní stav. Tento fakt může mít nepříznivý vliv na progresi primárního onkologického onemocnění, zejména v případech hormon-dependentních tumorů, jako je například karcinom prsu. V těchto případech lze použít alternativní „soft“ stimulační protokoly s využitím látek s antiestrogenním účinkem, jako je klomifencitrát či tamoxifen nebo nově inhibitory aromatázy (anastrozol, letrozol) [53]. Technika je dále vhodná pouze pro pacientky se stálým partnerem. V ČR je vždy vyžadován písemný souhlas partnera s použitím jeho spermií k oplození oocytů ženy. Další písemný souhlas partnera je nutný k transferu embrya vzniklého použitím takových spermií zpět do dělohy ženy. Oocyty jsou poté využívány zpravidla až několik let po jejich oplození, kdy již může být partnerská situace ženy naprosto odlišná. Bez písemného souhlasu „majitele spermií“ není možné z právního hlediska embryotransfer realizovat. Pacientka by na toto legislativně-etické úskalí metody měla být upozorněna již při pohovoru o možnostech reprodukční ochrany v době diagnózy onkologického onemocnění.
Pro ženy bez stálého partnera se jako alternativa nabízí technika kryokonzervace oocytů, nicméně rizika a časové prodlení související s ovariální stimulací zde zůstávají. Technika kryokonzervace oocytů či embryí by tedy měla být preferována u pacientek v celkově dobrém zdravotním stavu a v případech, kdy posunutí začátku onkologické léčby o několik týdnů významně nezhorší celkovou prognózu. Naše zkušenosti z praxe ukazují, že ve většině případů mladých pacientek s nově diagnostikovaným maligním onemocněním je potřeba hledat alternativní postupy, jako je například kryokonzervace ovariální tkáně.
Metoda kryokonzervace ovariální tkáně je poměrně rychlá, a tudíž nevyžaduje odsun zahájení onkologické léčby. Také zde není nutná ovariální stimulace gonadotropiny. Relativní nevýhodou této techniky je její invazivita. Odběr ovariální tkáně i její následná auto-transplantace zpravidla vyžaduje celkovou anestezii a krátkodobou hospitalizaci. Odběr ovariální tkáně se provádí většinou laparoskopicky a organismus pacientky významněji nezatěžuje. Celá procedura vyžaduje zpravidla jen jednodenní hospitalizaci a procento komplikací je při rutinním užití této metody velmi nízké. Onkologickou léčbu není většinou nutné odsouvat, celou proceduru se daří realizovat v průběhu nutných stagingových vyšetření. Nicméně zákrok je kontraindikován v případě neuspokojivého zdravotního stavu pacienta, většinou na podkladě základního onkologického onemocnění. Přestože většina nádorů nemetastazuje do ovaria, některé systémové druhy rakoviny, jako například leukémie, mají nezanedbatelné riziko výskytu metastáz také v ovariální tkáni. Ovariální metastázy jsou extrémně vzácné také u lymfomů (s výjimkou Burkittova lymfomu) a většiny sarkomů (například Wilmsům tumor ledviny, osteosarkom či Ewingův sarkom) [54]. Při absenci makroskopických či radiologických známek ovariálních metastáz je riziko poškození vaječníku tímto procesem velmi malé. Nicméně v celé proceduře v současné době zatím existuje řada nezodpovězených otázek. Není dosud stanovena optimální velikost vzorku tkáně určeného ke kryokonzervaci, rozsah resekce ovaria či doba fungování štěpu po transplantaci. Klinické zkušenosti s touto technikou jsou zatím krátké a na světě existují pouze desítky pacientek, u nichž bylo po auto-transplantaci dosaženo gravidity a porodu zdravého dítěte. Bedaivy a spol. podrobněji analyzoval dosud publikovaných 23 případů úspěšné transplantace ovariální tkáně u člověka. Ve všech případech šlo o pacientky s předčasným ovariálním selháním po chemoterapii s bazálním FSH vyšším než 30 IU/l. Průměrný čas nutný k obnově funkce ovariálního štěpu byl 120 dní. Studie hodnotící dobu funkčnosti transplantátu prokázaly jeho funkčnost průměrně 210 dní (přibližně 7 měsíců) [55]. Délka fungování štěpu, podobně jako rychlost obnovení jeho funkce, závisí zejména na míře ischemického inzultu tkáně procesem kryokonzervace, velikosti transplantovaného vzorku a také na věku ženy. Na základě těchto limitovaných pozorování je nutné každého pacienta po úspěšné transplantaci ovariální tkáně upozornit na riziko opakovaného ovariálního selhání a na pravděpodobně omezenou dobu fungování transplantátu. Právě v období fungování transplantátu je nutné v maximálně možné míře využít standardních metod asistované reprodukce k dosažení těhotenství. Pacientka a její partner by si měli být dobře vědomi tohoto faktu a vlastní proces transplantace ovariální tkáně by měl jít ruku v ruce s plánováním následné léčby metodami IVF.
Redukce cytotoxického efektu chemoterapie na ovariální tkáň pomocí podpůrné léčby analogy gonadoliberinu byla předmětem celé řady studií. Protektivní efekt léčby GnRH-a byl opakovaně prokázán řadou autorů [45, 46, 47]. U vysoce agresivních chemoterapeutických režimů s nutností použití alkylačních cytostatik nebo v případech myeloablační chemoterapie před transplantací kostní dřeně, tyto léky nicméně nedokáží zabránit masivní destrukci primordiálních folikulů [48, 49, 50]. Citované práce zkoumaly účinnost GnRH-a pouze v kohortových studiích, kde nelze vyloučit ovlivnění výsledků třetími tzv. confounding faktory. Prospektivní randomizované studie by mohly definitivně vyřešit klinickou nejistotu v užití těchto léků k ochraně vaječníku před destruktivními účinky chemoterapie. Praktické provedení těchto studií může být z etického hlediska kontroverzní a vyžaduje schválení etickou komisí, zejména pokud dosud provedené studie prokázaly pozitivní účinek těchto léčiv. Na základě těchto poznatků se snažíme tuto metodu reprodukční ochrany nabízet pacientkám s onkologickým onemocněním v časném klinickém stadiu, kde se předpokládá celkově nižší kumulativní dávka cytostatik. V případech hematologických malignit, u nichž je indikována transplantace kostní dřeně s myeloablativní chemoterapií v kombinaci s celotělovým ozářením, je vhodné nabídnout pacientce také embryologické metody ovariální protekce. Pacientku je nutné upozornit, že samotná farmakologická ochrana gonád GnRH analogy není v těchto případech účinná [56].
ZÁVĚR
Onkofertilita jako nová medicínská disciplína přibližuje svět základního vědeckého výzkumu běžné klinické praxi. Prohlubuje mezioborovou spolupráci mezi specialisty v oboru reprodukční medicíny, embryology, onkology či sociology. Nový obor nabízí moderní, ale zároveň reálnou možnost podpůrné léčby mladým lidem, kteří musí bojovat s rakovinou.
Sledování úspěšnosti výše popsaných postupů reprodukční ochrany často vyžaduje dlouhodobou dispenzarizaci pacientů a monitoring reprodukčních funkcí po ukončení onkologické léčby. V praxi je toto sledování často složité s ohledem na nutnost úzké spolupráce s pacienty, potřebu mimoregionálních konzultací či dostupnost příslušného specialisty. Je také nutno vzít v úvahu celkový zdravotní stav pacienta po onkologické léčbě a riziko rekurence onkologického onemocnění či úmrtí v průběhu dispenzarizace. Proto také relevantní a validní data o úspěšnosti těchto technik z hlediska dosažení gravidity zatím nejsou k dispozici. K získání těchto cenných údajů by mohla významně napomoci digitalizace a globální on-line dostupnost zdravotnických dat (electronic health record, medical data warehousing, elektronická zdravotní knížka apod.) [57].
V praxi zatím neexistuje nejefektivnější a dostatečně univerzální metoda reprodukční ochrany. Situace každého onkologického pacienta je jiná, jeho posuzování musí být individuální. Poskytování těchto specializovaných poradenských služeb je tedy vhodné směrovat do center, kde je možné pacientovi nabídnout celé portfolio metod reprodukční ochrany. Pacienti s nově diagnostikovaným onkologickým onemocněním a mnohdy ani jejich lékaři nejsou často dostatečně informováni o možnostech reprodukční ochrany. Dlouhodobá edukace odborné i laické veřejnosti v této problematice je jistě správná. Zatím není možné nabídnout tuto podpůrnou léčbu všem onkologickým pacientům reprodukčního věku, nicméně naše centrum reprodukční ochrany má v této oblasti nejdelší klinické zkušenosti v ČR a nabízí pacientům osobní konzultaci většinou do 48 hodin od prvního telefonického kontaktu.
MUDr. Martin Huser, Ph.D.
Gynekologicko-porodnická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: martin.huser@gmail.com
Web : www.ivfbrno.cz/cor
Zdroje
1. Huser, M., Crha, I., Zakova, J., Ventruba, P. Proces reprodukčního stárnutí ženy – příčiny, stanovení a možnosti užití v praxi. Čes Gynek, 2010, 75, s. 353-358.
2. Němec, P., Huser, M., Souček, M. Možnosti ochrany reprodukčních funkcí u žen podstupujících léčbu cytotoxickými léky. Vnitřní Lék, 2008, 54, s. 191-196.
3. Crha, I., Ventruba, P., Zakova, J., et al. Survival and infertility treatment in male cancer patients after sperm banking. Fertil Steril, 2009, 91, p. 2344-2348.
4. Woodruff, TK., Snyder, KA. Oncofertility – fertility preservation for cancer survivors. Springer, 2007, p. 1-255.
5. Tournaye, H., Clasen, K., Aytoz, A., et al. Fine needle aspiration versus open biopsy for testicular sperm recovery: a controlled study in azoospermic patients with normal spermatogenesis. Hum Reprod, 1998, 13, p. 901-904.
6. Subak, LL., Adamson, GD., Boltz, NL. Therapeutic donor insemination: a prospective randomized trial of fresh versus frozen sperm. Am J Obstet Gyn, 1992, 166, p. 1597-1604; discussion p. 1604-1596.
7. Anger, JT., Gilbert, BR., Goldstein, M. Cryopreservation of sperm: indications, methods and results. J Urol, 2003, 170, p. 1079-1084.
8. Crha, I., Dostal, J., Ventruba, P., et al. [Posthumous sperm procurement and use - ethical and legal dilemmas]. Ces Gynek, 2004, 69, p. 335-339.
9. Dostal, J., Utrata, R., Loyka, S., et al. Post-mortem sperm retrieval in new European Union countries: case report. Hum Reprod, 2005, 20, p. 2359-2361.
10. Rivkees, SA., Crawford, JD. The relationship of gonadal activity and chemotherapy-induced gonadal damage. Jama, 1988, 259, p. 2123-2125.
11. Ward, JA., Robinson, J., Furr, BJ., et al. Protection of spermatogenesis in rats from the cytotoxic procarbazine by the depot formulation of Zoladex, a gonadotropin-releasing hormone agonist. Cancer Res, 1990, 50, p. 568-574.
12. Meistrich, ML., Wilson, G., Huhtaniemi, I. Hormonal treatment after cytotoxic therapy stimulates recovery of spermatogenesis. Cancer Res, 1999, 59, p. 3557-3560.
13. Thomson, AB., Anderson, RA., Irvine, DS., et al. Investigation of suppression of the hypothalamic-pituitary-gonadal axis to restore spermatogenesis in azoospermic men treated for childhood cancer. Human Reprod, 2002, 17, p. 1715-1723.
14. Greenlee, RT., Murray, T., Bolden, S., Wingo, PA. Cancer statistics, 2000. CA: a cancer journal for clinicians 2000, 50, p. 7-33.
15. Trounson, A., Mohr, L. Human pregnancy following cryopreservation, thawing and transfer of an eight-cell embryo. Nature, 1983, 305, p. 707-709.
16. Ventruba, P., Zakova, J., Adler, J., et al. [Prolonged culture of human embryos: comparison of coculture on human tubal epithelium and culture in synthetic media]. Ces Gynek, 1996, 61, p. 351-357.
17. Ventruba, P., Mardesic, T., Pilka, L., et al. [The National Register for Assisted Reproduction: results and analysis of complications]. Ces Gynek, 1998, 63, p. 107-110.
18. Rezazadeh Valojerdi, M., Eftekhari-Yazdi, P., Karimian, L., et al. Vitrification versus slow freezing gives excellent survival, post warming embryo morphology and pregnancy outcomes for human cleaved embryos. J Assisted Reprod Genetics, 2009, 26, p. 347-354.
19. Katayama, KP., Stehlik, J., Kuwayama, M., et al. High survival rate of vitrified human oocytes results in clinical pregnancy. Fertil Steril, 2003, 80, p. 223-224.
20. Cobo, A., Bellver, J., Domingo, J., et al. New options in assisted reproduction technology: the Cryotop method of oocyte vitrification. Reprod Biomed online, 2008, 17, p. 68-72.
21. Cobo, A., Kuwayama, M., Perez, S., et al. Comparison of concomitant outcome achieved with fresh and cryopreserved donor oocytes vitrified by the Cryotop method. Fertil Steril, 2008, 89, p. 1657-1664.
22. Chian, RC., Huang, JY., Tan, SL., et al. Obstetric and perinatal outcome in 200 infants conceived from vitrified oocytes. Reprod Biomed online, 2008, 16, p. 608-610.
23. Ciotti, PM., Porcu, E., Notarangelo, L., et al. Meiotic spindle recovery is faster in vitrification of human oocytes compared to slow freezing. Fertil Steril, 2009, 91, p. 2399-2407.
24. Donnez, J., Dolmans, MM., Demylle, D., et al. Livebirth after orthotopic transplantation of cryopreserved ovarian tissue. Lancet, 2004, 364, p. 1405-1410.
25. Meirow, D., Levron, J., Eldar-Geva, T., et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med, 2005, 353, p. 318-321.
26. Demeestere, I., Simon, P., Buxant, F., et al. Ovarian function and spontaneous pregnancy after combined heterotopic and orthotopic cryopreserved ovarian tissue transplantation in a patient previously treated with bone marrow transplantation: case report. Human Reprod, 2006, 21, p. 2010-2014.
27. Hovatta, O. Methods for cryopreservation of human ovarian tissue. Reprod Biomed online, 2005, 10, p. 729-734.
28. Newton, H., Aubard, Y., Rutherford, A., et al. Low temperature storage and grafting of human ovarian tissue. Human Reprod, 1996, 11, p. 1487-1491.
29. Demeestere, I., Simon, P., Emiliani, S., et al. Fertility preservation: successful transplantation of cryopreserved ovarian tissue in a young patient previously treated for Hodgkin’s disease. Oncologist, 2007, 12, p. 1437-1442.
30. Silber, SJ., DeRosa, M., Pineda, J., et al. A series of monozygotic twins discordant for ovarian failure: ovary transplantation and cryopreservation. Human Reprod, 2008, 23, p. 1531-1537.
31. Anderson, RA., Weddell, A., Spoudeas, HA., et al. Do doctors discuss fertility issues before they treat young patients with cancer? Human Reprod, 2008, 23, p. 2246-2251.
32. Donnez, J., Squifflet, J., Van Eyck, AS., et al. Restoration of ovarian function in orthotopically transplanted cryopreserved ovarian tissue: a pilot experience. Reprod Biomed online, 2008, 16, p. 694-704.
33. Wang, X., Chen, H., Yin, H., et al. Fertility after intact ovary transplantation. Nature, 2002, 415, p. 385.
34. Yin, H., Wang, X., Kim, SS., et al. Transplantation of intact rat gonads using vascular anastomosis: effects of cryopreservation, ischaemia and genotype. Human Reprod, 2003, 18, p. 1165-1172.
35. Imhof, M., Bergmeister, H., Lipovac, M., et al. Orthotopic microvascular reanastomosis of whole cryopreserved ovine ovaries resulting in pregnancy and live birth. Fertil Steril, 2006, 85, Suppl 1, p. 1208-1215.
36. Arav, A., Revel, A., Nathan, Y., et al. Oocyte recovery, embryo development and ovarian function after cryopreservation and transplantation of whole sheep ovary. Human Reprod, 2005, 20, p. 3554-3559.
37. Martinez-Madrid, B., Dolmans, MM., Van Langendonckt, A., et al. Freeze-thawing intact human ovary with its vascular pedicle with a passive cooling device. Fertil Steril, 2004, 82, p. 1390-1394.
38. Dolmans, MM., Michaux, N., Camboni, A., et al. Evaluation of Liberase, a purified enzyme blend, for the isolation of human primordial and primary ovarian follicles. Human Reprod, 2006, 21, p. 413-420.
39. Xu, M., Barrett, SL., West-Farrell, E., et al. In vitro grown human ovarian follicles from cancer patients support oocyte growth. Human Reprod, 2009.
40. Kim, SS., Kang, HG., Kim, NH., et al. Assessment of the integrity of human oocytes retrieved from cryopreserved ovarian tissue after xenotransplantation. Human Reprod, 2005, 20, p. 2502-2508.
41. Morita, Y., Tilly, JL. Oocyte apoptosis: like sand through an hourglass. Developmental Biol, 1999, 213, p. 1-17.
42. Danforth, DR., Arbogast, LK., Ghosh, S., et al. Vascular endothelial growth factor stimulates preantral follicle growth in the rat ovary. Biol Reprod, 2003, 68, p. 1736-1741.
43. Blumenfeld, Z., Eckman, A. Preservation of fertility and ovarian function and minimization of chemotherapy-induced gonadotoxicity in young women by GnRH-a. J Natl Cancer Inst Monogr, 2005, p. 40-43.
44. Ataya, K., Rao, LV., Lawrence, E., Kimmel, R. Luteinizing hormone-releasing hormone agonist inhibits cyclophosphamide-induced ovarian follicular depletion in rhesus monkeys. Biol Reprod, 1995, 52, p. 365-372.
45. Blumenfeld, Z., Avivi, I., Linn, S., et al. Prevention of irreversible chemotherapy-induced ovarian damage in young women with lymphoma by a gonadotrophin-releasing hormone agonist in parallel to chemotherapy. Human Reprod, 1996, 11, p. 1620-1626.
46. Dann, EJ., Epelbaum, R., Avivi, I., et al. Fertility and ovarian function are preserved in women treated with an intensified regimen of cyclophosphamide, adriamycin, vincristine and prednisone (Mega-CHOP) for non-Hodgkin lymphoma. Human Reprod, 2005, 20, p. 2247-2249.
47. Recchia, F., Saggio, G., Amiconi, G., et al. Gonadotropin-releasing hormone analogues added to adjuvant chemotherapy protect ovarian function and improve clinical outcomes in young women with early breast carcinoma. Cancer, 2006, 106, p. 514‑523.
48. Badawy, A., Elnashar, A., El-Ashry, M., Shahat, M. Gonadotropin-releasing hormone agonists for prevention of chemotherapy-induced ovarian damage: prospective randomized study. Fertil Steril 2009, 91, p. 694-697.
49. Blumenfeld, Z., Avivi, I., Eckman, A., et al. Gonadotropin-releasing hormone agonist decreases chemotherapy-induced gonadotoxicity and premature ovarian failure in young female patients with Hodgkin lymphoma. Fertil Steril, 2008, 89, p. 166‑173.
50. Huser, M., Crha, I., Ventruba, P., et al. Prevention of ovarian function damage by a GnRH analogue during chemotherapy in Hodgkin lymphoma patients. Human Reprod, 2008, 23, p. 863‑868.
51. Blumenfeld, Z., von Wolff, M. GnRH-analogues and oral contraceptives for fertility preservation in women during chemotherapy. Human Reprod update, 2008, 14, p. 543-552.
52. Ferme, C., Eghbali, H., Meerwaldt, JH., et al. Chemotherapy plus involved-field radiation in early-stage Hodgkin’s disease. N Engl J Med, 2007, 357, p. 1916-1927.
53. Requena, A., Herrero, J., Landeras, J., et al. Use of letrozole in assisted reproduction: a systematic review and meta-analysis. Human Reprod update, 2008, 14, p. 571-582.
54. Oktay, K. Ovarian tissue cryopreservation and transplantation: preliminary findings and implications for cancer patients. Human Reprod update, 2001, 7, p. 526-534.
55. Bedaiwy, MA., El-Nashar, SA., El Saman, AM., et al. Reproductive outcome after transplantation of ovarian tissue: a systematic review. Human Reprod, 2008, 23, p. 2709-2717.
56. Huser, M., Crha, I., Hudecek, R., et al. Ovarian tissue cryopreservation. Eur J Gyn Oncol, 2007, 28, p. 249-255.
57. Huser, V., Narus, SP., Rocha, RA. Evaluation of a flowchart-based EHR query system: a case study of RetroGuide. J Biomed Informatics, 2010, 43, p. 41-50.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek EditorialČlánek Možnosti a výsledky preimplantační genetické diagnostiky (PGD) u párů s chromozomální translokacíČlánek Prokázané klinické účinky rekombinantních gonadotropinů v porovnání s urinárními v indukci ovulaceČlánek Děložní myomy a jejich léčbaČlánek Screening kolorektálního karcinomu v ordinaci praktického gynekologa – který test je ten pravý?
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2011 Číslo 2- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Možnosti a výsledky preimplantační genetické diagnostiky (PGD) u párů s chromozomální translokací
- Luteální podpora v programu IVF/ET
- Prokázané klinické účinky rekombinantních gonadotropinů v porovnání s urinárními v indukci ovulace
- Srovnání lidského choriového gonadotropinu (Pregnyl 10 000 IU i.m.) s GnRH agonistou (triptorelin 0,2 mg s.c.) pro maturaci oocytů u stejných dárkyň vajíček – klinické a embryologické charakteristiky
- Prodloužená kultivace embryí při IVF nezvyšuje naději na otěhotnění
- Do jaké míry je rozvoj ovariálního hyperstimulačního syndromu v přímé souvislosti se syndromem polycystických ovarií u IVF pacientek podstupujících řízenou hyperstimulaci ovarií?
- Využití a význam 3D ultrasonografického vyšetření v asistované reprodukci
- Vybrané markery v skorej predikcii preeklampsie
- Význam konzultace při výběru kombinované hormonální antikoncepce – výsledky projektu CHOICE (Contraception Health Research Of Informed Choice Experience) v České a Slovenské republice
- Prevalence žen s hyperaktivním močovým měchýřem v České republice
- Děložní myomy a jejich léčba
- Screening kolorektálního karcinomu v ordinaci praktického gynekologa – který test je ten pravý?
- Spontánna ruptúra uterinných ciev počas gravidity u pacientky s predchádzajúcou endometriózou
- Zemřel prof. MUDr. Otakar Nyklíček, DrSc. FIAC (em.)
- Reprodukční imunologie ve světě
- XXXIX. globální kongres minimálně invazivní gynekologie Las Vegas, USA
- CELOSTÁTNÍ KONFERENCE Sdružení soukromých gynekologů ČR a České gynekologické a porodnické společnosti ČLS JEP
- Editorial
- Snížená plodnost a současné možnosti vyšetřování v reprodukční imunologii
- Onkofertilita – nový směr reprodukční medicíny
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Prodloužená kultivace embryí při IVF nezvyšuje naději na otěhotnění
- Děložní myomy a jejich léčba
- Luteální podpora v programu IVF/ET
- Snížená plodnost a současné možnosti vyšetřování v reprodukční imunologii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



