Děložní mikrobiom jako faktor receptivity endometria
Uterine microbiome and endometrial receptivity
Objective: Structure and correct function of endometrium is necessary for embryo implantation, pregnancy development and childbirth. It is a result of many factors – anatomical and histological structure, hormonal effects and signalling pathways at the molecular genetic level. A little known phenomenon is the presence of microorganisms on the endometrium. Traditionally, the uterine cavity was considered sterile, but new findings have been changing this view fundamentally. The aim of this work is to present new findings on endometrial microbiome and its importance for embryo implantation and development.
Design: Review article.
Setting: Department of Obstetrics and Gynecology, Faculty of Medicine, Masaryk University and University Hospital Brno; Department of Obstetrics and Gynecology, University Hospital Faculty of Medicine, Palacky University Olomouc.
Methods: PubMed was searched for articles in English indexed until 30th June 2018 with terms of „uterine microbiome analysis“ and „endometrial receptivity“.
Results: The vital information on bacterial colonization of endometrium brought new diagnostic methods for their detection based on ribosomal RNA analysis in 16S subunit, which are capable of detection and exact identification of bacteria that cannot be detected by classical cultivation methods. The endometrial microbiome is assumed to modulate the function of endometrial cells and local immunity system, it prevents growth of pathogenic microorganisms by its presence and production of protective substances.
Conclusion: Endometrial microbiome seems to be important factor of endometrial receptivity.
Keywords:
endometrium – uterine microbiome – embryo implantation – endometrial receptivity
Autoři:
I. Crha 1,2
; P. Ventruba 1; J. Žáková 1; M. Ješeta 1; R. Pilka 3; E. Lousová 1; Z. Papíková 1
Působiště autorů:
Gynekologicko-porodnická klinika LF MU a FN, Brno, přednosta prof. MUDr. P. Ventruba, DrSc., MBA
1; Katedra porodní asistence a zdravotnických záchranářů LF MU, Brno, přednosta doc. MUDr. I. Crha, CSc.
2; Porodnicko-gynekologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D.
3
Vyšlo v časopise:
Ceska Gynekol 2019; 84(1): 49-54
Kategorie:
Přehledový článek
Souhrn
Cíl studie: Stavba a správná funkce endometria je nezbytná pro implantaci embrya, vývoj těhotenství a porod. Je výsledkem působení mnoha činitelů – anatomické a histologické stavby, hormonálních vlivů, signálních drah na molekulárně genetické úrovni. Málo známým faktorem je přítomnost mikroorganismů na povrchu endometria. Tradičně byla děložní dutina považována na sterilní prostředí, nové poznatky tento pohled zásadně mění. Cílem práce je prezentovat současné poznatky o mikrobiomu endometria a jeho významu pro implantaci a vývoj embrya.
Typ studie: Přehledová práce.
Název a sídlo pracoviště: Gynekologicko-porodnická klinika Lékařské fakulty Masarykovy univerzity a FN Brno; Porodnicko-gynekologická klinika FN a LF UP Olomouc.
Metodika: Literární rešerše databáze PubMed publikované do června 2018 s termíny zaměřenými na „uterine microbiome analysis“ a „endometrial receptivity“.
Výsledky: Zásadní informace o kolonizaci endometria bakteriemi přinesly nové diagnostické metody jejich průkazu pomocí analýzy ribozomální RNA v podjednotce 16S, které jsou schopny prokázat přítomnost a přesně identifikovat bakterie klasickými kultivačními metodami neprokazatelné. Předpokládá se, že mikrobiom endometria moduluje funkci endometriálních buněk a lokálního imunitního systému, svou přítomností a produkcí obranných látek brání rozvoji patogenních mikroorganismů.
Závěr: Mikrobiom endometria a jeho aktivita je zatím málo známým faktorem receptivity endometria.
Klíčová slova:
endometrium – děložní mikrobiom – implantace embrya – receptivita endometria
ÚVOD
Mikrobiální kolonizace se významně podílí na fyziologické funkci mnoha orgánů, její změny mohou být provázeny závažnými patologiemi. V současné době existuje velké množství poznatků a důkazů, které mění dlouholetou představu o sterilním prostředí děložní dutiny. Byla prokázána mikrobiální kolonizace endometria a její metabolická aktivita, která se podílí na produkci látek důležitých pro vývoj těhotenství a detoxikaci xenobiotik [12, 16]. Recentní studie sledovaly souvislost mezi přítomností bakterií v děloze, reprodukčními obtížemi a komplikacemi těhotenství [6, 7]. Přítomnost bakterií působí na imunitní systém endometria, který je důležitým faktorem správné funkce děložní sliznice [10, 23]. Bakterie mohou také ovlivnit morfologii endometriálních buněk a chránit před průnikem a množením patogenních druhů. Mikrobiom endometria se tak významně podílí na receptivitě endometria před implantací embrya, na decidualizaci a správném vývoji placenty [5, 18].
Studií hodnotících vliv mikrobiomu endometria na fertilitu zatím není mnoho, užitečné informace o mikrobiální kolonizaci sliznic, a jejich funkci proto přináší znalosti z jiných anatomických oblastí – především gastrointestinálního traktu. Střevní bakterie se mohou podílet na závažných idiopatických zánětech střev (inflammatory bowel disease – IBD), především Crohnovy choroby a ulcerózní kolitidy [9].
Cílem této práce je prezentovat současné poznatky o mikrobiomu endometria, jeho fyziologické funkci, ochraně proti patogenním bakteriím a možném vlivu na implantaci embrya a vývoj těhotenství.
ENDOMETRIUM A PŘÍTOMNOST MIKROBŮ
V obecné rovině je mezi mikroby a lidským organismem symbióza. Pro mikroby je důležitý stálý přísun živin, hostitel využívá přínosu mikrobů pro řadu fyziologických procesů – homeostázu epiteliálních buněk, funkci sliznic a přirozenou bariéru proti kolonizaci patogenními bakteriemi. Bakteriální kolonizace má také významný podíl na modulaci imunity hostitele. Metagenomické analýzy otevřely rozsáhlý výzkum přirozené kolonizace lidského organismu a prokázaly přítomnost mikrobů v oblastech původně považovaných za zcela sterilní. Původní „dogma sterilní dělohy“, které zavedl před více než sto lety Henry Tissier, tak bylo novými důkazy překonáno. Významnými limity výzkumu v této oblasti bylo získání vzorků a technologie průkazu a identifikace všech přítomných mikroorganismů. Přítomnost mikrobů tak byla často přehlédnuta. V současné době narůstá počet studií, které přinášejí důležité informace o mikrobiomu endometria [6, 7, 13] a komenzální kolonizaci placenty [19].
ENDOMETRIUM JAKO NIKA MIKROBIOMU
Podmínkou bezpečné symbiózy mezi hostitelem a bakteriemi je vymezení prostoru pro jejich růst – niky – a dodržení vymezené hranice. Invaze do tkání hostitele musí být omezena, aby nedošlo k zánětlivé reakci [16]. Byly popsány tři typy imunologické bariéry potřebné pro tuto homeostázu – anatomická vrstva bránící průniku bakterií do imunitního systému, obranné mediátory omezující přímý kontakt mezi bakteriemi a epiteliemi a rychlá likvidace bakterií, které bariérou proniknou. Endometrium všechny tyto požadavky splňuje [27]. Buňky jednovrstevného cylindrického epitelu jsou pevně spojeny v anatomickou bariéru. Děložní sliznice a endometriální tekutina (EF – endometrial fluid) obsahují molekuly antimikrobiálních peptidů (AMP – antimicrobial peptides). Jejich hladiny v průběhu menstruačního cyklu kolísají. Jedním z AMP je leukocytární sekreční inhibitor proteáz, který má baktericidní účinky na gramnegativní bakterie (Escherichia coli) a grampozitivní bakterie jako (Staphylococcus aureus).
V endometriu ve všech fázích menstruačního cyklu jsou přítomny lymfocyty, které jsou schopny rychle reagovat na invazi mikroorganismů. Na endometriu je tak prostor pro bezpečnou niku symbiotických bakterií podobně jako na sliznici střev.
PRŮKAZ KOMENZÁLNÍCH BAKTERIÍ ENDOMETRIA
Historickým standardem průkazu bakterií jsou kultivační metody, které jsou využívány především při diagnostice zánětu vnitřních rodidel. Byly prezentovány studie kultivace bakterií z transferových souprav v souvislosti s dosažením těhotenství a porodem, které však přinášely protichůdné výsledky [15, 20]. Těhotenství bylo možné i při pozitivní kultivaci stěru endometria. Pro přesnou kvalitativní a kvantitativní charakteristiku všech druhů bakterií v mikrobiomu jsou však kultivační metody nedostatečné. Dominují rychle rostoucí aerobní druhy, bakterie pomalu rostoucí, které vyžadují specifické podmínky, nejsou detekovány. Nové poznatky přinesly molekulárně genetické metody diagnostiky různých druhů bakterií. Mitchell et al. [14] vyšetřovali vzorky endometriální tekutiny kvantitativní PCR na přítomnost 12 bakteriálních druhů a prokázali rozdíly v jejich zastoupení v poševním prostředí a endometriu. Přítomnost bakterií byla prokázána u 95 % vyšetřovaných vzorků. V pochvě bylo častěji prokázáno Atopobium vaginae, v endometriální tekutině Lactobacillus iners. Další studie využily metody FISH (fluorescent in-situ hybridization) nebo sekvencování hypervariabilního 16S úseku ribozomální RNA charakteristického pro jednotlivé druhy bakterií [8].
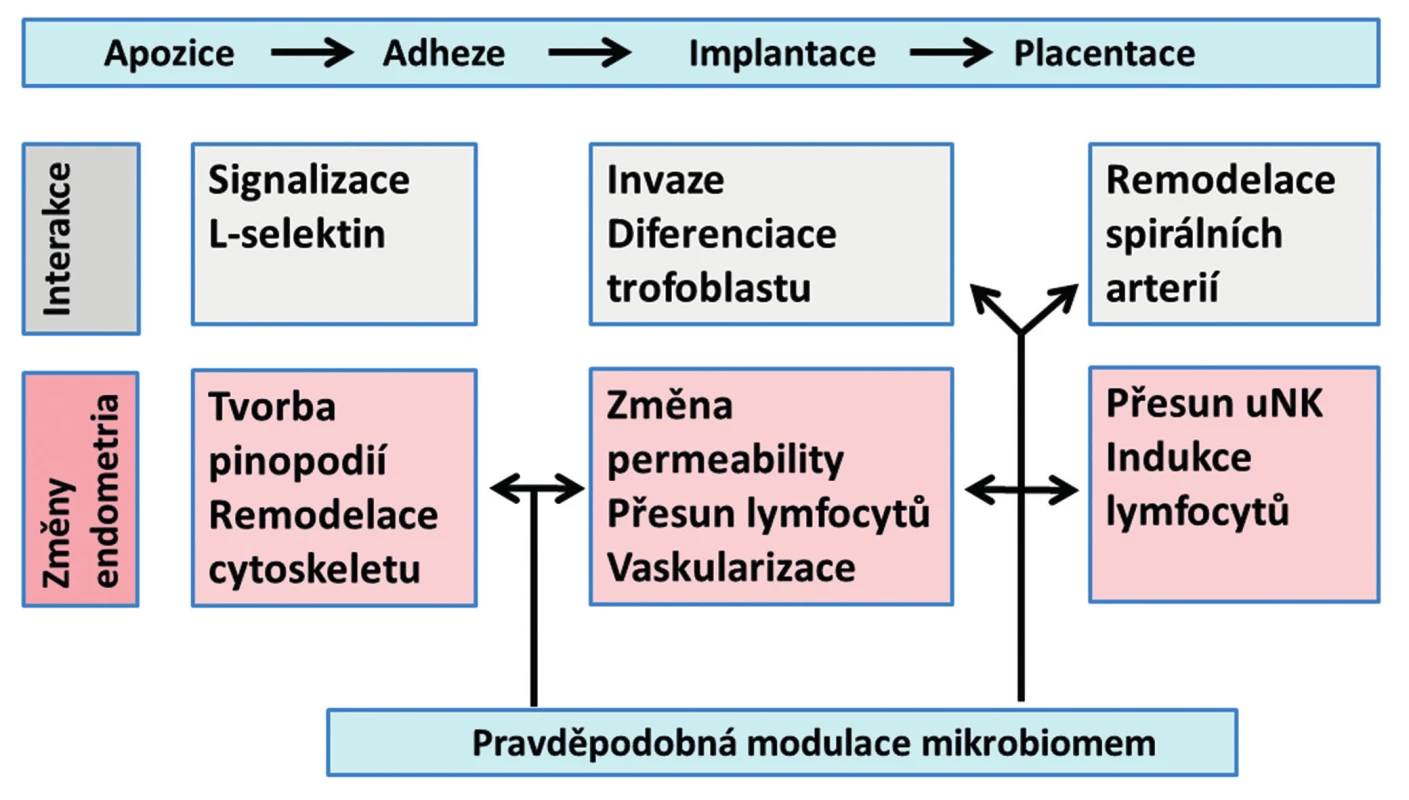
ENDOMETRIUM – ZÁKLADNÍ FAKTOR DECIDUALIZACE, IMPLANTACE A PLACENTACE
Na decidualizaci a transformaci endometria do receptivního stavu – implantačního okna (windows of implantation) se podílí nejen cyklické změny ovariálních steroidů, ale také buňky a působky imunitního systému. Dochází k rozsáhlým změnám fibroblastů stromatu endometria i epiteliálních buněk, mění se cytoskelet buněk a modifikuje se stavba plazmatické membrány. Byly prokázány změny adhezních molekul – integrinů a ligandy L-selektinu (ligandy L-selektinu jsou přítomny na epitelu endometria, receptory L-selektinu jsou na trofoblastu blastocysty). Důležité informace přináší analýza proteomu nitroděložního sekretu [5]. Již v tomto stadiu mohou vznikat poruchy, které vedou k abnormní vaskularizaci placenty a následným komplikacím těhotenství, preeklampsii a restrikci růstu plodu. Endometrium tak má klíčovou roli pro fyziologickou placentaci a fyziologický průběh těhotenství. Mikrobiom a jeho produkty se tak mohou podílet na implantaci a placentaci embrya [4].
VLIV MIKROBIOMU NA IMUNITNÍ SYSTÉM ENDOMETRIA
Imunitní systém endometria je zapojen do změn endometria nutných pro jeho fyziologickou funkci v procesu reprodukce [23]. Buňky imunitního systému jsou prokázaným faktorem migrace trofoblastu a správné remodelace spirálních arterií. V centru pozornosti jsou NK (natural killer) buňky, T-lymfocyty a antigen prezentující buňky (APC – antigen presenting cells). Velmi důležité interakce mezi intestinálním mikrobiomem a imunitním systémem střevní sliznice byly spolehlivě prokázány [17] a lze z nich odvodit možné analogické vztahy pro endometrium a jeho mikrobiom.
BUNĚČNÁ IMUNITA
NK buňky tvoří většinu z buněk imunitního systému přítomných v endometriu – přibližně 70 %. Fenotypicky a funkčně se navzájem liší eNK buňky endometria před decidualizací, dNK buňky deciduálně transformovaného endometria, pNK buňky placenty a pbNK buňky periferní krve (peripheral blood) [23]. V endometriu dominují eNK buňky, které neprodukují cytolytické cytokiny, jen velmi malá frakce představuje NK buňky ničící infikované buňky. dNK buňky produkují velké množství cytokinů – např. interleukin 10 (IL-10), tumor necrosis factor alfa (TNF-α), které se mohou podílet na iniciální implantaci a tvorbě placenty. eNK a dNK se podobně jako NK buňky střeva kontinuálně exponované střevnímu mikrobiomu liší od buněk pbNK v tom, že neprodukují cytotoxický perforin a další cytotoxické substance [1].
APC (antigen-presenting cell) buňky, především makrofágy a dendritické buňky (DC – dendritic cell) tvoří přibližně 10–20 % leukocytů endometria. APC integrují jednotlivé stimuly včetně mikrobiálních a jsou klíčové pro zahájení adekvátní imunitní odpovědi. V průběhu menstruačního cyklu počet makrofágů narůstá a dosahuje vrcholu v pozdní sekreční fázi. Produkcí LIF (leudemia inhibitory factor) se podílejí na fukosylaci povrchových struktur důležitých pro navázání trofektodermu, a tím pro receptivitu endometria. Makrofágy přítomné ve střevní sliznici a exponované střevnímu mikrobiomu se také liší mnoha funkčními parametry od makrofágů periferní krve. Byla prokázána jejich výrazně snížená schopnost zahájit zánětlivou odpověď.
T-buňky představují další významnou frakci buněk imunitního systému přítomných v endometriu. Mimo těhotenství jsou uloženy v hlubších vrstvách endometria, pravděpodobně se podílejí na tvorbě placenty krátce po implantaci. Přibývá důkazů o vlivu mikrobiomu na „vyladění“ jednotlivých skupin T-buněk. Jedním ze známých vektorů mezi mikrobiomem a T-lymfocyty hostitele je polysacharid A (PSA) pocházející z pouzdra Bacteroides fragilis [11]. Důležitou roli mají T-regulační buňky sliznice, které se podílejí na udržení homeostázy mikrobiomu a zvýšení tolerance lokálního imunitního systému. T-regulační buňky střevní sliznice jsou aktivovány mnoha komenzály – např. Lactobacillus, Bacteroides, Flexistipes, Clostridium. Podobný mechanismus se může uplatňovat také na programování imunitního systému endometria v souvislosti s implantací embrya a placentací [1].
CYTOKINY A CHEMOKINY
Pro fyziologii reprodukce jsou důležitým faktorem cytokiny a chemokiny produkované imunitním systémem a buňkami endometria. V období implantace se zvyšuje množství prozánětlivých Th1 cytokinů IL-6, IL-8 a TNF-α, což vede k aktivaci buněk imunitního systému a aktivaci endometria. Významným faktorem je také chemokin CCL2 označovaný též jako „monocyte chemoattractant protein“, který produkují stromální buňky endometria a který přitahuje monocyty, T-buňky a dendritické buňky do děložní sliznice. Sekrece CCL2 byla také prokázána v deciduálních buňkách získaných v prvním trimestru těhotenství, kde zajišťuje lokální rovnováhu T-buněk a dendritických buněk. Bylo prokázáno, že mikrobiom je důležitým faktorem pro nastavení základní produkce CCL2 a navození homeostázy plazmocytoidních dendritických buněk [22].
MECHANISMY INTERAKCE MIKROBIOMU S ENDOMETRIEM
Na udržení fyziologické rovnováhy mezi přítomností mikrobiomu a aktivitou imunitního systému se podílí mechanismy vrozené a adaptivní imunity. Je nutné udržet hranici s fyziologickým mikrobiomem a efektivně likvidovat patogeny [27]. Součástí vrozeného imunitního systému jsou receptory PRR (pattern recognition receptors), které jsou schopny rozpoznat charakteristické znaky mikrobiálních patogenů – PAMPs (pathogen-associated molecular patterns). PAMPs jsou nejčastěji molekuly buněčné stěny – lipopeptidy, proteoglykany, lipopolysacharidy nebo mannany. K nejznámějším PRR patří toll-like receptory (TLR), NOD-like receptory (NLR) a C-type lektinové receptory, jako selektiny, kolektiny a proteoglykany [1]. Aktivace TLR indukuje nukleární faktor kappa-B, který zahajuje kaskádu zánětlivé reakce. PRR tvoří první linii proti STD (sexually transmitted diseases) a dalším patogenům, které mohou do dělohy pronikat z poševního prostředí. Epiteliální a stromální buňky endometria exprimují četné TLR a další PRR, v kontaktu s PAMPs tak mohou zahájit intenzivní zánětlivou reakci [2]. Bylo prokázáno, že NLR a TLR se podílejí na regulaci mikrobiomu a endometria v perikoncepčním období [21]. Nové poznatky v této oblasti mohou přispět ke zlepšení výsledků léčby poruch plodnosti metodami asistované reprodukce [24, 25, 26].
OBRANA PROTI PATOGENŮM
Stabilní kolonizace komenzálních bakterií chrání hostitele před patogeny, fyziologický mikrobiom je ve svém prostoru lépe adaptován než invazní patogeny. Komenzální bakterie ve svém prostředí kompetitivně snižují množství živin pro patogeny, jejich vzájemná symbióza brání vstupu patogenů do jejich niky. Komenzální bakterie také stimulují TLR a podporují jejich schopnost reagovat na PAMPs možných patogenů [1, 21]. Podobným mechanismem může endometrium chránit jeho mikrobiom.
Dalším velmi důležitým faktorem obrany je vrstva epiteliálních buněk a její pevnost. Intaktní epitel brání proniknutí bakterií do stromatu sliznice a jejich kontaktu s imunitním systémem. Na stavbu a diferenciaci epitelu má výrazný vliv mikrobiom. Bylo prokázáno, že v intestinální sliznici mikrobiom podporuje regeneraci epitelu, moduluje jeho permeabilitu a vaskularizaci [1]. V děloze mohou komenzální bakterie přispívat k remodelaci endometria nutné pro implantaci. Bylo prokázáno, že v období implantačního okna se snižuje pevnost spojení a počet dezmozomů mezi epiteliálními buňkami, což usnadňuje průnik trofoblastu a současně také bakterií, které zvyšují tvorbu prozánětlivých cytokinů podílejících se na implantaci a placentaci [3, 5].
ZÁVĚR
Mikrobiom endometria může být s neurohormonálním a imunitním systémem důležitou součástí fyziologické adaptace nutné pro úspěšný vývoj těhotenství. Historická představa sterilního endometria již neplatí. Současné poznatky otvírají prostor pro další výzkum. Je třeba stanovit standardy vyšetření mikrobiomu, eliminace kontaminace vzorků, souvislost mezi mikrobiomem a průběhem těhotenství. To vyžaduje úzkou spolupráci v oblasti mikrobiologie, imunologie a reprodukční medicíny.
Práce vznikla za podpory MZ ČR – RVO (FNBr, 65269705) a projektu MZ ČR reg. č. NV18-08-00291.
Korespondující autor:
ing. Michal Ješeta, PhD.
Gynekologicko-porodnická klinika
LF MU a FN
Obilní trh 11
602 00 Brno
e-mail: jeseta.michal@fnbrno.cz
Zdroje
1. Benner, M., Ferwerda, G., Irma Joosten, I., et al. How uterine microbiota might be responsible for a receptive, fertile endometrium. Hum Reprod Update, 2018, 24(4), p. 393–415.
2. Botos, I., Sega, DM., Davies, DR. The structural biology of toll-like receptors. Structure, 2011, 19, p. 447–459.
3. Buck, VU., Windoffer, R., Leube, RE., Classen-Linke, I. Redistribution of adhering junctions in human endometrial epithelial cells during the implantation window of the menstrual cycle. Histochem Cell Biol, 2012, 137, p. 777–790.
4. Burton, GJ., Jauniaux, E., Charnock-Jones, DS. The influence of the intrauterine environment on human placental development. Int J Dev Biol, 2010, 54, p. 303–312.
5. Dvořan, M., Vodička, J., Dostál, J., et al. Implantace a diagnostika receptivity endometria. Čes Gynek, 2018, 83(4), s. 291–299.
6. Franasiak, JM., Scott, RT, Jr. Reproductive tract microbiome in assisted reproductive technologies. Fertil Steril, 2015, 104, p. 1364–1371.
7. Franasiak, JM., Scott, RT. Endometrial microbiome. Curr Opin Obstet Gynecol, 2017, 29, p. 146–152.
8. Franasiak, JM., Werner, MD., Juneau, CR., et al. Endometrial microbiome at the time of embryo transfer: next-generation sequencing of the 16 S ribosomal subunit. J Assist Reprod Genet, 2016, 33, p. 129–136.
9. Geva-Zatorsky, N., Sefik, E., Kua, L., et al. Mining the human gut microbiota for immunomodulatory organisms. Cell, 2017, 168, p. 928–943.
10. Hooper, LV., Littman, DR., Macpherson, AJ. Interactions between the microbiota and the immune system. Science, 2012, 336, p. 1268–1273.
11. Ivanov, II., Atarashi, K., Manel, N., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell, 2009, 139, p. 485–498.
12. Macpherson, AJ., de Aguero, MG., Ganal-Vonarburg, SC. How nutrition and the maternal microbiota shape the neonatal immune system. Nat Rev Immunol, 2017, 10, p. 508–517.
13. Miles, SM., Hardy, BL., Merrell, DS. Investigation of the microbiota of the reproductive tract in women undergoing a total hysterectomy and bilateral salpingooopherectomy. Fertil Steril, 2017,107, p. 813–820.
14. Mitchell, CM., Haick, A., Nkwopara, E., et al. Colonization of the upper genital tract by vaginal bacterial species in nonpregnant women. Am J Obstet Gynecol, 2015, 212, p. 611–619.
15. Moore, DE., Soules, MR., Klein, NA., et al. Bacteria in the transfer catheter tip influence the live-birth rate after in vitro fertilization. Fertil Steril, 2000,74, p. 1118–1124.
16. Moreno, I., Franasiak, JM. Endometrial microbiota—new player in town. Fertil Steril, 2017, 108, p. 32–39.
17. Postler, TS., Ghosh, S. Understanding the holobiont: how microbial metabolites affect human health and shape the immune system. Cell Metab, 2017, 26, p. 110–130.
18. Power, ML., Quaglieri, C., Schulkin, J. Reproductive microbiomes. Reprod Sci, 2017, 24, p. 1482–1492.
19. Prince, AL., Ma, J., Kannan, PS., et al. The placental membrane microbiome is altered among subjects with spontaneous preterm birth with and without chorioamnionitis. Am J Obstet Gynecol, 2016, 214, p. 621–627.
20. Selman, H., Mariani, M., Barnocchi, N., et al. Examination of bacterial contamination at the time of embryo transfer, and its impact on the IVF/pregnancy outcome. J Assist Reprod Genet, 2007, 24, p. 395–399.
21. Sirota, I., Zarek, SM., Segars, JH. Potential influence of the microbiome on infertility and assisted reproductive technology. Semin Reprod Med, 2014, 32, p. 35–42.
22. Swiecki, M., Miller, HL., Sesti-Costa, R., et al. Microbiota induces tonic CCL2 systemic levels that control pDC trafficking in steady state. Mucosal Immunol, 2017, 10, p. 936–945.
23. Ulčová-Gallová, Z., Pešek, M., Chaloupka, P., et al. Screening of endometrial NK cells in selected infertile patients. First part – Methods and current results. Čes Gynek, 2017, 82(5), p. 366–371.
24. Ventruba, P., Žáková, J., Trávník P., et al. Aktuální otázky asistované reprodukce v České republice. Čes Gynek, 2013, 78(4), s. 392–398.
25. Ventruba, P., Žáková, J., Ješeta, M., et al. Současná témata reprodukční medicíny v České republice. Čes Gynek, 2016, 81(3), s. 234–240.
26. Vodička, J., Dvořan, M., Smékalová, K., et al. Možnosti přípravy endometria ke kryotransferu. Čes Gynek, 2018, 83(1), s. 24–28.
27. Wira, CR., Grant-Tschudy, KS., Crane-Godreau, MA. Epithelial cells in the female reproductive tract: a central role as sentinels of immune protection. Am J Reprod Immunol, 2005, 53, p. 65–76.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicínaČlánok vyšiel v časopise
Česká gynekologie

2019 Číslo 1
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Mýty a fakta ohledně doporučení v těhotenství
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Jak podpořit využití železa organismem bez nežádoucích účinků
Najčítanejšie v tomto čísle
- Endometrióza v těhotenství – diagnostika a management
- Diagnostika a moderní trendy v terapii poporodní deprese
- Cerclage – historie a současnost
- Děložní mikrobiom jako faktor receptivity endometria
