-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sekundární imunodeficitní stav s infekčními komplikacemi po imunosupresivní terapii u nemocné se systémový lupus erytematodes
Secondary immunodeficiency with infectious complications following immunosuppressive therapy in a female patient with systemic lupus erythematosus
We present a young female with systemic lupus erythematosus with cutaneous vasculitis, necrotic defects and suspected vasculitis of colon. The glucocorticoid therapy and the administration of pulse intravenous cyclophosphamide led to a decrease in IgG and IgA levels with numerous infectious complications, e.g. Salmonella gonitis, thrush, vaginal mycosis with labial phlegmon and herpetic efflorescence in gluteal area, cultured Staphylococcus aureus from the vasculitic defect on an elbow. The administration of a substitution dose of intravenous immunoglobulins (IVIG), targeted antibiotic, virostatic and antimycotic therapy led to improvement in clinical and laboratory findings. A new onset of diabetes mellitus, presumably induced by glucocorticoids, has been documented.
Key words:
systemic lupus erythematosus, immunodeficiency
Autoři: L. Podrazilová 1; J. Vencovský 1; O. Kryštůfková 1; M. Podrazil 2; C. Dostál 1; K. Pavelka 1
Působiště autorů: Revmatologický ústav, Praha, 2Ústav imunologie, 2. LF UK, Praha 1
Vyšlo v časopise: Čes. Revmatol., 17, 2009, No. 2, p. 91-95.
Kategorie: Kazuistiky
Souhrn
V práci prezentujeme mladou ženu se systémovým lupus erytematodes s kožní vaskulitidou a nekrotickými defekty a suspektní vaskulitidou tlustého střeva. Při terapii glukokortikoidy (GK) a po pulzním podání cyklofosfamidu došlo k poklesu hladin imunoglobulinů IgG a IgA s četnými infekčními komplikacemi, např. salmonelovou gonitidou, soorem, vaginální mykózou s flegmónou labií a herpetickou eflorescencí v gluteální krajině, vykultivovaným zlatým stafylokokem z vaskulitického defektu na lokti. Po podání substituční dávky intravenózních imunoglobulinů (IVIG), cílené antibiotické, virostatické a mykotické terapii došlo ke klinickému i laboratornímu zlepšení. Nově se manifestoval diabetes mellitus v.s. kortikoidní geneze.
Klíčová slova:
systémový lupus erytematodes, imunodeficienceÚvod
Infekce jsou jednou z hlavních příčin morbidity a mortality u pacientů se systémovým lupus erytematodes (SLE), až 55 % všech úmrtí je způsobeno infekcí (1). Na zvýšené vnímavosti pacientů se SLE k infekcím se podílí léčba, vlastní choroba a genetická vnímavost nemocného (2). Bakteriální mikroorganismy jsou nejčastějším vyvolavatelem infekčních komplikací, vzácněji se uplatňují i mykobakteria, virus hepatitidy B (HBV) nebo virus lidské imunodeficience (HIV) (3). Nejčastěji se infekce manifestují na kůži, kloubech, v močových cestách, na mozku, v plicích a v krvi (4, 5). Diferenciálně diagnosticky je nutné v úvodu odlišit vzplanutí lupusu (flare) od akutní infekce (6). Uvážlivé podávání glukokortikoidů a cytotoxických látek je nezbytné v prevenci infekčních komplikací (2, 6). Mezi rizikové faktory infekcí patří relabující onemocnění, aktivní renální postižení a léčba glukokortikoidy nebo imunosupresivní léčbou (6). V našem případě byl podán z důvodu aktivního onemocnění s kožní vaskulitidou pulzní cyklofosfamid, jehož mechanismus účinku je mimo jiné i potlačení funkce lidských B lymfocytů (7) a potlačení indukce pomocných T lymfocytů (8). Mezi nežádoucí účinky cyklofosfamidu patří i infekční komplikace nejčastěji vyvolané virem herpes zoster (HSV) (9), cytomegalovirem (10), nokardiemi a Pneumocystou carinii (11, 12). Podávání kortikosteroidů působí lymfopenii a potlačuje funkci T lymfocytů více než B lymfocytů, tj. suprimují buněčnou imunitu (13).
Popis případu
U mladé 22leté ženy se z plného zdraví objevila tvorba erytematózních ložisek na kůži po oslunění. Přidaly se bolesti kloubů, myalgie a svalová slabost dolních končetin, Raynaudův fenomén na prstech horních a dolních končetin s tvorbou defektů na akrálních částech končetin. Nemocná byla unavená, vyčerpaná a v posledních třech měsících necíleně zhubla devět kilogramů.
Její matka zemřela ve 36 letech na karcinom endometria, otce neznala. Vyrůstala s babičkou a sestrou. Vyučila se a pracovala jako prodavačka. Její přítel se přiznal k závislosti na drogách, ona sama pouze k nikotinismu.
V osobní anamnéze byla v minulosti sledována a léčena pro asthma bronchiale inhalačními kortikosteroidy.
Na interním oddělení v místě bydliště bylo vysloveno podezření na systémové onemocnění pojiva na podkladě fotosenzitivity, jednorázově prokázané leukopenie, perikarditidy, pozitivity antinukleárních, anti ds-DNA a antiSm autoprotilátek, s kožní vaskulitidou, proto byla zahájena léčba glukokortikoidy (GK), tj. 3 pulzy Solu-Medrolu 1000 mg, p.o. 48 mg Medrolu, a nemocná byla přeložena do Revmatologického ústavu.
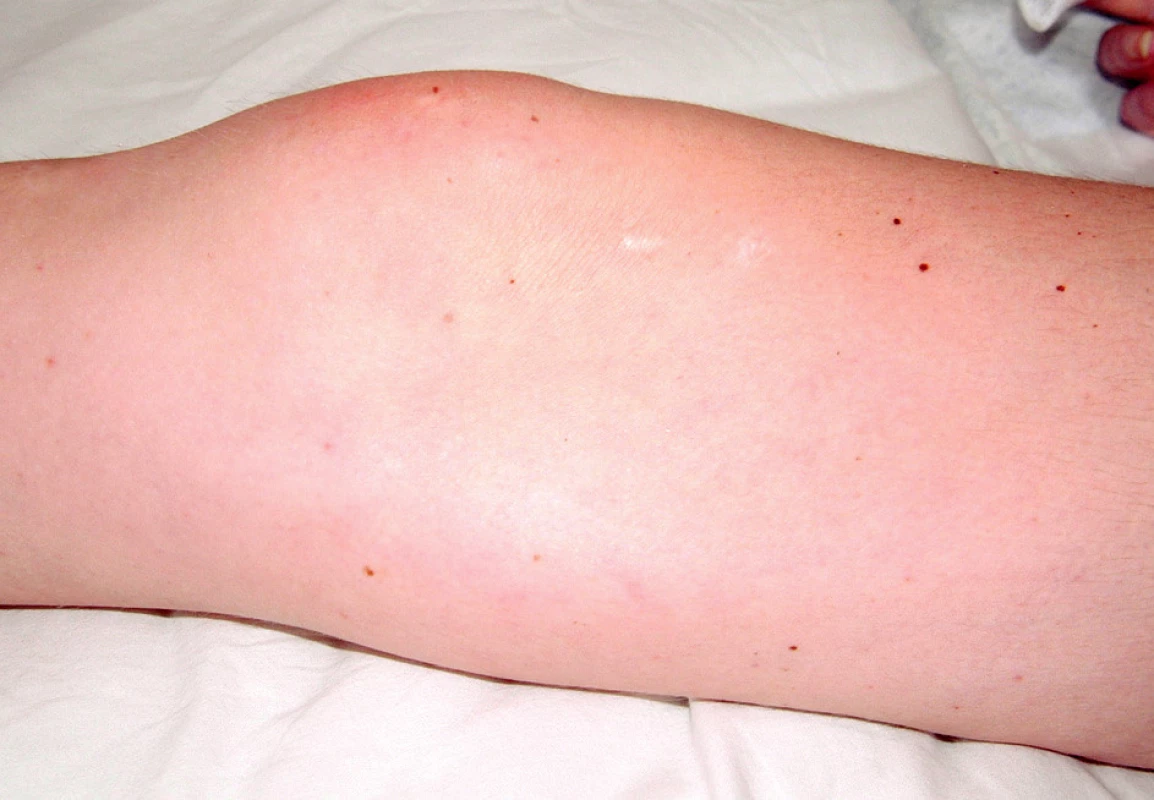
Při přijetí subjektivně udávala artralgie kolen, kyčlí a loktů s ranní ztuhlostí deset minut. Objektivně byla pozorována artritida drobných ručních kloubů. Při fyzikálním vyšetření dominoval kožní nález s vaskulitickými defekty na třetím prstu pravé ruky (obr. 1), nad lokty a nad druhým až pátým prstem levé nohy (obr. 2).
Obr. 1. Vaskulitický defekt na prstu ruky, šipkou je označena třískovitá hemoragie. 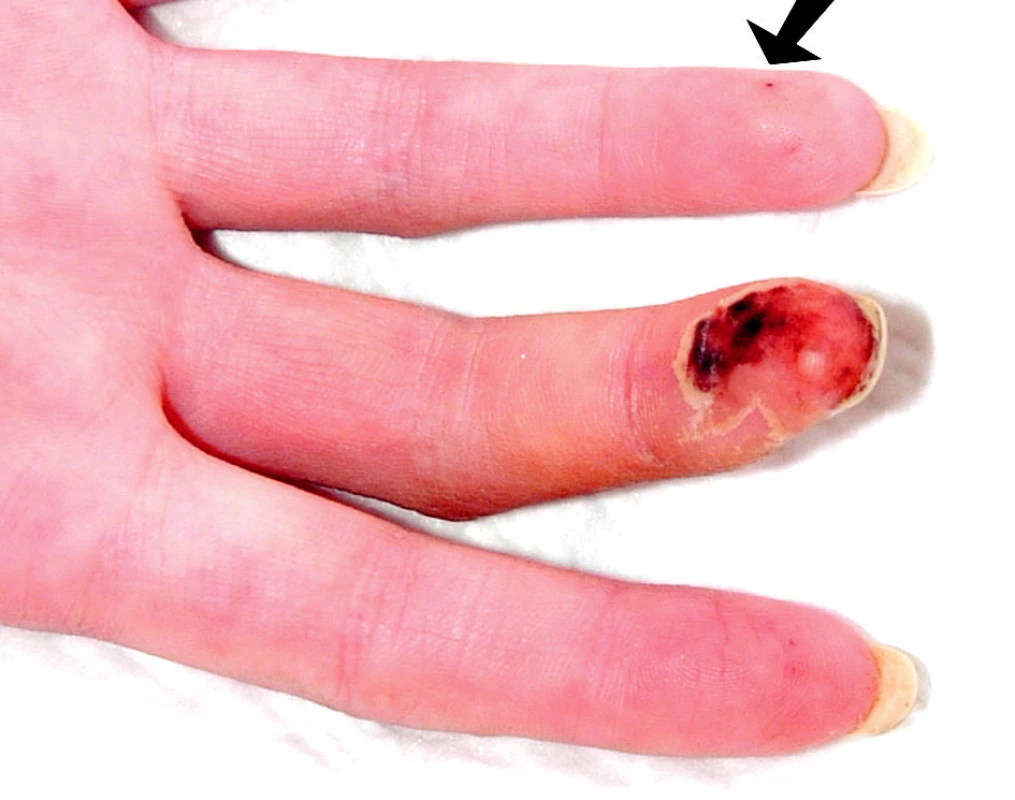
Obr. 2. Vaskulitický defekt palce PDK, na 2.-5.prstu LDK třískovité hemoragie. 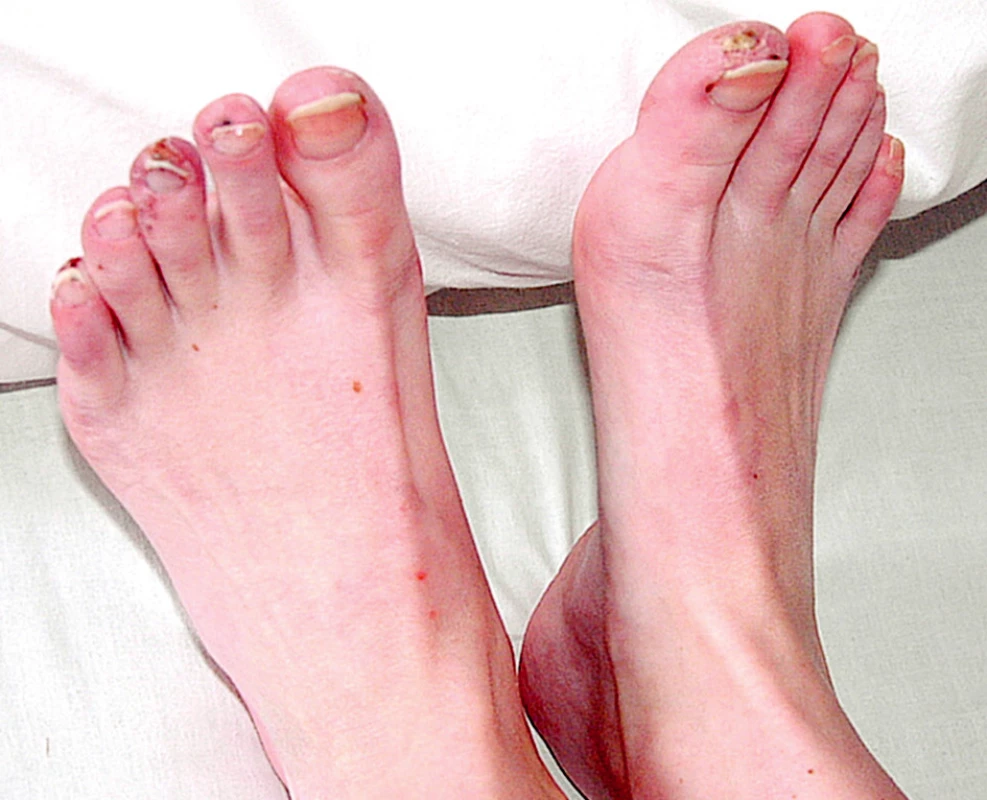
Diagnóza systémového lupus erytematodes byla stanovena na podkladě: fotosenzitivity, artritid, perikarditidy, leukopenie před nasazením GK, pozitivity antinukleárních, anti ds-DNA, antiSm, antiRNP autoprotilátek.
Echokardiograficky byl zjištěn perikardiální výpotek se separací listů 6 mm. Orgánové postižení ledvin, plic ani mozku zjištěno nebylo. Při vyšetření kůže přímou imunofluorescencí byl získán necharakteristický nález, diferenciálně diagnosticky bylo zvažováno onemocnění pojiva, histologicky byla prokázána akutní fáze SLE. Na RTG snímcích rukou a nohou nebyly prokázány destrukce.
Pro recidivující spazmy v břiše bylo provedeno vyšetření výpočetní tomografií (CT) břicha, které prokázalo tekutinu v Douglasově prostoru se ztluštěním stěny tračníku, diferenciálně diagnosticky byla zvažována možnost manifestace vaskulitidy v gastrointestinálním traktu (GIT).
Pro vysoce aktivní onemocnění s vysokými titry autoprotilátek (ANA 1 : 1280, anti ds-DNA – ELISA 48,2, pozitivitou anti Ro, antiRNP, antiSm, anti histonů, anti Scl-70) a kožní vaskulitidou byla zahájena pulzní léčba cyklofosfamidem – 10 mg/kg (CFM), po kterém došlo k rozvoji infekčních komplikací a poklesu hladin imunoglobulinů IgG a IgA (graf 1). Buněčná imunita postižena nebyla.
V průběhu hospitalizace se u nemocné rozvinula septická gonitida (obr. 3) s vykultivovanou bakterií Salmonela enteritidis. Nově se objevila rozsáhlá herpetická eflorescence v gluteální oblasti (obr. 4). Již od přijetí byla přítomna kandidiáza v dutině ústní, nově byla prokázána kandidová infekce v pochvě, která progredovala do těžké inquinolabiální flegmóny (obr. 5). Vaskulitické defekty byly trvale osídleny zlatým stafylokokem.
Obr. 4. Herpetická eflorescence na hýždích 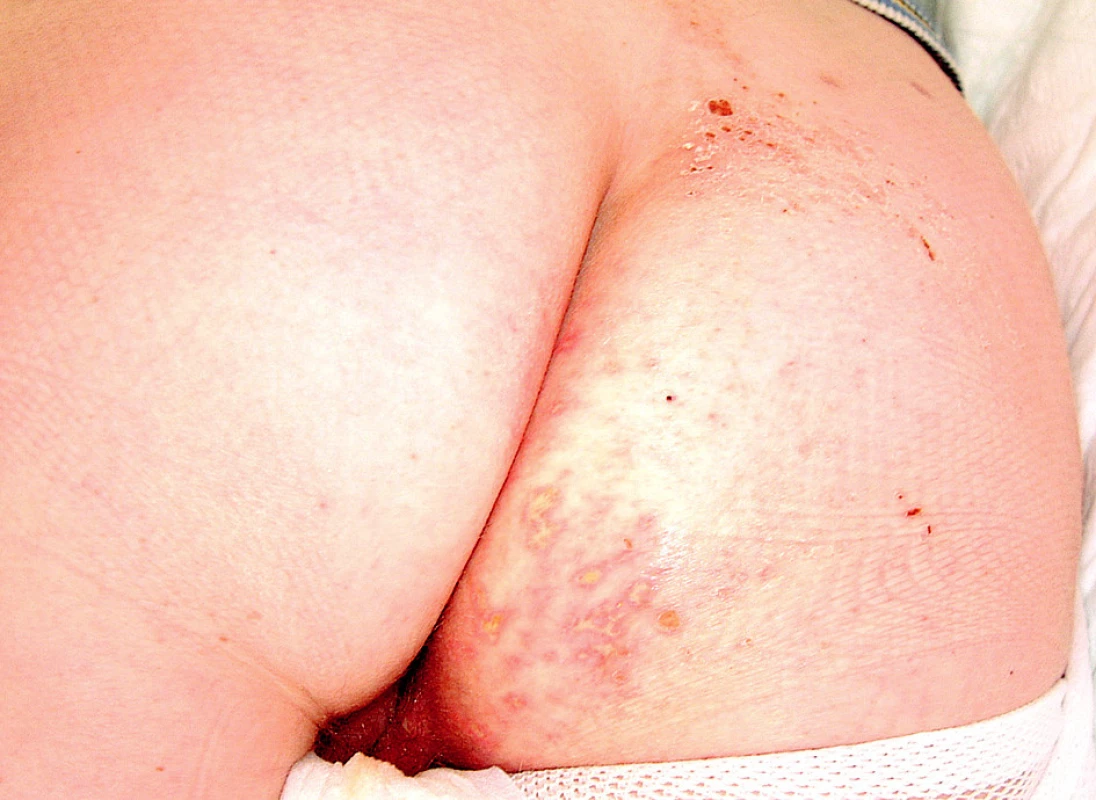
Obr. 5. Flegmóna pravého labia. herpetická eflorescence na hýždích. 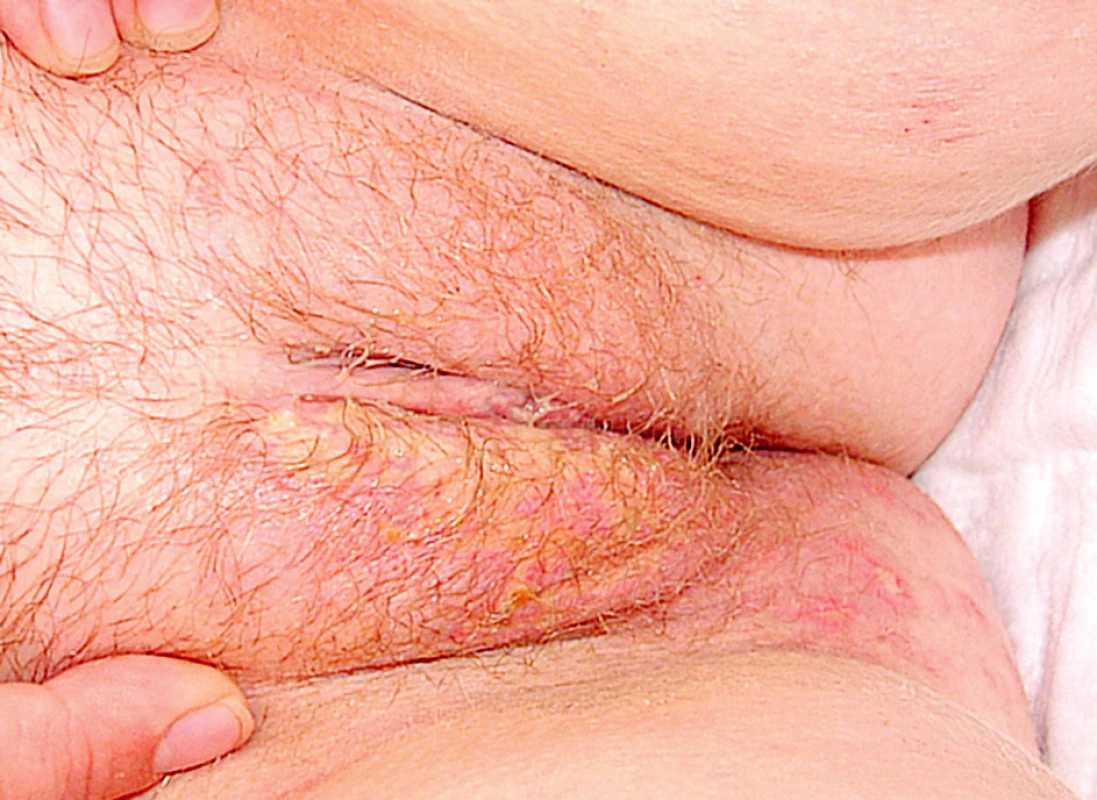
Další pulz cyklofosfamidu nebyl podán pro rozvoj sekundárního imunodeficitního stavu s četnými infekčními komplikacemi. Pro labilní glykemie byla redukována dávka GK na 24 mg Medrolu denně. Infekční komplikace byly léčeny širokospektrými antibiotiky dle citlivosti, virostatiky a antimykotiky. Nemocné byla pro kožní vaskulitidu podána série vasodilatačních infuzí s alprostadilem (Prostavazin).
Pro prohlubující se imunodeficitní stav IgG a IgA a život ohrožující infekce byla zahájena substituční léčba intravenózními imunoglobuliny (IVIG), tj. 800 mg na kilogram hmotnosti rozděleně ve 3 dnech (14, 15). Po první dávce došlo ke klinickému zlepšení s postupným zhojením infekčních komplikací a zároveň normalizaci hladin imunoglobulinů (graf 1), proto již další dávka IVIG podána nebyla.
Graf 1. Vývoj hladin imunoglobulinů po aplikaci cyklofosfamidu a následně po intravenózních imunoglobulinech, na vedlejší ose y je vyznačena dávka Medrolu v mg a zároveň hladina anti ds-DNA protilátek stanovených metodou ELISA. 
Jako udržovací terapie byla zahájena léčba azathioprinem v dávce 50 mg denně a ponechána byla dávka kortikosteroidů. Ve výrazně zlepšeném stavu bez žádných infekčních komplikací a s normálními hladinami imunoglobulinů byla dimitována a předána do ambulantní péče.
V průběhu hospitalizace se u nemocné manifestoval diabetes mellitus v.s. kortikoidní geneze, který byl zprvu labilní a vyžádal si intenzivní inzulinový režim. U nemocné se rozvinula sekundární amenorhea, menstruace u ní byla znovu navozena hormonálně.
Diskuse
U námi prezentovaného případu mladé ženy s aktivním SLE s kožní a susp. vaskulitidou GIT došlo po imunosupresivní léčbě cyklofosfamidem s vysokými dávkami kortikosteroidů k rozvoji přechodného sekundárního humorálního imunodeficitního stavu, který byl provázen četnými infekčními komplikacemi. U nemocné se manifestovaly bakteriální, virové i mykotické infekce.
Bakteriální infekce byly vyjádřené trvalým osídlením vaskulitického defektu na lokti zlatým stafylokokem. Rovněž se rozvinula salmonelová septická gonitida, která je v literatuře popisovaná u imunosuprimovaných nemocných zejména s aktivním SLE (16–21), často u pacientů s lupusovou nefritidou (22).
Mykóza (kandidiáza) a infekce virem varicela zoster (HZV) s erupcí svědivých puchýřků v průběhu nervu se často vyskytují u nemocných s nedostatečnou buněčnou odpovědí, v našem případě hodnoty buněčné imunity nebyly kvantitativně odlišné od normy.
Infekce HZV je popisována až u 47 % pacientů se SLE (2, 9), rovněž zde je rizikovým faktorem imunosupresivní terapie (GK, CFM, azathioprin) (23) a klinický průběh je často benigní. U pacientů se SLE, kteří prodělali infekci HZV, je větší pravděpodobnost postižení ledvin, trombocytopenie či hemolytické anémie (23), toto však nebylo zjištěno u prezentované pacientky.
Literárně je popisovaná klinická podobnost aktivního SLE a manifestace HIV (3, 24, 25), opakovaný test na HIV byl u naší pacientky negativní.
SLE je onemocnění charakterizované hyperaktivitou B lymfocytů, které po aktivaci produkují autoprotilátky a působí polyklonální hypergamaglobulinemii. V literatuře jsou popisovány případy panhypoglobulinemie u pacientů se SLE (26–29), ale protože všichni mají imunosupresivní terapii, nelze určit, zda hypogamaglobulinemie je v souvislosti s nemocí nebo terapií. Přechodná panhypogamaglobulinémie s humorální imunodeficiencí a infekčními komplikacemi byla popsána rovněž u nemocné se SLE po aplikaci CFM a GK (26–29).
O izolované IgG deficienci u SLE jsou v literatuře kazuistická sdělení. U jednoho nemocného se vyvinula srdeční tamponáda (30). Jako nežádoucí účinek vysokých dávek GK je popisována IgG deficience u nemocného se SLE s rozvojem lupus vulgaris (31) a u jiného nemocného došlo k rozvoji mimoplicní tuberkulózy s postižením synoviální tkáně, mening a kůže (32).
IgA deficit se častěji než v běžné populaci vyskytuje u nemocných se SLE (33, 34). Sekundární imunodeficit IgA může být způsoben léky, např. fenytoin, zlato, penicilamin a sulfasalazin, některé z nich mohou indukovat i léky indukovaný SLE (35).
Izolovaný IgM imunodeficit u SLE je vzácný (36, 37).
Substituční léčba intravenózními imunoglobuliny (IVIG) se užívá v léčbě primárního i sekundárního imunodeficitu (38–42), jako v našem případě navozeném terapií. Mechanismus účinku IVIG je přes funkci B a T lymfocytů, dále neutralizuje patogenní autoprotilátky a má silný protizánětlivý účinek, který závisí na interakci s komplementem, cytokiny a endoteliálními buňkami (39). U prezentované pacientky se po první substituční dávce IVIG s biologickým poločasem 4–6 týdnů obnovila tvorba protilátek a nemusela být podána další dávka, protože normální hladiny imunoglobulinů přetrvávaly i po třech měsících od podání IVIG.
Komentář si zasluhuje pozitivita anti-Scl70 protilátek, které jsou většinou typické pro nemocné se sklerodermií. U pacientky s jasnými klinickými a laboratorními projevy SLE lze s vysokou pravděpodobností předpokládat falešnou pozitivitu v tomto testu, způsobenou přítomností imunitních komplexů obsahujících DNA uvolněnou do séra a anti-dsDNA protilátku. Scl70 je topoizomeráza I, tedy enzym, který má svou funkci v topologii DNA a schopnost vazby na DNA. Při vyšších koncentracích DNA-anti-dsDNA imunitních komplexů se váže DNA tohoto komplexu na antigen Scl70 nespecificky a IgG anti-dsDNA v komplexu je pak falešně detekován jako anti-Scl70 protilátka.
Závěr
Tento případ mladé ženy s aktivním SLE s kožní a susp. GIT vaskulitidou byl komplikován tranzientním humorálním imunodeficitním stavem, který se rozvinul po imunosupresivní terapii pulzním CFM a vysokými dávkami GK. Závažné infekční komplikace provázely IgG a IgA deficienci a vyžádaly si intenzivní ATB, antimykotickou a virostatickou terapii. Ke zhojení všech infekčních ložisek a k normalizaci hladin imunoglobulinů došlo po substituční léčbě IVIG.
Je nesmírně důležité u SLE pacientů odlišit vzplanutí nemoci od infekce, protože léčebný přístup v těchto případech je odlišný. Při výskytu závažné infekční komplikace, je nutné vysadit imunosupresivní léčbu, případně zvážit podávání intravenózních imunoglobulinů při prokázaném symptomatickém imunodeficitním stavu. Primární a sekundární prevence případných infekčních komplikací je indikována u všech nemocných.
Práce vychází z výzkumných záměrů Revmatologického ústavu a MZ ČR 00000023728.
MUDr. Lucie Podrazilová,
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: podrazilova@revma.cz
Zdroje
1. Cervera R, Khamashta MA, Font J et al and the European Working Party on Systemic Lupus Erythematosus. Morbidity and mortality in systemic lupus erythematosus during a 5-year period: a multicenter prospective study of 1,000 patients. Medicine 1999; 78 : 167–75.
2. Fessler BJ. Infectious diseases in systemic lupus erythematosus: risk factors, management and prophylaxis. Best Pract Res Clin Rheumatol 2002; 16(2): 281–91.
3. Sommer S, Piyadigmage A, Goodfield MJ. Systemic lupus erythematosus or infection with HIV, or both? Clin Exp Dermatol 2004; 29(4): 393–5.
4. Zonana - Nacach A, Camargo-Coronel A, Yanez P, et al. Infections in outpatients with systemic lupus erythematosus: a prospective study. Lupus 2001; 10 : 505–10.
5. Petri M. Infection in systemic lupus erythematosus. Rheumatic Disease Clinics of North America 1998; 24 : 423–56.
6. Zandman-Goddard G, Shoenfeld Y. SLE and infections. Clin Rev Allergy Immunol 2003; d25(1): 29–40.
7. Cupps TR, Edgar LC, Fauci AS. Suppression of human B lymphocyte function by cyclophosphamide. J Immunol 1982; 128 : 2453–7.
8. Clements PJ, Davis J Cytotoxic drugs: their clinical application to the rheumatic diseases. Semin Arthritis Rheum 1986; 15 : 231–54.
9. Kahl LE. Herpes zoster infections in systemic lupus erythematosus: risk factors and outcome. Journal of Rheumatology 1994; 21 : 84–6.
10. Sakamoto O, Ando M, Yishimatsu S, et al. Systemic lupus erythematosus complicated by cytomegalovirus-induced hemophagocytic syndrome and colitis. Intern Med 2002; 41(2): 77–8.
11. Dostál C. Cyklofosfamid. Ve: Farmakoterapii revmatických onemocnění (ed. Pavelka K), Grada, Praha 2005 : 105–11.
12. Ward MM, Donald F. Pneumocystis carinii pneumonia in patients with connective tissue diseases: the role of hospital experience in diagnosis and mortality. Arthritis and Rheumatism 1999; 42 : 780–9.
13. Butler WT, Rossen RD. Effects of corticosteroids on immunity in man. J Clin Invest 1973; 52 : 2629–40.
14. Lories RJU, Maertens JA, Ceuppens JL, et al. The use of polyclonal intravenous immunoglobulins in the prevention and treatment of infectious diseases. Acta Clinica Belgica 2000; 55–3 : 163–9.
15. ASHP Commission on Therapeutics. ASHP therapeutic guidelines for intravenous immunoglobulin. Clin Pharm 1992; 11 : 117–36.
16. Gebauer CM, Borte M, Schille R, et al. Gonarthritis due to Salmonella enteritidis in a patient with systemic lupus erythematosus. Klin Padiatr 2002; 214(5): 319–23.
17. Becker A, van Agtmael MA, Comans EF, et al. Persistent fever in a patient with Salmonella typhimurium gonarthritis. Ned Tijdschr Geneeskd 2005; 149(1): 33–6.
18. Joshua F, Riordan J, Sturgess A. Salmonella typhimurium mediastinal abscess in a patient with systemic lupus erythematosus. Lupus 2003; 12(9): 710–3.
19. Chiu YL, Huang JW, Hsueh PR, et al. CAPD-related peritonitis due to Salmonella enteritidis in a patient with SLE. Am J Kidney Dis 2005; 46(2): 21–3.
20. Tsao CH, Chen CY, Ou LS et al. Risk factors of mortality for salmonella infection in systemic lupus erythematosus. J Rheumatol 2002; 29(6): 1214–8.
21. Lim E, Koh WH, Loh SF. Non-thyphoidal salmonellosis in patients with systemic lupus erythematosus. A study of fifty patients and a review of the literature. Lupus 2001; 10(2): 87–92.
22. Chen JY, Luo SF, Wu YJ. Salmonella septic arthritis in systemic lupus erythematosus and other systemic diseases. Clin Rheumatol 1998; 17(4): 282–7.
23. Manzi S, Kuller LK, Kutzer J, et al. Herpes zoster in systemic lupus erythematosus. Journal of Rheumatology 1995; 22 : 1254–8.
24. Chowdhry IA, Tan IJ, Mian A, et al. Systemic lupus erythematosus presenting with features suggestive of human immunodeficiency virus infection. J Rheumatol 2005; 32(7): 1365–8.
25. Saravana S, James DW, Abourawi F, et al. HIV infection mimicking SLE. Clin Rheumatol 2004; 23(6): 562–3.
26. Song J, Park Y.-B, Suh C.-H, et al. Transient panhypogammaglobulinaemia and B lymphocyte deficiency in a patient with neuropsychiatric systemic lupus erythematosus after immunosuppresive therapy. Clin Rheumatol 2003; (22): 62–6.
27. Tsokos GC, Smith PL, Balow JE. Development of hypogammaglobulinaemia in a patient with systemic lupus erythematosus.AmJ Med 1985; 81 : 1081–4.
28. Cronin ME, Balow JE, Tsokos GC. Immunoglobulin deficiency in patients with systemic lupus erythematosus. Clin Exp Rheumatol 1989; 7 : 359–64.
29. Fort JG, Scovern H, Abruzzo JL. Intravenous cyclophosphamide and methylprednisolone for the traetment of bronchiolitis obliterans and interstitial fibrosis associated with cryotherapy. J Rheumatol 1988; 15 : 850–4.
30. Tamura A, Agematsu K, Urasawa R et al. Cardiac tamponade due to systemic lupus erythematosus in a 7-year-old boy with selective IgG subclass deficiency. Eur J Pediatr 1998; 157(6): 475–8.
31. Duzgun A, Duman M, Sonel B, et al. Lupus vulgaris in a patient with systemic lupus erythematosus and persistent IgG deficiency. Rheumatol Int 1997; 16(5): 213–6.
32. Dzgun A, Peksari Y, Sonel B, et al. Localization of extrapulmonary tuberculosis in the synovial membrane, skin, and meninges in a patient with systemic lupus erythematosus and IgG deficiency. Rheumatol Int 2002; 22 : 41–44.
33. Liblau RS, Bach J-F. Selective IgA deficiency and autoimmunity. Int Arch Allergy Immunol 1992; 99 : 16–27.
34. Rifle G. Selective IgA deficiency nad systemic lupus erythematosus. Ann Med Interne (Paris) 1988; 139 : 134–7.
35. Rankin ECC, Isenberg DA. IgA deficiency and SLE: prevalence in a clinic population and review of the literature. Lupus 1997; 6 : 390–4.
36. Takeuchi T, Nakagawa T, Maeda Y, et al. Functional defects of B lymphocytes in a patient with selective IgM deficiency associated with systemic lupus erythematosus. Autoimmunity 2001; 34(2): 115–22.
37. Tanaka A, Kasahara M, Miyawaki T, et al. A case of selective IgM deficiency associated with systemic lupus erythematosus. Nippon Jinzo Gakkai Shi 1996; 38(4): 185–90.
38. Lories RJU, Maertens JA, Ceuppens JL, Peetermans.WE. The use of polyclonal intravenous immunoglobulins in the prevention and treatment of infectious diseases. Acta Clinica Belgica 2000; 55–3 : 163–169.
39. Bayry J, Misra N, Latry V, et al. Mechanism of action of intravenous immunoglobulins in autoimmune and inflammatory diseases. Transfusion Clinique et Biologique 2003; 165–169.
40. ASHP Commission on Therapeutics. ASHP therapeutic guidelines for intravenous immuneglobulin. Clin. Pharm 1992; 11 : 117–36.
41. Keller T, McGrath K, Newland A, Gatenby P, et al. Indications for use of intravenous immunoglobulin. The medical journal of Australia 1993; 204–206.
42. Lee ML, Strand V. Intravenous immunoglobulins in clinical practise. New York 1997; 57 : 63.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2009 Číslo 2- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Třeboňské revmatologické dny Abstrakta – sekce Středně zdravotnických pracovníků v revmatologii
- HLA-Cw*0602 jako predispoziční alela rozvoje psoriatické artritidy
- Utilizace zdravotní péče a náklady pacientů s revmatoidní artritidou léčených TNF-α inhibitory v České republice
- Omezený význam prokalcitoninu v odlišení septického stavu od vzplanutí autoimunitního onemocnění
- Vliv biologické úpravy povrchu vybraných implantačních materiálů na proliferaci a syntetickou aktivitu kostních buněk. Studie in vitro
- Sekundární imunodeficitní stav s infekčními komplikacemi po imunosupresivní terapii u nemocné se systémový lupus erytematodes
- Třeboňské revmatologické dny Abstrakta odborného programu
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- HLA-Cw*0602 jako predispoziční alela rozvoje psoriatické artritidy
- Třeboňské revmatologické dny Abstrakta odborného programu
- Omezený význam prokalcitoninu v odlišení septického stavu od vzplanutí autoimunitního onemocnění
- Sekundární imunodeficitní stav s infekčními komplikacemi po imunosupresivní terapii u nemocné se systémový lupus erytematodes
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy