-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Možnosti predikce rentgenové progrese revmatoidní artritidy
Prediction of radiographic progression of rheumatoid arthritis
Progression in structural changes in rheumatoid arthritis leads to a simultaneous decrease in functional abilities and the quality of life of a patient. Therefore it is of great importance to thoroughly evaluate the disease, and use such therapeutic approaches which lead to slowing or a complete cessation of radiographic progression. In the introduction, the authors discuss alternative methods of evaluation of structural progression of RA. The Sharp score (van der Heijde or Gennant modification) still represents the golden standard for the use in clinical randomised trials and observational studies. Furthermore, the authors present two models of risk evaluation of rapid radiographic progression (RRP). The borderline value for RRP was chosen as > 5 units of the Sharp score year. The first model was derived from ATTRACT and ASPIRE studies, and the second one evolved from the BeST study. It is a visual matrix model enabling an evaluation of an individual patient’s risk for RRP using a combination of various risk factors of progression. Based on the percentage value in the RRP risk, appropriate level of aggressive treatment is selected – including, for instance, an initial combination therapy with a biological agent in patients with a high RRP risk, and, on the contrary, a less intensive treatment with a synthetic DMARD monotherapy in patients with a lower risk. Persisting high activity, rheumatoid factors, anti-CCP antibodies or their combination, and high titers of acute phase reactants belong to the most significant risk factors for RRP. This proposed model will have to be tested in further prospective studies in various populations with RA.
Key words:
rheumatoid arthritis, rapid radiographic progression, Sharp score, anti-TNF therapy
Autoři: K. Pavelka; J. Gatterová
Působiště autorů: Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 18, 2010, No. 1, p. 19-25.
Kategorie: Přehledné referáty
Souhrn
Při postupující rentgenové progresi revmatoidní artritidy dochází paralelně k poklesu funkční schopnosti nemocného a zhoršuje se kvalita života nemocného. Proto je velmi důležité pečlivě hodnotit a používat takové terapeutické postupy, které rentgenovou progresi zpomalují či úplně zastavují. V úvodu článku autoři rozebírají alternativní metody hodnocení strukturální progrese RA. Zlatým standardem pro užití v klinických randomizovaných studiích a v observačních sledování je stále Sharpovo skóre (modifikace van der Heijde nebo Gennant). Dále autoři představují dva modely k hodnocení rizika rychlé rentgenové progrese (RRP). Za hranici RRP bylo zvoleno > 5 jednotek Sharpova skóre/rok. První model je odvozen od studií ATTRACT a ASPIRE a druhý model od studie BeST. Jde o vizuální, matrixový model, na kterém je možné z kombinace různých rizikových faktorů progrese vyhodnotit individuální riziko pacienta pro riziko RRP. Podle procentuálního rizika RRP je pak možné zvolit různě agresivní léčbu, včetně např. iniciální kombinační léčby s biologickým lékem a pacientů s vysokým rizikem RRP a naopak méně intenzivní léčbu monoterapií syntetického DMARD u pacientů s menším stupně rizika. Nejvýznamnějšími rizikovými faktory RRP jsou přetrvávající vysoká aktivita, revmatoidní faktory, anti CCP protilátky nebo jejich kombinace a vysoké reaktanty akutní fáze. Tento navržený model bude nutné testovat v dalších prospektivních studiích u různých populací s RA.
Klíčová slova:
revmatoidní artritida, rychlá rentgenová progrese, Sharpovo skóre, anti TNF léčbaRevmatoidní artritida (RA) je chronické, zánětlivé revmatické onemocnění, které může vést k destrukcím kloubů, vzniku deformit a disabilitě. Zatímco v časné fázi RA je pokles funkce převážně způsoben aktivitou nemoci (synovitidou), v pozdějším průběhu onemocnění jsou za rozvoj disability zodpovědné především strukturální změny (obr. 1). Zatímco v časných fázích nemoci jsou změny reverzibilní, v pozdější fázi je většina změn již ireverzilní. Z uvedeného vyplývá, že je nutné nasadit včas takovou léčbu RA, která prokazatelně zpomaluje nebo zastavuje rentgenovou progresi.
Obr. 1. Vztah mezi dlouhodobou rentgenovou progresí a poklesem funkce u pacientů s RA. 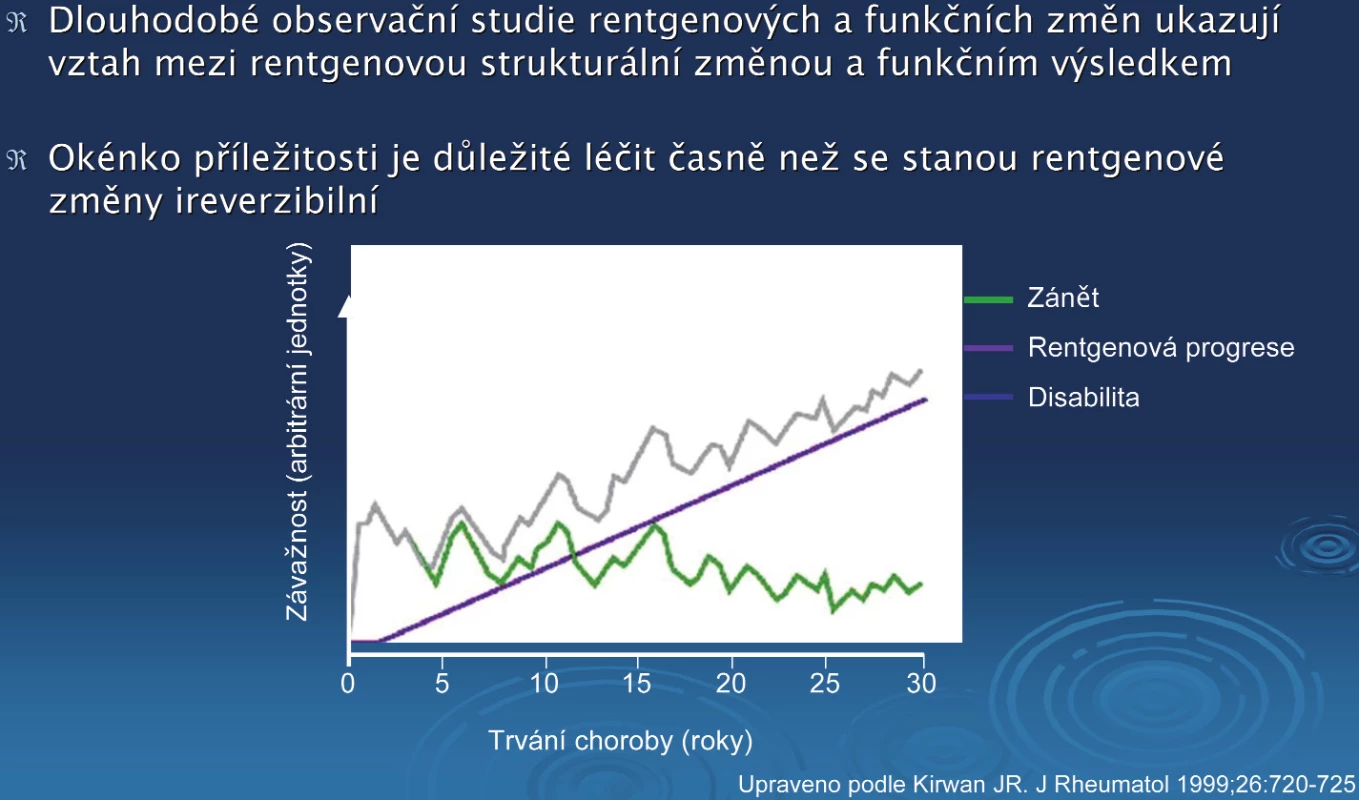
Metodiky hodnocení strukturální progrese
Strukturální změny u RA lze hodnotit pomocí metodik rentgenových, magnetickou resonancí a perspektivně též artrosonograficky (tab. 1). Základní zobrazovací technikou zůstává klasická skiagrafie. Nevýhodou nativního snímku je jeho malá výpovědní hodnota v časných stadiích RA, kdy na skiagramu nacházíme pouze periartikulární porózu a rozšíření měkkých částí. Pro hodnocení rozvoje morfologických změn se používá v současné době řada skórovacích systémů. Všechny tyto systémy jsou založeny na hodnocení snímků rukou a nohou. Historicky prvním systémem bylo hodnocení dle Steinbrockera, které se v běžné klinické praxi dodnes používá, ale má však nízkou senzitivitu k hodnocení morfologických změn v určitém časovém úseku. Další skórovací systém navrhl Larsen (1). Předností Larsenova skóre je, že velmi dobře reflektuje 32 oblastí jak pro ruce, tak pro nohy. Každý kloub je hodnocen podle rozsahu poškození v bodovém rozmezí 0–5, přičemž v prvních stupních jsou rozlišeny eroze podle velikosti do 1 mm a více. Největšího rozšíření při hodnocení rentgenové progrese RA však dosáhlo skóre navržené Sharpem (2) (obr. 2), respektive modifikace Sharpova skóre dle van der Heijde (3) nebo dle Gennanta (4). Sharpovo skóre se skládá ze dvou komponent – tzv. skóre erozí a skóre zúžení kloubních štěrbin. Odráží tak dva základní procesy destrukce kloubů – destrukci a úbytek kloubní chrupavky (zúžení štěrbin) a destrukce kosti (eroze). Tyto dva procesy mohou probíhat částečně nezávisle na sobě (5) a proto se většinou hodnotí obě komponenty zvlášť a též jako celkové Sharpovo skóre (tzv. Total Sharp score – užívaná zkratka TTS). Jsou hodnoceny snímky rukou a nohou současně, maximální skóre erozí je na rukou 160, maximální skóre zúžení štěrbin je 0–48. Hodnocení Sharpova skóre je časově velmi náročné. V naší vlastní práci jsem srovnávali výsledky progrese skupiny léčené biologiky a kontrolní skupiny na syntetických DMARD a zjistili jsme, že výpovědní hodnota Larsenova a Sharpova skóre byla obdobná (obr. 3). Larsenovo skóre je přitom značně jednodušší.
Tab. 1. Metody hodnocení strukturální progrese u RA. 
Obr. 2. Sharpovo skóre – modifikace van der Heijde. 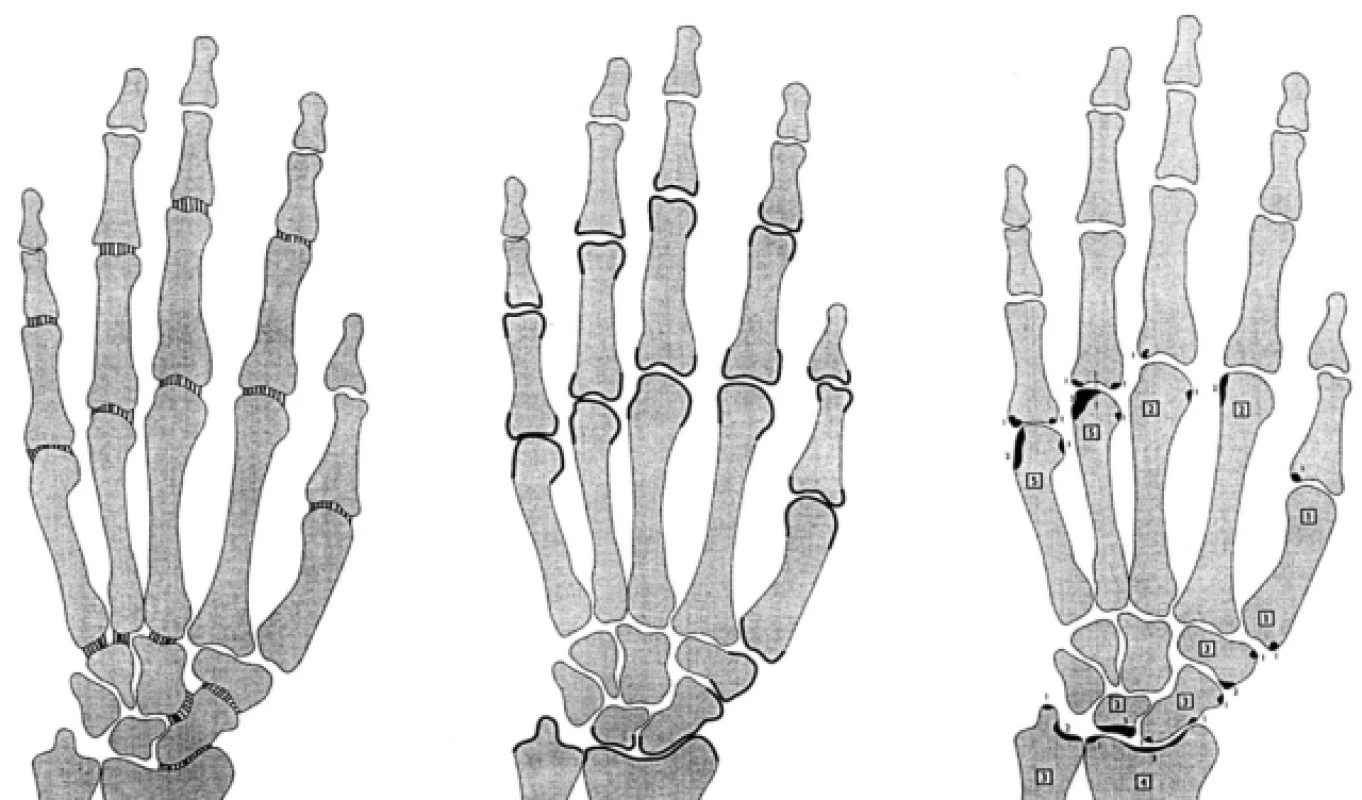
Obr. 3. Srovnání senzitivity Sharpova a Larsenova skóre - podíl pacientů bez rentgenové progrese (2 roky). 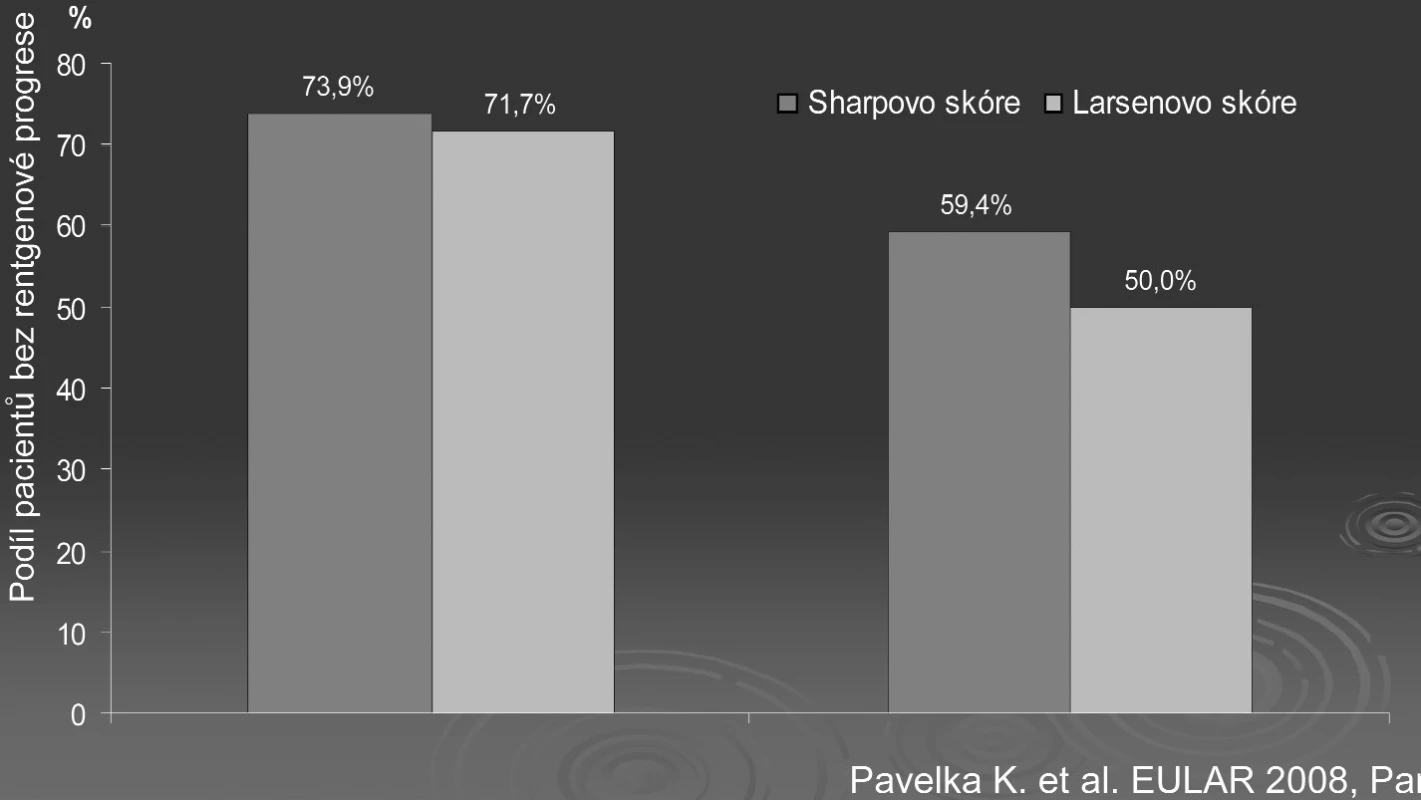
Rentgenová progrese u revmatoidní artritidy
RA je v principu destruktivní onemocnění a eroze se vyvíjejí rychle u 10–26 % pacientů během 3 měsíců u 75 % pacientů během prvních dvou let (6). Byla publikována řada prací, které sledovaly dlouhodobý průběh rentgenové progrese až v průběhu 20 let. Většina prací ukázala, že průběh rentgenové progrese je lineární, ale některé studie ukázaly rychlejší progresi na začátku onemocnění (7). Rychlost rentgenové progrese onemocnění se u jednotlivých pacientů značně liší. Graudal dokonce popsal 5 typů rentgenové progrese u RA (8). Nicméně pro epidemiologické studie se často používá určitý zjednodušený model, který počítá s průměrnou a lineární progresí RA. Byl zaveden termín „odhadovaná roční progrese“ (estimated yearly progression) (9). Příklad kalkulace odhadované roční progrese: Při vyšetření má pacient celkové Sharpovo skóre 26 a délka trvání jeho nemoci jsou čtyři roky. Odhadovaná roční progrese je tedy 26 děleno 4 rovná se 6,5. Ve většině publikovaných kohortových studií včetně studií z Českého registru ATTRA se odhadovaná roční progrese pohybuje kolem 8 jednotek TSS (10).
Prediktivní faktory rentgenové progrese
Bylo předloženo mnoho důkazů o tom, že přetrvávající vysoká aktivita RA je nejvýznamnějším faktorem, který vyvolává progredující strukturální změny, detekovatelné např. na rentgenovém snímku (11). Nejlepším ukazatelem aktivity RA jsou dnes kompozitní indexy. Bylo opakovaně prokázáno, že existuje vztah mezi průměrnou aktivitou nemoci a změnami aktivity v průběhu léčby a rozsahem rentgenové progrese. Tento vztah byl nalezen jak při použití kompozitních indexů pro hodnocení aktivity, tak při použití CRP.
Dalšími rizikovými faktory rychlé rentgenové progrese RA mohou být positivní revmatoidní faktory a anti CCP protilátky (12). Ke stanovení rizika individuálního pacienta pro rychlou rentgenovou progresi byla testována celá řada biomarkerů biochemických i imunogenetických (13). Ukázalo se však, že použití jednoho biomarkeru má limitovanou výpovědí hodnotu a že lepší výsledky mohou být získány při jejich kombinaci (14). Kromě laboratorních metod mohou mít určitou výpovědní hodnotu predikce rentgenové progrese i metodiky zobrazovací. Přítomnost erozí na rentgenovém snímku, které vznikají velmi časně po začátku choroby, což je dle některých studií až 26 % během 3 měsíců, může znamenat riziko rychlé rentgenové progrese (6). Další studie ukázaly prediktivní hodnotu pozitivního nálezu na magnetické resonanci (např. přítomnost kostního edému) pro progresi na individuálních kloubech (15). Velmi účinnou metodikou pro hodnocení časné synovitidy může být také ultrazvuk (16, 17), ale o prediktivní hodnotě tohoto vyšetření se však mnoho neví.
Celá řada biomarkerů a zobrazovacích metodik byla testována v nedávno publikované studii CIMESTRA (18). Do dvouletého prospektivního sledování se dvěma chemickými DMARD bylo zařazeno130 pacientů. Jednalo se o pacienty s časnou RA (průměrné trvání nemoci v obou skupinách 3 měsíce). Rentgenová progrese v průběhu 2 let byla hodnocena pomocí modifikovaného Sharpova skóre (3). Metodikou mnohočetné lineární regrese bylo zjištěno, že jediným nezávislým prediktorem rentgenové progrese bylo MRI skóre pro hodnocení kostního edému na MCP kloubech a zápěstí hodnocené dle metodiky RAMRIS (18). MRI skóre pro synovitidu, MRI skóre pro eroze, skóre aktivity DAS 28, anti CCP protilátky, sedimentace, kouření, věk ani pohlaví nebyly nezávislými ukazateli predikce vývoje erozí.
Ovlivnění rentgenové progrese terapií
A proč je vlastně predikce rentgenové progrese (a zvlášť rychlé rentgenové progrese) důležitá? Z klinické praxe je známo, že rentgenová progrese je u většiny pacientů relativně pomalá, nicméně u určité části pacientů je progrese poměrně rychlá. U těchto pacientů může ale účinná léčba snížit riziko progrese až o 78 %, jak prokázala metaanalýza klinických studií (19). Určitého zpomalení rentgenové progrese je možné docílit i po chemických DMARDs (20), nicméně podstatně účinnější při zpomalení rentgenové progrese jsou tzv. biologické léky RA, mezi které řadíme jednak TNF alfa blokátory (etanercept, infliximab, adalimumab, golimumab), jednak biologika s jiným mechanismem účinku (rituximab, abatacept, tocilizumab) (21–27). Efekt biologických léků byl zvláště výrazný ve studiích u časné RA (28, 29). Při srovnání metodicky velmi podobných studií s adalimumabem při stejném dávkování, byl prokazatelně výraznější vliv na zpomalení rentgenové progrese u časné RA (v této studii méně než tři roky trvání) oproti RA s delším trváním (30).
V lékových studiích se ukázal ještě jeden zajímavý fakt. Klinická aktivita je sice silným prediktorem rentgenové progrese, ale tyto faktory mohou být i rozpojeny a to nejen na úrovni jedince, ale i skupinové úrovni. U chemických DMARD je průkazné, že pacienti s přetrvávající aktivitou nadále rentgenově progredují, zatímco při léčbě anti TNF preparáty docházelo ke zpomalení rentgenové progrese i u pacientů bez klinické odpovědi. Anti TNF preparáty inhibují totiž rentgenovou progresi dvojím mechanismem, jednak nepřímo snížením aktivity, jednak přímo přes sníženou aktivaci RANKL a tím i osteoklastů (31).
Matrixový model predikce rychlé rentgenové progrese (RRP)
Do budoucna by bylo výhodné identifikovat pacienty se zvýšeným rizikem rychlé rentgenové progrese a nasadit ji včas účinnou léčbu. Protože je jasné, že bude nutné užít více ukazatelů, autoři se rozhodli vypracovat určitý rizikový model pro rychlou rentgenovou progresi. Jistou inspirací byl systém SCORE (Systemic Coronary Risk Evaluation), který hodnotí 10leté riziko kardiovaskulární mortality na bazi kombinace nejdůležitějších rizikových faktorů (např. hypertenze, lipidů, kouření atd.). Tyto faktory jsou pak zaneseny do jednoduché, vizuální, barevné matrice a umožňují rychlé vyhodnocení individuálního rizika. Systém SCORE je jeden z nejužívanějších rizikových modelů používaných v medicíně.
Skupina autorů se pokusila vypracovat matrixový model pro 1roční RRP revmatoidní artritidy pro individuálního pacienta na bázi kalkulace známých rizikových faktorů RRP a podle typu zahájené léčby (konzervativní versus intenzivní léčba) (32). Pro ověření modelu byly použity skupiny pacientů s časnou RA ve studii ASPIRE (28) a u pokročilé RA ve studii ATTRACT (21). V obou těchto studiích byla jednak skupina léčená kombinací anti TNF preparátu (konkrétně infliximab) a skupina kontrolní, léčená metotrexátem. První skupina na kombinované léčbě byla označována jako skupina na intenzivní léčbě, zatímco skupina na monoterapii MTX jako skupina konzervativní léčby. Za hranici RRP bylo považováno 5 jednotek dle celkového Sharpova skóre (m. van der Heijde) za jeden rok.
Matrixový model RRP pro časnou revmatoidní artritidu
Tento model pro 1roční RRP byl vytvořen za pomoci dat pacientů ze studie s časnou RA ASPIRE (28) (obr. 4). Byly vytvořeny dva alternativní modely (obr. 4A a B). Jedna varianta používá sedimentaci erytrocytů (ESR) druhá pak další reaktant akutní fáze CRP. Čísla ve čtverečcích představují procento (95 % CI) všech pacientů, kteří splňují bazální (na začátku léčby) charakteristiky nemoci a jsou léčeni daným způsobem léčby. Např. pacient s časnou RA, který má 18 oteklých kloubů a CRP 70 mg/l a koncentrace RF v séru 380 U/ml má 49 % riziko RRP pokud bude léčen monoterapií MTX a 15 % riziko při užití kombinované léčby anti TNF plus MTX. Redukce relativního rizika RRP s infliximabem plus MTX vs. MTX samotnému byla 43 a 71 % u pacientů s nízkými bazálními hodnotami a 70 % a 59 % u pacientů s vysokými bazálními hodnotami v modelech používající buď CRP, nebo ESR. Absolutní redukce rizika RRP byla u kombinace MTX plus infliximab ve srovnání s MTX monoterapií byla 3 a 5 % u pacientů s nízkými bazálními hodnotami a 33 a 24 % u pacientů s vysokými bazálními hodnotami v modelech užívající ESR nebo CRP. Počet pacientů nutných léčit agresivně aby se zabránilo 1 RRP byl 3 pro pacienty s bazálně vysokými hodnotami a 33 pro pacienty s bazálně nízkými hodnotami.
Obr. 4. Model předpovědi rychlé RTG progrese (RRP) u pacientů s RA. 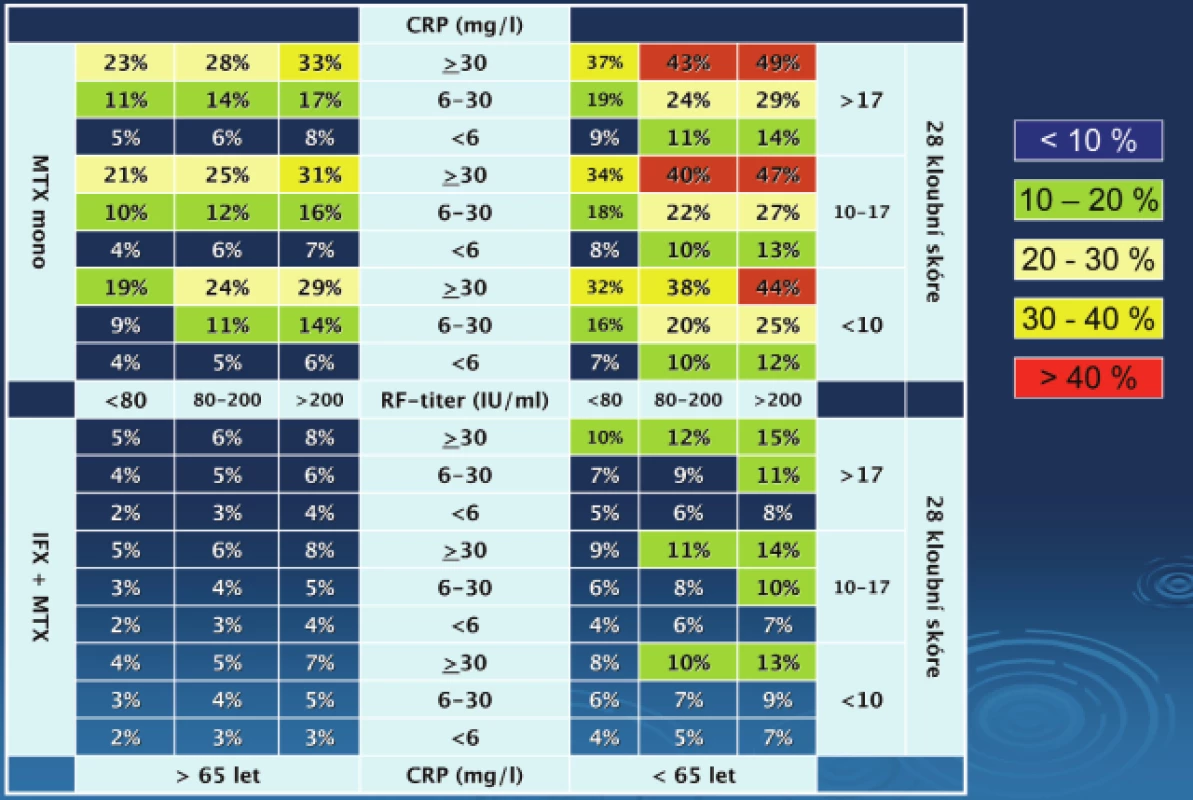
Matrixový model RRP etablovanou RA
Pro etablovanou (pozdní) revmatoidní artritidu byl model kalkulován na pacientských skupinách ze studie ATTRACT (21). Podle očekávání všichni pacienti, kteří dostávali konzervativní léčbu (MTX) měli tendenci k tomu, mít vysoké riziko RRP, nezávisle na hodnotě bazálních rizikových faktorů. Do větší míry než u skupiny pacientů ze studie ASPIRE byla u pacientů u pokročilé RA ve skupině ATTRACT snížená proporce pacientů s RRP po kombinované léčbě MTX plus infliximab než po MTX. Vysvětlením může být i horší efekt MTX u této skupiny, protože u většiny pacientů v ATTRACTu nešlo o nové nasazení MTX, nýbrž o pokračování v již zavedené léčbě.
Matrixový model predikce RRP založený na analýze pacientů s různým způsobem léčby RA (studie BEST)
Studie BEST (33) není klasickou lékovou studií, nýbrž studií různých strategií léčby RA. Po své publikaci se právem stala jednou z nejvíce citovaných prací vůbec. Studie byla provedena jako multicentrická, randomizovaná a otevřená. Celkem bylo zařazeno 465 pacientů s časnou RA. Aktivita RA byla hodnocena pomocí DAS 28 a pokud nebylo dosaženo klinické remise (DAS 28 méně než 2,4) bylo nutné provést změnu léčby. První skupina byla na monoterapii DMARD a při nedostatečném efektu byl jeden DMARD nahrazen jiným. Druhá skupina byla rovněž na monoterapii DMARD, ale při nedostatečném efektu nebylo DMARD vysazeno, ale bylo k němu přidáno do kombinace další DMARD (tzv. step up princip). Třetí skupina měla iniciálně kombinovanou léčbu více DMARD společně s vysokou dávkou prednisonu (tzv. step down, studie COBRA). Ve čtvrté skupině byl v iniciálním režimu s MTX používán infliximab. Za hranici RRP byla považována změna > Sharpových jednotek / rok. Prediktivní faktory byly hodnoceny pomocí logistické regresní analýzy.
Obr. 5. Matrixový model pro predikci rychlá rentgenové progrese u pacientů s různým typem léčby. 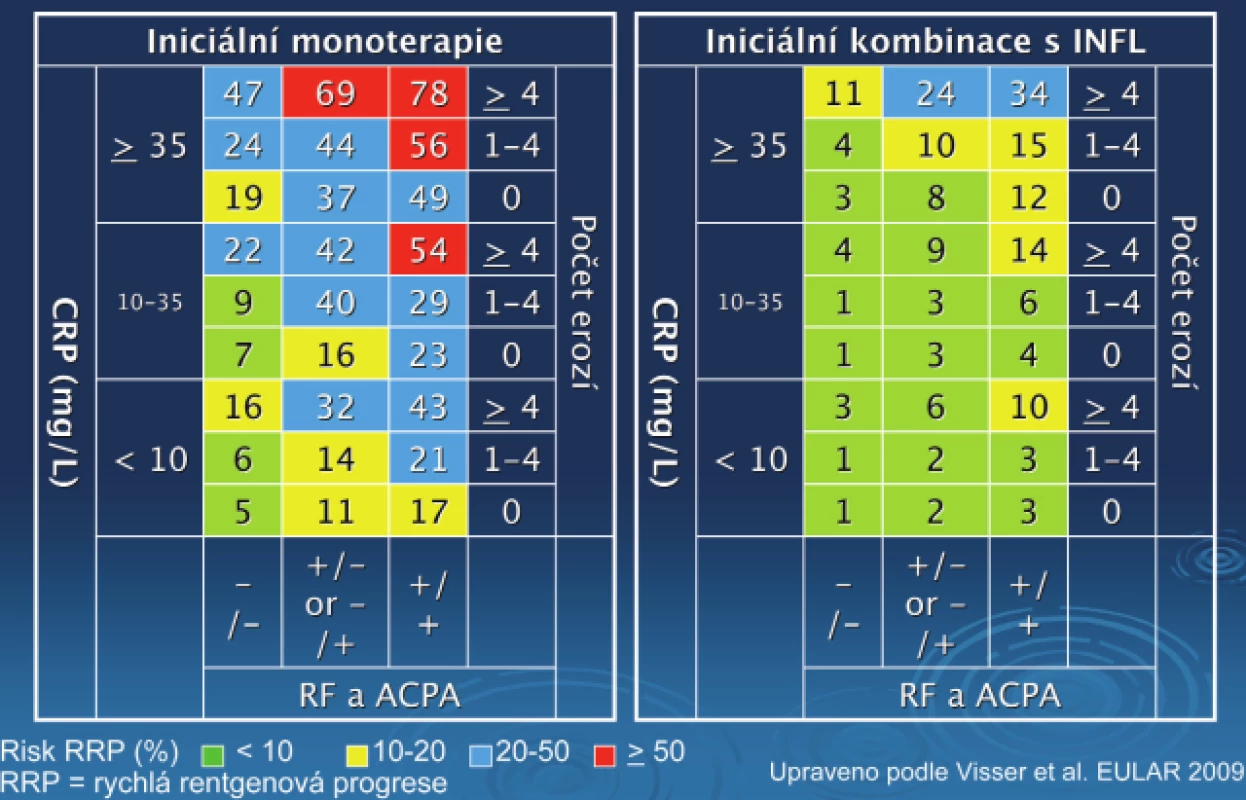
Obr. 6. Matrixový model pro predikci rychlá rentgenové progrese u pacientů s různým typem léčby. 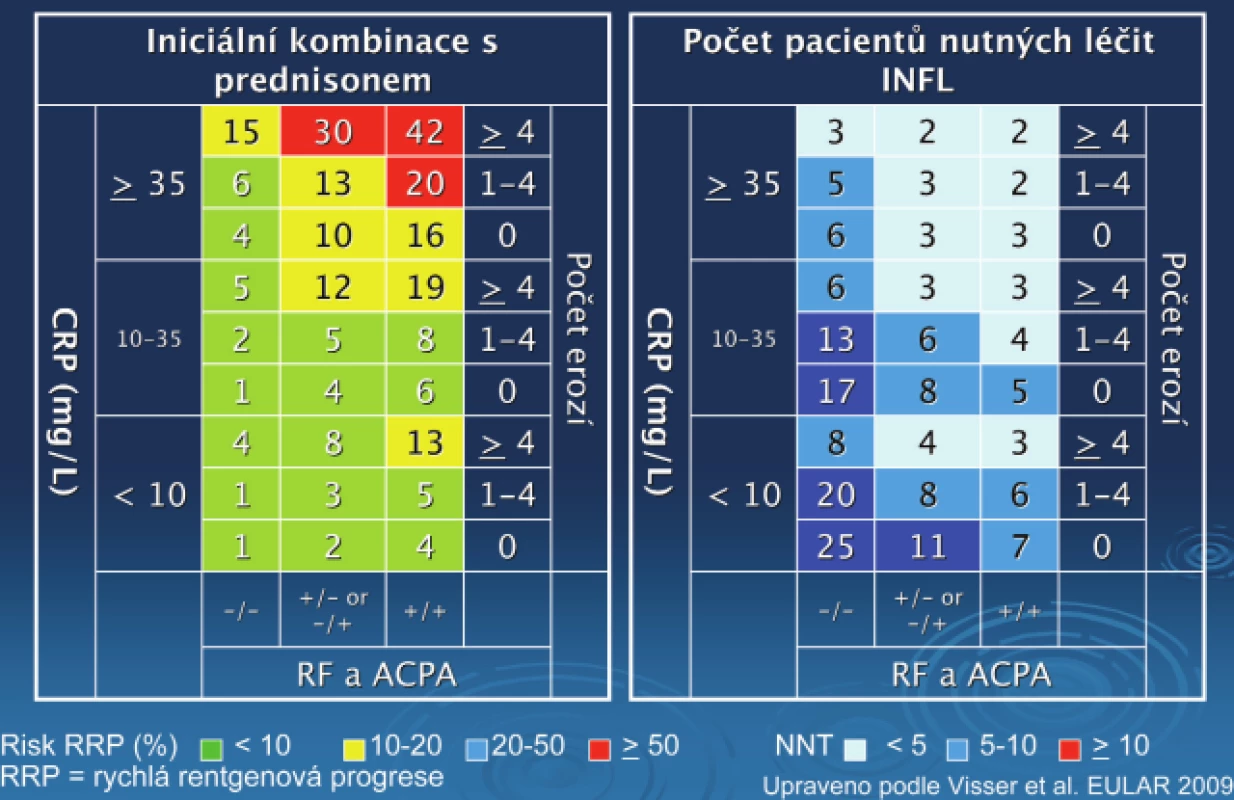
Přítomnost revmatoidních faktorů a/nebo anti CCP, C reaktivní protein (CRP), bazální skóre erozí a způsob léčby byly signifikantní, nezávislé prediktivní faktory RRP (definice RRP: > 5 Sharpových jednotek ročně). Při použití hraničních hodnot u < 20 % (nízké riziko) a > 50 % (vysoké riziko). Matrixový model ukazuje nízké riziko pro 23 % pacientů léčených iniciálně monoterapií (negat, pred. hodn. 91 %) a vysoké riziko pro 25 % těchto pacientů (obr. 5, 6). U obou skupin léčených kombinační léčbou bylo prediktivní RRP sníženo. Počet pacientů nutných léčit (NNT), aby se zabránilo 1 případu RRP byl ve skupině s vysokou aktivitou 2–3, ve skupině se střední aktivitou 3–6 a ve skupině s nízkou aktivitou 7–25.
Matrixový model vizualizuje rizikové faktory RRP u různých subpopulací časné RA. Ukazuje riziko nedostatečné i nadbytečné léčby (34).
Diskuse
Byly navrženy 2 matrixové modely pro predikci rizika rychlé rentgenové progrese. Unikátnost těchto modelů není v tom, že používají známé rizikové faktory progrese na začátku onemocnění, ale způsob, jakým jsou tyto rizikové faktory kombinovány a aranžovány do visuální matrix, ze které je možné vyčíst pravděpodobnost RRP pro individuálního pacienta. Provedená studie má ovšem i své limitace, které autoři v diskusi uvádějí. Jde především o fakt, že bylo možné používat pouze ukazatele, které byly hodnoceny ve studii ASPIRE, která primárně nebyla určena k vytváření modelu matrix pro rtg progresi. Nebyly hodnoceny některé novější biomarkery, které mohou být důležité pro progresi RA jako je MMP-3 (35) nebo IL 8, ze sérologických markerů pak např. HLA - DR sdílený epitop (36). Dále pak fakt, že anti CCP, které jsou považovány dnes za jeden z nejvýznamnějších rizikových faktorů nebyly u většiny pacientů v ASPIRE prováděny. Výzkum ukázal, že prognostický význam titrů RF, anti CCP nebo jejich kombinace je ale srovnatelný (37).
Druhý matrixový model je odvozen ze studie BEST a má výhodu v tom, že vyhodnocuje též význam strategie léčby pro RRP. Dále pak již vyhodnocuje u všech pacientů přítomnost anti CCP protilátek.
Navržené matrixové modely RRP je nutné považovat za první krok, ale v dalším vývoji bude nutné ověřovat tyto modely v dalších a větších populacích pacientů s RA a eventuálně zapracovat další novější ukazatele.
Prof. MUDr. Karel Pavelka Revmatologický ústav Na Slupi 4 128 50 Praha 2
Zdroje
1. Larsen A, Dale K, Eek M, et al. Radiographic evaluation of rheumatoid arthritis and related conditions by standard reference films. Acta Radiol (Diagn) 1977; 18 : 481–491.
2. Sharp JT, Young DY, Bluhm GB, et al. How many joints in the hands and wrists should be included in a score of radiologic abnormalities used to asses rheumatoid arthritis. Ann Rheum Dis; 28 : 1326–35.
3. Van der Heide D,van Riel P, et al. Biannual radiographic assessments of hands and feetin a free-year prospective follow up of patiens with early rheumatoid arthritis. Arthritis Rheum 1992; 35 : 26–34.
4. Gennat HK, Jiang Y, Peterfy C, et al.Assesssment of rheumatoid arthritis using a modified scoring method on digitized and originál radiographs. Artrhritis Rheum 1998; 41 : 1583–90.
5. Smolen JS, van der Heijde D, Aletaha D, et al. „Progression of radiographic joint damage in rheumatoid arthritis: Independence of erosions and joint space narrowing. Ann Rheum Dis 2008; doi:10.1136/ard.2008.094128.
6. Machold KP, Symmons TA. Very recent onset arthritis: clinical, laboratory and radiological findings during first year of disease. J. Rheumatol. 2002; 29 : 2278–87.
7. Hulsmans HM, Jacobs JWG, nav der Heijde D, et al. The course of radiologic damage during the first six years of rheumatoid arthritis. Artrhritis Rheum 2000; 43 : 1927–1940.
8. Graudal NA, Jurik AG, Carvalho A Radiographic progression in rheumatoid arthritis. Arthritis Rheum 1998; 41 : 1470–1480.
9. Strand V. Using estimated yearly progression rates to campare radiographic data across recent randomised controlled trials in rheumatoid arthritis. Ann Rheum Dis 2002; 61(Suppl. II): ii64–ii66.
10. Pavelka K, Gatterová J, Tegzová D, et al. Radiographic progression of rheumatoid arthritis in patiens from the Czech National Registry receiving infliximab treatment. Clinical and Experimental Rheumatology 2007; 25 : 540–545.
11. Welsing PMJ, Landewe RBM, van Riel PLCM, et al. The relationship between disease activity and radiologic progression in patiens with rheumatoid arthritis. Arthritis Rheum 2004; 50 : 2082–2093.
12. Syversen SW, Gaarder PL, Goll GL, et al. High anti cyclic citrulinated peptide levels and a algorithm of baseline parameters can predict radiograpic progression in patiens with rheumatoid arthritis: results from a 10 year longitudinal study. Ann Rheum Dis 2008; 67 : 212–217.
13. Lindquist E, Eberhardt K, Bendtzen K, et al. Prognostic laboratrory markers of joint damage in rheumatoid arthritis. Ann Rheum Dis 2005; 64 : 196–201.
14. de Vries Boustra J, Cessie S, Allart C, et al. Using predicted disease outcome to provide differentiated treatment of early rheumatoid arthritis. J Rheumatol 2006; 33 : 1747–1753.
15. Hetland ML, Ejbjerg B, Horslev Petersen K, et al. MRI bone oedema is the strongest predictor of subsequent radiographic progresssion in early rheumatoid arthritis. Results from a 2 year randnomised controlled trial. Ann Rheum Dis 2009; 68 : 384–390.
16. Schmidt WA Technology Insight: the role of color and power Doppler ultrasonography in rheumatology. Nat Clin Pract Rheumatol 2007; 335–42.
17. Naredo E, Bonilla G, Gampero F, et al. Assessment of inflammatory aktivity in rheumatoid arthritis: a comparative study of clinical evaluation with grey scale and power Doppler ultrasonography. Ann Rheum Dis 2005; 64 : 375–381.
18. Ostergaard M, Peterfy C, Conaghan P, et al. OMERACT rheumatoid arthritis magnetic resonance imaging studies. Core set of MRI acquisitions, joint patology definitions, and the OMERACT RA-MRI scoring systém. J Rheumatol 2003; 30 : 1385–1386.
19. Jones B, Halbert J, Crotty, et al.The effect of treatment on radiological progression in rheumatoid arthritis: a systematic review of randomized contolled trials. Rheumatology 2003; 42 : 6–13.
20. Korpela M, Leasonen L, Hannonen P, et al. Retardation of joint damage in patiens with early rheumatoid arthritis by initial aggressive treatment with disease modifying antirheumatic drugs: a five-year experience from FIN-RACO study. Arthritis Rheum 2004; 50 : 2072–81.
21. Lipsky PE, van der Heide DM, St.Clair EW, et al. Infliximab and methotrexate therapy of rheumatoid arthritis. N Engl J Rheumatol 2000; 343 : 1594–1602.
22. Klareskog, et al. TEMPO (Trial of Etanercept and Methotrexate with Radiographic Patient Outcomes) study investigator. Therapeutic efect of the combination of etanercept and methotrexate compared with each treatmetn alone in patients with rheumatoid arthritis: double-blind randomised controlled trial. Lancet 2004; 363 : 675–81.
23. Keystone, et al. Radiographic, clinical and functional outcomes of treatment with adalimumab (a human anti-tumor necrosis factor monoclonal antibody) in patients with active placebo-controlled, 52-week trial. Arthritis Rheum 2004; 50 : 1400–11.
24. Keystone EC, Genovese MC, Klareskog L. Golimumab, a human antibody to tumour necrosis factor (alpha) given by monthly subcutaneous injections, in active rheumatoid arthritis despite methotrexate therapy: the GO-FORWARD Study. Ann Rheum Dis 2009 Jun; 68(6): 789–96. Epub 2008 Dec 9.
25. Smolen JS, Keystone EC, Emery P, Breedveld FC. Consensus statement on the use of rituximab in patients with rheumatoid arthritis. Ann Rheum Dis 2007 Feb; 66(2):143–50. Epub 2006 Oct 26.
26. Weinblatt M, Combe B, Covucci A, Aranda R, et al. Safety of the selective costimulation modulator abatacept in rheumatoid arthritis patients receiving background biologic and nonbiologic disease-modifying antirheumatic drugs: A one-year randomized, placebo-controlled study. Arthritis Rheum 2006 Sep; 54(9): 2807–16.
27. Kremer JM, Fleischman RM, Halland AM: Tocilizumab inhibit structural damage in rheumatoid arthritis patiens with inadequate response to methotrexate. ACR 2008; Abstract L19.
28. St. Clair FW, van der Heide D, Smolen JS, et al. Combination of inliximab and methotrexate therapy for early rheumatoid arthritis: a randomized, controlled trial. Arthritis Rheum 2004; 50 : 3432–43.
29. Emery P, et al. Comparison of methotrexate monotherapy with combination of MTX and etanercept in active early, moderate to severe rheumatoid arthritis (COMET): a randomized, double-blind, parallel treatment trial. Lancet, 2008; doi:10.1016/s140–6736(08)61000–4.
30. Jamal S, Kaushnik P, Keystone EC, et al. Adalimumab response in patiens with early versus established rheumatoid arthritis: DE 019 randomized, controlled trial subanalysis. Clin Rheumatol 2009; 28 : 413–419.
31. Kirwan JR. The synovium in rheumatoid arthritis:evidence for (at least) two pathologies. Artrhritis Rheum 2004; 50 : 1–4.
32. Vastesaeger N, Xu Stephen, Aletaha D, et al. A pilot risk model for the prediction of rapid radiographic progression in rheumatoid arthritis. Rheumatology 2009; doi:10.1093(rheumatology)kep 155.
33. Goekoop-Ruiterman YP, De Vries Boustra JK, Alaart CF, et al. Clinical and radiographic outcomes fo four different treatement strategies in patiens with early rehumatoid artrhritis the BeST study: a randomized, controlled, trial. Artrhitis Rheum 2005; 52 : 3381–3390.
34. Visser K, Goekoop YPM - Ruiterman, De Vries Boustra JK, et al. A matrix model for prediction of rapid radiographic progression in rheumatoid arthritis patiens receiving different treatment strategies. Abstrakt EULAR 2009; Cobenhaven.
35. Visvanathan S, Marini JC, Smolen JC, et al. Changes in biomarkers of inflammation and bone turnover and associations with clinical efficacy following infliximab plus methotrexate therapy in poatients with early rehuamatoid arthritis. J Rheumatol 2007; 34 : 1465–74.
36. van Zeben D, Hazes JM, Zwindeman AH, et al. Association of HLA - DR4 s více agresivním průběhem nemoci u pacientů s revmatoidní artritidou. Artrhritis Rheum 1991; 34 : 822–30.
37. Nishimura K, Suplyyama D, Kogata Y, et al. Meta-analysis: diagtnostic accuracy of anticyclic citrulinated peptide and rheumatoid factor for rheumatoid arthritis. Ann Intern Med 2007; 146 : 797–808.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2010 Číslo 1- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Výhody subkutánně podávaného methotrexátu
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
-
Všetky články tohto čísla
- Asociace mezi svalovou hmotou a zlomeninami u pacientů s anamnézou juvenilní idiopatické artritidy
- Možnosti predikce rentgenové progrese revmatoidní artritidy
- Může stanovení sérového prokalcitoninu pomoci v diferenciální diagnóze mezi infekcí a akutním zhoršením u pacientů se systémovým autoimunitním onemocněním?
- Metodologické aspekty diagnostiky kognitivní dysfunkce u pacientů se systémovým lupus erytematodes
- ABSTRAKTA Z JÁCHYMOVSKÝCH REVMATOLOGICKÝCH DNÍ 9. – 11. prosince 2009
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Může stanovení sérového prokalcitoninu pomoci v diferenciální diagnóze mezi infekcí a akutním zhoršením u pacientů se systémovým autoimunitním onemocněním?
- Možnosti predikce rentgenové progrese revmatoidní artritidy
- ABSTRAKTA Z JÁCHYMOVSKÝCH REVMATOLOGICKÝCH DNÍ 9. – 11. prosince 2009
- Metodologické aspekty diagnostiky kognitivní dysfunkce u pacientů se systémovým lupus erytematodes
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



