-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Metodologické aspekty diagnostiky kognitivní dysfunkce u pacientů se systémovým lupus erytematodes
Methodological aspects of cognitive dysfunction diagnosis in patients with systemic lupus erythematosus
Systemic lupus erythematosus (SLE) is a chronic autoimmune disease with a broad spectrum of manifestations. Involvement of the nervous system is present in up to 80% of patients with SLE. Diagnosis of neuropsychiatric involvement (NPSLE) is very difficult with regard to a variety of clinical symptoms. Cognitive dysfunction (CD) is one of the most common manifestations of NPSLE. Its cause has not yet been entirely elucidated; a possible role of various autoantibodies, inflammatory mediators, vascular abnormalities, and neuropeptides has been discussed. Diagnosis of cognitive dysfunction is based on the testing of all substantial areas of cognitive functions: perception, attention, memory, motoric and verbal abilities, problem solving, and executive (controlling, also performing) functions (abilities to plan, act effectively, and achieve a goal) are evaluated.
Key words:
systemic lupus erythematosus, neuropsychiatric involvement, cognitive
Autoři: R. Svobodová 1; M. Pošmurová 1; P. Kozelek 2; M. Olejárová 1
Působiště autorů: Revmatologický ústav Praha, 2Psychiatrická klinika VFN Praha 1
Vyšlo v časopise: Čes. Revmatol., 18, 2010, No. 1, p. 42-47.
Kategorie: Přehledné referáty
Souhrn
Systémový lupus erytematodes (SLE) je chronické autoimunitní onemocnění se širokým spektrem klinických manifestací. Postižení nervového systému se objevuje až u 80 % pacientů se SLE. Diagnóza neuropsychiatrického postižení (NPSLE) je velmi obtížná vzhledem k rozmanitosti klinických projevů. Kognitivní dysfunkce (KD) je jednou z nejčastějších manifestací NPSLE. Příčina jejího vzniku není dosud zcela objasněna, uvažuje se o možné roli různých autoprotilátek, zánětlivých mediátorů, vaskulárních abnormalit a neuropeptidů. Diagnostika kognitivní dysfunkce je založena na testování všech podstatných oblastí kognitivních funkcí: hodnotí se percepce, pozornost, paměť, motorické a jazykové dovednosti, řešení problémů, exekutivní (řídící, též výkonové) funkce (schopnosti plánovat, účelně jednat a dosáhnout cíle).
Klíčová slova:
systémový lupus erytematodes, neuropsychiatrické postižení, kognitivní dysfunkceÚvod
Systémový lupus erytematodes (SLE) je chronické multisystémové autoimunitní onemocnění s četnými orgánovými manifestacemi a sérologickými abnormalitami. Spektrum klinických projevů je široké, kolísá od jemných příznaků k potenciálně letálním stavům s ireverzibilním orgánovým postižením.
Postižení nervového systému se objevuje až u 80 % pacientů se SLE (1) nezávisle na délce trvání onemocnění (2, 3). Značné rozdíly v udávané frekvenci 14–75 % (4) nejčastěji závisejí na diagnostických kritériích neuropsychiatrického postižení u SLE (NPSLE), sledované populaci, rozvržení studie a použitých analyzovaných protilátkách. Hlavními postiženými oblastmi jsou centrální a periferní nervový systém, autonomní systém a myoneurální spoje (5). Postižení centrálního nervového systému (CNS) převažuje, může být difuzní (např. psychóza nebo deprese) nebo fokální (např. transverzální myelitida nebo iktus) (6). Definitivní diagnóza NPSLE je velmi obtížná vzhledem k rozmanitosti klinických projevů a vzhledem k tomu, že není dosud žádný ukazatel, který by byl „zlatým standardem“ pro vyšetření NPSLE, takže diagnóza bývá primárně založena na klinickém obraze (7, 8).
Americká revmatologická společnost (The American College of Rheumatology = ACR) v roce 1999 stanovila 19 neuropsychiatrických syndromů asociovaných se SLE (9). Tyto definice zahrnují jednak neurologické syndromy postihující centrální a periferní nervový systém, ale i psychiatrické onemocnění, kognitivní deficity a akutní stavy zmatenosti (tab. 1).
Tab. 1. Neuropsychiatrické syndromy SLE definované ACR. 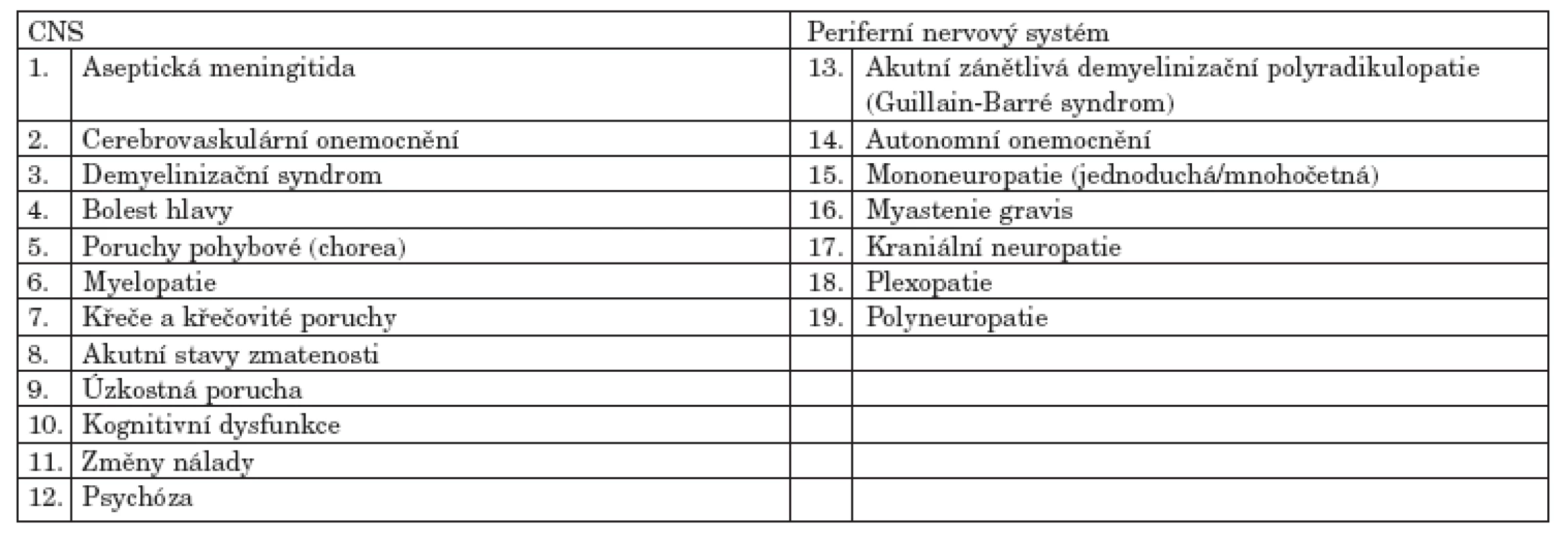
Patogeneze
Patogeneze NPSLE zůstává stále málo objasněna, ale je uznáváno, že tento stav je jednou z hlavních příčin mortality pacientů se SLE (10). Je pravděpodobné, že je do ní zapojeno více mechanismů (11).
Neuropsychiatrické projevy pacientů se SLE mohou být projevem primární manifestace onemocnění, sekundární manifestací komplikací onemocnění nebo komplikací terapie. Primární manifestace NPSLE pravděpodobně odráží směs patogenních mechanismů, které zahrnují vaskulární abnormality, přítomnost autoprotilátek a lokální produkci cytokinů (tab. 2).
Důležitost vaskulárních abnormalit u neuropsychiatrického lupusu podporují výsledky několika autoptických studií včetně klasické práce Johnstona a Richardsona staré více než 30 let (12). V těchto studiích byla hlavním nálezem mírná nezánětlivá vaskulopatie drobných cév. Ve studii Hanlyho a kol. (13) byly zase hlavními nálezy mikroinfarkty v mozkové tkáni v souvislosti s mikroangiopatií.
Z mnoha autoprotilátek, které byly u lupusu studovány, je největší zájem o antineuronální protilátky, ribosomy a fosfolipidy.
Data ze studií zkoumající antineuronální protilátky v patogeneze NPSLE jsou velice podrobné a zabývají se časovým vztahem mezi klinickými a sérologickými abnormalitami (14), přítomností autoprotilátek v cerebrospinálním moku (CSF) (15) a v omezené míře identifikací autoprotilátek v neuronální tkáni pacientů zemřelých na toto onemocnění (16). Přítomnost autoprotilátek v CSF u pacientů se SLE je přisuzována pasivnímu přenosu z cirkulace přes zvýšenou permeabilitu hematoencefalické bariéry (17) a jejich zvýšené intratekální produkci (14, 17).
Bluestein a kol. demonstrovali, že IgG antineuronální protilátky byly přítomny v mnohem vyšších koncentracích v cerebrospinálním moku pacientů s aktivním NPSLE než v CSF pacientů se SLE bez neuropsychiatrické manifestace (15).
Studie, které hledaly souvislost KD s antineuronálními protilátkami, přinesly rozporuplné výsledky (18, 19). Studie zkoumající asociaci mezi anti-NR2 protilátkami (protilátky proti N-methyl-D-aspartátovému receptoru [NMDA]) a NPSLE přinesly též protichůdné výsledky. Omdal et al. (20) prokázal asociaci mezi anti-NR2 protilátkami a zhoršením krátkodobé paměti a depresivní náladou. Jiné studie však tyto nálezy nepotvrdily (21–24). Nedávná studie prokázala, že zvýšené hladiny anti-NR2 protilátek v cerebrospinálním moku byly častější u pacientů s difuzním NPSLE, z nichž 12,5 % mělo kognitivní dysfunkci (25).
Antiribozomální-P (anti-P) protilátky byly prvně popsány u pacientů se SLE v roce 1985. V roce 1987 byly tyto protilátky asociovány s NPSLE, zvláště psychózou (26), později i s depresí (27). Ve studii Isshiho a kol., která sledovala 87 pacientů se SLE, byla nalezena signifikantní elevace cirkulujících anti-P protilátek u 34 pacientů s lupusovou psychózou, ale nebyla nalezena zvýšená hladina sérových antineuronálních protilátek. Naopak, vyšetření cerebrospinálního moku těchto pacientů odhalilo signifikantní zvýšení hladin antineuronálních protilátek, ale ne hladin anti-P protilátek (28).
Následující studie ale daly rozličné výsledky (27, 29, 30, 31), 2 nedávné mezinárodní multicentrické studie uskutečněné na velkém množství pacientů se SLE vedly dokonce k opačným výsledkům (32, 33). Nedávná studie Brianiho a kol. (1) publikovaná v tomto roce však prokázala až 51% výskyt protilátek proti P ribozomálním proteinům u pacientů s NPSLE, které byly přítomny jak v séru, tak v cerebrospinálním moku.
Protilátky proti P ribozomálním proteinům jsou tedy považované za vysoce specifické markery SLE a zdá se, že korelují s aktivitou onemocnění, jaterním, ledvinným a CNS postižením (34).
Asociace antiribozomálních P protilátek s kognitivní dysfunkcí nebyla dosud prokázána (18, 35).
Antifosfolipidové protilátky jsou asociovány hlavně s ložiskovou manifestací NPSLE. V přehledu více než 1000 pacientů se SLE Love a Santoro (36) popsali NP manifestaci u 38 % pacientů s lupusovým antikoagulans (LA) ve srovnání s 21 % pacientů bez antifosfolipidových protilátek. Nejčastější neurologická onemocnění byla vaskulárního původu. Hlavním patogenním mechanismem těchto protilátek u NPSLE je trombóza cév různých kalibrů a následná cerebrální ischémie. Prokoagulační stav může být navozen získanou rezistencí k proteinu C a proteinu S, agregací destiček a přímou aktivací endoteliálních buněk (37). Další studie nalezla korelaci mezi antifosfolipidovými protilátkami a poškozením paměti, kognitivní flexibility a psychomotorického tempa u pacientů se SLE, kteří neměli v minulosti žádné neuropsychiatrické příznaky (38).
Byla prokázána intratekální produkce antifosfolipidových protilátek u pacientů s NPSLE (17) a jejich asociace s difuzním kognitivním postižením (39, 40). V 5leté práci Hanlyho a kol. (39) a 2leté práci Menona a kol. (40) byla nalezena asociace mezi kognitivní funkcí a antikardiolipiny (aCL). Pacienti, kteří měli trvale pozitivní IgG aCL protilátky měli rychlejší pokles psychomotorického tempa ve srovnání s pacienty, kteří měli aCL negativní. Naopak, pacienti, kteří měli trvale pozitivní IgA aCL protilátky podávali signifikantně horší výkon v logickém myšlení a výkonnostních schopnostech. Tyto výsledky naznačují, že IgG a IgA aCL mohou být odpovědny za deterioraci kognitivních funkcí.
V posledních letech vzrůstá zájmem o studium prozánětlivých cytokinů v patogenezi NPSLE. Japonské studie prvně popsaly asociaci mezi zvyšující se intrakraniální produkcí interleukinu (IL)-6 s NPSLE, zvláště se záchvaty (41) a interferon-alfa s lupusovou psychózou (42). Následující studie poskytly další důkazy intratekální produkce IL-6 (43) a identifikovaly jiné potenciální cytokiny, jako je IL-10 (44), IL-2 (45) a IL-8 (43). Možnými zdroji intratekální produkce těchto cytokinů jsou neuronální (42, 46) a gliové buňky (41).
Jiné potenciálně důležité mediátory zánětu jsou matrixové metaloproteinázy (MMPs). MMP-9 hrají klíčovou roli v porušení hematoencefalické bariéry u pacientů s NPSLE, především u těch s kognitivní dysfunkcí, jsou jejich hladiny v séru (47) i CSF (48) zvýšené.
Z neuropeptidů a endokrinních faktorů je nejvíce studována role vasopresinu. Jeho zvýšené hladiny byly pozorovány u pacientů s kognitivní dysfunkcí (49).
Ze všech výše diskutovaných faktorů, které by mohly být potenciálně jednou z příčin KD u SLE, byla potvrzena souhlasná asociace KD (nezávisle na iktu) pouze s antifosfolipidovými protilátkami (39, 40).
Kognitivní dysfunkce
Kognitivní dysfunkce je jednou z nejčastějších manifestací NPSLE. Byla nalezena přibližně u 80 % pacientů se SLE (50, 51), Glanz a kol. (52) ve své práci zjistili kognitivní dysfunkci u 50 % pacientů bez předchozí anamnézy cévní mozkové příhody. Na základě shrnutí výsledků studií řady dalších autorů konstatovali výskyt této poruchy v rozmezí 21–81 % nemocných se SLE (51–54). K variacím v uvedeném výskytu dochází v důsledku odlišných vzorků zkoumaných osob, různých metod hodnocení kognitivních funkcí a rozdílných kritérií pro kognitivní poruchy.
Diagnostika kognitivní dysfunkce je založena na testování všech podstatných oblastí kognitivních funkcí: hodnotí se percepce, pozornost, paměť, motorické a jazykové dovednosti, řešení problémů, exekutivní (řídící, též výkonové) funkce (schopnosti plánovat, účelně jednat a dosáhnout cíle).
Hloubka kognitivního deficitu je značně variabilní – od mírného deficitu přes středně těžké postižení až po těžký deficit. Mírné a středně těžké kognitivní dysfunkce mezi SLE pacienty převažují a mohou uniknout detekci. Známky kognitivního postižení mohou být přítomny i bez jiných neuropsychiatrických projevů v minulosti či současnosti (55).
Je nutno si uvědomit, že již středně těžký deficit negativně ovlivňuje společenské a pracovní uplatnění nemocných (51, 56).
Mezi kognitivními poruchami převažují postižení paměti a koncentrace, poruchy verbální a neverbální paměti, pokles verbální výkonnosti, porušení visuálně prostorových schopností, pokles psychomotorického tempa a postižení kognitivní flexibility (57, 58). Ve studii Miguela a kol. (59) byla pozorována pozitivní korelace mezi kognitivní dysfunkcí a dobou trvání onemocnění, stejně jako mezi zhoršením kognitivního postižení a progresí onemocnění.
Možnosti diagnostiky kognitivní dysfunkce
Na vyšetření kognitivních dysfunkcí zatím neexistuje jednotné doporučení. V roce 1999 ACR sice navrhla oblasti, které by měly být vyšetřovány pro klinické i výzkumné účely a určila specifické testy (9), které byly následně validizovány, ale i když byly použity v několika recentních studiích (60, 61), nebyly univerzálně akceptovány.
V našich podmínkách můžeme k detekci kognitivní dysfunkce u pacientů se SLE použít baterii testů, sestavenou ze standardních neuropsychologických testů tak, aby postihovala úrovně základních kognitivních funkcí. Testovací soubor je zaměřen na posouzení psychomotorického tempa, pozornosti, paměti, vizuálně-prostorové orientace, řeči, schopnosti kategorizace a abstrakce.
Pro toto vyšetření jsou vhodné subtesty z Wechslerova inteligenčního testu pro dospělé (WAIS-R) (62), subtesty z Wechslerovy paměťové škály (WMS-III) (63), Reyova-Oesterriethova komplexní figura (TKF) (64) a Test cesty část A, část B (Trail Making Test – TMT A,B) (65).
WAIS-R Opakování čísel. Jde o jednoduchou paměťovou zkoušku, sledující kvalitu pozornosti – především její rozsah a kapacitu krátkodobé verbálně auditivní paměti, která je jednou z komponent tzv. pracovní paměti.
WAIS-R Číselné symboly. Hodnotí se psychomotorické tempo, vizuálně-motorická koordinace, schopnost mechanického učení a krátkodobé pracovní paměti, koncentrace pozornosti při jednoduché činnosti, mentální flexibilita.
WAIS-R Kostky. Zjišťuje se vizuálně-motorická koordinace a percepční organizace, průběh myšlenkových operací v prostoru (analýza a syntéza). Kostky se považují za jeden z nejlepších indikátorů mozkového poškození.
WAIS-R Podobnosti. Subtest měří úroveň vytváření pojmů, schopnost slovní generalizace a abstrakce (tedy pojmové a abstraktní myšlení).
WAIS-R Slovník. Zahrnuje vývoj a užívání řeči, sleduje pojmotvorné procesy, myšlenkové operace a ukládání informací do dlouhodobé paměti a jejich opětovné vybavování. Lze použít k odhadu premorbidní inteligence.
WMS-III. Logická paměť. Měří verbálně-auditivní paměť, schopnost zapamatovat si vyslechnuté krátké příběhy.
WMS-III Verbální párové asociace. Posuzuje se verbálně-auditivní paměť, schopnost zapamatovat si dvojice vyslechnutých navzájem nesouvisejících slov.
WMS-III Uspořádávání písmen a čísel. Subtest hodnotí pozornost, krátkodobou verbálně-auditivní paměť a mentální flexibilitu.
Test komplexní figury zkoumá vizuální paměť, schopnost vizuálně-prostorové percepční organizace. Příp. též ukazatel psychomotorického tempa.
Trail Making Test vyšetřuje psychomotorické tempo, pozornost a vizuálně-motorickou koordinaci. Obě části testu měří rychlost kognitivního zpracování informací, část B navíc i mentální flexibilitu. Podle údajů v literatuře (66, 67) část B zahrnuje též exekutivní funkce.
Nejvhodnější je následující pořadí administrace:
- Opakování čísel
- Uspořádávání písmen a čísel
- Logická paměť I (bezprostřední vybavení)
- TKF Kopie (kresba dle předlohy)
- TKF I (reprodukce po 3 minutách)
- Verbální párové asociace I (bezprostřední vybavení)
- TMT A
- TMT B
- Kostky
- Číselné symboly
- Logická paměť II (oddálené vybavení po 30 minutách)
- TKF II (reprodukce po 30 minutách)
- Verbální párové asociace II (oddálené vybavení po 30 minutách)
- Podobnosti
- Slovník
Vyšetření touto neuropsychologickou baterií je časově náročné, trvá v průměru kolem 1 1/2 hodiny.
Výkony pacientů ve všech testech jsou pak hodnoceny podle norem vytvořených pro zdravou populaci v závislosti na věku. Ve WAIS-R a WMS-III jsou dány profilovými skóré (PS), které vyjadřují výkon probanda v jednotlivých subtestech ve srovnání s populací jeho věkového pásma (průměr je 10, standardní odchylka SD 3). Profilové skóry v testu TKF je určováno podle norem Fastenaua et al. (68). V testu TMT, kde PS nejsou k dispozici, je stanovována velikost SD od průměru příslušné věkové skupiny – vychází se z tabulkových norem, vypracovaných Mitrushinou et al. (66) na základě metaanalýzy 28 studií.
U každého pacienta je získáno celkem 15 skóré vyjadřujících úrovně dotyčných kognitivních funkcí. Stupeň narušení je definován jako mírný kognitivní deficit (PS 8 a 7; SD –0,51 až –1,00),
středně těžký kognitivní deficit (PS 6, 5 a 4; SD –1,01 až –2,00), těžký kognitivní deficit (PS 3, 2 a 1; SD –2,01 až –5,00).
Mírný (sporný) kognitivní deficit odpovídá subnormnímu kognitivnímu oslabení, jde o subklinickou formu kognitivní poruchy. Středně těžký a těžký kognitivní deficit představují výraznější poruchy, které jsou klinicky relevantní.
Kognitivní dysfunkce je diagnostikována na základě dvou kritérií: poškození minimálně 1 funkce a významný pokles (nesporný – tj. středně těžký nebo těžký deficit).
Závěr
Poruchy nervového systému představují významný diagnostický a terapeutický problém v celkovém přístupu k pacientům se SLE. Faktory, které k tomu přispívají zahrnují extrémně široký rejstřík klinických manifestací, pro které zatím nebyly přijaté všeobecně uznávané definice, ne zcela objasněné patogenetické mechanismy vzniku NPSLE a nedostatek důkazů o specifických léčebných zásazích. Proto, že je tento stav jednou z hlavních příčin mortality pacientů se SLE, byla v posledních letech provedena řada studií, zabývající se touto problematikou.
Kognitivní dysfunkce je jednou z nejčastějších manifestací NPSLE. Známky kognitivního postižení mohou být přítomny i bez jiných neuropsychiatrických projevů v minulosti či současnosti. Vzhledem k tomu, že již středně těžký deficit negativně ovlivňuje společenské a pracovní uplatnění těchto nemocných, je nutné po projevech kognitivní dysfunkce aktivně pátrat, protože časná detekce KD by pomohla odhalit NPSLE a umožnit tak včasné zahájení imunosupresivní terapie. Neexistuje však zatím jednotné doporučení, jak tuto poruchu diagnostikovat a navíc jsou tato vyšetření velmi časově náročná. Bude třeba ještě další sledování těchto pacientů a dalších studií, které by i porovnávaly výsledky testů pacientů se SLE se zdravou populací.
Tento projekt byl podporován grantem č. NR/9290-3 MZ České republiky.
MUDr. Radka Svobodová Revmatologický ústav Na Slupi 4 128 50 Praha 2 e-mail: svobodova.r@revma.cz
Zdroje
1. Briani C, Lucchetta M, Ghirardello A, et al. Neurolupus is associated with anti-ribosomal P protein antibodies: An inception cohort study. Journal of Autoimmunity 2009; 32 : 79–84.
2. Denburg SD, Denburg JA, Carbotte RM, et al. Cognitive deficits in systemic lupus erythematosus. Rheum Dis Clin North Am 1993; 19 : 815–31.
3. West SG. Lupus and the central nervous system. Curr Opin Rheumatol 1996; 8 : 408–14.
4. Hanly JG. Evaluation of patients with CNS involvement in SLE. Clin Rheumatol 1998; 32 : 329–332.
5. Khoshbin S, Glanz BI, Schur PH. Neuropsychiatric syndromes in systemic lupus erythematosus: a new look. Clin Exp Rheumatol 1999; 17 : 395–8.
6. Bruns A, Meyer O. Neuropsychiatric manifestations of systemic lupus erythematosus. Joint Bone Spine 2006; 73 : 639–45.
7. Rood MJ, Breedveld FC, Huizinga TW. The accuracy of diagnosing neuropsychiatric systemic lupus erythematosus in a series of 49 hospitalized patients. Clin exp Rheumatol 1999; 17 : 395–8.
8. Gerli R, Caponi L, Tincani A, et al. Clinical and serological associations of ribosomal P protein autoantibodies in systemic lupus erythematosus: prospective evaluation in a large cohort of Italian patients. Rheumatology 2002; 41 : 1357–66.
9. ACR ad hoc committee on neuropsychiatric lupus nomenclature „The American College og Rheumatology nomenclature and case definitions for neuropsychiatric lupus syndromes“. Arhtitis Rheum 1999; 42 : 599–608.
10. Magalhaes MG, Silva LM, Voltarelli JC, et al. Lymphocytotoxic antibodies in systemic lupus erythematosus are associated with disease activity irrespective of the presence of neuropsychiatric manifestations. Scand J Rheumatol 2007; 36 : 442–447.
11. Kang EH, Shen GQ, Morris R. Flow cytometric assessment of anti-neuronal antibodies in central nervous system involvement of systemic lupus erythematosus and other autoimmune diseases 2008; 17 : 21–25.
12. Johnson RT, Richardson EP: The neurological manifestations of systemic lupus erythematosus. Medicine (baltimore) 1968; 47 : 337–369.
13. Hanly JG, Walsh NM, Sangalang V. Brain pathology in systemic lupus erythematosus. J Rheumatol 1992; 19 : 732–41.
14. Weiner SM, Klein R, Berg PA. A longitudinal study of autoantibodies against central nervous system tissue and gangliosides in connective tissue diseases. Rheumatol Int 2000; 19 : 83–88.
15. Bluestein HG, Williams GW, Steinberg AD. Cerebrospinal fluid antibodies to neuronal cells: association with neuropsyschiatric manifestations of systemic lupus erythematosus. Am J Med 1981; 70 : 240–246.
16. Zvaifler NJ, Bleustein HG. The pathogenesis of central nervous system menifestations of systemic lupus erythematosus. Arthritis Rheum 1982; 25 : 862–866.
17. Martinez-Cordero E, Garcia BE, Leon DE. Anticardiolipin antibodies in serum and cerebrospinal fluid from patients with systemic lupus erythematosus. J Invest Allergol Clin Immunol 1997; 7 : 596–601.
18. Hanly JG, Walsh NM, Fisk J, et al. Cognitive impairment and autoantibodies in systemic lupus erythematosus. Br J Rheumatol 1993; 32 : 291–6.
19. Denburg SD, Carbotte RM, Denburg JA. Cognitive impairment in systemic lupus erythematosus: a neuropsychological study of individual and group deficits. J Clin Exp Neuropsychol 1987; 9 : 323–39.
20. Omdal R, Brokstad K, Waterloo K, et al. Neuropsychiatric disturbances in SLE are associated with antibodies against NMDA receptor. Eur J Neurol 2005; 12 : 392–8.
21. Lapteva L, Nowak M, Yarboro CH, et al. Anti-N-methyl-D-aspartate receptor antibodies, cognitive dysfunction, and depression in systemic lupus erythematosus. Arthritis Rheum 2006; 54 : 2505–14.
22. Hanly JG, Robichaud J, Fisk JD. Anti-NR2 glutamate receptor antibodies and cognitive function in systemic lupus erythematosus. J Rheumatol 2006; 33 : 1553–8.
23. Harrison MJ, Ravdin LD, Lockshin MD. Relationship between serum NR2a antibodies and cognitive dysfunction in systemic lupus erythematosus. Arthritis rheum 2006; 54 : 2515–22.
24. Steup-Beekman G, Steens S van Buchem M, et al. Anti-NMDA receptor autoantibodies in patients with systemic lupus erythematosus and their first-degree relatives. Lupus 2007; 16 : 329–34.
25. Arinuma Y, Yanagida T, Hirohata S. Association of cerebrospinal fluid anti-NR2 glutamate receptor antibodies with diffuse neuropsychiatric systemic lupus erythematosus. Arthritis Rheum 2008; 58 : 1130–5.
26. Bonfa E, Golombek SJ, Kaufman LD, et al. Association between lupus psychosis and ant-ribosomal P protein antibodies. N engl J Med 1987; 317 : 265–271.
27. Teh LS, Isenberg DA. Antiribosomal P protein antibodies in systemic lupus erythematosus. A reappraisal Arthritis Rheum 1994; 37 : 307–315.
28. Isshi K, Hirohata S. Differential roles of the anti-ribosomal P antibody in the pathogenesis of central nervous systém involvement in systemic lupus erythematosus. Arthritis Rheum 1998; 41 : 1819–1827.
29. Sato T, Uchiumi T, Ozawa T, et al. Autoantibodies against ribosomal proteins found with high frequency in patients with systemic lupus erythematosus with active disease. J Rheumatol 1991; 18 : 1681–4.
30. Chindalore V, Neas B, Reichlin M. The association between anti-ribosomal P antibodies and active nephritis in systemic lupus erythematosus. Clin Immunol Immunopathol 1998; 87 : 292–6.
31. Yoshio T, Hirata D, Onda K, et al. Antiribosomal P protein antibodies in cerebrospinal fluid are associated with neuropsychiatric systemic lupus erythematosus. J Rheumatol 2005; 32 : 34–9.
32. Karassa FB, Afeltra A, Ambrozic A, et al. Accuracy of anti-ribosomal P protein antibody testing for the diagnosis os neuropsychiatric systemic lupus erythematosus: an international meta-analysis. Arthritis Rheum 2006; 54 : 312–24.
33. Hanly JG, Urowitz MB, Siannis F, et al. Autoantibodies and neuropsychiatric events at the time of systemic lupus erythematosus diagnosis: results from an international inception cohort study. Arthritis Rheum 2008; 58 : 843–53.
34. Toubi E, Shoenfeld Y. Clinical and biological aspects of anti-P-ribosomal protein autoantibodies. Autoimmun Rev 2007; 6 : 119–25.
35. Kozora E, Thompson LL, West SG, et al. Analysis of cognitive and psychological deficits in systemic lupus erythematosus patients without overt central nervous systém disease. Arthritis Rheum 1996; 39 : 2035–45.
36. Love PE, Santoro SA: Antiphospholipid antibodies: anticardiolipin and the lupus anticoagulant in systemic lupus erythematosus (SLE) and in non-SLE disorders. Prevalence and clinical significance. Ann Intern Med 1990; 112 : 682–98.
37. Petri M. Pathogenesis and treatment of the antiphospholipid antibody syndrome. Med Clin North Am 1997; 81 : 151–77.
38. Denburg SD, Carbotte RM, Denburg JA. The relationship of antiphospholipid antibodies to cognitive function in patients with systemic lupus erythematosus. J Int Neuropsychol Soc 1997; 3 : 377–86.
39. Hanly JG, Hong C, Smith S, et al. A prospective analysis of cognitive function and anticardiolipin antibodies in systemic lupus erythematosus. Arthritis Rheum 1999; 42 : 728–34.
40. Menon S, Jameson-Shortall E, Newman SP, et al. A longitudinal study of anticardiolipin antibody levels and cognitive funcioning in systemic lupus erythematosus. Arthritis Rheum 1999; 42 : 735–41.
41. Hirohata S, Miyamoto T. Elevated levels of interleukin-6 in cerebrospinal fluid from patients with systemic lupus erythematosus and central nervous system involvement. Arthritis Rheum 1990; 33 : 644–9.
42. Shiozawa S, Kuroki Y, Kim M, et al. Interferon-alfa in lupus psychosis. Arthritis rheum 1992; 35 : 417–22.
43. Trysberg E, Carlsten H, Tarkowski A. Intrathecal cytokines in systemic lupus erythematosus with central nervous system involvement. Lupus 2000; 9 : 498–503.
44. Rood MJ, Keijsers V, van der Linden MW, et al. Neuropsychiatric systemic lupus erythematosus is associated with imbalance in interleukin 10 promoter haplotypes. Ann Rheum Dis 1999; 58 : 85–9.
45. Gilad R, Lampl Y, Eshel Y, et al. Cerebrospinal fluid soluble interleukine-2 receptor in cerebral lupus. Br J Rheumatol 1997; 36 : 190–93.
46. Hirohata S, Hayakawa K. Enhanced interleukin-6 messenger RNA expression by neuronal cells in a patient with neuropsychiatric systemic lupus erythematosus. Arthritis Rheum 1999; 42 : 2729–30.
47. Ainiala H, Hietaharju A, Dastidar P, et al. Increased serum matrix metalloproteinase 9 levels in systemic lupus erythematosus patients with neuropsychiatric manifestations and brain magnetic resonance imaging abnormalities. Arthritis Rheum 2004; 50 : 858–65.
48. Trysberg E, Blennow K, Zachrisson O. Intrathecal levels of matrix metalloproteinases in systemic lupus erythematosus with central nervous system engangement. Arthritis Res Ther 2004; 6: R551–6.
49. Lapteva L, Yarboro CH. Roebuck-Spencer T, et al. Cognitive dysfunction and serum neuropeptides in systemic lupus erythematosus [abstract]. Arthritis Rheum 2006; 54: Suppl 9: S293.
50. Ainiala H, Hietaharju A, Loukkola J, et al. Validity of the new American College of Rheumatology criteria for neuropsychiatric lupus syndromes: a population-based evaluation. Arthirits Rheum 2001; 45 : 419–23.
51. Brey RL,Holliday SL, Saklad AR, et al. Neuropsychiatric syndromes in lupus. Prevalence using standardized definitions. Neurology 2002; 58(8): 1214–20.
52. Glanz BI, Schur PH, Lew RA, Khoshbin S. Lateralized cognitive dysfunction in patients with systemic lupus erythematosus. Lupus 2005; 14(11): 896–902.
53. Hanly JG, Liang MH. Cognitive disorders in systemic lupus erythematosus. Epidemiologic and clinical issues. Ann N Y Acad Sci 1997; 823 : 60–8.
54. Denburg SD, Denburg JA. Cognitive dysfunction and antiphospholipid antibodies in systemic lupus erythematosus. Lupus 2003; 12 : 883–90.
55. Denburg SD, Carbotte RM, Denburg JA. Psychological aspects of systemic lupus erythematosus: cognitive function, mood, and self-report. J Rheumatol 1997; 24 : 998–1003.
56. Tůma I. Schizofrenie a kognitivní funkce. Psychiatrické centrum Praha, 1999.
57. Kozora E, Laudenslager M, Lemieux A, et al. Inflammatory and hormonal measures predict neuropsychological functioning in systemic lupus erythematosus and rheumatoid arthritis patients. J Int Neuropsychol soc 2001; 7 : 745–54.
58. Fisk J, eastwood B, Sherwood G, et al. Patterns of cognitive impairment in patients with systemic lupus erythematosus. Br J Rheumatol 1993; 33(Suppl): S103.
59. Miguel EC, Pereira RM, Pereira CA, et al. Psychiatric manifestations of systemic lupus erythematosus: clinical features, symptoms, and signs of central nervous system activity in 43 patients. Medicine 1994; 73 : 224–32.
60. Kozora E, Ellison MC, West S. Depression, fatigue, and pain in systemic lupus erythematosus (SLE): relationship to the American College of Rheumatology SLE neuropsychological battery. Arthritis Rheum 2006; 55 : 628–35.
61. Harrison MJ, Morris KA, Horton R, et al. Results of intrevention for lupus patients with self-perceived cognitive difficulties. Neurology 2005; 65 : 1325–7.
62. WAIS-R. Wechslerův inteligenční test pro dospělé. Příručka. Autoři českého manuálu Říčan P, Šebek M, Vágnerová M. Psychodiagnostické a didaktické testy, Bratislava, 1983.
63. WMS-III. Wechslerova paměťová škála – třetí vydání. Technická příručka pro WAIS-III a WMS-III. Příručka pro administrování a skórování WMS-III. Experimentální verze. Překlad z angličtiny. Psychodiagnostika, Brno, 1999.
64. Reyova-Oesterriethova komplexní figura – TKF. Příručka k testu. Autoři českého manuálu Košč M, Novák J. Psychodiagnostika, Brno, 1997.
65. Test cesty. Trail Making Test. Příručka pro děti i dospělé. Autoři českého manuálu Preiss M, Preiss J, Panamá J. Psychodiagnostika, Brno, 1997. (Autoři testu Reitan R, Volfsonová D).
66. Mitrushina M, Boone KB, Razani J, DęElia LF. Handbook of Normative Data for Neuropsychological Assessment. Second Edition. Oxford University Press, 2005.
67. Preiss M, Rodriguez M, Kawaciuková R, Laing H. Neuropsychologická baterie Psychiatrického centra Praha. Klinické vyšetření základních kognitivních funkcí. 2., přepracované vydání. Psychiatrické centrum Praha, 2007.
68. Fastenau PS, Denburg NL, Hufford BJ. Adult norms for the Rey-Oesterrieth Complex Figure Test and for supplemental recognition and matching trials from the extended Complex Figure Test. The Clinical Neuropsychologist 1999; 13(1): 30–47.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2010 Číslo 1- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Asociace mezi svalovou hmotou a zlomeninami u pacientů s anamnézou juvenilní idiopatické artritidy
- Možnosti predikce rentgenové progrese revmatoidní artritidy
- Může stanovení sérového prokalcitoninu pomoci v diferenciální diagnóze mezi infekcí a akutním zhoršením u pacientů se systémovým autoimunitním onemocněním?
- Metodologické aspekty diagnostiky kognitivní dysfunkce u pacientů se systémovým lupus erytematodes
- ABSTRAKTA Z JÁCHYMOVSKÝCH REVMATOLOGICKÝCH DNÍ 9. – 11. prosince 2009
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Může stanovení sérového prokalcitoninu pomoci v diferenciální diagnóze mezi infekcí a akutním zhoršením u pacientů se systémovým autoimunitním onemocněním?
- Možnosti predikce rentgenové progrese revmatoidní artritidy
- ABSTRAKTA Z JÁCHYMOVSKÝCH REVMATOLOGICKÝCH DNÍ 9. – 11. prosince 2009
- Metodologické aspekty diagnostiky kognitivní dysfunkce u pacientů se systémovým lupus erytematodes
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




