-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam nových cytokinů v patogenezi revmatických onemocnění
Autoreferát disertační práce
Significance of new cytokines in the pathogenesis of rheumatic diseases
Summary of the PhD thesisBackground:
An imbalance between pro - and anti-inflammatory cytokine activities favors the induction of autoimmunity, chronic inflammation and joint damage in patients with rheumatoid arthritis (RA). Adipokines are bioactive proteins that are important regulators of inflammation. IL-35 is a new cytokine involved in the inflammatory processes in mouse models and is of unknown function in humans. The aim of the work was to study the levels and role of several adipokines and IL-35 in the joint and blood compartment and the association with the disease activity in patients with RA or other rheumatic diseases.Results:
We found increased levels of adiponectin in serum of patients with erosive osteoarthritis (OA) of the hand, differential regulation of new adipokines vaspin and omentin in synovial fluid of patients with RA compared with OA and the effect of therapy using TNFα inhibitor on the expression profile of adipokines in subcutaneous adipose tissue of RA patients. B cell depletion therapy in RA resulted in decrease of serum levels of visfatin that correlated with following change of disease activity. The levels of IL-35 in synovial fluid are significantly higher in RA than in OA and correlate with the disease activity and functional status. IL-35 subunits p35 and EBI3 are overexpressed in RA synovial tissue than that in OA. IL-35 is increased at transcriptional and protein levels after stimulation with proinflammatory cytokine TNFα in RA synovial fibroblasts and peripheral blood mononuclear cells (PBMC). IL-35 induces release of some inflammatory mediators in PBMC.Conclusion:
Our results show the role of adipokines and IL-35 in inflammation in patients with rheumatic diseases and the association with disease activity in RA. Thus, the discovery of new therapeutic targets would be beneficial for patient resistant to current therapy.Key words:
Rheumatoid arthritis, adipokines, IL-35
Autoři: M. Filková
Působiště autorů: 1. lékařská fakulta Univerzity Karlovy v Praze
Vyšlo v časopise: Čes. Revmatol., 21, 2013, No. 1, p. 14-28.
Kategorie: Referát
Souhrn
Nerovnováha mezi aktivitou pro - a protizánětlivých cytokinů u revmatoidní artritidy (RA) přispívá ke vzniku imunitní dysregulace, chronického zánětu a následné kloubní destrukce. Adipokiny jsou bioaktivní proteiny, které se kromě jiného podílejí na regulaci zánětu. IL-35 je nový cytokin s dosud neznámou funkcí u lidí, který je podle výsledků u myších modelů důležitou součástí zánětlivých procesů. Cílem práce bylo zjistit hladiny a úlohu vybraných adipokinů a IL-35 v kloubním a systémovém kompartmentu a vztah k aktivitě nemoci u pacientů s RA a jiným revmatickým onemocněním.
Výsledky:
Prokázali jsme zvýšené sérové hladiny adiponectinu u pacientů s erozivní osteoartrózou (OA) kloubů rukou, rozdílné koncentrace nových adipokinů vaspinu a omentinu v synoviální tekutině pacientů s RA a OA. Dále jsme zjistili vliv biologické léčby TNFα inhibitorem na expresní profil adipokinů v tukové tkáni pacientů s RA. Biologická léčba rituximabem vedoucí k depleci B lymfocytů způsobila pokles sérových hladin visfatinu u RA. Změna hladin visfatinu navíc předurčovala změnu aktivity nemoci v době, kdy by se měla podat další infuze biologického léku. Vyšší hladiny IL-35 v synoviální tekutině u pacientů s RA ve srovnání s OA korelovaly s parametry aktivity nemoci. IL-35 podjednotky p35 a EBI3 jsou zvýšené v RA synoviální tkáni. IL-35 je na genové i proteinové úrovni indukován prozánětlivým TNFα v RA synoviálních fibroblastech a periferních mononukleárních buňkách (PBMC). IL-35 vede v PBMC k uvolnění několika zánětlivých mediátorů.Závěr:
Výsledky našich studií prokázaly význam adipokinů a IL-35 při regulaci zánětu u revmatických onemocnění a jejich vztah k aktivitě nemoci u pacientů s RA. Objasnění patogeneze RA a nalezení nových potenciálních terapeutických cílů by mohlo přispět k zlepšení klinického průběhu u pacientů rezistentních na dosavadní léčbu.Klíčová slova:
Revmatoidní artritida, adipokiny, IL-35ÚVOD
Revmatoidní artritida (RA) je systémové zánětlivé autoimunitní onemocnění, které se vyskytuje u 0,5–1 % dospělé populace a může vést k ireverzibilnímu poškození a doživotnímu funkčnímu omezení. Hlavním znakem RA je hyperplazie synoviální kloubní výstelky, lokální/systémový zánět a destrukce kloubní chrupavky a kosti.
Aktivace synoviální tkáně u RA je řízena komplikovanou sítí autokrinních a parakrinních faktorů, součástí které jsou prozánětlivé cytokiny, dráhy nezávislé na cytokinech (TLR, endogenní retrovirové elementy), chemokiny, růstové faktory, adhezní molekuly a matrixové metalloproteinázy (MMP) (1, 2). To vede v konečném důsledku k degradaci kloubní chrupavky, následnému zúžení kloubní štěrbiny a ke vzniku kostních erozí.
RA se stává onemocněním, kde díky extenzivnímu výzkumu molekulárních mechanismů patogeneze dochází k uplatnění nejmodernějších léčebných modalit. Současně dostupné biologické léky, které jsou zaměřeny cíleně proti cytokinům (TNFα, IL-1, IL-6) a buňkám imunitního systému (B a T lymfocyty), významně přispívají k lepšímu průběhu onemocnění. U části pacientů je stále léčebná odpověď nedostatečná a u velkého počtu není šance na dosažení remise. Pokrok ve výzkumu patogeneze RA významně přispěl k objevu dalších potenciálních terapeutických cílů, jejichž ovlivnění by mohlo být prospěšné i pro tuto skupinu pacientů (3).
Osteoartróza (OA), která je charakterizována nerovnováhou mezi syntézou a degradací makromolekul kloubní chrupavky a obecně se označuje jako nezánětlivé onemocnění. Pouze erozivní forma OA drobných kloubů rukou (EOA) je definována jako „zánětlivá“, což dokazují nejenom klinické příznaky, ale i výsledky konvenčního rentgenového zobrazení, kostní scintigrafie, sonografie, magnetické rezonance, histopatologické změny a laboratorní nálezy (4).
Adipokiny jsou bioaktivní mediátory uvolňované tukovou, ale i jinou tkání. Na jejich tvorbě se podílí adipocyty a ostatní buňky tvořící stroma, včetně imunitních buněk (5). Patří k nim leptin, adiponectin, resistin, visfatin, nově popsané adipokiny např. vaspin a omentin a dále skupina „klasických“ cytokinů jako jsou TNFα, IL-1β, IL-6 a MCP-1. Kromě regulace energetického metabolismu se účastní fyziologických a patofyziologických procesů, včetně regulace imunitního systému a zánětlivé odpovědi a mají důležitou roli i v patogenezi některých revmatických onemocnění, kterými jsou například RA a OA (6, 7).
IL-35, heterodimer složený z řetězců p35 (IL-12a) a EBI3 (IL-27b), je cytokin potřebný k maximální regulační aktivitě myších T regulačních buněk (Treg) a vykazuje imunosupresivní vlastnosti v experimentálním modelu zánětlivého střevního onemocnění a kolagenem indukované artritidy (8, 9). Obě podjednotky p35 i EBI3 jsou přítomny v místech zánětu lidského aterosklerotického plátu a jsou indukovány několika zánětlivými mediátory (10). Zatímco je exprese p35 podobně regulována u myší jako u člověka, exprese EBI3 se významně liší a některé práce naopak poukazují na fakt, že podjednotka EBI3 není lidskými Treg tvořena vůbec (11). Je proto možné, že i funkce samotného IL-35 se mezi oběma druhy může významně lišit.
CÍLE PRÁCE
Cílem mojí disertační práce bylo alespoň částečně odpovědět na tyto otázky:
- Jakým způsobem mohou již dříve popsané adipokiny přispívat k lokálnímu a celkovému zánětu u revmatoidní artritidy a jiných revmatických onemocnění?
- Jakou roli u revmatoidní artritidy mají nové, doposud jen málo prostudované cytokiny?
- Jaké jsou hladiny těchto cytokinů v kloubním a systémovém kompartmentu?
- Mají tyto molekuly vztah k aktivitě nemoci a jejímu průběhu?
METODIKA
Stanovení adipokinů u pacientů s revmatickými nemocemi (přehled metodiky z publikovaných prací)
Pacienti
Sérové hladiny adipokinů adiponectinu, resistinu, visfatinu, vaspinu a omentinu byly stanovovány podle typu studie buď v séru, nebo synoviální tekutině anebo podkožní tukové tkáni u pacientů s revmatickými nemocemi. Pacienti s RA a OA splňovali ACR kritéria pro diagnózu RA anebo kritéria pro OA kolenních kloubů, respektive OA drobných ručních kloubů, pacienti s EOA měli navíc známky erozí (12–14). Každý účastník před zařazením do výzkumu podepsal informovaný souhlas schválený etickou komisí.
Zobrazovací metody
U pacientů s EOA a s neerozivní OA rukou byl k dispozici rentgenový snímek kolenních a kyčelních kloubů, byla provedena sonografie kolenních kloubů a trojfázová kostní scintigrafie s aplikací injekčního bolusu Tc-99m metylén difosfonátu do kubitální žíly.
Měření vybraných biologických markerů
Hladiny adipokinů, faktoru aktivujícího B lymfocyty BAFF, cytokinů TNFα, IL-1β a IL-6 a protilátek proti cyklickým citrulinovaným peptidům (ACPA) a revmatoidnímu faktoru IgM RF byly měřeny metodou ELISA podle doporučení výrobce. Profil periferních mononukleárních buněk (PBMC) byl analyzován metodou průtokové cytometrie za použití příslušných protilátek.
Statistická analýza
Pro porovnání hodnot mezi 2 skupinami byl použit Mann-Whitney U-test nebo t-test, pro porovnání sledovaných hodnot mezi 3 skupinami Kruskal-Wallisův test. Ke zjištění korelací byl použit Spearmanův nebo Pearsonův korelační koeficient. Aplikace příslušných statistických testů závisela od normality rozložení jednotlivých skupin. Hodnoty p menší než 0,05 byly považovány za statisticky významné. Složitější statistická zpracování jsou blíže uvedena v jednotlivých publikacích.
IL-35 v patogenezi RA
Pacienti
Studie se zúčastnilo 46 pacientů s RA, 43 s OA kolenního kloubu, kteří splnili ACR kritéria pro diagnózu RA (12) anebo kritéria pro OA kolenního kloubu (13) a 34 zdravých kontrol. Aktivita RA byla stanovena pomocí skóre DAS28 a fukční stav byl zjišťován pomocí dotazníku HAQ (Health Assessment Questionnaire) u pacientů s RA a WOMAC (Western Ontario and McMaster Universities Arthritis Index) u pacientů s OA. Každý účastník před zařazením do výzkumného projektu podepsal informovaný souhlas schválený etickou komisí.
Tkáňové kultury a in vitro experimenty
Periferní mononukleární buňky (PBMC) od zdravých dárců byly izolovány standardní gradientovou centrifugací. RA synoviální fibroblasty (RASF) byly získány ze vzorků synoviální tkáně od pacientů s RA, kteří podstoupili operaci pro kloubní náhradu. Buňky byly stimulovány TNFα (R&D Systems) a IL-35:Fc humánním rekombinantním proteinem (ALEXIS Biochemicals, Enzo Life Sciences). Buněčné lyzáty a kultivační média byla až do použití skladována při teplotě -80°C.
Real Time PCR
Po izolaci celkové RNA použitím MagNA Pure Compact RNA Isolation Kit (Roche Diagnostics) a reverzní transkripci (Applied Biosytems) následovala analýza genové exprese metodou PCR reakce v reálném čase (RT-PCR) a použitím TaqMan genových esejí (Applied Biosytems). Výsledky byly analyzovány metodou ddCt pro relativní kvantifikaci a exprese genu 18S byla použita jako endogenní kontrola.
ELISA
Komerčně dostupná ELISA (USCN Life Science) byla použita k měření koncentrace IL-35 v synoviální tekutině, séru a kultivačním médiu dle doporučení výrobce. Cytokiny IL-1β, IL-6 a MCP-1 byly měřeny v kultivačním médiu podle pokynů výrobce (RayBiotech). Absorbance byla měřena na vlnové délce 450 nm.
Immunohistochemie
Vzorky synoviální tkáně byly získány od 5 pacientů s RA a 5 pacientů s OA. K barvení byla použita polyklonální protilátka proti EBI3 (Lifespan Biosciences) nebo monoklonální protilátka proti IL-12a (Santa Cruz). Současně bylo provedeno kontrolní barvení. Řezy byly analyzovány semikvantitativně na škále intenzity barvení 0–3 (žádná – maximální intenzita barvení) v 7 zorných polích pro vrstvu intimy (lining) a intersticium (sublining).
Statistická analýza
Mann Whitney U-test byl použit pro porovnání rozílů mezi 2 proměnnými a Kruskall-Wallisův test s následnou post-hoc korekcí pro mnohočetná porovnání (Dunn's post hoc test) byl použit k určení rozdílu mezi více než 2 proměnnými. Spearmanův korelační koeficient byl použit k výpočtu asociace mezi 2 veličinami. Hodnoty p menší než 0,05 byly považovány za statisticky významné.
VÝSLEDKY
Význam adipokinů u revmatických onemocnění
Adipokiny v séru u pacientů s EOA
Cílem studie bylo porovnat sérové hladiny adipokinů adiponectinu a resistinu u pacientek s EOA a neerozivní formou OA drobných ručních kloubů a zdravých kontrol (ZK) (tab. 1).
Tab. 1. Charakteristika pacientek s OA kloubů rukou a zdravých kontrol zařazených do studie analyzující sérové koncentrace adipokinů adiponectinu a resistinu. 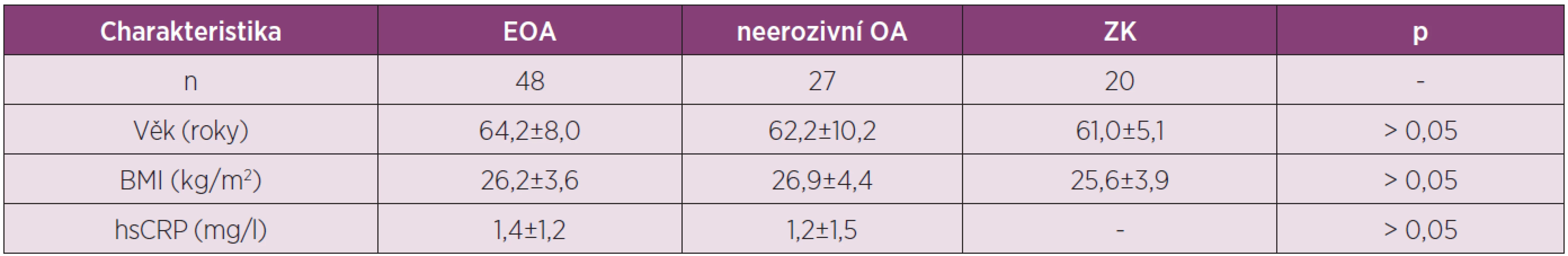
Výsledky získané v blood-pool fázi 3fázové kloubní scintigrafie ukázaly 2 x častější výskyt zánětu u pacientek s EOA než u pacientek s neerozivní OA, přestože se CRP u těchto skupin nelišilo. U pacientek s EOA jsme prokázali významně vyšší hladiny sérového adiponectinu ve srovnání s neerozivní OA nebo ZK, zatím co se hladiny resistinu v jednotlivých skupinách nelišily (obr. 1). Nepozorovali jsme korelaci hladin těchto adipokinů s CRP a přítomnost hydropsu nebo synovitidy kolenních kloubů neměla vliv na jejich koncentraci.
Obr. 1. Sérové hladiny adiponectinu (a) a resistinu (b) u zdravých kontrol a pacientů s neerozivní OA a EOA drobných kloubů rukou. 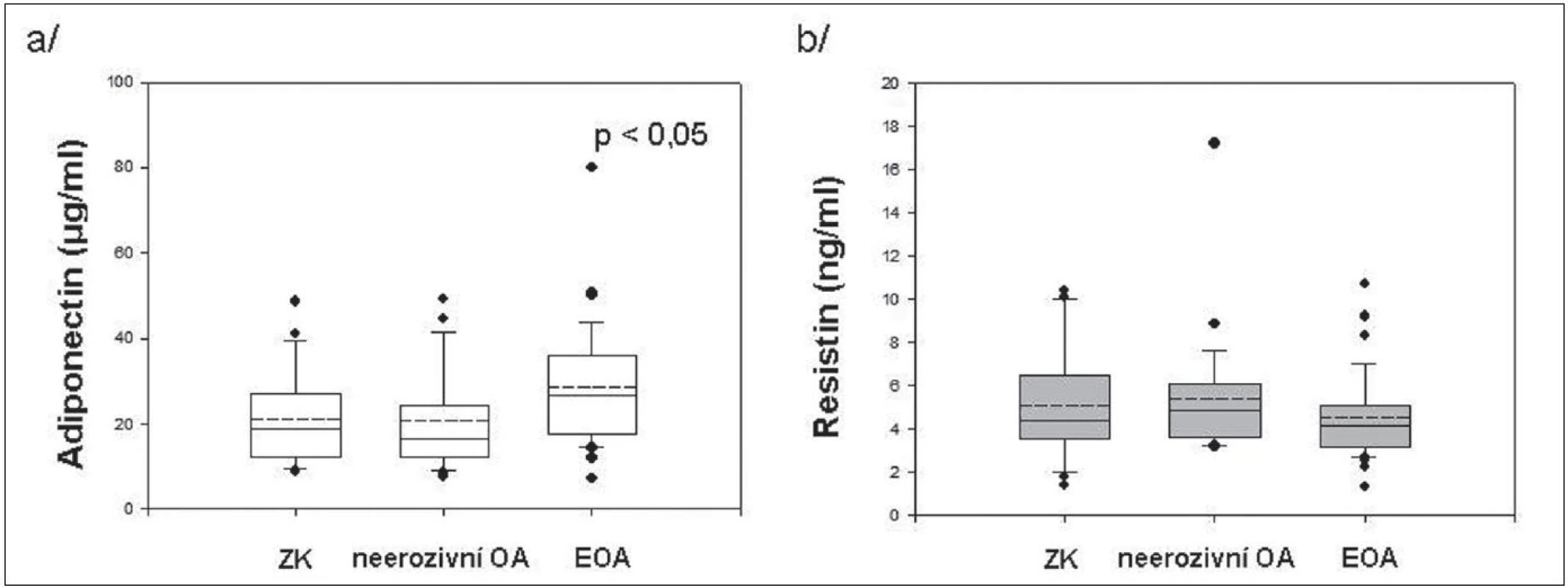
Publikace k tématu:
1. Filková M, Lišková M, Hulejová H, Haluzík M, Gatterová J, Pavelková A, Pavelka K, Gay S, Müller-Ladner U, Šenolt L. Increased serum adiponectin levels in female patients with erosive compared with non-erosive osteoarthritis. Ann Rheum Dis 2009;68 : 295-6.
2. Filková M, Lišková M, Hulejová H, Haluzík M, Gatterová J, Pavelka K, Šenolt L. Zvýšené hladiny sérového adiponectinu u pacientů s erozivní osteoartrózou. Čes Revmatol 2008;16 : 100-3.
Hladiny nových adipokinů vaspinu a omentinu v synoviální tekutině u pacientů s RA
V naší práci jsme v synoviální tekutině u pacientů s RA a OA zjišťovali koncentrace nově popsaných adipokinů vaspinu a omentinu (tab. 2).
Tab. 2. Charakteristika pacientů zařazených do studie analyzující koncentrace adipokinů vaspinu a omentinu v synoviální tekutině u RA a OA. 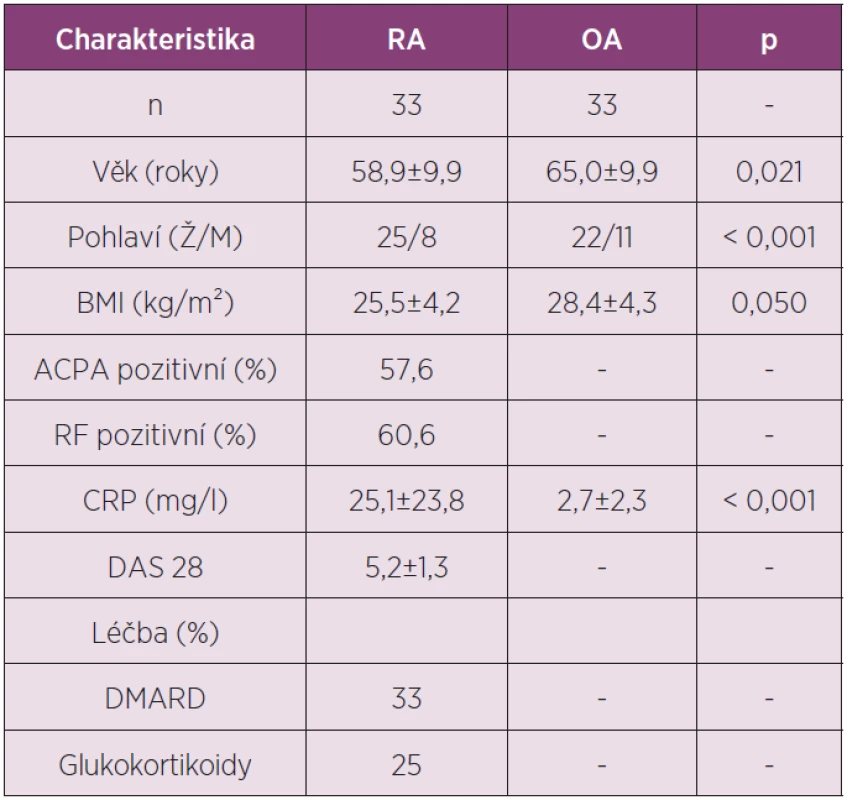
V synoviální tekutině u pacientů s RA byla koncentrace vaspinu významně vyšší zatím co hladiny omentinu byly naopak nižší ve srovnání s OA (obr. 2). Hladiny vaspinu měly tendenci korelovat s aktivitou nemoci měřenou podle DAS28 skóre (r = 0,320, p = 0,070), zatím co hladiny omentinu korelovaly s hladinou ACPA (r = 0,398, p = 0,029) a IgM RF (r = 0,592, p < 0,001) u pacientů s RA.
Obr. 2. Hladiny vaspinu (a) a omentinu (b) v synoviální tekutině u pacientů s RA a OA. 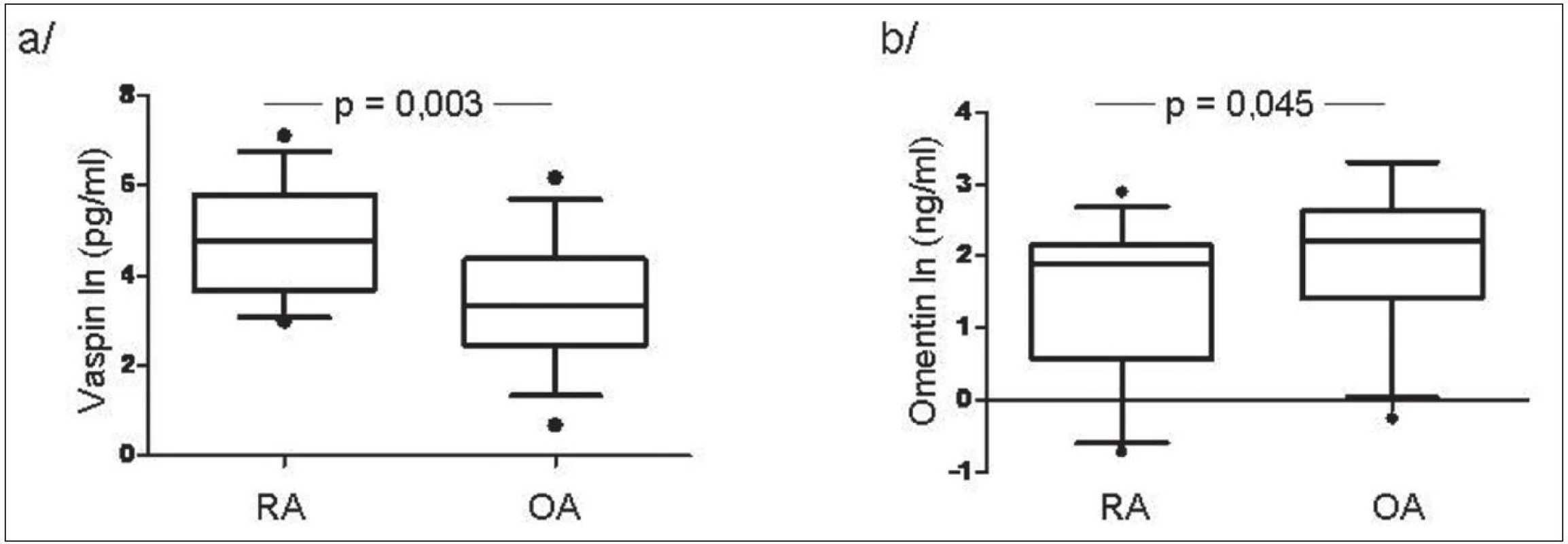
Publikace k tématu:
1. Šenolt L, Polanská M, Filková M, Oslejšková L, Pavelka K, Gay S, Haluzík M, Vencovský J. Vaspin and omentin: new adipokines differentially regulated at the site of inflammation in rheumatoid arthritis. Ann Rheum Dis 2010;69 : 1410-1 .
Vliv léčby TNFα inhibitorem na expresi adipokinů v tukové tkáni u pacientů s RA
V podkožní tukové tkáni pacientů s RA jsme studovali expresní profil adipokinů adiponectinu, resistinu, leptinu, visfatinu, vaspinu, omentinu a TNFα, IL-1β a IL-6 před začátkem a po 6 měsících léčby TNFα inhibitorem etanerceptem (tab. 3).
Tab. 3. Charakteristika pacientů s RA zařazených do studie analyzující expresní profil adipokinů v tukové tkáni po léčbě TNFα inhibitorem etanerceptem. 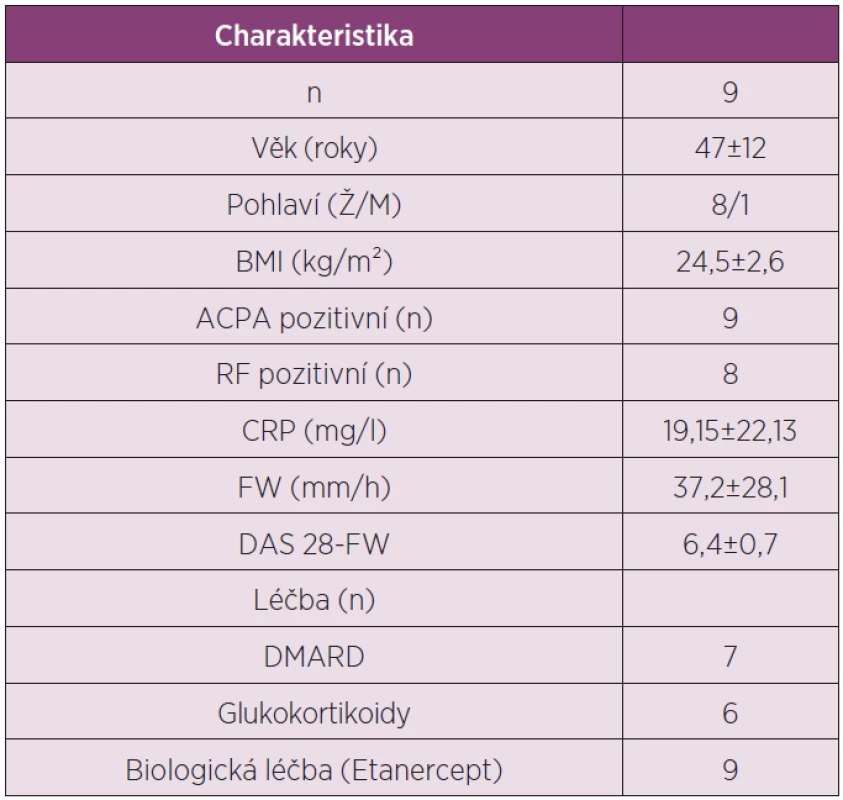
V tukové tkáni se po 6měsíční léčbě etanerceptem množství leptinu signifikantně zvýšilo a množství adiponectinu významně snížilo, zatím co pokles koncentrací visfatinu a IL-6 po léčbě nedosáhl statistickou významnost. Hladiny ostatních adipokinů se po léčbě nezměnily (obr. 3). Hladiny leptinu v tukové tkáni před zahájením léčby negativně korelovaly s hladinou CRP před léčbou a zvýšená koncentrace leptinu v tukové tkáni po 6měsíční terapii negativně korelovaly se změnou/rozdílem CRP.
Obr. 3. Vliv léčby TNFα inhibitorem na expresi vybraných adipokinů leptinu (a), adiponectinu (b), visfatinu (c) a IL-6 (d) v podkožní tukové tkáni u pacientů s RA. 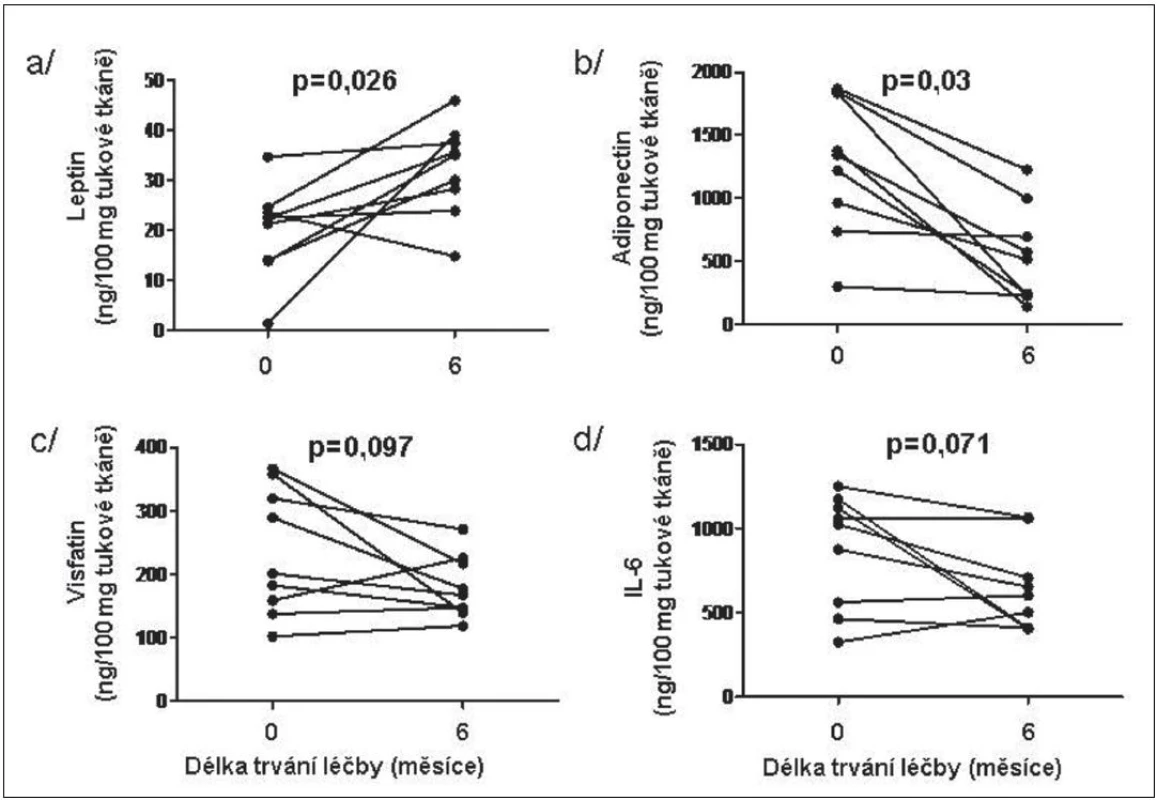
Publikace k tématu:
1. Šenolt L, Kuklová M, Cerezo LA, Hulejová H, Filková M, Bosanská L, Pecha O, Pavelka K, Haluzík M, Vencovský J. Adipokine profile is modulated in subcutaneous adipose tissue by TNF{alpha} inhibitors in patients with rheumatoid arthritis. Ann Rheum Dis 2011 Nov; 70(11):2054-6.
Vliv léčby rituximabem na sérové hladiny visfatinu u pacientů s RA
Cílem práce bylo porovnat sérové hladiny visfatinu u pacientů s RA a ZK, zjistit efekt léčby rituximabem na sérové hladiny visfatinu a jeho vztah k cirkulujícímu BAFF a k aktivitě nemoci u pacientů s RA (tab. 4).
Tab. 4. Charakteristika pacientů s RA a zdravých kontrol zařazených do studie hodnotící vliv léčby rituximabem na sérové hodnoty visfatinu a jejich vztah k cirkulujícímu BAFF a k aktivitě RA. 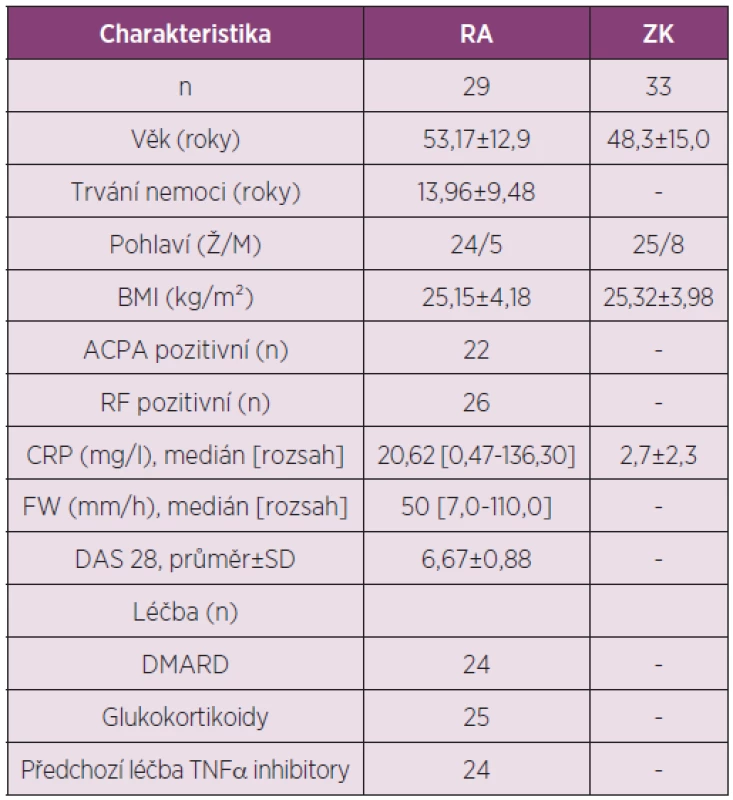
BAFF (B cell activating factor of the TNF family) zvyšuje expresi visfatinu v B lymfocytech a jeho zvýšené hladiny byly popsány po léčbě rituximabem (15). Počet lymfocytů před začátkem léčby koreloval pozitivně s hladinami visfatinu a negativně s hladinami BAFF u pacientů s RA (obr. 4). Po 16 týdnech léčby tyto asociace nebyly již významné. Hladiny visfatinu ani BAFF nekorelovaly s aktivitou nemoci před ani po 16 týdnech léčby. Koncentrace visfatinu byla před začátkem léčby signifikantně vyšší u pacientů s RA než u ZK a po 16 týdnech od začátku léčby byly tyto hladiny srovnatelné. Naproti tomu koncentrace BAFF v séru významně stoupla (obr. 5). V 16. týdnu léčby hladiny visfatinu a BAFF vzájemně negativně korelovaly, ale před začátkem léčby tato korelace nebyla patrná (obr. 6).
Obr. 4. Korelace visfatinu (a) a BAFF (b) s počtem lymfocytů u pacientů s RA před zahájením léčby rituximabem. 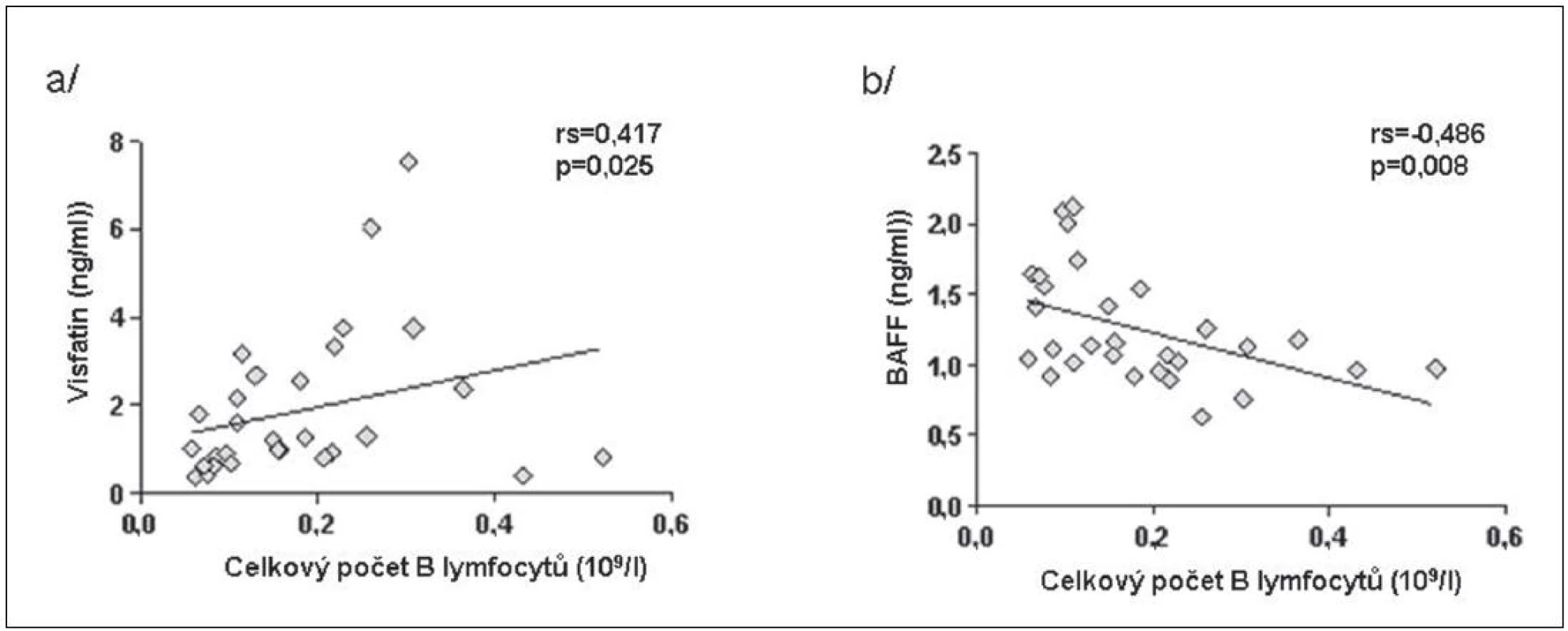
Obr. 5. Změny celkového počtu B lymfocytů (a), visfatinu (b) a BAFF (c) u pacientů s RA před a 16 týdnů po zahájení léčby rituximabem. 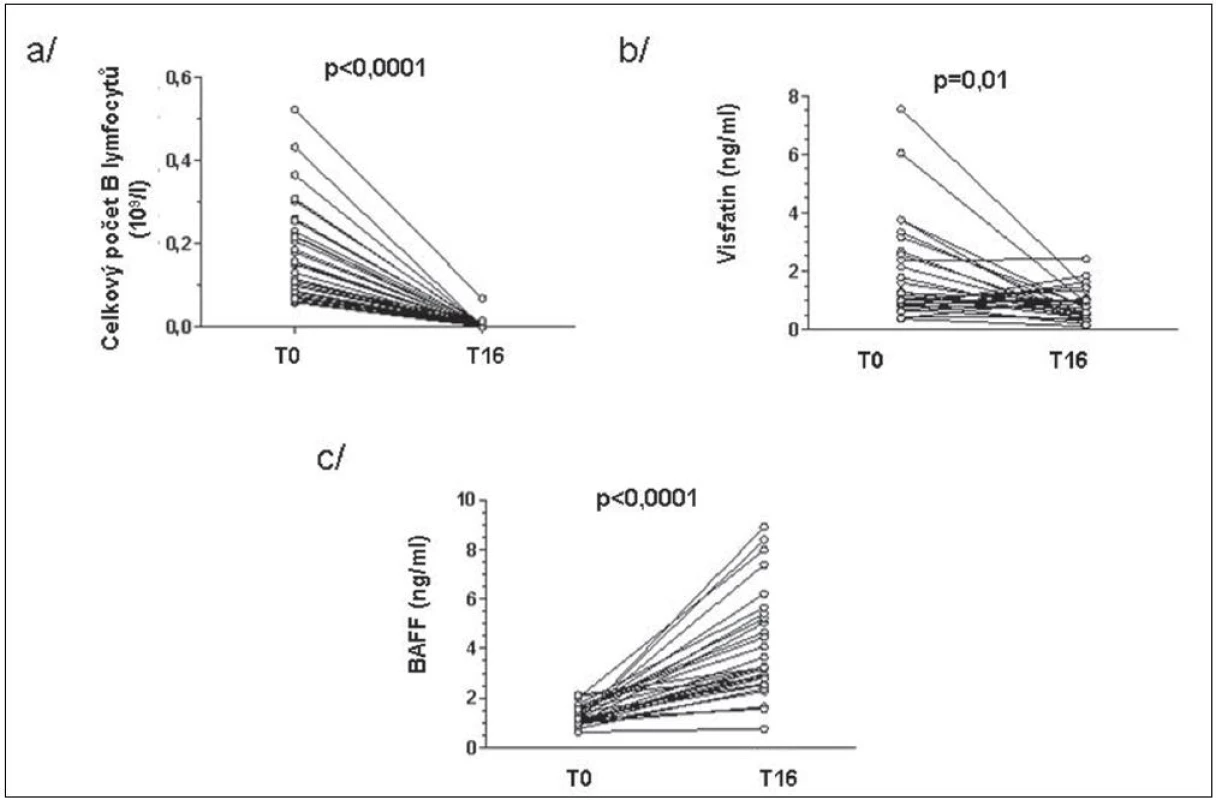
Obr. 6. Korelace hladin visfatinu a BAFF u pacientů s RA před (a) a 16 týdnů (b) po zahájení léčby rituximabem. 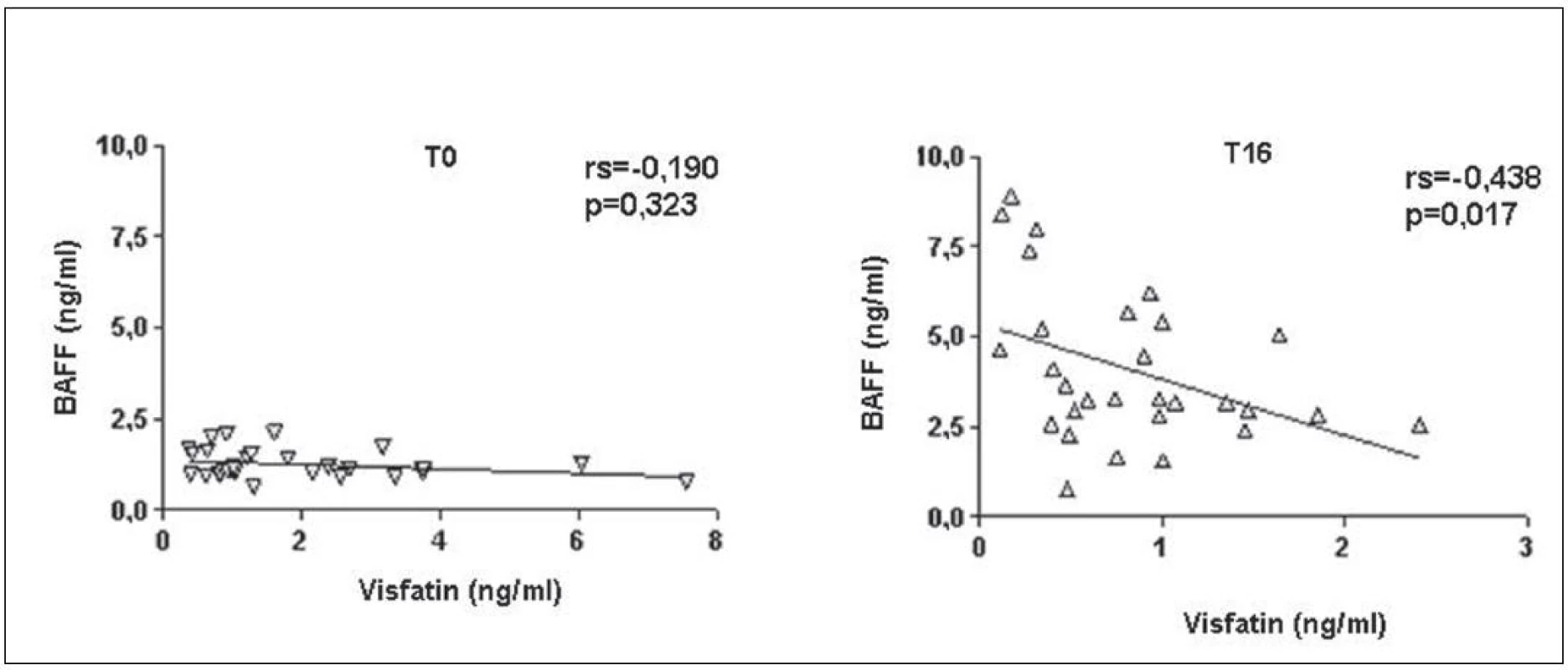
I když v současnosti neexistují spolehlivé parametry, na základě kterých by bylo možné předpovědět, jak bude individuální pacient reagovat na léčbu, zvýšení nebo minimální změna sérového visfatinu z období před léčbou rituximabem a v 16. týdnu po jejím začátku představovalo predispozici pro zhoršení aktivity nemoci v období následujících 8 týdnů (obr. 7).
Obr. 7. Prediktivní hodnota změny sérových hladin visfatinu po 16 týdnech léčby pro změnu aktivity RA (DAS28 skóre) mezi 16. a 24. týdnem léčby. 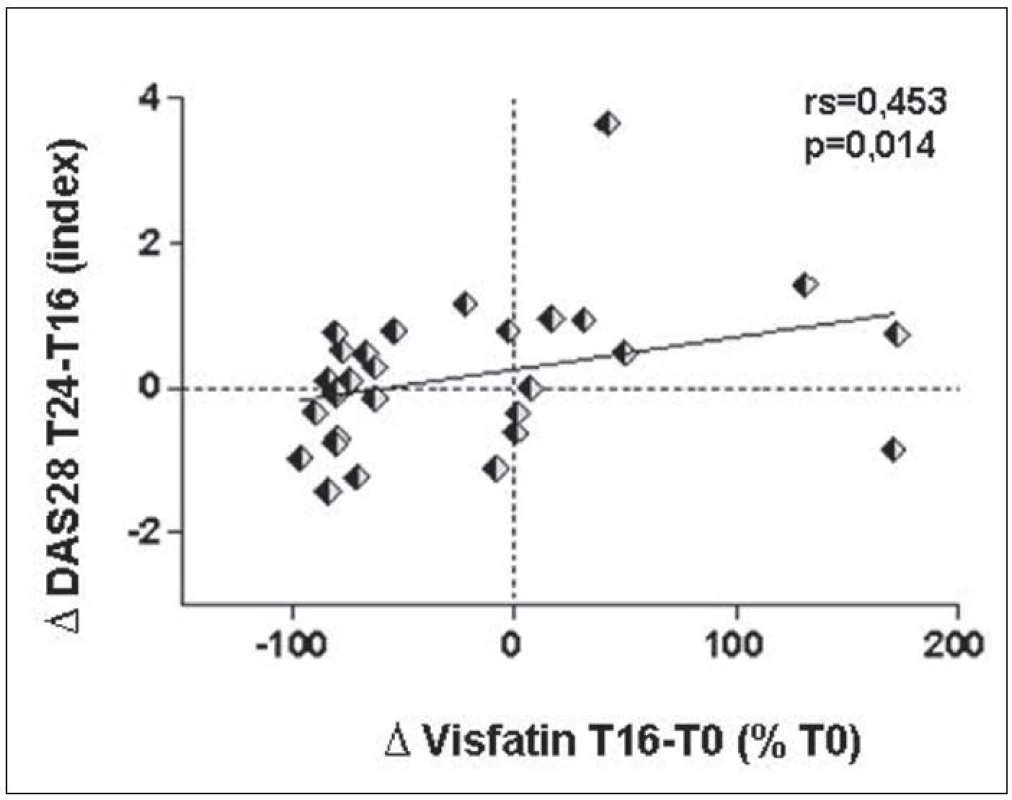
Publikace k tématu:
1. Šenolt L, Kryštůfková O, Hulejová H, Kuklová M, Filková M, Cerezo LA, Běláček J, Haluzík M, Forejtová S, Gay S, Pavelka K, Vencovský J. The level of serum visfatin (PBEF) is associated with total number of B cells in patients with rheumatoid arthritis and decreases following B cell depletion therapy. Cytokine 2011; 55 : 116-21.
Význam IL-35 v patogenezi RA
IL-35 a aktivita nemoci
Charakteristika pacientů a ZK, kteří se zúčastnili studie je uvedena v tabulce 5.
Tab. 5. Charakteristika pacientů s RA, OA a zdravých kontrol zařazených do studie analyzující koncentrace IL-35 v séru a synoviální tekutině. 
Hladiny IL-35 v synoviální tekutině byly u pacientů s RA signifikantně vyšší v porovnání s pacienty s OA (medián 7483 vs. 257,6 pg/ml, p < 0,0001, obr. 8). Hladiny IL-35 v synoviální tekutině u pacientů s RA korelovaly významně s DAS28 skóre aktivity nemoci, funkčním stavem pacienta podle dotazníku HAQ a CRP (obr. 9). U pacientů s OA hladiny IL-35 v synoviální tekutině korelovaly s funkčním stavem podle dotazníku WOMAC (r=0,405, p=0,01), ale ne se sérovým CRP nebo počtem leukocytů v synoviální tekutině, jak tomu bylo u RA.
Obr. 8. Hladiny IL-35 v synoviální tekutině pacientů s RA a OA. 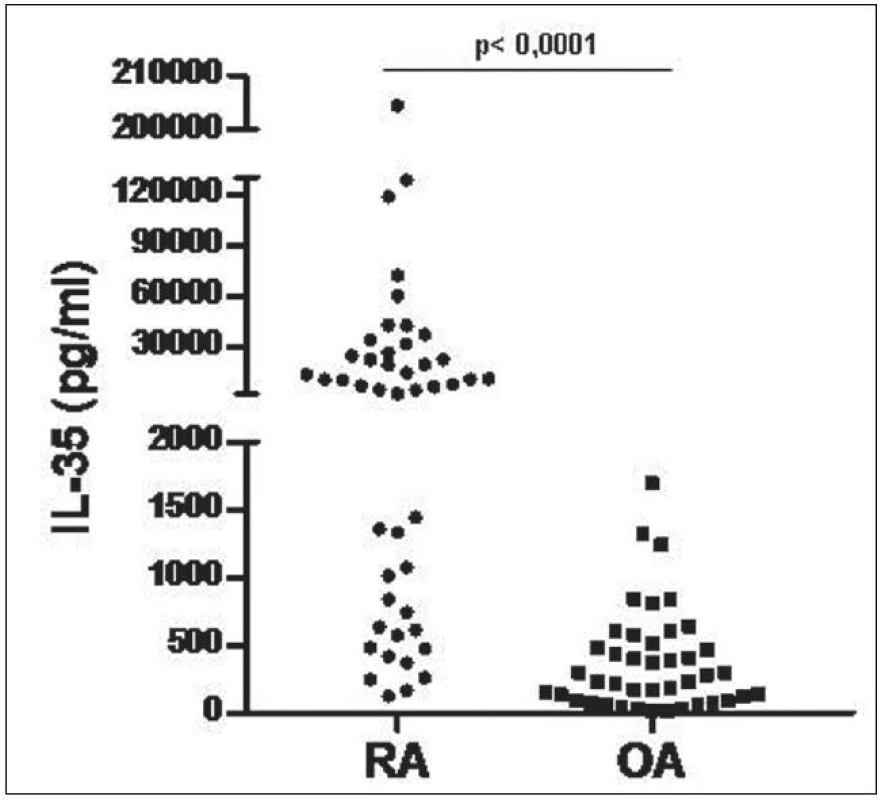
Obr. 9. Korelace hladin IL-35 v synoviální tekutině s DAS28 (a), HAQ (b) a CRP (c) u pacientů s RA. 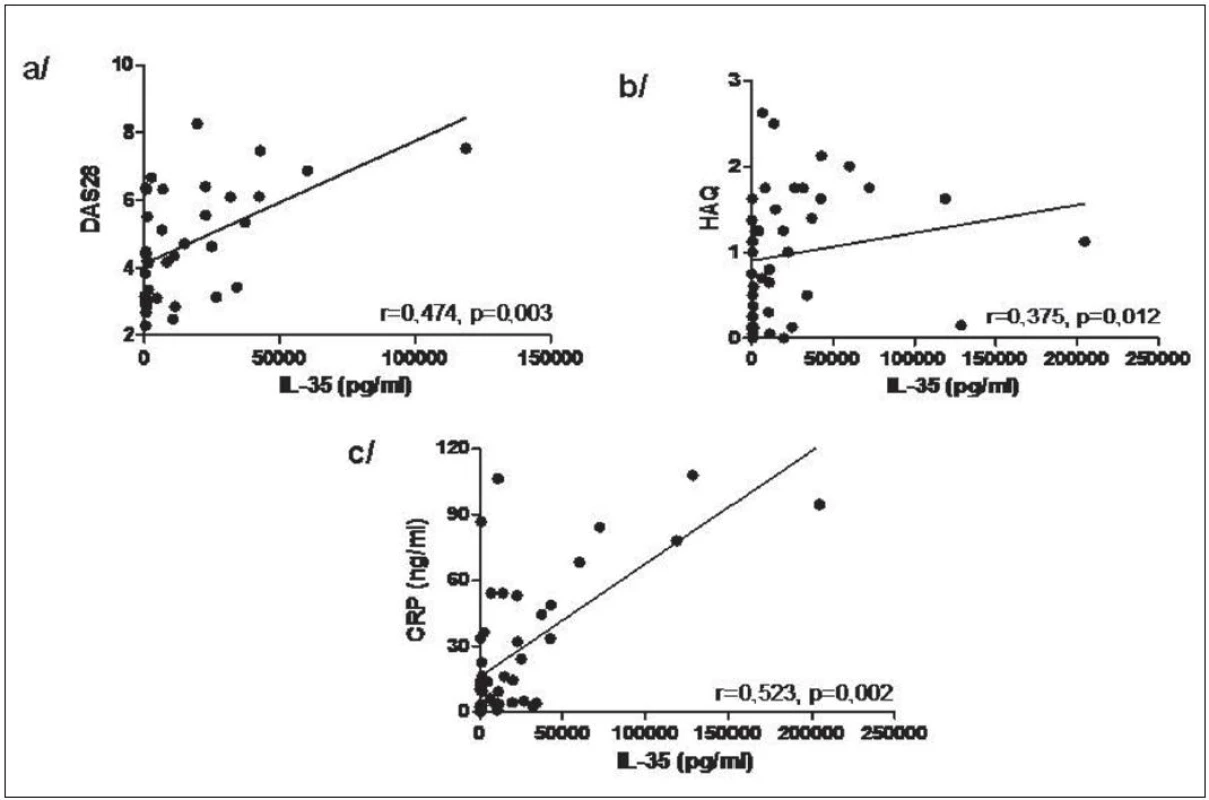
EBI3 a p35 podjednotky IL-35 v RA synoviální tkáni
Imunohistochemické barvení s následnou semikvantitativní analýzou prokázalo vyšší intenzitu barvení obou podjednotek p35 a EBI3 v synoviální tkáni pacientů s RA v porovnání s OA a to jak v povrchové vrstvě, tak v intersticiu synoviální tkáně (obr. 10).
Obr. 10. Imunonistochemické barvení p35 (a, c) a EBI3 (b, d) podjednotek IL-35 v OA (a, b) a RA (c, d) synoviální tkáni. Semikvantitativní hodnocení prokázalo vyšší expresi p35 (e) a EBI3 (f) jak v synoviální intimě (lining), tak v oblasti intersticia (sublining). Původní zvětšení x20. * p <0,05, ** p <0,01. 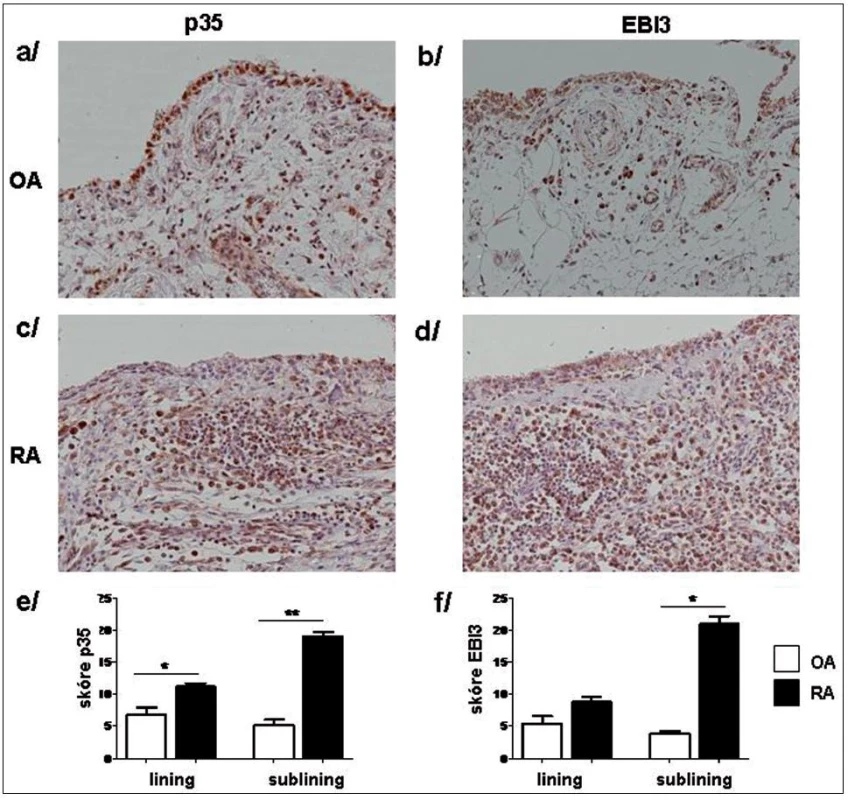
Exprese p35/EBI3 a IL-35 v RASF a PBMC
Exprese p35 a EBI3 na úrovni mRNA v RASF byly signifikantně zvýšeny po stimulaci TNFα a byly následovány uvolněním IL-35 do kultivačního média v závislosti na dávce TNFα (obr. 11). Rovněž u PBMC vedla stimulace TNFα k indukci exprese p35 a EBI3 na transkripční úrovni. Uvolnění IL-35 do kultivačního média potvrdilo výsledky na transkripční úrovni (obr. 12).
Obr. 11. Indukce p35 (a) a EBI3 (b) na transkripční úrovni a uvolnění IL-35 do kultivačního média (c). * p < 0,05, ** p < 0,01, *** p < 0,001. 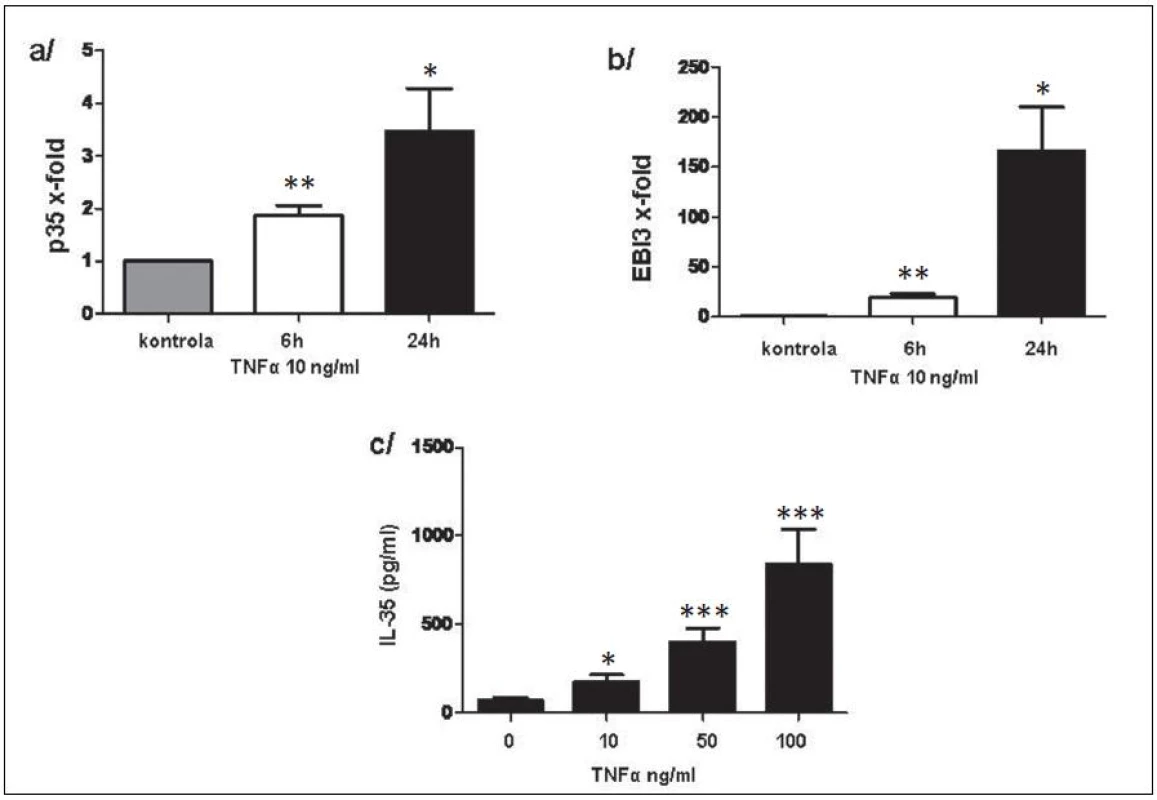
Obr. 12. Exprese p35 (a) a EBI3 (b) na transkripční úrovni a uvolnění IL-35 do kultivačního média po stimulaci TNFα (c) u PBMC. * p < 0,05, ** p < 0,01, *** p < 0,001. 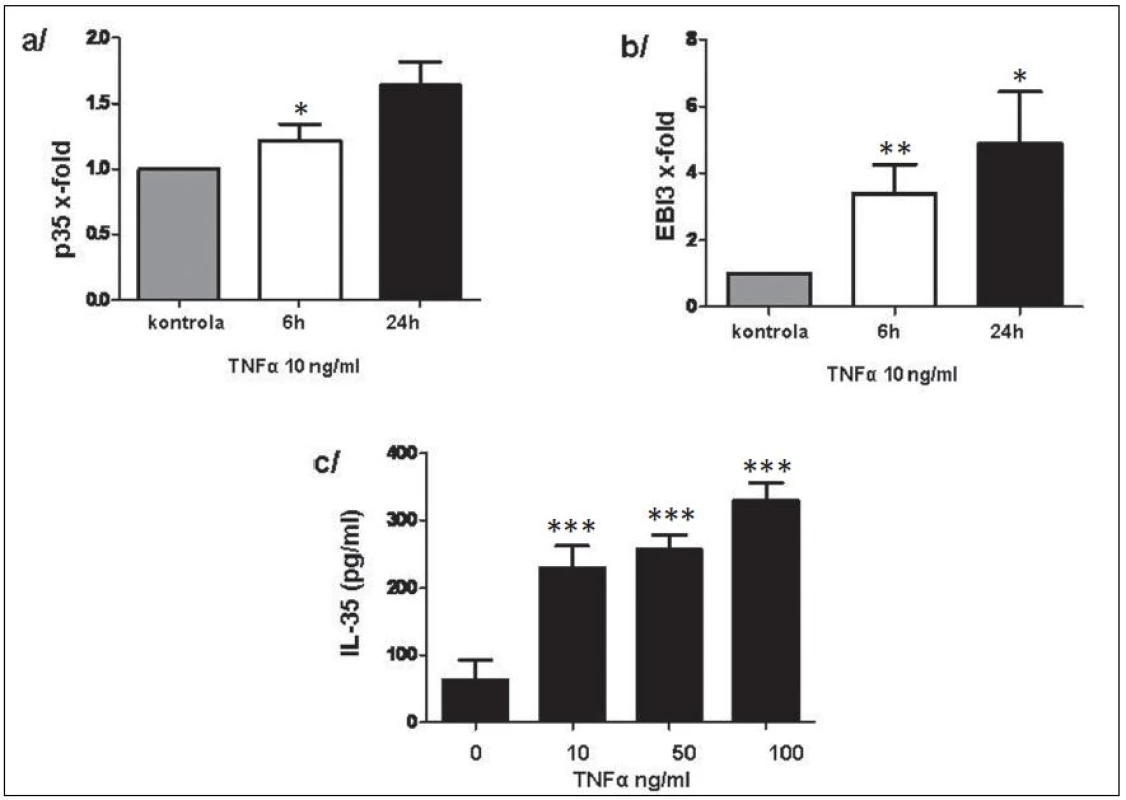
IL-35 indukuje expresi prozánětlivých cytokinů/chemokinů
IL-35 zvyšuje v závislosti na dávce expresi IL-1β a IL-6 a chemoaktraktantu MCP-1 jak úrovni mRNA po 6 a 24h, tak i na proteinové úrovni po 24h (obr. 13). Tato stimulace neměla vliv na uvolnění TNFα.
Obr. 13. IL-35 indukuje v PBMC tvorbu cytokinů IL-1β (a) a IL-6 (b) a chemoatraktantu MCP-1 (c). * znamenají porovnání s nestimulovanou kontrolou, * znamenají porovnání s TNFα stimulovanou kontrolou v případě kombinované stimulace. * p < 0,05, ** p < 0,01, *** p < 0,001. 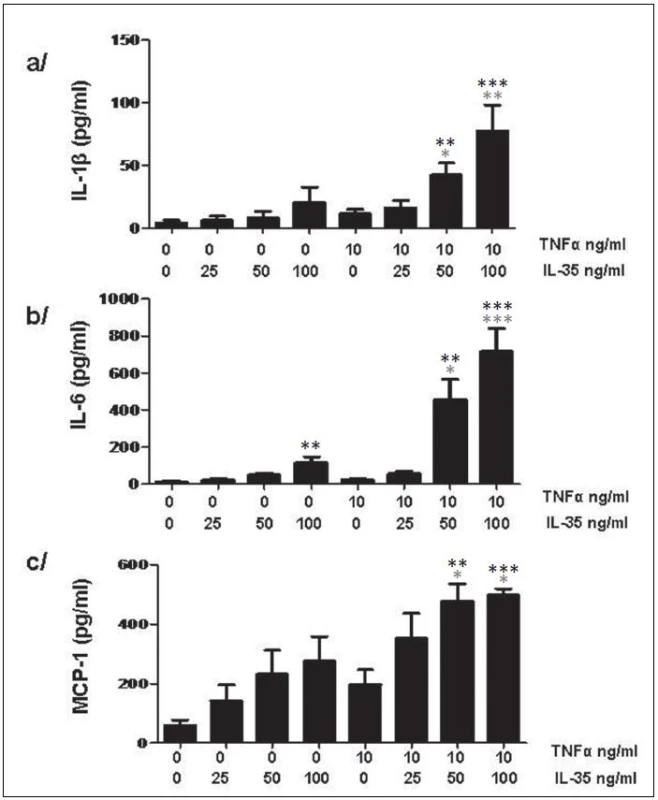
Stimulace RASF IL-35 neměla žádný vliv na expresi následujících molekul, které jsou esenciální v patogenezi RA: IL-1β, IL-6, TNFα, MCP-1, COX2, MMP-1 a MMP-3. Nelze ale vyloučit, že některé z genů, které nebyly předmětem našeho studia, byly touto stimulací ovlivněny.
DISKUSE
Význam adipokinů u pacientů s EOA a RA
V posledních letech vzrůstá zájem o výzkum známých adipokinů a objevování nových molekul, včetně jejich potenciálního vztahu k zánětu. Několik prací potvrdilo zvýšené koncentrace adipokinů adiponectinu, resistinu, visfatinu nebo leptinu v synoviální tekutině u RA pacientů (6,16–19).
Adiponectin má obecně v patogenezi metabolického syndromu a jeho komplikací roli protizánětlivého cytokinu (20). Adiponectin v synoviálních fibroblastech a chondrocytech indukuje tvorbu zánětlivých cytokinů, chemokinů a MMP a podporuje tak zánětlivé prostředí v kloubu a jeho destrukci (21). Sérové hladiny adiponectinu korelují se závažností kloubní destrukce u pacientů s RA (22, 23). Adiponectin v synoviální tekutině koreluje s degradačními produkty proteoglykanů a s mírou postižení u pacientů s OA kolenního kloubu (24, 25). Intraartikulární podání rekombinantního resistinu u myšího modelu vede k zánětu synoviální tkáně, který svým obrazem připomíná RA a jeho vysoká exprese je popsána v RA synoviální tkáni (16, 17). Resistin vede v PBMC k tvorbě zánětlivých cytokinů, chemoatraktantů, cyklooxygenázy a MMP (16, 26, 27).
Hladiny adipokinů u pacientů s OA byly doposud stanovovány pouze u nemocných s OA kolenních kloubů. Některé práce studovaly biochemické markery u pacientů s EOA, kde vyšší hodnoty CRP byly považovány za ukazatel aktivity nemoci hodnocené podle klinického a scintigrafického nálezu (4).
V naší studii jsme nezjistili u pacientů s EOA a neerozivní OA rozdíl v koncentracích sérového CRP, i když kostní scintigrafie prokázala 2 x častější zánět drobných kloubů rukou u pacientů s EOA. Na základě toho se domníváme, že zánětlivý charakter EOA je podmíněný lokálně a nevede k systémové zánětlivé odezvě v podobně zvýšeného CRP. U pacientů s EOA jsme současně zjistili významně vyšší hladiny sérového adiponectinu než u pacientů s neerozivní formou OA. Lze proto předpokládat, že adiponectin se účastní v patogenezi erozivní formy artrotického procesu. Jeho protektivní nebo destruktivní úloha u EOA zůstává otázkou, i když nejnovější data poukazují na jeho prozánětlivé a destruktivní účinky.
Vaspin a omentin jsou adipokiny objevené v souvislosti se senzitiviou k inzulinu. Některé práce poukazují na jejich možnou souvislost se zánětlivými procesy (28, 29).
Naše výsledky ukazují vyšší koncentraci vaspinu a nižší koncentraci omentinu v synoviální tekutině u pacientů s RA než s OA a tím i rozdílný mechanismus regulace těchto adipokinů v místech zánětu. Jakým způsobem se tyto cytokiny podílí na zánětu a kloubní destrukci zůstává předmětem dalšího výzkumu.
I když je obezita závažným rizikovým faktorem pro rozvoj aterosklerózy, diabetu 2. typu, OA, některých typů rakoviny atd., je obezita u RA paradoxně spojena s méně agresivním průběhem a představuje tak spíše protektivní faktor dalšího vývoje nemoci (30, 31).
Na rozdíl od limitovaného vlivu TNFα inhibitorů na systémové hladiny adipokinů v předchozích studiích (21), naše data ukazují, že léčba etanerceptem významně ovlivňuje expresi leptinu a adiponectinu v podkožní tukové tkáni u pacientů s RA. Předpokládáme, že zejména zvýšení leptinu v tukové tkáni je důsledkem zlepšení systémového zánětu po léčbě, což je v souladu s protektivním účinkem vysokých systémových hladin leptinu na rentgenové kloubní postižení u pacientů s RA (32).
Visfatin se kromě energetického metabolismu, kde plní fukci nikotinamid fosforibosyl transferázy, podílí jako PBEF (pre-B colony enhancing factor) na diferenciaci B lymfocytů (33, 34). Visfatin je protein s významnými imunomodulačními vlastnostmi. Prozánětlivé faktory stimulují jeho tvorbu v synoviálních fibroblastech a on sám působí jako zánětlivý mediátor (18). Inhibice visfatinu u myšího modelu artritidy snížila lokální expresi a systémové hladiny zánětlivých cytokinů, eliminovala destrukci chrupavky a tvorbu kostních erozí (35,36). Zvýšené hladiny visfatinu v cirkulaci a v synoviální tekutině u pacientů s RA navíc významně korelovaly s aktivitou nemoci (18). Jiná studie však neprokázala vztah sérového visfatinu k aktivitě RA ani k jeho změnu po léčbě TNFα inhibitory (37).
V souladu s předchozími publikacemi jsme potvrdili vyšší sérové koncentrace visfatinu v séru RA pacientů než u zdravých jedinců, které ale nekorelovaly s aktivitou nemoci, což by mohlo být podmíněné předchozí léčbou TNFα inhibitory u většiny pacientů v naší studii. Hladiny sérového visfatinu významně korelovaly s počtem B lymfocytů a poklesly po terapii rituximabem, která vedla ke snížení počtu B lymfocytů a ke zlepšení klinické aktivity.
BAFF, který je rovněž faktorem regulujícím dozrávání a přežívání B lymfocytů, zvyšuje expresi visfatinu v B lymfocytech (15). Protože se hladiny BAFF u našich RA pacientů po terapii rituximabem významně zvýšily a po 16 týdnech léčby negativně korelovaly s hladinami visfatinu, domníváme se, že uvedený pokles visfatinu po léčbě rituximabem je specificky podmíněn sníženým počtem B lymfocytů. Navíc změna sérového visfatinu před začátkem a 16 týdnů po zahájení léčby korelovala se změnou aktivity RA v následujících 8 týdnech, kdy bývá obvykle podávána další dávka rituximabu. Lze tedy uvažovat, že visfatin by mohl mít prediktivní hodnotu pro další průběh RA.
Prozánětlivé vlastnosti IL-35 a jeho vztah k aktivitě nemoci u pacientů s RA
Rodina IL-12 je složena ze 4 heterodimerních cytokinů IL-12 (p35/IL-12a a p40/IL-12b), IL-23 (p19 a p40), IL-27 (p28 a EBI3/IL-27b) a IL-35 (p35 a EBI3) (38). Hladiny IL-12 byly zvýšeny v séru a synoviální tekutině u pacientů s RA a mají vztah k počtu oteklých kloubů a k CRP (39). IL-27 je vyšší v plazmě RA pacientů ale jeho asociace s aktivitou RA není známá (40). Zjistili jsme, že IL-35 je signifikantně vyšší v synoviální tekutině u RA než OA a koreluje s aktivitou a funkčním stavem u RA pacientů. Na základě korelace IL-35 s počtem leukocytů v synoviální tekutině u RA se můžeme domnívat, že právě leukocyty mohou být hlavním zdrojem IL-35 v místě zánětu.
Buňky, které tvoří IL-12, jsou v RA synoviální tkáni lokalizované v především v povrchové intimě v souladu s predominantní expresí IL-12 v makrofázích (41). Protein p19 je přítomen v intimě RA synovie, v místech invaze do chrupavky a v cévním endotelu. Zatímco je p35 protein exprimován ubikvitně, EBI3 je vysoce inducibilní a je exprimován selektivně (11, 42). Koexprese p35 a EBI3 byla popsaná v placentárních trofoblastech a hladkých svalových buňkách aterosklerotickém plátu (10, 43).
Zjistili jsme, že obě podjednotky IL-35 - p35 a EBI3 jsou více exprimovány v RA oproti OA synovii a to jak v intimě, tak v intersticiu. Exprese obou podjednotek je přítomna i v buňkách připomínajících fibroblasty. Protože RASF neprodukují p40 (44), je EBI3 jediným možným (a doposud známým) partnerem pro p35.
Jak p35, tak i EBI3 jsou indukovány po stimulaci mediátory zánětu (10). Naše experimenty in vitro ukazují, že exprese p35 a EBI3 je po stimulaci TNFα zvýšena v RASF a PMBC. Zvýšená exprese p35 a EBI3 v RA synoviální tkáni může být proto vysvětlena chronickým zánětlivým prostředím, což koresponduje s výsledky předchozích publikací a s naším pozorováním in vitro. Zatím co IL-12 a IL-23 fungují jako zánětlivé molekuly, studie na IL-27 u myších modelů jsou protichůdné (45, 46). IL-35 byl u myších modelů většinou prezentován jako protein s protizánětlivými vlastnostmi (8, 9, 47). IL-35 měl i vlastnosti zánětlivého cytokinu, kdy u myšího modelu nezabránil rozvoji lymské artritidy, ale naopak zesílil zánětlivou odpověď (48). V našich experimentech IL-35 stimuluje PBMC k tvorbě několika zánětlivých molekul, které jsou esenciální pro průběh RA.
ZÁVĚR
Naše studie prokázaly význam adipokinů při regulaci zánětu u revmatických onemocnění a jejich možnou prediktivní hodnotu pro další průběh RA. Další výsledky poukazují spíše na zánětlivé vlastnosti IL-35, podobně jako je tomu u ostatních členů IL-12 rodiny a jeho vztah k aktivitě nemoci u pacientů s RA. Objasnění patogeneze RA a nalezení nových potenciálních terapeutických cílů by mohlo přispět ke zlepšení klinického stavu u pacientů rezistentních na dosavadní léčbu.
PODĚKOVÁNÍ
Na závěr bych velmi ráda poděkovala svému školiteli doc. MUDr. Ladislavu Šenoltovi, Ph.D., za příkladné vedení, pomoc při postgraduálním studiu a profesním růstu. Dále bych chtěla poděkovat prof. MUDr. Karlu Pavelkovi, DrSc., řediteli Revmatologického ústavu v Praze, prof. Dr. Steffenu Gayovi, prof. Dr. Renate Gay a Dr. Astrid Jüngel, PhD. v Center of Experimental Rheumatology v Curychu. Děkuji všem kolegům a spoluautorům v Revmatologickém ústavu v Praze, především Ing. Haně Hulejové, Mgr. Lucii Andrés Cerezo a Mgr. Markétě Kuklové, v Center of Experimental Rheumatology v Curychu a na všech partnerských pracovištích za pomoc a spolupráci při řešení projektů.
Adresa pro korespondenci:
MUDr. Mária Filková, Ph.D.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Zdroje
1. Müller-Ladner U, Pap T, Gay RE, Neidhart M, Gay S. Mechanisms of disease: the molecular and cellular basis of joint destruction in rheumatoid arthritis. Nat Clin Pract Rheumatol. 2005;1 : 102-10.
2. McInnes IB, Schett G. Cytokines in the pathogenesis of rheumatoid arthritis. Nat Rev Immunol. 2007;7 : 429-42.
3. Senolt L, Vencovský J, Pavelka K, Ospelt C, Gay S. Prospective new biological therapies for rheumatoid arthritis. Autoimmun Rev. 2009; 9 : 102-7.
4. Punzi L, Frigato M, Frallonardo P, Ramonda R. Inflammatory osteoarthritis of the hand. Best Pract Res Clin Rheumatol 2010; 24 : 301-12.
5. Fantuzzi G. Adipose tissue, adipokines, and inflammation. J Allergy Clin Immunol. 2005;115 : 911-9; quiz 920.
6. Schaffler A, Ehling A, Neumann E, Herfarth H, Tarner I, Schölmerich J, Müller-Ladner U, Gay S. Adipocytokines in synovial fluid. JAMA. 2003;290 : 1709-10.
7. Gómez R, Conde J, Scotece M, Gómez-Reino JJ, Lago F, Gualillo O. What's new in our understanding of the role of adipokines in rheumatic diseases? Nat Rev Rheumatol. 2011;7 : 528-36.
8. Collison LW, Workman CJ, Kuo TT, Boyd K, Wang Y, Vignali KM, Cross R, Sehy D, Blumberg RS, Vignali DA. The inhibitory cytokine IL-35 contributes to regulatory T-cell function. Nature. 2007;450 : 566-9.
9. Niedbala W, Wei XQ, Cai B, Hueber AJ, Leung BP, McInnes IB, Liew FY. IL-35 is a novel cytokine with therapeutic effects against collagen-induced arthritis through the expansion of regulatory T cells and suppression of Th17 cells. Eur J Immunol. 2007;37 : 3021-9.
10. Kempe S, Heinz P, Kokai E, Devergne O, Marx N, Wirth T. Epstein-barr virus-induced gene-3 is expressed in human atheroma plaques. Am J Pathol. 2009;175 : 440-7.
11. Bardel E, Larousserie F, Charlot-Rabiega P, Coulomb-L'Herminé A, Devergne O. Human CD4+ CD25+ Foxp3+ regulatory T cells do not constitutively express IL-35. J Immunol. 2008;181 : 6898-905.
12. Arnett FC, Edworthy SM, Bloch DA, McShane DJ, Fries JF, Cooper NS, Healey LA, Kaplan SR, Liang MH, Luthra HS, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum. 1988;31 : 315-24.
13. Altman R, Asch E, Bloch D, Bole G, Borenstein D, Brandt K, Christy W, Cooke TD, Greenwald R, Hochberg M, et al. Development of criteria for the classification and reporting of osteoarthritis. Classification of osteoarthritis of the knee. Diagnostic and Therapeutic Criteria Committee of the American Rheumatism Association. Arthritis Rheum. 1986;29 : 1039-49.
14. Altman R, Alarcon G, Appelrouth D, et al. The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hand. Arthritis Rheum 1990;33 : 1601-10.
15. Lavie F, Miceli-Richard C, Ittah M, Sellam J, Gottenberg JE, Mariette X. Increase of B cell-activating factor of the TNF family (BAFF) after rituximab treatment: insights into a new regulating system of BAFF production. Ann Rheum Dis 2007;66 : 700-3.
16. Bokarewa M, Nagaev I, Dahlberg L, Smith U, Tarkowski A. Resistin, an adipokine with potent proinflammatory properties. J Immunol. 2005;174 : 5789-95.
17. Senolt L, Pavelka K, Housa D, Haluzík M. Increased adiponectin is negatively linked to the local inflammatory process in patients with rheumatoid arthritis. Cytokine. 2006;35 : 247-52.
18. Brentano F, Schorr O, Ospelt C, Stanczyk J, Gay RE, Gay S, Kyburz D. Pre-B cell colonyenhancing factor/visfatin, a new marker of inflammation in rheumatoid arthritis with proinflammatory and matrix-degrading activities. Arthritis Rheum 2007;56 : 2829-39.
19. Bokarewa M, Bokarew D, Hultgren O, Tarkowski A. Leptin consumption in the inflamed joints of patients with rheumatoid arthritis. Ann Rheum Dis 2003;62 : 952-6.
20. Haluzik M. Adiponectin and its potential in the treatment of obesity, diabetes and insulin resistance. Curr Opin Investig Drugs. 2005;6 : 988-93.
21. Neumann E, Frommer KW, Vasile M, Müller-Ladner U. Adipocytokines as driving forces in rheumatoid arthritis and related inflammatory diseases? Arthritis Rheum 2011;63 : 1159-69.
22. Giles JT, Allison M, Bingham CO 3rd, Scott WM Jr, Bathon JM. Adiponectin is a mediator of the inverse association of adiposity with radiographic damage in rheumatoid arthritis. Arthritis Rheum. 2009;61 : 1248–56.
23. Giles JT, van der Heijde DM, Bathon JM. Association of circulating adiponectin levels with progression of radiographic joint destruction in rheumatoid arthritis. Ann Rheum Dis. 2011;70 : 1562-8.
24. Hao D, Li M, Wu Z, Duan Y, Li D, Qiu G. Synovial fluid level of adiponectin correlated with levels of aggrecan degradation markers in osteoarthritis. Rheumatol Int. 2011;311433-7.
25. Honsawek S, Chayanupatkul, M. Correlation of plasma and synovial fluid adiponectin with knee osteoarthritis severity. Arch. Med. Res. 2010;41 : 593–8.
26. Nagaev I, Bokarewa M, Tarkowski A, Smith U. Human resistin is a systemic immune-derived proinflammatory cytokine targeting both leukocytes and adipocytes. PLoS ONE. 2006;1:e31.
27. Lee JH, Ort T, Ma K, Picha K, Carton J, Marsters PA, Lohmander LS, Baribaud F, Song XY, Blake S. Resistin is elevated following traumatic joint injury and causes matrix degradation and release of inflammatory cytokines from articular cartilage in vitro. Osteoarthritis Cartilage 2009;17 : 613–20.
28. Hida K, Wada J, Eguchi J, Zhang H, Baba M, Seida A, Hashimoto I, Okada T, Yasuhara A, Nakatsuka A, Shikata K, Hourai S, Futami J, Watanabe E, Matsuki Y, Hiramatsu R, Akagi S, Makino H, Kanwar YS. Visceral adipose tissue-derived serine protease inhibitor: a unique insulin-sensitizing adipocytokine in obesity. Proc Natl Acad Sci U S A. 2005;102 : 10610-5.
29. Schäffler A, Neumeier M, Herfarth H, Fürst A, Schölmerich J, Büchler C. Genomic structure of human omentin, a new adipocytokine expressed in omental adipose tissue. Biochim Biophys Acta. 2005;1732 : 96-102.
30. Escalante A, Haas RW, del Rincon I. Paradoxical effect of body mass index on survival in rheumatoid arthritis: role of comorbidity and systemic inflammation. Arch Intern Med 2005; 165 : 1624–9.
31. Westhoff G, Rau R, Zink A. Radiographic joint damage in early rheumatoid arthritis is highly dependent on body mass index. Arthritis Rheum 2007; 56 : 3575–82.
32. Rho YH, Solus J, Sokka T, Oeser A, Chung CP, Gebretsadik T, Shintani A, Pincus T, Stein CM. Adipocytokines are associated with radiographic joint damage in rheumatoid arthritis. Arthritis Rheum 2009; 60 : 1906-14.
33. Rongvaux A, Shea RJ, Mulks MH, Gigot D, Urbain J, Leo O, Andris F. Pre-B-cell colony-enhancing factor, whose expression is up-regulated in activated lymphocytes, is a nicotinamide phosphoribosyltransferase, a cytosolic enzyme involved in NAD biosynthesis. Eur J Immunol. 2002;32 : 3225-34.
34. Samal B, Sun Y, Stearns G, Xie C, Suggs S, McNiece I. Cloning and characterization of the cDNA encoding a novel human pre-B-cell colony-enhancing factor. Mol Cell Biol 1994;14 : 1431–37.
35. Busso N, Karababa M, Nobile M, Rolaz A, Van Gool F, Galli M, Leo O, So A, De Smedt T. Pharmacological inhibition of nicotinamide phosphoribosyltransferase/visfatin enzymatic activity identifies a new inflammatory pathway linked to NAD. PLoS One 2008; 3:e2267.
36. Evans L, Williams AS, Hayes AJ, Jones SA, Nowell M. Suppression of leukocyte infiltration and cartilage degradation by selective inhibition of pre-B cell colony-enhancing factor/visfatin/nicotinamide phosphoribosyltransferase: Apo866-mediated therapy in human fibroblasts and murine collagen-induced arthritis. Arthritis Rheum 2011; 63 : 1866-77.
37. Gonzalez-Gay MA, Vazquez-Rodriguez TR, Garcia-Unzueta MT, Berja A, Miranda-Filloy JA, de Matias JM, Gonzalez-Juanatey C, Llorca J. Visfatin is not associated with inflammation or metabolic syndrome in patients with severe rheumatoid arthritis undergoing anti-TNF-alpha therapy. Clin Exp Rheumatol. 2010;28 : 56-62.
38. Collison LW, Vignali DA. Interleukin-35: odd one out or part of the family? Immunol Rev. 2008;226 : 248-62.
39. Kim W, Min S, Cho M, Youn J, Min J, Lee S, Park S, Cho C, Kim H. The role of IL-12 in inflammatory activity of patients with rheumatoid arthritis (RA). Clin Exp Immunol. 2000;119 : 175-81.
40. Wong CK, Chen da P, Tam LS, Li EK, Yin YB, Lam CW. Effects of inflammatory cytokine IL-27 on the activation of fibroblast-like synoviocytes in rheumatoid arthritis. Arthritis Res Ther. 2010;12:R129.
41. Morita Y, Yamamura M, Nishida K, Harada S, Okamoto H, Inoue H, Ohmoto Y, Modlin RL, Makino H. Expression of interleukin-12 in synovial tissue from patients with rheumatoid arthritis. Arthritis Rheum. 1998;41 : 306-14.
42. Trinchieri, G. Interleukin-12 and the regulation of innate resistance and adaptive immunity. Nat. Rev. Immunol. 2003;3 : 133–146.
43. Devergne O, Birkenbach M, Kieff E. Epstein-Barr virus-induced gene 3 and the p35 subunit of interleukin 12 form a novel heterodimeric hematopoietin. Proc Natl Acad Sci U S A. 1997;94 : 12041-6.
44. Brentno F, Ospelt C, Stanczyk J, Gay RE, Gay S, Kyburz D. Abundant expression of the interleukin (IL)23 subunit p19, but low levels of bioactive IL23 in the rheumatoid synovium: differential expression and Toll-like receptor-(TLR) dependent regulation of the IL23 subunits, p19 and p40, in rheumatoid arthritis. Ann Rheum Dis. 2009;68 : 143-50.
45. Niedbala W, Cai B, Wei X, Patakas A, Leung BP, McInnes IB, Liew FY. Interleukin 27 attenuates collagen-induced arthritis. Ann Rheum Dis. 2008;67 : 1474-9.
46. Cao Y, Doodes PD, Glant TT, Finnegan A. IL-27 induces a Th1 immune response and susceptibility to experimental arthritis. J Immunol. 2008;180 : 922-30.
47. Collison LW, Chaturvedi V, Henderson AL, Giacomin PR, Guy C, Bankoti J, Finkelstein D, Forbes K, Workman CJ, Brown SA, Rehg JE, Jones ML, Ni HT, Artis D, Turk MJ, Vignali DA. IL-35-mediated induction of a potent regulatory T cell population. Nat Immunol. 10;11 : 1093-101.
48. Kuo J, Nardelli DT, Warner TF, Callister SM, Schell RF. Interleukin-35 Enhances Lyme Arthritis in Borrelia-Vaccinated and -Infected Mice. Clin Vaccine Immunol 2011; 18 : 1125-32.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2013 Číslo 1- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
Najčítanejšie v tomto čísle- Prof. MUDr. Zbyněk Hrnčíř, DrSc. – 80letý
- Imunoglobulinové volné lehké řetězce v séru jako biomarker aktivity u systémového lupus erythematodes
-
Třeboňské revmatologické dny
(Třeboň, 7.–9. 1. 2013) -
Význam nových cytokinů v patogenezi revmatických onemocnění
Autoreferát disertační práce
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



