Periferní ulcerózní keratitida – závažná komplikace revmatoidní artritidy
Peripheral ulcerative keratitis – a severe complication of rheumatoid arthritis
Rheumatoid arthritis is a systemic inflammatory disease of connective tissue. It can sometimes present itself with extraarticular symptoms, such as eye disorders. Although the most common manifestation is the dry eye disease, there are other severe conditions such as peripheral ulcerative keratitis as well. It is a destructive inflammation at the margin of corneal stroma associated with epithelial defect and progressive stromal degradation and thinning. This potentially devastating disorder can quickly produce necrosis of the corneal stroma, leading to perforation and blindness. In some cases, the peripheral ulcerative keratitis can be the first manifestation of underlying systemic disease. It can also indicate the presence of potentially lethal systemic vasculitis. Therefore, an early diagnose and adequate treatment protocol is key for achievement of satisfactory therapy results. A close cooperation between an ophthalmology and rheumatology specialist is necessary for successful treatment. The role of the rheumatologist is to medically manage patient´s systemic disease with regard to the dynamics of eye impairment. The ophthalmologist´s concern is mainly dealing with local complications and providing feedback for treatment modification. Only effective interdisciplinary cooperation can induce healing process and bring satisfactory treatment results.
Key words:
Rheumatoid arthritis, extraarticular symptoms, peripheral ulcerative keratitis, treatment
Autori:
N. Járová 1; M. Palos 2; Z. Mazal 1
Pôsobisko autorov:
Oční oddělení, Oblastní nemocnice Mladá Boleslav, a. s.
1; Oční klinika Všeobecné fakultní nemocnice 1. LF UK, Praha
2
Vyšlo v časopise:
Čes. Revmatol., 22, 2014, No. 2, p. 100-106.
Kategória:
Přehledový článek
Súhrn
Revmatoidní artritida je systémové onemocnění pojiva s variabilně přítomnými mimokloubními projevy, mezi něž patří i postižení oka. Ačkoli nejčastější oční manifestací RA je syndrom suchého oka, neméně významnou a závažnou komplikací je i periferní ulcerózní keratitida. Jedná se o destrukci periferie rohovky a přilehlých tkání autoimunitním zánětem. V některých případech je periferní ulcerózní keratitida prvním projevem dosud latentního systémového onemocnění. Může signalizovat přítomnost závažné systémové vaskulitidy a v krajním případě ohrožovat zrak perforací bulbu. Důležitá je proto především včasná diagnostika a adekvátní léčba vedená ve spolupráci revmatologa a oftalmologa. Oční postižení může být vedoucí formou manifestace u nízce aktivního základního onemocnění. Úlohou revmatologa je v takovém případě vést terapii celkového onemocnění s přihlédnutím k dynamice očního nálezu. Role oftalmologa poté spočívá v řešení lokálních komplikací a poskytování zpětné vazby. Pouze účinnou mezioborovou spoluprací lze dosáhnout uspokojivých výsledků léčby.
Klíčová slova:
Revmatoidní artritida, mimokloubní projevy, periferní ulcerózní keratitida, terapie
Úvod
Jednou ze vzácnějších komplikací systémových onemocnění pojiva je periferní ulcerózní keratitida (dále jen PUK). Jde o destruktivní zánět juxtalimbálního stromatu rohovky asociovaný s defektem epitelu, přítomností zánětlivých buněk ve stromatu a jeho degradací. Současně může být zánětem postižena přilehlá spojivka, skléra a episkléra. Toto závažné zánětlivé postižení periferie rohovky provázené jejím okrskovitým progresivním ztenčováním může vést v krajním případě až k perforaci bulbu. PUK je závažným projevem aktivity systémového autoimunitního procesu, který i přes možnosti soudobé imunosupresivní terapie zůstává diagnózou s nepříznivou prognózou. Důvodem je rychlá progrese nálezu a velký rozsah lézí, což často vede k perforaci bulbu ještě před nástupem účinku terapie (1). Těmto komplikacím lze předejít včasnou diagnózou, rozpoznáním základního systémového onemocnění a vhodnou léčbou.
Nejčastější onemocnění spojená s PUK jsou: revmatoidní artritida (dále jen RA), asociovaná s 34 % případů PUK (2), Wegenerova granulomatóza, relabující polychondritida, systémový lupus erythematodes, polyarteriitis nodosa a její formy, mikroskopická polyangiitida nebo Churg-Straussové syndrom.
Etiopatogeneze
Vzhledem k jedinečným anatomickým a imunologickým vlastnostem periferie rohovky se v této oblasti vyskytují afekce, které centrální část rohovky prakticky nepostihují. Díky intimnímu vztahu skléry, episkléry, spojivky a periferie rohovky se mohou onemocnění postihující výše uvedené tkáně (např. infekce, hypersenzitivní reakce nebo degenerace) sekundárně šířit přes limbus na přilehlou část rohovky. To je dáno především charakteristickým anatomickým uspořádáním cévního zásobení této oblasti. Oproti centrální avaskulární části získávají limbus a periferie rohovky část nutritivního zásobení z předních spojivkových a hlubokých episklerálních cév, které zasahují zhruba 0,5 mm přes limbus (3). Nutritivní řečiště je doprovázeno lymfatickými cévami drénovanými do spádových lymfatických uzlin. Touto cestou je umožněn omezený přestup některých molekul a buněk do rohovky. Oproti centru rohovky se zde tak ve zvýšené míře vyskytují molekuly IgM a C1 složky komplementu. Předpokládá se proto, že vznikající komplexy antigenů a protilátek zde mohou nadměrně aktivovat systém komplementu. V důsledku toho dochází k přitahování zánětlivých buněk včetně neutrofilů a makrofágů, uvolňujících významné množství proteolytických a kolagenolytických enzymů, jež mohou způsobovat destrukci rohovky (obr. 1) (4). Rovněž Langerhansovy a dendritické antigen-prezentující buňky se vyskytují ve zvýšené míře především ve spojivce a na periferii rohovky. Svou produkcí mediátorů zánětu mohou přispívat ke vzniku periferní rohovkové ulcerace (5). Přítomnost výše zmíněných elementů zde predisponuje k většímu riziku alterace širokou škálou infekčních i neinfekčních onemocnění systémového i lokálního charakteru. Postižení rohovky tohoto typu vzniklá uvedenými mechanismy shrnujeme pod nozologickou jednotku periferní ulcerózní keratitidy.
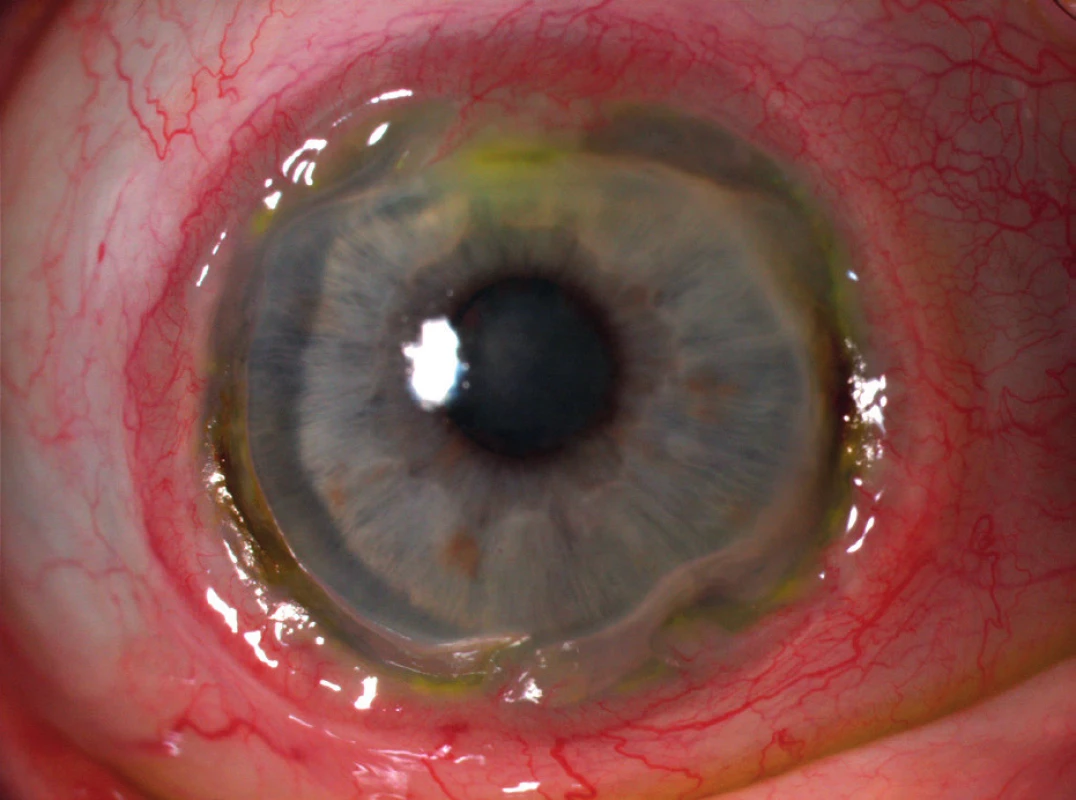
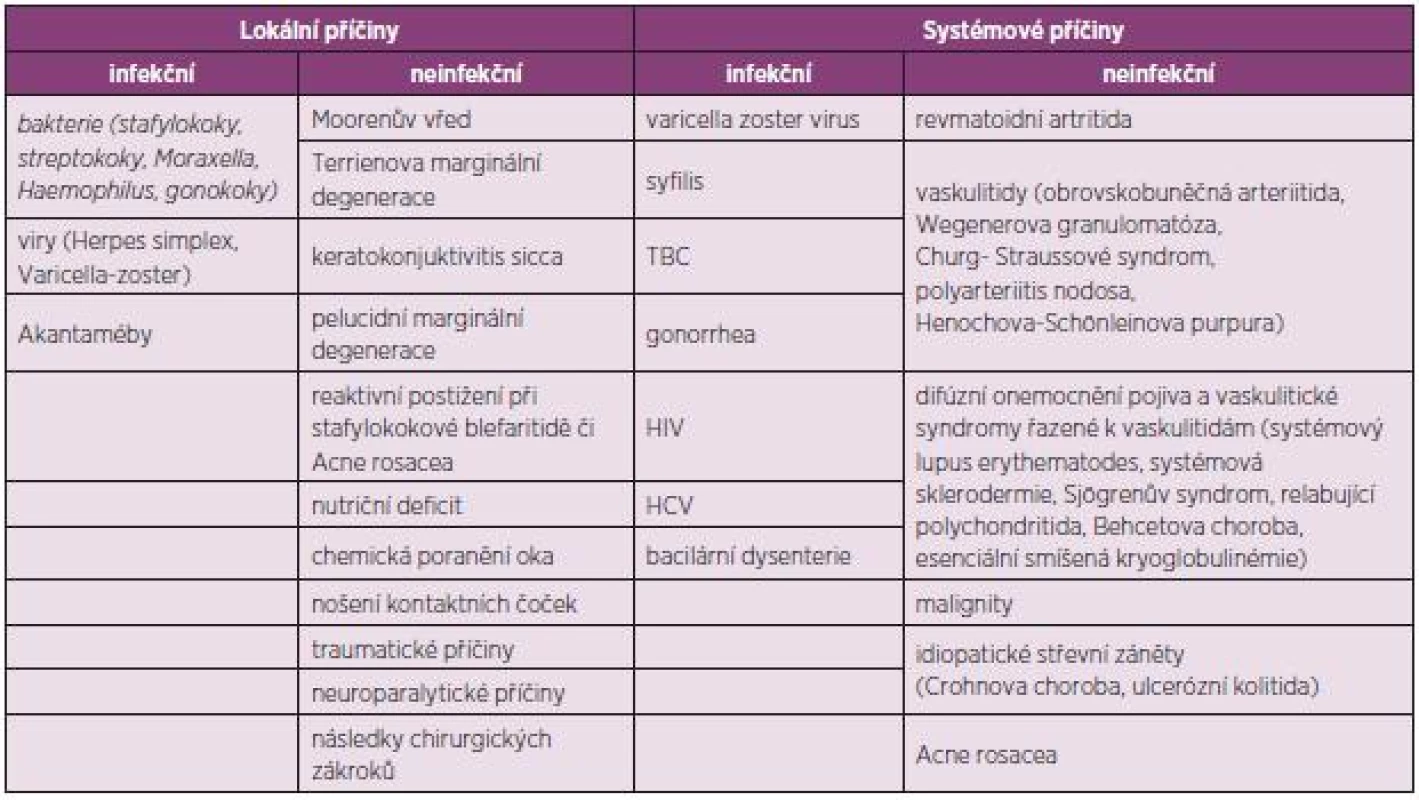
Ke ztenčení periferní části rohovky může docházet v důsledku zánětlivého procesu způsobeného hypersenzitivní reakcí spouštěnou mechanismy autoimunity (neinfekční příčiny) či exogenními faktory (infekční příčiny). PUK infekčního původu mohou způsobovat například bakterie (S. aureus, Pneumococcus, Pseudomonas sp.), viry (Herpes simplex virus, Varicella zoster virus, Human immunodeficiency virus), houby a paraziti (Acantamoeba). Příčiny dělíme na lokální a systémové, obojí pak dále na infekční a neinfekční (viz tabulka 1).
Diagnóza
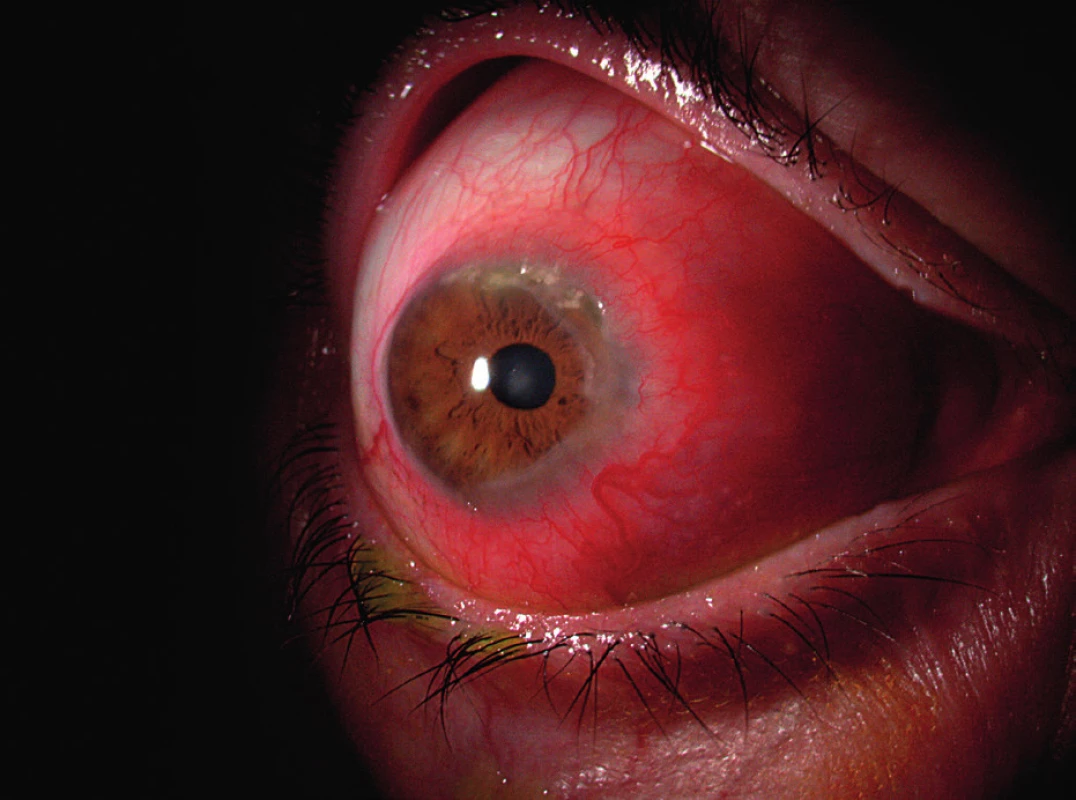
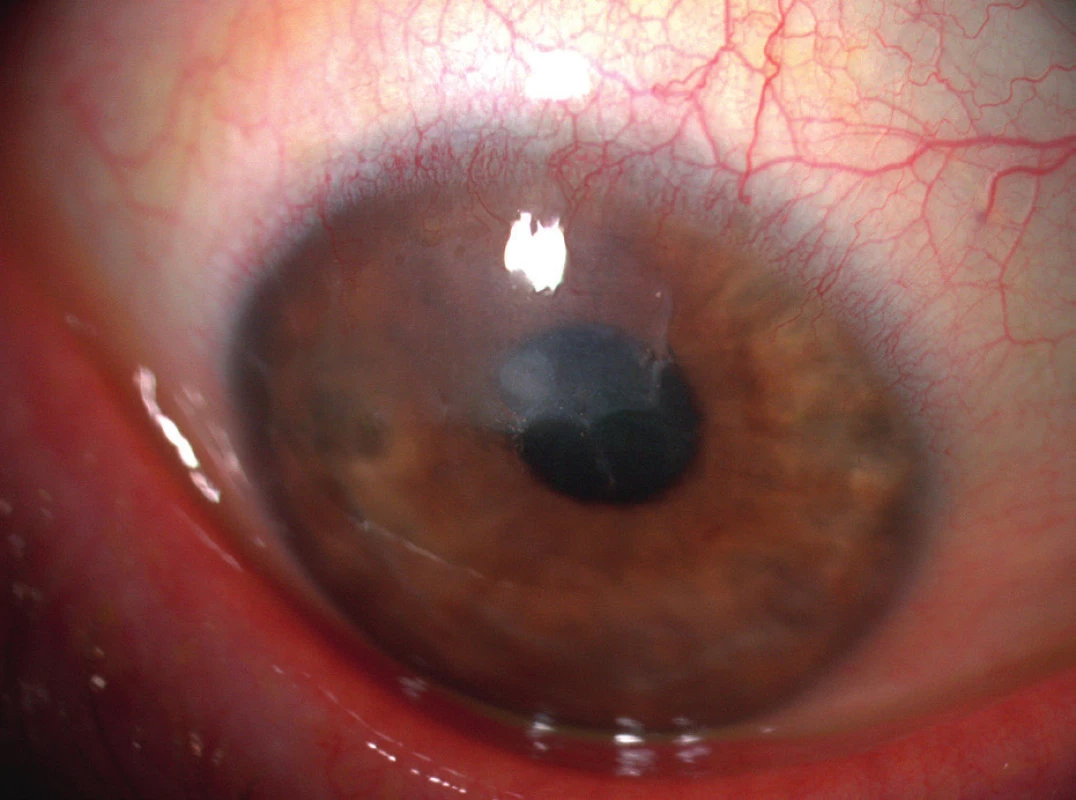
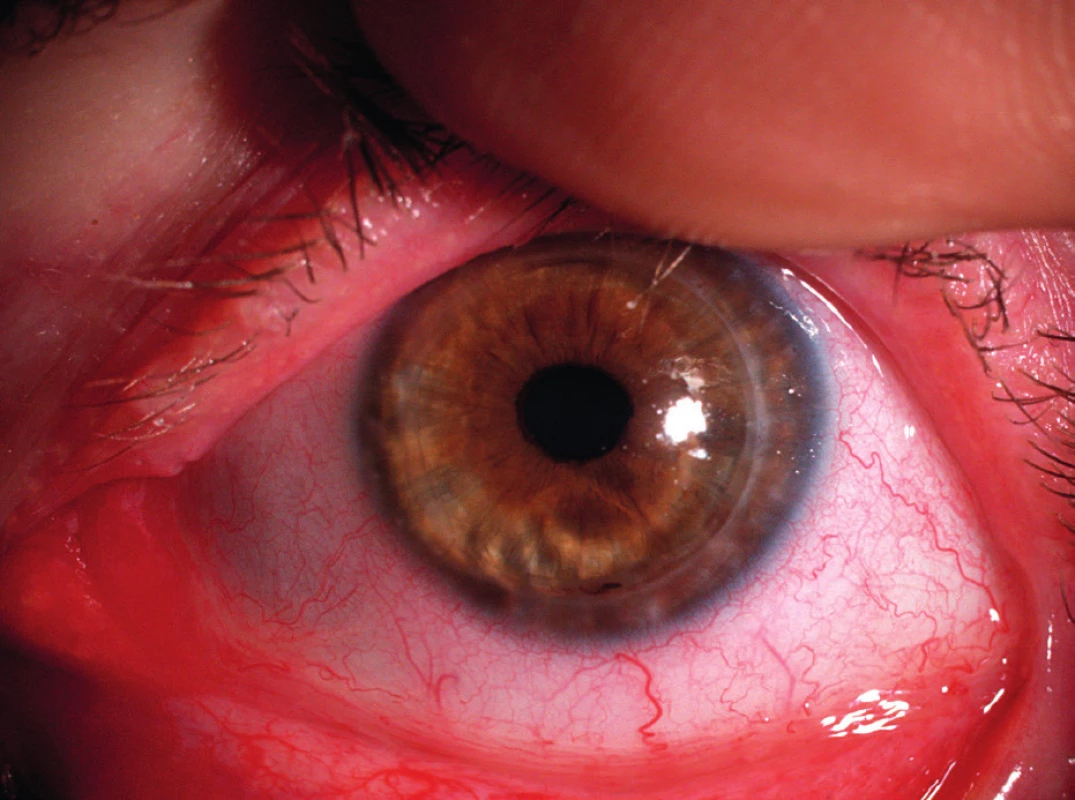
Hlavními symptomy PUK jsou slzení, bolest oka, fotofobie a zhoršení zrakové ostrosti v důsledku indukovaného astigmatismu. Často uváděná podmínka výskytu příznaku červeného oka pro diagnózu PUK je zavádějící, neboť u pacientů s PUK neinfekční etiologie (např. u revmatiků) může proces probíhat i na zcela klidném oku (obr. 2).
Nález nekrotizující skleritidy a PUK při očním vyšetření může značit přítomnost potenciálně smrtelné systémové vaskulitidy, která vyžaduje celkovou imunosupresivní terapii. Měl by proto vždy vést k podrobnému dovyšetření pacienta. Foster a kol. uvádějí desetileté přežití neléčených pacientů s RA a současnými projevy PUK/nekrotizující skleritidy pouze zhruba v 50 % (6).
Při vyšetření pacienta je důležité zaměřit se především na současné převládající obtíže, důkladnou osobní a rodinnou anamnézu a minulou i současnou terapii. Cíleně se dotazujeme na příznaky systémových onemocnění pojiva. Nezbytnou součástí je i fyzikální vyšetření hlavy, krku a končetin a pátrání po kožních symptomech. Neexistuje žádný doporučený soubor diagnostických testů přímo určený k průkazu etiologie PUK. Kromě výše zmíněné anamnézy a fyzikálního vyšetření jsou stěžejní součástí diagnostického procesu i laboratorní vyšetření – např. krevní obraz s diferenciálním rozpočtem, sedimentace, stanovení hladin C-reaktivního proteinu, alfa-1 glykoproteinu, imunoglobulinů, properdinu a dalších složek komplementu, revmatoidního faktoru, ANA a ANCA protilátek. Přesný panel zvolených vyšetření závisí na předpokládané diagnóze. Mimo laboratorních metod lze využít i jiná pomocná vyšetření – např. RTG snímky srdce a plic či dlouhých kostí. Další možností k upřesnění diagnózy je biopsie spojivky z okolí rohovkové ulcerace, především v případech podezření na PUK asociovanou s autoimunitním onemocněním. Vzorky mohou být zpracovány pomocí elektronové mikroskopie, imunologických metod (ELISA) či PCR.
Vyhodnocení klinických nálezů, výsledků laboratorních vyšetření a bioptického rozboru hraje důležitou roli při diagnostice, určování prognózy onemocnění a rozhodování o cílené terapii. PUK může být první manifestací latentního systémového onemocnění, jehož ostatní projevy může předcházet i o několik let (7).
Terapie
Léčba PUK je vedena zároveň cestou ovlivnění základního onemocnění a očních symptomů. Nehledě na intenzitu lokální terapie nelze dosáhnout uspokojivých výsledků bez dostatečně agresivní systémové léčby, kterou je nutno modifikovat dle progrese a závažnosti očního nálezu. Současná strategie léčby PUK na podkladě systémové choroby pojiva během akutní fáze onemocnění spočívá v celkovém podávání kortikoidů a farmak s cytotoxickým účinkem. Volba podávaného imunosupresiva závisí na typu základního onemocnění. Cílem terapie očního postižení je zmírnění zánětlivého procesu, podpora epitelizace a minimalizace ztenčení stromatu rohovky. Přes pokroky dosažené ve vývoji nových imunomodulancií a biologických léčiv závisí konečný výsledek především na včasné diagnóze a charakteru systémového onemocnění. Avšak ani dobrá kontrola aktivity základního onemocnění neumožňuje ve všech případech předejít vzniku očního postižení. Například Squirrell a kol. uvádějí ve své případové studii, že u 8 z 9 sledovaných pacientů došlo k rozvoji PUK i přes několikaletou absenci synovitidy, elevace zánětlivých parametrů či jiných progresivních extraartikulárních změn. Všichni sledovaní pacienti nicméně měli předchozí dlouhou anamnézu séropozitivní nodulární RA s vysokým titrem protilátek (8). Neexistuje jasný konsenzus ohledně optimální doby trvání terapie PUK asociované s RA. PUK může představovat komplexní, obtížně řešitelný oftalmologický problém. Rozhodnutí ohledně délky terapie závisí na několika faktorech: a) zda je onemocnění rohovky asociováno se systémovou vaskulitidou, b) zda adekvátně odpovídá na farmakoterapii, c) zda vyžaduje chirurgickou intervenci, d) zda došlo k sekundární infekci. Nezbytný je individuální přístup ke každému případu a úzká spolupráce revmatologa a oftalmologa.
Lokální terapie
Značná část pacientů s RA trpí zároveň poruchou slzného filmu (zhruba 90 % (9) ). Tyto poruchy bývají nejčastěji důsledkem sekundárního Sjögrenova syndromu, jehož charakteristickým obrazem je keratoconjunktivitis sicca. Fox a kol. udávají incidenci sekundárního Sjögrenova syndromu u revmatiků v rozmezí 11–31 % (10). Obecně je popisována významná statistická korelace výskytu syndromu suchého oka s délkou trvání onemocnění RA (11). Významnou součástí úspěšné léčby je proto zvlhčování očního povrchu, a to nejlépe lubrikancii bez konzervačních látek ve formě kapek nebo gelů (4). Účinnost této terapie je vhodné potencovat aplikací silikonových zátek do punctum lacrimale. Uzávěrem slzných cest docílíme prodloužení doby působení kapek na povrchu oka. K profylaxi bakteriální superinfekce před chirurgickým zákrokem je doporučována aplikace antibiotických kapek, nejlépe bez konzervačních látek, nebo s jejich sníženým obsahem. Lokálně podávané kortikoidy nejsou doporučovány jako terapie první volby u pacientů s přidruženým systémovým onemocněním. Tyto látky totiž inhibují novotvorbu kolagenu a tím zvyšují riziko perforace (12–14). Jejich využití je vhodné omezit na pooperační období, vždy s ohledem na vývoj očního nálezu a průběh epitelizace povrchu rohovky (1). Jako účinnou lokální protizánětlivou terapii lze užít rovněž magisteraliter připravované 2% cyklosporinové kapky. Jejich nevýhodou je horší snášenlivost (pálení očí v úvodních fázích terapie), na což je třeba pacienty předem upozornit (15).
Systémová terapie
Glukokortikoidy
Celkově podávané kortikoidy jsou tradičně na prvním místě v terapii akutních fází PUK. Jako monoterapie jsou však často nedostačující ke zpomalení progrese onemocnění a překonání autoimunitní choroby. Jejich výhodou naopak je rychlejší nástup působení oproti ostatním imunosupresivům, u nichž dosažení plné účinnosti trvá řádově několik týdnů. Obvyklá úvodní dávka je 1 mg/kg/den (maximálně 60 mg/den) s postupným snižováním dávky v závislosti na klinické odpovědi. U pacientů bezprostředně ohrožených ztrátou vizu mohou být podávány pulsy metylprednisolonu v dávce 1 g/den ve 3 po sobě následujících dnech. Glukokortikoidy mohou být podávány společně s dalšími imunosupresivy nebo biologickou léčbou. Výjimku tvoří refrakterní případy nereagující na kortikoterapii. Jejich užití omezujeme rovněž v případě, že nežádoucí účinky převýší benefit terapie. U takových pacientů jsou podávána jiná imunosupresiva v monoterapii (12, 14, 16–18). Ačkoli steroidy mají vysoce pozitivní efekt na oční a systémové příznaky, nesnižují dle Fostera (6) prokazatelně míru mortality u pacientů s vaskulitidou.
Imunosupresiva, imunomodulancia
Dosud neexistuje jednoznačná shoda v otázce užití konkrétních imunomodulancií pro různé klinické jednotky. Jabs a kol. vypracovali rozsáhlý přehled doporučených dávkovacích schémat a příkladů užití pro jednotlivá imunosupresiva (19). V současnosti užívanými druhy imunosupresiv jsou: antimetabolity, alkylační látky, inhibitory T-lymfocytů a biologická léčba. K antimetabolitům se řadí methotrexát, azathioprin, mykofenolát mofetil a leflunomid. Methotrexát a azathioprin jsou nejužívanějšími antimetabolity v torpidních případech PUK u revmatiků, neodpovídajících na perorální kortikoterapii. V několika studiích je popisován dobrý efekt per os podávaného methotrexátu v dávkách v rozmezí 7,5–25 mg/týden a azathioprinu v dávce 1,0–2,5 mg/kg/den (6, 8, 19, 20). V závažnějších případech neodpovídajících na výše zmíněnou terapii jsou doporučovány alkylační látky – cyklofosfamid a chlorambucil. V retrospektivní případové studii Messmer a Foster udávají, že tato cytotoxická imunosupresiva jsou vysoce efektivní u pacientů rezistentních k systémové kortikoterapii (21). Ačkoli cyklofosfamid je těmito autory hodnocen jako nejúčinnější, doporučují jako potenciální imunosupresivum první volby methotrexát. Důvodem je prakticky srovnatelně vysoká efektivita a menší toxicita. Cyklofosfamid lze podávat per os v dávkách 1–2 mg/kg/den nebo jako pulsní intravenózní terapii každé 3–4 týdny pod vedením revmatologa nebo internisty (8, 19, 21–23). Nedávné studie upřednostňují užití mykofenolát mofetilu dávce 1,0 g dvakrát denně před terapií azathioprinem a methotrexátem z důvodu menšího množství nežádoucích účinků a lepší kontroly zánětlivého procesu (19, 24–26). V České republice podléhá užití tohoto léčiva schválení revizním lékařem. Současně je jeho užití omezeno i pro vyšší cenu, a proto je vyhrazeno především pro refrakterní případy. Některé klinické studie popisují příznivý efekt leflunomidu v terapii očních zánětů (27).
Biologická léčba
TNF-alfa blokátory byly prokázány jako bezpečná a efektivní terapie k navození klinické remise u pacientů s aktivní ulcerózní kolitidou a revmatoidní artritidou, u kterých selhala systémová terapie kortikoidy a imunosupresivy (28, 29).
Infliximab byl poprvé využit v terapii panuveitidy a skleritidy asociované s RA v r. 2001 (30, 31). V současnosti je infliximab indikován v terapii systémových onemocnění pojiva nebo autoimunitních vaskulitid s doprovodnou PUK a dále u jiných očních zánětů typu nekrotizující skleritidy či uveitidy (32–35). Jedná se o specifickou chimerickou monoklonální protilátku proti prozánětlivému cytokinu TNF-alfa. Ten stimuluje produkci matrixových metaloproteináz zodpovědných za lýzu stromatu rohovky u PUK. Infliximab ovlivňuje jak solubilní, tak membránově vázaný TNF-alfa tím, že blokuje jeho receptor. Jeho navázání v buňkách exprimujících transmembránový TNF-alfa může rovněž podporovat jejich odstraňování komplementem a tím zvyšovat protizánětlivý efekt (33, 36). Dávkování infliximabu se liší od 3 mg/kg i.v. v případech RA do 5 mg/kg i.v. u Crohnovy choroby. Je podáván v 0., 2. a 6. týdnu a dále každých 6–8 týdnů po dobu 18 měsíců. Ke zlepšení stavu dochází již 1–2 týdny po první infuzi. Ačkoli optimální frekvence a dávkování infliximabu pro PUK či perforaci rohovky nebyly dosud stanoveny, jako vhodné se jeví obdobné dávkovací schéma jako u RA (33, 35, 37). Dalšími biologickými preparáty využívanými v terapii PUK jsou etanercept a rituximab. Etanercept je lidský rekombinantní dimerický fúzní protein, napodobující účinek přirozených solubilních TNF-alfa receptorů. Je využíván v terapii refrakterní uveitidy, nekrotizující skleritidy a keratitidy. V léčbě očních zánětů je však méně účinný než infliximab, což může souviset se schopností infliximabu vázat i transmembránový TNF-alfa. Rituximab, chimerická protilátka proti antigenu CD20-alfa, exprimovanému B-lymfocyty, je v poslední době využíván v léčbě refrakterní PUK asociované s Wegenerovou granulomatózou (33, 38–40).
Chirurgické řešení
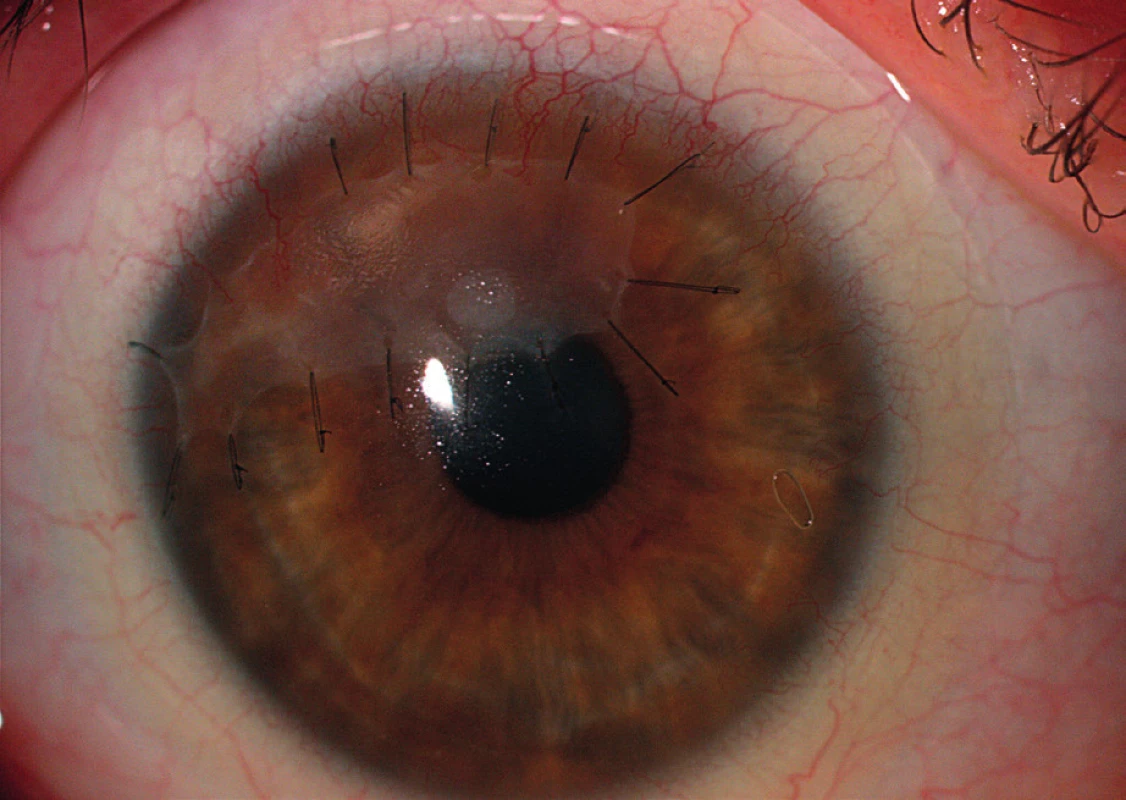
Chirurgická řešení jsou využívána převážně k zachování integrity bulbu. Řadíme sem transplantace amniové membrány, lamelární a perforující keratoplastiky, použití tkáňových lepidel a terapeutických kontaktních čoček. Momentálně nejrozšířenější metodou v terapii PUK s hrozící perforací je našití amniové membrány do defektu v jedné či v případě potřeby i ve více vrstvách (obr. 3). Lidská amniová membrána je tenká kolagenní tkáň, skládající se ze stromatu, bazální membrány a vrstvy epitelových buněk. Je připravována z placenty získané při porodu císařským řezem. V oftalmologii je využívána pro své mimořádné hojivé účinky a proliferační potenciál. Je pravděpodobné, že biologické vlastnosti amniové membrány ovlivňují zánět pomocí exprese Fas-ligandů, HLA-G antigenu a aktivace supresorových mechanismů T-lymfocytů (41–44). Výsledkem je snížení zánětlivé aktivity a navození reepitelizace (obr. 4). Další možností řešení je provedení perforující keratoplastiky (dále jen PKP). Principem operace je odstranění rohovky v celé tloušťce a její náhrada kadaverózním štěpem (terčem) (obr. 5). Zákrok by měl být spojen s odpovídající úpravou imunosupresivní terapie. Maeno a kol. udávají, že v souboru provedených PKP měla ze všech indikací ulcerózní keratitida největší pravděpodobnost rejekce štěpu, a to i přes pokroky v cytotoxické terapii (45). Resekce perilimbální spojivky postižené při PUK pomáhá odstranit imunokomplexy, snížit produkci kolagenáz a proteináz a zmírnit tak zánětlivou reakci. Tento způsob řešení je však kontroverzní, neboť je popisována rekurence PUK poté, co spojivka doroste zpět k limbu (5, 12–14, 17). Užití tkáňových lepidel je vhodné u pacientů s hrozící perforací a velikostí defektu do 2 mm. Je kombinováno s aplikací terapeutické kontaktní čočky za účelem předcházení diskomfortu po zákroku (14). V praxi se přikláníme spíše k levnějším variantám: histoakrylátovým a cyanoakrylátovým lepidlům.
Závěr
Periferní ulcerózní keratitida je onemocnění ohrožující zrak, spojené především s dlouhotrvající séropozitivní RA. Může být projevem aktivity základního onemocnění. Proto by mělo být považováno za závažnou komplikaci RA a postižení pacienti by měli být důkladně sledováni. Je nutné u nich pravidelně pátrat po známkách aktivity systémové vaskulitidy. Revmatologové by měli mít na paměti, že PUK se může projevovat nespecifickými očními symptomy. Pouhé zevrubné zhodnocení klinického obrazu je nedostačující ke stanovení diagnózy. Udává-li pacient nově vzniklou bolest oka (kontrastující s dlouhodobým pocitem diskomfortu v rámci projevů poruchy slzného filmu), ztrátu zrakové ostrosti, ohraničené zarudnutí spojivky či zvýšené slzení předtím suchého oka, je doporučeno časné vyšetření oftalmologem. Výše uvedené příznaky totiž mohou poukazovat na závažné onemocnění rohovky. PUK by měla být léčena dostatečně intenzivní imunosupresí v úzké spolupráci mezi revmatologem a oftalmologem. Lze tak předcházet nevratnému postižení zraku a snížit mortalitu asociovanou s dalšími komplikacemi RA.
Autoři děkují archivu Oční kliniky Všeobecné fakultní nemocnice v Praze a 1. LF UK za laskavé poskytnutí obrazové dokumentace.
Adresa pro korespondenci:
MUDr. Nikola Járová
Oblastní nemocnice Mladá Boleslav, a.s., Nemocnice Středočeského kraje
V. Klementa 147
293 50 Mladá Boleslav
nikola.jarova@seznam.cz
tel. 326 743 214
Zdroje
1. Svobodová M, Palos M. Periferní ulcerózní keratitida jako komplikace revmatoidní artritidy – výsledky retrospektivní studie. XXI výroční sjezd České oftalmologické společnosti ČLS JEP; Brno: Hanzo production, spol. s r.o.; 2013. p. 104–5.
2. Silva B, Cardozo J, Marback P, Machado F, Galvão V, Santiago M. Peripheral ulcerative keratitis: a serious complication of rheumatoid arthritis. Rheum Int 2010; 30(9): 1267–8.
3. Hogan M AJ, Weddell J. Histology of the Human Eye – An Atlas and Textbook. 2nd ed. Philadelphia: WB Saunders; 1971.
4. Chung G. Phlyctenular keratoconjunctivitis and marginal staphylococcal keratitis. Krachmer J, Mannis M, Holland E (eds). Cornea, 3rd ed. Amsterdam: Elsevier; 2011. p. 1307–10.
5. Mondino BJ. Inflammatory diseases of the peripheral cornea. Ophthalmology 1988; 95(4): 463–72.
6. Foster CS, Forstot SL, Wilson LA. Mortality rate in rheumatoid arthritis patients developing necrotizing scleritis or peripheral ulcerative keratitis. Effects of systemic immunosuppression. Ophthalmology 1984; 91(10): 1253–63.
7. Ali NAM, Mathew R, Joshi N. Peripheral ulcerative keratitis as the initial presentation of rheumatoid arthritis. Brunei Int Med J 2012; 8(6): 353–7.
8. Squirrel DM, Winfield J, Amos RS. Peripheral ulcerative keratitis ‘corneal melt’ and rheumatoid arthritis: a case series. Br J Rheumatol 1999; 38:1245–8.
9. Baldassano VF, Jr. Ocular manifestations of rheumatic diseases. Curr Opin Ophthalmol 1998; 9(6): 85–8.
10. Fox RI, Stern M, Michelson P. Update in Sjögren syndrome. Curr Opin Rheumatol 2000; 12(5): 391–8.
11. Polanska V, Sery O, Fojtik Z, Hlinomazova Z. The presence of dry eye syndrome and corneal complications in patients with rheumatoid arthritis and its association with -174 gene polymorphism for interleukin 6. Cesk Slov Oftalmol 2008; 64(2): 77–80.
12. Galor A, Thorne JE. Scleritis and peripheral ulcerative keratitis. Rheum Dis Clin N Am 2007; 33(4): 835–54.
13. Tauber J, de la Maza MS, Hoang-Xuan T, Foster CS. An analysis of therapeutic decision making regarding immunosuppressive chemotherapy for peripheral ulcerative keratitis. Cornea 1990; 9(1): 66–73.
14. Gregory JK, Foster CS. Peripheral ulcerative keratitis in the collagen vascular diseases. Int Ophthalmol Clin 1996; 36(1): 21–30.
15. Bachmann B, Jacobi C, Cursiefen C. Augenentzündungen bei entzündlichen Systemerkrankungen: Keratitis. Klin Monatsbl Augenheilkd 2011; 228(05): 413–8.
16. Ladas JG, Mondino BJ. Systemic disorders associated with peripheral corneal ulceration. Curr Opin Ophthalmol 2000; 11(6): 468–71.
17. Messmer EM, Foster CS. Vasculitic peripheral ulcerative keratitis. Surv Ophthalmol 1999; 43(5): 379–96.
18. Dana MR, Qian Y, Hamrah P. Twenty-five-year panorama of corneal immunology: emerging concepts in the immunopathogenesis of microbial keratitis, peripheral ulcerative keratitis, and corneal transplant rejection. Cornea 2000; 19(5): 625–43.
19. Jabs DA, Rosenbaum JT. Guidelines for the use of immunosuppressive drugs in patients with ocular inflammatory disorders: recommendations of an expert panel. Am J Ophthalmol 2001; 131(5): 679.
20. Sainz de la Maza M, Foster C, Jabbur NS, Baltatzis S. Ocular characteristics and disease associations in scleritis-associated peripheral keratopathy. Arch Ophthalmol 2002; 120(1): 15–9.
21. Messmer EM, Foster CS. Destructive corneal and scleral disease associated with rheumatoid arthritis. Medical and surgical management. Cornea 1995; 14(4): 408–17.
22. McCarthy JM, Dubord PJ, Chalmers A, Kassen BO, Rangno KK. Cyclosporine A for the treatment of necrotizing scleritis and corneal melting in patients with rheumatoid arthritis. J Rheumatol 1992; 19(9): 1358–61.
23. Diaz-Valle D, Benitez del Castillo JM, Castillo A, Sayagues O, Banares A, Garcia-Sanchez J. Immunologic and clinical evaluation of postsurgical necrotizing sclerocorneal ulceration. Cornea 1998; 17(4): 371–5.
24. Galor A, Jabs DA, Leder HA, Kedhar SR, Dunn JP, Peters GB 3rd, et al. Comparison of antimetabolite drugs as corticosteroid-sparing therapy for noninfectious ocular inflammation. Ophthalmology 2008; 115(10): 1826–32.
25. Thorne JE, Jabs DA, Qazi FA, Nguyen QD, Kempen JH, Dunn JP. Mycophenolate mofetil therapy for inflammatory eye disease. Ophthalmology 2005; 112(8): 1472–7.
26. Sobrin L, Christen W, Foster CS. Mycophenolate mofetil after methotrexate failure or intolerance in the treatment of scleritis and uveitis. Ophthalmology 2008; 115(8): 1416–21
27. Robertson SM, Lang LS. Leflunomide: inhibition of S-antigen induced autoimmune uveitis in Lewis rats. Agents Actions 1994; 42(3-4): 167–72.
28. Reinisch W, Sandborn WJ, Hommes DW, D'Haens G, Hanauer S, Schreiber S, et al. Adalimumab for induction of clinical remission in moderately to severely active ulcerative colitis: results of a randomised controlled trial. Gut 2011; 60(6): 780–7.
29. Wiens A, Venson R, Correr CJ, Otuki MF, Pontarolo R. Meta-analysis of the efficacy and safety of adalimumab, etanercept, and infliximab for the treatment of rheumatoid arthritis. Pharmacotherapy 2010; 30(4): 339–53.
30. Sfikakis PP, Theodossiadis PG, Katsiari CG, Kaklamanis P, Markomichelakis NN. Effect of infliximab on sight-threatening panuveitis in Behcet's disease. Lancet 2001; 358(9278): 295–6.
31. Smith JR, Levinson RD, Holland GN, Jabs DA, Robinson MR, Whitcup SM, et al. Differential efficacy of tumor necrosis factor inhibition in the management of inflammatory eye disease and associated rheumatic disease. Arthritis Rheum 2001; 45(3): 252–7.
32. Oh J, Kim M, Wee W. Infliximab for progressive peripheral ulcerative keratitis in a patient with juvenile rheumatoid arthritis. Jpn J Ophthalmol 2011; 55(1): 70–1.
33. Odorcic S, Keystone EC, Ma JJ. Infliximab for the treatment of refractory progressive sterile peripheral ulcerative keratitis associated with late corneal perforation: 3-year follow-up. Cornea 2009; 28(1): 89–92.
34. Pham M, Chow CC, Badawi D, Tu EY. Use of infliximab in the treatment of peripheral ulcerative keratitis in Crohn disease. Am J Ophthalmol 2011; 152(2): 183–8.
35. Thomas JW, Pflugfelder SC. Therapy of progressive rheumatoid arthritis-associated corneal ulceration with infliximab. Cornea 2005; 24(6): 742–4.
36. Tugal-Tutkun I, Ayranci Ö, Kasapcopur Ö, Kir N. Retrospective analysis of children with uveitis treated with infliximab. J AAPOS 2008; 12(6): 611–3.
37. Murphy CC, Ayliffe WH, Booth A, Makanjuola D, Andrews PA, Jayne D. Tumor necrosis factor alpha blockade with infliximab for refractory uveitis and scleritis. Ophthalmology 2004; 111(2): 352–6.
38. Tarabishy AB, Schulte M, Papaliodis GN, Hoffman GS. Wegener's granulomatosis: clinical manifestations, differential diagnosis, and management of ocular and systemic disease. Surv Ophthalmol 2010; 55(5): 429–44.
39. Theodossiadis PG, Markomichelakis NN, Sfikakis PP. Tumor necrosis factor antagonists: preliminary evidence for an emerging approach in the treatment of ocular inflammation. Retina 2007; 27(4): 399-413.
40. Hernandez-Illas M, Tozman E, Fulcher SF, Jundt JW, Davis J, Pflugfelder SC. Recombinant human tumor necrosis factor receptor Fc fusion protein (Etanercept): experience as a therapy for sight-threatening scleritis and sterile corneal ulceration. Eye Contact Lens 2004; 30(1): 2–5.
41. Shimmura S, Shimazaki J, Ohashi Y, Tsubota K. Antiinflammatory effects of amniotic membrane transplantation in ocular surface disorders. Cornea 2001; 20(4): 408–13.
42. Houlihan JM, Biro PA, Harper HM, Jenkinson HJ, Holmes CH. The human amnion is a site of MHC class Ib expression: evidence for the expression of HLA-E and HLA-G. J Immunol 1995; 154(11): 5665–74.
43. Griffith TS, Brunner T, Fletcher SM, Green DR, Ferguson TA. Fas ligand-induced apoptosis as a mechanism of immune privilege. Science 1995; 270(5239): 1189–92.
44. McGhee CNJ, Patel DV. Mooren's ulcer and amniotic membrane transplant: a simple surgical solution? Clin Exp Ophthalmol 2011; 39(5): 383–5.
45. Maeno A, Naor J, Lee HM, Hunter WS, Rootman DS. Three decades of corneal transplantation: indications and patient characteristics. Cornea 2000; 19(1): 7–11.
Štítky
Dermatológia Detská reumatológia ReumatológiaČlánok vyšiel v časopise
Česká revmatologie

2014 Číslo 2
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- Výhody subkutánně podávaného methotrexátu
Najčítanejšie v tomto čísle
- Metatarzalgie u pacientů s revmatoidní artritidou
- Periferní ulcerózní keratitida – závažná komplikace revmatoidní artritidy
- Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie
- 18F-FDG PET a PET/CT vyšetření u pacientů s obrovskobuněčnou arteritidou – praktický pohled z PET centra
