-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Polymorfismus C677T genu pro methylentetrahydrofolát reduktázu je spojen se změnou léčebné odpovědi na methotrexát v populaci revmatoidní artritidy Východočeského regionu
The C677T polymorphism in the methylentetrahydrofolate reductase gene is associated with methotrexate treatment outcome in the East Bohemian region rheumatoid arthritis population
Methotrexate (MTX) is one of the essential medicines used in the treatment of rheumatoid arthritis (RA). The efficacy of treatment of rheumatoid arthritis with MTX is between 46 % and 65 % (as assessed by ACR 20). Pharmacogenetics deals with genetic predisposition of the patient to respond to the treatment.
The aim of the study was to determine whether single nucleotide polymorphism (SNP) C677T (rs1801133) of the MTHFR gene are predictive of peroral MTX efficacy or are associated with lower change of DAS28 (∆DAS 28) after a 6-month MTX treatment in RA adult patient cohort of the East Bohemian population. The 120 patients were enrolled in the study, all of whom fulfilled the American College of Rheumatology (ACR) 1987 RA criteria, and currently or previously taking MTX oral treatment, either as a monotherapy (n = 65) or in a combination with DMARDs (n = 55). Genotyping was performed using qPCR allelic discrimination. We did not found any association of C677T SNP on MTX treatment inefficacy in dominant model CC versus (CT+TT). However, when ∆DAS 28 was used as a measure of MTX treatment efficacy, MTHFR 677CT genotype was significantly associates with less favourable response to MTX (P = 0.01) in case of MTX monotherapy.
Our data thus shows that C677T SNP might be associated with theless favourable response to low dose MTX treatment.Key words:
Rheumatoid arthritis, methotrexate, methylentetrahydrofolate reductase, pharmacogenetics, personalized medicine
Autoři: T. Soukup 1; M. Doseděl 2; P. Pávek 3; J. Nekvindová 4; T. Veleta 5; A. Kuběna 2; M. Tošovský 1; J. Vlček 2; P. Bradna 1
Působiště autorů: Univerzita Karlova v Praze, Lékařská fakulta a Fakultní nemocnice v Hradci Králové, II. interní gastroenterologická klinika 1; Univerzita Karlova v Praze, Farmaceutická fakulta v Hradci Králové, Katedra sociální a klinické farmacie 2; Univerzita Karlova v Praze, Farmaceutická fakulta v Hradci Králové, katedra farmakologie a toxikologie 3; Univerzita Karlova v Praze, Lékařská fakulta a Fakultní nemocnice v Hradci Králové, Ústav klinické biochemie a diagnostiky 4; Fakultní nemocnice Hradec Králové, Oddělení urgentní medicíny 5
Vyšlo v časopise: Čes. Revmatol., 23, 2015, No. 1, p. 4-12.
Kategorie: Originální práce
Souhrn
Methotrexát (MTX) patří k základním lékům používaným při léčbě revmatoidní artritidy (RA). Efektivita léčby MTX u RA se pohybuje mezi 46 % až 65 % (hodnoceno podle kritéria ACR 20). Farmakogenetika se zabývá genetickou predispozicí pacienta pro odpověď na danou léčbu.
Cílem práce bylo zjistit, zda jednonukleotidový polymorfismus (SNP) C677T (rs1801133) pro MTHFR gen predikuje odpověď na perorální léčbu MTX u pacientů s RA z Východočeského regionu. Hodnocení účinnosti bylo provedeno na základě sledování změny DAS 28 (∆DAS 28) během prvních šesti měsíců léčby MTX. Do studie bylo zařazeno 120 pacientů, všichni splnili klasifikační kritéria pro RA (American College of Rheumatology – ACR 1987) a v minulosti nebo v současnosti byli léčeni perorálním MTX. Část nemocných byla léčena monoterapií MTX s glukokortikoidy nebo bez nich (n = 65), ostatní (n = 55) pacienti užívali MTX a zároveň konvenční syntetický DMARD nebo biologikum. Genotypizace byla provedena použítím qPCR alelické diskriminace. Při hodnocení za pomocí tzv. dominantního modelu CC versus (CT+TT) jsme nenalezli asociaci C677T SNP a EULAR odpovědi na léčbu MTX. Porovnáním genotypů (všech homozygotů a heterozygotů) za použití ∆DAS 28 během šesti měsíců MTX léčby jsme nalezli signifikatně zhoršenou odpověď na léčbu u genotypu 677CT (p = 0,01) u pacientů na MTX monoterapii. Tato asociance nebyla nalezena u skupiny kombinace MTX s jinými DMARDs (konvenčními syntetickými nebo biologickými) (p = 0,886).
Naše data svědčí pro možnou spojitost C677T SNP se zhoršenou odpovědí na léčbu MTX u RA.Klíčová slova:
Revmatoidní artritida, methotrexát, methylentetrahydrofolát reduktáza, farmakogenetika, personalizovaná medicínaÚvod
Methotrexát (MTX) je základním lékem používaným při léčbě revmatoidní artritidy (RA) (1, 2). Jsou důkazy o účinnosti MTX na klinické symptomy nemoci pro časnou a pozdní RA se střední i vyšší aktivitou. Je znám vliv na zpomalení rentgenové progrese. MTX je součástí primární léčebné strategie u pacientů s aktivní RA a je vysoce efektivní v monoterapii, kombinaci s glukokortikoidy nebo jinými konvenčními syntetickými, chorobu modifikujícími léky (csDMARDs) a biologickými DMARDs (bDMARDs). Významný efekt je pozorován již po 4–6měsíční léčbě (4–8). Efektivita léčby RA MTX je mezi 46 % až 65 % (hodnoceno podle kritéria ACR 20). Při léčbě MTX se může vyskytnout celá řada nežádoucích účinků (NÚ). Alespoň jeden se objeví až u 72,9 % pacientů, závažné projevy toxicity se zjišťují až u 30 % pacientů.
Farmakogenetika je nový moderní směr klinické farmakoterapie umožňující personalizaci terapie na základě zjištění genetické predispozice pacienta pro odpověď na danou léčbu. Farmakogenetika se zabývá studiem geneticky podmíněné variability (většinou ve formě jednonukleotidových polymorfismů – single nucleotid polymorphisms (SNPs). Znalost genetických změn vedoucích k této variabilitě a možnost předpovědět reakci na léčbu může umožnit včasnou změnu dávkování nebo vysazení léčiva tak, aby pacient byl léčen efektivně a s co nejnižším rizikem vzniku NÚ.
Výzkum farmakogenetiky MTX u RA se soustředí na souvislost mezi terapeutickým účinkem či toxicitou MTX a mutacemi genů metabolických drah, transportérů MTX, genů podílejících se na účinku adenosinu, genů HLA-G antigenů a enzymů metabolismu bází nukleových kyselin. Nejlépe prostudovaným genem v intracelulárním metabolismu MTX je methylentetrahydrofolát reduktáza (MTHFR). Enzym MTHFR je klíčový pro konverzi 5, 10-metylentetrahydrofolátu na 5-metyltetrahydrofolát, který je nezbytný pro metylaci homocysteinu a vznik methioninu (9). Do současnosti bylo popsáno více než 10 polymorfismů pro gen MTHFR, detailněji však byly prostudovány pouze dva C677T a A1298C (10). SNP C677T způsobuje záměnu alaninu za valin na kodonu 222. Vzniká termolabilní varianta enzymu MTHFR s nižší enzymatickou aktivitou. Genotyp 677TT má prevalenci 8–10 %, aktivita enzymu je v tomto případě asi 30 %. V populaci je zhruba 40 % heterozygotů (677CT) s aktivitou enzymu kolem 60 %. U pacientů s alespoň jednou alelou T bylo prokázáno zvýšené riziko vzniku NÚ, především hepatotoxicity (11, 12). Podle většiny dostupných dat nebyl prokázán vliv na změnu efektivity léčby pro tento polymorfismus (9, 13).
Cílem práce je zjistit, zda polymorfismus C677T (rs1801133) pro MTHFR gen predikuje odpověď na léčbu MTX u pacientů s RA z Východočeského regionu. Hodnocení účinnosti bylo provedeno na základě sledování změny podle disesase activity score na 28 kloubech (∆DAS 28) během prvních šesti měsíců perorální léčby MTX u pacientů s RA. Byly zjišťovány vztahy mezi genotypem a klinickými prediktory aktivity RA: věk, pohlaví, kouření cigaret, seropozitivita revmatoidních faktorů (RF), pozitivita protilátek proti citrulinovanému peptidu (ACPA), přerušení léčby MTX a dávka MTX.
Soubor a metodika
Charakteristiky pacientů a uspořádání studie
Prezentujeme monocentrickou, regionální, retrospektivní a zčásti prospektivní, cross-sectional studii. Do studie bylo prvotně zařazeno a genotypováno 186 pacientů splňujících klasifikační kritéria Americké koleje revmatologů (ACR) 1987 (14), kteří aktuálně nebo dříve užívali perorální léčbu MTX v monoterapii nebo kombinaci s csDMARDs nebo bDMARDs. Zařazení pacienti byly léčeni MTX pro RA na 2. interní gastroenterologické klinice Fakultní nemocnice v Hradci Králové, podepsali informovaný souhlas se zařazením do studie a vyšetřením DNA. Všichni byli kavkazského původu a dospělého věku nad 18 let. Celkem 65 pacientů bylo léčeno monoterapií MTX (nebo kombinací s glukokortikoidy), 55 nemocných kombinací s csDMARDs či b DMARDs. Souběžná léčba byla zastoupena sulfasalazinem (n = 18), leflunomidem (n = 10), hydrochlorochinem (n = 18), cyklosporinem (n = 8), glukokortikoidy (n = 86). Průměrná dávka MTX ve skupině s MTX monoterapií byla 11,7 ± 2,9 mg, ve skupině kombinace MTX s csDMARDs a bDMARDs 11,0 ± 2,7 mg. Léčba kyselinou listovou byla prováděna u všech nemocných ve studii (dávka 40 mg den po MTX).
Efekt léčby byl hodnocen použitím DAS 28 na základě hodnocení EULAR odpovědi na začátku MTX léčby (15), prospektivně při vstupu do studie nebo retrospektivně ze zdravotnické dokumentace 2. interní gastroenterologické kliniky (u pacientů s MTX léčbou v anamnéze) a po šesti měsících léčby. Kalkulace DAS 28 byla provedena u 120 pacientů (u těchto pacientů byla dostupná potřebná data). Probandy jsme rozdělili na respondéry (pacienty s dobrou, střední odpovědí podle EULAR) a nonrespondéry. Jestliže nemocní po šesti měsících léčby dosáhli DAS 28 ≤ 3,2, pak pacienti s dobrou odpovědí na MTX léčbu byli definováni zlepšením DAS 28 > 1,2, střední odpověď jako zlepšení DAS 28 > 0,6 a ≤ 1.2, a nonrespondéři změnou ≤ 0,6. Pro pacienty s DAS 28 po šesti měsících > 3,2 a ≤ 5,1 byla střední odpověď definována jako zlepšení DAS 28 > 0,6, nonrespondéři se zlepšením DAS 28 ≤ 0,6. Nakonec v případě DAS 28 > 5,1 střední respondéři byli definováni zlepšením DAS 28 > 0,6, a nonrespondéři ≤ 0,6 (15). Účinnost MTX terapie v závislosti na SNP byla zjišťována v šestém měsíci léčby komparací distribucí genotypů s klinickou odpovědí (respondéři versus nonrespondéři). Zároveň byl efekt terapie hodnocen podle parametru ∆DAS 28.
Pro zjištění toxicity byly ze zdravotnické dokumentace zaznamenány NÚ. Všechny NÚ jsou popsány trváním, frekvencí, závažností a záznamem o pokračování v následné terapii. Léčba byla přerušena v případě mírných NÚ: mírné gastrointestinální symptomy, mírná mukozitida, perzistentní zvýšení AST/ALT do trojnásobku horního limitu laboratoře, perzistující leukopenie (3–3,5 x 109 buněk/litr), trombocytopenie (100–150 × 109 buněk/litr). Léčba MTX byla vysazena v případě závažných NÚ: závažné gastrointestinální symptomy, závažná mukozitida, podezření na MTX pneumonitidu, elevace AST/ALT ≥ trojnásobek horního limitu, leukopenie (<3,0 × 109 buněk/litr) nebo trombocytopenie (<100 × 109 buněk/litr).
Při vstupu do studie byla zaznamenána demografická data: věk, pohlaví, kouření cigaret, délka trvání RA a kloubní příznaky. Ze zdravotnické dokumentace byly v čase zahájení MTX zjištěny laboratorní parametry CRP, ACPA, RF, sedimentace erytrocytů (FW; mm/h), CRP (mg/l), krevní obraz, sérová hladina bilirubinu, plazmatická aktivita ALT, AST, ALP, clearance kreatininu (počítaná pomocí Cockcroft-Gault vzorce). Všechna klinická data byla uvedena také po šesti měsících léčby. Potenciální klinické prediktory aktivity RA byly vybrány na základě literatury. Klinické prediktory zahrnují věk, pohlaví, kouření cigaret (kuřák x nekuřák), RF status, ACPA status (16, 17).
Terapie MTX byla přerušena u 13 pacientů pro NÚ během šesti měsíců léčby, tito pacienti byli ze studie vyřazeni.
Klinická data byla dostupná u 120 RA pacientů, kteří jsou charakterizováni: průměrným věkem 58,5 roků, SD ± 12,6, věkovým rozmezím 29–85 roků, a počtem mužů n = 32 (26,7 %). Skupiny rozdělené podle genotypu byly porovnatelné v závislosti na DMARDs farmakoterapii, vstupní hodnotě DAS 28, přerušení MTX léčby a MTX dávky na začátku léčby. Charakteristiky skupin pacientů jsou uvedeny v tabulce 1.
Tab. 1. Charakteristiky pacientů s RA léčených perorálním MTX, porovnání podle jednotlivých genotypů polymorfismu C677T a podle MTX terapie. 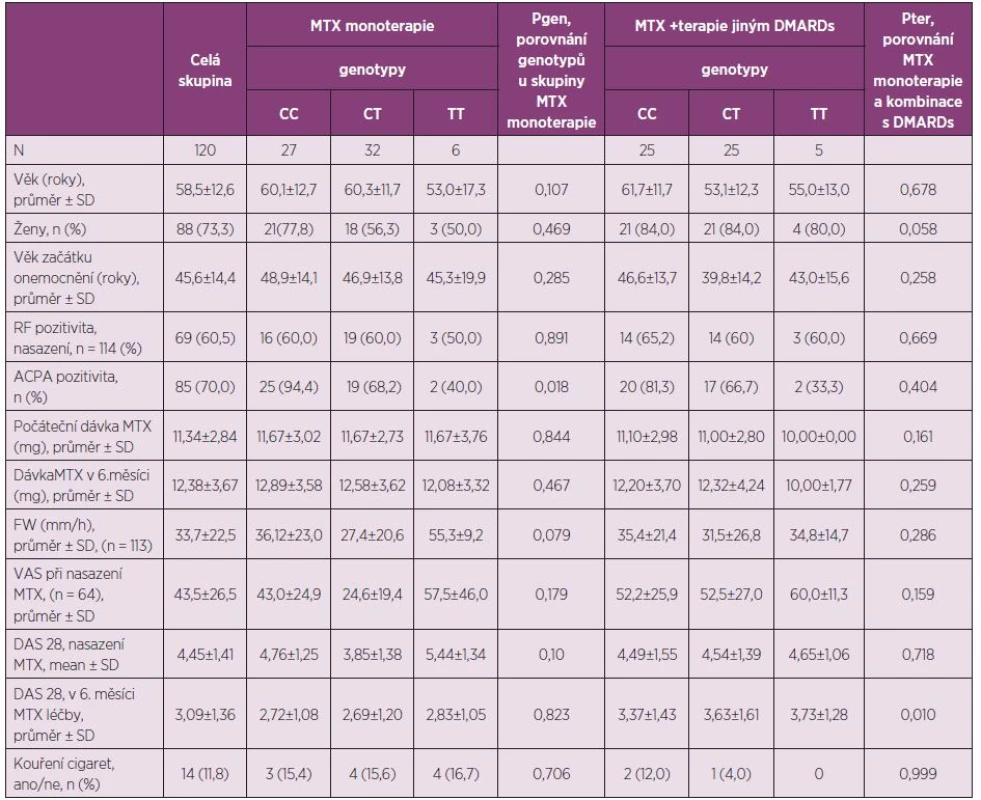
MTX, methotrexát; DMARDs, chorobu modifikující léky; RF, revmatoidní faktory; ACPA, protilátky proti cyklickému citrulinovanému peptidu; FW, sedimentace erytrocytů; VAS, vizuální analogová škála; DAS 28, disease activity score (28 joints) Studie byla schválena Etickou komisí Fakultní nemocnice Hradec Králové, Česká republika, a byla prováděna v souladu s principy Helsinské deklarace z roku 1975, revize z roku 1983.
Genotypizace
Všech 186 pacientů s RA a 80 probandů kontrolní skupiny (vzorku tzv. běžné populace) bylo genotypováno za použití genotypizačního testu: genomická DNA byla extrahována z krve za použití QIAamp DNA Blood Mini Kit (Qiagen). Samotná genotypizace byla provedena qPCR alelickou diskriminací za použití komerčního setu TaqMan (allele-specific) assays (LifeTechnologies). Míra úspěšnosti byla vždy vyšší než 95 %. Genotypy sledovaného C677T SNP ve skupině s RA a v kontrolní skupině nevykazují deviaci v Hardy-Weinbergově rovnováze.
Statistika
Logistická regresní analýza byla použita pro výpočet v případě dichotomického rozdělení na respondéry (dobrá a střední odpověď) a nonrespondéry za použití EULAR kritérií. Výsledky byly vyjádřeny pomocí odds ratio (OR) s 95% konfidenčním intervalem (95% CI).
Rozdíly mezi respondéry a nonrespondéry byly vyjádřeny za použití Mann-Whitney U testu nebo chí-kvadrát testu. Vliv genetických variant na ∆ DAS 28 byl zjištěn pomocí jednocestné ANOVA analýzy při porovnání wild-type homozygotů, heterozygotů, a variantních homozygotů.
V analýze bylo použito technologie GML/FENENAL, BOOSTRAP typ. Statistické rozdíly klinických a laboratorních parametrů mezi haplotypy byly analyzovány t-testem nebo ANOVA testem. Byla zvolena statistická hladina významnosti p < 0,05. Všechny statistické analýzy byly provedeny SPSS verzí 16 (SPSS Inc., Chicago, IL, USA).
Výsledky
Nebyly nalezeny statisticky významné rozdíly v distribuci genotypů mezi RA probandy a kontrolní skupinou (p = 0,722). Zároveň u variantních homozygotů pro 677TT nebylo zjištěno zvýšené riziko pro RA (OR = 1,370 95% CI = 0,343 – 5,474, p = 0,656). Rozdělení kohorty podle genotypizace bylo následující: 6 (9,2 %) 677TT homozygotů a 32 (49,2 %) 677CT heterozygotů.
Efekt MTX léčebné odpovědi podle EULAR
Při hodnocení efektu léčby podle kritérií EULAR odpovědi bylo 80 pacientů ze 120 (66,6 %) klasifikováno jako respondéři. Nebyl nalezen vztah C677T SNP s efektem nízkodávkové perorální léčby MTX u RA kohorty Východočeského regionu za použití stratifikace podle tzv. dominatního modelu CC versus (CT+TT) (tab. 2, 3).
Tab. 2. Charakteristiky pacientů s RA léčených perorálním MTX a jejich porovnání podle rozdělení na EULAR respondéry/nonrespondéry. 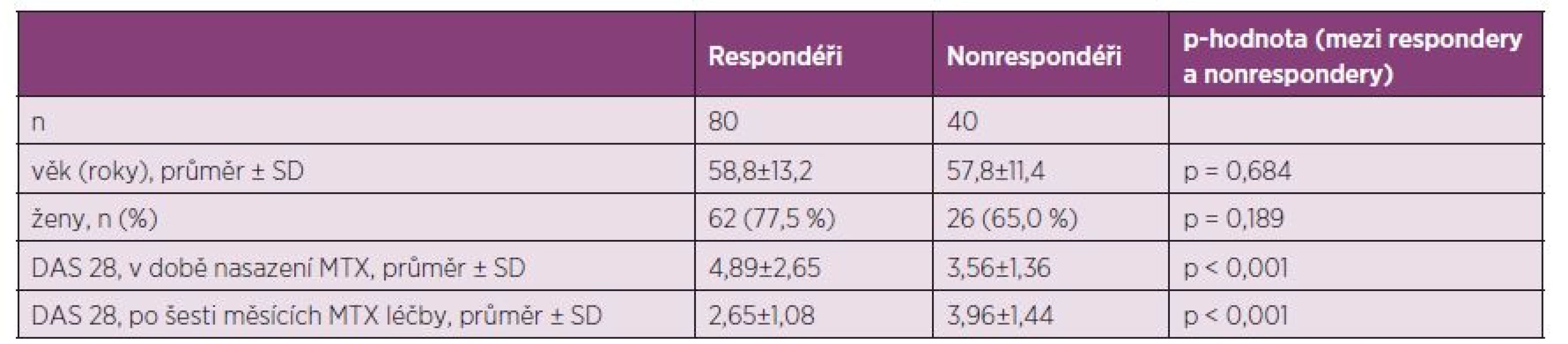
MTX, methotrexát; DAS 28, disease activity score (28 joints) Tab. 3. Vliv C677T SNP na léčebnou odpověď perorálním MTX podle EULAR kritérií, stratifikace podle dominantního modelu CC vs. (CT+TT). 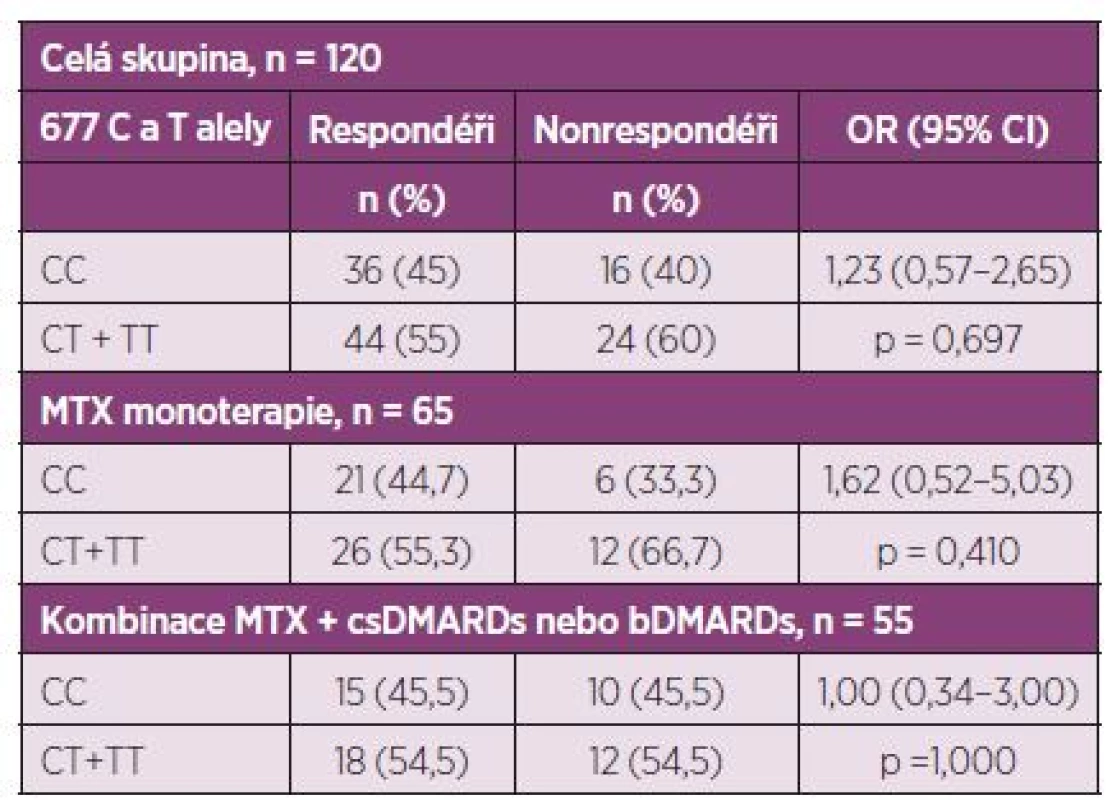
DMARDs, chorobu modifikující léky; csDMARDs, konvenční syntetické DMARDs; bDMARDs biologické DMARDs; MTX, methotrexát; OR, odds ratio Efekt MTX léčby podle ∆DAS 28
Poté byla analyzována účinnost léčby pomocí kvantnitativního parametru ∆DAS 28. Podle výsledků byl genotyp 677CT statisticky významně asociován s nižší odpovědí na MTX léčbu u pacientů na MTX monoterapii během šestiměsíční léčby. Tato asociance nebyla nalezena u skupiny kombinace MTX s jinými DMARDs (konvenčními syntetickými nebo biologickými) (p = 0,886). V porovnání s pacienty na monoterapii MTX je statistická významnost p = 0,025, η2 = 0,112 – medium effect size.
Efekt MTX léčby ve skupině monoterapie MTX
Pacienti na monoterapii MTX měli po šesti měsících léčby výrazně nižší absolutní hodnoty DAS 28 oproti skupině na kombinované terapii MTX + csDMARDs a bDMARDs (tabulka 1). Post-hoc testy ukázaly signifikantně sníženou odpověď na léčbu v případě 677CT genotypu oproti wild-type homozygotům CC a mutantním homozygotům TT. Rozdíl průměrné ∆DAS 28 u CT vs. CC genotypů (vyjádřeném ∆ DAS 28 po šesti měsících léčby) byl 0,885, CI 95% = (0,105, 1,667); p = 0,027. V případě CT vs. TT, byl rozdíl ∆ DAS 28 1,448 CI 95% = (0,119, 2,776); p = 0,033. Nebyl zjištěn signifikantní rozdíl mezi CC a TT homozygoty p = 0,407 (viz graf 1). Různé genotypy C677T SNP se nelišily porovnáním klinických prediktorů aktivity RA: věk, pohlaví, kouření cigaret (kuřák x nekuřák), RF status. Pacienti na monoterapii MTX s genotypem 677CC měli významně vyšší frekvenci pozitivity ACPA autoprotilátek oproti genotypu 677CT a TT (tab 1).
Graf 1. Vztah genotypů C677T SNP a ΔDAS 28 u nemocných s RA na MTX monoterapii nebo MTX v kombinaci s konvenčními syntetickými a biologickými DMARDs. 
Diskuse
Předchozí výzkum neodhalil odlišnou distribuci C a T alel polymorfismu 677 v běžné populaci oproti nemocným s RA (18). To je také v souladu s našimi výsledky. Zkoumali jsme nejprve rozdíly v léčebné odpovědi mezi skupinami rozdělenými podle genotypu CC versus (CT+TT). To odpovídá tzv. dominantnímu modelu, za předpokladu dominantního efektu minoritní alely je to konzistentní s hodnocením v předchozích studiích a meta-analýzách. Naše hodnocení OR pro respondéry a nonrespondéry nevedlo k významným rozdílům v odpovědi na léčbu podle EULAR. Užití tohoto modelu ve studiích ukázalo nejednoznačné/konfliktní výsledky. Více studií neprokázalo asociaci polymorfismu s NÚ (11, 19, 20), některé studie ukázaly vyšší výskyt gastrointestinální toxicity (11, 21). Část studií svědčila pro lepší účinnost MTX u 677CC homozygotů: hodnocené DAS 44 < 2,4 podle Wessels a kol. (16), hodnocené ACR 20 podle Kurzawski a kol. (22). Na druhou stranu zbytek studií nenalezl vztah polymorfismu k efektu léčby MTX (20, 23, 24). Fisher a Cronstein publikovali v roce 2009 rozsáhlou meta-analýzu. Význam této práce spočívá ve velikosti vzorku nemocných RA s více než 1400 pacienty. Meta-analýza neukázala dostatečná data pro potvrzení asociace C677T SNP s toxicitou nebo účinností MTX (25). Také závěry recentní meta-analýzy s celkem 1140 RA pacientů podle Owena a kol. nesvědčí pro predikci odpovědi na léčbu MTX u C677T SNP (13). Menší počet studií hodnotil odpověď na léčbu podle rozdělení na jednotlivé genotypy (16, 22, 26–28). Naše práce hodnotí vliv genotypu (při porovnání wild-type, variantních homozygotů a heterozygotů) na MTX účinnost stanovenou ∆DAS 28. Porovnává také skupiny MTX monoterapie a kombinované MTX léčby s jinými DMARDs. 677CT heterozygoti měli signifikantně nižší odpověď na základě ∆DAS 28 oproti oběma homozygotům. Podle literatury vede mutace C677T ke snížené aktivitě enzymu MTHFR, která je zároveň pozorována i u heterozygotů (29). Předchozí data ukázala klinický význam 677CT heterozygozity v mnoha klinických příkladech (výskytu gliomu, demence, aterosklerózy) (30–33). Vzhledem k nízkému počtu 677TT homozygotů ve studii nebyl pravděpodobně naplněn možný předpoklad nízké odpovědi 677TT homozygotů na léčbu.
V literatuře jsou zmiňovány limitace v hodnocení různých studií nebo meta-analýz. Byl komentován design studií a nastavení hodnotících parametrů (prospektivní/retrospektivní, ambulantní/hospitalizovaní pacienti), variabilita prostředí, definice MTX toxicity a efektu. Jsou diskutovány enviromentální proměnné, jako saturace populace kyselinou listovou lokálními dietními zvyklostmi, rozdíly v kouření cigaret mezi populacemi. Také suplementace kyseliny listové goegraficky kolísá (u nekavkazské populace jsou obvykle používány nižší dávky MTX a kyseliny listové při její suplementaci) (13). Nízký příjem kyseliny listové může mít větší klinické důsledky u pacientů s genotypem 677TT spojené se zvýšenou hladinou homocysteinu oproti genotypu 677CC nebo CT.
Na výsledky studií má rovněž vliv komedikace jinými DMARDs v porovnání s nemocnými na monoterapii MTX. Na základě tohoto faktu porovnáváme obě skupiny. Význam genotypizace C677T SNP se ukázal pouze v případě skupiny s monoterapií. Důležitým aspektem MTX léčebné účinnosti je také dávka léku. Pacienti v této studii nebyli léčeni v současnosti běžně doporučovanými dávkami perorálního MTX. Nyní je za efektivnější považována dávka mezi 20–30 mg na týden. Vysoká dávka MTX by měla být dosažena během osmi týdnů po zahájení léčby, jako důležitý aspekt léčebného úspěchu (2, 34, 35). V této studii byla průměrná dávka (11,0 mg/týden) ovlivněna doporučeními a zvyklostmi léčby RA v době zahájení MTX léčby. Dávka je porovnatelná s dávkami ve studiích podrobených meta-analýze Owenem a kol. (13). Retrospektivní část naší studie zařadila nemocné s počátkem léčby MTX v roce 2002. Přitom v roce 2003 byla průměrná dávka MTX u pacientů léčených pro RA 10 mg za týden (35, 36). Definice léčebné odpovědi mezi studiemi není plně standardizována. Byly vyvinuty dva hlavní způsoby měření aktivity. Není známo, který způsob je přínosnější. EULAR kritéria pro odpověď na léčbu jsou založeny na ∆DAS 28. ACR kritéria jsou založena na procentuální změně hlavních proměnných. Obě metody jsou validizovány pro klinická hodnocení (15). Je zřejmé, že komedikace (glukokortikoidy, konvenčními syntetickými nebo biologickými DMARDs, nesteroidními antirevmatiky a analgetiky) a komorbidity mění léčebnou odpověď MTX.
Geografická variabilita je ukázána na rozdílech v prevalenci RA. Navíc C677T SNP má svojí geografickou heterogenitu. Okolo 10 % severoamerické populace jsou 677TT homozygoti. Je známa etnická variabilita, výskyt T alely je vyšší mezi středomořím (hispánci) než u kavkazské populace, ale ta je zároveň vyšší než afrických Američanů (18). Lokality extrémní frekvence distribuce vykazují deviaci Hardy-Weinbergovy rovnováhy (Helsinky, jižní Itálie a jižní Čína). Tyto nálezy svědčí pro přítomnost selektivního tlaku vedoucího k vyhraněné variaci (37). V porovnání s předchozími daty je frekvence 677TT genotypu v naší studii relativně nižší.
Limitace práce
Je nezbytné zmínit, že práce má své limitace. Jde o monocentrickou, z velké části retrospektivní. Nízkodávková MTX léčba vedla k nízkému výskytu na MTX závislých NÚ a relativně nízkému počtu nemocných vyřazených pro NÚ.
Tato práce je součástí projektu hodnotícího více SNP s možným vlivem na léčbu MTX u RA: SNP A1298C pro MTHFR gen, SNP pro gen přenašeče SLC19A1, SNP genu pro efluxní transportéry ABC, polymorfismus pro gen metylentetrahydrofolát dehydrogenázy MTHFD1 gen, polymorfismus pro gen dihydrofolátreduktázy DHFR 829C>T, SNP pro geny funkce adenosinu (AMPD1, ATIC, ITPA). Další výsledky budou publikovány později.
Závěry
Nebyl prokázán vliv SNP C677T hodnocený podle dominantního modelu CC versus (CT+TT) na léčebný výsledek stanovený podle EULAR odpovědi. Nebyl shledán význam genopytizace pro C677T SNP u pacientů léčených kombinací MTX s cs nebo bDMARDs. Statisticky významné rozdíly byly zjištěny při porovnání skupin různých genotypů hodnocením odpovědi na léčbu podle ∆DAS 28. Heterozygoti 677CT na monoterapii MTX měli v porovnání s homozygoty významný vliv na sníženou odpověď při MTX léčbě podle ∆DAS 28. Není jasné, proč nebyla nalezena odlišná odpověď na léčbu u 677TT homozygotů oproti homozygotům 677CC a heterozygotům 677CT.
Závěrem lze říci, že výsledky práce ukazují na prediktivní hodnotu C677T SNP pro efekt nízkodávkové perorální léčby MTX u populace RA Východočeského regionu. S přihlédnutím k výsledkům práce je třeba dalších studií k průkazu těchto souvislostí.
Podpořeno MZ ČR – RVO (FNHK, 00179906)
Poděkování patří našim pacientům a nelékařským zdravotním pracovníkům účastnícím se na této práci.
Adresa pro korespondenci:
MUDr. Tomáš Soukup, Ph.D.
2. interní gastroenterologická klinika
Fakultní nemocnice Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: soukutom@fnhk.cz
Zdroje
1. Smolen JS, Landewé R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis 2010; 69 : 964–975.
2. Smolen JS, Landewé R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann Rheum Dis 2014; 73 : 492–509.
3. Gaujoux-Viala C, Nam JL, Ramiro S, et al. Efficacy of conventional synthetic disease-modifying antirheumatic drugs, glucocorticoids and tofacitinib - a bysystematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis 2014; 73 : 510–5.
4. Breedveld FC, Weisman MH, Kavanaugh AF, et al. The PREMIER study-A multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheum 2006; 54 : 26–37.
5. St Clair EW, van der Heijde DM, Smolen JS, et al. Combination of infliximab and methotrexate therapy for early rheumatoid arthritis: a randomized, controlled trial. Arthritis Rheum 2004; 50 : 3432–43.
6. Klareskog L, van der Heijde D, de Jager JP, et al. Therapeutic effect of the combination of etanercept and methotrexate compared with each treatment alone in patients with rheumatoid arthritis: double-blind randomised controlled trial. Lancet 2004; 363 : 675–81.
7. Tak PP, Rigby WF, Rubbert-Roth A, et al. Inhibition of joint damage and improved clinical outcomes with rituximab plus methotrexate in early active rheumatoid arthritis: the IMAGE trial. Ann Rheum Dis 2011; 70 : 39–46.
8. Westhovens R, Robles M, Ximenes AC, et al. Clinical efficacy and safety of abatacept in methotrexate-naive patients with early rheumatoid arthritis and poor prognostic factors. Ann Rheum Dis 2009; 68 : 1870–7.
9. van Ede AE, Laan RF, Blom HJ, et al. The C677T mutation in the methylenetetrahydrofolate reductase gene: a genetic risk factor for methotrexate-related elevation of liver enzymes in rheumatoid arthritis patients. Arthritis Rheum 2001; 44 : 2525–30.
10. Brinker RR, Ranganathan P. Methotrexate pharmacogenetics in rheumatoid arthritis. Clin Exp Rheumatol 2010; 28(Suppl 61): 33–9.
11. Urano W, Taniguchi A, Yamanaka H, et al. Polymorphisms in the methylenetetrahydrofolate reductase gene were associated with both the efficacy and the toxicity of methotrexate used for the treatment of rheumatoid arthritis, as evidenced by single locus and haplotype analyses. Pharmacogenetics 2002; 12 : 1831–47.
12. Hider SL, Mack LF, Shadforth MF, et al. Single nucleotide polymorphisms within MTHFR are associated with abnormal liver function tests in RA patients recieving MTX. Rheumatology 2006; 45(Suppl 1): 104.
13. Owen SA, Lunt M, Bowes J, et al. MTHFR gene polymorphisms and outcome of methotrexate treatment in patients with rheumatoid arthritis: analysis of key polymorphisms and meta-analysis of C677T and A1298C polymorphisms. Pharmacogenomics J 2013; 13 : 137–47.
14. Arnett FC, Edworthy SM, Bloch DA, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum 1988; 31 : 315–24.
15. Van Gestel AM, Prevoo ML, van't Hof MA, van Rijswijk MH, van de Putte LB, van Riel PL. Development and validation of the European League Against Rheumatism response criteria for rheumatoid arthritis: comparison with the preliminary American College of Rheumatology and the World Health Organization/International League Against Rheumatism Criteria. Arthritis Rheum 1996; 39 : 34–40.
16. Wessels JA, van der Kooij SM, le Cessie S, et al. A clinical pharmacogenetic model to predict the efficacy of methotrexate monotherapy in recent-onset rheumatoid arthritis. Arthritis Rheum 2007; 56 : 1765–75.
17. Anderson JJ, Wells G, Verhoeven AC, Felson DT. Factors predicting response to treatment in rheumatoid arthritis: the importance of disease duration. Arthritis Rheum 2000; 43 : 22–9.
18. Schneider JA, Rees DC, Liu YT, Clegg JB. Worldwide distribution of a common methylenetetrahydrofolate reductase mutation. Am J Hum Genet 1998; 62 : 1258–60.
19. Ranganathan P. An update on methotrexate pharmacogenetics in rheumatoid arthritis. Pharmacogenomics 2008; 9 : 439–51.
20. Aggarwal P, Naik S, Mishra KP, Aggarwal A, Misra R. Correlation between methotrexate efficacy & toxicity with C677T polymorphism of the methylenetetrahydrofolate gene in rheumatoid arthritis patients on folate supplementation. Indian J Med Res 2006; 124 : 521–6.
21. Kim SK, Jun JB, El-Sohemy A, Bae SC. Cost-effectiveness analysis of MTHFR polymorphism screening by polymerase chain reaction in Korean patients with rheumatoid arthritis receiving methotrexate. J Rheumatol 2006; 33 : 1266–74.
22. Kurzawski M, Pawlik A, Safranow K, Herczynska M, Drozdzik M. 677C>T and 1298A>C MTHFR polymorphisms affect methotrexate treatment outcome in rheumatoid arthritis. Pharmacogenomics 2007; 8 : 1551–9.
23. Lee YH, Song GG. Association between the C677T and A1298C polymorphism of MTHFR and the efficacy and toxicity of methotrexate in rheumatoid arthritis: a metaanalysis. Clin Drug Investig 2010; 30 : 101–8.
24. Taniguchi A, Urano W, Tanaka E, et al. Validation of the associations between single nucleotide polymorphisms or haplotypes and responses to disease-modifying antirheumatic drugs in patients with rheumatoid arthritis: a proposal for prospective pharmacogenomic study in clinical practice. Pharmacogenet Genomics 2007; 17 : 383–90.
25. Fisher MC, Cronstein BN. Metaanalysis of methylenetetrahydrofolate reductase (MTHFR) polymorphisms affecting methotrexate toxicity. J Rheumatol 2009; 36 : 539–45.
26. Xiao H, Xu J, Zhou X, et al. Associations between the genetic polymorphisms of MTHFR and outcomes of methotrexate treatment in rheumatoid arthritis. Clin Exp Rheumatol 2010; 28 : 728–33.
27. Taraborelli M, Andreoli L, Archetti S, Ferrari M, Cattaneo R, Tincani A. Methylenetetrahydrofolate reductase polymorphisms and methotrexate: no association with response to therapy nor with drug-related adverse events in an Italian population of rheumatic patients. Clin Exp Rheumatol 2009; 27 : 499–502.
28. Dervieux T, Greenstein N, Kremer J. Pharmacogenomic and metabolic biomarkers in the folate pathway and their association with methotrexate effects during dosage escalation in rheumatoid arthritis. Arthritis Rheum 2006; 54 : 3095–103.
29. Frosst P, Blom HJ, Milos R, et al. A candidate genetic risk factor for vascular disease: a common mutation in methylenetetrahydrofolate reductase. Nat Genet 1995; 10 : 111–3.
30. Liu N, Jiang J, Song YJ, et al. Impact of MTHFR polymorphisms on methylation of MGMT in glioma patients from Northeast China with different folate levels.Genet Mol Res 2013; 12 : 5160–71.
31. Szabó GV. The role and importance of gene polymorphisms in the development of atherosclerosis. Interv Med Appl Sci 2013; 5 : 46–51.
32. Karata S, Aydin Y, Ocer F, Buyru A, Balci H. Hereditary thrombophilia, anti-beta2 glycoprotein 1 IgM, and anti-annexin V antibodies in recurrent pregnancy loss. Am J Reprod Immunol 2012; 67 : 251–5.
33. Tsai SJ, Hong CJ, Yeh HL, Liou YJ, Yang AC, Liu ME, Hwang JP. Heterozygote advantage of the MTHFR C677T polymorphism on specific cognitive performance in elderly Chinese males without dementia. Dement Geriatr Cogn Disord. 2011; 32 : 159–63.
34. Visser K, van der Heijde D. Optimal dosage and route of administration of methotrexate in rheumatoid arthritis: a systematic review of the literature. Ann Rheum Dis 2009; 68 : 1094–9.
35. Aletaha D, Smolen JS. Effectiveness profiles and dose dependent retention of traditional disease modifying antirheumatic drugs for rheumatoid arthritis. An observational study. J Rheumatol 2002; 29 : 1631–8.
36. Pincus T, Yazici Y, Sokka T, et al. Methotrexate as the “anchor drug” for the treatment of early rheumatoid arthritis. Clin Exp Rheumatol 2003; 21(Suppl 31): 178–85.
37. Wilcken B, Bamforth F, Li Z, et al. Geografical and ethnic variation og the 677C-T allele of 5, 10 methylenetetrahydrofolate reductase (MTHFR): findings from over 7000 newborns from 16 areas world wide. J Med Genet 2004; 40 : 619-25.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2015 Číslo 1- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Perspektivy léčby osteoartrózy
- Účinnost a bezpečnost intraartikulární aplikace depotních glukokortikoidů u revmatických onemocnění
- Editorial
- Systémový lupus erythematodes – kazuistika neobvyklého případu s krvácivými projevy
- Jozef Rovenský et al.: Gerontorevmatologie
- Polymorfismus C677T genu pro methylentetrahydrofolát reduktázu je spojen se změnou léčebné odpovědi na methotrexát v populaci revmatoidní artritidy Východočeského regionu
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Účinnost a bezpečnost intraartikulární aplikace depotních glukokortikoidů u revmatických onemocnění
- Perspektivy léčby osteoartrózy
- Systémový lupus erythematodes – kazuistika neobvyklého případu s krvácivými projevy
- Polymorfismus C677T genu pro methylentetrahydrofolát reduktázu je spojen se změnou léčebné odpovědi na methotrexát v populaci revmatoidní artritidy Východočeského regionu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



