-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Systémový lupus erythematodes – kazuistika neobvyklého případu s krvácivými projevy
Systemic lupus erythematosus – a report of an unusual case with hemorrhagic manifestations
The present case report describes a patient with SLE manifesting as a severe disease with a variety of organ complications and the development of life-threatening coagulopathy based on the presence of autoantibodies against coagulation factor VIII and von Willebrand factor. The condition was controlled with difficulties using combined immunosuppression, iv administration of immunoglobulins and anti-CD20 monoclonal antibodies (rituximab), along with long-term administration of recombinant activated coagulation factor VIIa (NovoSeven®). The disease activity was reduced during the treatment and the patient is now treated with maintenance therapy with glucocorticoids.
Key words:
SLE, hemorrhagic event, antibodies against Factor VIII and von Willebrand factor, rituximab
Autoři: D. Jílek 1,3; Z. Burianová 1; J. Kourek 1; A. Vašková 2; J. Laštůvka 1
Působiště autorů: Interní oddělení Masarykovy nemocnice o. z., Krajská zdravotní a. s., Ústí nad Labem 1; Oddělení klinické hematologie Masarykovy nemocnice o. z., Krajská zdravotní a. s., Ústí nad Labem 2; Centrum imunologie a mikrobiologie Zdravotního ústavu se sídlem v Ústí nad Labem 3
Vyšlo v časopise: Čes. Revmatol., 23, 2015, No. 1, p. 34-38.
Kategorie: Kazuistika
Souhrn
Uvedená kazuistika popisuje pacienta se SLE probíhajícím pod obrazem těžkého onemocnění s řadou orgánových komplikací a s rozvojem život ohrožující koagulopatie, na podkladě přítomnosti autoprotilátek proti koagulačnímu faktoru VIII a von Willebrandovu faktoru. Stav byl obtížně zvládnut kombinovanou imunosupresí, podáním i.v. imunoglobulinů a monoklonálních protilátek anti-CD20 (rituximab) spolu s dlouhodobým podáváním rekombinantního aktivovaného koagulačního faktoru VIIa (NovoSeven®). V průběhu léčby došlo k potlačení aktivity nemoci a pacient je nyní léčen udržovací kortikoterapií.
Klíčová slova:
SLE, krvácivý stav, protilátky proti faktoru VIII a von Willebrandovu faktoru, rituximabÚvod
Systémový lupus erythematodes (SLE) je považován za modelové autoimunitní onemocnění, jehož podkladem je reakce složek imunitního systému proti strukturám vlastních tkání s jejich následným poškozením. Jde o onemocnění orgánově nespecifické, s proměnlivým klinickým obrazem a průběhem. Postihuje převážně mladé jedince mezi dvacátým a třicátým rokem života, s výraznějším postižením žen. Diagnostika SLE se tradičně opírá o 11 kritérií ACR (American College of Rheumatology, poslední revize 1997), z nich splnění 4 znamená potvrzení diagnózy SLE. Nověji lze pro diagnózu nemoci použít kritéria SLICC (Systemic Lupus International Collaborating Clinic). Poučení o použití obou kritérií v diagnostice SLE přináší aktuální Doporučení České revmatologické společnosti pro diagnostiku a sledování nemocných se SLE (1).
SLE se vyznačuje přítomností autoprotilátek především proti strukturám buněčného jádra (antinukleární protilátky – ANA), ale také proti dalším strukturám organismu. Spektrum autoprotilátek, které se u SLE vyskytují, je velmi široké, popsáno bylo kolem 200 druhů (2), z nichž pouze některé mají patogenetický či diagnostický význam. Hovoří se o „lavině“ autoprotilátek, jejichž počet nemá ve srovnání s jinými autoimunitními chorobami obdobu, a můžeme se domnívat, že právě tento fenomén přispívá k pestrosti možných klinických průběhů, které byly u SLE pozorovány. Připomeňme, že vedle mírných průběhů s přítomností remitující neerozivní artritidy, alopecie či občasných orálních ulcerací se můžeme setkat s těžkými případy lupusových nefritid, perikarditid a pleuritid či neuropsychiatrických forem SLE (3).
V tomto sdělení předkládáme kazuistiku mladého muže s méně obvyklým klinickým obrazem SLE, který se projevil jako velmi těžký krvácivý stav na podkladě nízkých hodnot koagulačního faktoru VIII (FVIII) a von Willebrandova faktoru (vWF) s přítomností inhibitoru FVIII.
Popis případu
Třicetiletý muž byl 8. června 2013 přeložen z nemocnice v Rumburku na oddělení ORL Masarykovy nemocnice v Ústí nad Labem (MNUL) pro trvající epistaxi s těžkou posthemorhagickou anémií. V osobní anamnéze neuváděl žádné závažné choroby, úrazy ani operace. Asi dva měsíce před hospitalizací začal mít potíže s bolestí drobných kloubů horních končetin, loktů, kolen a večerní febrilie do 39 °C. Od 24. 5. 2013 měl opakované epistaxe. O čtyři dny později byl poprvé pro tyto obtíže ošetřen na oddělení chirurgie nemocnice v Rumburku a následně hospitalizován pro zjištěnou anémii a kolapsový stav na interním oddělení v Rumburku. Po dimisi z interního oddělení byla doporučena hospitalizace na ORL oddělení nemocnice v Děčíně, kam se pacient nedostavil.
Dne 7. 6. 2013 se dostavilo opětovné silné krvácení z dutiny nosní. Pacient byl ošetřen následující den na oddělení chirurgie nemocnice v Rumburku a vzhledem k celkovému stavu (anémie, hypotenze, trombocytopenie) byla doporučena hospitalizace na ORL oddělení MNUL. K úpravě anémie (hemoglobin 45 g/l) na tomto oddělení byla podána celkem pětkrát erymasa, dvakrát plazma, hemostatická a antifibrinolytická léčba (Dicynone®, Pamba®). I přes absenci pokračujícího krvácení z dutiny nosní a vzhledem k přítomnosti těžké trombocytopenie a prodlouženého APTT byl pacient na doporučení hematologa přeložen dne 10. 6. 2013 k dovyšetření na interní oddělení MNUL.
Během celé hospitalizace byla přítomna normocytární normochromní anémie (hemoglobin 68–82 g/l), trombocytopenie (vstupně 25–307x109/l), prodloužené APTT (54,7–59,9 s), INR bylo v hraničních hodnotách (1,15–1,26), hladiny fibrinogenu i antitrombinu byly v normě, hladina D-dimerů stoupla (6,76 µg/ml), a hraničně kratší trombinový čas (15,8–15,7 s). Diferenciální rozpočet leukocytů prokázal posun doleva (tyče 0,06) a lymfocytopenii (0,19). Provedené biochemické vyšetření prokázalo mírný vzestup CRP (5,1–33,0 mg/l) a pokles celkové bílkoviny (63,6–58,7 g/l) a albuminu (28,2–31,8 g/l).
Na doporučení hematologa, infekcionisty a imunologa byla doplněna další vyšetření. Bylo prokázáno výrazné snížení hladiny FVIII (méně než 2 % s pozitivním dilučním testem, zjištěn i specifický inhibitor o síle 1,2 BJ – Bethesda jednotky), faktory IX, XI, XII byly v normě. Byly také odebrány biologické materiály ke kultivačním a sérologickým vyšetřením. EBV vyšel s pozitivitou titru ve třídě IgG, stejně jako cytomegalovirus. Sérologicky nebyly prokázány lues, HIV, hepatitidy (HBsAG, anti-HBs, anti-HCV), Mycoplasma pneumoniae, RS virus, chřipka A+B. V krvi nebyly prokázány antigeny Legionella pneumophila, Chlamydia pneumoniae, kandidy ani aspergila, stejně tak vyšetření moči a hemokultur neprokázalo přítomnost patogenu. Ve stolici a výtěru z krku byla prokázána po opakovaných odběrech plně citlivá Candida albicans. Dále bylo indikováno imunologické vyšetření včetně řady orgánově nespecifických autoprotilátek.
Při vstupním vyšetření pacienta byly zjištěny hmatné lymfatické uzliny nadklíčkové, axilární a inguinální. K verifikaci tohoto nálezu bylo provedeno ultrasonografické vyšetření, které nález potvrdilo. Dále prokázalo lymfadenopatii retroperitoneálně a parailicky, s velikostí lymfatických uzlin do 3 cm, a při tomto vyšetření byla také prokázána hepatosplenomegalie (slezina velikosti 13,5 cm). Vykonané CT vyšetření v rozsahu krku až pánve potvrdilo, vedle již známé lymfadenopatie, pohrudniční výpotek a infiltrativní změny v levém plicním křídle a horním laloku pravé plíce. Na tento nález bylo reagováno zavedením antibiotické terapie (Ceftriaxon, Ciphin® i.v.).
Pro zhoršující se stav pacienta, trvající febrilie, zhoršení koagulačního nálezu, rozvoj petechií v oblasti obou bérců, byl dne 13. 6. 2013 dohodnut akutní překlad na lůžko Ústavu hematologie a krevní transfuze (ÚHKT) Praha. Původně plánovaná excize uzliny z třísla k histologické verifikaci nebyla vzhledem ke koagulačním parametrům a akutnímu překladu provedena. V době překladu nebyly k dispozici ani výsledky imunologického vyšetření, proto byl pacient přeložen s diagnózou suspektního maligního lymfomu, s těžkou trombocytopenií (v.s. sekundární při suspektním maligním lymfomu + konsumpce při infekčním onemocnění a podíl ztrát při opakovaném krvácení) a deficitem koagulačního faktoru VIII nejasné etiologie, s podezřením na přítomnost jeho specifického i nespecifického inhibitoru.
Během pobytu na lůžkách ÚHKT se stav pacienta dále zhoršoval. Z důvodu respirační insuficience následkem bilaterální bronchopneumonie a krvácení do plic bylo nutné zajistit dýchací cesty orotracheální intubací se zahájením umělé plicní ventilace. V koagulačním vyšetření byly prokázány nízké hodnoty FVIII a vWF. Opakovaně byly substituovány krevní elementy a koagulační faktory. Pokus o substituci byl neúčinný. Byla prokázána přítomnost inhibitoru FVIII a bylo usouzeno na kombinaci inhibitoru pro oba tyto faktory (FVIII a vWF). Krvácení bylo dále kontrolováno pouze pomocí rekombinantního aktivovaného faktoru VIIa (NovoSeven®).
Byla provedena exstirpace uzliny na krku pouze s nálezem nespecifického granulomatózního zánětu. Vyšetření průtokovou cytometrií ze vzorku uzliny i kostní dřeně bylo negativní ve smyslu patologické populace. Tímto tedy bylo vyloučeno původní podezření na lymfom. Současně bylo v MNUL dokončeno imunologické vyšetření, jehož výsledky jsou uvedeny v tabulce 1. Nález umožnil stanovit pracovní diagnózu floridního SLE s pravděpodobným sekundárním antifosfolipidovým syndromem s projevy v hematologické oblasti a s lymfadenopatií. Výsledky byly předány do ÚHKT.
Tab. 1. Přehled výsledku imunologického laboratorního vyšetření z odběru 11. 6. 2013. 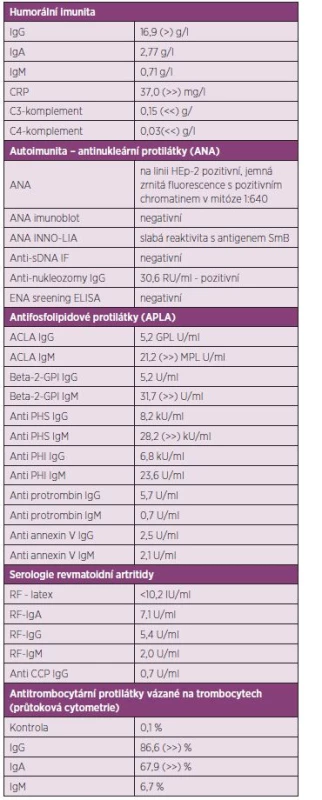
Vzhledem k přítomnosti autoprotilátek (zvláště proti koagulačním faktorům) a výraznému krvácivému syndromu byla od 15. 6. zahájena imunosupresívní léčba (methylprednisolon + cyklofosfamid). Tato léčba měla jen malý efekt na vzestup hodnot FVIII a vWF. Následovalo i.v. podání imunoglobulinů a bolusová imunosuprese (cyklofosfamid v dávce 600 mg + 1g methylprednisolonu ob den). Takto podaná terapie vedla ke zlepšení orgánových lézí. Bylo přistoupeno k dlouhodobé substituci NovoSeven® v kontinuální infuzi a imunosupresívní terapii methylprednisolonem (40 mg/den). Celkem čtyřikrát byl také podán rituximab (monoklonální protilátka anti-CD20). Po této terapii došlo k uspokojivému vzestupu vWF k hodnotám 50 %. Přechodně byl stav komplikován leukopenií (dáváno do souvislosti s léčbou rituximabem). Provedené vyšetření kostní dřeně prokázalo izolovanou agranulocytózu, která byla zvládnuta podáním růstového faktoru (G-CSF).
Celkový stav pacienta byl komplikován koncem července 2013 rozvojem těžké neuromyopatie kriticky nemocných (rozvoj kvadruplegie a sakrálního dekubitu IV. stupně). Tato diagnóza byla stanovena na základě neurologického konziliárního vyšetření dne 3. 8. 2013. Po zahájení intenzivní rehabilitační léčby nastalo postupné zlepšování mobility pacienta. Dne 19. 9. 2013 byl přeložen na Rehabilitační kliniku Malvazinky. Na tomto pracovišti došlo po týdnu opět k rozvoji výrazné leukopenie, a proto byl přeložen dne 25. 9. 2013 zpět na ÚHKT Praha. Stav byl vyřešen opětovným podáním růstových faktorů. Tato komplikace byla dle dostupné dokumentace vyhodnocena jako cyklická neutropenie při SLE a o povaze této komplikace bude pojednáno v diskusi.
Dne 8. 10. 2013 byl pacient přeložen na rehabilitační oddělení MNUL. Při překladu byl bez známek aktivity SLE a ostatních sekundárních komplikací. Překladové diagnózy byly SLE a získaný těžký deficit vWF a FVIII autoimunitní etiologie v rámci SLE. V řadě dalších diagnóz jsou uvedeny akutní respirační selhání při krvácení do plic a bilaterální bronchopneumonii, a také těžká neuromyopatie kriticky nemocných.
Během pobytu na lůžku rehabilitačního oddělení MNUL byla postupně snižována dávka kortikoterapie. Pacient zůstává v pravidelných kontrolách v ÚHKT a Revmatologickém ústavu v Praze a dle dostupné dokumentace trvá remise onemocnění (podzim 2014). Udržovací terapií je Medrol střídavě 8 mg a 4 mg denně.
Diskuse
Předložený případ dokumentuje široké spektrum možných klinických průběhů SLE, kdy se můžeme setkat jak s běžnými formami a závažnostmi průběhu, tak rovněž s případy raritními. Hematologická symptomatologie je u SLE poměrně častá a setkáváme se zpravidla s hemolytickou anémií (často s pozitivitou Coombsova testu) a leukopenií. Trombocytopenie se může vyskytovat v rámci sekundárního antifosfolipidového syndromu (APS) či trombotické trombocytopenické purpury. Prodloužené APTT je častým nálezem u sekundárního APS. Krvácivé projevy při SLE jsou naopak považovány za vzácnost (4).
Protilátková povaha inhibitoru FVIII byla popsána Bidwellem v roce 1966 (5), ale četnější zprávy o získaných poruchách koagulačních faktorů na podkladě autoprotilátek lze zaznamenat až v létech osmdesátých a devadesátých minulého století (6). V případě FVIII hovoříme o tzv. získané hemofilii. V sestavě 215 osob s prokázaným inhibitorem FVIII, kteří neměli vrozenou hemofilii typu A, bylo ukázáno, že tento fenomén nemusí být nutně spojen s klinicky manifestním autoimunitním onemocněním. Vedle pacientů s revmatoidní artritidou (7,9 %), SLE (5,7 %), dalšími autoimunitními chorobami (4,5 %) byli v souboru rovněž osoby s maligními tumory (6,7 %), lékovými reakcemi (6 %), ženy po porodu (7,2 %) a lidé bez prokázaných chorob (přibližně 50 %) (7). Lollar v obsáhlých přehledných pracích rozebírá okolnosti vzniku protilátek proti koagulačním faktorům a v případě FVIII a vWF uvádí autoimunitní onemocnění mezi typickými situacemi, kde se tyto autoprotilátky mohou vyskytovat (8, 9).
Poznatky o průběhu a léčbě získané hemofilie A a von Willebrandova syndromu jako součástí klinického obrazu SLE nejlépe poskytují některé publikované kazuistiky. V léčbě získané hemofilie A se vedle substituce koagulačních faktorů úspěšně uplatnila kombinovaná imunosupresivní léčba (kortikoidy a cyklofosfamid) (4). Akahoshi a kol. zpracovali 8 kazuistik získané hemofilie u SLE publikovaných od r. 1990. Cyklofosfamid byl podáván většinou v úvodu léčby v pulsním i.v. podání (500 mg/m2) v kombinaci s methylprednisolonem (pulsní i orální podávání). Ve dvou případech byl pro kombinaci s kortikoidem použit azathioprin, avšak v obou případech bez efektu a ke zvratu ve vývoji těchto případů došlo až po použití i. v. gamaglobulinu (IVIG) (10). V léčbě SLE kombinovaného se získaným von Willebradovým syndromem postačila monoterapie kortikoidy (11). Naší zkušenosti se nejvíce blíží kazuistika mexických autorů, popisující terapeuticky rezistentní případ, kdy zvratu v průběhu bylo dosaženo po podání rituximabu (12).
V našem případě pro diagnózu SLE svědčila pozitivita ANA ve středním titru. Ve specifikačním vyšetření byla pozitivita protilátky proti nukleozomům a slabá pozitivita anti-SmB protilátky, která se vyznačuje vysokou specificitou pro SLE. Byla pozitivita 4 specifit antifosfolipidových protilátek izotypu IgM. Hypokomplementémie C3 a C4 rovněž patří do obrazu akutního SLE. Se znalostí těchto výsledků imunologického vyšetření bylo možné případ diagnosticky uzavřít jako SLE podle kritérií ACR i SLICC(8). Shledali jsme u pacienta artritidu, serozitidu (pleuritida a perikarditida), trombocytopenii, pozitivitu ANA, anti-Sm a antifosfolipidových protilátek, hypokomplementémii C3 a C4). Leukopenii zastiženou v průběhu hospitalizace v ÚHKT a na Rehabilitační klinice Malvazinky lze spíše přičítat lékovým vlivům rituximabu a cyklofosfamidu, protože se vyskytla až po použití těchto látek v léčbě, resp. nebyla přítomna v počáteční fázi vývoje případu.
Průkaz nízkých hodnot FVIII a vWF společně přítomností inhibitoru FVIII umožnilo upřesnění diagnostického pohledu na případ. Přestože protilátky proti FVIII a vWF nebyly stanoveny, lze jejich přítomnost považovat za jistou, neboť Lollar užívá pojmy inhibitory FVIII a vWF a protilátky proti nim prakticky jako synonyma (8, 9). Případ tedy lze zhodnotit jako dokumentující mnohotnost tvorby autoprotilátek u SLE, kdy vedle autoprotilátek obvyklých a cenných pro stanovení diagnózy (ANA) se patogeneticky uplatnily autoprotilátky proti koagulačním faktorům FVIII a vWF, vedoucí k velmi těžkému a život ohrožujícímu klinickému průběhu, který se podařilo zvládnout až použitím v současnosti nejvyššího stupně léčby - biologickou léčbou rituximabem. Přibývající zkušenosti s tímto druhem biologické léčby ukazují, že rituximab může být vhodnou volbou pro léčbu případů získané hemofilie, které jsou rezistentní k léčbě první linie (13).
Závěr
Autoři na kazuistice pacienta se systémovým lupus erythematodes (SLE) s počátečními projevy těžkého krvácivého stavu ukazují, že u SLE je nutné počítat rovněž s méně obvyklými klinickými příznaky. Diagnostice SLE napomohlo včasné provedení imunologického vyšetření s průkazem autoprotilátek (pozitivita ANA a APLA). Diagnostika život ohrožující koagulopatie byla na vyšším pracovišti dovršena průkazem přítomnosti autoprotilátek proti koagulačnímu faktoru VIII a von Willebrandově faktoru.
V dalším průběhu se vyvinul obraz těžkého onemocnění s řadou orgánových komplikací. Stav se podařilo zvládnout kombinovanou imunosupresí, podáním i.v. imunoglobulinů a biologickou léčbou (rituximab) společně s použitím rekombinantního aktivovaného koagulačního faktoru VIIa (NovoSeven®). Remise onemocnění navozená touto léčbou trvá na udržovací nízkodávkové kortikoterapii (podzim 2014).
Poděkování a dovětek autorů. Autoři děkují kolektivu pracovníků Ústavu hematologie a krevní transfúze v Praze za převzetí pacienta, jakož i za příkladnou diagnostickou a život zachraňující léčebnou péči a za přehlédnutí rukopisu této práce bez připomínek.
Autoři zároveň s politováním konstatují, že po několikaměsíční snaze o spolupráci s pracovníky Ústavu hematologie a krevní transfúze v Praze na přípravě tohoto sdělení jim bylo sděleno rozhodnutí se této spolupráce nezúčastnit.
Adresa pro korespondenci:
MUDr. Dalibor Jílek, CSc.
Centrum imunologie a mikrobiologie
Zdravotní ústav se sídlem v Ústí nad Labem
Moskevská 15
400 01 Ústí nad Labem
tel.: 477 751 801, 606 754 803
dalibor.jilek@zuusti.cz
Zdroje
1. Horák P, Tegzová D, Závada J et al. Doporučení České revmatologické společnosti pro diagnostiku a sledování nemocných se systémovým lupus erythematodes. Čes Revmatol 2013; 21(2): 59–70.
2. Sherer Y, Shoenfeld Y. Autoantibodies guide in systemic lupus erythematosus. BioRad Laboratories 2007.
3. D´Cruz DP, Khamashta MA, Hughes GRV. Systemic lupus erythematosus. Lancet 2007; 369 : 587–596.
4. Ishikawa T, Tsukamoto N, Suto M, Uchiumi H, Mitsuhashi H, Yokohama A, Maesawa A, Nojima Y, Naruse T. Acquired hemophilia A in a patient with systemic lupus erythematosus. Intern Med 2001; 40(6): 541–543.
5. Bidwell E, Denson KWE, Dike GWR, Augustin R, Lloyd GM. Antibody nature of the inhibitor to antihemophilic globulin (Factor VIII). Nature 1966; 210 : 746–747.
6. Ahmed AEE. Autoantibodies to coagulation factors and bleeding disorders. Clin Rev Allergy Immunol 1998; 16 : 313–319.
7. Green D, Lechner K. A survey of 215 non-hemophilic patients with inhibitors to Factor VIII. Thromb Haemost 1981; 45 : 200–203.
8. Lollar P. Pathogenic antibodies to coagulation factors. Part one: factor VIII and factor IX. J Thromb Haemost. 2004; 2(7): 1082–95.
9. Lollar P. Pathogenic antibodies to coagulation factors. Part II. Fibrinogen, prothrombin, thrombin, factor V, factor XI, factor XII, factor XIII, the protein C system and von Willebrand factor. J Thromb Haemost 2005; 3(7): 1385–91.
10. Akahoshi M, Aizawa K, Nagano S, Inoue H, Sadanaga A, Arinobu Y, Niiro H, Nakashima H. Acquired hemophilia in a patient with systemic lupus erythematosus: a case report and literature review. Mod Rheumatol 2008; 18(5): 511–515.
11. Hong S, Lee J, Chi H, Lee C, Nah S, Kim Y, Oh J, Moon H, Yoo B. Systemic lupus erythematosus complicated by acquired von Willebrand's syndrome. Lupus 2008; 17(9): 846–848.
12. Jiménez OE, Fragoso LS, Gabayet R.M. Aquired inhibitors of coagulation in a patient with systemic lupus erythematosus and antiphospholipid antibodies: response to rituximab. Reumatol Clin 2008; 4(2): 74–76.
13. Cugno M, Gualtierotti R, Tedeschi A, Meroni PL. Autoantibodies to coagulation factors: From pathophysiology to diagnosis and therapy. Autoimmunity Rev 2014; 13 : 40–48.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2015 Číslo 1- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Perspektivy léčby osteoartrózy
- Účinnost a bezpečnost intraartikulární aplikace depotních glukokortikoidů u revmatických onemocnění
- Editorial
- Systémový lupus erythematodes – kazuistika neobvyklého případu s krvácivými projevy
- Jozef Rovenský et al.: Gerontorevmatologie
- Polymorfismus C677T genu pro methylentetrahydrofolát reduktázu je spojen se změnou léčebné odpovědi na methotrexát v populaci revmatoidní artritidy Východočeského regionu
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Účinnost a bezpečnost intraartikulární aplikace depotních glukokortikoidů u revmatických onemocnění
- Perspektivy léčby osteoartrózy
- Systémový lupus erythematodes – kazuistika neobvyklého případu s krvácivými projevy
- Polymorfismus C677T genu pro methylentetrahydrofolát reduktázu je spojen se změnou léčebné odpovědi na methotrexát v populaci revmatoidní artritidy Východočeského regionu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



