-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vztah revmatických chorob a jejich léčby k manifestnímu postižení ledvin
The relation of rheumatic diseases and their treatment to clinical renal involvement
Number of rheumatic diseases manifest with involvement of renal and urinary system. Connective tissue diseases and vasculitides are often accompanied by glomerulonephritis. Involvement of renal interstitium is often present in connective tissue diseases such as certain forms of systemic lupus or Sjögren's syndrome, and vascular involvement typical for systemic sclerosis or antiphospholipid syndrome. Inflammatory diseases may also be accompanied by AA amyloidosis associated with nephrotic syndrome and renal failure. Renal impairment occurs frequently in patients with hyperuricaemia. The effect of drugs used for treatment of rheumatic diseases on a kidney represents a separate chapter. On the other hand, even patients on dialysis often need to continue the treatment of rheumatic diseases. These questions are explored in the present review article.
Key words:
rheumatic diseases, renal involvement, hemodialysis, complications, specific isssues of the treatment
Autoři: A. Klíčová 1; P. Horák 1; T. Tichý 2; J. Zadražil 1
Působiště autorů: III. interní klinika – nefrologická, revmatologická a endokrinologická FN a LF UP, Olomouc 1; Ústav klinické a molekulární patologie FN a LF UP, Olomouc 2
Vyšlo v časopise: Čes. Revmatol., 23, 2015, No. 4, p. 133-145.
Kategorie: Přehledový článek
Souhrn
Řada revmatických chorob se projevuje postižením v oblasti ledvin a vylučovacího systému. Systémová onemocnění pojiva a vaskulitidy jsou často doprovázena glomerulonefritidou. U systémových onemocnění pojiva se vyskytuje rovněž postižení intersticia ledviny, jak tomu bývá u některých forem systémového lupusu či Sjögrenova syndromu, a vaskulární postižení typické pro sklerodermii či antifosfolipidový syndrom. Zánětlivé choroby mohou být také doprovázeny AA amyloidózou spojenou s nefrotickým syndromem a renálním selháním. Postižení ledvin se vyskytuje často i u nemocných s hyperurikemií. Samostatnou kapitolu pak představuje vliv farmak používaných k léčbě revmatických chorob na ledviny. Na druhou stranu i u dialyzovaných osob je často potřeba pokračovat v léčbě jejich revmatického onemocnění. Těmi otázkami se zabývá předkládaný přehledový článek.
Klíčová slova:
revmatické choroby, postižení ledvin, hemodialýza, komplikace, specifika léčbyÚvod
Řada revmatických chorob se může projevovat rovněž v oblasti ledviny a vylučovacího systému. Někdy jsou to projevy velmi diskrétní a mírné, jindy se může jednat o vedoucí symptomatologii dané choroby. Postižení ledvin je jednou z nejvýznamnějších manifestací systémového lupus erythematodes (SLE), má význam pro prognózu systémové sklerodermie, je nedílnou součástí klinického obrazu renálních vaskulitid, může doprovázet revmatoidní artritidu (RA), smíšené onemocnění pojiva, Sjögrenův syndrom či hyperurikémii a dnu. Postižení ledvin u těchto chorob může vyústit do akutního, častěji však do chronického selhání ledvin, které vyžaduje dialyzační léčbu. Rovněž mnohá léčiva užívaná v léčbě revmatických chorob mohou svými vedlejšími účinky postihnout ledviny a být příčinou renálního selhání. U řady pacientů v chronické dialyzační léčbě je třeba určitým způsobem pokračovat v terapii při vědomí toho, že renální selhání a hemodialýza modifikují metabolismus léků užívaných v léčbě revmatických chorob.
Systémový lupus erythematodes a antifosfolipidový syndrom
Postižení ledvin v rámci SLE patří mezi nejvýznamnější negativní prognostické faktory choroby. Donedávna figurovala lupusová nefritida mezi hlavními příčinami smrti v důsledku této choroby a stále zůstává až u 30 % nemocných hlavním faktorem významné morbidity (1). Při provedení biopsie ledviny je téměř u všech nemocných přítomen určitý stupeň renálního postižení. U SLE je základním patogenetických faktorem postižení ledviny přítomnost glomerulonefritidy. Histologická klasifikace WHO a její revize z roku 2004 (ISN/RPS) rozlišuje 6 základních tříd glomerulonefritid a je v současnosti doplněna o indexy aktivity a chronicity (2). U SLE je však třeba počítat také s autoimunitní intersticiální nefritidou a vaskulárním, zejména mikroangiopatickým postižením ledvin v souvislosti s antifosfolipidovým syndromem či trombotickou trombocytopenickou purpurou/hemolyticko-uremickým syndromem (TTP/HUS). Častokrát je manifestace ledvinné choroby velmi necharakteristická, močový nález je u části mesangiálních i membranózních nefritid negativní či necharakteristický. Typicky se lupusová nefritida manifestuje proteinurií a jejími následky včetně manifestního nefrotického syndromu. Mikroskopická hematurie je častým, i když v naprosté většině případů ne jediným projevem postižení ledviny. Makroskopická hematurie je velmi vzácná a vyskytuje se skoro výlučně pouze u dětských forem nemoci. Aktivní močový sediment, který spočívá v přítomnosti proteinurie a výskytu nadměrného množství erytrocytů a převážně granulárních válců, je poměrně častý. Dalším častým projevem postižení ledvin je hypertenze, která je přítomná u 38–55 % nemocných s lupusovou nefritidou IV. třídy (3, 4). Akutní renální selhání se často rozvíjí v souvislosti s přítomností kapilárních mikrotrombů při TTP/HUS či u trombóz renálních arterií i žil, jakožto významných komplikacích SLE a antifosfolipidového syndromu (5). V rámci SLE se může vyskytnout také akutní intersticiální nefritida spojená s depozity imunokomplexů podél tubulární bazální membrány a nekorelující s přítomností a aktivitou glomerulonefritidy. Diagnostika postižení ledvin se opírá o detailní klinické a laboratorní vyšetření doplněné v indikovaných případech o histologické vyšetření vzorku získaného při biopsii ledvin (6).
Při provedení biopsie lze nalézt jistý stupeň postižení ledvin téměř u všech nemocných se SLE. Histologická klasifikace WHO rozlišuje 6 základních tříd glomerulonefritid (2).
Třída I (minimální mesangiální lupusová nefritida) je charakterizovaná normálním histologickým nálezem při světelné mikroskopii a nálezem mesangiálních depozit při imunofluorescenční a/či elektronové mikroskopii. Distribuce malých mesangiálních depozit se pohybuje od segmentálních po difuzní změny. Klinický obraz je většinou velmi nenápadný, často s normálním močovým nálezem a normálním sérovým kreatininem (6).
Třída II – mesangiálně proliferativní lupusová nefritida je histologicky charakterizovaná mesangiální hypercelularitou nebo expanzí mesangiální matrix s depozitami imunokomplexů patrnými již při světelné mikroskopii. Mesangiální proliferace je většinou mírná až střední a neomezuje kapilární lumen. Imunofluorescence popisuje přítomnost granulárních mesangiálních depozit imunokomplexů, elektronově mikroskopický obraz je pak charakterizovaný denzními depozity v mesangiální matrix (obr. 1). V klinickém obraze se vyskytuje mikroskopická hematurie či proteinurie, hypertenze není častá a k rozvoji nefrotického syndromu či renální nedostatečnosti nedochází. Prognóza z pohledu postižení ledvin je velmi dobrá (6).
Obr. 1a Systémový lupus erythematodes, Lupusová nefritida, třída II. Glomerulus se segmentální mesangiální hypercelularitou a jemnými bazálními membránami. Mesangiální hypercelularita může mít v jednotlivých glomerulech téhož vzorku různou intenzitu. Barvení HE, zvětšení 200x. 
Obr. 1b Systémový lupus erythematodes, Lupusová nefritida, třída II. V imunofluorescenci dominují granulární mesangiální depozita imunoglobulinů a komplementu. Zvětšení 200x. 
Třída III (fokální lupusová nefritida) a IV (difuzní lupusová nefritida) jsou většinou považovány za kvalitativně podobné typy glomerulárního postižení, které se liší pouze rozsahem postižení. Třída III. je popisovaná jako fokálně segmentální nebo globální endokapilární či extrakapilární glomerulonefritida postihující méně než 50 % glomerulů v bioptickém vzorku. Třída IV je difuzní segmentální nebo globální endokapilární nebo extrakapilární glomerulonefritida s postižením více než 50 % glomerulů. Obě tyto třídy jsou charakterizované subendoteliálními depozity imunokomplexů s i bez mesangiální alterace. Oba typy mohou mít jak aktivní (proliferativní), tak inaktivní (sklerotizující) léze. Endokapilární hypercelularita obou typů lupusové glomerulonefritidy pochází z proliferace glomerulárních endotelií a mesangiálních buněk. Ve světelné mikroskopii se mohou vyskytnout takzvané „srpky“, což jsou známky fokální nekrózy glomerulu v okolí buněčná proliferace či membranoproliferativní změny fokální či difuzní (drátěné kličky „wire loops“) (obr. 2a). Imunofluorescenční vyšetření odhalí přítomnost subendoteliálních depozit imunokomplexů, které odpovídají distribuci proliferativních změn. U třídy III jsou tato depozita relativně fokální (postižení některých glomerulů) a segmentální (postižení části glomerulu), zatímco u třídy IV. jsou více difuzní (postižení více jak 80 % glomerulů) a globální (v celém rozsahu) (obr. 2b). Imunohistochemie může přispět k popisu složení depozit, které se skládají z imunokomplexů obsahující IgG, IgA, IgM a složky komplementu, tvz. „full house“.
Obr. 2a Systémový lupus erythematodes, Lupusová nefritida, třída III/A. Tři glomeruly s mesangiální proliferací, jednom z nich nekróza a celulární srpek (šipka). Segmentární extrakapilární proliferace postihuje méně než 50% glomerulů. Barvení HE, zvětšení 100x. 
Obr. 2b Systémový lupus erythematodes, Lupusová nefritida, třída III/IV. Hrubě granulární a pseudolineární pozitivita IgG v kapilárních kličkách a v mesangiu. Imunofluorescence 200x. 
Oba typy jsou nejčastější a nejzávažnější formou lupusové nefritidy. Glomerulonefritidy III. třídy představují 10–20 % ledvinných manifestací choroby (7), IV. třídy pak 30–65 % (6). Fokálně proliferativní typ má o poznání lepší prognózu s nižší tendencí k renálnímu selhání (zejména v prvních pěti letech trvání). Klinicky se glomerulonefritida III./IV. třídy projevuje nejčastěji hematurií a proteinurií, často se vyskytne nefrotický syndrom, hypertenze a rozvíjí se renální insuficience. Během aktivní fáze choroby mají pacienti výraznou hypokomplementémii, postihující zejména C3 složku a zvýšené hladiny anti-dsDNA protilátek. U difuzní formy i přes nasazenou imunosupresivní terapii se mohou v průběhu let po odeznění aktivních zánětlivých změn vyskytnout progredující jizevnaté změny ledvinné tkáně vedoucí k významnému poklesu renálních funkcí (6).
Třída V (membranózní lupusová glomerulonefritida) je charakterizovaná přítomností subepiteliálních depozit na bazální membráně glomerulů, různým stupněm mesangiální hypercelularity či přítomností mesangiálních depozit. Čistá membranózní glomerulonefritida je prostá jakékoliv mesangiální proliferace či hypercelularity při světelné mikroskopii. Přítomnost depozit v mesangiu při světelné mikroskopii lze hodnotit jako překryv III. resp. IV./V. třídy (obr. 3a a 3b). Membranózní glomerulonefritida postihuje 10–20 % nemocných (6). Manifestuje se typicky nefrotickým syndromem, koncentrace kreatininu je zpravidla na počátku nemoci v normě, může se vyskytnout mikrohematurie a hypertenze.
Obr. 3a Systémový lupus erythematodes, lupusová nefritida, třída V. Zvětšený glomerulus, bazální membrány jsou globálně zesíleny, v mesangiu nepravidelná hypercelularita. V imunofluorescenci jsou hlavním nálezem granulární depozita imunoglobulinů a komplementu v kapilárních kličkách, méně mesangiálně. Barvení HE, zvětšení 200x . 
Obr. 3b Systémový lupus erythematodes, lupusová nefritida, třída V. Jemně granulární exprese IgG v kapilárních kličkách a v mesangiu. Imunofluorescence 200x. 
Třída VI (pokročilá sklerotizující glomerulonefritida) je charakterizovaná globální sklerózou více než 90 % glomerulů. Je výsledkem jizevnatého hojení předcházejícího zánětlivého postižení ledvin a pokročilou fází chronických forem III., IV. a V. třídy. Klinicky se manifestuje pomalou progredující ledvinnou nedostatečností s proteinurií a relativně chudým nálezem v močovém sedimentu. Je nízká pravděpodobnost výraznějšího prospěchu imunosupresivní léčby.
Nemocní s lupusovou nefritidou, kteří dospějí do terminálního selhání ledvin v důsledku pomalé progrese jinak inaktivního onemocnění, zpravidla tolerují dobře dialyzační léčení a jejich prognóza se podstatně neliší od ostatních dialyzovaných nemocných. Aktivita onemocnění zpravidla vyhasíná, zřejmě v důsledku poruchy imunity indukované urémií, takže je zpravidla možné snížit dávku imunosupresiv či je zcela vysadit. Někteří nemocní (častěji na peritoneální dialýze, která je spojena s menším defektem imunity než hemodialýza) však mohou mít dále projevy aktivity onemocnění (horečka, artralgie, serozitida) a vyžadují tak nadále imunosupresivní léčbu. Během prvních tří měsíců dialyzační léčby je zvýšené riziko úmrtí na infekční komplikace v důsledku vysokých dávek glukokortikoidů, později se přidávají i kardiovaskulární komplikace. Přítomnost cirkulujících antifosfolipidových protilátek může vést k trombózám nebo stenózám cévního přístupu. Nemocní s aktivní nefritidou a rychlou ztrátou renální funkce mají špatnou prognózu a často je ztrácíme v důsledku extrarenální aktivity onemocnění. U 10–28 % nemocných s lupusovou nefritidou vstupně vyžadujících dialyzační léčbu dochází k částečnému obnovení renálních funkcí (8). Proto se doporučuje odložit transplantaci ledvin alespoň 3–6 měsíců po zahájení dialýzy zejména u nemocných s rychlou progresí renální insuficience, aby se vyloučila možnost obnovy renální funkce a odezněly důsledky předchozí imunosupresivní terapie (9).
Systémová sklerodermie
U systémové sklerodermie se při pitvě objevuje postižení ledvin až u 60–80 % postižených (4). Klinické známky ledvinného postižení jako mírná proteinurie, hypertenze či mírně zvýšená koncentrace sérového kreatininu jsou většinou spojeny s dobrou prognózou bez tendence k progresi renálního postižení. Nejzávažnějším typem renálního postižení u sklerodermie je renální krize, která dle literárních údajů postihovala 5–10 % nemocných s difuzní formou sklerodermie (10). V dnešní době je tato závažná, život ohrožující manifestace chorob podstatně vzácnější. Renální krize je trombotická mikroangiopatie postihující ledviny podobná TTP/HUS, maligní hypertenzi či antifosfolipidovému syndromu. Histologickým korelátem je zvláštní proliferace intimy arkuátních a interlobulárních renálních arterií a arteriol vedoucí k zúžení až obliteraci cév s tvorbou typické koncentrické hypertrofie. Proliferativní změny mohou být doprovázeny arteriolárními trombózami a nekrózami. Nekrózy glomerulů jsou méně časté (6). Prognóza tohoto stavu je velmi závažná, před zavedením ACE inhibitorů zemřeli během jednoho roku takřka všichni nemocní s významnou renální nedostatečností. Základními klinickými nálezy u renální krize jsou akutní renální selhání většinou bez předcházejících známek významné ledvinné choroby, náhlá elevace krevního tlaku, doprovázená často známkami maligní hypertenze a pouze nenápadné změny v močové sedimentu (mírná proteinurie a/nebo hematurie). Renální krize se častěji vyskytuje u nemocných s difuzní, rychle progredující sklerodermií. Rizikovým faktorem je rovněž podávání vysokých dávek glukokortikoidů, užívání cyklosporinu A či přítomnosti protilátek proti RNA polymeráze (11).
I přes nepopiratelný benefit terapie ACE inhibitory 20–50 % nemocných s renální krizí progreduje do konečného renálního selhání a vyžaduje náhradu renálních funkcí dialýzou či peritoneální dialýzou (6). Léčba hemodialýzou je spojena u nemocných se sklerodermickou renální krizí s vysokou mortalitou. Vzhledem k problematickému založení cévního přístupu, je častěji volena peritoneální dialýza. I u nemocných léčených dialýzou se doporučuje pokračovat v terapii menšími dávkami ACE inhibitorů. U významné části nemocných ale dochází při dialyzační léčbě ke zlepšování renálních funkcí až do 18 měsíců po zahájení dialýzy, které umožní ukončení náhrady funkce ledvin. Doporučuje se odložit transplantaci ledvin alespoň 6 měsíců od zahájení dialýzy (12).
Smíšená choroba pojiva
Jde o syndrom kombinující projevy systémového lupusu, sklerodermie a myozitidy a je imunologicky charakterizován vysokými titry anti RNP protilátek. Hlavní renální manifestací je membranózní glomerulopatie či mesangiálně proliferativní glomerulonefritida. Ostatní ledvinné manifestace jako je difuzní proliferativní glomerulonefritida, vaskulární či glomerulární skleróza jsou méně časté. Klinicky se postižení manifestuje zejména proteinurií, zřídka pak hematurií. Může se rozvinout nefrotický syndrom i chronické renální selhání. Vzácně se mohou vyskytnout sklerodermické renální krize s maligní hypertenzí (6).
Polymyozitida, dermatomyozitida
Ačkoliv akutní renální selhání u mechanické či metabolické rabdomyolýzy je velmi časté, u idiopatických myozitid se vyskytuje jen velmi vzácně. Nálezy mesangiálních proliferativních glomerulonefritid jsou u idiopatických myozitid popisovány pouze kazuisticky.
Sjögrenův syndrom
Ledvinné postižení nebývá klinicky diagnostikováno příliš často, lze však předpokládat častou přítomnost subklinických forem. Ačkoliv bývá zpravidla mírné, může vyústit i do akutní či chronické renální nedostatečnosti. Nejčastější klinickou manifestací je tubulointersticiální nefritida, která má histologicky chronický ráz s ložiskovými lymfoplazmocytárními infiltráty, v nichž většina lymfocytů je T původu. Glomerulární postižení je vzácné. Zatímco močový nález bývá velmi mírný a necharakteristický jen s malou proteinurií či leukocyturií, poměrně často se vyskytují funkční tubulární syndromy, jako je renální tubulární acidóza, glykosurie při normální glykémií, nefrogenní diabetes insipidus, kompletní Fanconiho syndrom či poruchy koncentrační schopnosti ledviny (6). Chronické renální selhání vyžadující dialyzační léčbu se nevyskytuje často. Potřeba specifické imunosupresivní terapie během chronické dialyzační léčby se odvíjí od přítomnosti a závažnosti extrarenálních manifestací nemoci (9).
Revmatoidní artritida
Hlavními příčinami selhání ledvin u RA jsou sekundární amyloidóza a léky indukované renální postižení, vzácně pak glomerulonefritida. Ve vyspělých zemích je RA nejčastější příčinou rozvoje sekundární AA amyloidózy, i když její incidence v posledních 20 letech dramaticky poklesla. Důvodem toho poklesu je zřejmě větší povědomí o riziku spojeném s permanentním zvýšením reaktantů akutní fáze a dostupnost vysoce efektivní a agresivnější terapie (6). Sekundární amyloidóza se může vyskytnout rovněž v rámci těžkých forem seronegativních spondylartritid (13). Glomerulonefritida v rámci RA je poměrně vzácná, je popsána přítomnost mesangiálně proliferativní, membranózní glomerulonefritidy či dokonce srpkovité glomerulonefritidy v rámci rozsáhlejších bioptických či pitevních studií, ale klinický význam je malý (14). Klinicky se projevuje proteinurií i izolovanou mikroskopickou hematurií. Vzácně byla popsána rovněž přítomnost IgA nefropatie. Renální nekrotizující vaskulitida s mikroskopickou hematurií, proteinurií a renální nedostatečností se vyskytuje opět raritně u nemocných s těžkými formami seropozitivní a erozivní RA (6).
Nemocní s revmatoidní artritidou v hemodialyzační léčbě vyžadují často terapii základního onemocnění, užití základního léku RA, methotrexátu, se nedoporučuje pro riziko akumulace v organismu a zvýšené myelotoxicity (15). Rovněž není známa přesná farmakokinetika TNFαinhibitorů při dialýze (16). Z kazuistických sdělení však vyplývá, že terapie infliximabem, potenciálně i dalšími TNF blokátory při chronické dialyzační léčbě, není spojena s nárůstem toxicity a komplikací.
Vaskulitidy
Jedná se o velmi heterogenní skupinu chorob, jejichž společnou charakteristikou je zánětlivé postižení cévní stěny. Ledvinné postižení je součástí klinického obrazu mnoha z nich.
Polyarteriitis nodosa je jedna z prvních popsaných vaskulitid. Vyskytuje se poměrně vzácně a postihuje arterie malého a středního kalibru. Ledvinné postižení souvisí zejména s ischemickou nefropatií, která může být doprovázena až maligní hypertenzí. Vyústěním postižení ledvin bývá renální nedostatečnost. Příčinou renální nedostatečnosti bývají ledvinné infarkty a jizvení parenchymu při stenózách cév. Ruptury aneuryzmat jsou vzácné, ale mohou komplikovat renální biopsii (6).
ANCA asociované vaskulitidy s postižením ledvin jsou charakterizovány patologicko-anatomicky nekrotizujícím zánětem malých arterií, arteriol, kapilár a venul, chronickými sklerotizujícími změnami a v některých případech tvorbou granulomů. Klinicky se manifestují purpurou, mononeuritis multiplex, plicními hemoragiemi, viscerálními infarkty, nekrotickými změnami sliznic zejména horních dýchacích cest, oftalmopatií či otitidou (14). Poškození ledvin je způsobeno pauci-imunní nekrotizující glomerulonefritidou s tvorbou srpků, která se může manifestovat rovněž jako rychle progredující glomerulonefritida (17). Pauci-imunní glomerulonefritidy jsou na rozdíl od lupusové nefritidy charakterizovány absencí výrazných depozit imunoglobulinů či složek komplementu (obr. 4).
Obr. 1. Granulomatóza s polyangiitidou. Glomerulus s okluzivním fibrocelulárním srpkem (šipka). V intersticiu fibróza, v některých tubulech deskvamované epitelie a stagnace eozinofilního obsahu. Imunofluorescene typicky negativní. HE, zvětšení 100x. 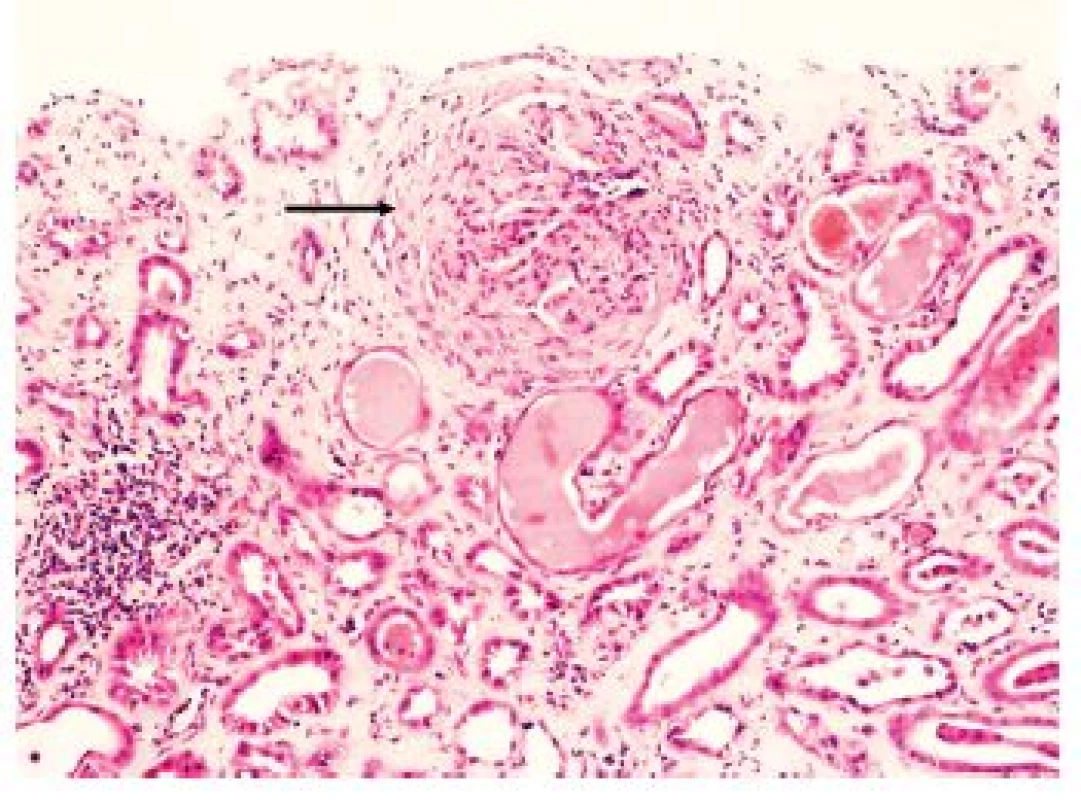
Henoch-Schönleinova purpura. Jedná se o poměrně častou vaskulitidu malých cév, která se manifestuje multiorgánovým postižením kůže, gastrointestinálního traktu, ledvin a kloubů. Jedná se o ANCA negativní leukocytoklastickou vaskulitidu. Postižení ledvin je variabilní. Zatímco pediatrické zdroje popisují postižení ledvin často jako pouze přechodné a mírné, nefrologické popisy nezřídka nacházejí závažnou a progresivní formu choroby jak u dospělých, tak u dětí. Klinicky se postižení ledvin manifestuje mikroskopickou až makroskopickou hematurií, mírnou proteinurií, někdy až nefrotickým, jindy nefritickým syndromem, který může být doprovázen různým stupněm renální nedostatečnosti. Renální postižení může předcházet kožním projevům choroby (6). Histologicky je nefritida spojená s Henoch-Schönleinovou purpurou charakterizovaná jako IgA nefropatie s poměrně širokým morfologickým projevem – od fokální mesangiálně proliferativní glomerulonefritidy až po formy nekrotizující s tvorbou srpků. Charakteristickým rysem jsou mesangiální IgA depozita (obr. 5a a 5b). Imunosupresivní léčba (cyklofosfamid nebo azathioprin s glukokortikoidy) by se neměla používat u nemocných glomerulární filtrací (GF) < 0,5 ml/s, pokud nejde o srpkovitou IgA nefropatii s rychle se zhoršující funkcí ledvin (9).
Obr. 5a Henoch-Schönleinova purpura. Ve dvou glomerulech označených šipkami jsou segmentální projevy zánětu. V horním glomerulu míří šipka na oblast endokapilární proliferace, spodní šipka označuje drobnou fibrinoidní nekrózu. Třetí glomerulus vlevo s nevýraznými projevy mesangiální proliferace. V imunofluorescenčním vyšetření dominantní exprese IgA. Barvení HE, zvětšení 200x. 
Obr. 5b Henoch-Schönleinova purpura. Granulární pozitivita IgA v mesangiu a v některých kapilárních kličkách. Imunofluorescence 200x. 
Kryoglobulinemická vaskulitida
Kryoglobuliny jsou imunoglobuliny, které reverzibilně precipitují v chladu, typicky při 4°C, někdy i při vyšší teplotě. Kryoglobulin typu I se vyskytuje při monoklonálních gamapatiích a skládá se z monoklonálního imunoglobulinu bez protilátkové aktivity, typ II a III jsou charakterizované přítomností smíšených kryoglobulinů, skládajících se nejméně ze dvou typů imunoglobulinů. V případě II. typu se jedná o monoklonální imunoglobuliny s revmatoidní aktivitou proti polyklonální IgG, typ III zahrnuje polyklonální komponenty. Smíšená kryoglobulinémie typu III bývá asociována se systémovými chorobami pojiva, leukémií, hepato-biliárními chorobami či infekcemi. Opakovaně byl prokázán úzký vztah smíšené kryoglobulinémie II. typu a infekce virem hepatitidy C. Smíšená kryoglobulinémie se vyznačuje kožní purpurou s přítomností leukocytoklastické vaskulitidy. Kožní léze mohou být doprovázeny rozsáhlými ulceracemi či mutilacemi. Dále se vyskytuje slabost, horečka, artralgie a Raynaudův syndrom. Charakteristická je rovněž periferní neuropatie doprovázená dysesteziemi či anestezií. Současná hepatosplenomegalie je často důsledkem hepatitidy C. Příznaky ledvinného postižení jsou proteinurie a mikroskopická hematurie doprovázená často známkami mírné renální insuficience. Klinicky se může vyskytnout nefritický syndrom, hypertenze i nefrotický syndrom. Progrese k závažné formě renální nedostatečnosti se vyskytuje častěji u mužů a starších jedinců. Laboratorně lze prokázat přítomnost smíšeného kryoglobulinu, dalším charakteristickým nálezem je výrazná konzumpce složek komplementu a pozitivita revmatoidních faktorů. Ledvinná biopsie, nejčastěji u II. typu smíšené kryoglobulinémie, prokazuje membranoproliferativní glomerulonefritidu s poměrně intenzivním neutrofilním a monocytárním infiltrátem, dvojitou konturou bazální membrány a v akutní fázi nefritického syndromu také přítomnost amorfních, eozinofilních, PAS pozitivních intraluminárních depozit (6).
Renální vaskulitidy jsou poměrně častou příčinou renálního selhání vyžadujícího dialyzační léčbu. Použití imunosupresivních režimů se odvíjí od celkové aktivity těchto chorob jakož i od přítomnosti dalšího orgánového postižení (plíce). Transplantace ledviny by měla být u nemocných s ANCA asociovanou vaskulitidou odložena, dokud není nemocný v kompletní extrarenální remisi po dobu 12 měsíců. Doporučuje se neodkládat transplantaci u nemocných, kteří jsou v kompletní remisi, ale jsou stále ANCA-pozitivní. V případě relapsu onemocnění je nutné transplantaci odložit nebo nemocného z čekací listiny dočasně vyřadit. Důvodem je vysoká míra imunosuprese při léčbě relapsu onemocnění, která by po transplantaci mohla být odpovědná za závažné infekční komplikace (18).
Hyperurikémie a ledviny
Dnavá nefropatie byla ještě před 50 lety jednou z nejčastějších příčin renální nedostatečnosti u mužů středního věku. Důvodem poklesu její prevalence je zřejmě výrazné snížení incidence chronické tofózní dny díky pokrokům v diagnostice i léčbě a rovněž vymizení latentní intoxikace olovem z vodovodů. Poškození funkce ledvin a ztráta funkčních nefronů z jakékoli příčiny vede k vzestupu sérové hladiny kyseliny močové. Renální léze u pacientů s dnou jsou charakterizovány pokročilou arteriosklerózou, glomerulosklerózou a intersticiální fibrózou, je popisována přítomnost krystalů urátu v zevní dřeňové vrstvě ledvin. Chronická urátová nefropatie se dnes považuje za poměrně vzácnou, v minulosti byla popisována její asociace s tofózní dnou (19). Převažuje přesvědčení, že tuto diagnózu nelze stanovit pouze klinicky, bez jasného průkazu z ledvinné biopsie, což není vždy možné (20).
Naproti tomu s akutní formou poškození ledvin se setkáváme častěji, bývá spojeno s hyperurikémickou nefropatií způsobenou velkou náloží kyseliny močové filtrované do primární moči. Koncentrace objemu moči spojená se zhoršenou rozpustností urátů vede k jejich precipitaci v ledvinných tubulech, jejich blokádě, k tubulární nekróze, zánětu a k akutnímu selhání ledvin (21).
Lékové postižení ledvin a dávkování antirevmatických léků u renální nedostatečnosti a při hemodialýze
Nesteroidní antirevmatika
Nesteroidní antirevmatika (NSA) jsou chemicky heterogenní skupina látek, které inhibují cyklooxygenázu. Většina jejich terapeutického účinku jakož i nežádoucích efektů vyplývá právě s interakcí se syntézou prostaglandinů. Rovněž potenciální riziko poškození ledvin je spojené s inhibicí vasodilatačně působících prostaglandinů PGE2, PGF2α a PGI2, které jsou produkovány a metabolizovány v ledvině, kde regulují renální tok krve, produkci reninu, tubulární transport iontů a metabolismus vody. Riziko postižení ledvin je velmi malé u zdravých jedinců. Zvětšuje se však u řady stavů, které samy o sobě predisponují k renální nedostatečnosti. Jsou to stavy jako například hypovolémie, krvácení, septický šok, diabetes mellitus, nefrotický syndrom, současná medikace nefrotoxických léků nebo diuretik (22). Klinicky se postižení ledvin v důsledku terapie NSA může projevit velmi různorodě. Častý je výskyt akutní renálního poškození s akutní tubulární nekrózou. Po vysazení NSA se většinou renální funkce upravují spontánně, ale může být potřebná i hemodialýza. Akutní intersticiální nefritida je vzácnějším projevem toxicity NSA, která se obvykle objevuje po dlouhé expozici NSA ve starším věku. Ačkoliv se jedná o intersticiální nefritidu, bývá doprovázena překvapivě výraznou proteinurií, někdy až nefrotického charakteru. V těchto případech mohou glomeruly jevit fúzi pedicel podocytů typickou pro tzv. minimální změny (minimal change disease). Většinou nebývají jiné známky systémové alergie. Rozvoj membranózní nefropatie s nefrotickým syndromem je vzácnou manifestací postižení ledvin NSA, idiosynkratická reakce na různé třídy NSA je považována za příčinu jejího vzniku (23). Typicky se objevuje již po malých dávkách těchto léčiv a spontánně regreduje po jejich vysazení. Nekróza renálních papil je dobře známá reakce na chronické užívání fenacetinu ve vysokých dávkách. Byla však vzácně také popsána při užívání ibuprofenu, indomethacinu, fenoprofenu či dokonce paracetamolu (24). Užívání NSA bývá také spojeno se zvýšeným rizikem retence soli a vody, hypertenze a hyperkalémie. Nefrotoxický účinek NSA se zvyšuje zejména při současném užívání diuretik a kalcineurinových inhibitorů. Chronická analgetická nefropatie je forma renální poruchy charakterizovaná nekrózou renálních papil, chronickou intersticiální nefritidou a sklerozující mikroangiopatií. Je způsobená dlouhodobým a nadměrným používáním analgetických směsí. Dnes se tato manifestace vyskytuje jen zřídka, byla popisována zejména v souvislosti s užíváním fenacetinu a to zejména v lékových kombinacích. Ačkoliv největší riziko analgetické nefropatie je spojeno s fenacetinem, jeho celosvětové stažení z trhu tuto jednotku zcela neeradikovalo. Ledvinné manifestace jsou většinou necharakteristické, jedná se typicky o pomalý rozvoj chronického ledvinného selhání doprovázeného mírnou leukocyturií a proteinurií (11).
NSA jsou extenzivně v organismu metabolizovány, mají vysokou vazbu na proteiny s malým distribučním objemem a jsou jen málo dialyzovatelné. Renální nedostatečnost nehraje ve farmakokinetice NSA takový význam, jelikož renální exkrece nezměněného léku je zanedbatelná (1 %) pro většinu NSA s výjimkou diclofenacu, diflunisalu, ketorolacu či nebumetonu (zde činí 10–60 %). U dialyzovaných nemocných je použití NSA spojeno s větším rizikem krvácení do horní části trávicího traktu, jejich použití je třeba omezit na nezbytně krátkou dobu (25).
Soli zlata
Mezi závažné nežádoucí projevy užití solí zlata patří nefrotoxicita. Přechodná a mírná proteinurie se vyskytuje až u 10 % léčených. Za určitých okolností může vzniknout i nefrotický syndrom, který má tendenci k regresi po vysazení léku, návrat proteinurie k normě však může trvat mnoho měsíců (26). V léčbě revmatoidní artritidy se v současnosti tyto léky používají velmi marginálně. U pacientů s těžkou poruchou funkce ledvin a u dialyzovaných se vůbec nepodávají (6).
D - penicilamin
Tento přípravek je registrován v revmatologii pro léčbu revmatoidní artritidy a systémové sklerodermie, u obou indikací je však jeho použití výrazně omezeno. Toxicita léku je častá. Z pohledu potenciálního postižení ledvin je nejzávažnějším projevem proteinurie, která se může rozvinout do obrazu masivního nefrotického syndromu (6).
Cyklosporin A (CsA) a tacrolimus
Užití kalcineurinových inhibitorů je spojeno s rizikem rozvoje akutní i chronické nefrotoxicity. Tyto látky jsou silnými vazokonstriktory aferentních renálních arteriol, jejich dlouhodobější použití vede k poškození endotelu a hladké svaloviny cév s následnou hyalinózou jejich stěny a přispívá k rozvoji tubulointersticiální fibrózy či glomerulosklerózy. Nejčastějším projevem nefrotoxicity kalcineurinových inhibitorů je hypertenze, která se objevuje de novo až u 30 % pacientů léčených byť pouze nízkými dávkami CsA. Charakteristicky chybí noční pokles tlaku krve typický pro esenciální hypertenzi. Akutní nefrotoxicita spojená s nárůstem kreatininu je způsobena vazokonstrikcí aferentních glomerulárních arteriol. Tento efekt závisí na dávce léku a reaguje dobře na její redukci. Dlouhodobější expozice kalcineurinovým inhibitorům (nejméně 6–12 měsíců), může vést k rozvoji chronické nefropatie charakterizované přítomností proužkovité tubulointersticiální fibrózy. Je spojena obvykle se zesílením arteriol a jejich hyalinizací, s náhradou pericytů a hladkých svalů cévní stěny eozinofilním proteinovým materiálem a rozvojem glomerulární sklerózy. Klinicky může být přítomna elevace hladin sérového kreatininu (6). Zlatým standardem průkazu tohoto typu postižení je renální biopsie. Vzácnou komplikací terapie CsA je rozvoj mikroangiopatické hemolytické anémie s mikrotromby způsobujícími obliterativní arteriolopatii, jejímž nejčastějším projevem je rychle progredující renální nedostatečnost. Jelikož projevy hemolýzy jsou někdy nevýrazné, ledvinná biopsie představuje často jediný klíč k správné diagnóze. V pozitivním případě je nutné okamžité vysazení CsA, poškození ledvin však může být ireverzibilní. K minimalizaci rizika nefropatie při terapii autoimunitních chorob, revmatoidní či psoriatické artritidy by se úvodní dávky CsA měly pohybovat mezi 2,5–3 mg/kg hmotnosti rozdělené do dvou denních dávek. Není doporučeno překračovat dávku 4 mg/kg (6). Po dosažení efektu je třeba dávku snížit na minimální účinnou. CsA lze použít u hemodialyzovaných pacientů. Dialýza neovlivňuje významně celkovou clearance cyklosporinu A a změna jeho dávkování proto není nutná (27).
Sulfasalazin
Lék se skládá ze sulfapyridinu a 5-aminosalicylové kyseliny. Je všeobecně dobře tolerovaný. Jeho užívání může vést k zabarvení moči do oranžova. Ačkoliv jsou závažné ledvinné vedlejší účinky velmi vzácné, byly popsány případy rozvoje renálního selhání, proteinurie či nefrotického syndromu. V případě renální nedostatečnosti se doporučuje pečlivě zvážit prospěch další léčby sulfasalazinem, dávka se redukuje dle GF. Nejsou k dispozici validní data ohledně použití sulfasalazinu u dialyzovaných nemocných. Vzhledem k jeho nízké molekulární hmotnosti a relativně nízké vazbě na proteiny je pravděpodobně dialýzou zvýšeně odstraňován (6).
Methotrexát
Renální toxicita methotrexátu je velmi nízká, ale ledvinná nedostatečnost snižuje jeho clearance zejména v kombinaci s NSA a tím zvyšuje jeho všeobecnou toxicitu. Dávky methotrexátu je třeba redukovat na polovinu v případě poklesu GF pod 0,8 ml/ a je kontraindikovaný v případech závažného ledvinného postižení (pokles GF pod 0,3 ml/s) (28).
Jeho použití u hemodialyzovaných nemocných většina zdrojů nedoporučuje vzhledem k nízké dialyzační clearance methotrexátu a riziku myelotoxicity. Novější high fluxové membrány mohou jeho dialyzační clearance zvýšit (29).
Leflunomid
Lék nemá měřitelný negativní efekt na ledvinné funkce, jeho užití ale může vést neznámým mechanismem účinku ke zvýšení krevního tlaku, zejména u nemocných s preexistující hypertenzí. Leflunomid je kontraindikován u nemocných se středně těžkou a těžkou poruchou ledvinných funkcí (30). Pro jeho použití u lehčích forem renální nedostatečnosti neexistuje příliš údajů, a proto by měl být u těchto nemocných používán jen s velkou opatrností za pečlivé monitorace jaterních funkcí a krevního obrazu a pouze tam, kde jeho použití je nevyhnutelné. Ohledně jeho použití u dialyzovaných nemocných neexistují validní data (11) a nedoporučuje se za těchto okolností podávat.
Azathioprin
Přípravek může vzácně indukovat vznik hypersenzitivního syndromu spojeného s multiorgánovým postižením včetně ledvinné nedostatečnosti s oligurií. Kazuisticky byla popsána intersticiální nefritida jako vedlejší účinek terapie azathioprinem. Je třeba pamatovat na potřebu výrazné redukce jeho dávky při současném užívání inhibitorů xantinoxidázy (allopurinol, febuxostat), jelikož xantinoxidáza hraje důležitou roli v jeho metabolismu. Současné podávání jejich inhibitorů vede k vysokému riziku akumulace a toxicity azathioprinu (31).
U chronické renální nedostatečnosti se doporučuje redukce jeho dávek. Během dialýzy se zkracuje poločas azathioprinu a jeho metabolitů v těle asi o 50 %. Jeho použití u hemodialyzovaných je tudíž poměrně bezpečné, někteří autoři doporučuji navíc po dialýze podat suplementární dávku ve výši 0,25 mg/kg (32).
Cyklofosfamid
Jelikož cyklofosfamid a jeho metabolity jsou vylučovány ledvinami, je třeba redukovat jeho dávku dle GF pro riziko jeho akumulace v organismu při renální nedostatečnosti. Toxicitu cyklofosfamidu zvyšuje komedikace allopurinolem a cimetidinem. Metabolit cyklofosfamidu akrolein vylučovaný močí vykazuje urologickou toxicitu, může indukovat vznik hemoragické cystitidy a z dlouhodobého pohledu zvyšuje riziko vzniku karcinomu močového měchýře a snad i karcinomu ledvin. Riziko vzniku hemoragické cystitidy, nižší u intravenózně a pulzně podávaného cyklofosfamidu, snižuje současné podávání Mesny (6).
U renální nedostatečnosti se doporučuji redukovat dávku cyklofosfamidu o 75 % v případě poklesu GF pod 0,17 ml/s. Cyklofosfamid a jeho metabolity jsou dialyzovatelné, 30–60 % podané dávky je odstraněno dialýzou. Z těchto důvodů se doporučuje podávat cyklofosfamid až po provedení dialýzy (32).
Mykofenolát mofetil
Podávání mykofenolátu mofetilu u jedinců s renální nedostatečností je spojeno s vyšším rizikem hematologické toxicity. Měření jeho hladin může v těchto případech riziko minimalizovat (6).
Hemodialýza hladiny mykofenolátu příliš neovlivňuje, což se může podílet na jeho horší gastrointestinální toleranci u hemodialyzovaných. V případě potřeby se doporučuje podávat nižší dávky, zpočátku 250 mg dvakrát denně, při dobré toleranci 500 mg dvakrát denně (32).
Biologické léky
Biologické léky (inhibitory TNFα, tocilizumab, rituximab, abatacept, anakinra) nevykazují přímou nefrotoxicitu, nebyly však zkoušeny u pacientů s těžkými formami renální nedostatečnosti. Vzhledem k všeobecně zvýšenému riziku infekcí je třeba z nefrologického pohledu počítat i s větším rizikem močových infekcí či pyelonefritid. Kazuistická sdělení popisují u hemodialyzovaných úspěšné podávání inhibitorů TNFα (infliximab, adalimumab, etanercept) (32).
Antiuratika
Kolchicin podávaný v přítomnosti ledvinné nedostatečnosti může poškodit renální funkce a jeho dávku je třeba redukovat. U dialyzovaných by se podávat neměl vůbec.
Allopurinol je stále lékem první volby při léčbě hyperurikémie. V případě jeho nesnášenlivosti či nedostatečné účinnosti je jeho alternativou febuxostat nebo urikosurika. Při podávání allopurinolu byla vzácně popsána indukce intersticiální nefritidy, mezi další nežádoucí účinky patří riziko vzniku hypersenzitivního syndromu. Tento syndrom může probíhat mírně jako kožní vyrážka, byly však popsány těžké formy s toxickou epidermální nekrolýzou, teplotou, eozinofílií, zhoršením renálních funkcí a dokonce úmrtím (DRESS syndrom). Allopurinol je možné podávat i pacientům s renální insuficiencí, dávky je však nutné redukovat dle GF. Při GF 0,33–0,17 ml/s je vhodná dávka 200 mg allopurinolu denně, při poklesu GF pod 0,17 ml/s by denní dávka neměla přesáhnout 100 mg. Dávka allopurinolu se u dialyzovaných nemocných snižuje na polovinu. Často není jeho podávání nutné, jelikož kyselina močová je odstraňována dialýzou. Febuxostat je metabolizován v játrech a je jimi i vylučován, takže u pacientů se středním stupněm renální insuficience není nutná adjustace dávky. Urikosurika jako probenecid a sulfinpyrazon jsou neúčinná a tudíž kontraindikovaná v případě renální nedostatečnosti, naproti tomu benzpromaron je možné použít i u pacientů s mírným renálním poškozením (33).
Antimalarika
Dávka antimalarika se doporučuje při těžce snížené GF (0,17 ml/s) redukovat na polovinu. Antimalarika jsou dialýzou odstraňována jen minimálně. V případě potřeby jejich podávání se doporučuje nechat nižší dávku korespondující se snížením GF (32).
Glukokortikoidy
Renální vylučování glukokortikoidů v nezměněné podobě činí pouze 1–20 %. Základním místem metabolismu jsou játra, proto není nutná úprava dávkování při renální insuficienci. U nemocných s cirhózou jater je clearance nevázané frakce snížena na 2/3 normálu a mělo by se s tím počítat při dávkování. Prednison a methylprednison mohou být odstraněny dialýzou, protože jejich vazba na proteiny je závislá na dávce. Nicméně dialýzou eliminované množství není tak velké, aby vyžadovalo úpravu dávkování. Glukokortikoidy zvyšují renální clearance salicylátů a vysazení steroidů může vést k intoxikaci salicyláty (31).
Závěr
Závěrem lze říci, že ledvinné manifestace představují široké spektrum možného poškození ledvinných funkcí v souvislosti se základní revmatickou chorobou, které může postihnout glomerulus, ledvinné intesticium stejně jako renální vaskulaturu. Klinicky nejvýznamnější jednotky, jejichž společným jmenovatelem je postižení ledvin, jsou systémové choroby pojiva jako celek včetně revmatoidní artritidy, dále vaskulitidy, hyperurikémie a v neposlední řadě také ledvinné postižení související s užitím některých antirevmatických léků. Při použití řady léčiv včetně imunosupresiv ve farmakoterapii revmatických chorob je třeba jejich dávku přizpůsobit ledvinným funkcím. Spolupráce revmatologa a nefrologa je na tomto poli nezbytná.
Tab. 1. Farmakokinetika a dávkování antirevmatických léků dle glomerulární filtrace (upraveno dle Swarup A, J Clin Rheum 2004; 10: 190–204). 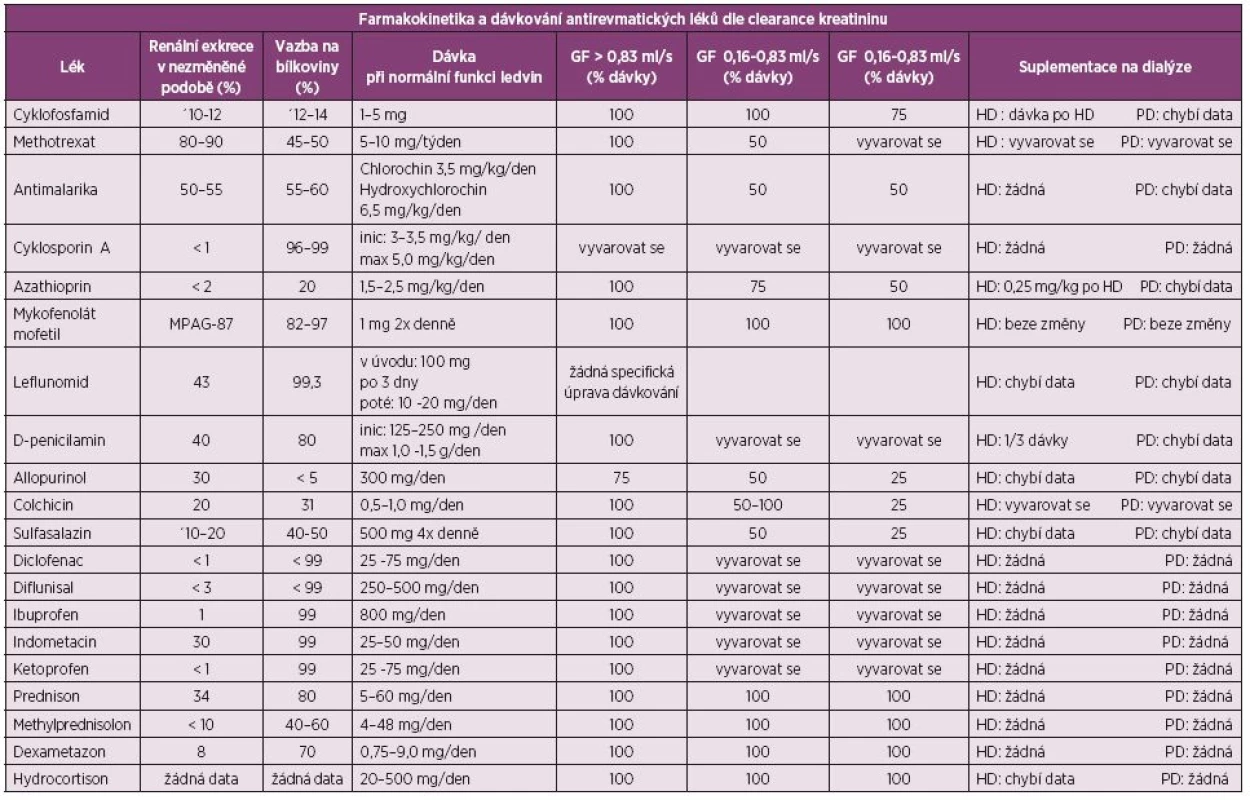
Podpořeno grantem AZV 15-28659A
Adresa pro korespondenci:
MUDr. Anna Klíčová
III. interní klinika FN a LF UP
I.P. Pavlova 6
779 00 Olomouc
e-mail: anna.klicova@fnol.cz
Zdroje
1. Bomback A, Appel G. End-stage renal disease due to lupus nephritis. Uptodate 2014; updated 8.8.2013.
2. Weening JJ, D´Agati, WD, Schwartz MM et al. The classification of glomerulonephritis in systemic lupus erythematosus revisited. J Am Soc Nephrol 2004; 15 : 241–250.
3. Naiker I P, Chrystal V, Randeree I G, et al. The significance of arterial hypertension at the onset of clinical lupus nephritis. Postgrad Med J 1997; 73 : 230–233.
4. Contreras G, Roth D, Pardo V, Strikre LG, et al. Lupus nephritis: A clinical review for practicing nephrologists. Clin Nephrol 2002; 57 : 95–107.
5. Joseph RE, Radhakrishnan J, Appel GB. Antiphospholipid antibody syndrome and renal disease. Curr Opin Nephrol Hypertens 2001; 10 : 175–181.
6. Adu D, Emery P, Madaio M. Rheumatology and the kidney. Oxford University Press, 2nd Edition 2012, 488.
7. Schwartz MM, Kawala KS, Corwin HL, Lewis EJ. The prognosis of segmental glomerulonephritis in systemic lupus erythematosus. Kidney Int 1987; 32(2): 274.
8. Ponticelli C, Moroni G. Renal transplantation in lupus nephritis. Lupus 2005; 14(1): 95.
9. O'Callaghan CA. Renal manifestations of systemic autoimmune disease: diagnosis and therapy. Best Pract Res Clin Rheumatol 2004; 18 : 411–427.
10. Denton CP, Lapadula G, Mouthon L, Müller-Lander U. Renal complication and scleroderma renal crisis. Rheumatology (Oxford) 2009; 48 : 32–35.
11. Penn H, Howie AJ, Kingdon EJ, et al. Scleroderma renal crisis: patient characteristics and long-term outcomes. QJM 2007; 100 : 485–494.
12. Varga J, Fenves A. Renal disease in systemic sclerosis (scleroderma), including scleroderma renal crisis. Uptodate 2014; updated 13.2. 2014.
13. Simms RW, Prout MN, Cohen AS. The epidemiology of AL and AA amyloidosis. Baillieres Clin Rheumatol 1994; 8 : 627–634.
14. Rose BD. Renal manifestations of systemic vasculitis. Uptodate 2012; updated 6.6.2011.
15. Karie S, Gandjbakhch F, Janus N, et al. Kidney disease in RA patients: prevalence and implication on RA-related drugs management: the MATRIX study 2008; 47 : 350-354.
16. Stokes MB, Foster K, Markowitz GS, et al. Development of glomerulonephritis during anti-TNF-alpha therapy for rheumatoid arthritis. Nephrol Dial Transplant 2005; 20 : 1400–1406.
17. Gayraud M, Guillevin L, le Toumelin P, et al. Long-term followup of polyarteritis nodosa, microscopic polyangiitis, and Churg-Strauss syndrome: analysis of four prospective trials including 278 patients. Arthritis Rheum 2001; 44 : 666–675.
18. KDIGO Clinical Practice Guideline for Glomerulonephritis. Kidney Int Suppl 2012; 2 : 218–239.
19. Talbott JH, Terplan KL. The kidney in gout. Medicine (Baltimore) 1960; 39 : 405.
20. Moe OW. Posing the question again: does chronic uric acid nephropathy exist? J Am Soc Nephrol 2010; 21(3): 395–397.
21. Hartus E, Budd R, Firestein G, et al. Kelley‘s Textbook of Rheumatology 2004; 7 : 1402–1425.
22. Garella S, Matarese R A. Renal effects of prostaglandins and clinical adverse gement: the MATRIX study. Rheumatology (Oxford) 2008; 47 : 350–354.
23. Gansevoort R T, Heeg J E, Vriesenorp R, et al. Antiproteinuric drugs in patients with idiopathic membranosus glomerulopathy. Nephrol Dial Transplant 1992; 91–96.
24. Akhund L, Quinet R J, Ishag S. Celecoxib-related renal papillary necrosis. Arch Intern Med 2003; 163 : 114–115.
25. Jankovic S, Aleksic J, Rakovic S, et al. Nonsteroidal antiinflammatory drugs and risk of gastrointestinal bleedingamong patients on hemodialysis. J Nephrol 2009; 22 : 502–507.
26. Hall C L. The natural course of gold and penicillamine nephropathy: a long term study of 54 patients. Adv Exp Med Biol 1989; 252 : 274–356.
27. Bennet W M, DeMattos A, Meyers M M, Andoh T Barry J M. Chronic cyclosporin nephrotoxicity. The Achille´s heel of immunosuppressive therapy. Kidney Int 1996; 50 : 1089–1100.
28. http://www.sukl.cz/download/spc/SPC23090.pdf
29. Saland J M, Leafly P J, Hansch E. Effective removal of methotrexate by high-flux hemodialysis. Pediatr Nephrol 2002; 17 : 825–829.
30. http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000235/WC500026289.pdf
31. Maršálková P, Grundmann M. Farmakokinetika a klinické aplikace vybraných imunosupresiv. Klin Farmakol Farm 2009; 23(3): 138–141.
32. Swarup A, Sachdeva N, Schumacher R. Dosing of Antirheumatic Drug in Renal Disease and Dialysis. J Clin Rheum 2004; 10 : 190–204.
33. Perez R P, Calabozo M, Pijaan JI, et al. Effect of urate-lowering therapy on the velocity of size of reduction of tophi in chronic gout. Arthritis Rheum 2002; 47 : 356–360.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2015 Číslo 4- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Deformační analýza pravé komory pomocí speckle tracking echokardiografie v diagnostice plicní arteriální hypertenze u pacientů se systémovou sklerodermií a smíšeným onemocněním pojiva
- Vztah revmatických chorob a jejich léčby k manifestnímu postižení ledvin
- Sérové biomarkery u axiálních spondyloartritid
- Obsah ročníku časopisu Česká revmatologie 23/2015
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vztah revmatických chorob a jejich léčby k manifestnímu postižení ledvin
- Sérové biomarkery u axiálních spondyloartritid
- Deformační analýza pravé komory pomocí speckle tracking echokardiografie v diagnostice plicní arteriální hypertenze u pacientů se systémovou sklerodermií a smíšeným onemocněním pojiva
- Obsah ročníku časopisu Česká revmatologie 23/2015
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



