-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Utlumení chronického zánětu cvičením nebo úpravou střevní mikrobioty jako kauzální opatření při involuční osteoporóze
Attenuation of chronic inflammation by exercise or by modifying the intestinal mikrobiome as causal measures on osteoporosis
Physical activity and nutritional adjustments inhibits chronic inflammation and biological signs of frailty syndrome. They allow to keep the necessary positive balance of bone remodeling. Therefore, they are causal measures to manage the involutional osteoporosis and generally in the prevention of osteoporosis. Although clinical studies have confirmed the slowing decline in BMD and decrease in fracture risk with age in improving physical activity and depending on dietary regimens, the necessary randomised clinical studies confirming a non-inferiority of these measures in comparison with the pharmacological treatment for osteoporosis.
Key words:
Aging, bone quality, microbiome, involutional osteoporosis, physical activity, sarcopenia
Autoři: J. Štěpán
Působiště autorů: Revmatologická klinika 1. LF UK Praha ; Revmatologický ústav, Praha
Vyšlo v časopise: Čes. Revmatol., 26, 2018, No. 3, p. 142-150.
Kategorie: Přehledový článek
Souhrn
Fyzická aktivita a úprava nutričního režimu tlumí chronický zánět a biologické projevy syndromu frailty. Umožňují udržet potřebnou pozitivní rovnováhu remodelace kostní hmoty a jsou proto kauzálním opatřením při involuční osteoporóze a obecně v prevenci osteoporózy. Přestože klinické studie potvrdily zpomalení poklesu BMD a snížení rizika zlomenin s věkem při zlepšení fyzické aktivity i v závislosti na dietních režimech, byly by potřebné randomizované klinické studie, potvrzující non-inferioritu těchto opatření v porovnání s farmakoterapií osteoporózy.
Klíčová slova:
Fyzická aktivita, kvalita kosti, mikrobiom, involuční osteoporóza, sarkopenie, stárnutí
Osteoporóza je definována jako systémové metabolické onemocnění skeletu charakterizované poruchou mechanické odolnosti kosti a v důsledku toho zvýšeným rizikem zlomenin [1]. Onemocnění osteoporózou postihuje zpravidla celý skelet, ale nemá výraznější charakteristické klinické symptomy. Osteoporotické zlomeniny vznikají po nepřiměřeně malém úrazu (např. pádu ze stoje) nebo i spontánně. Pravděpodobnost prodělat během dalšího života nízkotraumatickou zlomeninu má každá druhá žena a každý pátý muž ve věku ≥ 50 let. V r. 2010 bylo v České republice registrováno 72 195 nových zlomenin / 3,8 milionu osob ≥ 50 let. Nárůst počtu nových zlomenin, a to především zlomenin periferního skeletu, je výrazný po 70. roce života u žen i u mužů (obr. 1). V tomto věkovém období je zhoršování stavu skeletu u obou pohlaví obdobné, a jeho stupeň je výrazem involuční osteoporózy (nikoli postmenopauzální osteoporózy). Se zvyšujícím se počtem seniorů se v příštích desetiletích budou zvyšovat zdravotní, sociální a farmakoekonomické důsledky onemocnění asociovaných se stárnutím, mj. také involuční osteoporózy a sarkopenie, které patří k biologickým projevům syndromu frailty. Podle demografických údajů bude v r. 2025 počet zlomenin o třetinu vyšší, než v r. 2010 (93 643/ 4,3 milionu).
Obr. 1. Změny incidence zlomenin obratlů (prázdná kolečka) a kyčle (plná kolečka) s věkem u českých žen. Podle [2]. ![Změny incidence zlomenin obratlů (prázdná kolečka)
a kyčle (plná kolečka) s věkem u českých žen. Podle [2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/7880dcc7c4fcdf68c46f828c4f048df1.png)
Kromě stárnutí populace je pro nárůst prevalence zlomenin s věkem řada dalších důvodů. V České republice je jakákoli antiosteoporotická léčba zajištěna až při denzitometricky dokumentované osteoporóze (BMD ≤ -2,5 T-skóre v bederní páteři nebo v proximálním femuru). Farmakoterapie osteoporózy je zajištěna jen u desetiny mužů a u čtvrtiny žen s takovým nálezem [2]. Na tuto léčbu se v r. 2010 vynaložilo 1,4 miliardy Kč, ale tyto náklady nebyly plně využity, protože antiosteoporotickou terapii ukončuje do 2 let užívání perorálních aminobisfosfonátů více než 80 % pacientů a užívání denosumabu kolem 65 % pacientů [3, 4]. V jiných státech je to podobné, v USA bylo po zlomenině kyčle léčeno aminobisfosfonáty v r. 2004 15 % pacientů, v roce 2013 jen 3 % [5]. Mezi důvody tohoto stavu se uvádí nedostatečná péče o pacienty s již prodělanou zlomeninou, intolerance perorálních aminobisfosfonátů a obavy lékařů a pacientů z interakcí a nežádoucích účinků léků (často obavy i ze vzácně zjišťovaných atypických zlomenin kyčle a osteonekrózy čelisti). Dalším důvodem je, že u starších pacientů musí lékaři zvažovat naléhavost léčení dalších komorbidit a z toho plynoucí rizika polypragmazie. Osteoporóza je jen jedním z řady chronických onemocnění, asociovaných se zvyšováním věku (obr. 2).
Obr. 2. Pravděpodobnost denzitometricky dokumentované osteoporózy při komorbiditách u 4 961 mužů a 5 699 žen starších 50 let, z nichž 8,7% mělo prokázanou osteoporózu. Podle [45]. ![Pravděpodobnost denzitometricky dokumentované osteoporózy při komorbiditách u 4 961 mužů a 5 699 žen starších 50 let,
z nichž 8,7% mělo prokázanou osteoporózu. Podle [45].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/20da0435d9d8b33175fd7197e3859972.png)
Až 67 % starších pacientů užívá v různých indikacích 5 nebo více léků [6].
Cílem tohoto sdělení je upozornit, že fyzická aktivita a úprava nutrice jsou opatřeními, která tlumí chronický zánět a která udržením potřebné pozitivní rovnováhy remodelace kostní hmoty mohou být kauzálním opatřením v prevenci osteoporózy a nízkotraumatických zlomenin.
Syndrom frailty, jeho projevy a chronický zánět
Involuční osteoporóza a sarkopenie jsou biologickými projevy syndromu frailty, jak se označuje dynamický klinický stav se zvýšenou fyzickou křehkostí, jejíž příčinou je se stárnutím související zhoršování psychologických, fyzických a sociálních funkcí jedince. Prevalence syndromu frailty je vysoká, u osob ve věku nad 65 let 10–25 % a až u osob starších 85 let 45 %. Komorbidity se uvádějí u poloviny osob se syndromem frailty [7]. Projevy syndromu frailty jsou asociovány s buněčným stárnutím, kdy buňky ztrácejí schopnost dělení v důsledku oxidativního stresu, zkracování telomér, poškození DNA, poruchy funkce mitochondrií, agregace proteinů a účinků prozánětlivých cytokinů. Ve tkáni se zvyšuje se počet buněk s fenotypem, označovaným SASP (senescence-associated secretory phenotype), který je vyjádřen chronickým zánětem nízkého stupně a zhoršováním funkcí tkání [8–10]. Hromadění poškození, která buněčné a molekulární příčiny stárnutí navozují, se při stárnutí kostí a svalů uplatňují vyčerpáním kmenových buněk a zhoršením mezibuněčné komunikace. Ve staré kosti je upregulace SASP asociována s úbytkem osteoprogenitorových buněk exprimujících transkripční faktor osterix [11], ale je vyjádřena také v osteocytech, kde je zvýšena exprese transkripčního jaderného faktoru nukleárního faktoru κB a tím i rekrutování nových osteoklastů [12, 13]. Ve stárnoucí kosti proto klesá novotvorba, ale neklesá osteoresorpce.
Obě onemocnění, sarkopenie i osteoporóza, mají obdobné charakteristiky; jde o degenerativní ztrátu kosterní svalové hmoty, resp. kostní hmoty, zhoršování mikro - a makroarchitektury svalů, resp. zhoršování mikro - a makroarchitektury kosti a zhoršování svalové síly, resp. kostní pevnosti. Svaly a kosti sdílejí společný mezenchymální prekurzor už při intrauterinním vývoji [14]. Během časného postnatálního vývoje, v dospívání i v dospělosti záleží stav muskuloskeletálního systému na mechanických a biochemických interakcích mezi kostí a svaly [15]. Kost i sval mají endokrinní funkce, protože tvoří faktory, ovlivňující další tkáně a orgány. V endokrinních interakcích kosti a svalů se uplatňují faktory tvořené svalem (IL-5, IL-6, IL-7, IL-15, TGFα, TGFβ1, PGE2, CXCL1, irisin) a faktory tvořené kostí (PGE, Dkk-1, sclerostin, FGF23, osteoprotegerin, RANKL) [16]. Faktory tvořené ve svalu urychlují hojení zlomenin. Mezi množstvím kostní a svalové hmoty je vysoce významná korelace [17]. S věkem se u žen i u mužů zhoršuje interakce mezi svaly a kostí a prevalence obou onemocnění se zvyšuje obdobně [18]. Čím těžší je sarkopenie, tím častější osteoporóza a naopak, čím těžší je osteoporóza, tím častější je sarkopenie [19].
Obě onemocnění, sarkopenie i osteoporóza, jsou asociována se zvýšeným rizikem pádů a zlomenin. Pro léčení sarkopenie není registrován žádný lék, z ověřených antiosteoporotických léků je v České republice jen velmi omezeně dostupný osteoanabolický teriparatid, z antiresorpčních léků jsou dostupné aminobisfosfonáty (alendronát, risedronát, ibandronát a kys. zoledronová) a denosumab, nedostupný je raloxifen [20]. Antiresorpční léky útlumem remodelace významně zvyšují mineralizaci kosti a zpomalují nárůst rizika zlomenin s věkem. Tyto léky ale tlumí novotvorbu kosti, dříve ztracenou kostní hmotu nenahradí a kost dále stárne. Antiresorpční ani osteoanabolická léčba neupravuje stupeň sarkopenie, naopak při léčbě aminobisfosfonáty může množství svalové hmoty klesat [21]. Pacienti s involuční osteoporózou mají hodnoty BMD < -2,5 T skóre, hodnoty biomarkerů remodelace kosti (βCTX a PINP) v pásmu referenčních hodnot a pravděpodobnost nízkotraumatické zlomeniny poměrně nízkou (obr. 3). Neprokazuje se u nich zvýšená osteoresorpce, jejíž utlumení by zdůvodnilo antiresorpční terapii a vyvažovalo by její možné nežádoucí účinky. Platí to i pro pacienty, kteří prodělali nízkotraumatickou zlomeninu před mnoha lety, kdy byla zvýšená osteoresorpce kauzální léčbou úspěšně utlumena (tyreotoxikóza, hyperparatyreóza, deficience estrogenů). Při involuční osteoporóze je proto velmi častou klinickou otázkou volba vhodných opatření. Kauzálním opatřením při involuční osteoporóze a obecně v prevenci syndromu frailty by mělo zpomalit stárnutí buněk.
Obr. 3. Závislost pravděpodobnosti nízkotraumatických zlomenin na věku u žen s hodnotami BMD v krčku femuru -2,5 a -3 T skóre a u žen s prevalentní zlomeninou a BMD -2,5 T skóre. K odhadu pravděpodobnosti zlomenin užit FRAX (http://www.shef. ac.uk/FRAX/tool.jsp?country=39). 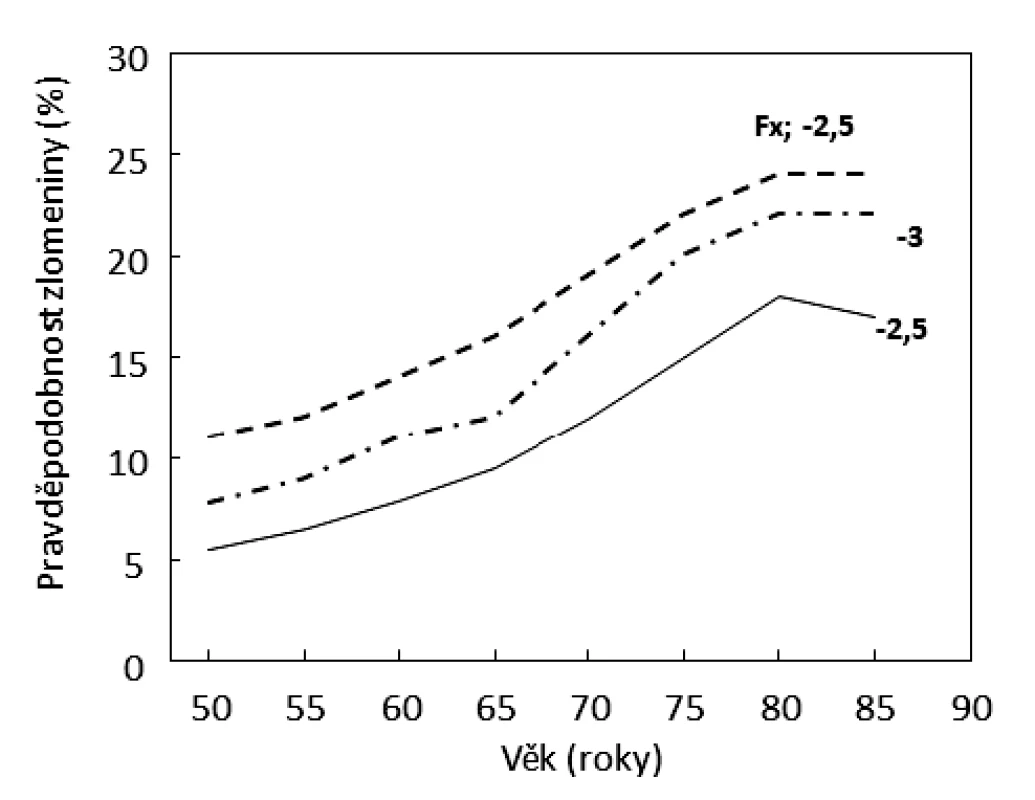
Pokud jde o skelet, lze na věku závislý úbytek a zhoršování kvality kostní hmoty experimentálně upravit třemi přístupy – genetickou manipulací, senolytiky (dasatinibem a quercetinem) nebo inhibicí prozánětlivých SASP. Pozoruhodné je, že všechny tyto přístupy mají obdobný účinek; všechny vedou k utlumení resorpce kosti, ale nedochází k útlumu novotvorby kostní hmoty [22]. Další výzkum musí ověřit, do jaké míry první dva přístupy respektují biologický význam senescence buněk a zda je lze uplatnit v humánní medicíně.
Třetí zmíněné opatření, tlumení zánětu, bylo naproti tomu opakovaně ověřené při řadě klinických situací. Při chronických zánětlivých onemocněních, jako jsou revmatoidní artritida, střevní zánětlivá onemocnění, nebo psoriáza, je účinným opatřením k zastavení úbytku a zhoršování kvality kostní hmoty biologická léčba zánětu [23]. Projevy chronického zánětu může navozovat také deficience estrogenů. U zhruba třetiny žen je zrychlená osteoresorpce během prvních 5–10 let po menopauze (postmenopauzální osteoporóza) projevem zvýšené tvorby RANKL v osteocytech a v osteoblastech, ale také zvýšené tvorby dalších prozánětlivých cytokinů (IL-17, TNFα), tvořených buňkami imunitního systému, zejména Th17, účinkem TNFα, IL-1β, IL-6 a IL-23 (v přehledu [24]). Současně je utlumena novotvorba kostní hmoty. TNFα a IL-17 zvýšují enzymatickou ubiquitinaci β-cateninu a utlumením kanonické signální cesty Wnt/β-catenin brání diferenciaci osteoblastů z jejich prekursorů [25]. Tuto signální cestu tlumí také sclerostin a Dkk1, jehož exprese je zvýšena účinkem TNFα [26]. Experimentálně lze zvýšení osteoresorpce a utlumu novotvorby kostní hmoty při deficienci estrogenů upravit biologickou léčbou zánětu. U ovariektomovaných myší se podáním protilátky proti IL-17 nebo proti TNFα předejde zvýšení exprese sclerostinu a zachovává se novotvorba kosti [27]. V klinické praxi by mohla být účinným opatřením k zastavení úbytku a zhoršování kvality kostní hmoty při deficienci estrogenů hormonální léčba. Estrogeny však nejsou pro tuto indikaci registrovány a selektivní modulátory estrogenních receptorů nejsou v ČR dostupné.
Chronický zánět a fyzická aktivita
Chronický zánět mírného stupně je prokazován při involuční osteoporóze, při sarkopenii a obecně při syndromu frailty [28, 29]. Sérové hodnoty hsCRP (biomarkeru zánětu) se v populaci významně zvyšují s věkem a jsou pozitivně asociovány s rizikem osteoporotických zlomenin a negativně s množstvím svalové hmoty (obr. 4). Asociaci mezi hodnotami CRP a sarkopenií potvrdila také recentní metaanalýza [30].
Obr. 4. Vlevo a uprostřed: asociace hsCRP s věkem a pravděpodobností zlomenin v populaci. Podle [46]. Vpravo: asociace mezi hsCRP a úbytkem svalové hmoty u žen ve věku 65-70 let. Podle [47]). ![Vlevo a uprostřed: asociace hsCRP s věkem a pravděpodobností zlomenin v populaci. Podle [46]. Vpravo: asociace mezi hsCRP
a úbytkem svalové hmoty u žen ve věku 65-70 let. Podle [47]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/a3f99833e09fc77820beb8183bb786d3.png)
V klinické praxi lze účinnost fyzické aktivity na útlum zánětu a stav kostní hmoty hodnotit podle úpravy sérových koncentrací biomarkerů zánětu, podle úpravy biomarkerů osteoresorpce a novotvorby kosti a podle změn denzity kostního minerálu (BMD). U výkonných atletů o průměrném věku 24 let a u trvale výkonných atletů ve věku 64 let byly hodnoty hsCRP a IL-6 významně vyšší, než u necvičících mužů v obdobném věku (obr 5). Ve studii, kde bylo po dobu 5 let sledováno 115 osob ve věku nad 60 let, bylo riziko ztráty svalové hmoty perif. skeletu významně vyšší u osob s bazální hodnotou hsCRP > 3,74 mg/l a IL-6 > 2,71 ng/l (v porovnání s osobami s nižší hodnotou CRP a po adjustavi na věk a pohlaví) [31]. Studie u 5 888 žen a mužů ve věku nad 65 let prokázala (po adjustaci výsledků na věk, rasu, pohlaví, BMI, kardiovaskulární onemocnění, hypertenzi, kouření, diabetes mellitus), že čím větší je fyzická aktivita, tím nižší jsou hodnoty hsCRP. Při nízké fyzické aktivitě (< 368 kcal/týden byly hodnoty hsCRP dvojnásobně vyšší, než u osob s výdejem > 2 269 kcal/týden) [32].
Obr. 5. Sérové koncentrace prozánětlivých cytokinů hsCRP a IL-6 u cvičících mužů (plné sloupce) a u necvičících mužů (prázdné sloupce). Podle [48]. ![Sérové koncentrace prozánětlivých cytokinů hsCRP
a IL-6 u cvičících mužů (plné sloupce) a u necvičících mužů
(prázdné sloupce). Podle [48].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/f59098f83102b6ae8884bc228323d42e.png)
Cvičení je proto při prevenci zlomenin důležitým opatřením, které i u starších osob tlumí chronický zánět, zvyšuje svalovou hmotu a brání poklesu BMD (obr. 6). Posílení zádových svalů cvičením snižuje riziko zlomenin obratlů [33]. Fyzická aktivita příznivě ovlivňuje riziko zlomeniny kyčle [34].
Obr. 6. Změny svalové hmoty, svalové síly, fyzické výkonnosti a BMD páteře a proximálního femuru u žen a mužů (prům. věk 66 let) po 8 měsících intenzivního cvičení (2x týdně 30 minut). Prázdné sloupce: kontroly, plné sloupce: cvičící osoby. Podle [49, 50]. ![Změny svalové hmoty, svalové síly, fyzické výkonnosti a BMD páteře a proximálního femuru u žen a mužů (prům. věk 66 let) po
8 měsících intenzivního cvičení (2x týdně 30 minut). Prázdné sloupce: kontroly, plné sloupce: cvičící osoby. Podle [49, 50].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/6d8a0c5916c5b8833d70f64edbd63dde.png)
Aby se snížilo riziko pádů a fraktur, je vhodné spolu s hodnocením množství a metabolického stavu kostní hmoty vyšetřovat stupeň sarkopenie (obr. 7) a cíleně doporučit potřebnou úpravu fyzické aktivity.
Obr. 7. Hodnocení stupně sarkopenie. Podle [51]. ![Hodnocení stupně sarkopenie. Podle [51].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/27297cfde4f8661da634bb6ee62006bb.png)
Pacientům s osteopenií nebo osteoporózou se doporučují cvičení, která zatěžují skelet a tím stimulují osteoblasty k novotvorbě kostní hmoty. Pacientům s prokázanou osteoporózou lze doporučit pravidelnou chůzi (2–4 hodiny denně). Vhodná jsou ale také cvičení, která nezatěžují skelet (masáže, extenze, plavání a cvičení ve vodě), ale upravují svalové koordinace, zlepšují schopnosti zabránit pádům a zlepšují celkovou kondici a kvalitu života. Pro starší osoby jsou doporučeny 3 typy fyzické aktivity (tab. 1). Podle recentní švédské studie u 37 238 žen a 45 906 mužů, sledovaných až 17 let, se ale riziko zlomenin kyčle snižuje o 31 % a hlavních osteoporotických zlomenin o 19 % i u osob, které denně 20 minut jezdí na kole nebo chodí a které cvičí hodinu týdně [35].
Tab. 1. Typy fyzické aktivity, doporučené pro starší osoby. Intenzita: 0: sezení, 5-6: mírné zvýšení frekvenci tepu a dýchání, 7-8: výrazné zvýšení frekvenci tepu a dýchání. Podle [52]. ![Typy fyzické aktivity, doporučené pro starší osoby. Intenzita: 0: sezení, 5-6: mírné zvýšení frekvenci tepu a dýchání, 7-8:
výrazné zvýšení frekvenci tepu a dýchání. Podle [52].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/76f636f3cbbd4d7ae077ce76a6980447.png)
Chronický zánět a střevní mikrobiom
Při chronických zánětlivých onemocněních je převaha osteoklastické osteoresorpce nad novotvorbou kosti asociována s genetickou predispozicí, ale závisí také na faktorech zevního prostředí. Hledají se proto antigeny, které po své prezentaci dendritickými buňkami a makrofágy navozují proliferaci T buněk. Protože pro stav imunitního systému jsou mimořádně významná mikrobiota zažívacího traktu, věnuje se zvláštní pozornost mikrobiálním antigenům. Asociace změn mikrobioty a chronického zánětu u člověka je známa z řady studií, ať už jde o asociace s metabolickým syndromem, malnutricí, neurologickými poruchami, nádory, kardiovaskulárními onemocněními, nebo chronickým zánětem střev [36]. Mikrobiota mohou příznivě ovlivňovat zdraví hostitele (regulací absorpce živin, tvorbou vitaminů, metabolickým využitím složek potravy, regulací střevního a systémového imunitního systému) [37]. Mikrobiota mohou ovlivnit střevní absorpci vápníku (snížením pH střevního obsahu, ovlivněním střevní absorpce vitaminu D, ovlivněním tvorby 25hydroxyvitaminu v játrech) a mohou regulovat kostní novotvorbu ovlivněním produkce IGF-1 nebo serotoninu.
Zastoupení jednotlivých mikrobiálních druhů závisí na genetických faktorech a mění se v závislosti na dietě a s věkem. Fyziologicky je prostor mezi sousedními enterocyty uzavřen specifickými proteiny a nízká permeabilita střevní sliznice omezuje přestup bakterií a jejich produktů do lamina propria. Při porušení integrity střevní bariéry při střevní dysmikrobii a také při deficienci estrogenů mohou produkty střevní mikroflóry (lipopolysacharidy, peptidoglykany, flageliny a volná DNA), ale i patogenní mikrobiota přestupovat do lamina propria, kde stimulují diferenciaci folikulárních T helper buněk (TFH), vytváření germinálních center a tvorbu autoprotilátek B buňkami [38]. Cytokiny IL-6 a IL-21 z TFH buněk, a IL-6 a TGF-β z TH17 buněk B-buňky také významně stimulují produkci pro-osteoklastogenního RANKL a M-CSF [39]. Zvýšená tvorba těchto cytokinů v B buňkách u žen s postmenopauzální osteoporózou je negativně asociována s BMD v bederní páteři. Úbytek kostní hmoty by mohly navozovat antigeny nebo prozánětlivé cytokiny, tvořené v imunitních buňkách střeva, ale také imunitní buňky nebo bakterie, které do kostní dřeně doputovaly ze střeva. Potvrzení vztahu střevní mikrobioty ke stavu skeletu přineslo zjištění, že bezmikrobní (germ-gree) myši mají vyšší kostní hmotu, než myši v konvenčních podmínkách, a že bezmikrobní myši nejsou po kastraci leukoprolidem schopny zvýšit množství CD4+ T-buněk, exprimujících TNFα [40]. Střevní mikrobiota u myší tedy modulují stupeň chronického zánětu a úbytku kostní hmoty, navozeného deficiencí estrogenů, ale také jiným stresem.
V klinické praxi se při hledání opatření, která by upravila permeabilitu střevní sliznice a zajistila integritu střevní bariéry a zabránila tak aktivaci imunitního systému, věnuje pozornost úpravě střevní mikrobioty volbou složení stravy, probiotiky a prebiotiky. Riziko zlomenin kyčle je nižší při dlouhodobě vyšším zastoupení fermentovaných mléčných výrobků v dietě a při dlouhodobé konzumaci stravy s nízkým protizánětlivým skóre [41, 42]. V zaslepené studii u 50 žen, které dostávaly probiotika nebo placebo, byla po 6 měsících hodnota sérového TNF v intervenční skupině významně nižší při srovnání s placebem [43]. Jedním z významných modulátorů střevního mikrobiomu je vitamin D. Prebiotika (nestravitelné složky stravy, např. některé oligosacharidy) podporují příznivé účinky mikrobioty metabolickými produkty fermentace (mastné kyseliny s krátkým řetězcem, SCFA), snížením pH střevního obsahu a zlepšením střevní absorpce vápníku, ale také ovlivněním funkce enterocytů a maturace a aktivity T-buněk [37]. Prebiotika příznivě ovlivňují nárůst kostní hmoty u rostoucích dětí a zpomalují pokles kostní hmoty u žen po menopauze [44].
Závěr
Syndrom zlomenin (osteoporóza) je závažným zdravotním a sociálním problémem stárnoucí populace většiny evropských zemí. Osteoporóza, tedy pokles množství a zhoršování kvality kostní hmoty, má dvě hlavní příčiny. V kterémkoli věku to mohou být sekundární příčiny zrychleného úbytku kostní hmoty, jako je snížená tvorba estrogenů, hyperkortizolismus, hypertyreóza, hyperparatyreóza, nežádoucí účinky některých léků a velmi často chronická zánětlivá onemocnění. S vysokou prevalencí zlomenin zejména periferního skeletu ve vyšším věku je však asociována především involuční osteoporóza. Tento typ osteoporózy patří spolu se sarkopenií k biologickým projevům syndromu frailty. Kauzálním opatřením při involuční osteoporóze a obecně v prevenci syndromu frailty je cvičení, protože i u starších osob tlumí chronický zánět, zvyšuje svalovou hmotu a brání poklesu BMD. Další možností jsou opatření (mj. složení stravy, probiotika a prebiotika), která upravují složení střevní mikrobioty, permeabilitu střevní sliznice, integritu střevní bariéry a zabrání tak aktivaci imunitního systému. Přestože klinické studie potvrdily zpomalení poklesu BMD a rizika zlomenin s věkem při zlepšení fyzické aktivity i v závislosti na dietních režimech, byly by potřebné randomizované kontrolované studie, potvrzující v klinické praxi non-inferioritu těchto opatření v porovnání s farmakoterapií osteoporózy.
Práce byla podpořena grantem AZV ČR NV18-05-00394.
adresa pro korespondenci:
Prof. MUDr. Jan Štěpán, DrSc.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
E-mail: stepan@revma.cz
Zdroje
1. Klibanski A, Adams-Campbell L, Bassford T, et al. Osteoporosis prevention, diagnosis, and therapy. JAMA 2001; 285(6): 785–95.
2. Svedbom A, Hernlund E, Ivergård M, et al. Osteoporosis in the European Union: a compendium of country-specific reports. Arch Osteoporos 2013; 8(137): 35–42.
3. Lakatos P, Takacs I, Marton I, et al. A retrospective longitudinal database study of persistence and compliance with treatment of osteoporosis in Hungary. Calcif Tissue Int 2016; 98(3): 215–25.
4. Fuksa L, Vytrisalova M. Adherence to denosumab in the treatment of osteoporosis and its utilization in the Czech Republic. Curr Med Res Opin 2015; 31(9): 1645–53.
5. Kim SC, Kim DH, Mogun H, et al. Impact of the U.S. Food and Drug Administration's safety-related announcements on the use of bisphosphonates after hip fracture. J Bone Miner Res 2016; 31(8): 1536–40.
6. Levy HB. Polypharmacy reduction strategies: Tips on incorporating American Geriatrics Society Beers and Screening Tool of older people's prescriptions criteria. Clin Geriatr Med 2017; 33(2): 177–87.
7. Fried LP, Tangen CM, Walston J, et al. Frailty in older adults: evidence for a phenotype. J Gerontol A Biol Sci Med Sci 2001; 56(3): M146-56.
8. Tchkonia T, Zhu Y, van Deursen J, et al. Cellular senescence and the senescent secretory phenotype: therapeutic opportunities. J Clin Invest 2013; 123(3): 966–72.
9. Hayflick L. The limited in vitro lifetime of human diploid cell strains. Exp Cell Res 1965; 37 : 614–36.
10. Zhao J, Fuhrmann-Stroissnigg H, Gurkar AU, et al. Quantitative analysis of cellular senescence in culture and in vivo. Curr Protoc Cytom 2017; 79 : 9.51.1-9.51.25.
11. Kim HN, Chang J, Shao L, et al. DNA damage and senescence in osteoprogenitors expressing Osx1 may cause their decrease with age. Aging Cell 2017; 16(4): 693–703.
12. Farr JN, Fraser DG, Wang H, et al. Identification of senescent cells in the bne microenvironment. J Bone Miner Res 2016; 31(11): 1920–9.
13. Piemontese M, Almeida M, Robling AG, et al. Old age causes de novo intracortical bone remodeling and porosity in mice. JCI Insight 2017; 2(17):e93771.
14. Endo T. Molecular mechanisms of skeletal muscle development, regeneration, and osteogenic conversion. Bone 2015; 80 : 2–13.
15. Lemos DR, Eisner C, Hopkins CI, et al. Skeletal muscle-resident MSCs and bone formation. Bone 2015; 80 : 19–23.
16. Brotto M, Bonewald L. Bone and muscle: Interactions beyond mechanical. Bone 2015; 80 : 109–14.
17. Ferretti JL, Capozza RF, Cointry GR, et al. Gender-related differences in the relationship between densitometric values of whole-body bone mineral content and lean body mass in humans between 2 and 87 years of age. Bone 1998; 22(6): 683–90.
18. Ethgen O, Beaudart C, Buckinx F, et al. The future prevalence of sarcopenia in Europe: A claim for publichealth action. Calcif Tissue Int 2017; 100(3): 229–34.
19. Trajanoska K, Schoufour JD, Darweesh SK, et al. Sarcopenia and its clinical correlates in the general population: The Rotterdam Study. J Bone Miner Res 2018; 33(7): 1209-18.
20. Rosa J, Šenk F, Palička V. Diagnostika a léčba postmenopauzální osteoporózy. Stanovisko Společnosti pro metabolická onemocnění skeletu ČLS JEP 2015 Osteologicky Bull 2016; 20(4): 150–68.
21. Uchiyama S, Ikegami S, Kamimura M, et al. The skeletal muscle cross sectional area in long-term bisphosphonate users is smaller than that of bone mineral density-matched controls with increased serum pentosidine concentrations. Bone 2015; 75 : 84–7.
22. Farr JN, Xu M, Weivoda MM, et al. Targeting cellular senescence prevents age-related bone loss in mice. Nat Med 2017; 23(9): 1072–9.
23. Haugeberg G, Helgetveit KB, Forre O, et al. Generalized bone loss in early rheumatoid arthritis patients followed for ten years in the biologic treatment era. BMC Musculoskelet Disord 2014; 15 : 289.
24. Štěpán J. Osteoporóza, chronický zánět, mikrobiom a estrogeny. Remedia 2018; 28(1): 28–34.
25. Chang J, Liu F, Lee M, et al. NF-kappaB inhibits osteogenic differentiation of mesenchymal stem cells by promoting beta-catenin degradation. Proc Natl Acad Sci U S A 2013; 110(23): 9469–74.
26. Yeremenko N, Zwerina K, Rigter G, et al. Tumor necrosis factor and interleukin-6 differentially regulate Dkk-1 in the inflamed arthritic joint. Arthritis Rheumatol 2015; 67(8): 2071–5.
27. Tyagi AM, Mansoori MN, Srivastava K, et al. Enhanced immunoprotective effects by anti-IL-17 antibody translates to improved skeletal parameters under estrogen deficiency compared with anti-RANKL and anti-TNF-alpha antibodies. J Bone Miner Res 2014; 29(9):1981–92.
28. Hubbard RE, Woodhouse KW. Frailty, inflammation and the elderly. Biogerontology 2010; 11(5): 635–41.
29. Fulop T, Larbi A, Witkowski JM, et al. Aging, frailty and age-related diseases. Biogerontology 2010; 11(5): 547–63.
30. Bano G, Trevisan C, Carraro S, et al. Inflammation and sarcopenia: A systematic review and meta-analysis. Maturitas 2017; 96 : 10–5.
31. Aleman H, Esparza J, Ramirez FA, et al. Longitudinal evidence on the association between interleukin-6 and C-reactive protein with the loss of total appendicular skeletal muscle in free-living older men and women. Age Ageing 2011; 40(4): 469–75.
32. Geffken DF, Cushman M, Burke GL, et al. Association between physical activity and markers of inflammation in a healthy elderly population. Am J Epidemiol 2001; 153(3): 242–50.
33. Pfeifer M, Sinaki M, Geusens P, Boonen S, et al. Musculoskeletal rehabilitation in osteoporosis: a review. J Bone Miner Res 2004; 19(8): 1208–14.
34. Forsen L, Bjorndal A, Bjartveit K, et al. Interaction between current smoking, leanness, and physical inactivity in the prediction of hip fracture. J Bone Miner Res 1994; 9(11): 1671–8.
35. Stattin K, Michaelsson K, Larsson SC, et al. Leisure-time physical activity and risk of fracture: A cohort study of 66,940 men and women. J Bone Miner Res 2017; 32(8): 1599–606.
36. Kostic AD, Xavier RJ, Gevers D. The microbiome in inflammatory bowel disease: current status and the future ahead. Gastroenterology 2014; 146(6): 1489–99.
37. Belkaid Y, Hand TW. Role of the microbiota in immunity and inflammation. Cell 2014; 157(1): 121–41.
38. Taneja V. Microbiome in 2016: T follicular helper cells and the gut microbiome in arthritis. Nat Rev Rheumatol 2017; 13(2): 72–4.
39. Weitzmann MN. The role of inflammatory cytokines, the RANKL/OPG axis, and the immunoskeletal interface in physiological bone turnover and osteoporosis. Scientifica (Cairo) 2013; 2013 : 125705.
40. Li JY, Chassaing B, Tyagi AM, et al. Sex steroid deficiency-associated bone loss is microbiota dependent and prevented by probiotics. J Clin Invest 2016;126(6): 2049–63.
41. Byberg L, Bellavia A, Larsson SC, et al. Mediterranean Diet and Hip Fracture in Swedish Men and Women. J Bone Miner Res 2016; 31(12): 2098–105.
42. Orchard T, Yildiz V, Steck SE, et al. Dietary inflammatory index, bone mineral density, and risk of fracture in postmenopausal women: Results from the Women's Health Initiative. J Bone Miner Res 2017; 32(5): 1136–46.
43. Jafarnejad S, Djafarian K, Fazeli MR, et al. Effects of a Multispecies Probiotic Supplement on Bone Health in Osteopenic Postmenopausal Women: A Randomized, Double-blind, Controlled Trial. J Am Coll Nutr 2017; 36(7): 497–506.
44. Slevin MM, Allsopp PJ, Magee PJ, et al. Supplementation with calcium and short-chain fructo-oligosaccharides affects markers of bone turnover but not bone mineral density in postmenopausal women. J Nutr 2014; 144(3): 297–304.
45. Puth MT, Klaschik M, Schmid M, et al. Prevalence and comorbidity of osteoporosis - a cross-sectional analysis on 10,660 adults aged 50 years and older in Germany. BMC Musculoskelet Disord 2018; 19(1): 144.
46. Schett G, Kiechl S, Weger S, et al. High-sensitivity C-reactive protein and risk of nontraumatic fractures in the Bruneck study. Arch Intern Med 2006; 166(22): 2495–501.
47. Wahlin-Larsson B, Carnac G, Kadi F. The influence of systemic inflammation on skeletal muscle in physically active elderly women. Age (Dordr) 2014; 36(5): 9718.
48. Mikkelsen UR, Couppe C, Karlsen A, et al. Life-long endurance exercise in humans: circulating levels of inflammatory markers and leg muscle size. Mech Ageing Dev 2013; 134(11-12): 531–40.
49. Watson SL, Weeks BK, Weis LJ, et al. High-Intensity Resistance and Impact Training Improves Bone Mineral Density and Physical Function in Postmenopausal Women With Osteopenia and Osteoporosis: The LIFTMOR Randomized Controlled Trial. J Bone Miner Res 2018; 33(2): 211–20.
50. Watson SL, Weeks BK, Weis LJ, et al. Heavy resistance training is safe and improves bone, function, and stature in postmenopausal women with low to very low bone mass: novel early findings from the LIFTMOR trial. Osteoporos Int 2015; 26(12): 2889–94.
51. Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing 2010; 39(4): 412–23.
52. American College of Sports Medicine. ACSM’s Guidelines for Exercise Testing and Prescription. 10 ed. Philadelphia: Lippincott Williams & Wilkins; 2018.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2018 Číslo 3- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Možnosti diagnostiky revmatické polymyalgie a obrovskobuněčné arteritidy pomocí FDG PET a PET/CT zobrazení – dvanáctileté zkušenosti jednoho diagnostického centra
- Inhibitory Janusových kináz v terapii revmatoidní artritidy
- Utlumení chronického zánětu cvičením nebo úpravou střevní mikrobioty jako kauzální opatření při involuční osteoporóze
- Aktuální témata z výročního kongresu Evropské ligy proti revmatismu EULAR 2018
- Prof. MUDr. Eduard Cmunt – revmatolog, fyzioterapeut, balneolog, člověk
- Abstrakta 62. sjezdu českých a slovenských revmatologů 20.–22. září 2018, Kongresový hotel Clarion, Praha
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Inhibitory Janusových kináz v terapii revmatoidní artritidy
- Možnosti diagnostiky revmatické polymyalgie a obrovskobuněčné arteritidy pomocí FDG PET a PET/CT zobrazení – dvanáctileté zkušenosti jednoho diagnostického centra
- Abstrakta 62. sjezdu českých a slovenských revmatologů 20.–22. září 2018, Kongresový hotel Clarion, Praha
- Prof. MUDr. Eduard Cmunt – revmatolog, fyzioterapeut, balneolog, člověk
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



