-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Novinky v diagnostice a léčbě granulomatózy s polyangiitidou
Granulomatosis with polyangiitis: news in diagnosis and treatment
Granulomatosis with polyangiitis (GPA) is a necrotizing vasculitis which belongs to ANCA associated vasculitides. It is characterized by the granulomas, most commonly affecting the nasal cavities, upper respiratory tract, lungs and kidneys. 82–94% of pacients with GPA are ANCA positive (antineutrophil cytoplasmic antibodies), especially type c-ANCA (specifically proteinase 3), in 20% p-ANCA (anti myeloperoxidase antibody) and ANCA negative in 10%. In edition to basic imaging we use as a standard lung HRCT (high resolution computed tomography) and brain and paranasal sinuses MRI (magnetic resonance imaging). Renal biopsy is important for diagnoses and assessing the severity of the disease. The Birmingham Vasculitis Activity Score (BVAS) is used to assess disease activity, both for initial diagnosis and for subsequent monitoring of treatment effect and relapse. Inicial therapy of GPA consists of high-dose glucocorticoids and cyclophosphamide or rituximab. Recently, a comparable effect has been demonstrated for mycophenolate mofetil. Plasma exchange is used for patients with rapidly progressing renal or pulmonary failure with pulmonary haemorrhage. Maintenance therapy of GPA consists of azathioprine, rituximab, methotrexate, mycophenolate mofetil, alternatively may be used leflunomide. Avacopan – C5a receptor inhibitor is new effective drug in replacing high-dose glucocorticoids.
Keywords:
azathioprine – rituximab – granulomatosis with polyangiitis – ANCA-associated vasculitis – Birmingham Vasculitis Activity Score – Cyclophosphamide – mycophenolate mofetil – Methotrexate – avacopan
Autori: E. Lokočová; P. Horák; M. Skácelová
Pôsobisko autorov: III. interní klinika NRE LF UP a FN, Olomouc
Vyšlo v časopise: Čes. Revmatol., 27, 2019, No. 3, p. 126-135.
Kategória: Přehledový článek
Súhrn
Granulomatóza s polyangiitidou (GPA) je nekrotizující vaskulitida patřící do skupiny ANCA asociovaných vaskulitid. Je charakterizována tvorbou granulomů, nejčastěji postihuje vedlejší nosní dutiny, horní cesty dýchací, plíce a ledviny. Z laboratorních vyšetření je pro 82–94 % pacientů s GPA charakteristická pozitivita ANCA (protilátky proti cytoplazmě neutrofilních leukocytů), zejména typ c-ANCA (protilátky proti proteináze 3), ve 20 % mohou být pozitivní p-ANCA (protilátky proti myeloperoxidáze) a v 10 % jsou ANCA negativní. V diagnostice GPA se využívají nejen základní zobrazovací vyšetření, ale v dnešní době již standardně HRCT plic (výpočetní tomografie s vysokým prostorovým rozlišením), MR mozku (magnetická rezonance) a vedlejších nosních dutin. Zlatým standardem pro diagnostiku a posouzení tíže onemocnění je provedení renální biopsie. Ke zhodnocení aktivity onemocnění se používá Birminghamské skóre aktivity vaskulitid (BVAS), a to jak v rámci úvodní diagnostiky, tak i k následnému monitorování efektu léčby a případného relapsu choroby. Základem indukční léčby nově diagnostikované GPA se závažným průběhem jsou vysokodávkové glukokortikoidy v kombinaci s cyklofosfamidem nebo rituximabem. Nově byl prokázán srovnatelný efekt u mykofenolát mofetilu. U pacientů s rychle progredujícím renálním nebo pulmonálním selháním s plicní hemoragií jsou indikovány plazmaferézy. K udržení remise je první volbou azathioprin, dále pak rituximab, methotrexát, mykofenolát mofetil, alternativně lze použít i leflunomid. Novinkou v léčbě GPA je možnost náhrady glukokortikoidů inhibitorem C5a receptoru – avacopanem s cílem omezení nežádoucích účinků chronické steroidní léčby.
Klíčová slova:
granulomatóza s polyangiitidou – ANCA asociované vaskulitidy – Birminghamské skóre hodnocení vaskulitid – cyklofosfamid – rituximab – mykofenolát mofetil – methotrexát – azathioprin – avacopan
ÚVOD
Granulomatóza s polyangiitidou (GPA, dříve známá jako Wegenerova granulomatóza) patří společně s mikroskopickou polyangiitidou (MPA) a eozinofilní granulomatózou s polyangiitidou (EGPA) do skupiny ANCA asociovaných vaskulitid (protilátky proti cytoplazmě neutrofilních leukocytů). Zánětlivě změněny jsou především cévy středního a malého kalibru, což vede k charakteristickému postižení horních cest dýchacích, očí, nosu, dolních cest dýchacích, ledvin, dále se mohou objevit poruchy periferního či centrálního nervového systému, gastrointestinálního traktu, artralgie či myalgie. Jedná se o chronickou nekrotizující vaskulitidu, která je charakterizována tvorbou granulomů nejčastěji v oblasti horních cest dýchacích, vedlejších nosních dutin, plic a mozku.
Mezi klinické příznaky patří chronická krustózní rinosinusitida s epistaxí, hnisavé otitidy i s ulceracemi v nosu a dutině ústní, s chronickým zánětem až destrukcí chrupavky nosu, jejímž důsledkem může být až charakteristický sedlovitý nos. Z plicních projevů bývá nejčastější kašel s váznoucí expektorací, dále dušnost, hemoptýza, bolesti na hrudi. Postižení ledvin se v počátku projevuje mikroskopickou hematurií, rychle progredující glomerulonefritida může vyústit až v rozvoj nefrotického syndromu s otoky, hypertenzí či hematurií. Z neurologických příznaků se často objevuje mononeuritis multiplex (vaskulitická neuropatie s postižením dvou nebo více periferních nervů), polyneuropatie, paréza hlavových nervů, vzácně se může vyskytnout postižení CNS s tvorbou granulomů či abscesů. Oční manifestace zahrnují konjunktivitidy, ulcerace rohovky, episkleritidy či skleritidy, neuropatie očního nervu, retinální vaskulitidu a uveitidu. Z vzácnějších příznaků se mohou retroorbitálně objevit granulomy s hnisavou sekrecí či naopak obstrukcí nazolakrimálních duktů. Přibližně polovina pacientů s GPA má některou z kožních manifestací, nejčastěji se jedná o leukocytoklastickou vaskulitidu, purpuru na dolních končetinách až se vznikem ulcerací, dále se na kůži může objevit urtika či livedo reticularis. Mezi kloubní příznaky patří artralgie, myalgie, artritidy. Časté jsou i celkové nespecifické příznaky jako únava, febrilie, celková slabost či váhový úbytek. Vzácně se může objevit postižení jater, příušní či štítné žlázy, gastrointestinálního traktu s průjmy, enteroragií nebo při kardiálním postižení perikarditida, dilatační kardiomyopatie či převodní poruchy (1, 2).
KLASIFIKACE
Všeobecně používaná klasifikační kritéria z konference v Chapel Hill (CHCC) z roku 2012 rozdělují jednotlivé vaskulitidy podle velikosti postižených cév s přihlédnutím k patologickým nálezům a orgánovému postižení (3). GPA, MPA a EGPA tvoří samostatnou podskupinu vaskulitid s postižením malých cév, v renální biopsii však oproti ostatním chybí imunitní depozita. MPA se odlišuje nepřítomností nekrotizujících granulomů. Starší klasifikační kritéria Americké revmatologické asociace ACR (American College of Rheumatology) z roku 1990 mohou být vodítkem v diagnostice, nezahrnují však pozitivitu ANCA protilátek a neodlišují MPA jako odlišnou jednotku. Dle ACR kritérií by měly být splněny alespoň dva z následujících bodů:
- zánět v nose, paranazálních dutinách či ústech (ulcerace, hnisavá či krvácející sekrece)
- abnormální rentgenový snímek plic s nálezem uzlíků, neměnnými plicními infiltráty či kavitami
- abnormální močový sediment (mikroskopická hematurie)
- histologický nález granulomatózního zánětu cévy či perivaskulárně (4)
Evropská léková agentura (EMA) kombinuje CHSS a ACR kritéria a mimo to zahrnuje i ANCA protilátky. V případě ANCA pozitivity a přítomnosti dalších bodů odpovídajících GPA lze stanovit diagnózu i bez biopsie (5).
DIAGNOSTIKA
Z laboratorních vyšetření je pro GPA charakteristická pozitivita ANCA protilátek, v 82–94 % se u těchto pacientů jedná o protilátky proti proteináze 3. U 20 % pacientů s GPA mohou být pozitivní protilátky proti myeloperoxidáze a minimálně 10 % je ANCA negativních. Ke stanovení protilátek se užívá nepřímá imunofluorescence s vyšší senzitivitou a ELISA (enzyme-linked immunosorbent assay – enzymová imunoanalýza) s vyšší specificitou testu. Jako substrát v případě imunofluorescence slouží etanolem fixované lidské neutrofily, které produkují odlišné typy cytoplazmatické imunofluorescence (granulární cytoplazmatická – cANCA, perinukleární – pANCA a atypická – aANCA nebo xANCA). Pozitivitu cANCA způsobují většinou protilátky namířené proti proteináze 3 (PR3-ANCA). V případě perinukleárního typu se pozitivně nabité granulové složky přeskupují kolem negativně nabité jaderné membrány, což vede k perinukleární fluorescenci. Tento obraz je charakteristický pro protilátky proti myeloperoxidáze (MPO-ANCA). Tzv. atypické ANCA mohou být imunofluorescenčně pozitivní u jiných onemocnění než systémových vaskulitid (např. u ostatních systémových onemocnění pojiva, ulcerózní kolitidy, primární sklerozující cholangitidy či autoimunitní hepatitidy). Testování pomocí enzymové imunoanalýzy (ELISA) na protilátky proti MPO či PR3 však bývá v tomto případě zpravidla negativní (6, 7). Pozitivita cANCA a PR3-ANCA byla detekována u velké skupiny pacientů se subakutní bakteriální endokarditidou i v případě jiných forem bakteriemií a dále u řady pacientů s tuberkulózou a aspergilózou (8).
Z rutinních laboratorních výsledků bývají zvýšené zánětlivé parametry – FW i CRP, v krevním obrazu nacházíme často zvýšenou hladinu leukocytů, trombocytů a normocytární normochromní anemii. V případě postižení ledvin dochází k nárůstu hladin urey, kreatininu, poklesu glomerulární filtrace, v močovém sedimentu se může objevovat erytrocyturie, mírná leukocyturie, válce, mikroalbuminurie bývá doprovázená nárůstem hodnoty ACR (poměr albumin/kreatinin). V případě rychle progredující glomerulonefritidy (RPGN) dochází u 10–30 % pacientů k rozvoji nefrotického syndromu s proteinurií > 3,5 g/24 hod., hypoproteinemií a hyperlipidemií. U neléčených pacientů s RPGN dochází k terminálním renálnímu selhání po 6 měsících až u 80–90 %. Z dalších laboratorních nálezů mohou být přítomné zvýšené hladiny cirkulujících imunokomplexů a hypergamaglobulinemie.
Z nových potencionálních biomarkerů lze zmínit protilátky proti LAMP-2 (lyzozom asociovaný membránový protein-2), moesinu, plazminogenu a pentraxinu-3. Prozatím však chybí dostatek důkazů jako prediktorů recidivy či porovnání se změnou titru ANCA protilátek. Dále pak profil CD8+ u pacientů s vyšším rizikem relapsu, index granularity granulocytů jako prediktor lepší odpovědi na léčbu rituximabem, z nových močových biomarkerů pak MCP-1 (monocytární chemoatraktant protein 1) a močový solubilní CD 163 jako prediktory relapsu a horší prognózy (9).
Využití jednotlivých zobrazovacích metod vychází z klinických projevů granulomatózy s polyangiitidou. Mezi základní vyšetření patří skiagram plic, který provádíme prakticky u všech pacientů i bez plicní symptomatologie (obr. 1). V současnosti se již jako standard v diagnostice a zhodnocení tíže postižení využívá HRCT plic (high resolution computed tomography – výpočetní tomografie s vysokým prostorovým rozlišením), které nám je schopné poskytnout přesný obraz časných změn i v případech normálního skiagramu. CT obraz GPA je velmi pestrý, nejčastěji bývají přítomny noduly, dále opacity mléčného skla pruhovité až difuzní při plicní hemoragii. Velikost nodulů se pohybuje kolem několika milimetrů až k 10 centimetrům, ve 30–50 % se jedná o noduly s kavitou, 17 % tvoří difuzní opacity. Dále se mohou vyskytovat retikulace, zesílení interlobulárních sept, voštiny, bronchiektázie, hilová lymfadenopatie či zesílení pleury. HRCT je schopné zobrazit i zmnožené cévy zásobující noduly či kavity, menší periferní klínovité denzity odpovídající plicním mikroinfarktům, nepravidelné, hvězdicovitě rozšířené plicní arterie nebo zúžení trachey či bronchů (10, 11) (obr. 2). U pacientů s chronickou krustózní rhinosinusitidou, epistaxí, hyposmií/anosmií, bolestivostí nebo tlakem ve tváři, kdy lze předpokládat postižení horních cest dýchacích, se kromě skiagramu paranazálních dutin využívá zejména CT vyšetření. Z běžných nálezů bývají zesílené slizniční lemy v nose i paranazálních dutinách (61–75 %), dále se mohou vyskytovat kostní destrukce v oblasti nosu (57 %), paranazálních dutin (54 %) i sklerotizující osteitida (18 %) (12). Z dalších zobrazovacích metod se využívá sonografie především se zaměřením na ledviny, kde může být v případě GPA patrná vyšší echogenita kůry ledvin, při pokročilé chorobě s chronickou renální insuficiencí pak menší velikost ledvin a ztenčení kůry. Dále lze využít magnetickou rezonanci, a to zejména při podezření na postižení CNS, oka, ucha nebo srdce (obr. 3).
Obr. 1. Rentgenový snímek plic u granulomatózy s polyangiitidou s nálezem solidních kavitovaných lézí v obou plicních polích (Radiologická klinika FN, Olomouc) 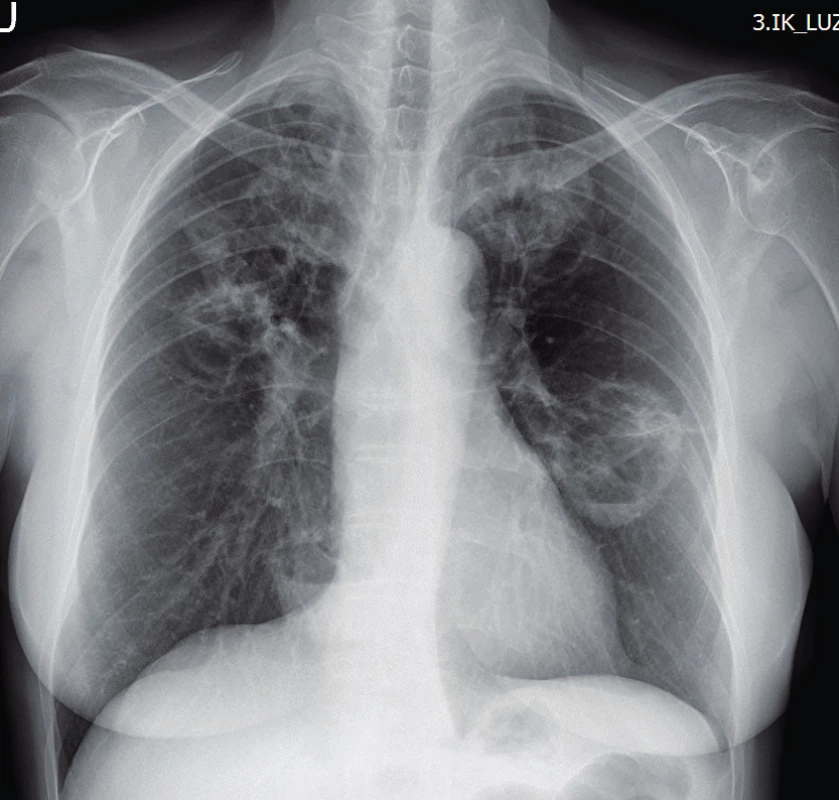
Obr. 2. HRCT plic (high-resolution computer tomography – výpočetní tomografie s vysokým prostorovým rozlišením) s obrazem nodulací a kavitovaných lézí, fibrózních pruhů, pleurálních plastických změn s trakčními bronchiektáziemi u granulomatózy s polyangiitidou (Radiologická klinika FN, Olomouc) 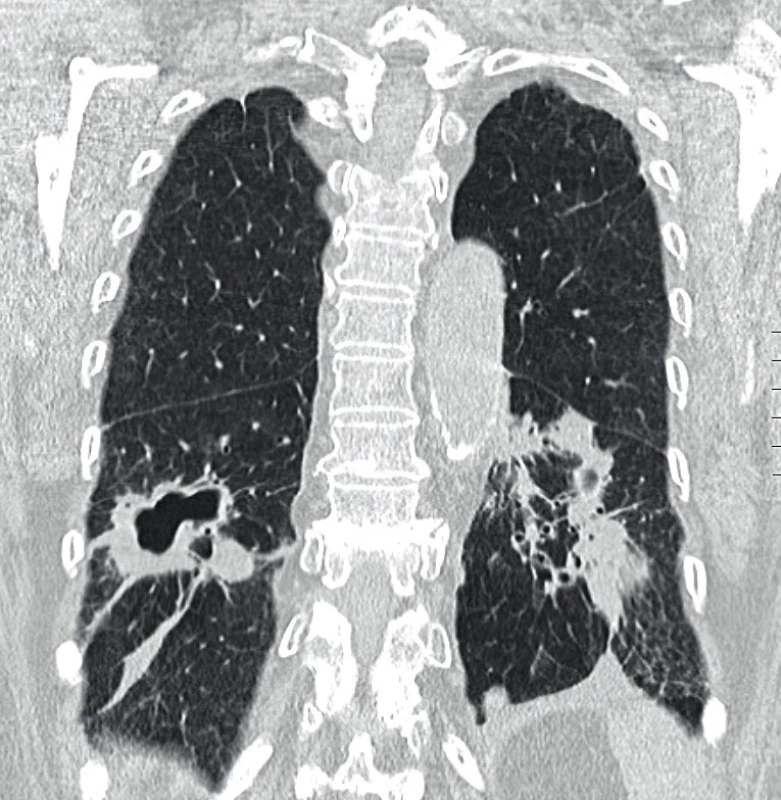
Obr. 3. Magnetická rezonance mozku u pacienta s granulomatózou s polangiitidou a postižením CNS s obrazem vaskulitidy se změnami supratentoriálně a mnohočetnými akutními i subakutními ischemiemi (Radiologická klinika FN, Olomouc) 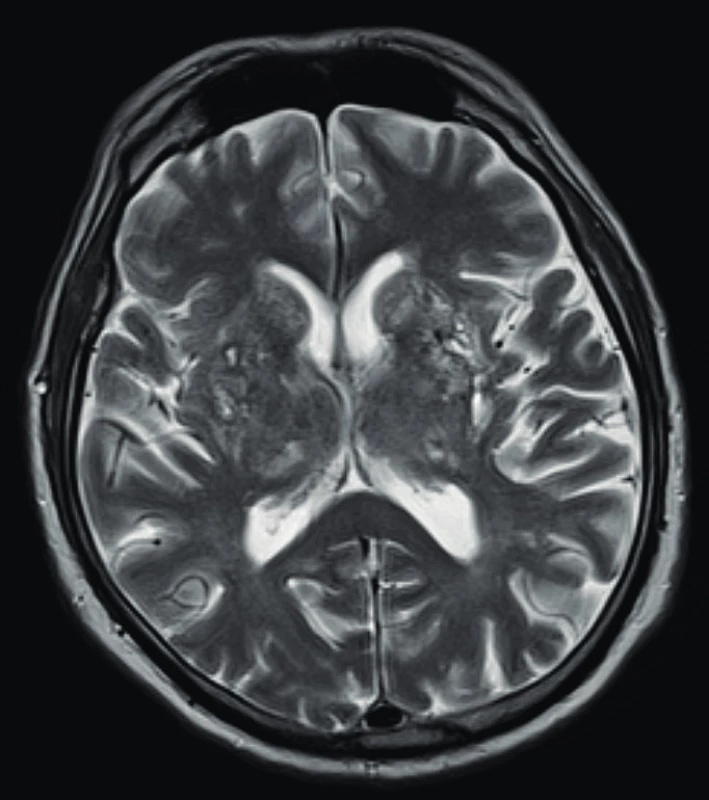
K posouzení plicních funkcí se využívá spirometrie s vyšetřením difuzní kapacity plic pro oxid uhelnatý (DLCO – diffusing capacity of the lung for carbon monoxide CO), která bývá v případě intersticiálního plicního postižení snížená. U difuzní alveolární hemoragie může být naopak DLCO zvýšená. Restrikční porucha je doprovázena snížením vitální kapacity plic (VC), ventilační parametry však mohou být zachovány. Při obstrukci dochází k oploštění křivky.
Při podezření na GPA se dále provádí bronchoskopie s biopsií a bronchoalveolární laváží (BAL). BAL je indikována především v případě CT nálezu difuzních plicních opacit, kdy lze předpokládat difuzní alveolární hemoragii (DAH), dále pak k získání vzorků k mikrobiologickému a cytologickému vyšetření. Bronchoskopicky mohou být patrné ulcerace laryngu či trachey (v 25 %), hyperpigmentace, zelenožluté plaky či pseudotumory tvořené granulační tkání, purulentní sekrece či izolované lobární hemoragie. Endobronchiální biopsie je důležitá i v rámci diferenciální diagnostiky k vyloučení malignity, tuberkulózy či sarkoidózy. BAL je v případě DAH charakteristického hemoragického vzhledu, mikroskopicky jsou přítomny siderofágy. Vyšetření hraje důležitou roli i v případě diagnostiky oportunních infekcí.
K transtorakální či torakoskopické biopsii se přistupuje spíše vzácně, většinou v případě ojedinělých nodulací nejasné etiologie za absence extrapulmonálních manifestací GPA. Přínosná je v takovéto situaci u vysoce suspektní GPA s pozitivitou ANCA protilátek, kdy je před zahájením iniciační imunosupresivní terapie žádoucí vyloučit infekci či malignitu. Z histologických nálezů se nejčastěji setkáváme s granulomy palisádově obklopující cévy, mezi granulomy bývá zmnožena populace lymfocytů, plazmocytů a alveolárních makrofágů. Charakteristické jsou i vaskulární fibrinoidní nekrózy s tvorbou mikroabscesů. Biopsie z nosní sliznice a paranazálních sinů se provádí v rámci došetření chronické sinusitidy, často i s obturací nosu, histologické nálezy však bývají ve více než 50 % nespecifické se známkami akutních či chronických zánětlivých změn s nekrózami (13, 14).
Zlatým standardem pro histologické vyšetření GPA je provedení renální biopsie. Nálezy mohou podat důležité informace o aktivitě a tíži onemocnění, od mírné fokálně segmentální glomerulonefritidy u pacientů s asymptomatickou hematurií a normálními renálními funkcemi až po difuzní nekrotizující krescentní glomerulonefritidu u akutního poškození ledvin (obr. 4). Renální biopsie je obecně doporučována jak ke stanovení diagnózy, tak i v případě zhodnocení suspektního relapsu. Diagnostická výtěžnost je vysoká, okolo 91,5 % (15). V případě GPA hovoříme o pauciimunní glomerulonefritidě, tzn. že imunofluorescenčně či elektronovou mikroskopií nebývá v glomerulech zjištěna žádná nebo pouze minimální depozita imunitních komplexů (16–18). Histopatologická klasifikace světelnou mikroskopií rozlišuje základní kategorie glomerulárního postižení:
- Fokální – minimálně 50 % glomerulů je normálních bez vaskulitických změn nebo sklerózy, mohou se vyskytovat mírné ischemické změny a malé množství zánětlivých buněk (méně než pět neutrofilů, lymfocytů nebo monocytů).
- Krescentní – je charakterizována přítomností srpků u minimálně 50 % glomerulů, srpky mohou být celulární, fibrocelulární nebo fibrózní.
- Sklerotizující – minimálně 50 % glomerulů je sklerotických ve více než 80 %.
- Smíšené – méně než 50 % glomerulů je normálních, méně než 50 % krescentních a méně než 50 % sklerotizujících.
Obr. 4. Granulomatóza s polyangiitidou s postižením ledvin: glomerulus s nekrózou postihující více než 50 % kapilárního trsu a objemným celulárním srpkem (šipka). Okolní tubuly s oploštělou výstelkou a projevy ischemie, tj. s akutní tubulární nekrózou (barvení HE, zvětšení 200×) (Ústav klinické a molekulární patologie LF UP a FN, Olomouc) 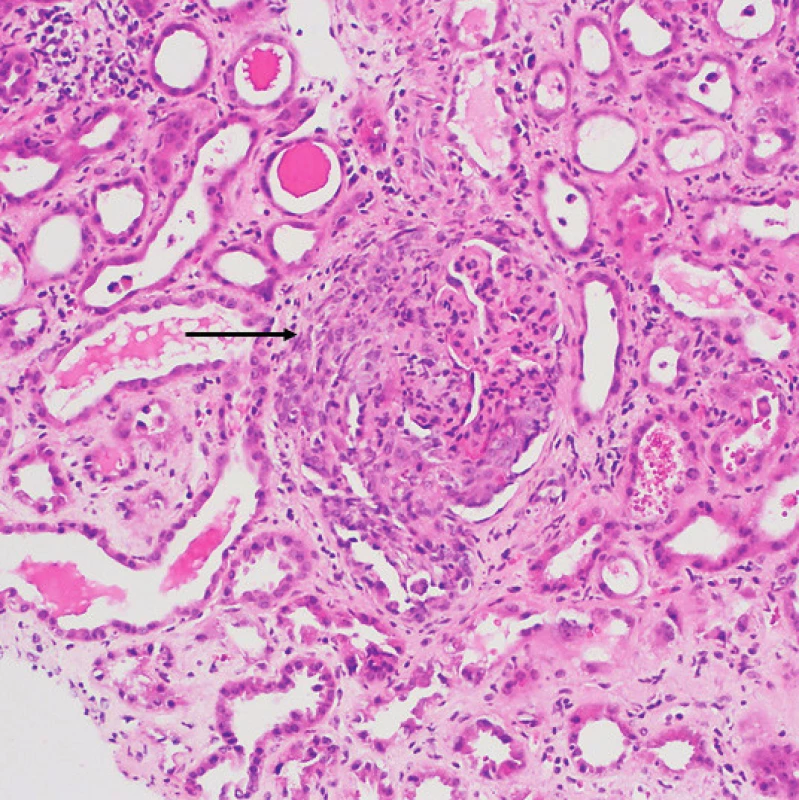
Diagnózu AAV jsme schopni stanovit i bez nutnosti biopsie, zejména pokud je vyjádřeno několik charakteristických klinických projevů, jako je např. destruktivní krustózní rhinosinusitida, plicní noduly či alveolární hemoragie za současné pozitivity ANCA protilátek. Časné stanovení diagnózy je důležité zejména v případě progresivní choroby s rychlým nástupem orgánového poškození, kdy může být včasné zahájení terapie život zachraňující. V těchto případech může riziko biopsie ledviny či plic převažovat nad přínosem tohoto vyšetření.
HODNOCENÍ AKTIVITY
Pro zhodnocení aktivity granulomatózy s polyangiitidou je v současnosti nejvíce využíváno Birminghamské skóre aktivity vaskulitid BVAS (Birmingham Vasculitis Activity Score) (tab. 1). Zahrnuje informace ohledně jednotlivých manifestací GPA, které jsou rozčleněny do devíti základních kategorií (celkové příznaky, kožní, sliznice/oči, ORL, hrudník, kardiovaskulární systém, břicho, ledviny, nervová soustava) a jsou dále obodovány podle konkrétních příznaků (19). Nejvyšší počet dosažených bodů je 33 v případě perzistující choroby a 63 u nově diagnostikované či zhoršené v posledních 4 týdnech. Lze jej využít nejen v klinických studiích, ale i v běžné praxi ke zhodnocení aktivity GPA během úvodní diagnostiky, dále v průběhu léčby i ke zhodnocení případného relapsu onemocnění.
Tab. 1. BVAS – Birmingham skóre aktivity vaskulitidy (verze 3) 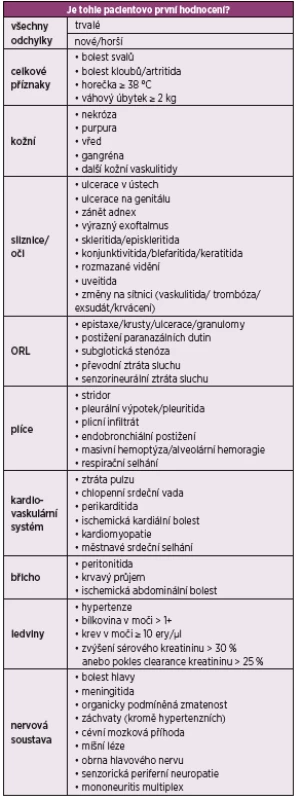
Jednotlivé příznaky jsou obodovány dle závažnosti 1, 2, 3, 6 nebo 9 body, maximální skóre v případě chronické choroby je 33, u nově diagnostikované je to 63. LÉČBA
Indukční terapie
Dle doporučení EULAR z roku 2016 jsou v případě nově diagnostikované GPA s orgánovým postižením nebo s rizikem ohrožení života první volbou glukokortikoidy (metylprednisolon 1–3krát 1000 mg i.v., následováno p.o. 1 mg/kg/d prednisonu) v kombinaci s cyklofosfamidem nebo rituximabem (20) (obr. 5). Jedná se o pacienty s aktivní glomerulonefritidou, plicní hemoragií, vaskulitidou CNS, progresivní periferní či kraniální neuropatií, orbitálním pseudotumorem, krvácením do GIT při vaskulitidě, perikarditidě či myokarditidě. Podání razantní úvodní imunosupresivní terapie je nezbytně nutné, mortalita neléčené systémové granulomatózy s polyangiitidou je vysoká, dosahuje až 90 % do 2 let. Nejčastější příčinou úmrtí bývá respirační a renální selhání.
Obr. 5. Doporučení pro léčbu granulomatózy s polyangiitidou
* tři hlavní indikace pro zahájení plazmaferéz:
1. rychle progredující glomerulonefritida vedoucí k akutnímu renálnímu selhání (s nutností dialýzy, vzestup kreatininu > 350 μmol/l)
2. pozitivita protilátek proti bazální membráně glomerulů
3. plicní hemoragie s respirační insuficiencí nebo v případě, kdy nereaguje na podávané vysoké dávky glukokortikoidů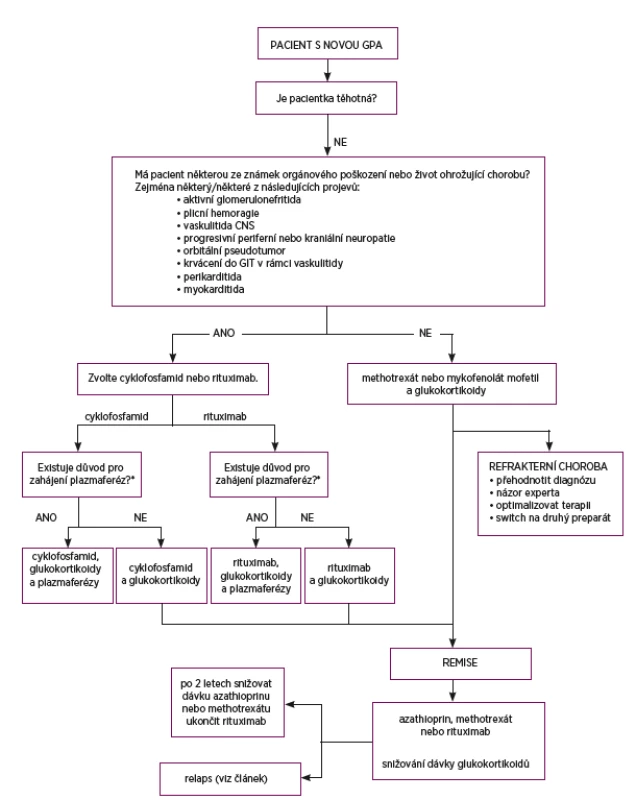
Studie RAVE (2010) a RITUXVAS (2015) prokázaly stejnou účinnost v dosažení remise u rituximabu v porovnání s cyklofosfamidem a v případě relapsu choroby byl rituximab v dosažení remise účinnější než cyklofosfamid (21). V současné době se u cyklofosfamidu preferuje intravenózní podávání namísto perorálního užívání. Hlavním důvodem je méně nežádoucích účinků, což dokládá studie CYCLOPS. Standardní dávkovací režim intravenózních pulzů cyklofosfamidů je doporučen 10 mg/kg 1krát měsíčně, klinické studie pracovaly i s dávkováním 15 mg/kg 3krát po 14 dnech, poté 1krát za 3 týdny po dobu 6 měsíců s dosažením požadovaného efektu v dosažení remise za 9 měsíců s menším rizikem nežádoucích účinků při nižší celkové kumulativní dávce oproti perorálnímu cyklofosfamidu (22). Doprovodnou terapií k pulzům cyklofosfamidu je jednak antiemetikum (ondansetron) a i.v. podávaná mesna (i.v. 2-mercaptoethansulfonát sodný) jako prevence hemoragické cystitidy a uroteliálních malignit. Proti infekci Pneumocystitis jiroveci je u pacientů v léčbě cyklofosfamidem doporučováno dlouhodobé profylaktické podávání trimethoprim/sulfamethoxazolu v denní dávce 480 mg. Alternativně lze podávat pentamidin nebo dapson. Cyklofosfamid negativně ovlivňuje fertilitu, u mladších pacientů v reprodukčním věku je proto lepší volbou rituximab. V případě relapsu choroby s orgánovým postižením nebo život ohrožující formě nemoci je doporučena obdobná terapie jako v případě nově diagnostikované GPA, dle doporučení EULAR je v případě rituximabu síla volby 94 % a u cyklofosfamidu je to 88 %.
V lednu 2019 byly publikovány výsledky randomizované, non-inferioritní studie Rachel Jones et al. z Evropské skupiny pro vaskulitidy (EUVAS), jenž prokázala srovnatelný efekt indukční terapie mykofenolát mofetilem (MMF) ve srovnání s podáváním cyklofosfamidu (CFA). Remise po 6 měsících byla dosažena u 67 % pacientů užívajících MMF a u 61 % ve skupině léčených CFA. Počet následných relapsů byl však vyšší u skupiny léčených mykofenolát mofetilem (33 % u MMF oproti 19 % u CFA). Výskyt infekčních komplikací byl srovnatelný v obou skupinách. Výhodou terapie mykofenolát mofetilem oproti cyklofosfamidu je zejména menší riziko malignit a infertility (23).
V případě refrakterní choroby nereagující na terapii cyklofosfamidem či rituximabem je doporučován switch z cyklofosfamidu na rituximab a obráceně. Jedná se o stavy progredující nebo nereagující na léčbu podávanou alespoň 4 týdny, dále případy, kdy 6týdenní léčba nevede ke snížení aktivity choroby alespoň o 50 % dle BVAS skóre. Změna léčby je doporučována i v případě přetrvávající aktivity onemocnění po více než 12 týdnech. Definována je přítomností minimálně jednoho hlavního a tří mírnějších projevů.
U pacientů s rychle progredujícím renálním selháním, těžkou renální insuficiencí (hodnotou kreatininu nad 350 µmol/l) nebo vyžadujících dialýzu jsou indikovány plazmaferézy. Dále jsou doporučeny u dyspnoických či hypoxických pacientů s plicní hemoragií, kteří nereagují na léčbu intravenózními glukokortikoidy.
U pacientů s lokalizovanou či mírnou formou onemocnění bez známek orgánového postižení, např. s rhinosinusitidou, artritidou a/nebo ojedinělými plicními nodulacemi bez kavitací či hemoptýzy, je doporučena léčba glukokortikoidy v kombinaci s methotrexátem nebo mykofenolát mofetilem. V případě kontraindikace nebo neúčinnosti léčby methotrexátem lze podat rituximab, popř. cyklofosfamid. Doporučovaná dávka methotrexátu se pohybuje mezi 20 a 25 mg týdně v perorální nebo subkutánní formě. V porovnání s perorálním cyklofosfamidem byla prokázána stejná účinnost v prvních 6 měsících, poté účinnost methotrexátu ve srovnání s pacienty léčenými cyklofosfamidem klesala (24).
U refrakterní formy onemocnění lze podat intravenózní imunoglobuliny (IVIG) v dávce 0,5 g/kg/den jednou měsíčně po dobu půl roku. Efekt IVIG je sice zpočátku rychlý, při dlouhodobém sledování (3 měsíce a více) se však aktivita a frekvence relapsů nesnižuje, navíc ekonomická náročnost léčby je vysoká. Dalšími alternativními imunosupresivy v léčbě refrakterních forem GPA jsou alemtuzumab (anti-CD52), 15-deoxyspergualin či antithymocytární globulin (ATG) (25).
Udržovací terapie
Po ukončení indukční léčby a navození remise se pokračuje v tzv. udržovací terapii. Dle doporučení EULAR je první volbou azathioprin (2 mg/kg/den) se sílou doporučení 94 %, dále rituximab (síla doporučení 59 %), methotrexát (20–25 mg týdně, síla doporučení 53 %) nebo mykofenolát mofetil (síla doporučení 53 %) v kombinaci s glukokortikoidy v nízké dávce. Ve druhé linii při intoleranci předchozí medikace lze použít leflunomid v dávce 20–30 mg denně. Studie MAINRITSAN publikovaná v roce 2014 prokázala vyšší účinnost rituximabu v udržující léčbě oproti azathioprinu. Po ukončení indukční terapie pulzy cyklofosfamidu dosáhl požadovaného cíle nízké aktivity choroby dle BVAS skóre s menším počtem relapsů (tři relapsy v případě rituximabu, 17 relapsů ve skupině azathioprinu) (26). Srovnání azathioprinu s mykofenolát mofetilem ve studii IMPROVE z roku 2010 přineslo doporučení s preferencí azathioprinu, který vykazoval nižší procento relapsů (30 pacientů ve skupině azathioprinu versus 42 pacientů s mykofenolát mofetilem, p > 0,01) (27). Doporučovaná doba podávání udržující terapie je minimálně 24 měsíců, předčasné ukončení léčby bylo spojeno s vyšším rizikem relapsů (28).
Novinku v léčbě ANCA asociovaných vaskulitid představuje avacopan jako náhrada glukokortikoidů s cílem redukce nežádoucích účinků, které jsou spojeny s jejich dlouhodobým užíváním. V roce 2017 byly publikovány výsledky randomizované, dvojitě zaslepené multicentrické studie s avacopanem (inhibitor C5a receptoru), které prokázaly jeho srovnatelnou účinnost s glukokortikoidy u nově diagnostikovaných nebo relabujících případů ANCA asociovaných vaskulitid v kombinaci s cyklofosfamidem nebo rituximabem (29). Již je registrován americkým Úřadem pro kontrolu léků a potravin FDA (Food and Drug Administration), očekává se i registrace Evropskou lékovou agenturou EMA (European Medicine Agency).
Klinická hodnocení s blokátory TNF-α (tumor necrosis factor alpha) nepřinesla příznivé výsledky, použití etanerceptu v léčbě GPA bylo spojené se zvýšeným výskytem malignit (30). V lednu 2019 byly publikovány výsledky další randomizované kontrolované studie s belimumabem v udržovací léčbě ANCA asociovaných vaskulitid, která neprokázala jeho účinnost oproti placebu (31). Otevřená je ještě otázka použití abataceptu v udržující léčbě u pacientů s relabující nezávažnou formou GPA, u kterého aktuálně probíhá multicentrická, randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie.
Role stanovení ANCA protilátek v případě posuzování efektu terapie byla hodnocena spíše jako méně specifická, výsledky klinických studií se v tomto případě rozcházely. V některých byla prokázána korelace výše protilátkové a klinické aktivity s incidencí relapsů, jiné studie tyto závěry nepotvrdily. Základem zůstává klinické zhodnocení s využitím skórovacího systému aktivity BVAS (32–34).
V posledních letech se přikládá stále větší důležitost aktivní participaci pacienta, s tím je spojená otevřená a intenzivní komunikace s pacientem a jeho rodinou, důsledná edukace i podpora pacientských spolků (35).
Terapie v těhotenství
Případy GPA a těhotenství jsou extrémně vzácné. Samostatná léčba glukokortikoidy je nedostatečná, je proto nutná kombinovaná terapie jako u netěhotných pacientů. Methotrexát i mykofenolát mofetil patří mezi teratogenní látky, zvyšují riziko abortu i kongenitálních malformací, jsou proto v těhotenství kontraindikovány. Cyklofosfamid může v I. trimestru způsobovat defekty patra, skeletu, končetinové malformace i poškození zraku. Během II. a III. trimestru jej v indikovaných případech lze podávat, je však nutné počítat s rizikem pancytopenie plodu a růstovou retardací. Použití rituximabu se pro nedostatek dat v těhotenství nedoporučuje. Z bezpečnějších léků lze v těhotenství volit azathioprin nebo cyklosporin A, většinou však pouze v případech méně až středně aktivní choroby (36).
ZÁVĚR
Granulomatóza s polyangiitidou je nekrotizující vaskulitida patřící do skupiny ANCA asociovaných vaskulitid. Klinické projevy mohou být variabilní od mírných či limitovaných forem, přes plně vyjádřený stav s postižením především horních, dolních dýchacích cest, ledvin, periferní nervů, kůže, očí, uší, mozku. Rychle progredující choroba s fulminantním průběhem může vést k ohrožení orgánových funkcí, respiračnímu a renálnímu selhání. Neléčená systémová forma onemocnění má vysokou mortalitu – až 90 % do 2 let. Standardem v diagnostice GPA je kromě stanovení ANCA protilátek, zobrazovacích a funkčních vyšetření i provedení renální biopsie. K posouzení aktivity choroby v rámci diagnostiky i monitorování průběhu onemocnění se doporučuje využití skórovacího systému BVAS. Základem léčby jsou vysokodávkové glukokortikoidy v kombinaci s cyklofosfamidem nebo rituximabem, srovnatelný efekt byl nově prokázán i u mykofenolát mofetilu. V případě mírné formy choroby lze použít methotrexát. Po navození remise se pokračuje v udržovací terapii azathioprinem, rituximabem, mykofenolát mofetilem nebo výjimečně leflunomidem. Nově existuje možnost náhrady glukokortikoidů inhibitorem C5a receptoru – avacopanem s cílem redukce nežádoucích účinků, které se pojí s jejich dlouhodobým užíváním. Důležitá je mezioborová spolupráce jak při diagnostice, léčbě, tak i v rámci dlouhodobého sledování pacientů s granulomatózou s polyangiitidou. V poslední době je kladen důraz na komunikaci s pacientem a jeho aktivní participaci, jsou podporovány pacientské spolky.
Práce vznikla za podpory MZ ČR – RVO (FNOL, 00098892) a grantu IGA_LF_2019_006.
Konflikt zájmů: žádný.
adresa pro korespondenci:
MUDr. Eva Lokočová
III. interní klinika NRE FN
I. P. Pavlova 6, 779 00 Olomouc
e-mail: eva.lokocova@fnol.cz
Zdroje
1. Morović-Vergles J, Culo MI, et al. Clinical manifestation of antineutrophil cytoplazmic antibodies associated vasculitis. Lijec Vjesn 2014; 136 : 228–231.
2. Seo P, Stone JH. The antineutrophil cytoplasmic antibody-associated vasculitides. Am J Med 2004; 117 : 39.
3. Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013; 65 : 1.
4. Leavitt RY, Fauci AS, Bloch DA, et al. The American College of Rheumatology 1990 criteria for the classification of Wegener’s granulomatosis. Arthritis Rheum 1990; 33 : 1101.
5. Watts R, Lane S, Hanslik T, et al. Development and validation of a consensus methodology for the classification of the ANCA-associated vasculitides and polyarteritis nodosa for epidemiological studies. Ann Rheum Dis 2007; 66 : 222.
6. Stone JH, Taylor M, Stebbing, et al. Test characteristics of of immunofluorescence and ELISA tests in 865 consecutive patients with possible ANCA-associated conditions. Arthritis Care Res 2000; 13 : 424.
7. Hoffman GS, Specks U. Antineutrophil cytoplasmic antibodies. Arthritis Rheum 1998; 41 : 1521.
8. Mahr A, Batteux F, Tubiana S, et al. Brief report: prevalence of antineutrophil cytoplasmic antibodies in inefective andocarditis. Arthritis Rheumatol 2014; 66 : 1672.
9. Draibe JB, Fulladosa W, Cruzado M, et al. Current and novel biomarkers in anti-neutrophil cytoplasm-associated vasculitis. Clin Kidney J 2016; 9(4): 547–551.
10. Cordier JF, Valeyre D, Guillevin L, et al. Pulmonary Wegener’s granulomatosis. A clinical and imaging study of 77 cases. Chest 1990; 97 : 906.
11. Ananthakrishnan L, Sharma N, Kanne JP. Wegener’s granulomatosis in the chest: high-resolution CT findings. AJR Am J Roentgenol 2009; 192 : 676.
12. Silvera S, Vignaux O, Legmann P. Sinonasal and cerebral imaging findings in Wegener’s granulomatosis. Presse Med 2007; 36 : 913.
13. Thompson G, Klecka M, Roden AC, et al. Biopsy-proven pulmonary capillaritis: A retrospective study of aetiologies including an in-depth look at isolated pulmonary capillaritis. Respirology 2016; 21 : 734.
14. Borner U, Landis BN, Banz Y, et al. Diagnostic value of biopsies in identifying cytoplasmic antineutrophil cytoplasmic antibody-negative localized Wegener’s granulomatosis presenting primarily with sinonasal disease. Am J Rhinol Allergy 2012; 26 : 475.
15. Yates M, Watts RA, Bajema IM, et al. EULAR/ERA-EDTCA recommendations for the management of ANCA-associated vasculitis. Ann Rheum Dis 2016; 75(9): 1583–1594.
16. Hauer HA, Bajema IM, Van Houwelingen HC, et al. Determinants of outcome in ANCA-associated glomerulonephritis: a prospective clinico-histopathological analysis of 96 patients. Kidney Int 2002; 62 : 1732.
17. Lind van Wijngaarden RA, Hauer HA, Wolterbeek R, et al. Clinical and histologic determinants of renal outcome in ANCA-associated vasculitis: A prospective analysis of 100 patients with severe renal involvement. J Am Soc Nephrol 2006; 17 : 2264.
18. Berden AE, Ferrario F, Hagen EC, et al. Histopathologic classification of ANCA-associated glomerulonephritis. J Am Soc Nephrol 2010; 21 : 1628.
19. Mukhtyar C, Lee R, Brown D, Carruthers D, et al. Modification and validation of the Birmingham Vasculitis Activity Score (version 3). Ann Rheum Dis 2009; 68(12): 1827–1832.
20. Stone JH, Merkel PA, Spiera R, et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med 2010; 363 : 221.
21. Jones RB, Furuta S, Tervaert JW, et al. Rituximab versus cyclophosphamide for induction of remission in antineutrophil cytoplasmic antibody-associated vasculitis: a randomized trial. Ann Rheum Dis 2015; 74 : 1178.
22. Harper L, Morgan MD, Walsh M, et al. Pulse versus daily oral cycloclophosphamide for induction of remission in ANCA-associated vasculitis: long-term follow up. Ann Rheum Dis 2012; 71 : 955.
23. Jones BR, Hiemstra T, Balladrin J, et al. Mycophenolate mofetil versus cyclophosphamide for remission induction in ANCA-assciated vasculitis: a randomised, non-inferiority trial. Ann Rheum Dis 2019; 78(3): 399–405.
24. Faurschou M, Westman K, Rasmussen N, et al. Brief report: long-term outcome of a randomized clinical trial comparing methotrexate to cyclophosphamide for remission induction in early systemic antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheum 2012; 64 : 3472–3477.
25. Zadražil J, Horák P, Karásek D, a kol. Moderní farmakoterapie autoimunitních chorob, 2. vydání. Praha: Maxdorf 2019; 31.
26. Guillevin L, Pagnoux C, Karras A, et al. Rituximab versus azathioprine for mainetance in ANCA-associated vasculitis. N Engl J Med 2014; 371 : 1771–1780.
27. Hiemstra TF, Walsh M, Mahr A, et al. Mycophenolate mofetil vs azathioprine for remission maintenance in antineutrophil cytoplasmic antibody-associated vasculitis: a randomized controlled trial. JAMA 2010; 304 : 2381–2388.
28. Springer J, Nutter B, Langford CA, et al. Granulomatosis with polyangiitis: impact of maintenance therapy duration. Medicine (Baltimore) 2014; 93 : 82–90.
29. Jayne D, Bruchfeld A, et al. Randomized trial of C5a receptor inhibitor avacopan in ANCA-associated vasculitis. J Am Soc Nephrol 2017; 28(9): 2756–2767.
30. WGET. Etanercept plus standard therapy for Wegener’s granulomatosis. NEJM 2005; 352 : 351–361.
31. Jayne D, Blockmans, Raashid L, et al. Efficacy and safety of belimumab and azathioprine for maintenance of remission in antineutrophil cytoplasmic antibody –associated vasculitis: A randomized controlled study. Arthritis Rheumatol 2019; 71(6): 952–963.
32. Savige J, Gillis D, Benson E, et al. International consensus statement on testing and reporting of antineutrophil cytoplasmic antibodies (ANCA). Am J Clin Pathol 1999; 111 : 507–513.
33. Savige J, Dimech W, Fritzler M, et al. Addendum to the International Consensus Statement on testing and reporting of Antineutrophil Cytoplasmic antibodies. Quality control guidelines, comments, and recommendations for testing in other autoimmune diseases. Am J Clin Pathol 2003; 120 : 312–318.
34. Finkielman JD, Lee AS, Hummel AM, et al. ANCA are detectable in nearly all patients with active severe Wegener’s granulomatosis. Am J Med 2007; 120 : 643.e9–14.
35. Herlyn K, Gross WL, Reinhold-Keller E. Longitudinal effects of structured patient education programs for vasculitis patients. Z Rheumatol 2008; 67 : 206–211.
36. Langford CA, Kerr GS. Pregnancy in vasculitis. Curr Opin Rheumatol 2002; 14 : 36.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2019 Číslo 3- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Vnímanie bolesti u mužov a žien s reumatoidnou artritídou
- Chronická rekurentní multifokální osteomyelitida (CRMO) v dětském věku – přehled a vlastní výsledky
- Novinky v diagnostice a léčbě granulomatózy s polyangiitidou
- Prenatální diagnostika kardiálního postižení u lupus neonatorum
- Steroidní myopatie
- Kongres EULAR 2019
- Odborné události
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Chronická rekurentní multifokální osteomyelitida (CRMO) v dětském věku – přehled a vlastní výsledky
- Novinky v diagnostice a léčbě granulomatózy s polyangiitidou
- Steroidní myopatie
- Prenatální diagnostika kardiálního postižení u lupus neonatorum
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



