-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Stanovení obsahových látek propolisů různého geografického původu
Determination of the constituents of propolis of different geographical origin
The structural diversity of propolis constituents, due to a larger number of plant sources, is the cause of diverse composition and the hitherto unsolved standardization. The principal share in the biological effects is ascribed to flavonoids and aromatic acids and their derivatives. The results presented in this paper illustrate the diversity of the compositions of ten propolis samples obtained from different regions of the Czech Republic and three samples from abroad. Attention was paid to the determination of polyphenols, content of flavones and flavonols and the assay of antioxidative activity. The results confirmed the variability of the parameters under study as well as the presence of chrysin, galangin, p-coumaric, ferulic, cinnamic and benzoic acids in dependence on the area of collection. It will be difficult to elaborate a method of standardization suitable for possible administration of propolis preparations. In the future, propolis could become a raw material for the isolation of individual groups of biologically active substances.
Key words:
propolis – flavonoids – phenolic acids – antioxidative activity – liquid chromatography
Autori: J. Muselík 1; R. Masteiková 1; V. Suchý 2; Z. Chalupová 1; V. Ostrá 1
Pôsobisko autorov: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků 1; Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav přírodních léčiv 2
Vyšlo v časopise: Čes. slov. Farm., 2009; 58, 179-183
Kategória: Původní práce
Súhrn
Strukturní rozmanitost obsahových látek propolisu, daná více rostlinnými zdroji, je příčinou proměnlivého složení a dosud nevyřešené standardizace. Hlavní podíl na biologických účincích je připisován flavonoidům a aromatickým kyselinám a jejich derivátům. Prezentované výsledky ilustrují proměnlivost ve složení deseti vzorků propolisu, získaných z různých oblastí ČR a dalších tří vzorků zahraničních. Pozornost byla věnována stanovení polyfenolů, obsahu flavonů a flavonolů a určení antioxidační aktivity. Výsledky potvrzují variabilitu sledovaných parametrů, i zastoupení chrysinu, galanginu, kyseliny p-kumarové, ferulové, skořicové a benzoové v závislosti na oblasti sběru. Bude obtížné vypracovat metodu standardizace, vhodnou pro možné aplikace propolisových přípravků. V budoucnu by se propolis mohl stát surovinou pro izolaci jednotlivých skupin biologicky aktivních látek.
Klíčová slova:
propolis – flavonoidy – fenolické kyseliny – antioxidační aktivita – kapalinová chromatografieÚvod
Propolis je polykomponentní pryskyřičnatá substance, kterou včely sbírají z rostlinných zdrojů. Jeho složení podléhá změnám a závisí na vegetaci v okolí stanoviště včel, ročním období sběru i na plemenu včel. Obsahuje okolo 50–60 % balzámů, 30 % vosků, pyl a silice. Dosud bylo popsaných více než sto obsahových látek, které lze zařadit do následujících skupin: flavonoidy, aromatické kyseliny, alkoholy, aldehydy a estery, dále kumariny, terpeny, steroly, vosky, mastné kyseliny, aminokyseliny, vitamíny, enzymy a stopové prvky 1). Tyto látky jsou zodpovědné za řadu biologických a farmakologických aktivit, jako např. antibakteriální 2), antiflogistické 3), antifungální 4), antioxidační 5), imunomodulační 6), hepatoprotektivní 7), antivirové 8) a další. Díky těmto účinkům nachází propolis uplatnění ve zdravotnictví, kosmetice a potravinářském průmyslu 9).
Nestejnorodé složení a nevyřešená problematika standardizace jsou příčinou, proč není propolis zařazen do seznamu povolených léčiv. Navíc některé obsahové látky propolisu mohou vyvolat alergické reakce a kontaktní dermatitidy. Schopnost vyvolat kontaktní alergie byla testována u základních skupin obsahových látek propolisu (flavonoidy, hydroxyderiváty kyseliny skořicové, estery kyseliny kávové s C5 isomerními alkoholy – 3-metyl--2-butenyl ester a 3-metyl-3-butenyl ester). Byla prokázána možnost vyvolání alergie u cca 0,5 % testovaných „zdravých“ lidí. Naopak alergické reakce na propolis u pacientů léčících se na jiné alergie byly zaznamenány u přibližně 15 % testovaných dobrovolníků 10–12). Přesto je i u nás propolis součástí několika volně prodejných přípravků. S tím souvisí problematika kvality, bezpečnosti, účinnosti a reprodukovatelnosti. Nelze předpokládat, že bude možné provést standardizaci propolisu na jednu jedinou obsahovou látku a že tato standardizace bude vyhovovat ve všech odvětvích, kde se propolis využívá. K tomuto účelu musí být dostupné vhodné analytické metody, které umožní kvantifikaci vybraných obsahových látek. Banková a kol. navrhují řešení založené na formulaci různých druhů propolisu dle jejich rostlinného zdroje a tomu odpovídajícímu chemickému profilu 13).
Cílem práce je popsat postupy vhodné k analytickému hodnocení jednotlivých vzorků propolisu na základě stanovení obsahu celkových polyfenolických látek, flavonů, flavonolů a jejich antioxidační aktivity a chromatografické stanovení vybraných obsahových látek. U analyzovaných vzorků propolisů různého geografického původu je popsána variabilita jejich chemického složení.
POKUSNÁ ČÁST
Materiál
Analyzované vzorky propolisu pocházely z různých lokalit České republiky. Dále byl analyzován propolis z Ruska, Brazílie a Kuby (tab. 1).
Tab. 1. Charakteristiky analyzovaných vzorků propolisu 
Při stanovení vybraných obsahových látek pomocí kapalinové chromatografie byly použity standardy galangin (Sigma), chrysin (Aldrich), kyselina benzoová (Fluka), kyselina ferulová (Aldrich), kyselina p-kumarová (Sigma) a kyselina skořicová (Fluka).
Ke stanovení obsahu polyfenolických sloučenin a antioxidační aktivity byly použity chemikálie: DPPH a kvercetin (Sigma), kyselina galová a Folin-Ciocalteuovo činidlo (Fluka).
Všechny ostatní použité chemikálie byly komerčně dostupné a byly p.a. čistoty.
Metodika
Příprava propolisových extraktů
Vzorky propolisu byly zmraženy kapalným dusíkem a důkladně rozetřeny ve třence. Připravené homogenní směsi byly použity na přípravu extraktů. Extrakty byly připraveny tak, že se navážilo 2,0 g propolisu a doplnilo se 70% ethanolem na 20,0 g. Takto byly připraveny tři vzorky extraktů od každého druhu propolisu. Po 24 hodinách vyluhování byly zakalené a shluky obsahující extrakty zfiltrovány. Získaly se čiré, hnědožluté extrakty, které byly použity k analýzám.
Chromatografická analýza
Pro stanovení obsahových látek byl použit kapalinový chromatograf HP 1100 (Agilent Technologies) s kvaternární pumpou, automatickým dávkovačem a detektorem s diodovým polem. Chromatografické separace byly provedeny na koloně Zorbax Eclipse XDB-C18 (2,1 × 50 mm; 1,8 μm). Složení rozpouštědel bylo 6 % methanolu (A), 4 % acetonitrilu (B) a 90 % 40 mM kyseliny mravenčí (C) použitých s následujícím gradientem: 12,5 % (A), 15 % (B), 72,5 % (C) do 6. minuty; 0 % (A), 28 % (B), 72 % (C) do 7. minuty; 0 % (A), 32 % (B), 68 % (C) do 20. minuty; 0 % (A), 60 % (B), 40 % (C) do 30. minuty; 0 % (A), 100 % (B), 0 % (C) do 31. minuty. Celková délka analýzy byla 35 minut. Průtok mobilní fáze byl 0,3 ml/min; teplota kolony byla 40 °C. Spektra byla snímána v rozmezí 190–400 nm. Byly dávkovány 2 μl propolisových extraktů naředěných 70% ethanolem v poměru 1 : 19 (v/v).
Stanovení celkových polyfenolických látek
Celkový obsah fenolických látek byl stanoven spektrofotometricky 14). 700 μl vhodně naředěného propolisového extraktu bylo oxidováno Folin-Ciocalteuovým činidlem (400 μl) a potom byla reakční směs doplněna do 10,0 ml roztokem uhličitanu sodného (75 g/l). Po 2 hodinách byla suspenze odstředěna (10 min při 5000 ot./min) a byla změřena výsledná absorbance při 760 nm. Kvantifikace byla provedena na základě kalibrační křivky pro kyselinu galovou. Výsledky byly vyjádřeny jako ekvivalent kyseliny galové (GAE) v g na 100 ml vzorku propolisového extraktu.
Stanovení celkového obsahu flavonů a flavonolů
Celkový obsah flavonů a flavonolů byl stanoven spektrofotometricky 15). 1,0 ml vhodně naředěného propolisového extraktu bylo smícháno s 10% roztokem chloridu hlinitého (200 μl) a doplněno do 10,0 ml methanolem. Po 30 minutách byla změřena výsledná absorbance při 425 nm. Kvantifikace byla provedena na základě kalibrační křivky pro kvercetin. Výsledky byly vyjádřeny jako ekvivalent kvercetinu (QE) v mg na 100 ml vzorku propolisového extraktu.
Antioxidační aktivita
Schopnost zhášet radikály byla sledována spektrofotometricky 14) pomocí stabilního radikálu 2,2-difenyl-1-pikrylhydrazylu (DPPH). Vhodně naředěný propolisový extrakt (200 μl) byl doplněn do 2,0 ml 0,1 mM DPPH v methanolu a po 5 minutách byla změřena absorbance při 517 nm. Redukce DPPH byla vypočítána relativně k hodnotě absorbance v kontrolním měření a zjištěná aktivita byla porovnána s kalibrační křivkou pro kvercetin. Výsledky byly vyjádřeny jako ekvivalent antioxidační aktivity kvercetinu v μmol na 100 ml vzorku propolisového extraktu.
VÝSLEDKY A DISKUSE
Propolisové extrakty z různých geografických lokalit byly hodnoceny za použití několika analytických postupů. Metody stanovení celkových polyfenolických látek, flavonů, flavonolů a antioxidační aktivity jsou založeny na spektrofotometrickém měření vzniklého barevného produktu. Výsledky těchto screeningových metod byly doplněny o stanovení vybraných obsahových látek pomocí kapalinové chromatografie.
Byla proměřena antioxidační aktivita a celkový obsah polyfenolických látek, flavonů a flavonolů několika propolisů z České republiky a dále vzorky z Ruska, Brazílie a Kuby (tab. 1). Výsledky měření jsou uvedeny v tabulce 2. Zjištěná antioxidační aktivita byla v rozmezí hodnot 33–3348 μmol ekvivalentu kvercetinu/100 ml propolisového extraktu. Celkový obsah fenolických látek byl v rozmezí hodnot 0,093–2,487 gramů ekvivalentu kyseliny galové/100 ml propolisového extraktu a celkových obsah flavonů a flavonolů byl v rozmezí hodnot 4,9–483 mg ekvivalentu kvercetinu/100 ml propolisového extraktu. U studovaných propolisových extraktů byly nalezeny několikanásobně vyšší obsahy celkových flavonů a flavonolů u vzorků ze Zlínského (ZL), Pardubického (PA), Královéhradeckého (HK) kraje a ruského propolisu. Antioxidační aktivita byla výrazně vyšší u vzorků ZL, PA a HK. Tato zjištění lze pravděpodobně vysvětlit různými rostlinnými zdroji v daných lokalitách. Vyjma kubánského vzorku, který vykazoval při všech analýzách velmi nízké obsahy sledovaných látek, byly zjištěné rozdíly v obsahu celkových polyfenolických látek mezi jednotlivými vzorky menší než u předchozích dvou testů (antioxidační aktivita a stanovení celkového obsahu flavonů a flavonolů). Vzorek s nejvyšším obsahem polyfenolických látek (HK) obsahoval přibližně dvojnásobné množství těchto látek než vzorek PM6.
Tab. 2. Antioxidační aktivita a celkové obsahy polyfenolických látek, flavonů a flavonolů ve studovaných vzorcích propolisu 
Výsledky jsou uvedeny jako průměr ze tří měření ± směrodatná odchylka. U všech studovaných propolisových extraktů byla provedena jednoduchá regresní analýza mezi antioxidační aktivitou a celkovým obsahem polyfenolických látek a celkovým obsahem flavonů a flavonolů. Zjištěné korelační koeficienty ukazují na signifikantní lineární závislost mezi množstvím obsažených látek a schopností redukovat DPPH (r > 0,73; p < 0,01).
Pomocí kapalinové chromatografie byly v propolisových extraktech kvantifikovány kyselina p-kumarová, ferulová, benzoová, skořicová a flavonoidy chrysin a galangin (tab. 3). Ze získaných výsledků vyplývá, že obsahy sledovaných látek se mění velmi významně v závislosti na lokalitě sběru. V kubánském propolisu byly všechny stanovované látky pod limitem stanovení, což souhlasí s výsledky spektrofotometrických metod. Rostlinné zdroje pro tento propolis byly tedy značně odlišné než u ostatních analyzovaných vzorků a obsahovaly jen velmi málo polyfenolických látek a neobsahovaly pro propolis typické fenolické kyseliny (obr. 1). Brazilský propolis neobsahuje chrysin a galangin, což lze opět vysvětlit odlišnými rostlinnými zdroji v dané oblasti. Výsledky analýz vzorků z České republiky potvrzují výrazný vliv lokality sběru a rostlinných zdrojů na množství obsahových látek. Ruský propolis byl obsahem stanovovaných látek podobný výsledkům získaných při analýzách propolisů z České republiky.
Tab. 3. Kvantitativní zastoupení vybraných obsahových látek ve studovaných vzorcích propolisu 
Výsledky jsou uvedeny v μg/ml jako průměr ze tří měření ± směrodatná odchylka. Obr. 1. Chromatogramy vzorků propolisu z různých lokalit kyselina p-kumarová (1), kyselina ferulová (2), kyselina benzoová (3), kyselina skořicová (4), chrysin (5), galangin (6) 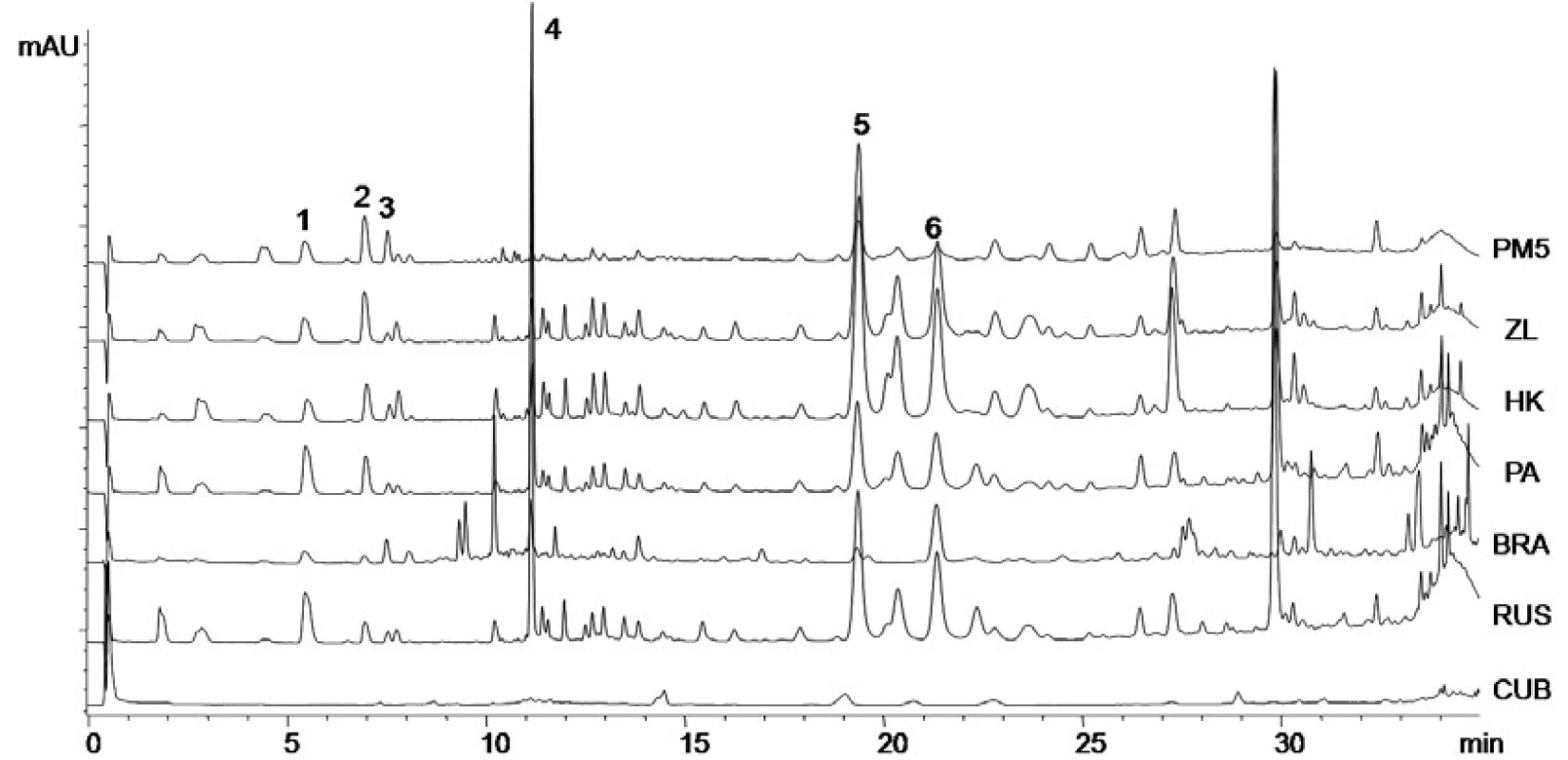
Dosažené výsledky potvrzují problematičnost „normalizace“ propolisu jako suroviny pro medicínské využití. Nicméně použité analytické postupy jsou vhodné pro analýzy propolisu a mohou sloužit jako kontrolní metody. Pro získání alespoň částečně „normalizované“ suroviny by bylo nutné vytvořit kvantitativní kritéria například na obsahy celkových polyfenolických látek, celkových flavonů a flavonolů a vybraných obsahových látek stanovených pomocí HPLC. Existuje celá řada látek s výrazným zastoupením a vysokou biologickou aktivitou, potenciálně vhodných pro standardizaci, které se ale vyskytují jen v některých typech propolisu z určitých oblastí 13). Z tohoto důvodu není možná univerzální standardizace propolisu. Je zapotřebí ji vztáhnout ke konkrétnímu rostlinnému druhu, případně lokalitě a odpovídajícímu chemickému profilu.
Tato práce vznikla za podpory projektu E 3694, PROPOCREAM, identifikační kód OE 235.
Adresa pro korespondenci:
Mgr. Jan Muselík, Ph.D.
Ústav technologie léků VFU
Palackého 1–3, 612 42 Brno
e-mail: muselikj@vfu.cz
Došlo 20. července 2009
Přijato 10. srpna 2009
Zdroje
1. Banskota, A. H., Tezuka, Y., Kadota, S.: Phytother. Res., 2001; 15, 561–571.
2. Lu, L. C., Chen, Y. W., Chou, C. C.: Int. J. Food Microbiol., 2005; 102, 213–220.
3. Borrelli, F. et al.: Fitoterapia, 2002; 73 Suppl. 1, 53–63.
4. Sawaya, A. C. H. F. et al.: Lett. Appl. Microbiol., 2002; 35, 203–207.
5. Moreira, L. et al.: Food Chem. Toxicol., 2008; 46, 3482–3485.
6. Sforcin, J. M.: J. Ethnopharmacol., 2007; 113, 1–14.
7. Banskota, A. H. et al.: Phytomedicine, 2001; 8, 16–23.
8. Gekker, G. et al.: J. Ethnopharmacol., 2005; 102, 158–163.
9. Lucrecia, L. et al.: Food Sci. Technol., 2009; 42 1422–1427.
10. Hegyi, E., Suchý, V., Nagy, M.: Hautarzt, 1990; 41, 675–679.
11. Hausen, B. M. et al.: Contact Dermatitis, 1987; 17, 163–170.
12. Hausen, B. M. et al.: Contact Dermatitis, 1987; 17, 171–177.
13. Bankova, V.: J. Ethnopharmacol., 2005; 100, 114–117.
14. Šmejkal, K. et al.: Molecules, 2007; 12, 1210–1219.
15. Trusheva, B., Trunkova, D., Bankova, V.: Chem. Cent. J., 2007; 1, 1–4.
Štítky
Farmácia Farmakológia
Článok vyšiel v časopiseČeská a slovenská farmacie

2009 Číslo 4-
Všetky články tohto čísla
- Standardní receptura pro přípravu léčivých přípravků v lékárnách III Některé možnosti využití isopropylalkoholu
- Kardioprotektivní efekt 2’,3,4’-trihydroxychalkonu v preklinickém experimentu
- Určení tloušťky obalu tvrdých hypromelosových tobolek pomocí blízké infračervené spektroskopie
- Úloha flavonoidu osajinu na modelu ischemie-reperfuze ledviny
- Vliv kombinovaného odnětí hormonů a houbového elicitoru na produkci kumarinů v suspenzní kultuře Angelica archangelica L.
- Studium vlastností tablet z přímo lisovatelného isomaltu
- XLIX. sympozium z historie farmacie a veterinární medicíny
- Stanovení obsahových látek propolisů různého geografického původu
- Z činnosti farmaceutických společností
- Na památku prof. RNDr. PhMr. Karla Paláta, CSc.
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Standardní receptura pro přípravu léčivých přípravků v lékárnách III Některé možnosti využití isopropylalkoholu
- Stanovení obsahových látek propolisů různého geografického původu
- Studium vlastností tablet z přímo lisovatelného isomaltu
- Určení tloušťky obalu tvrdých hypromelosových tobolek pomocí blízké infračervené spektroskopie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



