-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Možnosti ovlivnění obsahu léčiva a enkapsulační účinnosti chitosanových mikrosfér připravených procesem iontové gelace
Possibilities of influencing the drug content and encapsulation efficiency of chitosan microspheres prepared by ionic gelation process
This study aimed to prepare high molecular weight chitosan blank and drug-loaded microparticles using 5-aminosalicylic acid (5-ASA) as the model active substance by an external ionic gelation. Formulation and process variables included the chitosan concentration and presence of drug in the polymer solution, and/or in hardening solution during the microparticles preparation. The effect of different preparation conditions on the properties of the microparticles was observed with a view to increase drug content in microparticles. For both types of microparticles (with and without the drug), it was found that their sphericity and equivalent diameter increased with increasing chitosan concentration. The drug content of drug-loaded microparticles was the highest in the case of the sample prepared from 1.75% chitosan dispersion, when the drug was present both in the chitosan dispersion and the hardening solution. Maximum six times higher drug content was achieved by change of the placement of 5-ASA during preparation (1.25% chitosan concentration).
Keywords:
microparticles • external ionotropic gelation • chitosan • 5-ASA • encapsulation efficiency
Autoři: Jan Kouřil; Jakub Vysloužil; Martina Kejdušová; Kateřina Dvořáčková; David Vetchý
Vyšlo v časopise: Čes. slov. Farm., 2014; 63, 75-83
Kategorie: Původní práce
Souhrn
Cílem práce byla příprava mikročástic na bázi vysokomolekulárního chitosanu bez obsahu léčiva a následně příprava mikročástic s použitím 5-aminosalicylové kyseliny (5-ASA) jako modelové aktivní látky metodou vnější iontové gelace. Formulačními a procesními proměnnými byla koncentrace chitosanu a při přípravě aktivních mikročástic také přítomnost léčiva v roztoku polymeru a/nebo v použitém tvrdícím roztoku. Byl sledován vliv různých podmínek přípravy na vlastnosti mikročástic se zaměřením na zvýšení obsahu léčiva v mikročásticích. U mikročástic bez léčiva i s léčivem bylo zjištěno, že s rostoucí koncentrací chitosanu rostla jejich sféricita i jejich ekvivalentní průměr. Největší obsah léčiva byl dosažen u vzorku připraveného z 1,75% disperze chitosanu při přítomnosti léčiva v disperzi i tvrdícím roztoku. Změnou umístění léčiva během přípravy se podařilo zvýšit obsah 5-ASA maximálně 6krát (1,25% koncentrace chitosanu).
Klíčová slova:
mikročástice • vnější iontová gelace • chitosan • 5-ASA • enkapsulační účinnostÚvod
Stále větší požadavky na bezpečnost a efektivitu současné farmakoterapie vedou k rozvoji v oblasti lékových forem vyšších generací zajišťujících řízené uvolňování léčiva, popř. jeho cílenou biodistribuci. Mezi tyto lékové formy patří i mikročástice1). Tato léková forma je intenzivně studována díky celé řadě výhod (řízené uvolňování léčivé látky, možnost kombinace více léčiv, snížení nežádoucích účinků, uvolňování léčivé látky nezávisle na příjmu potravy atd.). Mikročástice lze efektivně podávat jak perorální, tak parenterální cestou2).
Důležitým aspektem přípravy mikročástic je zvolená metoda a použité materiály. Jednotlivé metody přípravy vedou k zisku dvou základních typů mikročástic. Mikrosféry lze definovat jako matricové částice, ve kterých je léčivo dispergováno v molekulární (roztok) nebo makroskopické (suspenze, emulze) formě3). Mikrotobolky, které představují zásobníkový typ, jsou systémy obsahující polymerní obal a jádro. To může být v kapalné, pevné nebo plynné formě, tvoří 10–90 % hmotnosti celé částice a ovlivňuje konečný tvar mikrotobolky. Na jádro těsně přiléhá polymerní obal3, 4).
Mikročástice lze připravit pomocí různých metod, které se dělí podle mechanismu vzniku částice5). Zvolená metoda by měla být schopna zajistit požadovanou velikost mikročástic, optimální enkapsulační účinnost, stabilitu lékové formy po dobu užívání, požadovaný disoluční profil atd.6). V této práci byla jako metoda přípravy mikročástic zvolena vnější iontová gelace, která patří do skupiny síťovacích metod. Síťovací metody mohou být rozděleny podle mechanismu zesíťování na chemické a fyzikálně-iontové (vnější a vnitřní iontová gelace; termální gelace)3). Při přípravě mikročástic metodou vnější iontové gelace dochází k extruzi disperze polymeru do tvrdící lázně ve formě kapek. Metoda je založena na interakci kationtové nebo aniontové funkční skupiny polymeru s opačně nabitými polyvalenčními ionty přítomnými v tvrdící lázni, čímž dochází k zesíťování struktury polymeru a vzniku mikrosféry7, 8). Výhodou iontové gelace je absence používání organických rozpouštědel, jejichž rezidua mohou být pro organismus toxická. Metoda nevyžaduje vyšší teplotu, a umožňuje tedy přípravu mikročástic s termolabilními léčivými látkami7). Postup je vhodný pro inkorporaci celé řady léčiv (chemická léčiva, peptidy, enzymy, vakcíny, živé buňky). Lze tak připravit mikrosféry na bázi alginátů9), kolagenu, hyaluronové kyseliny10), želatiny, škrobu11), karagenů12) nebo polosyntetického chitosanu.
Chitosan patří mezi biokompatibilní, biodegradovatelné a mukoadhezivní polymery13). Jedná se o polysacharid (1→4)-2-amino-2-deoxy-β-D-glukan odvozený od chitinu. Díky svým jedinečným fyzikálně-chemickým vlastnostem má velký potenciál pro biomedicínské nebo technologické aplikace14). Zdrojem chitosanu jsou nejčastěji schránky krabů, korýšů a měkkýšů. Při přípravě chitosanových mikročástic se jako síťovací činidla pro iontovou gelaci využívají látky obsahující ve své struktuře multivalenční aniontové funkční skupiny, jako např. tripolyfosfát sodný (TPP)15). Pro síťovací metody založené na chemickém zesíťování chitosanu se využívají glutaraldehyd16) nebo přírodní látka genipin. Glutaraldehyd je kvůli vyšší toxicitě méně vhodný ve srovnání s tripolyfosfátem. Genipin je aktivní aglykon odvozený od glykosidu geniposidu. Jeho nespornou výhodou je přírodní charakter, netoxičnost a kompatibilita s řadou polymerů. Nachází se v ovoci Gardenia jasminoides Ellis17).
Míra enkapsulace léčiva, resp. biofarmaceutika do chitosanových mikročástic připravených iontovou gelací, se pohybuje v poměrně širokém rozmezí. Enkapsulační účinnost (EE) nabývá velmi rozdílných hodnot, a to od velmi nízké –10 %, až po velmi vysokou –90 %, v závislosti na typu léčiva a zvolených formulačních a procesních parametrech. Důležitými parametry ovlivňujícími EE jsou koncentrace18) a molekulová hmotnost použitého chitosanu19), typ enkapsulovaného léčiva a jeho koncentrace v disperzi20), koncentrace tvrdícího činidla21) a pH tvrdící lázně22).
Vysokých hodnot EE se podařilo dosáhnout u mikročástic s obsahem vysokomolekulárních látek, např. proteinů (albumin, EE více než 90 %)23) nebo hormonů (růstový faktor hepatocytů, EE více než 85 %)24), jejichž tendence pro opouštění struktury mikrosféry v průběhu tvrzení je nižší ve srovnání s nízkomolekulárními léčivy. Proteiny se z mikročástic uvolňují zejména na základě eroze a/nebo degradace polymeru a vzhledem k jejich rozpustnosti a molekulové hmotnosti je jejich schopnost difundovat do roztoku velmi omezená25). V případě nízkomolekulárních léčiv dosahuje EE různých hodnot, např. u mikročástic obsahujících anxiolytikum klobazam se EE pohybovala v rozmezí 12–95 %26). Nízké hodnoty EE jsou typické pro hydrofilní nízkomolekulární léčiva.
Cílem této práce byla příprava mikrosfér pomocí metody vnější iontové gelace s obsahem 5-ASA jako modelového nízkomolekulárního léčiva a sledování vlivu formulačních a procesních proměnných na vlastnosti mikročástic. U mikročástic bez léčiva i s léčivem se sledoval vliv koncentrace chitosanu v použitých disperzích na jakostní parametry mikrosfér (morfologie, ekvivalentní průměr, sféricita). U mikročástic s léčivem se dále hlavní pozornost věnovala možnosti ovlivnění hodnoty obsahu léčiva a enkapsulační účinnosti různým umístěním léčiva při přípravě, a to: 1. v odkapávané disperzi chitosanu, 2. ve tvrdícím roztoku a 3. současně v odkapávané disperzi chitosanu i tvrdícím roztoku.
Pokusná část
Materiál
Modelovou léčivou látkou určenou k enkapsulaci do mikročástic byla 5-ASA (Mr – 153,14; Sigma Aldrich, St. Louis, USA), jako polymer byl zvolen vysokomolekulární chitosan; stupeň deacetylace > 75 % (Sigma Aldrich, St. Louis, USA), jako síťovací činidlo byl použit tripolyfosfát sodný (Merck KGaA, Darmstadt, Německo), disolučním médiem byl fosforečnanový tlumivý roztok (dodekahydrát hydrogenfosforečnanu sodného, dihydrogenfosforečnan draselný – oba Merck KGaA, Darmstadt, Německo). Všechny ostatní pomocné látky a chemikálie použité v experimentu vyhovovaly kvalitou lékopisu popř. dalším požadovaným normám.
Příprava mikročástic
Jako metoda pro přípravu mikročástic byla zvolena vnější iontová gelace. Při přípravě disperze chitosanu bylo na 1% roztok kyseliny octové navrstveno požadované množství polymeru a tato směs se nechala přes noc bobtnat. Celkem byly připraveny disperze chitosanu v rozmezí 1–1,75 %. V daném intervalu koncentrace vždy rostla o přírůstek 0,25 %. Disperze se následně homogenizovala pomocí přístroje Ultra Turrax (T25 BASIC, IKA – Werke GmbH & Co. KG, Staufen, Německo) při rychlosti 16 000 otáček za minutu. Při přípravě mikročástic s léčivem se k roztokům chitosanu přidalo 375 mg 5-ASA, čímž se získaly 0,25% disperze léčiva. Takto připravené homogenní disperze, bez nebo s léčivem, se poté naplnily do injekční stříkačky o objemu 2 ml s průměrem jehly 0,7 mm (tab. 1) a protlačovaly se pomocí lineárního dávkovače LD 2 (Vývojové dílny ČSAV, Praha, Česká republika) do tvrdící lázně (60 ml), která byla tvořená buď 10% roztokem TPP, nebo 10% roztokem TPP nasyceným 5-ASA o koncentraci 1160 mg/l27). Vzdálenost hladiny tvrdící lázně od ústí jehly byla 1,0 cm. Všechny šarže byly připraveny při teplotě místnosti.
Tab. 1. Přehled označení vzorků ve vztahu k podmínkám přípravy mikrosfér 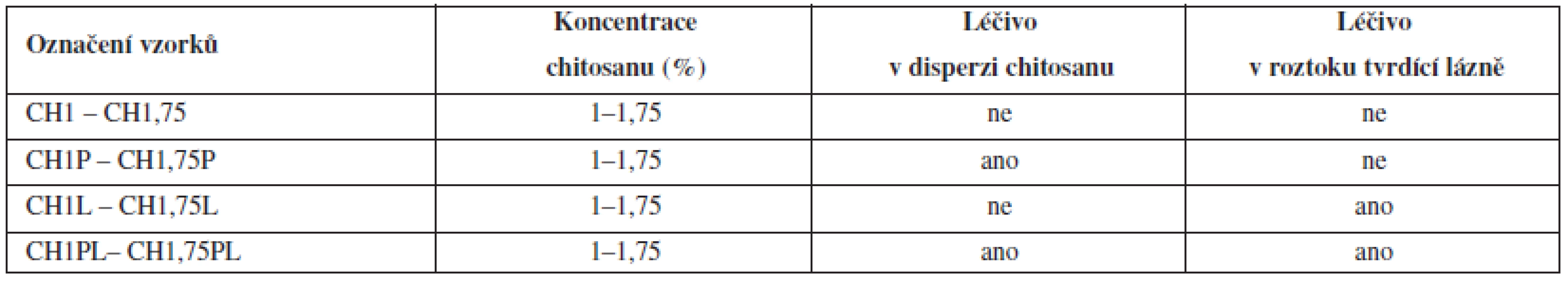
Vzorky byly označeny podle metody přípravy. Symbol „CH“ označuje materiál pro přípravu mikročástic chitosan a číslice pak jeho koncentraci v disperzi. Označení „P“ vyjadřuje přítomnost léčiva pouze v disperzi chitosanu, „L“ přítomnost léčiva v tvrdící lázni a „PL“ přítomnost léčiva v disperzi chitosanu i v tvrdící lázni.
Doba tvrzení byla u mikročástic bez léčiva 30 minut, pro mikročástice s léčivem 90 minut. Zvolené časové intervaly vychází z již publikovaných vědeckých prací28, 29).
Ihned po styku polymeru s roztokem tvrdící lázně docházelo k formování kulovitých částic. Vzniklé mikročástice se po uplynutí požadované doby třikrát promyly čištěnou vodou a sušily se na Petriho miskách v horkovzdušné sušárně Horo 048B (Dr. Ing. A. Hoffmann, Ostfildern, Německo) při teplotě 25 °C po dobu 24 hodin.
Charakteristika disperzí
Stanovení viskozity
Měření dynamické viskozity bylo provedeno u disperzí chitosanu s léčivem i bez léčiva. Všechny disperze byly před samotným měřením homogenizovány pomocí přístroje Ultra Turrax při rychlosti 16 000 otáček za minutu. Pro stanovení viskozity se použil Brookfieldův rotační viskozimetr Brookfield DV-II+Pro (Brookfield Engineering, Middleboro, USA). Během měření, které probíhalo při teplotě 37 °C, se použil adaptér pro měření malých vzorků a vřeteno SC4-21. Otáčky vřetena byly u všech měření stejné (200 ot./min). Výsledná viskozita a její směrodatná odchylka (SD) byla dána průměrem tří měření.
Charakteristika mikročástic
Stanovení morfologie a velikosti mikročástic
Velikost chitosanových mikročástic byla hodnocena pomocí stereoskopického mikroskopu STM – 902 ZOOM (Opting servis, Ostrava, Česká republika) propojeným s CCD kamerou Alphaphot (Nikon, Tokyo, Japonsko) a počítačem. Obrazové snímky se hodnotily s využitím softwaru pro obrazovou analýzu Ia32 (Leco Corporation, St. Joseph, USA). U každé šarže se měřilo 600 mikročástic. Z naměřených hodnot se stanovil faktor kulatosti (SF) a ekvivalentní průměr (EP). Výsledky se vyjádřily jako aritmetický průměr a jeho směrodatná odchylka.
kde A je plocha částice a p je obvod částice.
kde A je plocha částice.
Dále byla hodnocena distribuce velikosti částic Y. Distribuci velikosti částic charakterizují hodnoty d10, d50 a d90 vyjadřující hraniční mez, do které spadá svou velikostí 10, 50, resp. 90 % proměřených částic podle vztahu:
Stanovení obsahu 5-ASA v mikročásticích a enkapsulační účinnost
Přesně navážené množství rozdrcených mikročástic se v odměrné baňce o objemu 50 ml doplnilo čištěnou vodou po rysku. Baňky se umístily na ultrazvukovou lázeň Sonorex RK 52H (Bandelin, Berlín, Německo) na 5 hodin z důvodu úplného uvolnění léčiva z lékové formy. Poté se spektrofotometricky stanovila absorbance vzorků při vlnové délce 330 nm pro 5-ASA30) (Spektrofotometr Lambda 25, Perkin Elmer Instruments, St. Louis, USA). Obsah 5-ASA byl vypočítán pomocí hodnot ze sestavené kalibrační křivky. Pro každou šarži se měření opakovalo 3krát.
Na základě získaných hodnot se vypočítala enkapsulační účinnost (EE) podle vztahu:
kde cs je skutečný obsah 5-ASA v mikročásticích, ct je teoretický obsah v mikročásticích.
Zkouška disoluce
Ke stanovení uvolňování léčivé látky z mikročástic se použila pádlová disoluční metoda. Jako disoluční kapalina se zvolil lékopisný tlumivý roztok v množství 500 ml, o teplotě 37 ± 0,5 °C; rychlost otáček pádel byla 100 za minutu. Disoluční aparaturou byla on-line linka Sotax AT7 Smart (Donaulab, Zurich, Švýcarsko), kde se vzorky automaticky odebíraly a spektrofotometricky měřily při vlnové délce 330 nm (Spektrofotometr Lambda 25, Perkin Elmer, Wellesley, USA). Uvolňování léčiva probíhalo v prostředí fosforečnanového tlumivého roztoku o pH 6,8 (dodekahydrát hydrogenfosforečnanu sodného a dihydrogenfosforečnan draselný – oba Merck KGaA, Darmstadt, Německo). Odběry vzorků byly provedeny po 30, 60 a 120 min.
Výsledky a diskuze
Charakteristika disperzí
Stanovení viskozity
Viskozita disperzí chitosanu bez léčiva (1–1,75%) se pohybovala v rozmezí hodnot 258,16 ± 0,16–1786,66 ± 2,36 mPa.s, disperze s léčivem (1–1,75%) pak v rozmezí 213,83 ± 0,24–1765,00 ± 4,08 mPa.s. S rostoucí koncentrací polymeru u vzorků bez léčiva i s léčivem došlo k očekávanému nárůstu hodnot viskozity, což je ve shodě s již publikovanou literaturou31). Z výsledků je patrné, že průměrné hodnoty viskozity disperzí jednotlivých koncentrací s léčivem byly v porovnání s koncentracemi bez léčiva mírně nižší (obr. 1). Tento výsledek se přisuzuje interakcím mezi chitosanem a 5-ASA32, 33). Ke stejnému závěru dospěli ve své studii Hejazi a Amiji, kdy byl posuzován vliv močoviny na viskozitu roztoků chitosanu s močovinou a bez ní34). Při infračervené spektroskopii s Fourierovou transformací byly měřeny vzorky samotného polymeru, léčiva 5-ASA a mikročástic s 5-ASA. Byl pozorován posun charakteristických signálů potvrzující pravděpodobně elektrostatickou interakci mezi 5-ASA a chitosanem32).
Obr. 1. Viskozita disperzí chitosanu s léčivem a bez léčiva 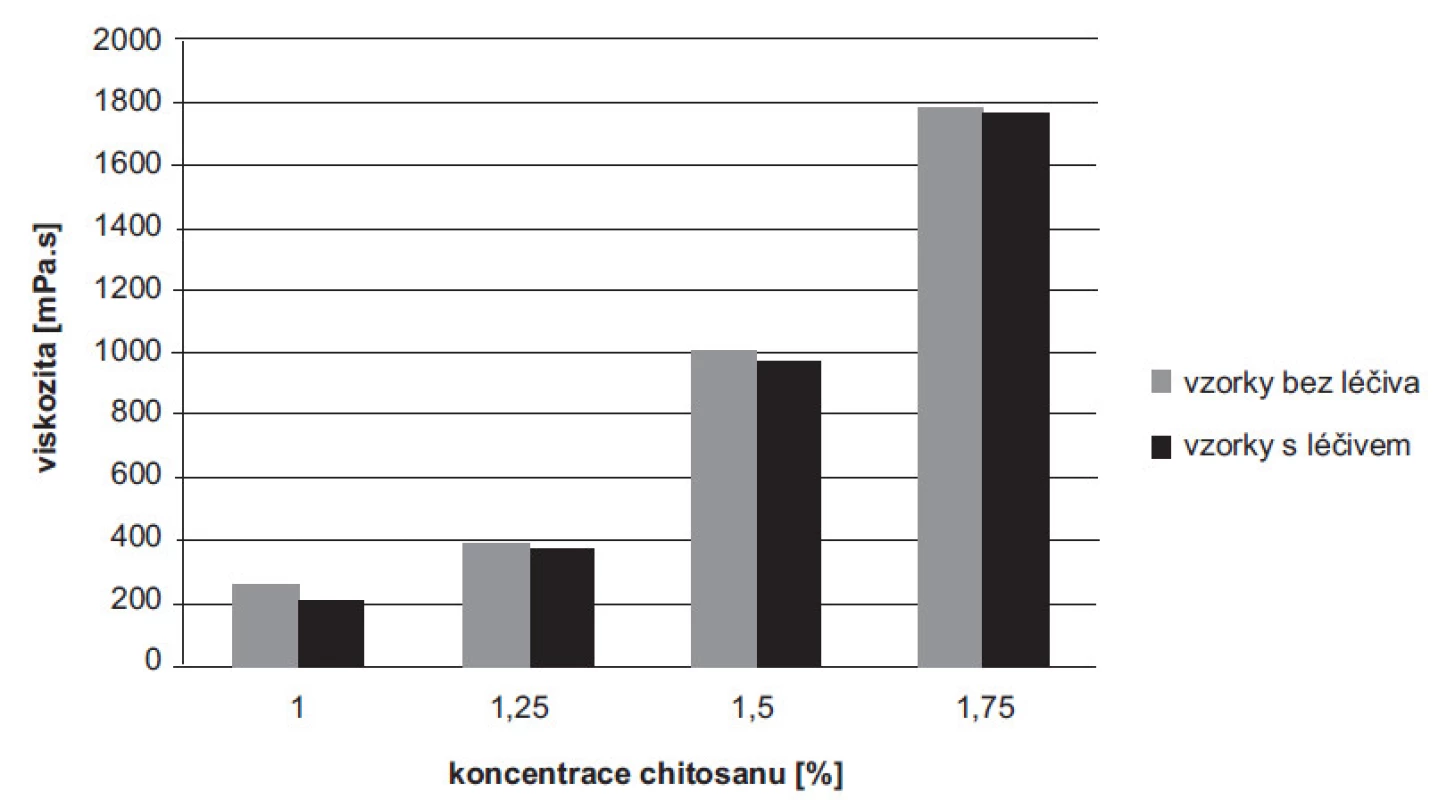
Charakteristika mikročástic
Stanovení morfologie a velikosti mikročástic
Pomocí stereoskopického mikroskopu byl podle vztahu 1 počítán faktor sfericity (obr. 2), podle vztahu 2 ekvivalentní průměr (obr. 3) a šířka distribuce (vztah 3), která je uvedena v tabulce 2. Obecně vyšších hodnot faktoru sféricity dosahovaly vzorky mikročástic bez obsahu léčiva, a to v rozmezí 0,75–0,80, kde sféricita rostla s rostoucí koncentrací použitého chitosanu35). Pro jednotlivé metody přípravy mikročástic s léčivem bylo možné pozorovat podobný trend, který je ve shodě s již publikovanou vědeckou literaturou36). Při stejné koncentraci chitosanu byl pozorován vliv použité metody přípravy na hodnotu faktoru sféricity. Nejnižších hodnot dosahovaly vzorky CHPL (0,73–0,75), kde bylo léčivo přítomno jak v disperzi chitosanu, tak v tvrdící lázni, vzorky CHL s obsahem léčiva v tvrdící lázni dosahovaly nepatrně vyšších hodnot (0,73–0,77). Mikročástice s označením CHP měly faktor kulatosti v rozmezí 0,74–0,78. Nejvyšší hodnoty faktoru sféricity (0,75–0,80) byly nalezeny pro vzorky s označení CH, kde nebylo při přípravě léčivo použito. Snímky mikrosfér připravených z disperzí chitosanu 1,75 % (bez léčiva a s léčivem při různém umístění léčiva) uvádí obrázek 4. Z uvedených výsledků vyplývá, že pokles faktoru sfericity v řadě CH – CHP – CHL – CHPL lze pravděpodobně připsat rostoucímu obsahu léčiva v mikročásticích připravených různými metodami (tab. 3). K podobnému závěru dospěl ve své experimentální práci Sinha a kol. Pokles sfericity při vyšším obsahu 5-ASA v mikročásticích se připisuje masivnější tvorbě povrchových deformit projevujících se hrubším povrchem37).
Obr. 2. Sféricita připravených mikročástic 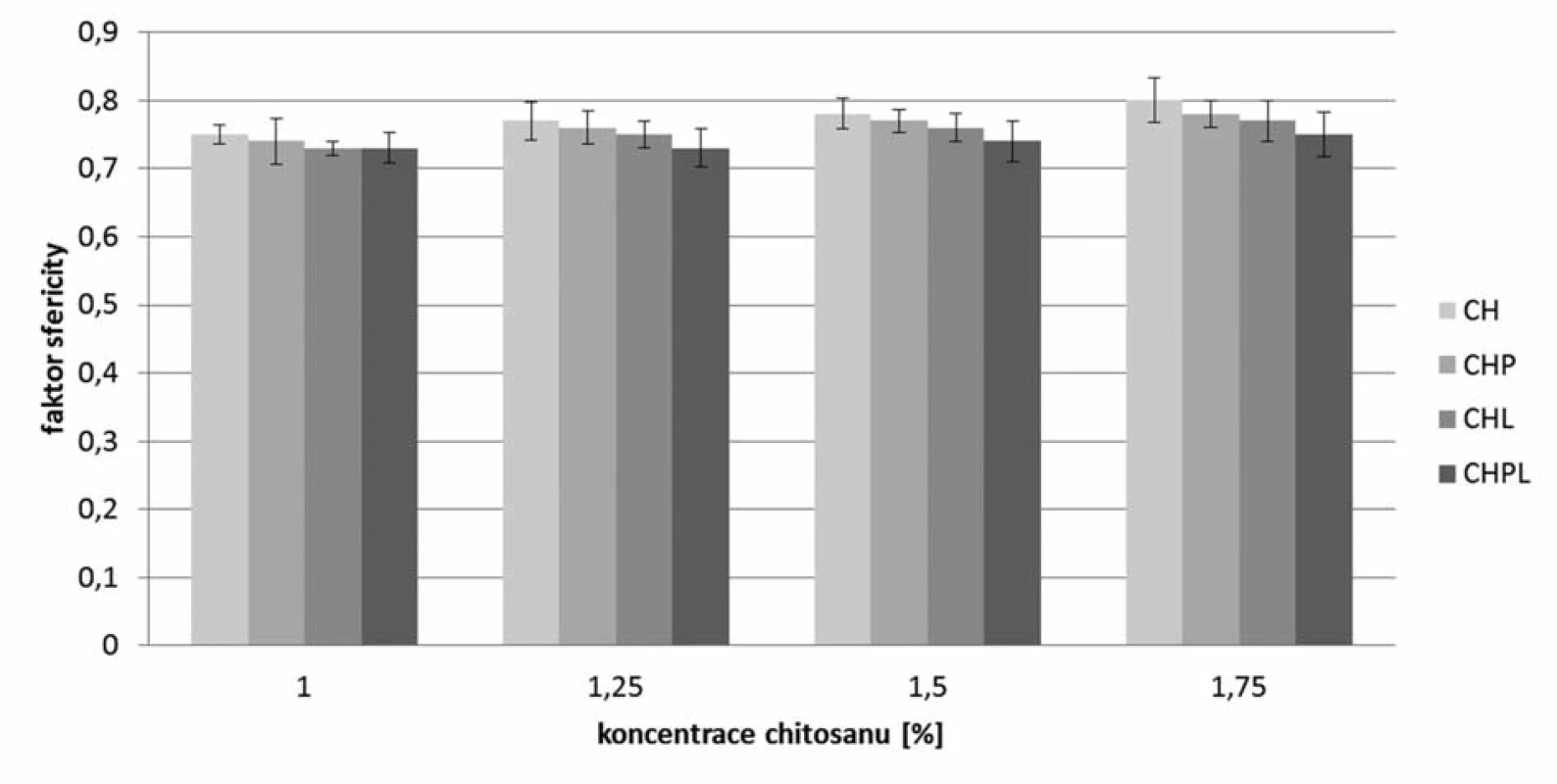
Obr. 3. Ekvivalentní průměr připravených mikročástic 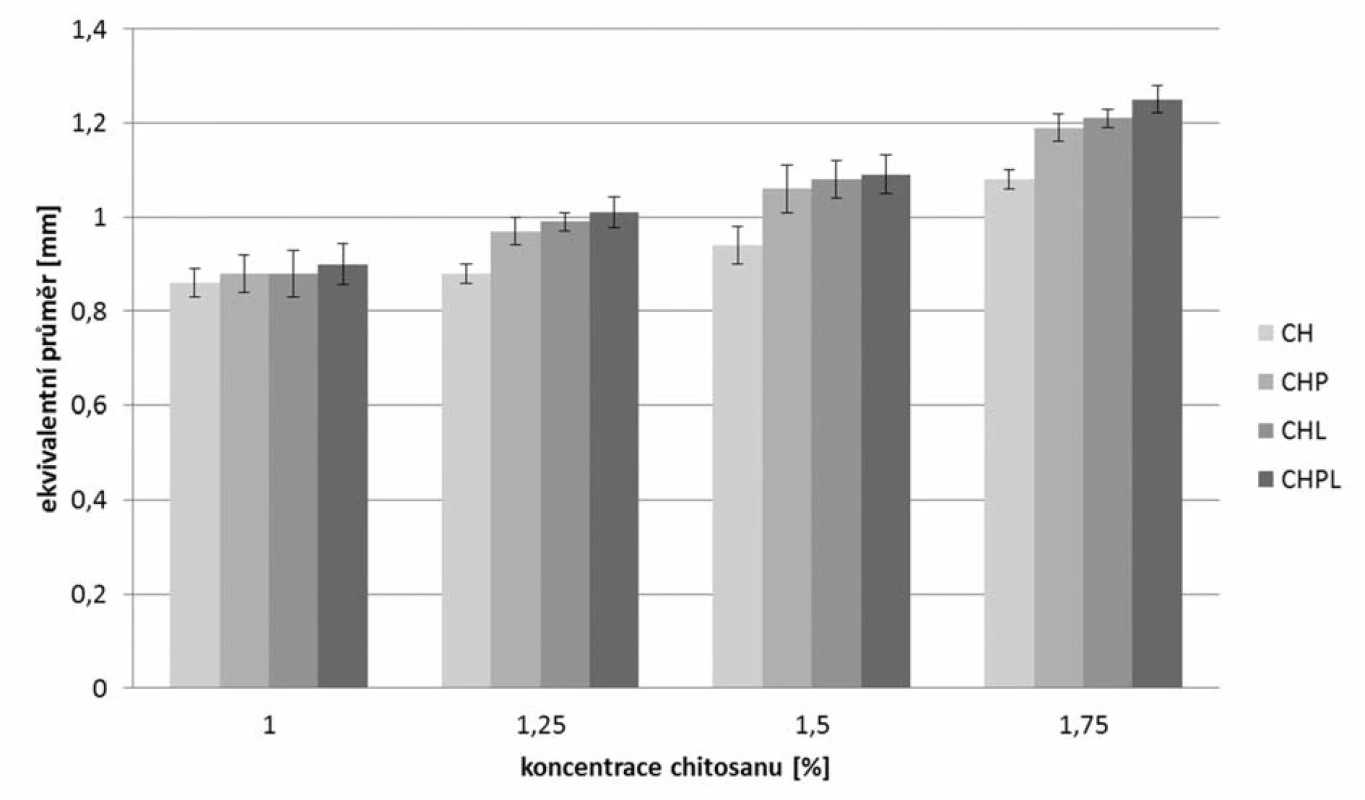
Tab. 2. Šířka distribuce připravených mikročástic 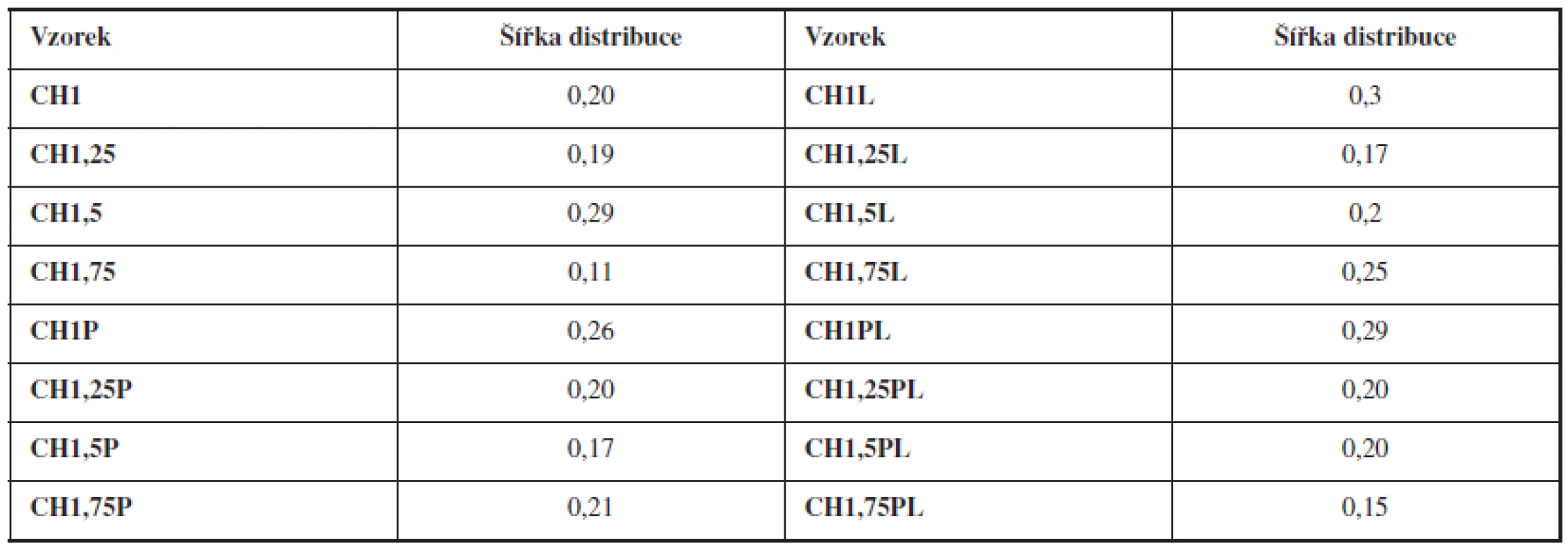
Obr. 4. Snímky ze stereoskopického mikroskopu (zvětšeno 7krát) (A) CH1,75, (B) CH1,75P, (C) CH1,75L, (D) CH1,75PL 
Tab. 3. Obsah 5-ASA v připravených mikročásticích a jejich enkapsulační účinnost 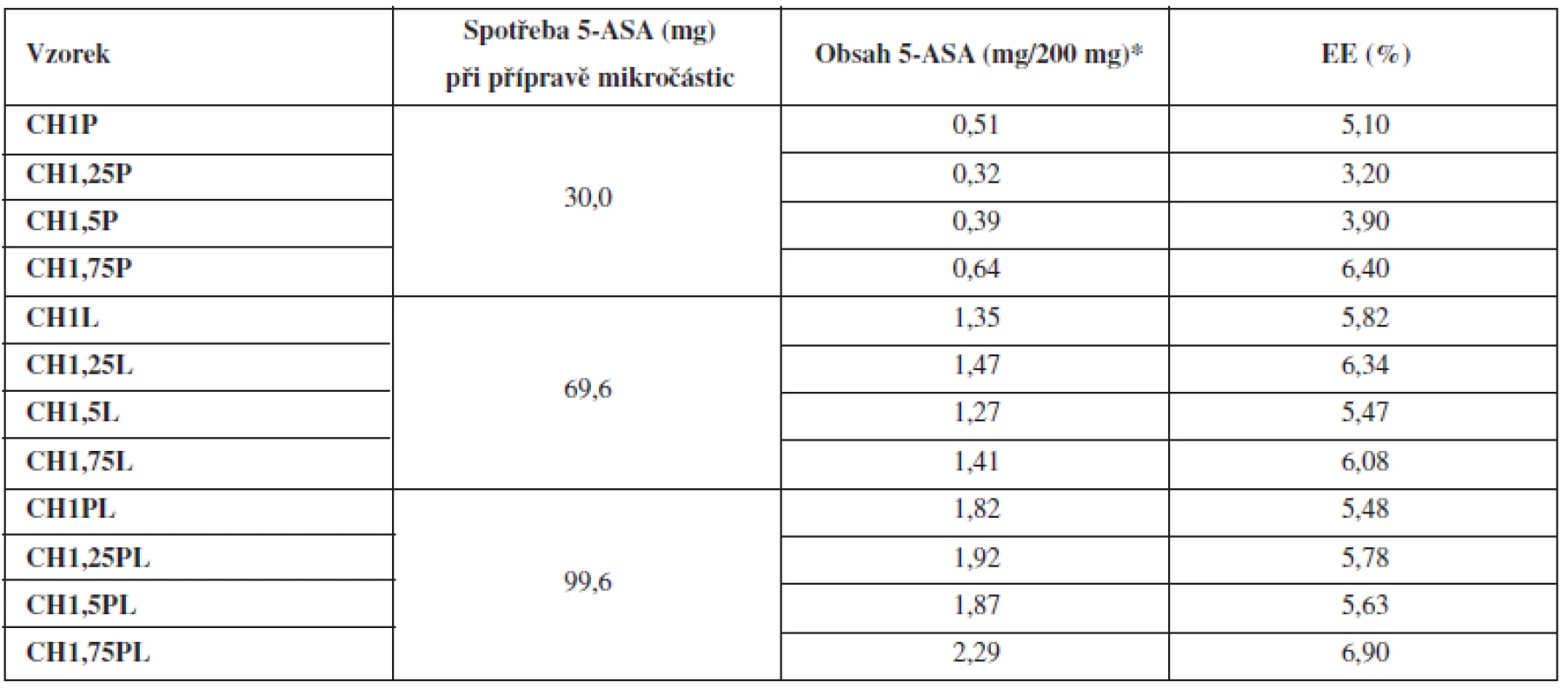
*Obsah léčiva se stanovoval ve 200 mg mikročástic. Z měření velikosti částic vyplývá, že nejmenší mikročástice byly připraveny z disperzí chitosanu bez obsahu léčiva, jejichž velikost očekávaně rostla se zvyšující se koncentrací chitosanu v použité disperzi (0,86 až 1,08 mm)38). Inkorporace léčiva do mikročástic měla za následek nárůst velikosti částic39). Z posouzení výsledků dosažených při hodnocení mikročástic s léčivem připravených rozdílnými metodami vyplývá, že nejnižších hodnot se dosáhlo u vzorků CHP, u kterých bylo léčivo přítomno v disperzi chitosanu (0,88–1,19 mm), nepatrně vyšších hodnot pak u vzorků CHL připravovaných pomocí tvrdícího roztoku nasyceného 5-ASA (0,88 až 1,21 mm) a nejvyšší hodnoty byly nalezeny u vzorků CHPL (0,9–1,25 mm) připravených pomocí metody charakterizované přítomností léčiva v disperzi chitosanu i tvrdícím roztoku. Z dosažených výsledků je zřejmé, že velikost mikročástic rostla s rostoucím obsahem léčiva v mikročásticích (viz dále)40).
Šířka distribuce velikosti částic se vypočítala podle vztahu 3. Z vypočítaných hodnot vyplývá, že distribuce velikosti mikročástic bez léčiva i s léčivem se pohybovala v rozmezí 0,11–0,30 (viz tab. 2). Vysoká hodnota tohoto parametru indikuje širokou distribuci, a tím i vysokou nežádoucí polydisperzitu41), zatímco hodnota blížící se nule ukazuje na monodisperzní systém. Například u granulátů je šířka distribuce menší než 3 považována za přijatelnou42), u mikročástic se v literatuře uvádí hodnota menší než 243). Dosažené výsledky potvrzují výhodnou velmi úzkou distribuci připravených mikročástic.
Stanovení obsahu 5-ASA v mikročásticích a enkapsulační účinnost
Obsah léčivé látky se stanovoval spektrofotometricky. Z výsledků uvedených v tabulce 3 vyplývá, že nebyl pozorován významný vliv rostoucí koncentrace chitosanu v mikročásticích na obsah 5-ASA. Použitá metoda přípravy však obsah léčiva ovlivnila výrazněji. Nejméně léčiva (0,32–0,64 mg/200 mg) obsahovala vzorky CHP, kde bylo při přípravě léčivo přítomno pouze v disperzi polymeru. Jejich enkapsulační účinnost (počítána dle vztahu 4) dosahovala hodnot 3,20–6,40 %. Hlavním důvodem nízké EE a obsahu léčiva bývá uváděn přestup léčivé látky na základě koncentračního gradientu z tvořící se mikročástice do roztoku tvrdící lázně44), k čemuž zjevně došlo u těchto vzorků. Vyšších obsahů léčiva bylo dosaženo u vzorků CHL, kde bylo léčivo přítomno v tvrdící lázni. Obsah dosahoval hodnot 1,27–1,47 mg/200 mg a enkapsulační účinnost byla 5,47–6,34 %. U těchto mikročástic došlo při enkapsulaci k přestupu 5-ASA do tvořící se mikročástice na základě opačného gradientu. Proces tvrzení mikročástice je nejintenzivnější na jejím povrchu. S poklesem koncentračního gradientu se však přestup léčiva do mikročástice v čase výrazně zpomaluje45). Nejvyšších hodnot obsahů 5-ASA (1,82–2,29 mg/200 mg) bylo dosaženo u vzorků CHPL, kde bylo léčivo přítomno jak v disperzi polymeru, tak v tvrdící lázni v jeho nasycené koncentraci. V tomto případě docházelo k nejmenším ztrátám během přípravy45). Enkapsulační účinnost (5,48–6,9 %) se však výrazně nezvýšila. Z uvedeného vyplývá, že umístění léčiva v průběhu přípravy ovlivnilo obsah léčiva enkapsulovaného do mikrosfér a to až 6krát, jak plyne ze srovnání obsahů mikročástic vzorků CHP a CHPL připravených z 1,25% disperze chitosanu. Enkapsulační účinnost vzorků připravených různými metodami se však výrazně nelišila, pravděpodobně díky nutnému zohlednění léčiva přítomného i ve tvrdící lázni při výpočtech. Obecně byly dosažené hodnoty EE velmi nízké. K uvedenému přispěl hydrofilní charakter použitého léčiva a jeho nízká molekulová hmotnost46). Problematická byla pravděpodobně i dlouhá doba tvrzení (90 min), která taktéž mohla přispět k nízké EE mikročástic47). V rámci experimentu však musela být doba tvrzení dodržena, neboť při kratším tvrzení vznikaly lepivé útvary s velmi nízkou sféricitou. Lze si také povšimnout, že u CHL mikročástic vedl růst koncentrace chitosanových disperzí ve srovnání s CHP a CHPL mikročásticemi pouze k minimálnímu nárůstu EE, což podporuje uvedenou teorii.
Zkouška disoluce
Zkouška disoluce se neprováděla u všech připravených vzorků mikročástic. Vzhledem k jejich charakteru lze očekávat shodné disoluční chování charakterizované rychlým uvolněním léčiva in vitro z chitosanové matrice. Disoluční zkouška byla provedena u mikročástic s obsahem 5-ASA s označením CHPL, kde při přípravě bylo léčivo přítomno jak v disperzi chitosanu, tak v tvrdící lázni, s cílem ověření uvolňování léčiva z připravených mikročástic. Zvolené koncentrace byly CH1,25PL až CH1,75PL, a to z důvodu nejvyššího obsahu enkapsulovaného léčiva (viz tab. 3). Mikročástice byly podrobeny zkoušce disoluce při pH 6,8, která byla zvolena vzhledem k rozpustnosti chitosanu v kyselém prostředí48). Jak je znázorněno na obrázku 5, došlo u mikročástic k okamžitému uvolnění léčivé látky do prostředí disolučního média. Po 30 minutách se uvolnilo u všech vzorků 90,8–97,6 % léčivé látky. Jak dle Českého tak Evropského lékopisu lze zhodnotit toto uvolňování léčiva jako okamžité. Uvolnění léčiva z lékové formy je základním předpokladem pro zajištění terapeutického účinku dané účinné látky. Okamžité uvolnění léčiva z chitosanových mikročástic je ve shodě s vědeckou literaturou. Barba et al. připravili metodou ultrazvukové atomizace chitosanové mikročástice s podobným disolučním profilem léčiva49).
Obr. 5. Disoluční zkouška vzorků mikročástic CHPL 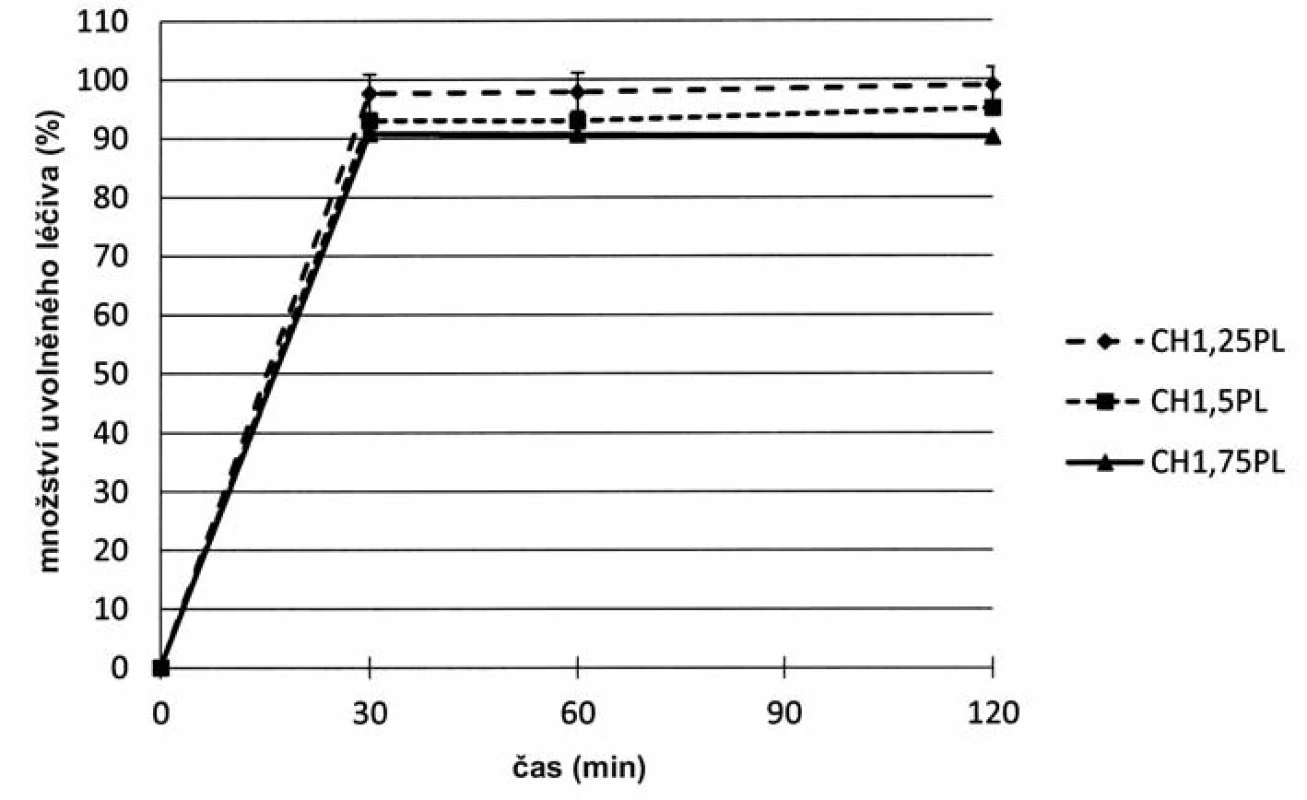
Závěr
Byly připraveny mikrosféry s 5-ASA na bázi vysokomolekulárního chitosanu metodou vnější iontové gelace. Jako formulační a procesní proměnné byly zvoleny koncentrace chitosanu a způsob zapracování léčiva během přípravy. Největší obsah léčiva byl dosažen u vzorku připraveného z 1,75% disperze chitosanu při přítomnosti léčiva v disperzi i tvrdícím roztoku. Volbou parametrů přípravy se podařilo obsah léčiva zvýšit až šestinásobně (1,25% CHPL vzorek), obecně však byly hodnoty nízké. Takto připravené mikročástice jsou tedy pravděpodobně vhodné spíše pro léčiva hydrofobní povahy či makromolekulární látky, kde lze očekávat vyšší hodnoty EE. Jistým řešením by byla náhrada finančně nákladného léčiva přítomného v tvrdící lázni levnou pomocnou látkou zabraňující ztrátám léčiva z mikročástic nebo okyselení tvrdícího roztoku, ve kterém je použité léčivo 5-ASA méně rozpustné. Při použití mikrosfér do distálních částí gastrointestinálního traktu je vzhledem k rozpustnosti chitosanu v kyselém prostředí nezbytné obalení částic acidorezistentním obalem nebo jejich umístění do enterosolventní tobolky.
Střet zájmů: žádný.
Došlo 27. ledna 2014
Přijato 7. března 2014
J. Kouřil • J. Vysloužil • M. Kejdušová • doc. PharmDr. Kateřina Dvořáčková, PhD. (∗) • D. Vetchý
Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků
Palackého 1/3, 612 42 Brno
e-mail: dvorackovak@vfu.cz
Zdroje
1. Vetchý D., Ceral J. Moderní perorální lékové formy používané v neurologii. Neurol. Prax. 2005; 6(4), 211–212.
2. Madhav N. V. S., Kala S. Review on microparticulate drug delivery system. Int. J. PharmTech Res. 2011; 3(5), 1242–1254.
3. Bajerová M., Dvořáčková K., Gajdziok J., Masteiková R., Rabišková M. Metody přípravy mikročástic ve farmaceutické technologii. Čes. slov. Farm. 2009; 58(5/6), 191–199.
4. Rabišková M. Částicové lékové formy. Prakt. Lékáren. 2005; 1, 29–30.
5. Sahil K., Akanksha M., Premjeet S., Bilandi A., Kapoor B. Microsphere: A review. IJRPC. 2011; 1(4), 1184–1198.
6. Alagusundaram M., Madhu Sudana Chetty C., Umashankari K., Badarinath A. V., Lavanya C., Ramkanth S. Microspheres as a novel drug delivery system – A review. Int. J. ChemTech Res. 2009; 1(3), 526–534.
7. Reis C. P., Neufeld R. J., Vilela S., Ribeiro A. J., Veiga F. Review and current status of emulsion/dispersion technology using an internal gelation process for the design of alginate particles. J. Microencapsul. 2006; 23(3), 245–257.
8. Patil P., Chavanke D., Wagh M. A review on ionotropic gelation method: Novel approach for controlled gastroretentive gelispheres. Int. J. Pharm. Pharm. Sci. 2012; 4(4), 27–32.
9. Das M. K., Senapati P. C. Furosemide-loaded alginate microspheres prepared by ionic cross-linking technique: Morphology and release characteristics. Indian J. Pharm. Sci. 2008; 70(1), 77–84.
10. Lee J. E., Park J. C., Kim J. G., Suh H. Preparation of collagen modified hyaluronan microparticles as antibiotics carrier. Yonsei Med. J. 2001; 42(3), 291–298.
11. Vedha Hari B. N., Praneetha T., Prathyusha T., Mounika K., Ramya Devi D. Development of starch-gelatin complex microspheres as sustained release delivery system. J. Adv. Pharm. Technol. Res. 2012; 3(3), 182–187.
12. Shaik A. A., Shaik U. K., Praneetha P. Preparation and in vitro evaluation of chitosan-carrageenan, chitosan-alginate beads for controlled release of nateglinide. Der Pharmacia Sinica 2011; 2(2), 375–384.
13. Rowe R. C., Sheskey P. J., Owen S. C. Handbook of pharmaceutical excipients: edited by Raymond C. Rowe, Paul J. Sheskey, Siân C. Owen. 5th ed. Washington, DC: American Pharmacists Association, 2006; xxi, 918 s.
14. Tahtat D., Mahlous M., Benamer S., Khodja A. N., Youcef S. L. Effect of molecular weight on radiation chemical degradation yield of chain scission of γ-irradiated chitosan in solid state and in aqueous solution. Radiat. Phys. Chem. 2012; 81(6), 659–665.
15. Taranejoo S., Janmaleki M., Rafienia M., Kamali M., Mansouri M. Chitosan microparticles loaded with exotoxin A subunit antigen for intranasal vaccination against Pseudomonas aeruginosa: An in vitro study. Carbohydr. Polym. 2011; 83(4), 1854–1861.
16. Pichayakorn W., Boonme P. Evaluation of cross-linked chitosan microparticles containing metronidazole for periodontitis treatment. Mater. Sci. Eng. C. Mater. Biol. Appl. 2013; 33(3), 1197–1202.
17. Harris R., Lecumberri E., Heras A. Chitosan-Genipin Microspheres for the Controlled Release of Drugs: Clarithromycin, Tramadol and Heparin. Mar. Drugs 2010; 8, 1750–1762.
18. Saha P., Goyal A. K., Rath G. Formulation and Evaluation of Chitosan-Based Ampicillin Trihydrate Nanoparticles. Trop. J. Pharm. Res. 2010; 9(5), 483–488.
19. Wang Y.-CH., Chung T.-H., Chung T.-W. The Effects of Characteristics of Chitosan on the Heparin Loaded Chitosan Microspheres. J. Med. Biol. Eng. 2001; 21(4), 225–232.
20. Dounighi M. N., Eskandari R., Avadi M. R., Zolfagharian H., Sadeghi M. M. A., Rezayat M. Preparation and in vitro characterization of chitosan nanoparticles containing Mesobuthus eupeus scorpion venom as an antigen delivery system. J. Venom. Anim. Toxins incl. Trop. Dis. 2012; 18(1), 44–52.
21. Sriamornsak P. Effect of calcium concentration, hardening agent and drying condition on release characteristics of oral proteins from calcium pectinate gel beads. Eur. J. Pharm. Sci. 1999; 8(3), 221–227.
22. Ravikumara N. R., Madhusudhan B. Chitosan nanoparticles for tamoxifen delivery and cytotoxicity to MCF-7 and Vero cells. Pure Appl. Chem. 2011; 83(11), 2027–2040.
23. Xu Y., Du Y. Effect of molecular structure of chitosan on protein delivery properties of chitosan nanoparticles. Int. J. Pharm. 2003; 250(1), 215–226.
24. Pulavendran S., Rose CH., Mandal A. Hepatocyte growth factor incorporated chitosan nanoparticles augment the differentiation of stem cell into hepatocytes for the recovery of liver cirrhosis in mice. J. Nanobiotechnology. 2011; 9(1), 1–11.
25. Shrivastava V., Jain U. K. Design of single dose control release device for antigen delivery based on Poly (Lactic -Co - Glycolic acid). IJPSN 2010; 3(3), 1075–1084.
26. Kumar S. S., Saha A. K., Kavitha K., Basua S. K. Evaluation of clobazam loaded ionically cross-linked microspheres using chitosan. Der Pharmacia Sinica. 2012; 6(3), 616–623.
27. 5-Aminosalicylic acid. Santa Cruz Biotech [online] [cit. 2013-08-18]. Dostupné z: http://www.scbt.com/datasheet-202890-5-aminosalicylic-acid.html
28. Smrdel P., Bogataj M., Mrhar A. The influence of selected parameters on the size and shape of alginate beads prepared by ionotropic gelation. Sci. Pharm. 2008; 76(1), 77–89.
29. Sari R., Rijal M., Sari D. M., Ruliyana I. D. Physical characterization and in vitro release study on theophylline-chitosan microparticles (effect on crosslinking time and method of preparation). PharmaScientia. 2012; 1(1), 16–22.
30. Cheng G., An F., Zou M.-J., Sun J., Hao X. H., He Y. X. Time - and pH-dependent colon-specific drug delivery for orally administered diclofenac sodium and 5-aminosalicylic acid. World J. Gastroenterol. 2004; 10(12), 1769–1774.
31. El-Hefian E. A., Elgannoudi E. S., Mainal A., Yahaya A. H. Characterization of chitosan in acetic acid: rheological and thermal studies. Turk. J. Chem. 2010; 34(1), 47–56.
32. Mura C., Nachér A., Merino V., Merino-Sanjuán M., Manconi M., Loy G., Fadda A. M., Díez-Sales O. Design, characterization and in vitro evaluation of 5-aminosalicylic acid loaded N-succinyl-chitosan microparticles for colon specific delivery. Colloids Surf. B. Biointerfaces. 2012; 94(1), 199–205.
33. Mladenovska K., Cruaud O., Richomme P., Belamie E., Raicki R. S., Venier-Julienne M. C., Popovski E., Benoit J. P., Goracinova K. 5-ASA loaded chitosan-Ca-alginate microparticles: Preparation and physicochemical characterization. Int. J. Pharm. 2007; 345(1–2), 59–69.
34. Hejazi R., Amiji M. Chitosan-based gastrointestinal delivery systems. J. Control. Release 2003; 89(2), 151–165.
35. Phromsopha T., Baimark Y. Chitosan microparticles prepared by the water-in-oil emulsion solvent diffusion method for drug delivery. Biotechnology 2010; 9(1), 61–66.
36. Goudanavar P., Bagali R., Chandrashekhara A., Patil S. M. Design and characterization of diclofenac sodium microbeads by ionotropic gelation technique. Int. J. Pharm. Bio. Sci. 2010; 1(2), 1–10.
37. Sinha V. R, Singla A. K., Wadhawan S., Kaushik R., Kumria R., Bansal K., Dhawan S. Chitosan microspheres as a potential carrier for drugs. Int. J. Pharm. 2004; 274(1–2), 1–33.
38. Saleem M. A., Murali Y. D., Naheed M. D., Jaydeep P., Dhaval M. Prepapation and evaluation of valsartan loaded hydrogel beads. IRJP 2012; 3(6), 80–85.
39. Wang CH., Fu X., Yang L. Water-soluble chitosan nanoparticles as a novel carrier system for protein delivery. Chin. Sci. Bull. 2007; 52(7), 883–889.
40. Prasanth V. V., Chakraborty A., Mathew S. T., Parthasarathy G., Mathappan R., Thoppil S. CH. Formulation and evaluation of salbutamol sulphate - alginate microspheres by ionotropic gelation method. Pharmacie Globale 2011; 2(7), 1–4.
41. Silva C. M., Ribeiro A. J., Figueiredo I. V., Gonçalves A. R., Veiga F. Alginate microspheres prepared by internal gelation: Development and effect on insulin stability. Int. J. Pharm. 2006; 311(1–2), 1–10.
42. Giry K., Viana M., Genty M., Louvet F., Wüthrich P., Chulia D. Comparison of single pot and multiphase granulation. Part 1: Effect of the high shear granulator on granule properties according to the drug substance and its concentration. Pharm. Dev. Technol. 2009; 14(2), 138–148.
43. Simonoska Crcarevska M., Glavas Dodov M., Goracinova K. Chitosan coated Ca-alginate microparticles loaded with budesonide for delivery to the inflamed colonic mucosa. Eur. Biopharm. 2008; 68(3), 565–578.
44. Smrdel P., Bogataj M., Podlogar F., Planinsek O., Zajc N., Mazaj M., Kaucic V., Mrhar A. Characterization of calcium alginate beads containing structurally similar drugs. Drug Dev. Ind. Pharm. 2006; 32(5), 623–633.
45. Bajerová M., Dvořáčková K., Gajdziok J., Masteiková R. Mikročástice na bázi oxycelulosy – vliv procesních proměnných na enkapsulační účinnost. Čes. slov. Farm. 2010; 59(2), 67–73.
46. Williams C., Panaccione R., Ghosh S., Rioux K. Optimizing clinical use of mesalazine (5-aminosalicylic acid) in inflammatory bowel disease. Therap. Adv. Gastroenterol. 2011; 4(4), 237–248.
47. Singh M. P., Alam G., Patel R. In vitro evaluation of polymeric beads of riboflavin formulated at different cross-linking time. Der Pharmacia Lettre. 2010; 2(4), 164–171.
48. Tungtong S., Okonogi S., Chowwanapoonpohn S., Phutdhawong W., Yotsawimonwat S. Solubility, viscosity and rheological properties of water - soluble chitosan derivatives. Maejo Int. J. Sci. Technol. 2012; 6(2), 315–322.
49. Barba A. A., Dalmoro A., D’Amore M., Lamberti G. Controlled release of drugs from microparticles produced by ultrasonic assisted atomization based on biocompatible polymers. Chem. Biochem. Eng. 2012; 26(4), 345–353.
Štítky
Farmácia Farmakológia
Článok vyšiel v časopiseČeská a slovenská farmacie

2014 Číslo 2-
Všetky články tohto čísla
- Doc. Mgr. Fils Andriamainty, PhD., ocenený SFS
- Vybrané přírodní fenolické látky jako potenciální léčba periferní neuropatie?
- Účinné látky dostupné jako substance pro magistraliter přípravu ve veterinární medicíně v České republice
- 41. mezinárodní kongres pro dějiny farmacie v Paříži
- Možnosti ovlivnění obsahu léčiva a enkapsulační účinnosti chitosanových mikrosfér připravených procesem iontové gelace
- Zdravotnícky a podnikateľský charakter lekárne
- Historie vývoje a výroby léčiv brněnské firmy Lachema
-
Pracovní den sekce technologie léků
České farmaceutické společnosti ČLS JEP
Pokroky v lékových formách
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Účinné látky dostupné jako substance pro magistraliter přípravu ve veterinární medicíně v České republice
- Historie vývoje a výroby léčiv brněnské firmy Lachema
- Doc. Mgr. Fils Andriamainty, PhD., ocenený SFS
- Možnosti ovlivnění obsahu léčiva a enkapsulační účinnosti chitosanových mikrosfér připravených procesem iontové gelace
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy







