-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Histopatologická diagnóza a diferenciálna diagnóza céliakie: prehľad pre gastroenterológov
Histopathological diagnosis and differential diagnosis of celiac disease: a review for gastroenterologists
Although morphological changes of celiac disease are considered typical, they are non-specific. The final diagnosis is clinico-pathological. Moreover, there are several unresolved issues in the morphology of celiac disease, namely the number of intraepithelial lymphocytes, villous to crypt ratio or biopsy site. This review aims to discuss these issues in the context of routine clinical practice.
Key words:
celiac disease – diagnosis – differential diagnosis – histopathology
Autoři: M. Švajdler Jr 1; P. Bohuš 2; B. Rychlý 3
Působiště autorů: Oddelenie patológie FN L. Pasteura, Košice2Cytolab s. r. o., Košice3Cytopathos s. r. o., Bratislava 1
Vyšlo v časopise: Gastroent Hepatol 2010; 64(3): 24-30
Kategorie: IBD: Aktuální přehled
Souhrn
Aj keď sú morfologické zmeny pri céliakii typické, sú nešpecifické a konečná diagnóza je klinickopatologická. V morfológii céliakie je stále viacero diskutabilných otázok týkajúcich sa najmä počtu intraepiteliálnych lymfocytov, pomeru výšky klkov a krýpt ako aj miesta odberu biopsie. Prehľad má za cieľ priblížiť túto problematiku v nevyhnutnej miere gastroenterológom diagnostikujúcim céliakiu v bežnej praxi.
Kľúčové slová:
céliakia – diagnóza – diferenciálna diagnóza – histopatológiaÚvod
Podobne ako mnohé iné tkanivá aj tenké črevo reaguje na rôznorodé inzulty limitovaným repertoárom morfologických zmien. Aj keď atrofia klkov a zmnoženie intraepiteliálnych lymfocytov (IEL) sú pre céliakiu typické a mnohými klinikmi považované za patognomické, tento nález je nešpecifický. Navyše v morfologickej diagnostike céliakie je stále viacero diskutabilných otázok týkajúcich sa najmä počtu IEL, pomeru výšky klkov a krýpt ako aj miesta odberu biopsie. Nasledujúci prehľad má za cieľ priblížiť túto problematiku v nevyhnutnej miere gastroenterológom diagnostikujúcim céliakiu v bežnej praxi.
Technické poznámky
Optimálne zhodnotenie gastrointestinálnej biopsie sa začína dobrou komunikáciou medzi endoskopistom a patológom. Na sprievodnom lístku by mala byť aspoň stručne uvedená anamnéza, endoskopický nález a výsledky serologického vyšetrenia, ak sú v čase biopsie k dispozícii [1]. Presný počet endoskopicky odobraných vzoriek potrebných na diagnostiku céliakie nie je určený. Americká gastroenterologická asociácia (AGA) odporúča odber minimálne troch vzoriek z distálneho duodéna [2], Severoamerická spoločnosť pre detskú gastroenterológiu, hepatológiu a výživu (NASPGHAN) odporúča „mnohopočetný” odber z distálnejších častí duodéna [3]. Vďaka zdokonaleniam v serologickej diagnostike a vyššej klinickej suspekcii je v súčasnosti diagnostikovaných čoraz viac pacientov, ktorí nemajú „klasické“ príznaky (hnačka, steatorea, váhový úbytok, únava, anémia) a majú podstatne miernejšiu klinickú manifestáciu (abdominálny diskomfort, nafukovanie), prípadne sú úplne bez ťažkostí [4,5]. V týchto prípadoch, alebo ak sú nižšie titre protilátok, sa dá predpokladať fokálne postihnutie sliznice, a preto by mal byť odber početnejší [1].
Aj keď je vo všeobecnosti odporúčané, aby endoskopista zorientoval biopsie na filtračnom papieri sliznicou smerom nahor, myslíme si, že to nie je nevyhnutné. Každá manipulácia so vzorkou totiž zvyšuje riziko vzniku artefaktov (rozdrvenie, denudácia epitelu). Skúsená histologická laborantka dokáže biopsiu pri zalievaní do parafínu správne zorientovať [1]. Nedostatočná veľkosť (minimálne 4 kontinuálne zachytené klky a krypty), zlá kvalita a nesprávna orientácia vzorky s nasledným tangenciálnym rezom môže aj v rukách skúseného gastrointestinálneho patológa viesť k nesprávnej diagnóze [6].
Histomorfológia neliečenej céliakie
Typický nález je charakterizovaný zmnožením intraepiteliálnych lymfocytov (IEL), hyperpláziou krýpt a atrofiou klkov. Stupeň týchto zmien však môže byť veľmi variabilný – od architektonicky normálnej sliznice so zmnoženými IEL, až po totálnu atrofiu a kryptálnu hyperpláziu [7]. Tradične je popisované najťažšie postihnutie sliznice orálnej časti tenkého čreva s miernejšími zmenami aborálne. Klinické symptómy nie sú závislé od histologického stupňa poškodenia sliznice, ale od celkového rozsahu (dľžky poškodenej sliznice). Kompenzované mierne poškodenie dostatočne dlhého segmentu čreva sa môže klinicky prejaviť až pri dodatočnom inzulte (napr. infekcia, ischémia, skrátenie čreva) [7,8].
Zvýšenie počtu IEL je považované za najkonzistentnejšiu a najvčasnejšiu zmenu (obr. 1) [7]. V súčasnosti používaná horná hranica normálneho počtu IEL v sliznici tenkého čreva je 40 IEL na 100 epiteliálnych buniek (EB). Táto hodnota však bola odvodená v sedemdesiatych rokoch z biopsií jejúna [9]. Neskôr stanovený limit pre sliznicu duodéna je 20–25 IEL [10–12]. Tieto o veľa nižšie normálne hodnoty sú však v praxi ako aj v publikovanej literatúre stále nepochopiteľne ignorované.
Obr. 1. Infiltratívne štádium (Marsh-Oberhuber 1). Sliznica duodéna so zachovanou architektonikou, kryptovilózny pomer je 1 : 4 až 1 : 5. Zmnoženie intraepiteliálnych lymfocytov. Hematoxylín-eozín, x 200. Fig. 1. Infiltrative stage (Marsh-Oberhuber 1). The architectonics of the duodenum mucous membrane is sustained; the crypt to villous ratio is 1 : 4 to 1 : 5. The proliferation of intraepithelial lymphocytes. Hematoxylin-eosin, x 200. 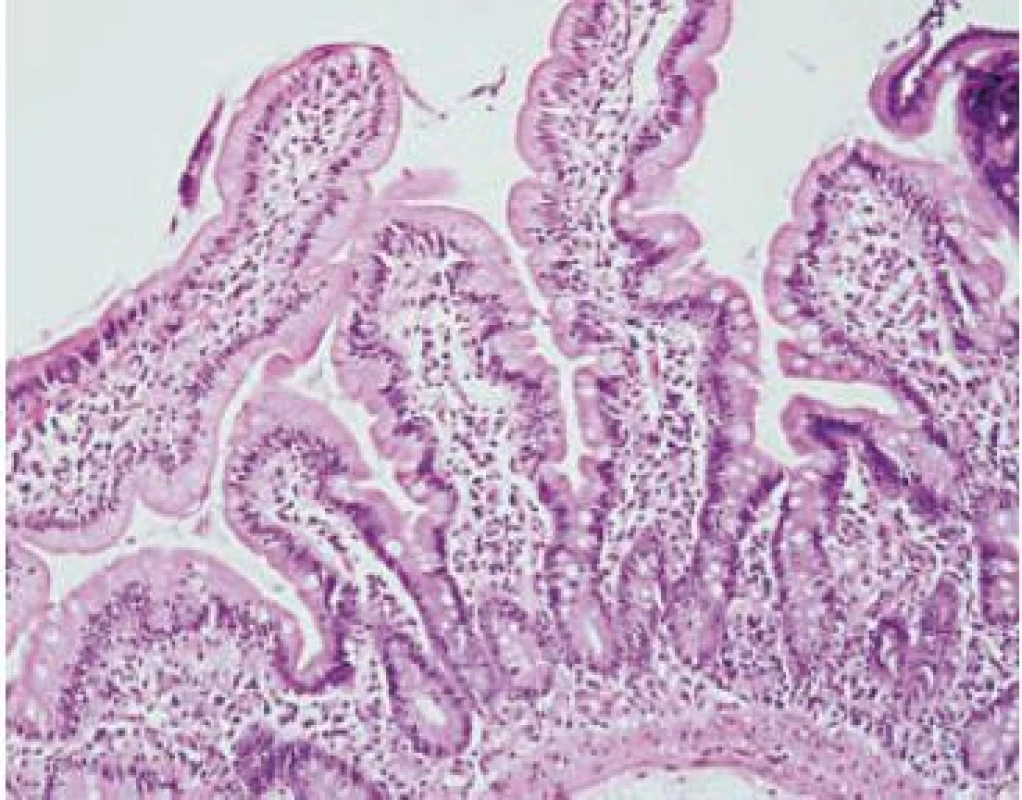
Formálne počítanie IEL v 100 až 1 000 EB je časovo veľmi náročné a v rutínnej diagnostike nepraktické. Rýchlejšou skríningovou metódou môže byť počítanie IEL na 20 EB v špičke piatich klkov [12,13]. Citlivou skríningovou metódou je posúdenie straty normálneho „decrescendo” vzoru rozloženia IEL. V normálnej sliznici počet IEL klesá od bázy klku smerom k špičke („decrescendo” vzor). Pri céliakii je tento vzor narušený a IEL sú rovnomerne rozložené po celej dľžke klku [14]. Na presné zhodnotenie počtu a distribúcie IEL možno v hraničných prípadoch použiť imunohistochemickú detekciu IEL pomocou protilátky anti-CD3. Vysoký počet CD3+ IEL v špičke klkov a pomer počtu IEL v špičke klkov ku počtu IEL bázy klkov > 1,7 je sugestívny pre diagnózu céliakie [15]. Pre bežnú prax je takáto metodika pre svoju náročnosť nevhodná.
Kryptálna hyperplázia predchádza atrofii klkov [7]. Výsledkom hyperplázie je, že napriek atrofii klkov sa celková výška sliznice podstatnejšie nemení. Krypty obsahujú prekurzorové pluripotentné bunky, ktoré sú zdrojom enterocytov a pohárikovitých buniek pri obnove sliznice [8]. Pri neliečenej céliakii je rastová frakcia buniek v kryptách meraná imunohistochemicky pomocou protilátky MIB-1 (detekujúcej antigén proliferujúcich buniek Ki-67) signifikantne vyššia ako pri liečenej céliakii alebo u zdravých kontrol [16]. O použití imunohistochémie s protilátkou detekujúcou Ki-67 však platí rovnaké konštatovanie ako v prípade detekcie IEL pomocou anti-CD3 protilátky.
Atrofia klkov je považovaná za najtypickejší znak céliakie. Normálny pomer výšky klkov k hľbke krýpt je však ešte stále predmetom sporov. Sú udávané hodnoty 3–5 : 1 až 1,2–2,46 : 1 [10,17]. U detí je udávaná hodnota 2,5 : 1 a viac [18]. Vzhľadom na chýbanie jednoznačných referenčných hodnôt ako aj metodického odporúčania týkajúceho sa spôsobu hodnotenia (odhadom patológa alebo presnejšími morfometrickými metódami) je nutné považovať hodnotenie atrofie klkov, predovšetkým miernejšieho stupňa, za vyslovene subjektívne.
Ďalšími zmenami popisovanými pri céliakii, avšak s limitovaným diagnostickým významom sú znížená výška entrocytov [16], pyknóza a strata bazálnej orientácie jadier enterocytov s pseudostratifikáciou, zníženie počtu pohárikovitých buniek, redukcia výšky mikroklkov [3,8], zmnoženie chronického zápalového infiltrátu v lamina propria (najmä plazmatických buniek a eozinofilov) a sporadická prímes neutrofilných granulocytov.
Histomorfológia liečenej céliakie
Klinická odpoveď na bezlepkovú diétu je vo väčšine prípadov rýchla (dni až týždne). V starších i celkom nových štúdiách bolo dokázané, že u detí i dospelých úprava histologického nálezu trvá mnoho mesiacov a nie u všetkých pacientov dôjde k úplnej normalizácii [19–21]. Aj pri dobrej spolupráci pacientov, klinickej remisii a negativite protilátok má po priemernej dobe dva roky iba približne 74 % detských pacientov a iba 17,5 % dospelých pacientov histologicky normálnu sliznicu. Zvyšní pacienti majú zvýšený počet IEL alebo miernu atrofiu klkov [21]. Serologické markery céliakie majú nízku negatívnu prediktívnu hodnotu v predpovedaní morfológie čreva pri bezlepkovej diéte. V štúdii 87 dospelých pacientov na bezlepkovej diéte malo 27 pacientov atrofiu klkov (Marsh Typ 3), pričom protilátky proti tkanivovej transglutamináze boli negatívne až u 16 z nich (59 %) [22]. Význam pretrvávajúcich histologických zmien počas bezlepkovej diéty v súčasnosti nie je známy. Remisia céliakie je oproti minulosti definovaná skôr na klinickom podklade – vymiznutie symptómov a normalizácia laboratórnych parametrov. AGA vo svojich odporúčaniach uvádza, že „po 3–4 mesiacoch bezlepkovej diéty môže byť zopakovaná biopsia tenkého čreva na dôkaz zlepšenia morfológie” [2]. NASPGHAN opakovanú biopsiu neodporúča [3]. Ak však napriek diéte nedôjde k zlepšeniu symptómov alebo sú pochybnosti o správnosti diagnózy, opakovaná biopsia je potrebná na vylúčenie inej príčiny ťažkostí, prípadne môže byť nevyhnutná rebiopsia po diéte obsahujúcej glutén (gluténová výzva – „gluten challenge”) [2,3].
Klasifikácia
Tak ako sa klinicky céliakia prejavuje celou škálou symptómov, aj histomorfologické prejavy céliakie predstavujú dynamické spektrum zmien. Niektorí pacienti s geneticky, serologicky a klinicky dokázanou céliakiou majú iba mierny histologický nález. Na základe týchto skutočností Marsh navrhol štvorstupňovú klasifikáciu: typ 0 – preinfiltratívny, s normálnou architektúrou a normálnym počtom IEL (< 40 IEL/100 EB), typ 1 – infiltratívny, s normálnou architektúrou a > 40 IEL (obr. 1), typ 2 – hyperplastický, s kryptálnou hyperpláziou a > 40 IEL, typ 3 – deštruktívny, s atrofiou klkov, hyperpláziou krýpt a > 40 IEL a typ 4 – hypoplastický, s atrofiou klkov a normálnou hľbkou krýpt a normálnym počtom IEL [23,24]. Oberhuber et al neskôr túto klasifikáciu modifikovali a vytvorili v súčasnosti najpoužívanejšiu schému (tab. 1). Typ 3 ďalej rozdelili na 3a – mierna atrofia klkov (obr. 2), 3b – výrazná atrofia klkov a 3c – totálna atrofia klkov s vyhladenou sliznicou (obr. 3) [25]. Najväčším prínosom tejto klasifikácie je pokrytie celého spektra morfologickej prezentácie céliakie, vrátane iniciálneho infiltratívneho štádia. Je ale potrebné zdôrazniť, že Marsh-Oberhuberova klasifikácia používa ako hranicu zmnoženia IEL 40 lymfocytov na 100 EB. Vo svetle výsledkov novších štúdií (viď vyššie) je v praxi vhodné znížiť túto hranicu na 25 IEL na 100 EB.
Obr. 2. Výrazná kryptálna hyperplázia a mierna atrofia klkov (Marsh-Oberhuber 3a). Krypto-vilózny pomer je približne 1 : 1. Hematoxylín-eozín, x 200. Fig. 2. Significant crypt hyperplasia and mild villous atrophy (March-Oberhuber 3a). The crypt to villous ratio is about 1 : 1. Hematoxylin-eosin, x 200. 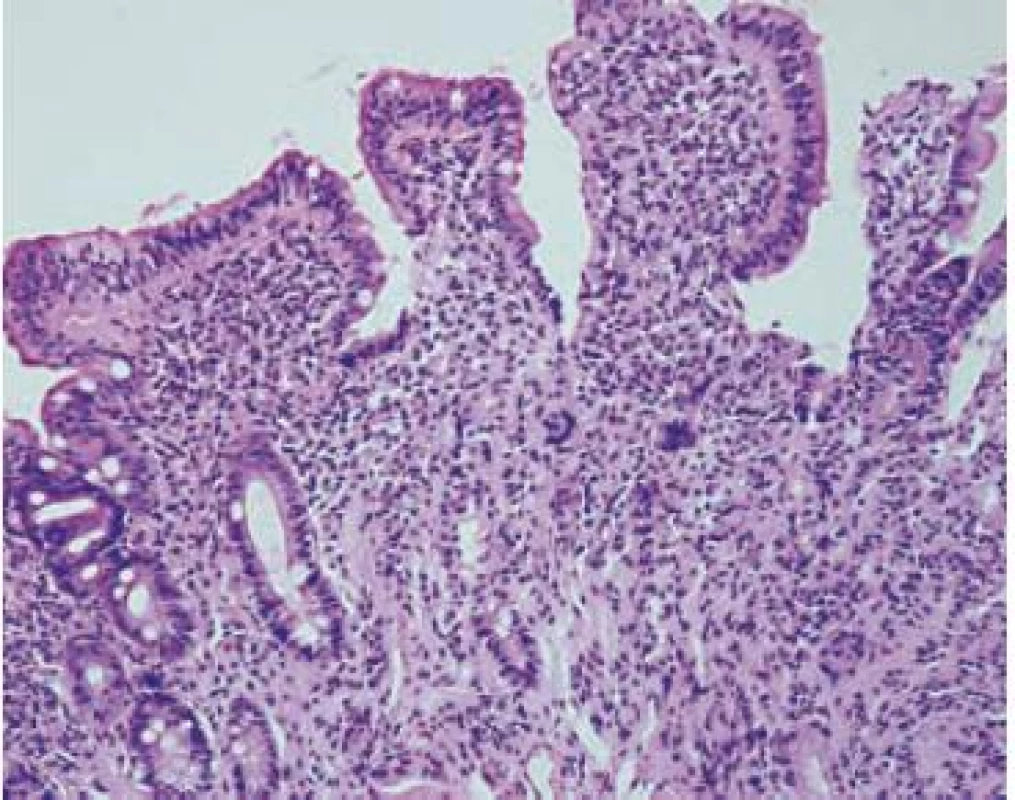
Tab. 1. Porovnanie Marsh-Oberhuberovej klasifikácie [25] a klasifikácie Corazzu et al [26]. Tab. 1. A comparison of the Marsh-Oberhuber classification [25] with the classification of Corraza and others [26]. ![Porovnanie Marsh-Oberhuberovej klasifikácie [25] a klasifikácie Corazzu et al [26].
Tab. 1. A comparison of the Marsh-Oberhuber classification [25] with the classification of Corraza and others [26].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c3b8bf490c92e72e685ae1d71dc1d0c6.jpeg)
Obr. 3. Totálna atrofia klkov (Marsh-Oberhuber 3c), sliznica je v celej výške tvorená hyperplastickými kryptami. Hematoxylín-eozín, x 200. Fig. 3. Total villous atrophy (Marsh-Oberhuber 3c); the mucous membrane consists of full-height hyperplastic crypt; Hematoxylin-eosin, x 200. 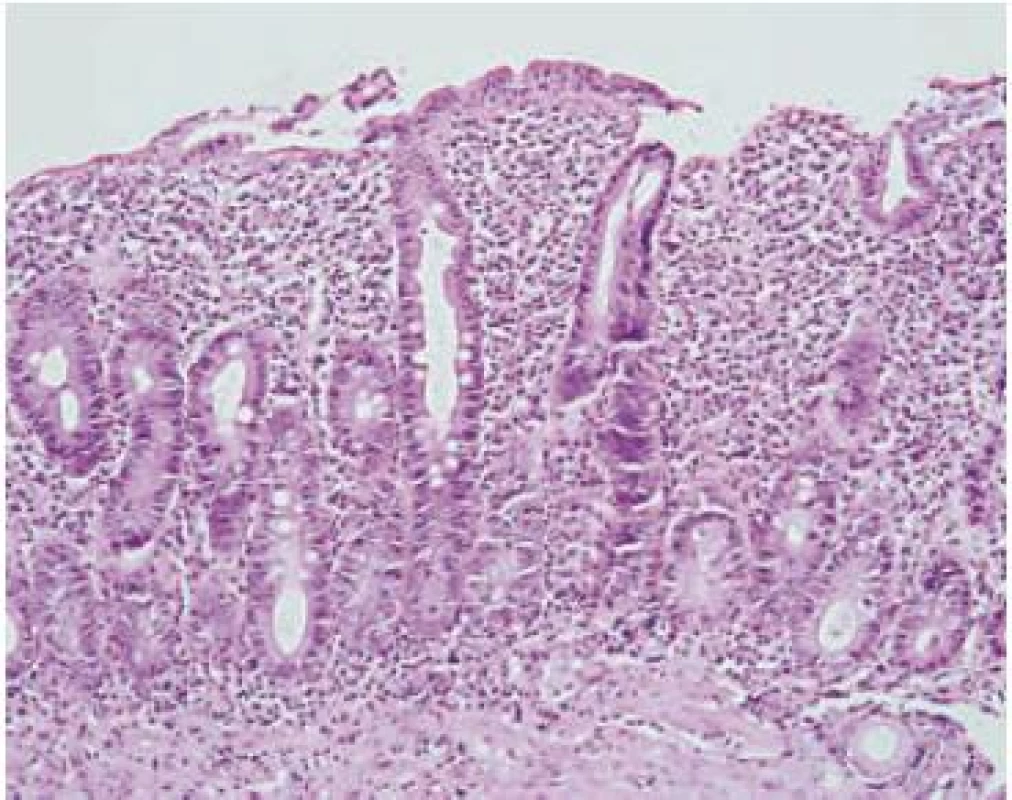
Všeobecne platí, že čím je vyšší počet diagnostických kategórií, tým nižšia je „interobserver” a „intraobserver” zhoda. Corazza et al preto navrhli zjednodušenie Marsh-Oberhuberovej klasifikácie [26]. Lézie typu 1 a typu 2 spojili do kategórie Grade A. Pacienti v oboch kategóriách starej klasifikácie sú identifikovaní podľa zvýšeného počtu IEL a v biopsiách sa iba zriedka nájde lézia typu 2 (izolovaná hyperplázia krýpt). Pretože hodnotenie menšieho stupňa atrofie klkov je veľmi slabo reprodukovateľné, spojili lézie typu 3a a 3b do novej kategórie Grade B1. Lézia typu 3c bola analogicky premenovaná na B2. Keďže lézia typu 4 sa dnes zdá byť obsolentná – väčšina týchto pacientov má v epiteli monoklonálnu proliferáciu lymfocytov a klinicky sa manifestuje ako refraktérna sprue, bola táto kategória zrušená (tab. 1) [26].
Aj keď bioptické nálezy kompatibilné s céliakiou v našej praxi bežne klasifikujeme (Marsh-Oberhuber), aj vzhľadom na chýbanie korelácie s klinikou a problémy s reprodukovateľnosťou je nutné tento grading zmien považovať iba za doplnok k diagnóze.
U detských pacientov alternatívny spôsob gradingu vilóznej atrofie navrhli Drut et al (tab. 2) [18]. Podľa týchto autorov prípady s konečnou diagnózou céliakie majú vždy zmeny Grade 3 alebo Grade 4 a liečba bezlepkovou diétou vždy znamená návrat k norme alebo Grade 1. Grade 2 zmeny boli zaznamenané iba pri nedôslednej diéte. Dôležitým zistením týchto autorov je, že nikdy nezaznamenali v literatúre tradične popisovanú fokalitu zmien ani prípad s iniciálne normálnou histológiou a neskoršími abnormalitami Grade 3 alebo 4 [18]. Keďže v tejto práci išlo vždy o symptomatických pacientov (malabsorpcia), vykonali neskôr štúdiu na súbore 10 pacientov s pozitívnymi protilátkami, ale klinicky bez malabsorpcie alebo rastovej retardácie (vyšetrovaní mali diabetes mellitus 1. typu alebo boli príbuzní pacientov s céliakiou) [27]. Biopsie boli odobraté oddelene z proximálneho duodéna (prvej a druhej časti duodéna) a distálneho duodéna (tretej a štvrtej časti duodéna). Sliznica z proximálneho duodéna bola vždy výrazne atrofická (Grade 3 alebo 4), zatiaľ čo sliznica distálneho duodéna bola normálna alebo takmer normálna. Z uvedených prác vyplýva, že serologicky dokázané protilátky sú u detí vždy asociované s atrofiou klkov (Grade 3 alebo 4). U symptomatických pacientov sú prítomné zmeny vždy v distálnom duodéne (dlhší segment postihnutého čreva), zatiaľ čo asymptomatickí pacienti majú zmeny limitované na proximálnejšie časti duodéna. Bioptický odber u asymptomatických pacientov zachytených serologickým skríningom by teda, napriek všetkým v súčasnosti platným odporúčaniam, mal zahŕňať i proximálne duodénum.
Tab. 2. Grading atrofie klkov podľa Druta [18]. Tab. 2. Grading of villous atrophy according to Drut [18]. ![Grading atrofie klkov podľa Druta [18].
Tab. 2. Grading of villous atrophy according to Drut [18].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/baa41afed0af14060825eeb7e4599b7a.jpeg)
normálny pomer klkov a krýpt je viac ako 2,5 Diagnóza
Na tomto mieste je opäť vhodné zdôrazniť, že aj keď sú atrofia klkov a zmnoženie IEL pre céliakiu typické, ide o nešpecifické zmeny. Konečná diagnóza céliakie je klinicko-patologická a spoľahlivé odlíšenie céliakie od lézií uvádzaných v nasledujúcom (určite nie kompletnom) prehľade je niekedy možné iba vyšetrením protilátok (tab. 3). Definitívna diagnóza je pri typickej morfológii, pozitivite protilátok a typickom HLA fenotype potvrdená zmiernením symptomatológie po bezlepkovej diéte.
Tab. 3. Histologická diferenciálna diagnostika céliakie. Tab. 3. Histological differential diagnostics of celiac disease. 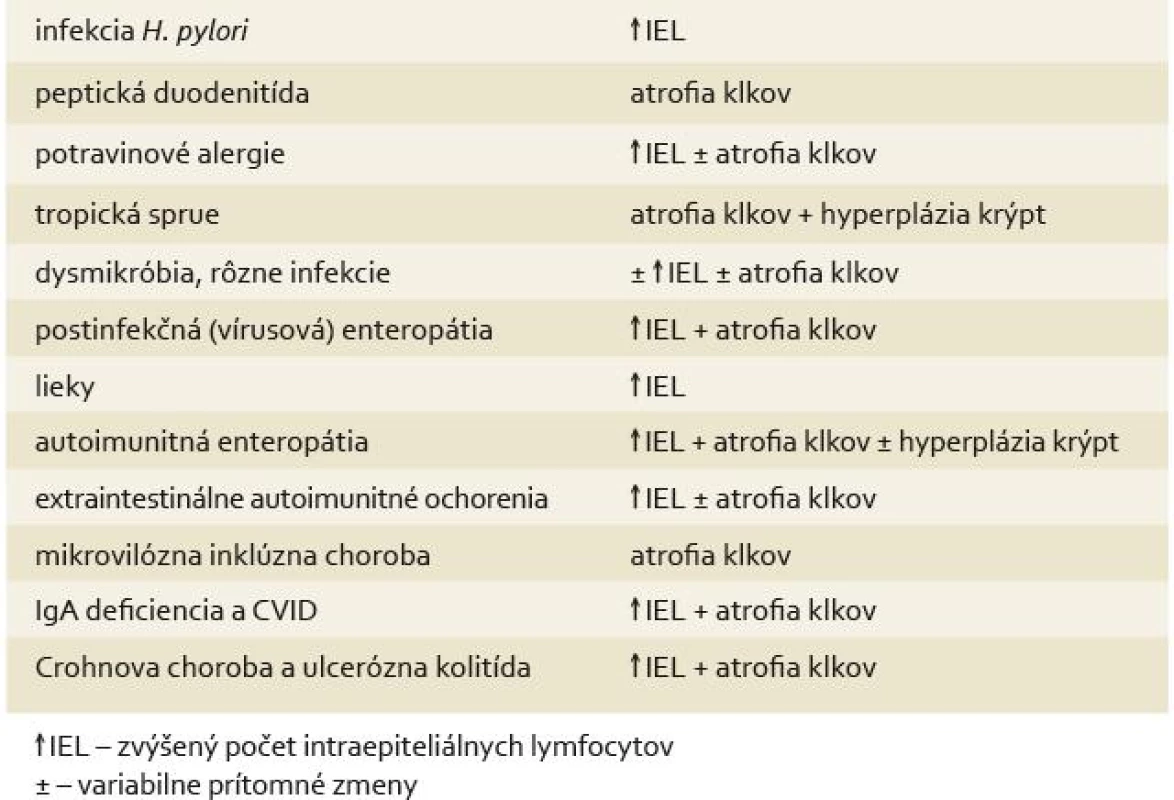
Histologická diferenciálna diagnóza
Zvýšený počet IEL v architektonicky normálnej sliznici duodéna môže byť asociovaný s infekciou H. pylori. Ide pravdepodobne o neprimeranú imunitnú odpoveď na antigény H. pylori. Po eradikácii infekcie dochádza k poklesu počtu IEL [28].
Peptická duodenitída charakterizovaná akútnym zápalovým infiltrátom, eróziami, edémom, gastrickou metapláziou a variabilnými zmenami architektoniky až po plochú sliznicu môže byť vzácne zachytená aj v distálnom duodéne. Nález peptickej duodenitídy v distálnej (ale aj proximálnej) časti duodéna by však pri pozitivite protilátok a klinickej suspekcii céliakie nemal odviesť patológa od správnej diagnózy. Podľa Leonarda et al až 92 % pacientov z diagnózou peptickej duodenitídy v distálnom duodéne malo retrospektívne stanovenú diagnózu céliakie. Céliakiu od peptickej duodenitídy v týchto prípadoch odlišoval zýšený počet IEL [29,30].
Iné potravinové alergie sú tiež asociované so zmnoženým počtom IEL. Podobne ako pri céliakii sú zmnožené cytotoxické T-lymfocyty [31]. Z ďalších histologických zmien je často popisované zmnoženie eozinofilov, edém, erózie a parciálna atrofia klkov [1].
Tropická sprue je endemické ochorenie (Stredná Amerika, Západná Afrika, India a Juhovýchodná Ázia) postihujúce domácu populáciu ako aj cestovateľov. Histologické zmeny sú veľmi podobné céliakii, aj keď úplná atrofia klkov je skôr výnimkou. Na rozdiel od céliakie histologické zmeny postihujú rovnako celé tenké črevo. Symptómy zvyčajne rýchlo vymiznú po liečbe širokospektrálnymi antibiotikami [32].
Aj ďalšie infekcie spôsobujú céliakii viac alebo menej podobné lézie sliznice. Infekcia Strongyloides stercoralis môže spôsobiť výraznú atrofiu klkov [18]. Infekcia parazitom Giardia lamblia vo väčšine prípadov nespôsobuje výraznejšie abnormality sliznice, niekedy však môže byť prítomná mierna až totálna atrofia klkov [32,33]. Akékoľvek narušenie normálnej bakteriálnej flóry tenkého čreva môže viesť k histologickým zmenám podobným céliakii, aj keď väčšinou miernejším a fokálnym [32,34]. U detí i dospelých po vírusovej gastroenteritíde s dlhšie trvajúcimi hnačkami s pomalou úpravou počas viacerých týždňov až mesiacov sú dobre zdokumentované histologické zmeny sliznice tenkého čreva neodlíšiteľné od céliakie [14].
Zmnoženie intraepiteliálnych lymfocytov v architektonicky normálnej sliznici môže byť asociované s liečbou nesteroidnými antiflogistikami alebo inhibítormi protónovej pumpy [34].
Céliakii je podobná i autoimunitná enteropátia. Ide o vzácne ochorenie prejavujúce sa klinicky nezvládateľnou hnačkou. U pacientov sa v sére dokážu protilátky proti enterocytom a ochorenie reaguje na imunosupresívnu liečbu. Histologicky je autoimunitná enteropátia charakterizovaná subtotálnou až totálnou atrofiou klkov s normálnymi alebo mierne hyperplastickými kryptami. Typická je deplécia mucinóznych, endokrinných a Panethovych buniek a lymfocytárna infiltrácia epitelu krýpt. V kryptách sú unicelulárne nekrózy pripomínajúce graft versus host disease [32,35].
Zvýšený počet IEL s variabilnou atrofiou klkov je uvádzaný pri viacerých extraintestinálnych autoimunitných ochoreniach: Hashimotova tyroiditída, Gravesova choroba, reumatoidná artritída, psoriáza, roztrúsená skleróza, systémový lupus erythematosus, ankylozujúca spondylitída [34].
Difúzna atrofia klkov je charakteristická aj pre mikrovilóznu inklúznu chorobu (kongenitálna, resp. familiárna mikrovilózna atrofia). Ide o špecifickú poruchu kefkovitého lemu enterocytov, ktorá vedie k nezvládnuteľnej hnačke u novorodencov. Život týchto pacientov je závislý od totálnej parenterálnej výživy. Jedinou potencionálnou liečebnou možnosťou je kombinovaná transplantácia tenkého čreva a pečene. Na rozdiel od céliakie nie je prítomný zápal lamina propria. Diagnóza je možná pomocou elektrónovej mikroskópie alebo imunohistochemickou detekciou aberantnej expresie CD10, alkalickej fosfatázy a polyklonálneho karcinoembryonálneho antigénu v cytoplazme enterocytov [36].
Zmeny neodlíšiteľné od céliakie kombinované s ťažkou malabsorpciou nereagujúcou na bezlepkovú diétu majú aj niektorí pacienti s deficienciou IgA a bežnou variabilnou imunodeficienciou (CVID). Na rozdiel od céliakie zápalový infiltrát lamina propria nie je až taký výrazný a typické je chýbanie alebo podstatné zníženie počtu plazmatických buniek. Diagnostickým vodítkom môže byť často asociovaná infekcia (napr. Giardia lamblia) a nodulárna lymfoidná hyperplázia [37].
Do diferenciálnej diagnózy pacienta s malabsorpciou je potrebné zahrnúť aj idiopatické zápaly čreva – Crohnovu chorobu a ulceróznu kolitídu. Diagnóza Crohnovej choroby zachytenej v biopsii vo florídnom štádiu by nemala robiť väčšie ťažkosti. Vo včasnom (preaktívnom) štádiu je však jedinou histologickou abnormalitou zvýšený počet IEL. U žiadneho pacienta s takouto iniciálnou prezentáciou Crohnovej choroby nebola neskôr patológom suponovaná diagnóza céliakie potvrdená [14]. Prítomnosť zápalových zmien v gastrointestinálnom trakte mimo sliznicu hrubého čreva bola až donedávna považovaná za presvedčivý dôkaz Crohnovej choroby. U niektorých pacientov s ulceróznou kolitídou však bola popísaná difúzna duodenitída s difúznym chronickým zápalom a narušením architektoniky sliznice. Vetvenie krýpt a ich atrofia spolu s kryptitídou a kryptálnymi pseudoabscesmi by mali viesť k správnej diagnóze [38].
Záver
Histomorfologické zmeny pri céliakii sú nešpecifické a patológ bez dostatočných klinických údajov nemôže (a ani nesmie) takúto diagnózu urobiť. Aj keď sa ani zďaleka nejedná o novú chorobnú jednotku, je zrejmé, že existuje množstvo nevyriešených otázok týkajúcich sa jej morfologickej diagnostiky. Definitívna diagnóza je v rukách klinika, ktorý má k dispozícii výsledky klinických a laboratórnych vyšetrení spolu s bioptickým vyšetrením. V prípade, že nie je morfologický nález v zhode s klinickým obrazom a podozrenie na céliakiu pretrváva, je podľa nášho názoru na mieste obrátiť sa na patológa s otázkou, aké diagnostické kritéria používa. Znížením diagnostického prahu zo 40 IEL na 25 IEL je možné odhaliť množstvo pacientov s tzv. latentnou a silentnou céliakiou. V oblasti morfologickej diagnostiky céliakie je v budúcnosti potrebné jednoznačnejšie stanoviť diagnostické kritériá.
prim. MUDr. Marián Švajdler Jr
Oddelenie patológie FN LP Košice
Trieda SNP1, 041 66 Košice
svajdler@yahoo.com
Zdroje
1. Lowichik A, Book L. Pediatric celiac disease: clinicopathologic and genetic aspects. Pediatr Dev Pathol 2003; 6(6): 470–483.
2. Ciclitira PJ. AGA Technical review on celiac sprue. Gastroenterology 2001; 120(6): 1526–1540.
3. Hill ID, Dirks MH, Liptak GS et al. Guideline for the Diagnosis and Treatment of Celiac Disease in Children: Recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2005; 40(1): 1–19.
4. Ravikumara M, Tuthill DP, Jenkins HR. The changing clinical presentation of coeliac disease. Arch Dis Child 2006; 91(12): 969–971.
5. van Heel DA, West J. Recent advances in coeliac disease. Gut 2006; 55(7): 1037–1046.
6. Shidrawi RG, Przemioslo R, Davies DR et al. Pitfalls in diagnosing coeliac disease. J Clin Pathol 1994; 47(8): 693–694.
7. Marsh MN, Crowe PT. Morphology of the mucosal lesion in gluten sensitivity. Baillieres Clin Gastroenterol 1995; 9(2): 273–293.
8. Dickson BC, Streutker CJ, Chetty R. Coeliac disease: an update for pathologists. J Clin Pathol 2006; 59(10): 1008–1016.
9. Ferguson A, Murray D. Quantitation of intraepithelial lymphocytes in human jejunum. Gut 1971; 12(12): 988–94.
10. Hayat M, Cairns A, Dixon MF et al. Quantitation of intraepithelial lymphocytes in human duodenum: what is normal? J Clin Pathol 2002; 55(5): 393–394.
11. Mahadeva S, Wyatt JI, Howdle PD. Is a raised intraepithelial lymphocyte count with normal duodenal villous architecture clinically relevant? J Clin Pathol 2002; 55(6): 424–428.
12. Biagi F, Luinetti O, Campanella J et al. Intraepithelial lymphocytes in the villous tip: do they indicate potential coeliac disease? J Clin Pathol 2004; 57(8): 835–839.
13. Goldstein NS, Underhill J. Morphologic features suggestive of gluten sensitivity in architecturally normal duodenal biopsy specimens. Am J Clin Pathol 2001; 116(1): 63–71.
14. Goldstein NS. Proximal small-bowel mucosal villous intraepithelial lymphocytes. Histopathology 2004; 44(3): 199–205.
15. Mino M, Lauwers GY Role of Lymphocytic immunophenotyping in the diagnosis of gluten-sensitive enteropathy with Preserved villous architecture. Am J Surg Pathol 2003; 27(9): 1237–1242.
16. Przemioslo R, Wright NA, Elia G et al. Analysis of crypt cell proliferation in coeliac disease using MI-B 1 antibody shows an increase in growth fraction. Gut 1995; 36 : 22–27.
17. Segal GH, Petras RE. Small intestine. In: Sternberg SS, ed. Histology for pathologists. New York, Raven Press 1992 : 547–572.
18. Drut R, CuetoRúa E. The histopathology of pediatric celiac disease: order must prevail out of chaos. Int J Surg Pathol 2001; 9(4): 261–264.
19. Rosekrans PC, Meijer CJ, Polanco I et al. Long-term morphological and immunohistochemical observations on biopsy specimens of small intestine from children with gluten-sensitive enteropathy. J Clin Pathol 1981; 34(2): 138–144.
20. Grefte JM, Bouman JG, Grond J et al. Slow and incomplete histological and functional recovery in adult gluten sensitive enteropathy. J Clin Pathol 1988; 41(8): 886–891.
21. Bardella MT, Velio P, Cesana BM et al. Coeliac disease: a histological follow-up study. Histopathology 2007; 50(4): 465–471.
22. Kaukinen K, Sulkanen S, Maki M et al. IgA class transglutaminase antibodies in evaluating the efficacy of gluten-free diet in coeliac disease. Eur J Gastroenterol Hepatol 2002; 14(3): 311–315.
23. Marsh MN. Grains of truth: evolutionary changes in small intestinal mucosa in response to environmental antigen challenge. Gut 1990; 31(1): 111–114.
24. Marsh MN. Gluten, major histocompatibility complex and the small intestine. A molecular and immunobiologic approach to the spectrum of gluten sensitivity (celiac sprue). Gastroenterology 1992; 102(1): 330–354.
25. Oberhuber G, Granditsch G, Vogelsang H. The histopathology of coeliac disease: time for a standardized report scheme for pathologists. Eur J Gastroenterol Hepatol 1999; 11(10): 1185–1194.
26. Corazza GR, Villanacci V. Coeliac disease. J Clin Pathol 2005; 58(6): 573–574.
27. Drut R, Rúa EC. Histopathologic diagnosis of celiac disease in children without clinical evidence of malabsorption. Int J Surg Pathol 2007; 15(4): 354–357.
28. Nahon S, Patey-Mariaud De Serre N, Lejeune O et al. Duodenal intraepithelial lymphocytosis during Helicobacter pylori infection is reduced by antibiotic treatment. Histopathology 2006; 48(4): 417–423.
29. Jeffers MD, Hourihane DO‘B. Coeliac disease with histological features of peptic duodenitis: Value of assessment of intraepithelial lymphocytes. J Clin Pathol 1993; 46(5): 420–424.
30. Leonard N, Feighery CF, Hourihane DO‘B. Peptic duodenitis-does it exist in the second part of the duodenum? J Clin Pathol 1997; 50(1): 54–58.
31. Augustin M, Karttunen T, Kokkonen J. TIA1 and mast cell tryptase in food allergy of children: increase of intraepithelial lymphocytes expresing TIA1 associates with allergy. J Pediatr Gastroenterol Nutr 2001; 32(1): 11–18.
32. Owens SR, Greenson JK. The pathology of malabsorption: current concepts. Histopathology 2007; 50(1): 64–82.
33. Oberhuber G, Stolte M. Giardiasis: analysis of histological changes in biopsy specimens of 80 patients. J Clin Pathol 1990; 43(8): 641–643.
34. Brown I, Mino-Kenudson M, Deshpande V et al. Intraepithelial lymphocytosis in architecturally preserved proximal small intestinal mucosa. An increasing diagnostic problem with a wide differential diagnosis. Arch Pathol Lab Med 2006; 130(7): 1020–1025.
35. Russo PA, Brochu P, Seidman EG et al. Autoimmune enteropathy. Pediatr Dev Pathol 1999; 2(1): 65–71.
36. Groisman GM, Amar M, Livne E. CD10. A valuable tool for the light microscopic diagnosis of microvillous inclusion disease (familial microvillous atrophy). Am J Surg Pathol 2002; 26(7): 902–907.
37. Washington K. Immunodeficiency disorders of the GI tract. In: Odze R, Goldblum J, Crawford J. Surgical pathology of the GI tract, liver, biliary tract, and pancreas, Philadelphia, Saunders 2003, 57–72.
38. Valdez R, Appelman HD, Bronner MP et al. Diffuse duodenitis associated with ulcerative colitis. Am J Surg Pathol 2000; 24(10): 1407–1413.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Pokyny pro autoryČlánek Instructions for Authors
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2010 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Endoskopické řešení stenózy hepatikojejunoanastomózy pomocí jednobalonkového enteroskopu zavedeného do Roux kličky
- Gastroprotekcia pri dlhodobom užívaní nesteroidných antireumatík, resp. nízkych dávok kyseliny acetylosalicylovej
- Histopatologická diagnóza a diferenciálna diagnóza céliakie: prehľad pre gastroenterológov
- Rifaximin v terapii Crohnovy nemoci. Výsledky studie GRACE 02
-
Karel Lukáš, Aleš Žák et al.: Chorobné příznaky a znaky.
Praha: Grada 2010. 520 stran. - VI. jarní diskuzní gastroenterologické dny, Kaprun
- Preventívna vakcinácia proti hereditárnemu nepolypóznemu kolorektálnemu karcinómu?
- Radiofrekvenční ablace Barrettova jícnu s dysplazií: Jak dlouho necháme naše pacienty čekat?
- Pokyny pro autory
- Instructions for Authors
- Zamyšlení, spíše povzdech nad několika kongresy a jejich souvislostmi
- Role protilátek anti-Saccharomyces cerevisiae v časné diagnostice Crohnovy choroby
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Role protilátek anti-Saccharomyces cerevisiae v časné diagnostice Crohnovy choroby
- Endoskopické řešení stenózy hepatikojejunoanastomózy pomocí jednobalonkového enteroskopu zavedeného do Roux kličky
- Histopatologická diagnóza a diferenciálna diagnóza céliakie: prehľad pre gastroenterológov
- Gastroprotekcia pri dlhodobom užívaní nesteroidných antireumatík, resp. nízkych dávok kyseliny acetylosalicylovej
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



