-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Etiopatogeneze chronické pankreatitidy
Etiopathogenesis of chronic pancreatitis
Chronic pancreatitis is a progressive inflammatory disease, which leads to destruction of pancreatic parenchyma and its replacement with fibrotic tissue. Subsequently it is associated with exogenous and later endogenous alteration of pancreatic function. The most prevalent cause of chronic pancreatitis in western countries is alcohol overconsumption. However, etiology of the disease of most patients is multi-factorial and the disease is a result of combined actions of genetic, metabolical factors and also of the influence of external environment. Former theories explaining mechanisms of genesis of chronic pancreatitis as an effect of toxins, metabolites, oxidative stress, obstruction or necrosis, are supported by many observations, but they are also partially inconsistent. Recently, there has been a major advance in the understanding of the genetic predisposition of chronic pancreatitis. Mutations causing alteration in regulation of trypsin activity or secretion of ductal cells contributes to the origin of chronic pancreatitis and modify the course of the disease. Newer SAPE hypothesis links knowledge of previous theories into a step-wise model of chronic pancreatitis origin. Pathogenesis, similarly to etiology, is probably complex with involvement of various pathogenetic mechanisms, depending on the cause. A key moment in understanding the disease pathogenesis was the characterization of pancreatic stellate cells as effector elements of fibrogenesis. They represent central cells, which activate themselves and create fibrotic tissue as a response to different pathological events. Better understanding of pathogenetic mechanisms of chronic pancreatitis gives hope for new causal modalities for treatment.
Key words:
chronic pancreatitis – etiology – pathogenesis – pancreatic stellate cell – SAPE hypothesis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
26. 7. 2013Accepted:
12. 8. 2013
Autoři: Mačinga; J. Špičák; T. Hucl
Působiště autorů: Klinika hepatogastroenterologie, IKEM, Praha
Vyšlo v časopise: Gastroent Hepatol 2013; 67(4): 275-288
Kategorie: Klinická a experimentální gastroenterologie: přehledová práce
Souhrn
Chronická pankreatitida je progresivní zánětlivé onemocnění, které vede k destrukci parenchymu pankreatu a jeho náhradě vazivem s následnou alterací exogenní a později i endogenní funkce slinivky břišní. Nejčastější příčinou chronické pankreatitidy ve vyspělých zemích je konzumace alkoholu, u většiny pacientů je však etiologie multifaktoriální a onemocnění vzniká následkem působení kombinace faktorů genetických, metabolických a vnějšího prostředí. Původní teorie vysvětlující mechanizmus vzniku chronické pankreatitidy v důsledku působení toxinů a metabolitů, oxidativního stresu, obstrukce či nekrózy jsou podložené řadou pozorování, avšak částečně rozporuplné. V posledních letech bylo dosaženo významného pokroku zejména v pochopení genetických predispozic chronické pankreatitidy. Mutace způsobující alterace v aktivaci a inaktivaci trypsinu či sekreci duktálních buněk se podílí na rozvoji chronické pankreatitidy a modifikují její průběh. Novější SAPE hypotéza zahrnuje poznatky předchozích teorií do vícestupňového modelu vzniku chronické pankreatitidy. Patogeneze je však nejspíše, podobně jako etiologie, komplexní s účastí různých patogenetických mechanizmů a jejich kombinací v závislosti na příčině. Klíčovým momentem v chápání patogeneze onemocnění byla charakterizace pankreatických stelárních buněk jako efektorových elementů fibrogeneze. Reprezentují centrální buňky, které reagují na různé patologické inzulty svou aktivací a tvorbou vaziva. Bližší pochopení mechanizmů patogeneze chronické pankreatitidy představuje naději na nové kauzální postupy v její léčbě.
Klíčová slova:
chronická pankreatitida – etiologie – patogeneze – pankreatická stelární buňka – SAPE hypotéza
Chronická pankreatitida (CHP) je onemocnění charakterizované progresivním a ireverzibilním poškozením funkční žlázy s následnou alterací endokrinní a exokrinní funkce. Společnými histopatologickými znaky jsou fibróza, acinární atrofie, chronický zánět a přestavba pankreatických vývodů. V některých případech je přítomna i kalcifikace a lymfoplazmocytární infiltrace.
Incidence CHP je geograficky rozdílná a byť jsou recentní epidemiologické studie vzácné, lze pozorovat její rostoucí trend. Ve vyspělých zemích se incidence nemoci pohybuje od 5,4 do 8,6 na 100 000 obyvatel/rok [1,2], v ČR dosáhla hodnoty 7,9 na 100 000 obyvatel/rok [3].
Z klinického hlediska charakterizují chronickou pankreatitidu bolest, maldigesce a diabetes. Obvyklým symptomem je charakteristická bolest v nadbřišku s iradiací do zad. Její vývoj je nepředvídatelný, ale většinou v průběhu onemocnění dochází ke zmírnění nebo vymizení bolesti, v některých případech je nutná endoskopická či chirurgická intervence. Porucha trávení se projevuje steatoreou a úbytkem tělesné hmotnosti, obvykle se manifestuje v pokročilejším stadiu onemocnění, kdy klesá sekrece lipázy pod 10 % normální hodnoty. Maldigesce tuků se steatoreou předchází kachektizaci, jelikož se sekrece lipázy snižuje rychleji než sekrece proteázy či amylázy. Pankreatogenní diabetes je pozdním příznakem onemocnění a vzniká důsledkem destrukce buněk pankreatických ostrůvků. Jeho léčba bývá komplikována vyšším rizikem hypoglykemie při současné nedostatečné syntéze glukagonu. Kauzální terapie CHP neexistuje, mezi základní pilíře léčby patří symptomatická léčba bolesti, náhrada ztracené trávicí funkce pankreatickými enzymy a substituce inzulinu u pankreatogenního diabetu.
Fyziologie exokrinního pankreatu
K pochopení patologických procesů vedoucích k chronické pankreatitidě je nutné uvést fundamentální fakta o struktuře a funkci normálního pankreatu. Slinivka břišní je žláza s exokrinní a endokrinní funkcí, která má zásadní úlohu v asimilaci a utilizaci energetických zdrojů organizmu. Exokrinní pankreas je tvořen acinárními buňkami a buňkami pankreatických vývodů.
Aciny, obsahující acinární a tubulární buňky, jsou primární funkční jednotkou exokrinního pankreatu. V acinárních buňkách dochází k syntéze inaktivních digestivních enzymů (zymogenů), úlohou tubulárních buněk je sekrece vody a zásaditých hydrogenuhličitanů. Zymogeny jsou za fyziologických podmínek vyplaveny v alkalické pankreatické šťávě do střeva, kde jsou následně aktivovány. Hlavní roli v procesu aktivace sehrává trypsin, který zprostředkuje konverzi samotného trypsinogenu na jeho aktivní formu a iniciuje aktivační kaskádu ostatních digestivních proenzymů. Trypsinogen je syntetizován na ribozomech acinárních buněk ve formě prezymogenu (pretrypsinogen), kotranslačně pak dochází v endoplazmatickém retikulu k odštěpení signálního peptidu o délce 15 aminokyselin. Hotový trypsinogen je dále transportován do Golgiho aparátu, uskladněn v sekrečních granulech a nakonec vyloučen cestou pankreatických vývodů do střeva, kde je aktivován odštěpením aktivačního peptidu o délce 8 aminokyselin. V pankreatické šťávě byly popsány tři různé formy trypsinogenu, které pak byly na základě své elektroforetické mobility označeny jako (i) kationický trypsinogen (PRSS1), (ii) anionický trypsinogen (PRSS2) a (iii) mesotrypsinogen (PRSS3). Nejvíce zastoupeným izoenzymem je PRSS1 (≈ 50–70 %), následován PRSS2 (≈ 30–40 %), podíl PRSS3 na celkovém trypsinogenu v pankreatické šťávě je minimální (≈ 2–10 %) [4]. Důležitou úlohu v procesu aktivace má hladina kalcia. Vysoká koncentrace vápníku vede ke stabilizaci aktivačního místa, čímž umožní odštěpení aktivačního peptidu [5]. Samotné štěpení trypsinogenu ale nevede k aktivaci trypsinu – k tomu je nutné i prostorové uspořádaní N-konce zbylého proteinu do globulární formy a interakce s vnitřní součástí trypsinu [6]. Tento děj je pH-dependentní a dochází k němu s nejvyšší intenzitou při hladině pH mezi 7 a 8 [7]. Nízké intracelulární pH (< 7,15) acinárních buněk u pacientů s ketoacidózou tudíž rovněž usnadňuje aktivaci trypsinu, a spolu s tranzientní hyperlipidemií tím může vést k akutní pankreatitidě [8].
Předčasná intrapankreatická aktivace zymogenů (zejména trypsinogenu) vede k poškození buněk a následné indukci zánětlivé odpovědi, kterou klinicky rozeznáváme jako akutní pankreatitidu [9]. Z tohoto důvodu jsou součástí exokrinního pankreatu četné protektivní mechanizmy, které aktivitu pankreatických enzymů kontrolují (obr. 1). Ochrannou funkci má autolýza trypsinu, při které trypsin a CTRC (chymotrypsinogen C – proteolytický zymogen aktivovaný trypsinem) štěpí trypsinogen a trypsin na specifických místech (Arg-122-Val-123, Leu-81-Glu-82), a tím jej inaktivují [10,11]. Ionty kalcia se na trypsin váží i v blízkosti Arg122 a změnou konformace molekuly snižují jeho vulnerabilitu vůči autolýze [12]. Vysoká hladina kalcia se tak tedy podílí nejen na aktivaci trypsinu, ale brání i jeho inaktivaci. Jiným inhibitorem intrapankreatické aktivity trypsinu je SPINK1 (serine protease inhibitor, Kazal type 1), který obsahuje specifické vazební místo pro trypsin. Inhibice trypsinu proteinem SPINK1 je ale pouze dočasná, protože samotný komplex trypsin-SPINK1 je substrátem pro trypsin, což vede k následné degradaci inhibiční molekuly a obnově původní enzymatické aktivity trypsinu [13]. Dalším obranným mechanizmem pankreatu je přítomnost CFTR (cystic fibrosis transmembrane conductance regulator) proteinu na apikální membráně tubulárních buněk. Při detekci enzymatické aktivity trypsinu prostřednictvím receptorů na luminálním povrchu (jako protease-activated receptor – PAR 1 a 2) dochází ke změně permeability CFTR a následnému uvolnění sekretu bohatého na bikarbonáty, který pak odplaví intraluminální obsah tubulů do duodena [14].
Obr. 1. Za fyziologických podmínek nastává konverze trypsinogenu na jeho aktivní formu v duodenu prostřednictvím střevní endopeptidázy, trypsin dále spouští aktivační kaskádu ostatních digestivních enzymů. V případě patologické (intrapankreatické) aktivace trypsinu dochází k utilizaci regulačního systému exokrinního pankreatu. Převaha aktivačních vlivů vyústí do autodigesce žlázy s následnou indukcí zánětu. Fig. 1. Physiologically, conversion of trypsinogen to active trypsin takes place in the duodenum and it is mediated by intestinal endopeptidase. Trypsin subsequently triggers activation of other digestive enzymes. Pathological (intrapancreatic) activation of trypsin leads to utilization of regulatory system of exocrine pancreas. Overactivation leads to gland autodigestion and induction of inflammation. 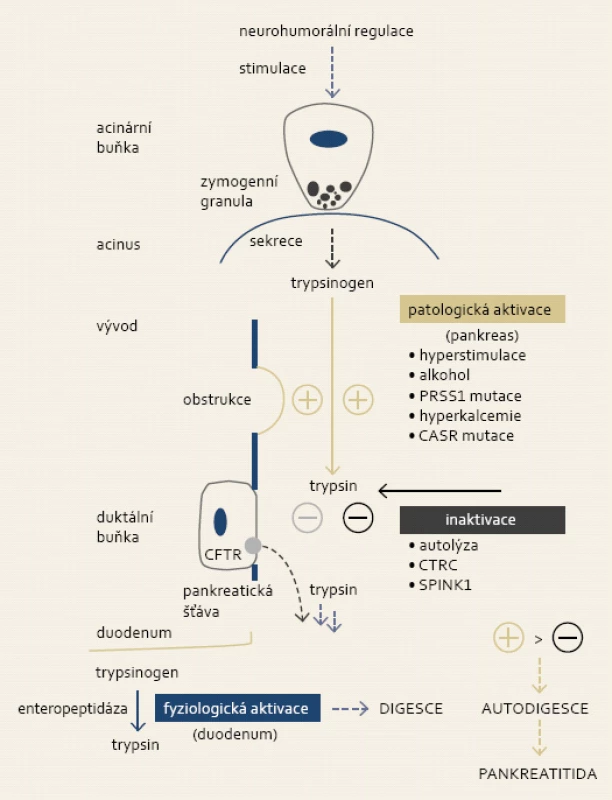
Klasifikace a etiologie chronické pankreatitidy
Ideální klasifikační systém chronické pankreatitidy by měl být jednoduchý, přesný, objektivní, co nejméně invazivní a měl by být schopen pojmout etiologii, patogenezi, strukturální i funkční změny parenchymu a v neposlední řadě klinické projevy nemoci. Taková klasifikace v současné době neexistuje, a to i přesto, že od konce 50. let minulého století vzniklo velké množství různých klasifikačních systémů, které se setkaly s větší nebo menší mírou přijetí gastroenterologickou obcí. Za nejdůkladnější klasifikaci současnosti, byť ne ideální, je všeobecně považována velmi detailní M-ANNHEIM klasifikace, kterou navrhli Schneider et al v roce 2007 [15]. Systém obsahuje definici nemoci a jejích komplikací, rizikových faktorů a diagnostických kritérií (kritéria zobrazovacích metod byla převzata z Cambridgeské klasifikace) [16]. Současně tato klasifikace klade mimořádný důraz na všechny parametry související s klinickou manifestací chronické pankreatitidy, především na přesné vyjmenování všech možných klinických projevů v jednotlivých stadiích nemoci. Na rozdíl od starších klasifikací obsahuje i bodovací systém ke stanovení pokročilosti nemoci, tzv. severity index. M-ANNHEIM klasifikace se v denní praxi právě pro svou rozsáhlost prakticky nepoužívá – pro tu se více hodí TIGAR-O klasifikace [17], jejíž název vznikl spojením počátečních písmen anglických adjektiv charakterizujících jednotlivé rizikové faktory CHP v jednoslovný pojem (tab. 1).
Tab. 1. TIGAR-O klasifikace: etiologické rizikové faktory asociované s chronickou pankreatitidou. Modifikováno dle Etemad et al [17]. Tab. 1. Etiologic factors associated with chronic pancreatitis: TIGAR-O classification system. Adapted and modified from Etemad et al [17]. ![TIGAR-O klasifikace: etiologické rizikové faktory asociované s chronickou pankreatitidou. Modifikováno dle Etemad et al [17].
Tab. 1. Etiologic factors associated with chronic pancreatitis: TIGAR-O
classification system. Adapted and modified from Etemad et al [17].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/091fbf0b09b37e72b197cfa1e336a59e.png)
Toxicko-metabolická
Vliv alkoholu na vznik CHP
Ve vyspělých zemích býval alkohol dlouho považován za dominantní etiologický faktor chronické pankreatitidy, zatímco v rozvojových zemích byla nejvíce zastoupená idiopatická forma chronické pankreatitidy. V českých zemích byla prevalence alkoholické chronické pankreatitidy odhadnuta na 70 % [3]. Výsledky recentních multicentrických studií z Itálie [18] a USA [19] však ukazují pokles zastoupení alkoholické CHP na 34 %, resp. 44 %. Zůstává otázkou, zda tento výsledek souvisí s charakterem studií (obě proběhly v referenčních centrech), se změnou chápání podílu alkoholu na rozvoji CHP či skutečně odráží změnu v příčině chronické pankreatitidy.
Riziko rozvoje chronické pankreatitidy následkem chronické konzumace alkoholu je v porovnání s ostatními chorobami indukovanými alkoholem relativně nízké a je závislé na dávce. V české literatuře je obvykle udáváno, že ke vzniku chronické alkoholické pankreatitidy vede letitý příjem alkoholu v množství nad 75 g u mužů a 40 g u žen. Recentně publikované case-control [20], populační [21] studie i metaanalýza [22] prokázaly exponenciální vztah mezi rizikem vzniku chronické pankreatitidy a mírou konzumace alkoholu, přičemž výsledky všech tří linií epidemiologického výzkumu naznačují, že musí být překročena jistá prahová dávka k tomu, aby se alkohol uplatnil jako rizikový faktor chronické pankreatitidy. Za prahovou dávku označují asi 4–5 alkoholických nápojů denně (přičemž jeden nápoj obsahuje přibližně 12 g čistého alkoholu). Platí ale, že absolutní riziko rozvoje chronické pankreatitidy je velmi nízké i u těžkých alkoholiků. V minulosti se předpokládalo, že akutní či chronickou pankreatitidu vyvine 10–20 % konzumentů významného množství alkoholu [23]. Některé nové studie však ukazují, že se může jednat dokonce až o pouze 3 % takových konzumentů [21,24,25]. Svědčí proto i fakt, že konzumace i většího množství alkoholu je v populaci relativně obvyklá, zatímco chronická pankreatitida nikoli. Zdá se tedy, že ke vzniku chronické pankreatitidy je vedle příjmu prahové dávky alkoholu nutná i interakce s dalšími genetickými či zevními faktory. Tuto teorii podporují také výsledky experimentálních studií ve zvířecích modelech. Alkohol potencoval vznik ceruleinem indukované chronické pankreatitidy [26], zatímco zvířata vystavená dlouhodobé konzumaci alkoholu nemoc nevyvinula [27]. Příkladem genetického vlivu je například signifikantně vyšší prevalence SPINK1 mutací u pacientů s alkoholickou CHP v porovnání s nemocnými s idiopatickou CHP, zdravými kontrolami či nemocnými s alkoholickou jaterní cirhózou [28]. U nemocných s alkoholickou chronickou pankreatitidou byl rovněž vyšší výskyt CTRC mutací v porovnání se zdravou populací [29].
Experimentální studie prokázaly, že chronický příjem alkoholu indukuje změny v acinárních buňkách, které vedou k předčasné aktivaci digestivních enzymů. Pankreaty potkanů exponovaných alkoholu měly vyšší obsah jak trávicích a lyzozomálních enzymů, tak i jejich mRNA [30]. Rovněž byla prokázána vyšší fragilita organel, kde jsou tyto enzymy skladovány [31]. Tyto změny mohou vést ke zvýšené pravděpodobnosti kontaktu lyzozomálních a trávicích enzymů a následně k předčasné intracelulární aktivaci digestivních enzymů a autodigestivnímu poškození žlázy. Alkohol je v pankreatu metabolizován na acetaldehyd (oxidací) a na etyl estery mastných kyselin (neoxidativní cestou), které mají rovněž toxický vliv na acinární buňky a podílejí se i na aktivaci stelárních buněk – jak přímo, tak i indukcí oxidativního stresu [32]. Chronický příjem alkoholu rovněž narušuje pankreatické neurohormonální kontrolní mechanizmy a způsobuje dysregulaci imunitního systému [33].
Vliv kouření na vznik CHP
Mimo alkoholu existuje jen několik málo nox, u kterých se předpokládá, že se podílejí na vzniku CHP. V posledních několika letech se dostává do popředí studium vlivu nikotinizmu na rozvoji CHP. Kouření ovlivňuje sekreci bikarbonátů do pankreatické šťávy [34], snižuje pankreatickou sekreci [35], indukuje oxidativní stres [36], snižuje inhibiční kapacitu trypsinu [37] a zvyšuje riziko vzniku kalcifikací [38]. Několik recentně publikovaných case-control a populačních studií prokázalo, že kouření je nezávislým rizikovým faktorem rozvoje jak akutní, tak chronické pankreatitidy. Americká case-control studie [20] ukázala, že u aktivně kouřících jedinců či jedinců, kteří v průběhu života vykouřili víc než 100 cigaret, je signifikantně vyšší prevalence CHP, přičemž asociace mezi kouřením a nemocí byla závislá na dávce. V porovnání s jedinci, kteří nikdy nekouřili, se relativní riziko vzniku CHP u kuřáků pohybovalo od 1,34 do 4,45 v závislosti na intenzitě kouření. Obdobné byly i závěry populačních studií z Dánska a Švédska [39,40], kde se relativní riziko rozvoje CHP u kuřáků v porovnání s nikdy nekouřícími jedinci pohybovalo v závislosti na dávce od 2,5 do 3,3, resp. od 2,1 do 3,6. Zajímavý je i fakt, že prevalence kouření se zvyšuje v závislosti na množství konzumovaného alkoholu [20]. Přesný patogenetický mechanizmus kouření jako i interakce kouření a alkoholu nebo jiných rizikových faktorů rozvoje CHP není ještě plně pochopen, novější práce ale prokázaly, že v in vitro podmínkách mají tabák a alkohol synergický efekt na pankreatickou fibrogenezi [41]. Kouření také hraje významnou roli, byť jiným mechanizmem, jako hlavní zevní rizikový faktor vzniku karcinomu pankreatu.
Idiopatická
Do této skupiny se řadí pacienti, u kterých není přítomen žádný jasný rizikový faktor CHP. Jejich zastoupení je odhadováno na 10–30 % [42]. Z klinického hlediska rozlišujeme idiopatickou chronickou pankreatitidu s (i) časným a (ii) pozdním nástupem. Idiopatická chronická pankreatitida s časným nástupem se typicky projeví v prvních dvou dekádách života zejména výraznou bolestí, strukturální a funkční změny pankreatu se obvykle dostaví s velkou latencí. Pozdní forma se manifestuje ve čtvrté a páté dekádě života jen minimální bolestí, není ale neobvyklé, že v čase stanovení diagnózy je již vyvinuta pankreatická insuficience. Nezanedbatelný počet nemocných s nejasnou etiologií CHP lze vysvětlit např. okultním příjmem alkoholu či přítomností nerozpoznané genetické predispozice.
Geneticky podmíněná
V průběhu posledního desetiletí došlo na poli studia patogeneze chronické pankreatitidy zejména k významnému pokroku v chápání podílu genetických alterací na vzniku CHP. Geny, jejichž alterace predisponuje k rozvoji CHP (PRSS1, SPINK1, CFTR, CASR, CTRC), můžeme dle míry rizika rozvoje onemocnění u nosiče mutované alely genu (bereme-li v úvahu „nejtěžší“ možnou mutaci) stratifikovat do tří úrovní: s vysokou, střední a malou penetrací (tab. 2). Z klinického hlediska lze rozdělit geneticky podmíněnou chronickou pankreatitidu na (i) sporadickou – při pozitivní mutaci jednoho nebo více pankreatických genů a absenci jiných rizikových faktorů, (ii) familiární, kde je navíc pozitivní rodinná anamnéza, ale nesplňující kritéria, a (iii) hereditární chronickou pankreatitidu – tzn. postižení tří a více členů rodiny minimálně dvou generací, typicky mutací PRSS1 [43]. Zatímco definice sporadické geneticky podmíněné CHP vyplývající z této klasifikace je jednoznačná, rozdíl mezi familiární a hereditární CHP je pouze arbitrární. Kritéria diagnózy hereditární CHP se v průběhu času vyvíjela a vzhledem k absenci mezinárodního konsenzu definice tohoto onemocnění se nyní v různých klinických centrech liší. Hereditární pankreatitida je vzácná klinická jednotka, s odhadem prevalence na 0,3–0,57/100 000 obyvatel [44,45].
Tab. 2. Geny, jejichž mutace se podílejí na rozvoji chronické pankreatitidy. Tab. 2. Genes associated with chronic pancreatitis. 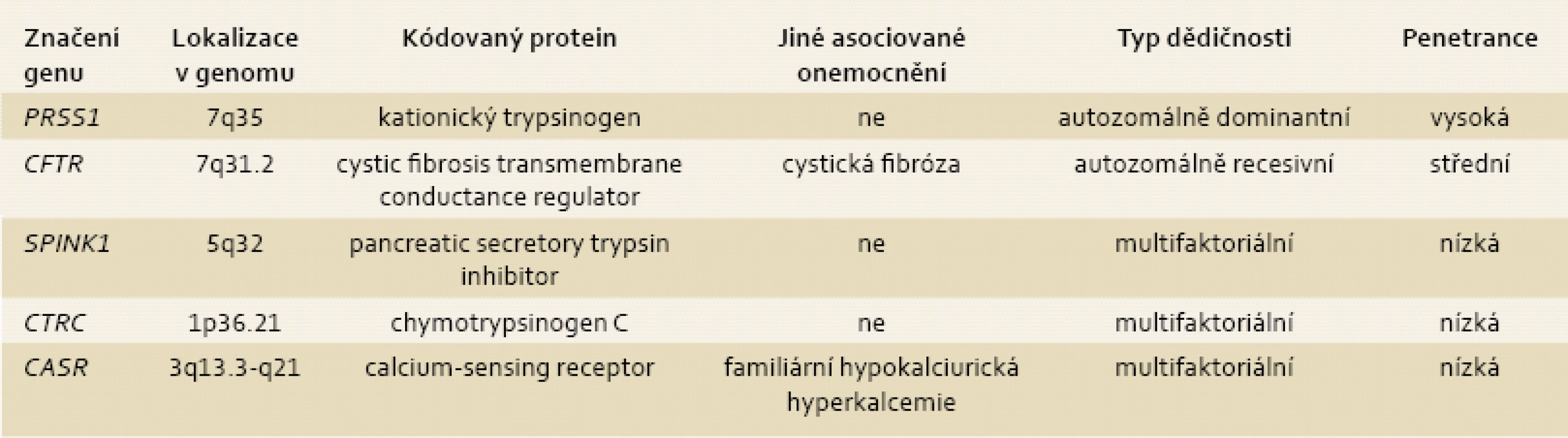
PRSS1 (kationický trypsinogen)
Gen PRSS1, lokalizovaný na krátkém raménku sedmého chromozomu, kóduje kationický trypsinogen. Doposud bylo popsáno několik desítek mutací tohoto genu, tři nejčetnější jsou R122H, N29I a A16V. Variace R122H a N29I obdobně jako většina studovaných mutací genu PRSS1 usnadňují změnou struktury trypsinogenu jeho autoaktivaci, následná intrapankreatická aktivace zymogenů vede k poškození parenchymu, indukci zánětlivé odpovědi a fibrogenezi. Mutace R122H rovněž inhibuje lýzu aktivovaného enzymu proteinem CTRC záměnou aminokyselin v primárním štěpícím místě (Arg-122-Val-123) [46,47]. V současnosti jsou známé jen tři varianty PRSS1 s jiným mechanizmem patogeneze, a sice třetí nejvíce zastoupená mutace A16V a dále vzácné E79K a R116C [48,49]. Rekombinantní A16V protein nemá vliv na autoaktivaci trypsinogenu, in vitro byla ale prokázaná čtyřnásobně zvýšená míra štěpení aktivačního peptidu prostřednictvím chymotrypsinu C s následnou akcelerací aktivace trypsinogenu [50]. Na rozdíl od mutací R122H a N29I s penetrancí na úrovni 70–80 % [51] byla varianta A16V detekována téměř výhradně u pacientů bez rodinné anamnézy chronické pankreatitidy [52]. To naznačuje, že pro chronickou pankreatitidu podmíněnou alterací PRSS1 není exkluzivní dominantní typ dědičnosti. Recentně byl u PRSS1 prokázán tzv. gene-dosage efekt [53,54]. Duplikace či triplikace lokusu trypsinogenu na sedmém chromozomu byla detekována u rodin s hereditární pankreatitidou. Z klinického hlediska je důležité zmínit mnohonásobně vyšší (≈ 50×) celoživotní riziko karcinomu slinivky u nosičů mutací PRSS1 v porovnání se zdravými jedinci, zatímco všeobecné riziko pacientů s chronickou pankreatitidou je „pouze“ dvacetinásobné [55,56].
Vzhledem ke zvýšenému riziku vzniku CHP u nosičů PRSS1 mutací se předpokládalo, že rovněž mutace anionické izoformy trypsinogenu (PRSS2) by mohly způsobovat onemocnění. Výsledky recentní studie [57] ale pozoruhodně naznačují, že PRSS2 mutace může být naopak protektivním faktorem vzniku chronické pankreatitidy. Substituce glycinu za arginin v kodónu 191 (G191R) byla detekována u 3,4 % kontrol, ale jen u 1,3 % pacientů s CHP. In vitro bylo následně prokázáno, že rekombinantní G191R protein ztrácí po aktivaci veškerou trypsinovou aktivitu následkem hypersenzitivity k autokatalytické proteolýze.
SPINK1 (serine protease inhibitor, Kazal type 1)
SPINK1, rovněž známý jako pancreatic secretory trypsin inhibitor (PSTI), je protein syntetizovaný acinárními buňkami exokrinního pankreatu. Řadí se do skupiny inhibitorů serinových proteáz s evolučně konzervovanou proteinovou doménou typu Kazal. Vzhledem k jeho schopnosti inhibovat až 20 % potenciální enzymatické aktivity trypsinu [58] na základě závěrů mutační analýzy kandidátních genů [59] a výsledků prací na myších modelech [60] je SPINK1 považován za důležitý negativní regulátor předčasné aktivace trypsinu. Nejčastější mutací SPINK1 je N34S, která je detekována zejména u pacientů s chronickou pankreatitidou bez pozitivní rodinné anamnézy. 15–40 % pacientů s idiopatickou CHP nesou N34S na jedné nebo obou alelách. Překvapivě je ale v populaci N34S haplotyp relativně častý (1–3 %), a to při nízké prevalenci CHP (42/100 000) [61]. Zdá se tedy, že heterozygotní mutace spíše modifikuje průběh CHP nežli přímo zvyšuje susceptibilitu vůči onemocnění [62]. Tato hypotéza je podložena i narůstajícím počtem prací, které naznačují, že přítomnost heterozygotní mutace SPINK1 je asociována s rozvojem CHP pouze v případě přítomnosti mutace dalšího genu (PRSS1, CTFR, CASR, CTRC) [63]. Přímý patogenetický vliv přítomnosti alely N34S na průběh CHP zůstává nejasný. Experimenty s rekombinantním lidským mutovaným N34S proteinem neprokázaly žádnou alteraci v inhibiční kapacitě trypsinu [64]. Zajímavé je ale zjištění, že N34S je v úplné vazebné nerovnováze například se čtyřmi variantami intronových sekvencí (c.56-37T>C, c.87+268A>G, c.195-604G>A, c195--66-65insTTTT) [65]. Lze tedy spekulovat, že patogeneticky relevantní mutací je jiná alterace v okolí než samotná N34S.
CFTR (cystic fibrosis transmembrane conductance regulator)
Cystická fibróza, nejčastější život zkracující autozomálně recesivní onemocnění europoidní rasy, je způsobena ztrátovou mutací v genu CFTR. CFTR je klíčovým proteinem chloridového ABC transportéru, který se nachází na apikální membráně epiteliálních buněk a má zásadní roli v sekreci tekutin a elektrolytů v respiračním a trávicím traktu. Funkcí CFTR v pankreatu je diluce a alkalizace acinárního sekretu bohatého na proteiny, čímž působí protektivně vůči precipitaci proteinových zátek a následné obstrukci proximálních pankreatických vývodů. Cystická fibróza je charakterizována klasickou trias – chronickým obstrukčním plicním onemocněním, exokrinní pankreatickou insuficiencí a elevací koncentrace natria a chloridů v potu. Pankreatickou insuficienci, která vzniká následkem náhrady funkčních acinárních buněk tukovým vazivem, vyvine přibližně 85 % pacientů s cystickou fibrózou. V současnosti je identifikováno téměř 2 000 variant CFTR genu, pouze u části z nich je prokázán jejich kauzální vztah k cystické fibróze. Z klinického hlediska se běžně se vyskytující varianty dělí na závažné a mírné podle jejich efektu na pankreatickou funkci. Molekulární klasifikace organizuje jednotlivé varianty do skupin dle jejich efektu na funkci CFTR. Varianty třídy I–III způsobují těžkou dysfunkci, IV–V redukovanou či alterovanou funkci, mnohé varianty jsou doposud neklasifikované. Mutace třídy IV a V mají variabilní a většinou mírný efekt na funkci orgánů včetně pankreatu a často se projeví až v případě překročení fyziologických potřeb organizmu při zvýšené zátěži. V roce 1998 byly simultánně publikovány dvě studie [66,67], které popsaly vyšší frekvenci mutací CFTR u pacientů s alkoholickou či idiopatickou chronickou pankreatitidou. Tyto závěry pak byly podpořeny replikací dat studiemi z USA, Evropy, Indie a Číny [63]. Minimálně jedna mutovaná alela CFTR genu byla detekována u přibližně 30 % pacientů s idiopatickou CHP a 10 % pacientů s alkoholickou CHP. Nicméně vzhledem k relativně vysoké odhadované frekvenci přenašečů mutovaného genu CFTR v populaci (1/25) při nízké prevalenci CHP lze předpokládat, že k indukci onemocnění je nutná interakce s dalšími rizikovými faktory, jako například mutací SPINK1 [68] či přítomností pankreas divisum (viz obstrukční etiologie).
CASR a CTRC
Mutace CASR (calcium-sensing receptor) i CTRC (chymotrypsin C, caldecrin) jsou asociovány s chronickou pankreatitidou [69], ale na rozdíl od mutací CFTR či SPINK1 nebyly u jedinců s familiální či idiopatickou CHP detekovány homozygotní či složené heterozygotní mutace genů CASR či CTRC. Naopak, variace v CASR a CTRC genech se u pacientů s CHP téměř vždy vyskytovaly spolu s heterozygotními variantami PRSS1, CFTR anebo SPINK1 [70]. Zdá se tedy, že mutace CASR a CTRC nejsou samy o sobě dostatečné k indukci onemocnění, ale spolu s jinými rizikovými faktory zvyšují susceptibilitu vůči CHP.
CASR je receptor spřažený s proteinem G a kontroluje hladinu extracelulárního kalcia prostřednictvím regulace uvolňování parathormonu v příštítných tělískách. Ztrátová mutace CASR genu vede k poruše detekce hladiny kalcia a domnělá hypokalcemie stimuluje příštítná tělíska k trvalému navýšení hladiny parathormonu. Tento stav vede následně k hyperkalcemii. Zajímavostí je, že zatímco ztrátová mutace CASR byla u pacientů s CHP asociována s přítomností SPINK1 mutace [71], přítomnost aktivační (gain of function) mutace byla spojena s abúzem alkoholu [72].
Chymotrypsin C je člen rodiny S1 peptidáz, jenž se podílí na degradaci kationického trypsinogenu, a tím působí protektivně vůči CHP [11]. Patogenetické CTRC varianty způsobují ztrátu funkce chymotrypsinogenu C prostřednictvím alterace jeho sekrece, aktivity a proteolytické stability [73].
Význam genetických alterací u CHP
Genetické studie dědičných faktorů CHP změnily v základech náhled na patogenezi onemocnění. Dlouhou dobu se předpokládalo, že geneticky podmíněná pankreatitida je mimořádně vzácná porucha, nicméně aktuální znalosti o výskytu mutací PRSS1, SPINK1, CFTR, CASR a CTRC u jedinců s tzv. idiopatickou CHP demonstrují mnohem vyšší podíl genetických alterací na rozvoji onemocnění. Různé mutace u různých pankreatických genů mají odlišný fenotyp i typ dědičnosti a dokonce i stejná mutace u konkrétního genu může mít u dvou jedinců různé konsekvence v závislosti na jejich genetickém pozadí a jeho interakci s faktory prostředí. Vyšší prevalence mutací u alkoholické pankreatitidy v porovnání s jedinci bez CHP, kteří ale splňují požadovanou prahovou konzumaci alkoholu, stírá zažité striktní dělení etiologií nemoci. Komplexní interakce mezi různými genetickými a zevními faktory tudíž vedou k plynulému přechodu mezi jednotlivými subtypy chronické pankreatitidy. Vliv vnějšího prostředí dobře demonstruje specifický sociobehaviorální profil pacientů s alkoholickou pankreatitidou v porovnání s jedinci s jinými alkoholem indukovanými chorobami, např. jaterní cirhózou [74].
Při úvaze o genetickém testování pacientů s CHP je nutné si uvědomit, že kromě mutací v PRSS1 genu, které způsobují hereditární pankreatitidu, jsou mutace v ostatních genech pouze rizikovým faktorem vzniku pankreatitidy. Celosvětově platná doporučení ke genetickému testování pacientů s CHP neexistují. Evropští pankreatologové recentně doporučili [75] genetickou analýzu PRSS1, SPINK1 a CTRC u všech pacientů léčených pro akutní nebo chronickou pankreatitidou s pozitivní rodinnou anamnézou chronické pankreatitidy či nádoru pankreatu nebo u všech pacientů s chronickou pankreatitidou bez rodinné anamnézy po vyloučení ostatních predisponujících faktorů. Toto doporučení sice umožní podrobnou molekulární charakteristiku pacientů s pankreatitidou, avšak nepřinese kromě pacientů s hereditární pankreatitidou zásadní význam do klinické péče o tyto pacienty. Dále nutno poznamenat, že negativní nález screeningu nevylučuje genetický podklad onemocnění. Vzhledem k absenci terapeutických konsekvencí se doporučuje testování asymptomatických příbuzných jen po pečlivém individuálním zvážení konkrétních případů. U pacientů se zvýšenou či hraniční koncentrací chloridů v potu je vhodné provést screening na CFTR mutace i s ohledem na fakt, že pacienti s cystickou fibrózou mohou trpět rekurentními atakami chronické pankreatitidy při absenci ostatních symptomů nemoci.
Autoimunitní
Autoimunitní pankreatitida (AIP) je vzácná klinická jednotka (2–4 % všech CHP) [76] definována specifickým klinickým, laboratorním i histologickým nálezem. Rozlišujeme (i) AIP 1. typu s vysokou prevalenci v Japonsku a Asii asociovanou s IgG4 systémovou sklerozující chorobou a (ii) AIP 2. typu asociovanou s idiopatickými střevními záněty a s vyšším výskytem v západní populaci. Důležitým rysem AIP je významná odpověď na imunosupresivní léčbu s možností úplné regrese onemocnění a zhojením ad integrum. Výrazné rozdíly v rasové a geografické distribuci AIP naznačují, že v patogenezi nemoci hrají důležitou roli genetické a zevní faktory, které jsou však doposud neznámé.
Rekurentní akutní
Do skupiny rekurentní akutní pankreatitidy zahrnujeme ty pacienty, kteří prodělali opakované ataky akutních pankreatitid. Jedná se o skupinu charakterizovanou klinickým průběhem, neboť rekurentními atakami se mohou manifestovat pankreatitidy různých etiologií především na počátku onemocnění. Vyvolávající faktor rekurentní pankreatitidy tak nejspíš rozhoduje o tom, zda pacient chronickou pankreatitidu vyvine. Např. opakované ataky biliární pankreatitidy k chronické pankreatitidě nevedou.
Ataka těžké akutní pankreatitidy také bez rozdílu příčiny může vést ke vzniku tak rozsáhlé nekrózy, jejímž následkem je ztráta pankreatické funkce a náhrada tkáně vazivem.
Obstrukční
Příčinou obstrukční pankreatitidy je omezení odtoku pankreatické šťávy zúženým či obturovaným pankreatickým vývodem. Příčinou stenózy lumen může být intraduktální konkrement nebo extraduktální útlak pankreatickou malignitou (adenokarcinom, neuroendokrinní tumor, intrapapilární mucinózní tumor atd.). Mezi další příčiny patří intraparenchymatická jizva po akutní pankreatitidě či stenóza Vaterovy papily. Obstrukce hlavního pankreatického vývodu ve zvířecích modelech reprodukovatelně vedla v průběhu několika týdnu k rozvoji chronické pankreatitidy [77] se specifickým histopatologickým nálezem, kde je patrná uniformní distribuce inter - a intralobulární fibrózy spolu s destrukcí exokrinního parenchymu v obturovaných oblastech a zároveň absence proteinových zátek a kalcifikací. Porucha odtoku exokrinních sekretů vede ke stagnaci a zvýšené litogenicitě pankreatické šťávy, dále ke zvýšení intraduktálního tlaku a poruše prokrvení pankreatu [78]. Úspěšná endoskopická či chirurgická léčba obstrukce vývodu vede u většiny pacientů k ústupu bolestí.
Mechanizmus obstrukce se předpokládá také v patogenezi vzniku akutní rekurentní pankreatitidy u pacientů s pankreas divisum. Nesplynutí ventrálního a dorzálního pankreatického vývodu znamená, že je větší část pankreatické tkáně drénována malou papilou do duodena. Drenáž malé papily je u těchto pacientů často úspěšná. Role pankreas divisum při vzniku chronické pankreatitidy zůstává stále předmětem diskuzí [79]. Recentně publikovaná data naznačují, že pankreas divisum samostatně chronickou pankreatitidu nezpůsobuje a vliv této anatomické variace se uplatní až v přítomnosti genetických alterací. Pankreas divisum byl zjištěn u 7 % jedinců ve zdravé populaci, 7 % pacientů s alkoholickou CHP, 5 % pacientů s idiopatickou CHP, 16 % pacientů s PRSS1−, 16 % pacientů se SPINK1 − a 47 % pacientů s CFTR − asociovanou CHP [80].
Patogeneze
V současnosti neexistuje jednoznačný konsenzus o způsobu, jakým se různé kauzativní faktory podílejí na vzniku chronické pankreatitidy. V průběhu posledních desetiletí bylo navrženo několik hypotetických modelů k popisu patogenetických mechanizmů onemocnění. Notoricky známé „tradiční“ teorie, jejichž bazální premisy budou zmíněny níže, byly koncipovány zejména se zřetelem na alkoholickou chronickou pankreatitidu a byť byly formulovány na základě přesvědčivých pozorování, nelze jimi spolehlivě vysvětlit působení všech vyvolávajících faktorů. Společnou patofyziologickou dráhu pro různé etiologické vlivy nabízí v současné době stále populárnější SAPE hypotéza, která propojuje myšlenky starších hypotéz s novými poznatky o patogenezi chronické pankreatitidy – nicméně k potvrzení různých aspektů této hypotézy je zapotřebí dalších konfirmačních studií. Někteří autoři se domnívají, že různé etiologické faktory vedou k chronické pankreatitidě odlišnými mechanizmy (obr. 2) [42].
Obr. 2. Komplexní model patogeneze chronické pankreatitidy s účastí různých patogenetických mechanizmů a jejich kombinací v závislosti na etiologii. Modifikováno dle Stevens et al [42]. Fig. 2. Complex model of pathogenesis of chronic pancreatitis presumes involvement of different pathogenetic mechanisms for each etiology. Adapted and modified from Stevens et al [42]. ![Komplexní model patogeneze chronické pankreatitidy s účastí různých patogenetických mechanizmů a jejich kombinací v závislosti na etiologii. Modifikováno dle Stevens et al [42].
Fig. 2. Complex model of pathogenesis of chronic pancreatitis presumes involvement of different pathogenetic mechanisms for each etiology. Adapted and modified from Stevens et al [42].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/cbedd2e18acd9e2ddfedf006ebd65a15.jpg)
Teorie obstrukce
U chronické pankreatitidy dochází působením noxy (např. alkoholu) ke změně ve složení pankreatického sekretu. Zvýšené vylučování bílkovin při současně snížené sekreci pankreatické šťávy z acinárních buněk [81] vede k vysrážení proteinové zátky v lumen acinů, která se pak stává jádrem ke vzniku pankreatického kamene. Uzávěr pankreatických kanálků následně indukuje chronický zánět žlázy s rozvojem atrofie a fibrózy. Pankreatické kameny jsou tvořeny krystalickou mřížkou uhličitanu vápenatého promíchanou s gelovou matrix tvořenou proteiny a polysacharidy [82]. Předpokládalo se, že významnou roli ve výše uvedeném procesu má litostatin (pancreatic stone protein, PSP), fosfoprotein syntetizovaný v pankreatických acinárních buňkách. Některé údaje nasvědčovaly, že PSP svým působením brání vzniku a růstu krystalů uhličitanu vápenatého v pankreatické šťávě supersaturované kalciem [83] a že jeho sekrece klesá při chronickém příjmu alkoholu [84]. Následné experimenty ale nebyly tyto hypotézy schopny reprodukovat, navíc konkluzivně prokázaly, že PSP in vitro neinhibuje formaci krystalů [85]. Pro podíl PSP na vzniku chronické pankreatitidy nesvědčí ani fakt, že mutace v jeho genu nebyly detekovány u pacientů s familiární či idiopatickou pankreatitidou [86,87]. Argumentem odpůrců teto hypotézy je i absence proteinových zátek v časných stadiích nemoci.
Teorie nekrózy-fibrózy
Hypotéza nekrózy-fibrózy předpokládá, že recidivující ataky akutní pankreatitidy vedou na podkladě hemoragie a fokální intersticiální nekrózy k jizvení periduktálního parenchymu [88]. Tyto změny pak mohou způsobit poruchu pankreatické drenáže s následnou tvorbou proteinových zátek a kalkulů a v konečném důsledku k zániku acinárních buněk a tvorbě obvyklých fibrotických změn. Původně byly podkladem pro tuto hypotézu patologické studie, které prokazovaly perilobulární fibrózu po atace akutní pankreatitidy. Na základě těchto závěrů pak lze předpokládat postupnou progresi fibrózy při rekurentních epizodách akutní pankreatitidy. Nemalou podporu tomuto modelu přineslo i objasnění genetického mechanizmu hereditární pankreatitidy (viz výše), která se typicky manifestuje rekurentními atakami akutní pankreatitidy již v časném dětství, které pak vedou k rozvoji chronické pankreatitidy. V souvislosti s touto hypotézou ale nelze ignorovat fakta, že (i) 5–10 % alkoholické pankreatitidy má bezbolestnou manifestaci v celém průběhu onemocnění [89] a (ii) i těžké ataky biliární akutní pankreatitidy extrémně zřídka progredují do chronické pankreatitidy.
Teorie toxicko-metabolická
Působením etylalkoholu a jeho metabolitů (viz výše) dochází k přímému poškození pankreatických acinárních buněk. Chronické užívání alkoholu vede k akumulaci cytoplazmatických lipidů, tukové degeneraci, buněčné nekróze, fibróze a nakonec k snížení pankreatické sekrece [90]. Pro tuto hypotézu svědčí i fakt, že hromadění tuku v buňkách acinů a intersticia je histopatologickou morfologickou známkou poškození slinivky břišní v důsledku abúzu alkoholu.
Teorie oxidativního stresu
Tato teorie je založena na hypotéze, že vyvolávajícím činitelem chronické pankreatitidy je oxidativní stres pankreatických acinárních buněk indukovaný přebytkem reaktivních molekul (reactive oxygen species, ROS) vznikajících v organizmu při biotransformaci cizorodých látek (např. alkoholu). ROS se podílejí na blokádě intracelulárních signálních drah, fúzi lyzozomálních a zymogenních kompartmentů a oxidaci buněčných membrán. Uvolněné trávicí enzymy pak v intersticiu vyvolají zánětlivou odpověď, která vede k infiltraci imunokompetentních buněk a aktivaci komplementu. Původně teorie předpokládala vznik ROS v játrech a jejích transport do pankreatu cestou systémové cirkulace a refluxí žluče do pankreatického stromu [91]. Nyní je známo, že pankreatické buňky jsou schopny obdobně jako hepatocyty metabolizovat alkohol oxidativní i neoxidativní cestou, přičemž pankreatická produkce ROS probíhá stejným enzymatickým aparátem (P4502E1) jako v hepatocytech. V současnosti převládá názor, že oxidativní stres hraje nepochybnou roli v poškození pankreatu, ale pravděpodobně není iniciátorem patofyziologické sekvence [42].
SAPE hypotéza
Nové znalosti o genetických mechanizmech uplatňujících se v rozvoji chronické pankreatitidy jako i pokrok v porozumění pankreatické fibrogenezi vedly předního amerického genetika D. Whitcomba k formulaci SAPE (sentinel acute pancreatic event) hypotézy (obr. 3) [92], která představuje paradigma dvou úderů a inkorporuje mnoho elementů tradičních hypotéz (toxických metabolitů, nekrózy-fibrózy a oxidativního stresu) do sjednoceného konceptu. Tento model rozděluje patogenezi chronické pankreatitidy do tří postupných fází: (i) preakutní pankreatitida, (ii) iniciální ataka akutní pankreatitidy (první úder) a nakonec (iii) fáze progrese (druhý úder). Ve fázi preakutní pankreatitidy model rozpoznává přítomnost rizikových faktorů chronické pankreatitidy (např. alkohol, kouření, genetické alterace) a definuje jejich vliv na jedince bez chronické pankreatitidy. První úder (sentinel event) je charakterizován jako první ataka akutní pankreatitidy s následnou aktivací imunitního systému (jak prozánětlivé, tak protizánětlivé složky). Hypotéza předpokládá, že tento první úder navodí v pankreatu zánět prostřednictvím monocytů (event. tkáňových makrofágů) a aktivovaných stelárních buněk, které jsou efektorovými elementy fibrózy. Indukce zánětu je normální odpovědí organizmu na poranění, která za obvyklých okolností vede k reparaci tkání a regeneraci. Důležité je proto třetí stadium, fáze progrese, která je závislá na faktorech modifikujících normální imunitní odpověď prostřednictvím různých stresorů – ty odpovídají druhému úderu. U pacientů s minimální následnou stimulací imunitního systému bez přítomné alterace imunitní odpovědi dochází po iniciální atace akutní pankreatitidy k restituci pankreatického parenchymu. Naopak, v případě přítomnosti faktorů, které modifikují zánětlivou odpověď organizmu (např. pokračující konzumace alkoholu), či další stimulace imunitního systému (metabolický stres u kouření či abúzu alkoholu; rekurentní akutní pankreatitidy u PRSS1 mutace), může dojít k progresi onemocnění.
Obr. 3. SAPE hypotéza – schéma. Modifikováno dle Yadav et al [102]. V první fázi je histologické vzezření pankreatu normální, i když je jedinec vystaven metabolickému či oxidativnímu stresu nebo je nositelem genetického rizika. Prvním úderem je inzult pankreatu, který vede k akutní pankreatitidě (sentinel event). Prozánětlivá fáze vyústí v infiltraci parenchymu imunokompetentními buňkami a zánětlivé poškození tkáně. Druhé stadium končí fází protizánětlivé odpovědi, která je asociována s aktivací a proliferací pankreatických stelárních buněk. Ve většině případů pak dochází ke klinickému zotavení slinivky. V případě, že dojde k rekurentní atace akutní pankreatitidy, nebo v případě predispozice jedince k indukci chronického stresu acinárních buněk (druhý úder), dochází k chronickému zánětu a progresivní fibrotizaci, jež klinicky rozeznáváme jako chronickou pankreatitidu. K rozvoji chronické pankreatitidy může dojít i přímo (bez druhého úderu), v podmínkách extenzivní pankreatické nekrózy či prolongované úplné obstrukce proximálního vývodu po epizodě těžké akutní pankreatitidy. Fig. 3. SAPE hypothesis – scheme. Adapted and modified from Yadav et al [102]. In the first phase, the histological aspect of the pancreas is normal, even though an individual is subjected to metabolical or oxidative stress, or genetic risk is present. The first step is injury of the pancreas, which leads to acute pancreatitis (sentinel event). The pro-inflammatory phase results in infiltration of parenchyma by immunocompetent cells and inflammatory damage of the tissue. The second phase ends with anti-inflammatory response, mediated by tissue macrophages and associated with activation and proliferation of pancreatic stellar cells. Subsequently, recovery of pancreas occurs in most cases. Recurrent attacks of acute pancreatitis or genetic predisposition of an individual for induction of chronic stress of acinar cells (second hit), result in chronic inflammation and progressive fibrotization, which is clinically recognized as chronic pancreatitis. Chronic pancreatitis could also be induced directly (without second hit) as a consequence of extensive pancreatic necrosis or as a consequence of total obstruction of proximal ductus after an episode of severe acute pancreatitis. ![SAPE hypotéza – schéma. Modifikováno dle Yadav et al [102].
V první fázi je histologické vzezření pankreatu normální, i když je jedinec vystaven metabolickému či oxidativnímu stresu nebo je nositelem genetického rizika. Prvním úderem je inzult pankreatu, který vede k akutní pankreatitidě (sentinel event). Prozánětlivá fáze vyústí v infiltraci parenchymu imunokompetentními buňkami a zánětlivé poškození tkáně. Druhé stadium končí fází protizánětlivé odpovědi, která je asociována s aktivací a proliferací pankreatických stelárních buněk. Ve většině případů pak dochází ke klinickému zotavení slinivky. V případě, že dojde k rekurentní atace akutní pankreatitidy, nebo v případě predispozice jedince k indukci chronického stresu acinárních buněk (druhý úder), dochází k chronickému zánětu a progresivní fibrotizaci, jež klinicky rozeznáváme jako chronickou pankreatitidu. K rozvoji chronické pankreatitidy může dojít i přímo (bez druhého úderu), v podmínkách extenzivní pankreatické nekrózy či prolongované úplné obstrukce proximálního vývodu po epizodě těžké akutní pankreatitidy.
Fig. 3. SAPE hypothesis – scheme. Adapted and modified from Yadav et al [102].
In the first phase, the histological aspect of the pancreas is normal, even though an individual is subjected to metabolical or oxidative stress, or genetic risk is present. The first step is injury of the pancreas, which leads to acute pancreatitis (sentinel event). The pro-inflammatory phase results in infiltration of parenchyma by immunocompetent cells and inflammatory damage of the tissue. The second phase ends with anti-inflammatory response, mediated by tissue macrophages and associated with activation and proliferation of pancreatic stellar cells. Subsequently, recovery of pancreas occurs in most cases. Recurrent attacks of acute pancreatitis or genetic predisposition of an individual for induction of chronic stress of acinar cells (second hit), result in chronic inflammation and progressive fibrotization, which is clinically recognized as chronic pancreatitis. Chronic pancreatitis could also be induced directly (without second hit) as a consequence of extensive pancreatic necrosis or as a consequence of total obstruction of proximal ductus after an episode of severe acute pancreatitis.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c1663d7e4968120b41721a3bdab3e3ad.jpg)
Pankreatické stelární buňky
Zásadním poznatkem je identifikace a charakterizace pankreatických stelárních buněk (pankreatické hvězdicovité buňky) a objasnění jejich úlohy v syntéze proteinů extracelulární matrix.
Poprvé byla přítomnost lipocytů (fat-storing cells) s vysokým obsahem retinoidů v pankreatu demonstrována v roce 1982 [93]. Možný podíl tohoto buněčného subtypu v remodelaci pankreatu byl zvažován již v roce 1990 [94], nicméně trvalo dalších osm let, než byly tyto buňky poprvé izolovány a charakterizovány [95,96]. Vzhledem k jejich morfologické podobnosti s hepatickými stelárními buňkami a obdobnému metabolizmu retinoidů byly tyto buňky pojmenovány jako pankreatické stelární buňky. Stelární buňky jsou lokalizovány v interlobulární a interacinární části lidského pankreatu a vykazují některé vlastnosti myofibroblastů jako např. schopnost exprese alfa-aktinu hladkého svalu, syntézy kolagenu a fibronektinu a formace mikrofilament, dále mají omezený potenciál migrace, proliferace a fagocytózy [97]. Hvězdicovité buňky se vyskytují ve dvou základních fenotypech – (i) klidovém a (ii) aktivovaném, přičemž klidové buňky mohou být aktivovány přímým působením některých nox (akohol a jeho metabolity, tabák) a jimi indukovaného oxidačního stresu [98] nebo prostřednictvím prozánětlivých cytokinů jako např. TGFβ, TNFα, PDGF a dalších, které jsou emitovány v průběhu prozánětlivé fáze akutní pankreatitidy [99]. Proces transformace stelárních buněk je charakteristický změnou tvaru buňky z kulaté na hvězdicovitou, ztrátou tukových kapének obsahujících retinoidy a navýšením exrese α-aktinu hladkého svalu a syntézy proteinů extracelulární matrix (obr. 4) [100]. Jedním z nejvíce prozkoumaných cytokinů, které mají vliv na biosyntézu a obrat extracelulární matrix, je TGFβ (transforming growth factor beta), který je uvolňován různými buněčnými typy včetně aktivovaných makrofágů a krevních destiček.
Obr. 4. K aktivaci pankreatických stelárních buněk (PSC) dochází jak přímým vlivem metabolitů alkoholu a jimi indukovaným oxidačním stresem, tak i působením cytokinů a růstových faktorů emitovanými imunokompetentními buňkami a stromálními buňkami pankreatu při zánětu. Proces aktivace je morfologicky charakteristický změnou tvaru buňky a ztrátou tukových kapének. Fig. 4. Activation of pancreatic stellate cells (PSC) is triggered either by alcohol metabolites and subsequent oxidative stress, or by action of cytokines and growth factors secreted by immunocompetent and stromal pancreatic cells accompanying inflammation. Activation of PSC is accompanied by its morphological change and loss of fat droplets. 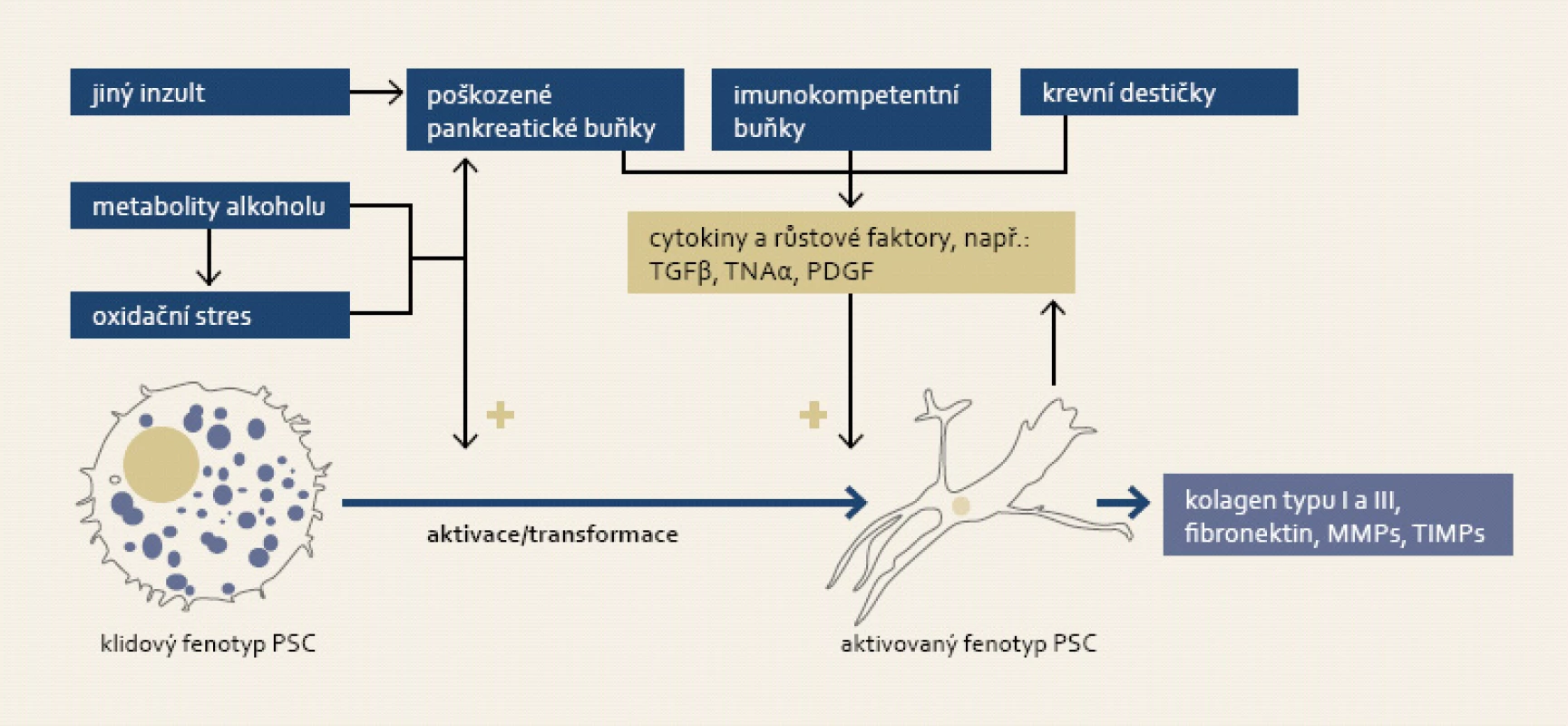
Experimenty na zvířecích modelech prokázaly paralelní alteraci exprese genů kolagenu a TGFβ u potkanů s ceruleinem indukovanou pankreatitidou [101]. Maximální navýšení TGFβ mRNA bylo detekováno dva dny po infuzi ceruleinu a in-situ hybridizace prokázala, že tyto transkripty byly produkovány zejména stromálními a acinárními buňkami. Inhibice TGFβ neutralizujícími protilátkami v průběhu regenerační fáze po ceruleinem indukované pankreatitidě byla asociována se snížením hladiny jak kolagenu 1. typu, tak i TGFβ. Tento fenomén byl přisuzován autokrinní kličce, kterou TGFβ indukuje svou vlastní syntézu.
Důležitou roli v procesu pankreatické fibrogeneze mají i matrixové metaloproteázy (MMP), které moderují fyziologickou resorpci extracelulární matrix [103]. Matrixové metaloproteázy jsou zinek-dependentní proteolytické enzymy, které jsou schopny štěpit prakticky všechny extracelulární matrixové proteiny. MMP jsou syntetizovány jako proenzymy, které jsou následně aktivovány proteolytickým štěpením aminoterminálního propeptidu, např. plazminem, katepsinem G, trypsinem anebo alfa chymotrypsinem [103]. Jejich aktivita je dále regulována prostřednictvím různých proteinázových inhibitorů, jako α-2-mikroglobulin a zejména rodinou tkáňových inhibitorů metaloproteináz (TIMP-1–4). Alterace v rovnováze mezi expresí MMP a TIMP je popisována u různých zánětlivých onemocnění. U chronické pankreatitidy byly detekovány vyšší hladiny MMP-2 a TIMP-1 a -2, nicméně nebyla prokázána zvýšená míra transkripce proteináz se substrátovou specificitou pro komponenty intersticiální extracelulární matrix [104] – MMP-1 a MMP-3. S daným faktem koreluje i schopnost produkce některých subtypů matrixových metaloproteáz (MMP-2) a jejich inhibitorů (TIMP-2) stelárními buňkami [105]. Lze se tedy domnívat, že neadekvátní exprese MMP-1 a MMP-3 u chronické pankreatitidy se může také podílet na zvýšené depozici komponentů extracelulární matrix v intersticiálním prostoru.
Shrnutí
Chronická pankreatitida je charakterizována jako progresivní a ireverzibilní onemocnění pankreatu, které se klinicky manifestuje poruchou jeho exokrinních a endokrinních funkcí. Prvním krokem k indukci zánětu je často autodigesce žlázy indukovaná předčasnou aktivací pankreatických enzymů. Exokrinní pankreas má proto k dispozici abundantní regulační systém, jehož úkolem je eliminace tohoto rizika. Na narušení regulačních funkcí a následné předčasné aktivaci proenzymů se mj. podílí toxicita etanolu a jeho metabolitů, porucha homeostázy kalcia (hyperkalcemie), geneticky podmíněná přítomnost defektních proteinů (jak regulačních, tak enzymů) či duktální dysfunkce při obstrukci nebo narušené sekreci duktálních buněk. Většina pacientů je však vystavena vlivu vícečetných rizikových faktorů, což implikuje multifaktoriální náhled na původ nemoci s komplexním mechanizmem genových a zevních interakcí. V průběhu let vzniklo několik modelů patogeneze chronické pankreatitidy, přičemž ústřední myšlenky většiny z nich jsou podnětné dodnes, navzdory jejich neúplnosti. Se zřetelem na aktuální znalosti byl definován nový pohled na molekulární patogenezi pankreatické fibrózy. Konečná depozice extracelulární matrix se tak jeví být následkem dynamického procesu zahrnujícího poškození acinárních buněk a předčasnou aktivaci digestivních enzymů s následnou nekrózou a indukcí zánětu, aktivaci makrofágů a agregaci krevních destiček, uvolnění cytokinů a růstových faktorů a aktivaci pankreatických stelárních buněk, který v konečném důsledku vede k nerovnováze mezi syntézou a degradací proteinů matrixu a vzniku pankreatické fibrózy. Navzdory těmto pokrokům v našem chápání příčin a mechanizmů chronického poškození pankreatu jsou naše terapeutické možnosti stále omezené na léčbu symptomů. Snaha o ještě bližší porozumění patofyziologických mechanizmů dává šanci na nové kauzální terapeutické postupy.
Seznam zkratek
CHP – chronická pankreatitida, PRSS1 – kationický trypsinogen, PRSS2 – anionický trypsinogen, PRSS3 – mesotrypsinogen, CTRC – chymotrypsinogen C, SPINK1 – serine protease inhibitor, Kazal type 1, PSTI – pancreatic secretory trypsin inhibitor, CFTR – cystic fibrosis transmembrane conductance regulator, CASR – calcium-sensing receptor, PAR – protease-activated receptor, PSP – pancreatic stone protein, ROS – reactive oxygen species, SAPE – sentinel acute pancreatic event, TGFβ – transforming growth factor beta, TNFα – tumor necrosis factor-alpha, PDGF – platelet-derived growth factor, PSC – pancreatic stellate cell, MMP – matrix metalloproteinase, TIMP – tissue inhibitor of metalloproteinases
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 26. 7. 2013
Přijato: 12. 8. 2013
MUDr. Peter Mačinga
Klinika hepatogastroenterologie, IKEM
Vídeňská 1958/9, 140 21 Praha 4
peter.macinga@ikem.cz
Zdroje
1. Lin Y, Tamakoshi A, Matsuno S et al. Nationwide epidemiological survey of chronic pancreatitis in Japan. J Gastroenterol 2000; 35(2): 136–141.
2. Tinto A, Lloyd DA, Kang JY et al. Acute and chronic pancreatitis – diseases on the rise: a study of hospital admissions in England 1989/90-1999/2000. Aliment Pharmacol Ther 2002; 16(12): 2097–2105.
3. Díte P, Starý K, Novotný I et al. Incidence of chronic pancreatitis in the Czech Republic. Eur J Gastroenterol Hepatol 2001; 13(6): 749–750.
4. Rinderknecht H, Stace NH, Renner IG. Effects of chronic alcohol abuse on exocrine pancreatic secretion in man. Dig Dis Sci 1985; 30(1): 65–71.
5. Liu JH, Wang ZX. Kinetic analysis of ligand-induced autocatalytic reactions. Biochem J 2004; 379(3): 697–702.
6. Bennett WS, Huber R. Structural and functional aspects of domain motions in proteins. CRC Crit Rev Biochem 1984; 15(4): 291–384.
7. Nemoda Z, Sahin-Tóth M. The tetra-aspartate motif in the activation peptide of human cationic trypsinogen is essential for autoactivation control but not for enteropeptidase recognition. J Biol Chem 2005; 280(33): 29645–29652.
8. Nair S, Yadav D, Pitchumoni CS. Association of diabetic ketoacidosis and acute pancreatitis: observations in 100 consecutive episodes of DKA. Am J Gastroenterol 2000; 95(10): 2795–2800.
9. Lerch MM, Gorelick FS. Early trypsinogen activation in acute pancreatitis. Med Clin North Am 2000; 84(3): 549–563.
10. Szmola R, Sahin-Tóth M. Chymotrypsin C (caldecrin) promotes degradation of human cationic trypsin: identity with Rinderknecht's enzyme Y. Proc Natl Acad Sci USA 2007; 104(27): 11227–11232.
11. Beer S, Zhou J, Szabó A et al. Comprehensive functional analysis of chymotrypsin C (CTRC) variants reveals distinct loss-of-function mechanisms associated with pancreatitis risk. Gut 2012.
12. Whitcomb DC, Lowe ME. Human pancreatic digestive enzymes. Dig Dis Sci 2007; 52(1): 1–17.
13. Laskowski M, Wu FC. Temporary inhibition of trypsin. J Biol Chem 1953; 204(2): 797–805.
14. Steward MC, Ishiguro H. Molecular and cellular regulation of pancreatic duct cell function. Curr Opin Gastroenterol 2009; 25(5): 447–453.
15. Schneider A, Löhr JM, Singer MV. The M-ANNHEIM classification of chronic pancreatitis: introduction of a unifying classification system based on a review of previous classifications of the disease. J Gastroenterol 2007; 42(2): 101–119.
16. Sarner M, Cotton PB. Classification of pancreatitis. Gut 1984; 25(7): 756–759.
17. Etemad B, Whitcomb DC. Chronic pancreatitis: diagnosis, classification, and new genetic developments. Gastroenterology 2001; 120(3): 682–707.
18. Frulloni L, Gabbrielli A, Pezzilli R et al. Chronic pancreatitis: report from a multicenter Italian survey (PanCroInfAISP) on 893 patients. Dig Liver Dis 2009; 41(4): 311–317.
19. Whitcomb DC, Yadav D, Adam S et al. Multicenter approach to recurrent acute and chronic pancreatitis in the United States: the North American Pancreatitis Study 2 (NAPS2). Pancreatology 2008; 8(4–5): 520–531.
20. Yadav D, Hawes RH, Brand RE et al. Alcohol consumption, cigarette smoking, and the risk of recurrent acute and chronic pancreatitis. Arch Intern Med 2009; 169(11): 1035–1045.
21. Kristiansen L, Grønbaek M, Becker U et al. Risk of pancreatitis according to alcohol drinking habits: a population-based cohort study. Am J Epidemiol 2008; 168(8): 932–937.
22. Irving HM, Samokhvalov AV, Rehm J. Alcohol as a risk factor for pancreatitis. A systematic review and meta-analysis. JOP 2009; 10(4): 387–392.
23. Corrao G, Bagnardi V, Zambon A et al. Exploring the dose-response relationship between alcohol consumption and the risk of several alcohol-related conditions: a meta-analysis. Addiction 1999; 94(10): 1551–1573.
24. Lankisch PG, Lowenfels AB, Maisonneuve P. What is the risk of alcoholic pancreatitis in heavy drinkers? Pancreas 2002; 25(4): 411–412.
25. Yadav D, Eigenbrodt ML, Briggs MJ et al. Pancreatitis: prevalence and risk factors among male veterans in a detoxification program. Pancreas 2007; 34(4): 390–398.
26. Deng X, Wang L, Elm MS et al. Chronic alcohol consumption accelerates fibrosis in response to cerulein-induced pancreatitis in rats. Am J Pathol 2005; 166(1): 93–106.
27. Singh M, LaSure MM, Bockman DE. Pancreatic acinar cell function and morphology in rats chronically fed an ethanol diet. Gastroenterology 1982; 82(3): 425–434.
28. Witt H, Luck W, Becker M et al. Mutation in the SPINK1 trypsin inhibitor gene, alcohol use, and chronic pancreatitis. JAMA 2001; 285(21): 2716–2717.
29. Rosendahl J, Witt H, Szmola R et al. Chymotrypsin C (CTRC) variants that diminish activity or secretion are associated with chronic pancreatitis. Nat Genet 2008; 40(1): 78–82.
30. Apte MV, Wilson JS, McCaughan GW et al. Ethanol-induced alterations in messenger RNA levels correlate with glandular content of pancreatic enzymes. J Lab Clin Med 1995; 125(5): 634–640.
31. Haber PS, Wilson JS, Apte MV et al. Chronic ethanol consumption increases the fragility of rat pancreatic zymogen granules. Gut 1994; 35(10): 1474–1478.
32. Apte MV, Phillips PA, Fahmy RG et al. Does alcohol directly stimulate pancreatic fibrogenesis? Studies with rat pancreatic stellate cells. Gastroenterology 2000; 118(4): 780–794.
33. Pandol SJ, Raraty M. Pathobiology of alcoholic pancreatitis. Pancreatology 2007; 7(2–3): 105–114.
34. Talamini G, Bassi C, Falconi M et al. Cigarette smoking: an independent risk factor in alcoholic pancreatitis. Pancreas 1996; 12(2): 131–137.
35. Chowdhury P, Bone RC, Louria DB et al. Effect of cigarette smoke on human serum trypsin inhibitory capacity and antitrypsin concentration. Am Rev Respir Dis 1982; 126(1): 177–179.
36. Bynum TE, Solomon TE, Johnson LR et al. Inhibition of pancreatic secretion in man by cigarette smoking. Gut 1972; 13(5): 361–365.
37. Crowley-Weber CL, Dvorakova K, Crowley C et al. Nicotine increases oxidative stress, activates NF-kappaB and GRP78, induces apoptosis and sensitizes cells to genotoxic/xenobiotic stresses by a multiple stress inducer, deoxycholate: relevance to colon carcinogenesis. Chem Biol Interact 2003; 145(1): 53–66.
38. Cavallini G, Talamini G, Vaona B et al. Effect of alcohol and smoking on pancreatic lithogenesis in the course of chronic pancreatitis. Pancreas 1994; 9(1): 42–46.
39. Tolstrup JS, Kristiansen L, Becker U et al. Smoking and risk of acute and chronic pancreatitis among women and men: a population-based cohort study. Arch Intern Med 2009; 169(6): 603–609.
40. Lindkvist B, Appelros S, Manjer J et al. A prospective cohort study of smoking in acute pancreatitis. Pancreatology 2008; 8(1): 63–70.
41. Castineira-Alvarino M, Luaces-Regueira M, Domínguez-Munoz JE. Tobacco has a synergistic effect with alcohol in pancreatic fibrogenesis: An in-vitro study in early and primary culture of pancreatic steallate cells. Pancreatology; 13 (3 Suppl): 53–54.
42. Stevens T, Conwell DL, Zuccaro G. Pathogenesis of chronic pancreatitis: an evidence-based review of past theories and recent developments. Am J Gastroenterol 2004; 99(11): 2256–2270.
43. Howes N, Lerch MM, Greenhalf W et al. Clinical and genetic characteristics of hereditary pancreatitis in Europe. Clin Gastroenterol Hepatol 2004; 2(3): 252–261.
44. Rebours V, Boutron-Ruault MC, Schnee M et al. The natural history of hereditary pancreatitis: a national series. Gut 2009; 58(1): 97–103.
45. Joergensen MT, Brusgaard K, Crüger DG et al. Genetic, epidemiological, and clinical aspects of hereditary pancreatitis: a population-based cohort study in Denmark. Am J Gastroenterol 2010; 105(8): 1876–1883.
46. Sahin-Tóth M, Tóth M. Gain-of-function mutations associated with hereditary pancreatitis enhance autoactivation of human cationic trypsinogen. Biochem Biophys Res Commun 2000; 278(2): 286–289.
47. Teich N, Rosendahl J, Tóth M et al. Mutations of human cationic trypsinogen (PRSS1) and chronic pancreatitis. Hum Mutat 2006; 27(8): 721–730.
48. Teich N, Le Maréchal C, Kukor Z et al. Interaction between trypsinogen isoforms in genetically determined pancreatitis: mutation E79K in cationic trypsin (PRSS1) causes increased transactivation of anionic trypsinogen (PRSS2). Hum Mutat 2004; 23(1): 22–31.
49. Kereszturi E, Szmola R, Kukor Z et al. Hereditary pancreatitis caused by mutation-induced misfolding of human cationic trypsinogen: a novel disease mechanism. Hum Mutat 2009; 30(4): 575–582.
50. Nemoda Z, Sahin-Tóth M. Chymotrypsin C (caldecrin) stimulates autoactivation of human cationic trypsinogen. J Biol Chem 2006; 281(17): 11879–11886.
51. Whitcomb DC. Genetic predisposition to alcoholic chronic pancreatitis. Pancreas 2003; 27(4): 321–326.
52. Witt H, Luck W, Becker M. A signal peptide cleavage site mutation in the cationic trypsinogen gene is strongly associated with chronic pancreatitis. Gastroenterology 1999; 117(1): 7–10.
53. Masson E, Le Maréchal C, Chandak GR et al. Trypsinogen copy number mutations in patients with idiopathic chronic pancreatitis. Clin Gastroenterol Hepatol 2008; 6(1): 82–88.
54. Le Maréchal C, Masson E, Chen JM et al. Hereditary pancreatitis caused by triplication of the trypsinogen locus. Nat Genet 2006; 38(12): 1372–1374.
55. Lowenfels AB, Maisonneuve P, DiMagno EP et al. Hereditary pancreatitis and the risk of pancreatic cancer. International Hereditary Pancreatitis Study Group. J Natl Cancer Inst 1997; 89(6): 442–446.
56. Malka D, Hammel P, Maire F et al. Risk of pancreatic adenocarcinoma in chronic pancreatitis. Gut 2002; 51(6): 849–852.
57. Witt H, Sahin-Tóth M, Landt O et al. A degradation-sensitive anionic trypsinogen (PRSS2) variant protects against chronic pancreatitis. Nat Genet 2006; 38(6): 668–673.
58. Rinderknecht H. Pancreatic secretory enzymes. In: Vay Liang WG, DiMagno EP, Gardner JD et al (eds). The Pankreas, Biology, Pathobiology, and Disease. New York: Raven Press 1993 : 219–251.
59. Witt H, Luck W, Hennies HC et al. Mutations in the gene encoding the serine protease inhibitor, Kazal type 1 are associated with chronic pancreatitis. Nat Genet 2000; 25(2): 213–216.
60. Ohmuraya M, Hirota M, Araki M et al. Autophagic cell death of pancreatic acinar cells in serine protease inhibitor Kazal type 3-deficient mice. Gastroenterology 2005; 129(2): 696–705.
61. Yadav D, Timmons L, Benson JT et al. Incidence, prevalence, and survival of chronic pancreatitis: a population-based study. Am J Gastroenterol 2011; 106(12): 2192–2199.
62. Threadgold J, Greenhalf W, Ellis I et al. The N34S mutation of SPINK1 (PSTI) is associated with a familial pattern of idiopathic chronic pancreatitis but does not cause the disease. Gut 2002; 50(5): 675–681.
63. Whitcomb DC. Genetic risk factors for pancreatic disorders. Gastroenterology 2013; 144(6): 1292–1302.
64. Kuwata K, Hirota M, Shimizu H et al. Functional analysis of recombinant pancreatic secretory trypsin inhibitor protein with amino-acid substitution. J Gastroenterol 2002; 37(11): 928–934.
65. Witt H, Luck W, Hennies HC et al. Mutations in the gene encoding the serine protease inhibitor, Kazal type 1 are associated with chronic pancreatitis. Nat Genet 2000; 25(2): 213–216.
66. Cohn JA, Friedman KJ, Noone PG et al. Relation between mutations of the cystic fibrosis gene and idiopathic pancreatitis. N Engl J Med 1998; 339(10): 653–658.
67. Sharer N, Schwarz M, Malone G et al. Mutations of the cystic fibrosis gene in patients with chronic pancreatitis. N Engl J Med 1998; 339(10): 645–652.
68. Noone PG, Zhou Z, Silverman LM et al. Cystic fibrosis gene mutations and pancreatitis risk: relation to epithelial ion transport and trypsin inhibitor gene mutations. Gastroenterology 2001; 121(6): 1310–1319.
69. Chen JM, Férec C. Genetics and pathogenesis of chronic pancreatitis: the 2012 update. Clin Res Hepatol Gastroenterol 2012; 36(4): 334–340.
70. LaRusch J, Whitcomb DC. Genetics of pancreatitis. Curr Opin Gastroenterol 2011; 27(5): 467–474.
71. Felderbauer P, Klein W, Bulut K et al. Mutations in the calcium-sensing receptor: a new genetic risk factor for chronic pancreatitis? Scand J Gastroenterol 2006; 41(3): 343–348.
72. Muddana V, Lamb J, Greer JB et al. Association between calcium sensing receptor gene polymorphisms and chronic pancreatitis in a US population: role of serine protease inhibitor Kazal 1 type and alcohol. World J Gastroenterol 2008; 14(28): 4486–4491.
73. Chen JM, Férec C. Chronic pancreatitis: genetics and pathogenesis. Annu Rev Genomics Hum Genet 2009; 10 : 63–87.
74. Spicak J, Pulkertova A, Kralova-Lesna I et al. Alcoholic chronic pancreatitis and liver cirrhosis: coincidence and differences in lifestyle. Pancreatology 2012; 12(4): 311–316.
75. Carey MC, Díte P, Gabryelewicz A et al. Future Perspectives in Gastroenterology. Dordrecht, The Netherlands: Springer 2008.
76. Pezzilli R. Etiology of chronic pancreatitis: has it changed in the last decade? World J Gastroenterol 2009; 15(38): 4737–4740.
77. Boerma D, Straatsburg IH, Offerhaus GJ et al. Experimental model of obstructive, chronic pancreatitis in pigs. Dig Surg 2003; 20(6): 520–526.
78. Reber HA, Karanjia ND, Alvarez C et al. Pancreatic blood flow in cats with chronic pancreatitis. Gastroenterology 1992; 103(2): 652–659.
79. Spicak J, Poulova P, Plucnarova J et al. Pancreas divisum does not modify the natural course of chronic pancreatitis. J Gastroenterol 2007; 42(2): 135–139.
80. Bertin C, Pelletier AL, Vullierme MP et al. Pancreas divisum is not a cause of pancreatitis by itself but acts as a partner of genetic mutations. Am J Gastroenterol 2012; 107(2): 311–317.
81. Sahel J, Sarles H. Modifications of pure human pancreatic juice induced by chronic alcohol consumption. Dig Dis Sci 1979; 24(12): 897–905.
82. Bockman DE, Kennedy RH, Multigner L et al. Fine structure of the organic matrix of human pancreatic stones. Pancreas 1986; 1(3): 204–210.
83. Multigner L, De Caro A, Lombardo D et al. Pancreatic stone protein, a phosphoprotein which inhibits calcium carbonate precipitation from human pancreatic juice. Biochem Biophys Res Commun 1983; 110(1): 69–74.
84. Multigner L, Sarles H, Lombardo D et al. Pancreatic stone protein. II. Implication in stone formation during the course of chronic calcifying pancreatitis. Gastroenterology 1985; 89(2): 387–391.
85. Bimmler D, Graf R, Scheele GA et al. Pancreatic stone protein (lithostathine), a physiologically relevant pancreatic calcium carbonate crystal inhibitor? J Biol Chem 1997; 272(5): 3073–3082.
86. Mahurkar S, Bhaskar S, Reddy DN et al. Comprehensive screening for reg1alpha gene rules out association with tropical calcific pancreatitis. World J Gastroenterol 2007; 13(44): 5938–5943.
87. Hawrami K, Mohan V, Bone A et al. Analysis of islet regenerating (reg) gene polymorphisms in fibrocalculous pancreatic diabetes. Pancreas 1997; 14(2): 122–125.
88. Klöppel G, Maillet B. The morphological basis for the evolution of acute pancreatitis into chronic pancreatitis. Virchows Arch A Pathol Anat Histopathol 1992; 420(1): 1–4.
89. DiMagno EP, Layer P, Clain JE. Chronic pancreatitis. In: Vay Liang WG, DiMagno EP, Gardner JD et al (eds). The Pankreas, Biology, Pathobiology, and Disease. New York: Raven Press 1993 : 665–706.
90. Bordalo O, Goncalves D, Noronha M et al. Newer concept for the pathogenesis of chronic alcoholic pancreatitis. Am J Gastroenterol 1977; 68(3): 278–285.
91. Braganza JM. Pancreatic disease: a casualty of hepatic “detoxification”? Lancet 1983; 2(8357): 1000–1003.
92. Schneider A, Whitcomb DC. Hereditary pancreatitis: a model for inflammatory diseases of the pancreas. Best Pract Res Clin Gastroenterol 2002; 16(3): 347–363.
93. Watari N, Hotta Y, Mabuchi Y. Morphological studies on a vitamin A-storing cell and its complex with macrophage observed in mouse pancreatic tissues following excess vitamin A administration. Okajimas Folia Anat Jpn 1982; 58(4–6): 837–858.
94. Ikejiri N. The vitamin A-storing cells in the human and rat pancreas. Kurume Med J 1990; 37(2): 67–81.
95. Bachem MG, Schneider E, Gross H et al. Identification, culture, and characterization of pancreatic stellate cells in rats and humans. Gastroenterology 1998; 115(2): 421–432.
96. Apte MV, Haber PS, Applegate TL et al. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture. Gut 1998; 43(1): 128–133.
97. Apte MV, Phillips PA, Fahmy RG et al. Does alcohol directly stimulate pancreatic fibrogenesis? Studies with rat pancreatic stellate cells. Gastroenterology 2000; 118(4): 780–794.
98. Apte MV, Pirola RC, Wilson JS. Battle-scarred pancreas: role of alcohol and pancreatic stellate cells in pancreatic fibrosis. J Gastroenterol Hepatol 2006; 21 (Suppl 3): 97–101.
99. Norman J, Franz M, Riker A et al. Rapid elevation of pro-inflammatory cytokines during acute pancreatitis and their origination within the pancreas. Surg Forum 1994; 45 : 148–160.
100. Yokota T, Denham W, Murayama K et al. Pancreatic stellate cell activation and MMP production in experimental pancreatic fibrosis. J Surg Res 2002; 104(2): 106–111.
101. Menke A, Yamaguchi H, Gress TM et al. Extracellular matrix is reduced by inhibition of transforming growth factor beta1 in pancreatitis in the rat. Gastroenterology 1997; 113(1): 295–303.
102. Yadav D, Whitcomb DC. The role of alcohol and smoking in pancreatitis. Nat Rev Gastroentol Hepatol 2010; 7(3): 131–45.
103. Woessner JF Jr. The family of matrix metalloproteinases. Ann N Y Acad Sci 1994; 732 : 11–21.
104. Ishihara T, Hayasaka A, Yamaguchi T et al. Immunohistochemical study of transforming growth factor-beta 1, matrix metalloproteinase-2,9, tissue inhibitors of metalloproteinase-1,2, and basement membrane components at pancreatic ducts in chronic pancreatitis. Pancreas 1998; 17(4): 412–418.
105. Phillips PA, McCarroll JA, Park S et al. Rat pancreatic stellate cells secrete matrix metalloproteinases: implications for extracellular matrix turnover. Gut 2003; 52(2): 275–282.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2013 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Letní gastroenterologický koktejl
- Kvíz – známá osobnost
- Manometrie jícnu
- Vzácný typ achalázie jícnu III. typu řešený perorální endoskopickou myotomií (POEM)
- Biopsie nejsou dostatečné pro přesnou diagnostiku neoplazie u pacientů s Barrettovým jícnem
- Úspěšná endoskopická léčba makroskopicky pokročilého adenokarcinomu jícnu u rizikového pacienta
- Etiopatogeneze chronické pankreatitidy
- Inhibitory protonové pumpy: vedlejší účinky a interakce
- Experimentální model perianální píštěle na malém laboratorním zvířeti
- Guidelines for the administration of biological therapy in patients with inflammatory bowel diseases – the amendment to the 2nd editon
- Současnost a budoucnost v léčbě Crohnovy nemoci
- Ulcerózní kolitida komplikovaná tromboembolizmem a toxickým megakolon – existuje souvislost toxického megakolon s antikoagulační terapií?
- Léčba těžké ataky ulcerózní kolitidy – komentář ke kazuistice dr. Mokré
- Problém nemusí být tak jednoduchý, jak se na první pohled jeví – komentář k Doporučení ČGS pro podávání antiagregační terapie kyselinou acetylsalicylovou
- Májové hepatologické dny
- Ostrava Live Endoscopy (OLE) 2013
- Správná odpověď na kvíz
- Autodidaktický test: klinická a experimentální gastroenterologie
- Pentasa Sachet 2 g
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Manometrie jícnu
- Pentasa Sachet 2 g
- Inhibitory protonové pumpy: vedlejší účinky a interakce
- Vzácný typ achalázie jícnu III. typu řešený perorální endoskopickou myotomií (POEM)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



