-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nové pohledy na zařazení farmakoterapie do algoritmu léčby jaterních metastáz kolorektálního karcinomu
New perspectives on pharmacotherapy in the algorithm of colorectal cancer liver metastases management
Neoadjuvant systemic pharmacotherapy has the potential to convert initially unresectable metastases to resectable ones. The exact criteria for patient selection, optimum therapeutic regime and duration of neoadjuvant therapy, including the timing of surgical intervention, depend on many factors related to the patient (performance status, co-morbidities, etc.) and to the disease (extent and localization of metastases, synchronous vs metachronous form, etc.). The real conversion rate is likely to be low.
Key words:
colorectal cancer – liver metastases – treatment – conversion
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
29. 8. 2014Accepted:
2. 10. 2014
Autoři: L. Petruželka 1; M. Ryska 2; Z. Krška 3; M. Vočka 1; P. Georgiev 1; J. Pudil 2
Působiště autorů: Onkologická klinika 1. LF UK a VFN – ÚVN Praha 1; Chirurgická klinika 2. LF UK a ÚVN Praha 2; I. chirurgická klinika 1. LF UK a VFN Praha 3
Vyšlo v časopise: Gastroent Hepatol 2014; 68(5): 424-429
Kategorie: Gastrointestinální onkologie: přehledová práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh2014424Souhrn
Neoadjuvantní systémová farmakoterapie má potenciál konvertovat iniciálně neresekabilní metastázy do resekabilního stavu. Přesná kritéria pro výběr nemocných, optimální režim farmakoterapie, trvání neoadjuvantní terapie včetně načasování chirurgické intervence závisí na řadě faktorů jak ze strany nemocného (PS, přidružená onemocnění), tak ze strany choroby (rozsah a lokalizace metastáz, synchronní vs metachronní postižení). Skutečná frekvence konverzí je pravděpodobně nízká.
Klíčová slova:
kolorektální karcinom – jaterní metastázy – léčba – konverze
V posledních 20 letech byl zaznamenán významný pokrok v léčbě kolorektálního karcinomu. Medián přežití metastazujícího onemocnění, který činil u neléčeného onemocnění 3–6 měsíců, dosahuje v současnosti až 30 měsíců [1–3]. Historickým standardem léčby metastazujícího kolorektálního karcinomu byla systémová chemoterapie 5-fluorouracilem (5-FU). V metaanalýze bylo prokázáno, že přidání leukovorinu (LV) k 5-FU zvyšuje počty objektivních léčebných odpovědí z 11 % na 21 % a prodlužuje medián doby přežití na téměř 12 měsíců. Zavedení účinnějšího a lépe tolerovaného kontinuálního podání 5-FU a začlenění irinotekanu a oxaliplatiny do kombinovaných režimů představovalo počátek nové éry chemoterapie metastazujícího kolorektálního karcinomu (mCRC) [4]. Po inovaci režimů chemoterapie dosahuje počet objektivních léčebných odpovědí (objective therapeutic response – OTR) v 1. linii rozmezí 35–60 % i více a medián doby přežití ≥ 20 měsíců. Nové léky měly původně nahradit 5-FU, ale u žádného z nich nebyla prokázána v monoterapii větší účinnost, a tak byla cesta nalezena v jejich kombinaci s 5-FU. Režimy FOLFOX (5-FU, LV, oxaliplatina) a FOLFIRI (5-FU, LV, irinotekan), XELOX (kapecitabin, oxaliplatina) a později FOLFIRINOX (5-FU, LV, irinotekan, oxaliplatina) jsou kombinace standardně používané v klinické praxi. Postupné rozpoznávání klíčových molekulárních struktur v nádorové buňce (EGFR – receptor pro epidermální růstový faktor; RAS – klíčový onkogen signální transdukce) a nádorovém mikroprostředí (VEGF(r) – vaskulární endotelový růstový faktor (receptor)) urychlilo nástup cílené léčby a do léčebného armamentaria kolorektálního karcinomu přibyl kromě bevacizumabu, cetuximabu a panitumumabu později ještě ziv-aflibercept a regorafenib [5]. Kromě tyrozinkinázového inhibitoru regorafenibu jsou všechny ostatní léky na bázi monoklonálních protilátek a potřebují k vyjádření účinnosti „partnerský“ chemoterapeutický režim. Chemoterapeutické režimy FOLFOX/FOLFIRI/FOLFIRINOX jsou patrně maximem možného efektu konvenční chemoterapie, a tak další zlepšení spočívá v kombinaci chemoterapie s cílenou biologickou léčbou (chemoterapie plus cetuximab/panitumumab nebo bevacizumab/aflibercept). Inkrementální prodloužení celkového přežití pacientů s mCRC v poslední dekádě je evidentní. Poslední prezentovaná velká klinická studie s mediánem přežití téměř 30 měsíců CALGB/SWOG 80405 je toho důkazem [6]. Ekvivalentní výsledky všech čtyř ramen otvírají pro onkology a pacienty možnost uplatnění principů personalizované medicíny jak pro volbu cílené léčby, tak pro volbu chemoterapeutického partnera při léčbě metastazujícího onemocnění. Účinnost režimů FOLFOX nebo FOLFIRI je ekvivalentní při rozdílném profilu nežádoucích účinků. FOLFIRI způsobuje alopecii a je ve srovnání s oxaliplatinou více emetogenní s rizikem průjmových komplikací. Tato kombinace může být hůře tolerována u nemocných s Gilbertovým syndromem a při UGT1A1 polymorfizmu. Limitací kombinace FOLFOX je periferní neuropatie. Pro oxaliplatinu je neurotoxicita dávky limitujícím specifickým nežádoucím účinkem. Riziko se zvyšuje s délkou podání. Na rozdíl od ostatních nežádoucích účinků chemoterapie (alopecie, nevolnost) můžou tyto účinky přetrvávat měsíce a roky po léčbě a u některých pacientů (< 5 %) nedojde k úplnému zotavení. Nežádoucí účinky cílené antiEGFR a antiVEGF léčby jsou též rozdílné, přičemž jejich výskyt je ve všech klinických studiích konzistentní. Ekvivalentní výsledky léčby neznamenají potlačení nezbytnosti stanovení molekulárních prediktorů (pro rozhodovací proces je nutné vždy před zahájením léčby vyšetřit minimálně RAS status).
Základy léčebné strategie mCRC
Strategie léčby mCRC se odvíjí od léčebného záměru [7].
- Potenciálně kurabilní záměr – cílem je vyléčení (dlouhodobá kontrola choroby):
- předoperační (perioperační) systémová léčba iniciálně resekabilních jaterních (plicních) metastáz,
- pooperační (postresekční) systémová léčba následně po resekci jaterních (plicních) metastáz,
- předoperační (neoadjuvantní, konverzní) systémová léčba iniciálně neresekabilních (potenciálně konvertibilních) jaterních metastáz s předpokladem konverze na resekabilní stav.
- Radikální záměr – cílem je prodloužení doby přežití a doby do progrese onemocnění:
- déletrvající kontrola nádorového růstu při chronicky podávané systémové léčbě.
- Paliativní záměr – cílem je symptomatická úleva a zlepšení kvality života:
- kontrola symptomů při redukci nádorové masy paliativní systémovou léčbou s minimem nežádoucích účinků.
Kritickým faktorem, který musí být vzat v úvahu při volbě terapeutického postupu, je výkonnostní stav nemocného (performance status – PS) [8]. Výběr léčby u nemocných v příznivém PS (PS 0 nebo PS 1) se liší od nemocných se sníženým stavem výkonnosti (PS 2 nebo PS 3). Důležité je vyhodnocení jak výkonnostního stavu, tak komorbidit. Přidružená onemocnění jsou definována jako zdravotní problémy nesouvisející s nádorovým onemocněním, které ale mohou ovlivnit PS. U nemocných s PS > 2 nebo se závažnými komorbiditami není možné podat agresivní léčbu, a pro některé nemocné tak může být největším přínosem léčba podpůrná. Klinicky symptomatické onemocnění je známkou agresivního průběhu onemocnění. U nemocných s horším PS z důvodu symptomatologie nádorového onemocnění by měla být jako první zvažována „agresivnější“ kombinace chemoterapie s přidáním cílené biologické léčby (schéma 1). Cílem je rychlé zmenšení nádorové masy a symptomatická úleva. Definitivní výběr léčby musí vycházet z rozhodnutí interdisciplinárního týmu [9]. Pro systémovou léčbu mCRC 1. linie existuje řada možností od monochemoterapie přes triplety až po biochemoterapii. Definitivní výběr léčby vychází z týmového rozhodnutí při skloubení klinické a molekulární predikce. Výběr a načasování optimálního režimu má stále řadu neznámých a je zde poměrně široká paleta víceméně rovnocenných možností parenterální léčby včetně kombinací obsahujících kapecitabin. Ani výsledky klinických studií fáze III zatím nepřinesly jednoznačnou odpověď na optimální volbu léčebného režimu [6,10,11].
Schéma 1. Faktory ve vztahu k nádorovému onemocnění ovlivňující léčebný přístup. Scheme 1. Factors in relation to cancer affecting therapeutic approach. 
Specifika léčby jaterních metastáz mCRC
Při léčbě jaterních (plicních) metastáz jako jediného sídla metastatického procesu je možné dosáhnout dlouhodobé kontroly choroby jedině při multimodalitním přístupu spočívajícím ve správném načasování chirurgické resekce metastáz a systémové léčby. Resekce jaterních metastáz je proto neopominutelnou součástí standardní léčebné strategie [12,13]. Při nevhodném postupu bez chirurgické intervence může nemocný přijít o šanci na vyléčení. Obdobně nezařazení farmakologické léčby může negativně ovlivnit léčebný výsledek. Játra jsou nejčastějším sídlem metastatického procesu kolorektálního karcinomu. Jaterní metastázy se vyvinou v průběhu choroby (metachronní metastázy) u 50–60 % nemocných s pokročilým CRC a v 15–25 % jsou metastázy prokázány již při iniciální diagnóze (synchronní metastázy) [14]. U 20–35 % nemocných je metastatický proces pouze v játrech. U 20–25 % nemocných jsou jaterní metastázy chirurgicky resekabilní a u dalších 10–15 % se stanou resekabilními po chemoterapii (konverzní neoadjuvantní systémová léčba) (schéma 2). Při nárůstu počtu nemocných, u kterých je provedena resekce jaterních metastáz, se pětileté přežití pohybuje mezi 45 a 60 % [15]. Cílem chirurgické intervence je odstranění všech metastatických lézí s negativními okraji (R0 resekce). Definice chirurgické resekability se značně změnila v průběhu posledních dvou desetiletí. Po samostatném chirurgickém výkonu se do pěti let až u 55–65 % objeví recidiva onemocnění a je žádoucí doplnit chirurgický výkon léčbou farmakologickou [16]. Zařazení postresekční systémové léčby prokazatelně přispívá ke snížení výskytu recidiv. V multicentrické analýze bylo prokázano, že chemoterapie (před - nebo pooperační) významně prodlužuje přežití bez recidivy onemocnění (relaps-free survival – RFS), HR = 0,56 (CI 0,33–0,65), při mediánu doby do recidivy 16,3 měsíce a pětiletém přežití 56,7 % [17].
Schéma 2. Konverzní farmakoterapie v praxi. Scheme 2. Conversion pharmacotherapy in practice. 
Resekce jaterních metastáz v klinické praxi
Význam chirurgické resekce je neoddiskutovatelný pro jednoznačné doklady o prodloužení přežití a je modalitou volby, jakmile je to klinicky možné. V klinické praxi se jedná o ne více než 20 % nemocných s izolovaným metastatickým jaterním postižením, potenciálně vhodných ke kurativní resekci. U většiny nemocných s izolovaným jaterním postižením je vyloučena možnost chirurgické intervence z důvodu velikosti, lokalizace metastáz, multifokálnímu postižení nebo nedostatečné funkční rezervě zbylého jaterního parenchymu.
Konverzní léčba pro iniciálně neresekabilní (potenciálně konvertibilní) metastázy
Termín „konverzní terapie“ je používán pro indukční systémovou léčbu jaterních metastáz primárně neřešitelných chirurgickou resekcí [3]. Podle publikovaných souborů se ukazuje, že u 12–33 % pacientů s „iniciálně neresekabilními“ jaterními metastázami lze dosáhnout objektivní léčebné odpovědi umožňující následnou radikální (R0) resekci [18,19].
Není nutné vyčkávat na nejlepší objektivní léčebnou odpověď – chirurgický výkon by měl být indikován ihned, jakmile je stav posouzen jako chirurgicky řešitelný. Kompletní regrese činí chirurgický výkon z topografického hlediska složitějším a hlavně prodloužení doby podávání chemoterapie může vést k toxickému poškození jaterního parenchymu. Pouze pravidelné a časné hodnocení zobrazovacích nálezů odborným týmem tak umožní včasnou a správnou indikaci resekčního výkonu. U každého nemocného by měla být pravidelně vyhodnocována možnost resekability v rámci interdisciplinárního týmu v krátkých časových intervalech (cca dva měsíce) za pomoci standardních zobrazovacích metod. Prodloužení doby podávání indukční chemoterapie zvyšuje riziko toxického poškození jaterního parenchymu. Typ chemoterapie/biochemoterapie má větší vliv na dosažení objektivní léčebné odpovědi než celková doba podávání. Konverzní (neoadjuvantní léčbu) je nutné odlišit od perioperační léčby, která je podávána u onemocnění, které je primárně chirurgicky resekabilní [20]. Definice iniciálně neresekabilního onemocnění je i při používání jednotných kritérií částečně subjektivní a je částečně ovlivněna „radikalitou přístupu“ jaterního chirurga. Ke skutečné konverzi primárně jednoznačně neresekabilních onemocnění dochází po neoadjuvantní chemoterapii u omezeného počtu nemocných. Počet objektivních léčebných odpovědí (ORR) nekoresponduje s podílem resekčních výkonů (resection rate) a údaje z klinických studií je třeba posuzovat z tohoto pohledu. Je to jeden z důvodů, proč by „jaterní chirurgie“ měla být prováděna ve vysoce erudovaných centrech disponujících vysoce erudovanými a zkušenými týmy. Členy týmů širšího „nového“ typu jsou molekulární patologové, molekulární biologové a další. I při nejvíce radikálních režimech lze systémové terapie dosáhnout po neoadjuvantní chemoterapii patologicky ověřených regresí pouze ve 4–9 %. Zobrazovací regrese neznamená, že se jedná o kompletní patologickou remisi. V jednom z největších publikovaných souborů zabývajícím se touto problematikou byly u 83 % lézí přítomny viabilní nádorové buňky [21]. Cílem indukční systémové léčby jaterních metastáz není dosáhnout kompletní regrese, ale zmenšit nádorová ložiska zejména ve vztahu k cévním strukturám umožňujícím radikální resekci. Pokud dojde k úplné klinické regresi, je resekce stále vhodná. Hlavním problémem je identifikace reziduální „rizikové“ oblasti pro resekci. Kontroverzní otázkou zůstává hodnocení viability pomocí PET/CT scanu.
Pravděpodobnost konverze závisí na řadě faktorů, včetně subjektivity hodnocení resekability jaterním chirurgem, a pravděpodobnost dosažení resekability má relativně široké rozmezí. Pacienti s iniciálně neresekabilním metastatickým CRC mohou být podle návrhu National Comprehensive Cancer Network (NCCN) kategorizováni na potenciálně konvertibilní nebo nekonvertibilní (tab. 2). U nemocných s nekonvertibilním onemocněním je hlavní modalitou volby systémová léčba s paliativním záměrem, zatímco u potenciálně konvertibilního onemocnění je indikována radikální neoadjuvantní chemoterapie a cílená biologická léčba.
Tab. 1. Porovnání konverzní a perioperační léčby. Tab. 1. Comparison of conversion and perioperative treatment. 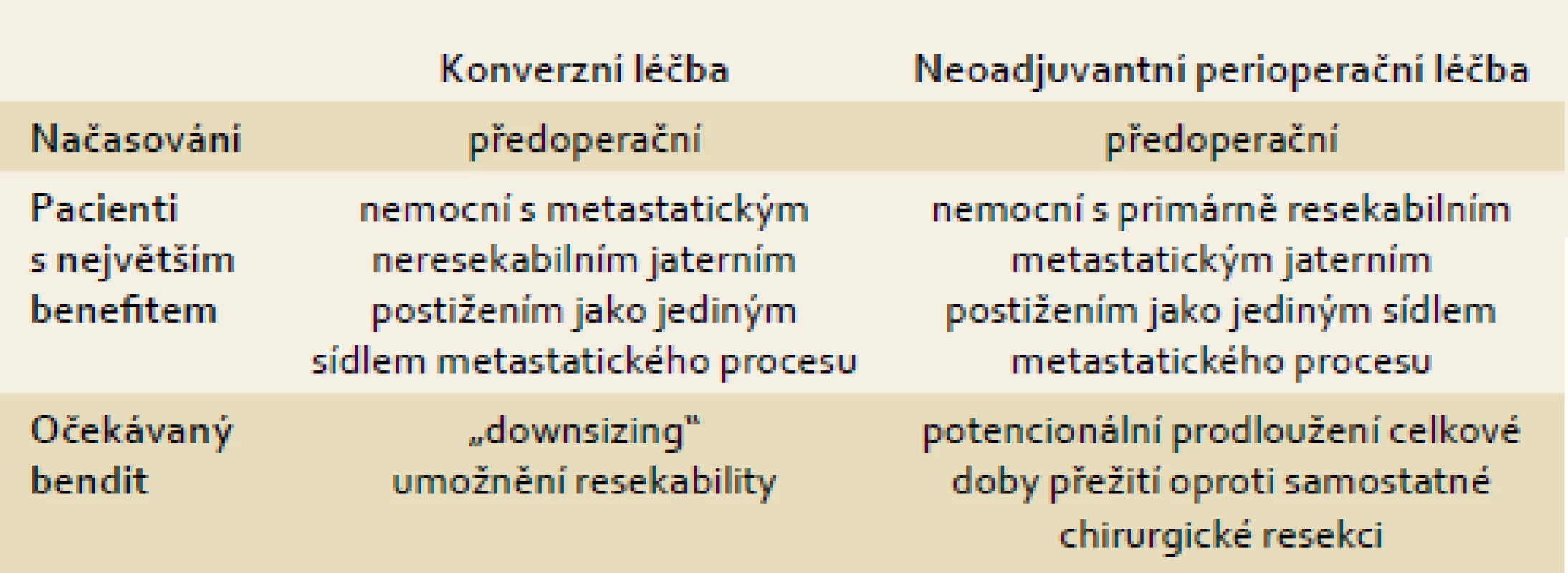
Tab. 2. Základní klinické scénáře v praxi. Tab. 2. Basic clinical scenarios in practice. 
U primárně resekabilních jaterních metastáz je doporučeno upřednostnit chirurgickou resekci před neoadjuvantní systémovou léčbou.
Výsledky studie EPOC (FOLFOX s cetuximabem, nebo bez cetuximabu po 12 týdnů před chirurgickou intervencí a 12 týdnů po chirurgické intervenci) přineslo horší dobu bez progrese choroby (PFS) při kombinaci chemoterapie s cílenou léčbou (14,8 vs 24,2 měsíců) [20]. V případě potenciálně resekabilního onemocnění, pokud není resekce první modalitou, by měla být perioperační samostatná chemoterapie upřednostněna před kombinací s biologickou cílenou léčbou.
Potenciálním rizikem neoadjuvantní chemoterapie je progrese v průběhu aplikace. Progrese v průběhu chemoterapie je znamením nepříznivé prognózy a chemoterapie 2. linie by měla být upřednostněna před chirurgickou resekcí [21].
Hodnocení radikality resekce R0 není tak striktní jako v minulosti. V rozsáhlé analýze nebyly prokázány rozdíly v pětiletém přežití nebo četnosti recidiv při volných okrajích od 1 mm do 4 mm, od 5 mm do 9 mm nebo > 10 mm. Pouze u pacientů s pozitivními okraji bylo horší přežití a vyšší četnost recidiv. Nejistota dosáhnout čistých resekčních okrajů není striktní kontraindikací resekce, i když R0 resekce zůstává stále hlavním cílem při chirurgické intervenci [22–27].
Nežádoucí účinky neoadjuvantní systémové léčby
Nežádoucí projevy hepatotoxicity (steatóza, nealkoholická steatohepatitida, vaskulární poškození, modulární regenerativní hyperplazie) při předoperační léčbě jsou jednou z limitací předoperační systémové léčby. Režimy s oxaliplatinou jsou spojeny s vyšší četností venookluzivního onemocnění. Projevují se především hemoragickými nekrózami a vznikem degenerativní nodulární hyperplazie. Makroskopicky se tyto změny označují jako tzv. „blue liver“. Tyto změny zásadně neovlivňují mortalitu, ale mohou vést k většímu pooperačnímu krvácení a nutnosti podávání krevních derivátů. Režimy s irinotekanem byly spojeny s vyšší četností výskytu steatózy a steatohepatitidy, která může mít bezprostřední vliv na pooperační mortalitu nemocných. Limitací použití systémové léčby před jaterní resekcí je možné toxické poškození. Steatohepatitida byla zaznamenána častěji po chemoterapii u nemocných s vysokým body mass indexem (BMI), což může též vysvětlovat vyšší výskyt komplikací v amerických studiích, kde byly vaskulární léze více pozorovány u evropské populace. Riziko toxického poškození závisí na trvání a načasování předoperační chemoterapie. Podávání chemoterapie déle než 12 týdnů nebo interval čtyř týdnů nebo méně mezi ukončením chemoterapie a resekcí zvyšují riziko postchirurgických komplikací, vyšší počet reoparecí a prodloužení hospitalizace. Podle jiných zdrojů podávání chemoterapie déle než 16 týdnů zvyšuje riziko jaterního poškození a pooperačních komplikací bez navýšení léčebných odpovědí. Ukazuje se, že vyšetření supermagnetickou nukleární rezonancí (iron oxide-enhanced MRI) by mohlo být použitelné pro předoperační detekci sinusoidálního postižení po neoadjuvantní chemoterapii. Tato MRI technologie není zatím všeobecně dostupná [28]. Časné zjištění jaterního postižení může být podkladem k odložení chirurgické intervence. Monoklonální protilátka bevacizumab ovlivňující angiogenezi má specifické projevy toxicity, jako jsou krvácení, narušení procesu hojení a možné narušení regeneračních procesů jater. Při analýze proveditelnosti a bezpečnosti resekčních výkonů nebylo doloženo riziko krvácení nebo poruch hojení při aplikaci bevacizumabu před resekcí. Zda bevacizumab narušuje jaterní regeneraci po embolizaci portální žíly, není jednoznačně doloženo. Vzhledem k delšímu plazmatickému poločasu bevacizumabu (20 hod) je doporučován 6–8týdenní interval mezi ukončením bevacizumabu a chirurgickou intervencí. Některé výsledky ukazují na možnost zkrácení intervalu na pět týdnů bez nárůstu rizika komplikací. V některých sděleních se uvažuje o možnosti snížení incidence a intenzity s oxaliplatinou spojeného jaterního poškození. Nutná je validace v prospektivních studiích.
Doporučení a závěr
V klinické praxi musí interdisciplinární týmy řešit tři základní modelové situace:
- pacient s primárně resekabilními jaterními metastázami,
- pacient s primárně neresekabilními metastázami, u kterých lze předpokládat možnost dosažení sekundární resekability,
- pacient s metastázami, u kterého nelze předpokládat, že bude dosaženo resekability.
Indukční léčba má za cíl:
- umožnění resekability primárně neresekabilních jaterních metastáz,
- zvýšení počtu R0 resekcí (pozn. kompletní resekce jaterních metastáz je stále podmínkou dlouhodobého léčebného výsledku),
- zabránění vzniku recidiv po chirurgickém výkonu (platí pro primárně resekabilní stav a kombinaci s postresekční léčbou).
Výběr a načasování optimální systémové léčby (chemoterapie a cílená biologická léčba) nebyl doposud určen. Vzhledem k rozmanitosti klinických situací a heterogenitě nádorů lze stanovit jen obecné principy [29,30]. Je všeobecně přijatým konsenzem, že léčebný postup by měl stanovit multidisplinární tým.
Tato práce byla podpořena grantem MPO TIP FR-TI3/666 a PRVOUK-P-27/LF1/1.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 29. 8. 2014
Přijato: 2. 10. 2014
prof. MUDr. Luboš Petruželka, CSc.
Onkologická klinika 1. LF UK a VFN – ÚVN Praha
U Nemocnice 499/2, 12 800 Praha 2
lubos.petruzelka@vfn.cz
Zdroje
1. Petruželka L. Kolorektální karcinom. In: Marek J (ed.). Farmakoterapie vnitřních nemocí. 4. ed. Praha: Grada 2010 : 554–558.
2. Heinemann V, Douillard JY, Ducreux M et al. Targeted therapy in metastatic colorectal cancer – an example of personalised medicine in action. Cancer Treat Rev 2013; 39(6): 592–601. doi: 10.1016/j.ctrv.2012.12.011.
3. Stein A, Bokemeyer C. Prolonging survival through a personalized approach in metastatic colorectal cancer. J Oncopathology 2013; 1(3): 31–41. doi: 10.13032/tjop.2052-5931.100047.
4. Venook AP, Weiser MR, Tepper JE. Colorectal cancer: all hands on deck. ASCO University Educational Book 2014. [online]. Available from: http://meetinglibrary.asco.org/content/114000083-144.
5. Jain VK, Hawkes EA, Cunningham D. Integration of biologic agents with cytotoxic chemotherapy in metastatic colorectal cancer. Clin Colorectal Cancer 2011; 10(4): 245–257. doi: 10.1016/j.clcc.2011.04.001.
6. Venook AP, Niedzwiecki D, Lenz HJ et al. CALGB/SWOG 80405: Phase III trial of irinotecan/5-FU/leucovorin (FOLFIRI) or oxaliplatin/5-FU/leucovorin (mFOLFOX6) with bevacizumab or cetuximab for patients with KRAS wild-type untreated metastatic adenocarcinoma of the colon or rectum. ASCO Annual Meeting. LBA3 2014.
7. Schmoll HJ, Van Cutsem E, Stein A et al. ESMO consensus guidelines for management of patients with colon and rectal cancer. A personalized approach to clinical decision making. Ann Oncol 2012; 23(10): 2479–2516.
8. Petruželka L, Vočka M, Georgiev P. Individualizace léčby nemocných s metastazujícím kolorektálním karcinomem – současný stav a výhledy. In: Kolorektální karcinom. Farmakoterapie 2013.
9. Grusenmeyer PA, Grubbs SS. Developing and implementing multidisciplinary disease-specific clinics in cancer care. Gastrointestinal (colorectal) cancer. ASCO Educational Book 2009.
10. Heinemann V, von Weikersthal LF, Decker T et al. Randomized comparison of FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment of KRAS-wildtype metastatic colorectal cancer: German AIO study KRK-0306 (FIRE-3). ASCO Annual Meeting 2013: Abstr. LBA3506.
11. Oliner KS, Douillard JY, Sienna S et al. Analysis of KRAS/NRAS and BRAF mutations in the phase III PRIME study of panitumumab plus FOLFOX versus FOLFOX as first-line treatment for metastatic colorectal cancer. ASCO Annual Meeting 2013: Abstr. 3511.
12. Morris EJ, Forman D, Thomas JD et al. Surgical management and outcomes of colorectal cancer liver metastases. Br J Surg 2010; 97(7): 1110–1118. doi: 10.1002/bjs.7032.
13. Petruželka L. Indikace indukční systémové léčby jaterních metastáz. Postgraduální medicína 2010; 3 : 324–328.
14. Adam R, Wicherts DA, de Haas RJ et al. Patients with initially unresectable colorectal liver metastases: is there a possibility of cure? J Clin Oncol 2009; 27(11): 1829–1835. doi: 10.1200/JCO.2008.19.9273.
15. De Jong MC, Pulitano C, Ribero D et al. Rates and patterns of recurrence following curative intent surgery for colorectal liver metastasis: an international multi-institutional analysis of 1669 patients. Ann Surg 2009; 250(3): 440–448. doi: 10.1097/SLA.0b013e3181b4539b.
16. Viganò L, Capussotti L, Lapointe R et al. Early recurrence after liver resection for colorectal metastases: risk factors, prognosis, and treatment. A LiverMetSurvey-based study of 6,025 patients. Ann Surg Oncol 2014; 21(4): 1276–1286. doi: 10.1245/s10434-013-3421-8.
17. Adam R, De Gramont A, Figueras J et al. The oncosurgery approach to managing liver metastases from colorectal cancer: a multidisciplinary international consensus. Oncologist 2012; 17(10): 1225–1239. doi: 10.1634/theoncologist.2012-0121.
18. Petruželka L, Georgiev P. Přínos neoadjuvantní a adjuvantní léčby v léčbě kolorektálního karcinomu. Rozhl Chir 2012; 91(1): 53–58.
19. Ryska M, Pantoflíček J, Dušek L. Léčba jaterních metastáz kolorektálního původu v České republice: současný celostátní survey. Rozhl Chir 2010; 89(2): 100–108.
20. Primrose JN, Falk S, Finch-Jones M et al. A randomized clinical trial of chemotherapy compared to chemotherapy in combination with cetuximab in k-RAS wild-type patients with operable metastases from colorectal cancer: The new EPOC study. J Clin Oncol 2013; 31 (Suppl): Abstr. 3504.
21. Adam R, Pascal G, Castaing D et al. Tumor progression while on chemotherapy: a contraindication to liver resection for multiple colorectal metastases? Ann Surg 2004; 240(6): 1052–1061.
22. Pawlik TM, Scoggins CR, Zorzi D et al. Effect of surgical margin status on survival and site of recurrence after hepatic resection for colorectal metastases. Ann Surg 2005; 241(5): 715–722.
23. Blazer DG 3rd, Kishi Y, Maru DM et al. Pathologic response to preoperative chemotherapy: a new outcome end point after resection of hepatic colorectal metastases. J Clin Oncol 2008; 26(33): 5344–5351. doi: 10.1200/JCO.2008.17.5299.
24. Brouquet A, Abdalla EK, Kopetz S et al. High survival rate after two-stage resection of advanced colorectal liver metastases: response-based selection and complete resection define outcome. J Clin Oncol 2011; 29(8): 1083–1090. doi: 10.1200/JCO.2010.32.6132.
25. Are C, Gonen M, Zazzali K et al. The impact of margins on outcome after hepatic resection for colorectal metastasis. Ann Surg 2007; 246(2): 295–300.
26. Andreou A, Aloia TA, Brouquet A et al. Margin status remains an important determinant of survival after surgical resection of colorectal liver metastases in the era of modern chemotherapy. Ann Surg 2013; 257(6): 1079–1088. doi: 10.1097/SLA.0b013e318283a4d1.
27. Adam R, Wicherts DA, de Haas RJ et al. Complete pathologic response after preoperative chemotherapy for colorectal liver metastases: myth or reality? J Clin Oncol 2008; 26(10): 1635–1641. doi: 10.1200/JCO.2007.13.7471.
28. Benoist S, Brouquet A, Penna C et al. Complete response of colorectal liver metastases after chemotherapy: does it mean cure? J Clin Oncol 2006; 24(24): 3939–3945.
29. Poultsides GA, Servais EL, Saltz LB et al. Outcome of primary tumor in patients with synchronous stage IV colorectal cancer receiving combination chemotherapy without surgery as initial treatment. J Clin Oncol 2009; 27(20): 3379–3384. doi: 10.1200/JCO.2008.20.9817.
30. Goldberg RM, Rothenberg ML, Van Cutsem E et al. The continuum of care: a paradigm for the management of metastatic colorectal cancer. Oncologist 2007; 12(1): 38–50.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2014 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Gastrointestinální onkologie – prevence, diagnostika i léčba
- Zpráva o činnosti výboru České gastroenterologické společnosti za uplynulé volební období
- Vedomostná úroveň na Slovensku o obezite ako rizikovom faktore zhubných nádorov tráviaceho traktu i ďalších orgánov
- Screening kolorektálního karcinomu v ČR po zavedení adresného zvaní – dosavadní výsledky dle dostupných dat
- Kvíz: Je léčená celiakie zdrojem problémů na celý život?
- Cílený screening kolorektálního karcinomu u diabetiků 2. typu a osob s vysokým kardiovaskulárním rizikem – první průběžné výsledky multicentrické prospektivní studie
- Transanal endoscopic microsurgery for rectal cancer at the 3rd Surgical Clinic of the 1st Faculty of Medicine, Charles University and the University Hospital in Motol in 2008–2013
- Nové pohledy na zařazení farmakoterapie do algoritmu léčby jaterních metastáz kolorektálního karcinomu
- Využití kontrastní endosonografie v diagnostice karcinomu pankreatu
- Zařazení režimu FOLFIRINOX do algoritmu léčby metastazujícího karcinomu slinivky břišní – první zkušenosti
- Expandibilné stenty v liečbe benígnych a malígnych ochorení pažeráka
- Rehabilitace a moderní přístup v léčbě syndromu solitárního rektálního vředu
- Péče o IBD pacienty – klinická praxe v gastroenterologických ambulancích sekundárního typu v ČR
- Komentář k článku „Účinnosť a bezpečnosť silymarínu u pacientov s chronickými chorobami pečene – multicentrická, prospektívna, otvorená klinická štúdia IMHOTEP“
- Správná odpověď na kvíz
- Autodidaktický test: gastrointestinální onkologie
- Hyaluronát sodný: nová cesta v léčbě ulcerózní kolitidy?
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Zařazení režimu FOLFIRINOX do algoritmu léčby metastazujícího karcinomu slinivky břišní – první zkušenosti
- Rehabilitace a moderní přístup v léčbě syndromu solitárního rektálního vředu
- Expandibilné stenty v liečbe benígnych a malígnych ochorení pažeráka
- Využití kontrastní endosonografie v diagnostice karcinomu pankreatu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



