-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diagnostika a léčba anémie u nemocných s chorobami gastrointestinálního traktu
Autori: J. Čermák
Pôsobisko autorov: Ústav hematologie a krevní transfuze, Praha
Vyšlo v časopise: Gastroent Hepatol 2015; 69(4): 358-364
Kategória: Vybrané kapitoly z vnitřního lékařství: přehledová práce
doi: https://doi.org/10.14735/amgh2015358Súhrn
Anémie je v celosvětovém měřítku nejčastějším hematologickým onemocněním vůbec. U nemocných s chronickými zánětlivými chorobami gastrointestinálního traktu (GIT) je často přítomna kombinace několika příčin podílejících se na vzniku anémie. Sideropenická složka vzniká zejména v důsledku zvýšených ztrát z poškozené sliznice GIT, může se na ní podílet i porušená resorpce Fe z trávicího traktu. Současně se na anémii u chronických zánětů střevních podílejí i mechanizmy vedoucí k rozvoji anémie při chronickém onemocnění (ACD). Zvýšená hladina cytokinů (IL‑1, IL‑6), jež je přítomna u zánětů, vede ke zvýšené sekreci regulačního hormonu hepcidinu, jejímž důsledkem je blokáda výdeje zásobního Fe do cirkulace pro potřeby erytropoézy. V diagnostice sideropenie se uplatňuje zejména kombinace hladiny feritinu v séru a saturace transferinu. U stavů s kombinovanou poruchou metabolizmu Fe je třeba k odhalení sideropenie většinou použít vyšetření několika parametrů (feritin v séru, cirkulující transferinový receptor, event. hepcidin v séru). V léčbě sideropenie se uplatňuje substituce přípravky obsahujícími Fe. Parenterální podávání Fe je indikováno u stavů s porušenou resorpcí Fe ze střeva, jako velmi efektivní se u těchto stavů ukazuje být podání nových přípravků s vysokou využitelností díky rovnoměrnému postupnému uvolňování i vysokého obsahu Fe v molekule (např. Fe3+ v komplexu s karboxymaltozou).
Klíčová slova:
anémie z nedostatku železa – anémie při chronickém onemocnění – chronické záněty střeva – diagnostika – léčba – – hepcidinÚvod
Anémie je nejčastějším hematologickým onemocněním a v celosvětovém měřítku nejčastější chorobou vůbec. Nejčastější příčinou anémie je nedostatek Fe, incidence sideropenické anémie je v našem regionu cca 5 % u mužů a 8 – 20 % u žen, ale v rozvojových zemích je popisován výskyt až u 30 – 70 % populace. Nedostatek Fe v organizmu je většinou absolutní, tj. je snížena jeho zásoba v organizmu v důsledku jeho nedostatečného přívodu či zvýšených ztrát, na rozvoji anémie při chronickém onemocnění se však podílí relativní nedostatek Fe utilizovatelného pro krvetvorbu při jeho normálním či zvýšeném obsahu v monocyto ‑ makrofágovém systému. U některých onemocnění se mohou tyto příčiny kombinovat, zejména u nemocných se zánětlivým postižením tenkého či tlustého střeva.
Metabolizmus železa a jeho regulace
Železo vstřebané z trávicího traktu je dopravováno do cílových tkání v trojmocné formě především ve vazbě na transferin. Transferin se na povrchu buňky váže na transferinový receptor a celý komplex podléhá endocytóze. Při poklesu pH v endocytickém váčku dochází k uvolnění Fe, které je redukováno na dvojmocnou formu reduktázou Steap3 a následně transportováno do nitra buňky pomocí DVMT1 (transportér pro dvojmocné Fe, jenž zprostředkovává i transport Fe ze střeva přes membránu střevního epitelu). Uvolněné Fe se váže buď na mitochondriální feritin a je dále utilizováno v mitochondriích, nebo je ukládáno v zásobní formě feritinu [1]. Metabolizmus Fe v erytroidních prekurzorech je znázorněn na obr. 1.
Obr. 1. Metabolizmus železa v erytroidních prekurzorech (upraveno podle [1]). Transferin (Tf) transportující trojmocné železo se váže na povrchu buňky na transferinový receptor 1 (TfR1), celý komplex podléhá endocytóze, v kyselém prostředí pak dochází k uvolnění Fe<sup>3+</sup> z vazby na komplex Tf-TfR1 a jeho redukci na dvojmocnou formu účinkem reduktázy Steap3. Transport Fe<sup>2+</sup> do nitra buňky je zprostředkován DVMT1, z intracelulárního prostoru je buď odsunováno vázané na mitochondriální feritin (Mfrn1) do mitochondrií i je ukládáno do zásobní formy feritinu. Vytvořený hem je vázán s globinem, za určitých okolností může být železo též transportováno extracelulárně (zprostředkováno ferroportinem 1 – Fpn), stejně tak jako vznikající hem (vazbou s FLVC receptorem – FLVCR1). Fig. 1. Metabolism of iron in erythroid precursors (modified according to [1]). Transferrin (Tf) transporting ferric iron binds on the cell surface with transferrin receptor 1 (TfR1), the whole complex is endocytosed, Fe<sup>3+</sup> is then released from the TF-TfR1 complex in acidic environment and is reduced to divalent form by the Steap3 reductase. Transport of Fe<sup>2+</sup> into the intracellular space is mediated by DVMT1, once eleased, iron binds to mitochondrial ferritin and is subsequently utilised in mitochondria, or it may be stored in ferritin. De novo synthesized haem binds with globin. Under certain circumstances, iron can also be transported extracellularly (mediated by ferroportin 1 – FPN), as well as created haem (mediated by FLVC receptor – FLVCR1). ![Metabolizmus železa v erytroidních prekurzorech (upraveno podle [1]). Transferin (Tf) transportující trojmocné železo se váže na povrchu buňky na transferinový receptor 1 (TfR1), celý komplex podléhá endocytóze, v kyselém prostředí pak dochází k uvolnění Fe<sup>3+</sup> z vazby na komplex Tf-TfR1 a jeho redukci na dvojmocnou formu účinkem reduktázy Steap3. Transport Fe<sup>2+</sup> do nitra buňky je zprostředkován DVMT1, z intracelulárního prostoru je buď odsunováno vázané na mitochondriální feritin (Mfrn1) do mitochondrií i je ukládáno do zásobní formy feritinu. Vytvořený hem je vázán s globinem, za určitých okolností může být železo též transportováno extracelulárně (zprostředkováno ferroportinem 1 – Fpn), stejně tak jako vznikající hem (vazbou s FLVC receptorem – FLVCR1).
Fig. 1. Metabolism of iron in erythroid precursors (modified according to [1]). Transferrin (Tf) transporting ferric iron binds on the cell surface with transferrin receptor 1 (TfR1), the whole complex is endocytosed, Fe<sup>3+</sup> is then released from the TF-TfR1 complex in acidic environment and is reduced to divalent form by the Steap3 reductase. Transport of Fe<sup>2+</sup> into the intracellular space is mediated by DVMT1, once eleased, iron binds to mitochondrial ferritin and is subsequently utilised in mitochondria, or it may be stored in ferritin. De novo synthesized haem binds with globin. Under certain circumstances, iron can also be transported extracellularly (mediated by ferroportin 1 – FPN), as well as created haem (mediated by FLVC receptor – FLVCR1).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ecf0fe5b676c4bbbf6f23dd5730f2cec.png)
V roce 2000 byl objeven hepcidin, polypeptid syntetizovaný v játrech, jenž hraje klíčovou úlohu v regulaci metabolizmu Fe. Úlohou hepcidinu je degradace feroportinu ‑ 1, jenž zprostředkovává přenos Fe extracelulárně, důsledkem stoupající hladiny hepcidinu je tedy snížení výdeje Fe z buňky. Na regulaci tvorby hepcidinu se podílí řada faktorů, tzv. protein dědičné hemochromatózy (HH či HFE protein) se váže v buňce na transferinový receptor kompetitivně s Fe uvolněným z transferinu, volný HFE protein se váže transferinovým receptorem 2 a tento komplex indukuje tvorbu hepcidinu cestou aktivace tzv. BMP (bone morphogenic protein) receptoru a jeho signální dráhy (SMAD). V poslední době se ukazuje, že zřejmě větší regulační význam má přímá stimulace aktivity BMP receptoru proteinem BMP6 (bone morphogenic protein 6), jehož hladina je závislá na koncentraci Fe v parenchymatozních orgánech, zejména v játrech. Dalšími regulačními proteiny simulujícími aktivitu BMP receptoru jsou hemojuvelin a matriptáza ‑ 2 (MT ‑ 2 neboli TM ‑ PRSS6). Tímto způsobem je citlivě regulován výdej Fe z monocyto ‑ makrofágového systému do cirkulace a druhotně resorpce Fe ze střeva při stoupající intracelulární hladině Fe. Obdobně stimuluje tvorbu hepcidinu hemojuvelin a též zvýšená hladina některých cytokinů (IL‑1, IL‑6) při zánětu, tento mechanizmus je základním patogenetickým momentem při rozvoji anémie při chronickém onemocnění. Anémie s hypoxií a vystupňovaná erytropoéza naopak tlumí tvorbu hepcidinu, cílem je zvýšení výdeje Fe do cirkulace za účelem přesunu do funkčního poolu v kostní dřeni a v poslední době bylo prokázáno, že tento efekt je zprostředkován proteinem nazvaným erytroferon [2], jehož sekrece je stimulována zvýšenou hladinou endogenního erytropoetinu (EPO). Tento moment se spolupodílí na rozvoji přetížení Fe u některých anémií z vystupňovanou inefektivní erytropoézou (talasemie, myelodysplastický syndrom) (obr. 2).
Obr. 2. Přehled jednotlivých mechanizmů uplatňujících se v regulaci tvorby hepcidinu. Fig. 2. Mechanisms involved in the regulation of hepcidin production. 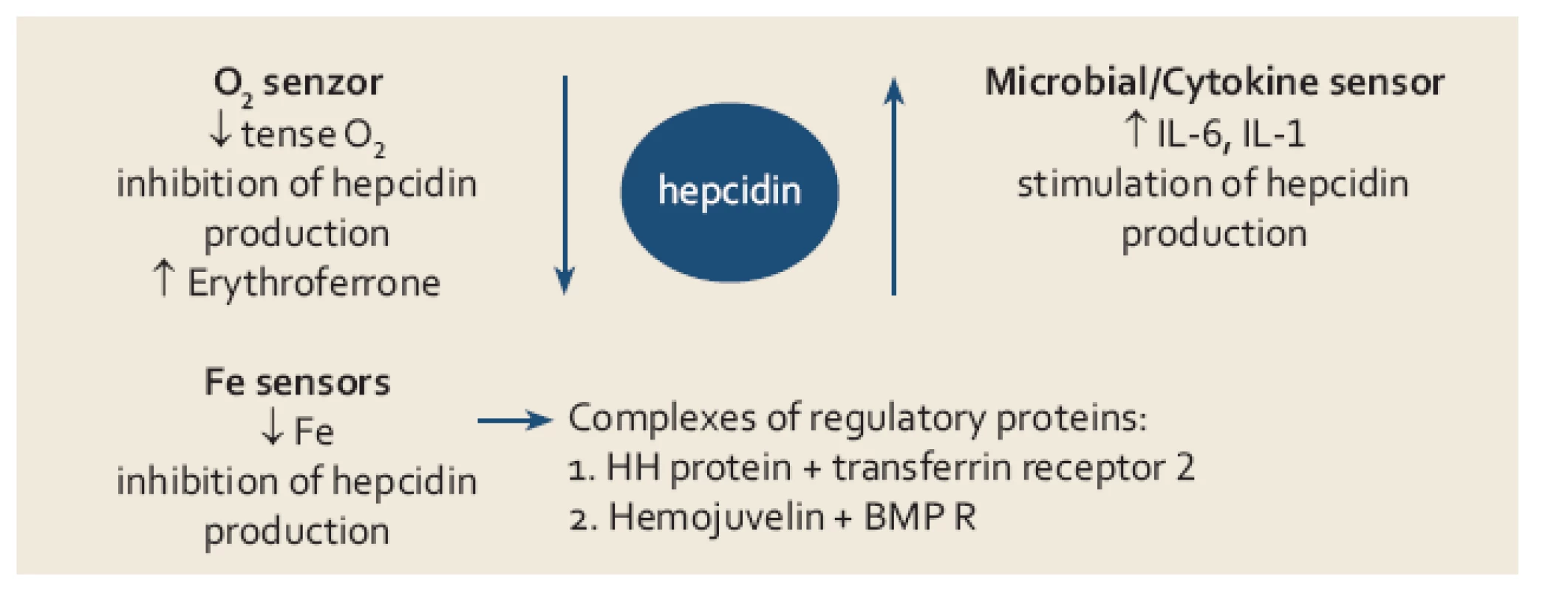
Na obr. 3 je znázorněn metabolizmus Fe v monocyto ‑ makrofágovém systému po fagocytóze zanikajících erytrocytů. Fe z hemoglobinu fagocytovaného erytrocytu se ve fagolyzozomu uvolňuje z vazby na hem účinkem hemoxygenázy (Hox) a ve dvojmocné formě je transportováno DVMT1 (DMT) do nitra buňky. Následně je buď ukládáno do zásobní formy feritinu, či může být transportováno extracelulárně, tento proces je zprostředkován ferroportinem 1. Aktivita ferroportinu je ovlivňována vazbou hepcidinu, jenž snižuje aktivitu ferroportinu indukcí jeho degradace. Dvojmocné Fe je extracelulárně oxidováno na trojmocnou formu účinkem ceruloplasminu a může se opět vázat na transferin [3].
Obr. 3. Metabolizmus železa v makrofázích a jeho uvolňování do cirkulace. Železo uvolněné z hemu ze zanikajícího erytrocytu ve fagolysosomu makrofágu je účinkem hemooxygenázy z lysozomu transportováno do cytoplasmy vazbou na protein DVMT1, v cytoplasmě buňky může být ukládáno v zásobní formě feritinu, nebo transportováno zpět do cirkulace, přičemž jeho přechod přes membránu makrofágu je zprostředkován ferroportinem. Hepcidin indukuje degradaci ferroportinu a vede tak k retenci železa v buňce. Fig. 3. Iron metabolism in macrophages and its release into the circulation. After phagocytosis of senescent erythrocytes, iron is released from the haeme in phagolysosomes by enzyme heme oxygenase (Hox), DVMT1(DMT) transports divalent iron into the cytoplasm. Subsequently, iron is either stored in ferritin, or it may be transported extracellularly; this process is mediated by ferroportin 1. The activity of ferroportin is regulated by hepcidin, which reduces the activity of ferroportin through the induction of its degradation. 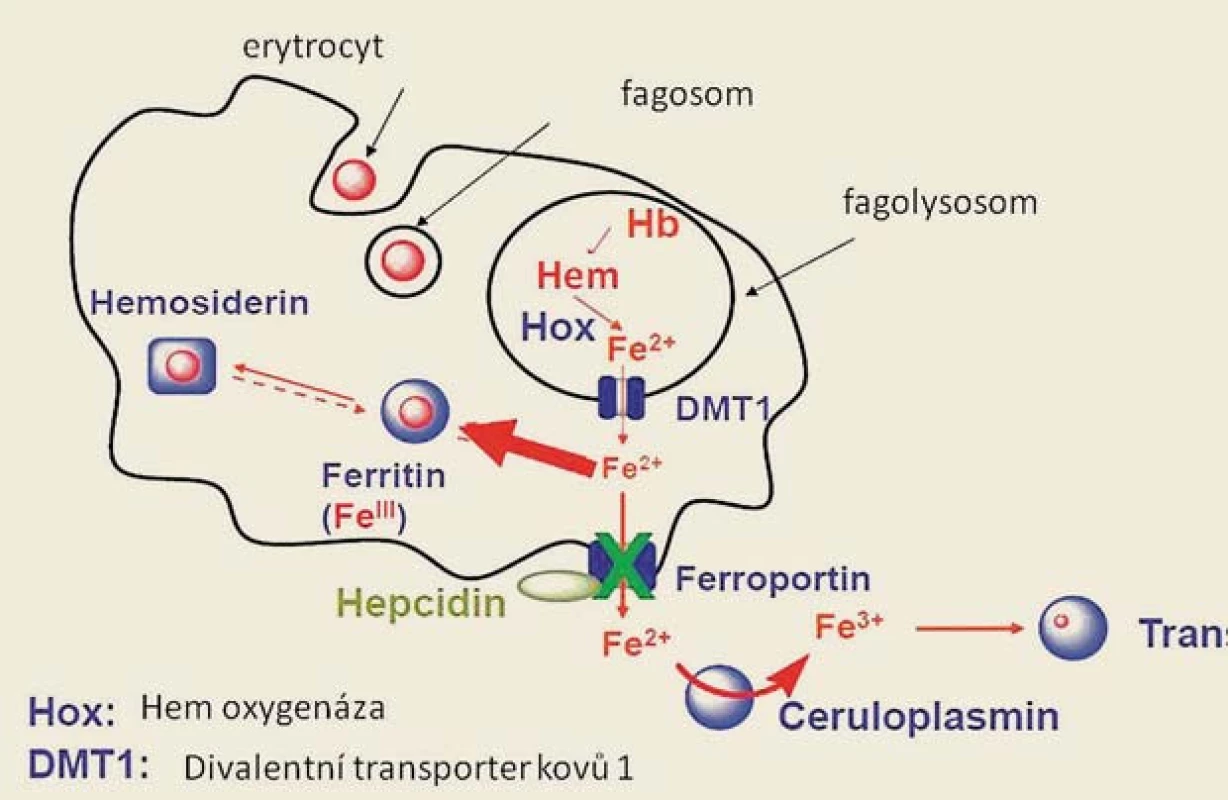
Příčiny nedostatku železa
Nejčastější příčinou sideropenie jsou nadměrné ztráty Fe z organizmu. U žen je častým zdrojem krvácení urogenitální trakt. Během menstruace činí krevní ztráta v průměru 40 – 60 ml za cyklus, což odpovídá cca 16 – 25 mg Fe. U žen se proto již fyziologicky uplatňuje první regulační mechanizmus, kterým se organizmus brání rozvoji sideropenie. Denní resorpce Fe z potravy je zvýšena z 7 – 10 % na 20 – 25 % přijaté dávky. Při krevních ztrátách přesahujících 70 – 80 ml za cyklus však již organizmus nestačí kompenzovat ztráty Fe zvýšenou resorpcí a pokud není dostatečně zvýšen obsah Fe v potravě (z běžných 10 – 15 mg denně na cca 18 – 20 mg), dochází k postupnému rozvoji sideropenie. Značné krvácení mohou způsobit jak benigní, tak maligní nádory dělohy. Nefrolitiáza, ureterolitiáza a zánětlivé afekce ledvin a močových cest bývají méně častou, ale nezanedbatelnou příčinou chronických ztrát Fe. Krvácení do trávicího ústrojí je další častou příčinou sideropenie a uplatňuje se zejména u mužů a u žen v menopauze. Z celé řady možných afekcí v GIT je nutno zdůraznit zejména peptický vřed, brániční kýlu s refluxní ezofagitidou, jícnové varixy, hemoroidy, divertikly, Crohnovu chorobu, ulcerózní kolitidu, ale také benigní či maligní nádory. Je třeba připomenout, že krvácení do GIT mohou vyvolávat i některé léky – kyselina acetylsalicylová, glukokortikoidy, nesteroidní antirevmatika, antikoagulancia, vzácněji např. chlorid draselný. Do trávicího ústrojí mohou krvácet i nemocní s krvácivými chorobami vyvolanými poruchou funkce destiček či koagulačních faktorů. Mezi vzácnější příčiny sideropenie patří krvácení z dýchacího ústrojí a artificiální ztráty, např. při hemodialýze či odběrech krve. U dárce je každý odběr krve spojen se ztrátou cca 150 – 200 mg Fe. Nedostatečný přívod Fe v potravě je v oblastech se skladbou stravy obdobnou naší poměrně vzácný. Kromě přímého nedostatku Fe v potravě se může na jeho sníženém přívodu podílet i nadbytek látek, jež mohou inhibovat jeho resorpci (fosfáty, fytáty, tanáty, oxaláty). U parazitárních onemocnění může jít o kombinaci porušeného vstřebávání s krvácením do GIT. Ke konzumpci Fe s jeho následným nedostatkem může vést i infekce Helicobacter pylori.
Zvýšené nároky na přívod Fe jsou přítomny v těhotenství, kdy jeho potřeba stoupá na 20 – 25 mg denně. Ztráta Fe během gravidity se odhaduje na 900 – 1 000 mg a zejména v posledním trimestru vzniká bez substituce Fe sideropenie u více než 70 % těhotných. Během kojení činí ztráty Fe cca 1 mg denně. Zvýšená spotřeba Fe je typická i pro období růstu. U dvouletých dětí by měl přívod Fe činit cca 15 mg denně, menstruující ženy mezi 14. a 30. rokem věku potřebují přibližně 18 mg Fe denně.
Mechanizmy vzniku anémie u chronických zánětlivých onemocnění střeva
Anémie u chronických zánětlivých onemocnění GIT má charakter anémie vznikající při chronických chorobách, bývá však modifikována dalšími činiteli. Jak již bylo uvedeno výše, společným etiologickým činitelem u chronických onemocnění a nádorů je aktivace imunitního systému, která vede jednak k omezení nabídky Fe přítomným patogenům či nádorovým buňkám, pro něž Fe představuje esenciální růstový faktor, jednak směřuje k udržení optimální koncentrace Fe pro cytotoxickou funkci efektorových buněk imunitního systému. Zvýšená sekrece cytokinů (TNF‑α, IL‑6, IL‑1, IL‑4, IL‑10, IFN‑γ) buňkami aktivovaného imunitního systému vede ke stimulaci tvorby feritinu a hepcidinu. Výsledkem je pokles hladiny Fe v séru s jeho retencí v buňkách monocyto ‑ makrofágového systému a sekundárně i inhibice vstřebávání Fe z GIT. Kromě nedostatku Fe využitelného pro erytropoezu se na rozvoji anémie do určité míry podílí i tlumivý účinek na proliferaci erytroidních prekurzorů, snížená tvorba EPO a zkrácené přežívání erytrocytů v důsledku alterace metabolizmu bílkovin a lipidů erytrocytární membrány [4] (obr. 4). Snížená tvorba EPO je hlavním patogenetickým činitelem u anémie při chronické nedostatečnosti ledvin, kromě toho u ACD chybí tlumivý efekt EPO na produkci hepcidinu a stimulační efekt na tvorbu transferinových receptorů sloužících k příjmu Fe buňkou.
Obr. 4. Základní mechanizmy uplatňující se v patogenezi anémie při chronickém onemocnění (ACD) (bližší vysvětlení v textu). Fig. 4. Basic mechanisms involved in the pathogenesis of anaemia in chronic dis ease (ACD) (detailed explanation in the text). 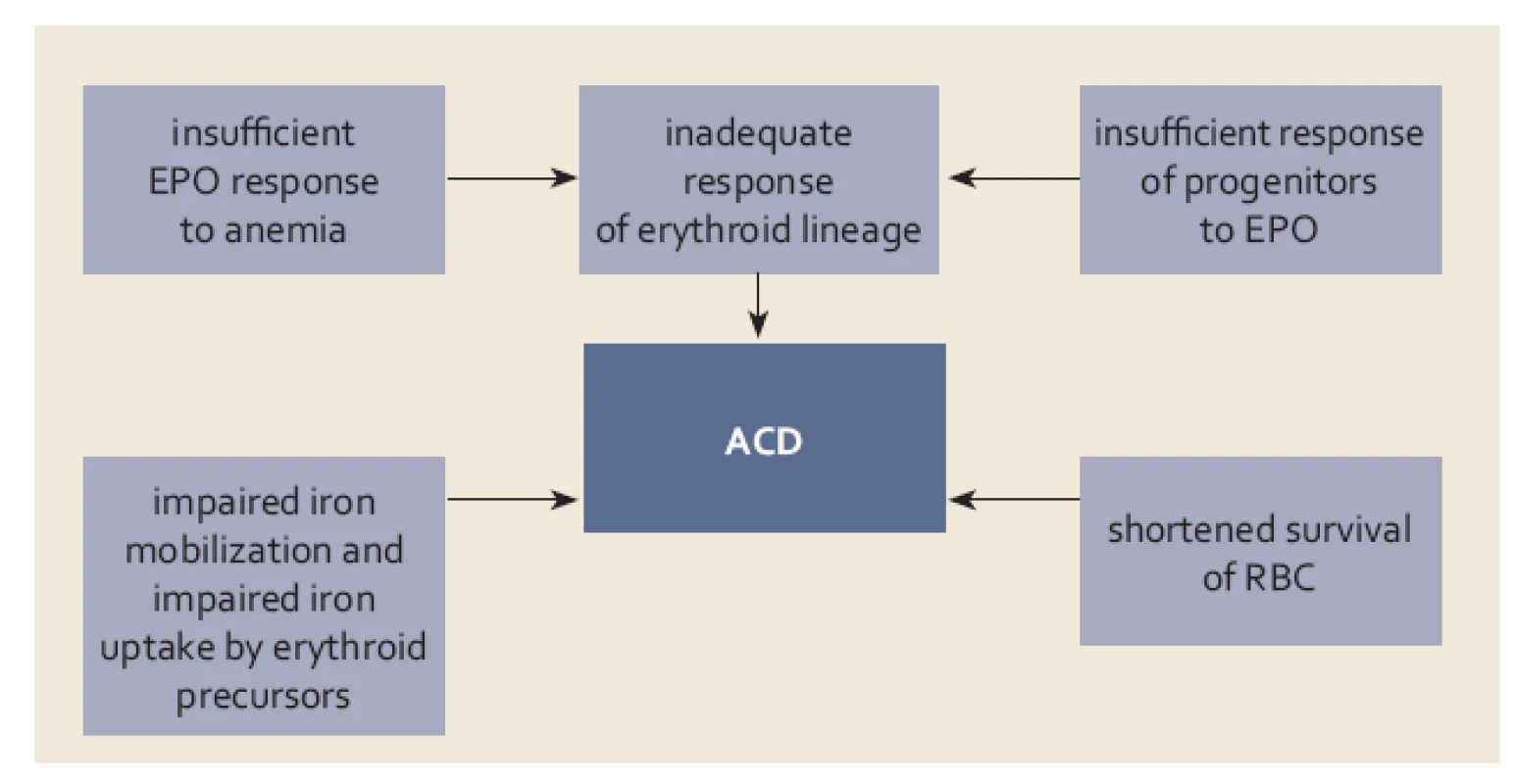
U řady nemocných s chronickým zánětlivým onemocněním střeva je současně přítomno krvácení do GIT z poškozené střevní sliznice. Současně může být přítomen nedostatečný příjem Fe jako projev malabsorpce zejména při celiakii, Crohnově chorobě či po resekci žaludku nebo střeva, kdy je resorpční plocha omezená a pasáž potravy zrychlená. U infekce Helicobacter pylori se předpokládá i vliv imunitních mechanizmů na metabolizmus Fe. Kvůli multifaktoriální etiologii anémie u chronických střevních zánětů je většinou třeba použít kombinace několika laboratorních vyšetření k odhalení přítomnosti a hloubky skutečného deficitu Fe a ke správné indikaci substituční léčby viz níže.
Diagnostika nedostatku železa
Již v období prelatentního nedostatku Fe, kdy dochází k postupnému vyčerpání zásob Fe, ale dodávka pro potřeby erytropoézy je ještě dostatečná, se uplatňují kompenzační mechanizmy organizmu: zvýšení resorpce Fe z GIT, snížení jeho výdeje a útlum tvorby feritinu – zásobního proteinu Fe. Klesá obsah barvitelného Fe v monocyto ‑ makrofágovém systému kostní dřeně a hladina feritinu v séru se snižuje pod dolní hranici normy u více než 50 % nemocných. Pro klinickou praxi je rozhodující včasná diagnostika latentní sideropenie, kdy jsou zásoby Fe již zcela vyčerpány a je snížena jeho dodávka do erytroblastů kostní dřeně, avšak tento pokles zatím nelimituje proliferaci buněk. V této fázi je snížena hladina feritinu v séru pod 12 µg/ l u více než 90 % nemocných, je snížena hladina Fe v séru a zvýšena celková vazebná kapacita transferinu pro Fe, saturace transferinu klesá pod 16 %. Kombinací vyšetření hladiny feritinu v séru a saturace transferinu lze odhalit až 95 % nemocných s latentní sideropenií a obě vyšetření jsou zásadní pro diagnostiku sideropenie. Současně je zvýšena koncentrace solubilních cirkulujících transferinových receptorů v séru (nad 5 – 8 mg/ l) a koncentrace volného protoporfyrinu v erytrocytech. V kostní dřeni klesá počet sideroblastů z 50 – 60 % pod 30 %. Ve stadiu manifestní sideropenie již nedostatek Fe tlumí proliferaci a vzniká obraz anémie jako důsledek neschopnosti erytropoézy kompenzovat normální či mírně zvýšený zánik erytrocytů. Manifestní sideropenie je charakterizována hypochromní mikrocytární anémií, hladina feritinu v séru je snížena pod 5 µg/ l, saturace transferinu klesá pod 10 %, v kostní dřeni chybí zásobní Fe a nalézáme zde méně než 10 % sideroblastů. Současně s diagnózou sideropenie je vždy nutno pátrat po příčině nedostatku Fe, nedílnou součástí vyšetřovacího postupu je proto opakované vyšetření stolice na okultní krvácení, moči a močového sedimentu, gynekologické vyšetření a event. instrumentální vyšetření GIT.
V diferenciální diagnostice je třeba odlišit mírnější formy sideropenie od anémie při chronickém onemocnění a od heterozygotních forem talasemie U nemocných s heterozygotní β ‑ talasemií je přítomna nápadná mikrocytóza a hypochromie bez výraznější anémie, počet erytrocytů může být naopak i lehce zvýšen. Hladiny Fe a feritinu v séru nejsou zvýšeny, charakteristické jsou změny v elektroforéze hemoglobinu a výrazně je snížena hladina hepcidinu v séru. Vzácně je třeba odlišit kongenitální sideroblastickou anémii. U anémie při chronickém onemocnění je přítomna snížená koncentrace Fe v séru v důsledku poruchy jeho distribuce v organizmu, na rozdíl od pravé sideropenie není snížena hladina feritinu v séru ani saturace transferinu. Počet cirkulujících transferinových receptorů (cTfR) není zvýšen a na rozdíl od sideropenie je zvýšena hladina hepcidinu v séru (tab. 1).
Tab. 1. Diferenciální diagnostika anémie z nedostatku železa. Tab. 1. Differential diagnosis of iron deficiency anaemia. 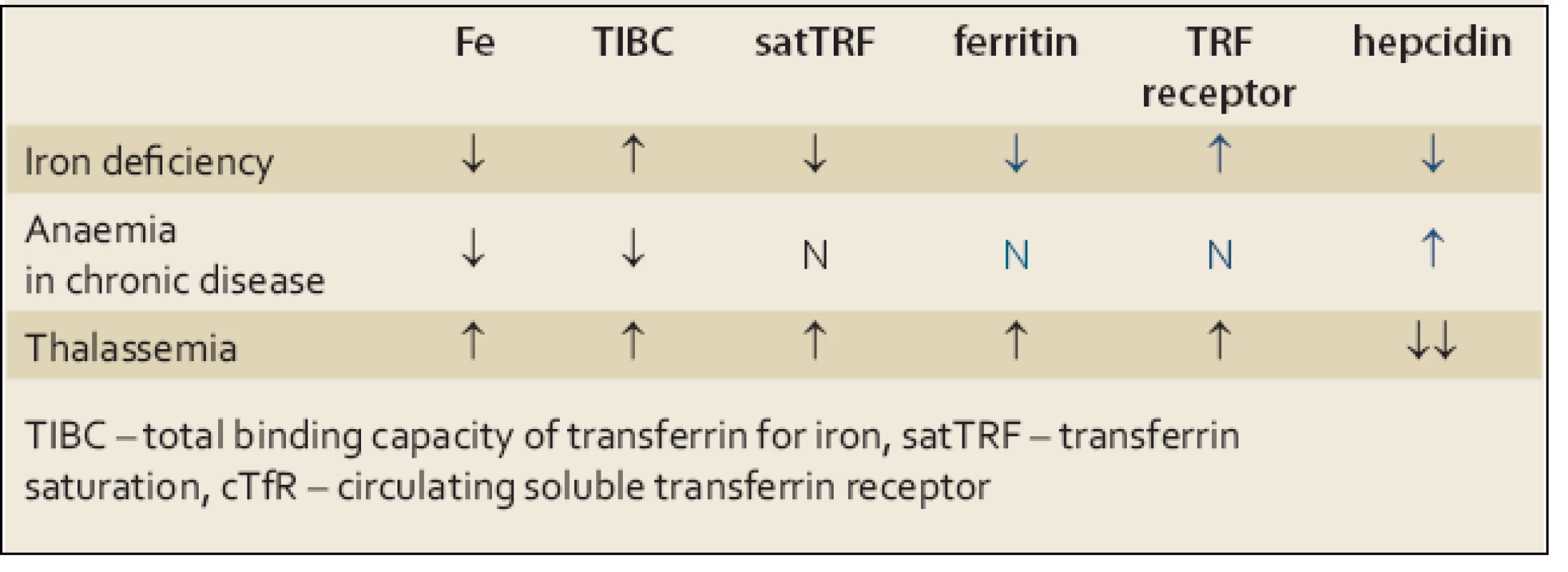
Jak již bylo uvedeno výše, u řady chronických onemocnění, zejména u chronických zánětů střevních, však může být přítomna kombinace zvýšených ztrát Fe, jeho snížené resorpce a distribučních poruch. Snížený výdej Fe do cirkulace představuje u anémie při chronickém onemocnění (ACD) určitý obranný mechanizmus bránící dodávce Fe jako růstového faktoru invadujícím mikroorganizmům či nádorovým buňkám, a proto je třeba Fe do organizmu dodat pouze při jeho prokázaném skutečném deficitu. Hladina feritinu bývá u ACD nespecificky zvýšena díky retenci Fe v monocyto ‑ makrofágovém systému, a proto má pro detekci přítomnosti deficitu Fe u ACD malý význam. Citlivějším ukazatelem je vyšetření hladiny cirkulujících transferinových receptorů, její zvýšení odráží zvýšenou syntézu transferinového receptoru v buňce při nedostatku utilizovatelného Fe (viz výše popsané regulační mechanizmy). Ještě přesnější je stanovení poměru hladiny cTFR k log feritinu. Průkaz zvýšené hladiny hepcidinu v séru může být důležitým diagnostickým ukazatelem převahy distribučních změn, zatím se však toto vyšetření rutinně neprovádí, a většinou jsme tedy u chronických onemocnění pro přesnou diagnostiku stavu zásob Fe odkázáni na užití kombinace několika vyšetření [5]. Doporučená kombinace vyšetření a jejich interpretace jsou uvedeny v tab. 2.
Tab. 2. Index cirkulující transferinový receptor/log feritin jako citlivý parametr diagnostiky absolutního deficitu železa u anémie při chronickém onemocnění. Tab. 2. Soluble transferrin receptor/log ferritin index as a sensitive parameter of absolute iron deficiency diagnostics in anaemia of chronic disease. 
Léčba nedostatku železa
První zásadou léčby sideropenie je odstranění její příčiny. Druhou zásadou je substituce dostatečným množstvím Fe po dostatečně dlouhou dobu. Optimální léčba sideropenie by měla vést k vzestupu hodnot Hb o 2 g/ l denně, k tomu je třeba vstřebat 50 – 60 mg elementárního Fe, což odpovídá při optimální resorpci dodávce nejméně 180 – 200 mg prvkového Fe denně per os. Přípravky Fe je nutno podávat rovnoměrně během dne a pokud možno nalačno nejméně půl hodiny před jídlem či nejméně dvě hodiny po jídle. Řada látek v potravě může snižovat resorpci Fe, naopak aminokyseliny, kyselina askorbová a citronová a některé cukry vstřebávání Fe podporují, toho je využíváno v některých přípravcích Fe. S resorpcí Fe mohou interferovat i některé léky (antacida, antagonisté H2 - receptorů, pankreatická lipáza, penicilamin aj.). Podávání kombinovaných přípravků Fe (většinou s vitaminem B12 a kyselinou listovou) je namístě pouze u skutečně prokázaného kombinovaného deficitu těchto látek či profylakticky v těhotenství. Kontrolu účinnosti léčby provádíme v první fázi vyšetřením hodnot Hb, po normalizaci hodnot Hb je vhodné opakovaně kontrolovat hladinu feritinu v séru a pokračovat v léčbě do naplnění zásob Fe v organizmu na optimální hodnoty, jež činí 300 – 500 mg, hodnota 1 µg/ l feritinu v séru přitom odpovídá cca 8 mg zásobního Fe.
U nemocných s chronickými střevními záněty je v důsledku poškození střevní sliznice jedním z etiologických činitelů anémie snížená resorpce Fe z GIT. U těchto nemocných je indikováno parenterální podávání Fe. Běžné dávkování je 62,5 mg (Fe3+ komplex s glukonátem sodným) nebo 100 mg (Fe3+ sacharózový komplex) elementárního Fe 1× denně. Nevýhodou těchto přípravků je poměrně rychlé uvolnění Fe z komplexu v cirkulaci, což může snižovat jeho utilizaci vzhledem k limitované proliferaci kvůli přítomné sideropenii. Rychlé uvolnění Fe do cirkulace je též nejčastější příčinou vedlejších nežádoucích účinků spojených s parenterálním podáním přípravků Fe. Komplex Fe3+ s karboxymaltózou umožňuje pomalé a rovnoměrné uvolňování i vysokých dávek Fe obsažených v přípravku, což je spojeno s utilizací více než 90 % podaného Fe při minimu vedlejších účinků a možnosti aplikace 1× týdně [6]. Změny metabolizmu Fe u afekcí GIT mají často multifaktoriální příčinu a, jak již bylo uvedeno výše, diagnostika skutečného deficitu Fe vyžaduje většinou kombinaci několika laboratorních vyšetření. Zcela obecně a velmi zjednodušeně lze říci, že pokles hladiny feritinu v séru pod 30 – 40 µg/ l, pokles saturace transferinu pod 16 – 18 % a vzestup hladiny cTFR nad 3 mg/ l může být u těchto onemocnění známkou vznikajícího absolutního deficitu Fe.
Možnosti ovlivnění mechanizmů anémie při chronickém onemocnění
V současné době je předmětem výzkumu ovlivnění zvýšené hladiny hepcidinu jako etiologického faktoru podílejícího se na vzniku ACD. Samotný rekombinantní erytropoetin (rHuEPO) má krom anémie při chronické renální insuficienci u ACD malý efekt, přínosem by mohla být jeho kombinace s podáváním erytroferonu, jenž zprostředkovává tlumivý účinek EPO na tvorbu hepcidinu. Další zkoumané látky lze rozdělit do skupiny protilátek proti hepcidinu či proti stimulačním mechanizmům tvorby hepcidinu (protilátky proti receptoru pro IL‑6), skupiny látek, jež interferují se signálními drahami stimulujícími tvorbu mRNA pro hepcidin (signální dráhu BMP – kostního morfogenního proteinu) a skupiny látek vážících hepcidin (některé syntetické oligonukleotidy) [7].
doc. MU Dr. Jaroslav Čermák, CSc.
Ústav hematologie a krevní transfuze
U nemocnice 2094/ 1
128 20 Praha 2
cermak@uhkt.cz
doc. MUDr. Jaroslav Čermák, CSc.
Narodil se 13. ledna 1954. Studium na Fakultě všeobecného lékařství UK v Praze ukončil roku 1979. Složil atestaci I. stupně v oboru interního lékařství (1983) a z hematologie a transfuzní služby (1989). Roku 1990 obhájil kandidátskou práci a je řešitelem grantů IgA MZ. V letech 1991–1992 získal stipendium na hematologickém a transplantačním oddělení Univerzity v Minnesotě. V letech 1993–2013 byl primářem lůžkové části ÚHKT v Praze, kde je nyní náměstkem ředitele pro vzdělávání a rozvoj. Habilitoval se roku 2006. Od roku 2012 je školitelem Fakulty všeobeckého lékařství UK v Praze v oboru Biologie a patologie buňky.
Je předsedou České hematologické společnosti ČLS JEP a členem mezinárodních společností. Je autorem více než 50 článků v mezinárodních impaktovaných časopisech, více než 100 sdělení na mezinárodních a domácích kongresech, spoluautorem Revidovaného mezinárodního prognostického systému pro MDS a Evropských guidelines pro diagnostiku a léčbu MDS.
Zdroje
1. Ganz T, Nemeth E. Iron metabolism: interactions with normal and disordered erythropoiesis. Cold Spring Harb Perspect Med 2012; 2(5): doi: 10.1101/ cshperspect.a011668.
2. Kautz L, Jung G, Valore E et al. Identification of erythroferrone as an erythroid regulator of iron metabolism. Nat Genet 2014; 46(7): 678 – 684. doi: 10.1038/ ng.2996.
3. Andrews NC. Anemia of inflammation: the cytokine ‑ hepcidin link. J Clin Invest 2004; 113(9): 1251 – 1253.
4. Weiss G, Goodnough LT. Anemia of chronic disease. N Engl J Med 2005; 352(10): 1011 – 1023.
5. Cullis JO. Diagnosis and management of anaemia of chronic disease: current status.Br J Haematol 2011; 154(3): 289 – 300. doi: 10.1111/ j.1365 ‑ 2141.2011.08741.x.
6. Geisser P. The pharmacology and safety profile of ferric carboxymaltose (Ferinject®): structure/ reactivity relationships of iron preparations. Port J Nephrol Hypert 2009; 23(1): 11 – 16.
7. Camaschella C. Iron and hepcidin: a story of recycling and balance. Hematology Am Soc Hematol Educ Program 2013; 2013. 1 – 8. doi: 10.1182/ asheducation ‑ 2013.1.1.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná Interné lekárstvo Nutričný terapeut Obezitológia
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2015 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Vývoj České gastroenterologické společnosti a gastroenterologie z pohledu tří generací lékařů
- Starší generace gastroenterologů a hepatologů
- Vývoj a proměny české gastroenterologie a gastroenterologické společnosti v 70leté historii
- Niektoré postrehy z histórie slovenskej gastroenterológie 1945– 2002
- Vývoj a proměny české gastroenterologie – 90. léta minulého století
- Vzťahy
- Střední generace gastroenterologů a hepatologů
- Česká gastroenterologie po roce 1989 – osobní pohled
- Spolupráce Společnosti pro gastrointestinální onkologii s Českou gastroenterologickou společností
- Význam hradecké školy pro českou gastroenterologii
- Vývoj a premeny česko‑ slovenskej gastroenterológie po roku 2000
- Střední generace gastroenterologů a hepatologů
- Historie hepatologie na území České republiky
- Nekonečná endoskopická cesta aneb endoskopická chirurgie – nový obor?
- Vývoj léčby idiopatických střevních zánětů v posledních 20 letech
- Mladší generace gastroenterologů a hepatologů
- Další vývoj české gastroenterologie z pohledu mladých gastroenterologů
- Medailonky předsedů České gastroenterologické společnosti
- Diagnostika a léčba anémie u nemocných s chorobami gastrointestinálního traktu
-
Komentář k článku v časopise Gut
Screening jaterního poškození u pacientů s diabetes mellitus 2. typu - Svízelná diagnostika primární sklerozující cholangitidy u pacienta s rekurentními epizodami akutní bakteriální cholangitidy
-
Komentář ke kazuistice
Svízelná diagnostika primární sklerozující cholangitidy s rekurentními epizodami akutní bakteriální cholangitidy - Neobvyklá příčina průjmu – cholecystokolická píštěl: kazuistika a literární přehled
- Bouveretův syndrom – endoskopické řešení vysokého ileu
- ICDS 2015, Praha
- Komentáře k vybraným zahraničním článkům
- Budenofalk Uno 9 mg enterosolventní granule
- Autodidaktický test: historie gastroenterologické společnosti a časopisu
- SOUTĚŽ O NEJLEPŠÍ KAZUISTIKU 2015
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Neobvyklá příčina průjmu – cholecystokolická píštěl: kazuistika a literární přehled
- Budenofalk Uno 9 mg enterosolventní granule
- Diagnostika a léčba anémie u nemocných s chorobami gastrointestinálního traktu
- Střední generace gastroenterologů a hepatologů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




