-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nedostatočná liečba tiopurínmi u pacientov s nešpecifickými zápalovými ochoreniami čreva odoslaných na anti-TNF liečbu
Thiopurine undertreatment among inflammatory bowel disease patients referred for anti-TNF therapy
Thiopurines are effective in maintaining remission in inflammatory bowel disease (IBD) patients. Their effect is dose-dependent, and the optimal daily dose of azathioprine (AZA) is 2–2.5 mg/kg. Inadequate dosing may result in lack of efficacy and ensuing premature referral for biological therapy.
Aim:
The aims were to assess the rate of deviation from the normal thiopurine dose among IBD patients referred for biological therapy and to analyze the reasons for this deviation.Patients and Methods:
All the IBD patients referred for anti-TNF therapy in one referral center by November 2014 were included. The dose of AZA at the time of indication for step-up to anti-TNF was noted, as well as the reasons for the use of a reduced dose of AZA, which was defined as a dose lower than 2 mg/kg.Results:
In total, 176 IBD patients were included. The mean age was 37 years (range 18–76 years), 92 (52%) were men, 120 (68%) had Crohn‘s disease, 54 (31%) had ulcerative colitis, and two (1%) were IBD unclassified. Twenty-eight patients (16%) were receiving an unreduced dose of AZA; 93 (53%) patients had not used AZA previously (8 patients; 5%) or were using a low dose of AZA (85 patients; 48%) without documented reasons; 55 patients (32%) had discontinued AZA (38 patients; 22%) or undergone a dose reduction (17 patients; 10%) of AZA because of adverse events.Conclusion:
In a real life clinical practice a substantial proportion of IBD patients referred for anti-TNF therapy are using low dose AZA with only a minority for well documented reasons of biologically-determined intolerance.Key words:
inflammatory bowel disease – treatment – thiopurines
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
9. 7. 2016Accepted:
11. 7. 2016
Autoři: V. Suchá 1; B. Kadlečková 2; B. Repákova 2; Ľ. Krajčíová 3; Ľ. Jurgoš 1; S. Kiňová 4; Z. Zelinková 2,5
Působiště autorů: Gastroenterologická ambulancia, Jurgos s. r. o., Bratislava, Slovenská republika 1; IBD centrum, Assiduo, Bratislava, Slovenská republika 2; Ústav lekárskej biológie, genetiky a klinickej genetiky, LF UK a UN Bratislava, Slovenská republika 3; I. interná klinika LF UK a UN Bratislava, Slovenská republika 4; Gastroenterologické oddelenie a oddelenie digestívnej endoskopie, Nemocnica sv. Michala, a. s., Bratislava, Slovenská republika 5
Vyšlo v časopise: Gastroent Hepatol 2016; 70(4): 335-339
Kategorie: IBD: původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh2016335Souhrn
Tiopuríny sa používajú na udržanie remisie u pacientov s nešpecifickými zápalovými ochoreniami čreva (IBD – inflammatory bowel disease). Ich efekt je závislý od dávky s odporúčanou dennou dávkou 2–2,5 mg/kg pre azatioprín (AZA). Nedostatočná dávka je spojená s inefektivitou a môže tak viesť k prematúrnej indikácii biologickej liečby.
Cieľ:
Cieľom práce bolo stanoviť mieru odchýlky od normálneho dávkovacieho režimu tiopurínov u pacientov odoslaných na biologickú liečbu a analyzovať dôvody redukovanej dávky.Pacienti a metodika:
Do štúdie boli zaradení IBD pacienti odoslaní na biologickú liečbu k 1. novembru 2014 v jednom centre biologickej liečby. Dávka AZA v čase indikácie biologickej liečby a dôvody pre redukovanú dávku AZA, ktorá bola definovaná ako dávka nižšia ako 2 mg/ kg, boli vyhľadané v dokumentácii.Výsledky:
Celkovo bolo zahrnutých 176 pacientov, z toho 92 mužov (52 %), priemerný vek 37 rokov (rozmedzí 18–76 rokov) – 120 (68 %) s Crohnovou chorobou, 54 (31 %) s ulceróznou kolitídou, 2 (1 %) s nešpecifikovaným IBD. Neredukovanú dávku AZA malo 28 pacientov (16 %); 93 (53 %) pacientov predtým buď vôbec neužívalo AZA (8 pacientov; 5 %) alebo malo nízku dávku AZA (85 pacientov; 48 %) bez zdokumentovaných dôvodov; 55 pacientov (32 %) buď prerušilo liečbu AZA (38 pacientov; 22 %) alebo podstúpilo redukciu dávky AZA (17 pacientov; 10 %) kvôli rozvoju nežiadúcich účinkov.Záver:
V reálnej klinickej praxi polovica IBD pacientov odoslaných na anti-TNF liečbu užíva redukovanú dávku AZA bez jasne zdokumentovaného dôvodu.Kľúčové slová:
nešpecifické zápalové ochorenia čreva – liečba – tiopurínyÚvod
Napriek výrazným pokrokom výskumu v posledných rokoch nie je etiopatogenéza nešpecifických zápalových ochorení čreva (IBD – inflammatory bowel disease) do detailov objasnená, z čoho vyplýva, že terapeutické možnosti cielenej intervencie sú stále limitované. Imunosupresívna liečba tiopurínovými analógmi, azatioprínom (AZA), 6-merkaptopurínom (6-MP), prípadne 6-tioguanínom (6-TG), je efektívna v indukcii a udržiavaní remisie asi u 2/3 IBD pacientov a patrí do prvej línie udržiavacej liečby IBD [1–3]. Terapeutický efekt tiopurínov je závislý od dávky, pričom odporúčaná denná dávka je 1,5–2,5 mg/kg podľa European Crohn’s and Colitis Organisation (ECCO) odporúčaní [4] a 2,0–3,0 mg/ kg podľa AGA (American Gastroenterology Association) odporúčaní [5] pre AZA s adekvátnou redukciou dávky pre 6-MP a 6-TG.
Tiopurínmi je liečená približne polovica IBD pacientov [6,7], avšak u 15 až 39 % pacientov je nutné liečbu prerušiť alebo redukovať dávku v dôsledku rozvoja nežiadúcich účinkov [7–9]. Väčšina nežiadúcich účinkov sa objavuje počas prvých troch mesiacov liečby. Môžu byť závislé od dávky a tzv. idiosynkratické, od dávky nezávislé. Do prvej skupiny patrí tiopurínmi indukovaná myelosupresia, ktorá je popisovaná u 2–11 % pacientov. Hepatotoxicita, s prevalenciou 3–14 %, sa prejavuje ako včasná, tiopurínmi indukovaná hepatotoxicita, alebo po rokoch liečby ako nodulárna regeneratívna hyperplázia či fibróza pečene. Medzi najčastejšie idiosynkratické vedľajšie účinky patrí nauzea, vomitus a nevoľnosť, vyskytujúce sa u viac ako 15 % pacientov. Za nimi nasledujú bolesť hlavy, únava, nechutenstvo, chudnutie, stomatitída, alopécia, atralgia, svalová slabosť, rash, horúčka u viac ako 10 % pacientov. Pankreatitída sa popisuje v priemere u 4 % (3,2–8 %) pacientov [10–16].
Efekt a toxicita tiopurínov závisí okrem iného aj od biologickej aktivity enzýmu tiopurín-metyltransferáza (TPMT) (fenotyp) a od funkčných mutácií v géne kódujúcom enzým TPMT (genotyp) [12,15]. Food and Drug Administration odporúča stanovenie fenotypu alebo genotypu TPMT pred začatím liečby AZA z dôvodu prevencie myelotoxicity [16], v rozpore so súčasnými ECCO odporúčaniami [4]. Na Slovensku je v súčasnosti možné stanoviť genotyp TPMT, fenotypizácia TPMT nie je zaradená v štandardných výkonoch hradených zdravotnými poisťovňami. Odporúčania na prispôsobenie dávkovacieho režimu na základe TPMT genotypu sú nasledovné: u pacientov wild type homozygótov (dve funkčné alely aktívneho génu TPMT*1/ TPMT*1; 89 % populácie) sa liečba začína neredukovanou dávkou, u pacientov heterozygótov s jednou alelou TPMT*1; (11 % populácie) by sa iniciálna dávka mala redukovať na 30–70 % odporúčanej dávky a u pacientov homozygót-mutantov (homozygót s dvoma variantnými alelami; 0,3 % populácie) by sa tiopuríny podávať nemali, prípadne iniciálna dávka AZA musí byť 10× redukovaná, podávaná v intervale 3× týždenne za prísneho monitoringu pacienta z dôvodu vysokého rizika rozvoja myelosupresie [7,17,18].
Vzhľadom k závislosti efektu od dávky tiopurínov je u pacienta s aktivitou IBD pri konvenčnej liečby nevyhnutné dodržať adekvátny dávkovací režim pred zhodnotením stavu ako zlyhanie konvenčnej imunosupresie a indikovaním biologickej liečby. Dáta o adherencii gastroenterológov k uvedeným odporúčaniam nie sú známe, osobitne nie je známe, koľko z pacientov odoslaných na biologickú liečbu má reálne vyčerpané možnosti optimalizácie liečby tiopurínmi. Preto cieľom tejto kohortovej, retrospektívnej štúdie, založenej na analýze dát z chorobopisov, bolo, primárne určiť, aký podiel pacientov odoslaných na biologickú liečbu má adekvátnu dávku tiopurínov. Sekundárnym cieľom tejto štúdie bolo zanalyzovať, či sú dôvody pre nepoužitie tiopurínov v adekvátnej dávke jasne zdokumentované a podľa súčasných odporúčaní je redukované dávkovanie odôvodnené.
Súbor pacientov a metodika
Do štúdie boli zaradení všetci IBD pacienti odoslaní do jedného centra pre biologickú liečbu IBD k 1. novembru 2014 na zváženie biologickej liečby. Vylúčení boli pacienti, u ktorých nebolo možné v dokumentácii overiť údaje o dávke AZA v momente indikácie k biologickej liečbe. Zaznamenané boli základné demografické údaje o veku, pohlaví pacienta, fenotype ochorenia, dôvodu indikácie biologickej liečby, dávke AZA v momente indikácie k biologickej liečbe a dôvody pre redukovanú dávku AZA (denná dávka nižšia ako 2 – 2,5 mg/kg) alebo prerušenie liečby AZA. Vyhodnotené bolo percentuálne zastúpenie nežiadúcich účinkov AZA a počet pacientov, u ktorých bol stanovený genotyp TPMT.
Výsledky
Spolu bolo v databáze evidovaných 186 IBD pacientov odoslaných na biologickú liečbu k danému dátumu. Desať pacientov bolo vylúčených pre chýbajúce údaje v zdravotnej dokumentácii, celkovo pre analýzu boli použité údaje od 176 IBD pacientov (tab. 1).
Tab. 1. Základné demografické charakteristiky súboru pacientov. Tab. 1. Patients’ demographics. 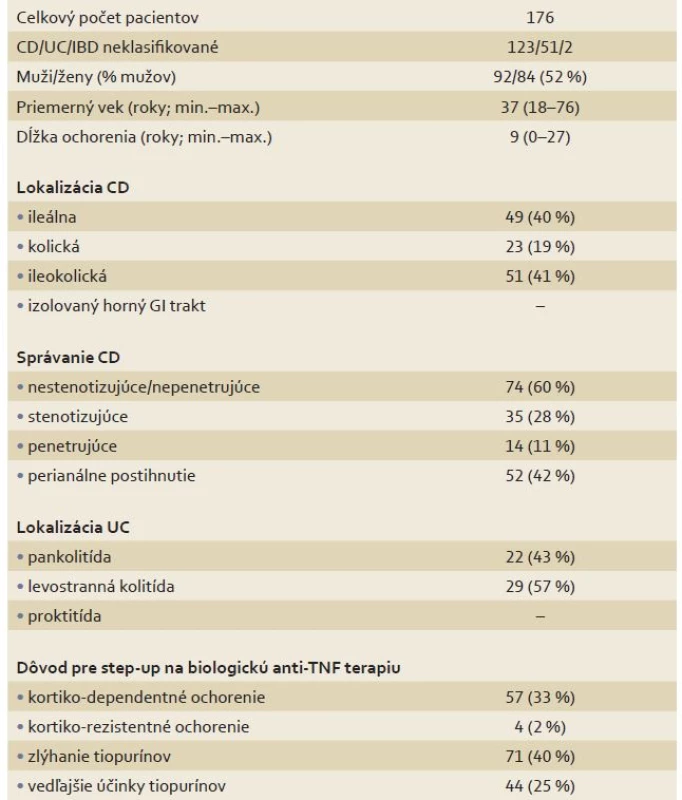
CD – Crohnova choroba, UC – ulcerózna kolitída, IBD – nešpecifické črevné zápalové ochorenia, GI – gastrointestinálny Z týchto 176 pacientov užívalo podľa dokumentácie neredukovanú dávku AZA 28 pacientov (16 %), 93 (53 %) pacientov predtým buď vôbec neužívalo AZA (8 pacientov; 5%) alebo malo dávku AZA pod 2 mg/kg (85 pacientov; 48 %) bez jasných dôvodov uvedených v zdravotnej dokumentácii. Celkovo 55 (32 %) pacientov malo zdokumentované nežiadúce účinky ako dôvod pre ukončenie liečby AZA (38 pacientov; 22 %), alebo redukciu dávky AZA (17 pacientov; 10 %). Dávkovanie a zdokumentovanie zdôvodnenia tohto dávkovanie AZA zobrazuje graf 1.
Graf 1. Liečba azatioprínom u IBD pacientov odoslaných na biologickú anti-TNF liečbu. Graph 1. Treatment with azathioprine of IBD patients referred for anti-TNF biological treatment. 
Dôvodom pre prerušenie liečby AZA boli myelotoxicita (7 pacientov; 18 % zo všetkých pacientov, ktorí liečbu prerušili), hepatotoxicita (6 pacientov; 16 %), pankreatitída (5 pacientov; 13 %), gastrointestinálne (GI) symptómy (4 pacienti; 11 %), alergické reakcie and artralgia (5 pacientov; 13 %), jedna pacientka prerušila liečbu pre vznik cervikálneho karcinómu in situ. U 10 pacientov (26 %) neboli nežiadúce reakcie zdokumentované. V prípade nežiadúcich účinkov ako dôvodu redukcie dávky sa jednalo o myelotoxicitu (5 pacientov; 29 % zo všetkých pacientov, ktorí podstúpili redukciu dávky), idiosynkratické reakcie v zmysle GI symptómov, artralgií a flu-like symptómov (5 pacientov; 29 %), hepatotoxicitu (3 pacienti; 18 %); u štyroch pacientov (24 %) typ nežiadúcej reakcie nebol špecifikovaný (graf 2).
Graf 2. Nežiadúce účinky uvedené v dokumentácii pre prerušenie liečby (A) alebo redukciu dávky azatioprínu (B) u pacientov odoslaných na biologickú liečbu. Graph 2. Side effects leading to azathioprine treatment discontinuation (A) or dose reduction (B) among patients referred for biological therapy as documented in medical records. 
GI – gastrointestinálne Iba 24 pacientov (14 %) malo stanovený genotyp TPMT, ktorý odhalil troch heterozygotov; dvaja z nich užívali redukovanú dávku AZA, tretí pacient (senior s psychiatrickou komorbiditou) liečbu AZA nedostal pre obavy z nežiadúcich účinkov pri danom genotype a komorbidite nezaručujúcej compliance.
Diskusia
Uvedená kohortová, retrospektívna štúdia analyzujúca údaje zo zdravotnej dokumentácie 176 IBD pacientov odoslaných na biologickú liečbu ukazuje, že v tejto klinickej situácii bolo adekvátne dávkovanie tiopurínov použité u minority pacientov. Navyše dôvody pre redukciu dávky pod štandardnú terapeutickú dávku 2–2,5 mg/kg nefigurujú jednoznačne v zdravotnej dokumentácii. V analyzovanej kohorte 53 % IBD pacientov odoslaných na biologickú liečbu tiopuríny buď neužívalo, alebo malo redukovanú dávku. Toto percento výrazne prevyšuje rozptyl 15–39 % výskytu od dávky závislých nežiadúcich účinkov tiopurínov uvádzaný v literatúre [7–9]. Na základe tohto porovnania možno predpokladať, že časť pacientov bola neodôvodnene poddávkovaná, osobitne berúc do úvahy fakt, že u polovice všetkých pacientov nebol dôvod na redukovanú dávku v zdravotnej dokumentácii uvedený.
V situácii stúpajúcich nákladov na liečbu IBD tak v dôsledku stúpajúcej incidencie, ako aj vysokej ceny nových liekov, predstavujú tiopuríny relatívne lacnú liečebnú modalitu. Sú účinné pri udržaní remisie u 2/3 IBD pacientov; 1/3 IBD pacientov však na liečbu neodpovedá a približne 10 % pacientov musí liečbu ukončiť v dôsledku nežiadúcich účinkov [19]. U časti pacientov je nedostatočná odpoveď a výskyt nežiadúcich účinkov, osobitne hepatotoxicity, spôsobený tzv. metabolickým shiftom. V tejto situácii v dôsledku vyššej aktivity TPMT dochádza k odkloneniu metabolickej dráhy tiopurínov smerom k hepatotoxickým metylovaným metabolitom a nie sú dosiahnuté terapeutické hladiny farmakodynamicky účinných metabolitov 6-TG. Niekoľko doteraz publikovaných štúdií dokumentovalo úspešnú reverziu nedostatočnej odpovede alebo nežiadúcich účinkov tiopurínov u pacientov s týmto metabolickým profilom prispôsobením dávky alebo pridaním liekov interferujúcich s metabolizmom tiopurínov ako allopurinol alebo mesalazín [20–24]. V predkladanej kohorte pacientov 5 % všetkých pacientov prerušilo liečbu AZA alebo malo redukovanú dávku pre hepatotoxické nežiadúce účinky. Títo pacienti by z uvedeného metabolického shiftu komedikáciou allopurinolom mohli profitovať. Navyše, ako už bolo uvedené, u polovice pacientov neboli dôvody redukcie dávky z dokumentácie zrejmé a je možné špekulovať, že signifikantná časť týchto pacientov by rovnako mohla profitovať z optimalizácie liečby, či už zvýšením dávkovania, alebo modifikáciou metabolizmu.
Na základe prezentovaných deskriptívnych dát je zrejmé, že v reálnej klinickej praxi sú rezervy v optimalizácii liečby tiopurínmi. Základným krokom k tejto optimalizácii je zreteľné zdokumentovanie dôvodov pre redukované dávkovanie tiopurínov, ktoré – ako ukazujú predstavené dáta – skôr systematicky než incidentálne v zdravotnej dokumentácii chýba. Farmakoekonomické dáta zamerané na analýzu efektu optimalizácie liečby tiopurínov zatiaľ nie sú dostupné. Aj bez farmakoekonomického opodstatnenia optimalizácie liečby tiopurínmi však ostáva dôležitým argumentom poskytnúť IBD pacientovi touto cestou možnosť ušetrenia kombinovanej imunosupresie so všetkými jej potenciálnymi komplikáciami.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 9. 7. 2016
Přijato: 11. 7. 2016
doc. MU Dr. Zuzana Zelinková, PhD.
Gastroenterologické oddelenie a oddelenie digestívnej endoskopie
Nemocnica sv. Michala
Satinského 1
811 06 Bratislava
Slovenská Republika
zuzana.zelinkova@nsmas.sk
Zdroje
1. Prefontaine E, Sutherland LR, Macdonald JK et al. Azathioprine or 6-mercaptopurine for maintenance of remission in Crohn’s disease. Cochrane Database Syst Rev 2009; 1: CD000067. doi: 10.1002/ 14651858.CD000067.pub2.
2. Prefontaine E, Macdonald JK, Sutherland LR. Azathioprine or 6-mercaptopurine for induction of remission in Crohn’s disease. Cochrane Database Syst Rev 2010; 4: CD000545. doi: 10.1002/ 14651858.CD000545.pub2.
3. Timmer A, McDonald JW, Macdonald JK. Azathioprine and 6-mercaptopurine for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2007; 1: CD000478.
4. Dignass A, Van Assche G, Lindsay JO et al. The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: current management. J Crohns Colitis 2010; 4(1): 28 – 62. doi: 10.1016/ j.crohns.2009.12.002.
5. Lichtenstein GR, Abreu MT, Cohen R et al. American Gastroenterological Association Institute medical position statement on corticosteroids, immunomodulators, and infliximab in inflammatory bowel disease. Gastroenterology 2006; 130(3): 935 – 939.
6. Cosnes J, Gower-Rousseau C, Seksik P et al. Epidemiology and natural history of inflammatory bowel diseases. Gastroenterology 2011; 140(6): 1785 – 1794. doi: 10.1053/ j.gastro.2011.01.055.
7. Chouchana L, Narjoz C, Beaune P et al. Review article: the benefits of pharmacogenetics for improving thiopurine therapy in inflammatory bowel disease. Aliment Pharmacol Ther 2012; 35(1): 15 – 36. doi: 10.1111/ j.1365-2036.2011.04905.x.
8. Ansari A, Hassan C, Duley J et al. Thiopurine methyltransferase activity and the use of azathioprine in inflammatory bowel disease. Aliment Pharmacol Ther 2002; 16(10): 1743 – 1750.
9. Jharap B, Seinen ML, de Boer NK et al. Thiopurine therapy in inflammatory bowel disease patients: analyses of two 8-year intercept cohorts. Inflamm Bowel Dis 2010; 16(9): 1541 – 1549. doi: 10.1002/ ibd.21221.
10. Hindorf U, Lindqvist M, Hildebrand H et al. Adverse events leading to modification of therapy in a large cohort of patients with inflammatory bowel disease. Aliment Pharmacol Ther 2006; 24(2): 331 – 342.
11. Costantino G, Furfaro F, Belvedere Aet al. Thiopurine treatment in inflammatory bowel disease: response predictors, safety, and with-drawal in follow-up. J Crohns Colitis 2012; 6(5): 588 – 596. doi: 10.1016/ j.crohns.2011.11.007.
12. Frei P, Biedermann L, Nielsen OH et al. Use of thiopurines in inflammatory bowel disease. World J Gastroenterol 2013; 19(7): 1040 – 1048. doi: 10.3748/ wjg.v19.i7.1040.
13. Goel RM, Blaker P, Mentzer A et al. Optimizing the use of thiopurines in inflammatory bowel disease. Ther Adv Chronic Dis 2015; 6(3): 138 – 146. doi: 10.1177/ 2040622315579063.
14. Greguš M. Riziká imunosupresívnej liečby tiopurínmi u IBD pacientov. Gastroenterol Prax 2013; 12(3): 130 – 133.
15. Kopylov U, Ben-Horin S, Seidman E. Therapeutic drug monitoring in inflammatory bowel disease. Ann Gastroenterol 2014; 27(4): 304 – 312.
16. Lichtenstein GR, Abreu MT, Cohen R et al. American Gastroenterological Association Institute medical position statement on corticosteroids, immunomodulators, and infliximab in inflammatory bowel disease. Gastroenterology 2006; 130(3): 935 – 939. doi: 10.1038/ clpt.2010.320.
17. Relling MV, Gardner EE, Sandborn WJet al. Clinical pharmacogenetics implementation consortium guidelines for thiopurine me-thyltransferase genotype and thiopurine dosing. Clin Pharmacol Ther 2011; 89(3): 387 – 391. doi: 10.1038/ clpt.2010.320.
18. Weinshilboum RM, Sladek SL. Mercaptopurine pharmacogenetics: monogenic inheritance of erythrocyte thiopurine methyltransferase activity. Am J Hum Genet 1980; 32(5): 651 – 662.
19. Chevaux JB, Peyrin-Biroulet L, Sparrow MP. Optimizing therapy in inflammatory bowel disease. Inflamm Bowel Dis 2011; 17(6): 1428 – 1435. doi: 10.1002/ ibd.21494.
20. Ansari A, Patel N, Sanderson J et al. Low-dose azathioprine or mercaptopurine in combination with allopurinol can bypass many adverse drug reactions in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2010; 31(6): 640 – 647. doi: 10.1111/ j.1365-2036.2009.04221.x.
21. de Boer NK, Wong DR, Jharap B et al. Dose-dependent influence of 5-aminosalicylates on thiopurine metabolism. Am J Gastroenterol 2007; 102(12): 2747 – 2753.
22. Sparrow MP, Hande SA, Friedman Set al. Allopurinol safely and effectively optimizes tioguanine metabolites in inflammatory bowel disease patients not responding to azathioprine and mercaptopurine. Aliment Pharmacol Ther 2005; 22(5): 441 – 446.
23. Hoentjen F, Seinen ML, Hanauer SB et al. Safety and effectiveness of long-term allopurinol-thiopurine maintenance treatment in inflammatory bowel disease. Inflamm Bowel Dis 2013; 19(2): 363 – 369. doi: 10.1002/ ibd.23021.
24. Smith MA, Blaker P, Marinaki AM et al. Optimising outcome on thiopurines in inflammatory bowel disease by co-prescription of allopurinol. J Crohns Colitis 2012; 6(9): 905 – 912. doi: 10.1016/ j.crohns.2012.02.007.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2016 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Klinická a experimentální gastroenterologie
- Pneumokoková vakcína – vzácná nežádoucí reakce
- Pankreatické cystické léze u pacientů po transplantaci jater
- První hodnocená zkušenost s testem Septin 9 v České republice
- Význam regulácie tranzientných relaxácií dolného pažerákového zvierača v patogenéze pažerákovej refluxovej choroby
- Bronchogenní cysta jícnu
- Apoptóza při vývoji kolorektální neoplazie
- Primární adenokarcinom žaludku s yolk sac diferenciací
- Metabolický profil pacientů po transplantaci jater ve vztahu k rozvoji NAFLD – výsledky pilotní studie
- Nezvyklá manifestace časného kryptogenního hepatocelulárního karcinomu
- Nedostatočná liečba tiopurínmi u pacientov s nešpecifickými zápalovými ochoreniami čreva odoslaných na anti-TNF liečbu
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Noví členové redakční rady časopisu
- Falk Symposium 202 – Evolving therapies in clinical practice in IBD
- Výběr z mezinárodních časopisů
-
Správná odpověď na kvíz
Pemfigus - Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Olysio® (simeprevir)
- SOUTĚŽ O DVĚ NEJLEPŠÍ PŮVODNÍ PRÁCE 2016
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- První hodnocená zkušenost s testem Septin 9 v České republice
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Bronchogenní cysta jícnu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



