-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Metabolický profil pacientů po transplantaci jater ve vztahu k rozvoji NAFLD – výsledky pilotní studie
Metabolic profile of liver transplant recipient with respect to the development of NAFLD – results of a pilot study
Aims:
Non-alcoholic fatty liver disease (NAFLD) of liver grafts occurs in 31–56% of liver transplant recipients, and its prevalence increases with time after transplantation. The aim of this prospective study was to analyze metabolic profile of liver transplant recipients with respect to development of NAFLD.Methods:
The pilot part of the prospective study included 31 patients at 1–16 years after liver transplantation who underwent a protocol liver biopsy. We performed laboratory investigations of glucose and lipid metabolism, and determined liver fat content and subcutaneous and visceral fat volume by 1H MR spectroscopy and imaging. We determined the maximal mitochondrial capacity in musculus gastrocnemius by dynamic 31P MR spectroscopy.Results:
In the liver biopsies, we found steatosis grade 2–3 in 12 (38.7%) patients, steatosis grade 1 in 13 (41.9%) patients, and no steatosis in six (19.4%) patients. With increasing steatosis grade, a positive correlation was found between BMI (p = 0.002), waist circumference (p = 0.004), subcutaneous fat volume (p = 0.023), visceral fat volume (p = 0.034), occurrence of metabolic syndrome (p = 0.006), fasting glucose (p = 0.043), glycated haemoglobin (p = 0.048) and C-peptide (p = 0.026). The proportion of smokers was lower in patients with steatosis than in those without steatosis (p = 0.001). Increases in the HOMA index (p = 0.10) and decreases in the QUICKI index (p = 0.10) did not reach statistical significance. With increasing steatosis grade, we found a trend towards a decrease in maximal mitochondrial capacity of skeletal muscles measured by 31P MR spectroscopy, but the differences were not statistically significant (p = 0.23). Histological grade of steatosis correlated well with steatosis grade measured by 1H MR spectroscopy (p = 0.0002).Conclusions:
In this pilot study, we identified significant clinical, laboratory and MR parameters that could contribute to predicting NAFLD in liver transplant recipients.Key words:
insulin resistance – magnetic resonance – metabolic syndrome – mitochondrial capacity – NAFLD – liver transplantation
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
11. 7. 2016Accepted:
1. 8. 2016
Autoři: I. Hejlová 1; M. Dezortová 2; P. Šedivý 2; M. Drobný 2; M. Hájek 2; M. Cahová 3; H. Daňková 3; E. Sticová 4; V. Lánská 5; P. Trunečka 6
Působiště autorů: Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 1; Pracoviště radiodiagnostiky a intervenční radiologie, Komplement, IKEM, Praha 2; Centrum experimentální medicíny, IKEM, Praha 3; Pracoviště klinické a transplantační patologie, Transplantcentrum, IKEM, Praha 4; Lékařská statistika, IKEM, Praha 5; Transplantcentrum, IKEM, Praha 6
Vyšlo v časopise: Gastroent Hepatol 2016; 70(4): 325-330
Kategorie: Hepatologie: původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh2016325Souhrn
Cíl:
Nealkoholická steatóza (NAFLD – non-alcoholic fatty liver disease) jaterního štěpu se vyskytuje u 31–56 % pacientů po transplantaci jater, její výskyt narůstá s dobou od transplantace. Cílem naší prospektivní studie byla analýza metabolického profilu pacientů po transplantaci jater ve vztahu k rozvoji NAFLD.Metody:
Pilotní část prospektivní studie zahrnula 31 pacientů 1 – 16 let po transplantaci jater, kteří podstoupili protokolární biopsii jater. Provedli jsme laboratorní vyšetření glukózového a lipidového metabolizmu, 1H MR spektroskopií a zobrazováním jsme stanovili obsah tuku v játrech a objem podkožního a viscerálního tuku. Metodou dynamické 31P MR spektroskopie jsme v musculus gastrocnemius stanovili maximální mitochondriální kapacitu.Výsledky:
V biopsii jater jsme prokázali steatózu stupně 2 – 3 u 12 (38,7 %) pacientů, steatózu stupně 1 u 13 (41,9 %) pacientů a šest (19,4 %) pacientů bylo bez steatózy. Se stupněm steatózy pozitivně koreloval body mass index (p = 0,002), obvod pasu (p = 0,004), objem podkožního (p = 0,023) i viscerálního tuku (p = 0,034), výskyt metabolického syndromu (p = 0,006), lačná glykemie (p = 0,043), glykovaný hemoglobin (p = 0,048) a C-peptid (p = 0,026). Podíl kuřáků ve skupině se steatózou byl významně menší (p = 0,001) než ve skupině bez steatózy. Vzestup HOMA indexu (p = 0,10) a pokles QUICKI indexu (p = 0,10) nedosahovaly statistické významnosti. Se vzrůstajícím stupněm steatózy jsme pozorovali trend k poklesu maximální mitochondriální kapacity kosterního svalstva měřené 31P MR spektroskopií, ale rozdíly nebyly statisticky signifikantní (p = 0,23). Histologický stupeň steatózy dobře koreloval se stupněm steatózy stanoveným 1H MR spektroskopií (p = 0,0002).Závěry:
V pilotní studii jsme identifikovali významné klinické, laboratorní a MR parametry, které mohou přispět k predikci NAFLD u pacientů po transplantaci jater.Klíčová slova:
inzulinová rezistence – magnetická rezonance – metabolický syndrom – mitochondriální kapacita – NAFLD – transplantace jaterÚvod
Prevalence nealkoholické steatózy jater (NAFLD – non-alcoholic fatty liver disease) se v obecné populaci západních zemí pohybuje mezi 19 a 31 % [1,2]. Pacienti s NAFLD mají dle rozsáhlých studií vyšší celkovou mortalitu [3,4]. NAFLD je spojena se znaky metabolického syndromu zahrnujícími abdominální obezitu, inzulinovou rezistenci nebo diabetes mellitus 2. typu (DM2T) a aterogenní dyslipidemií, k rozvoji NAFLD významně predisponují i genetické faktory [5]. Tématu prevalence, rizikových faktorů a významu steatózy po transplantaci jater jsme se věnovali v rozsáhlé retrospektivní epidemiologické studii hodnotící celkem 2 360 potransplantačních biopsií u 548 pacientů po ortotopické transplantaci jater (OLT – orthotopic liver transplantation) [6]. Steatóza jaterního štěpu (≥ 5 %) postihovala 56,4 % pacientů, u 10,4 % pacientů byla diagnostikována steatohepatitida (NAS ≥ 5). Výskyt steatózy narůstal s dobou od OLT (30,3 % v jednom roce, 47,6 % v 10 letech). Nezávislými před-/ peritransplantačními rizikovými faktory steatózy nad 33 % byly alkoholická cirhóza, vysoký body mass index (BMI) a nízká sérová alkalická fosfatáza, iniciálně podávaný mykofenolát mofetil měl protektivní účinek. Nezávislými potransplantačními rizikovými faktory byly vysoký BMI, vysoký obsah triglyceridů v séru, konzumace alkoholu, přítomnost DM2T a nízký obsah kreatitinu. Pacienti se steatózou nad 33 % měli tendenci k horšímu dlouhodobému přežívání [6]. Retrospektivní design studie neumožňoval hodnocení dalších potenciálně významných faktorů spojených s výskytem NAFLD, zejména stupně inzulinové rezistence.
Zlatým standardem měření inzulinové rezistence je metoda hyperinzulinického euglykemického clampu, která je však nákladná a časově i organizačně značně náročná. Pro účely větších epidemiologických studií lze bazální inzulinovou rezistenci snadno hodnotit pomocí HOMA (homeostasis assessment model) indexu nebo QUICKI (quantitative insulin sensitivity check index), které vycházejí z hodnot lačné inzulinemie a lačné glykemie, nebo z poměrů lačná glykemie/inzulinemie nebo 1/lačná inzulinemie. Markerem endogenní sekrece inzulinu je C-peptid, jehož hladina není ovlivněna exogenně podávaným inzulinem [7,8].
U pacientů s DM2T a inzulinovou rezistencí byl popsán pokles v energetickém metabolizmu kosterního svalstva [9,10]. Mitochondriální oxidativní fosforylaci lze in vivo hodnotit metodou 31P MR spektroskopie při zátěži, při které se mimo jiné měří hodnota rychlosti syntézy fosfokreatinu (VPCr), a lze vypočítat maximální mitochondriální kapacitu (Qmax) [9–11].
Kromě jaterní biopsie lze stupeň jaterní steatózy hodnotit i metodou 1H MR spektroskopie [12], jejíž výhodou je neinvazivita a použitelnost i v rozsáhlých epidemiologických studiích. Jak jsme prokázali v naší předchozí práci, je tato metoda vhodná i pro hodnocení obsahu tuku v transplantovaných játrech [13].
Cílem této pilotní prospektivní studie bylo zhodnotit metabolický profil pacientů po transplantaci jater ve vztahu k přítomnosti NAFLD hodnocené histologicky a identifikovat faktory vhodné pro predikci potransplantační NAFLD.
Metodika
Do studie byli zahrnuti pacienti, kteří podstoupili protokolární jaterní biopsii v rámci standardního sledování po OLT. Studie nezahrnovala pacienty s rekurencí hepatitidy C ve štěpu, pacienty s aktuálním známým či předpokládaným abúzem alkoholu a pacienty léčené prednisonem v dávce nad 5 mg/den. Všichni pacienti podepsali informovaný souhlas se studií a s MR vyšetřením.
Vzorek biopsie jater byl získán Menghiniho technikou a zpracován standardním způsobem v naší laboratoři. Biopsie byly klasifikovány dle Kleinera et al [14] a steatóza byla rozdělena dle procenta postižených hepatocytů na stupeň 0 u < 5 %, stupeň 1 u 5 – 33 %, stupeň 2 u 33,1–66 % a stupeň 3 u > 66 %.
V den biopsie byly pacientům odebrány vzorky krve po celonočním lačnění (min. 8 hod) a stanoveny parametry glukózového a lipidového metabolizmu.
V den biopsie po krátkodobém lačnění (min. 3 hod) jsme technikou MR získali celkový objem břicha, objem podkožního a viscerálního tuku. Metodou 1H MR spektroskopie jsme stanovili procento objemu tuku v játrech, toto měření bylo prováděno ve třech standardizovaných částech jater.
Následujícího dne podstoupili pacienti po celonočním lačnění (min. 8 hod) vyšetření dynamickou 31P MR spektroskopií. Při ní pacienti prováděli plantární flexi a extenzi jedné končetiny na mechanickém ergometru vlastní výroby s pracovní zátěží cca 10 kg. Po 6 min cvičení následovalo 6 min klidu, kdy byly opakovaně měřeny intenzity signálů z oblasti musculus gastrocnemius odpovídající signálům anorganického fosfátu, fosfokreatinu (PCr), fosfodiesterů a ATP a z nich byla vypočtena iniciální VPCr a Qmax. Vyšetření se prováděla na 3T celotělovém tomografu Trio (Siemens, Německo).
Statistické hodnocení
Kategorické proměnné jsou udávány v absolutních počtech a procentech, spojité proměnné jako průměr a směrodatná odchylka. Rozdíly mezi spojitými proměnnými byly hodnoceny pomocí analýzy rozptylu (ANOVA–analysis of variance) nebo Kruskal-Wallisova testu, rozdíly v procentuálním zastoupení byly porovnány pomocí Pearsonova χ2 testu. Všechny proměnné byly porovnávány mezi třemi skupinami pacientů, se steatózou stupně 2–3, 1 a 0. Vzhledem k malému počtu pacientů v jednotlivých skupinách nebylo možné provést multivariantní analýzu. Spearmanův korelační koeficient byl použit k měření závislosti dvou spojitých veličin. Za statisticky významnou byla použita hodnota p < 0,05. Pro statistické hodnocení jsme použili JMP 10.0.0 statistický software, SAS Institute Inc. 2012.
Výsledky
V pilotní studii bylo hodnoceno 31 pacientů, 17 (54,8 %) mužů, průměrného věku 55,5 ± 9,6 let, v průměru 5,7 ± 4,0 let (rozmezí 1 – 16 let) po OLT. Indikací k transplantaci jater byla alkoholická cirhóza u 11 pacientů (35,5 %), virová hepatitida B nebo C u 6 pacientů (19,4 %), biliární cirhóza u 5 pacientů (16,1 %), jiná diagnóza u 9 pacientů (29,0 %). Průměrný BMI v době biopsie byl 27,9 ± 5,4. V době biopsie mělo 19 pacientů (61,3 %) hypertenzi a 13 pacientů (41,9 %) DM2T. Základním imunosupresivem byl takrolimus u 28 pacientů (90,3 %), cyklosporin u 1 pacienta (3,2 %) a sirolimus u 2 pacientů (6,5 %). Devět pacientů (29,0 %) bylo léčeno prednisonem v dávce 1,25–5,0 mg/den.
Histologickým zhodnocením vzorku jaterní biopsie byla u jednoho pacienta (3,2 %) přítomna steatóza stupně 3, u 11 (35,5 %) steatóza stupně 2, u 13 pacientů (41,9 %) steatóza stupně 1 a šest pacientů (19,4 %) bylo bez steatózy (stupeň 0). Klinická (tab. 1), laboratorní (tab. 2), histologická (tab. 2) a MR data (tab. 3) jsme porovnávali mezi třemi skupinami pacientů, pacienty se steatózou stupně 2–3, 1 a 0.
Tab. 1. Rozdíly klinických parametrů a užívané medikace mezi skupinami pacientů s různým stupněm steatózy v biopsii jater. Tab. 1. Differences in clinical parameters and medication between groups of patients with various steatosis grade on the liver biopsy. 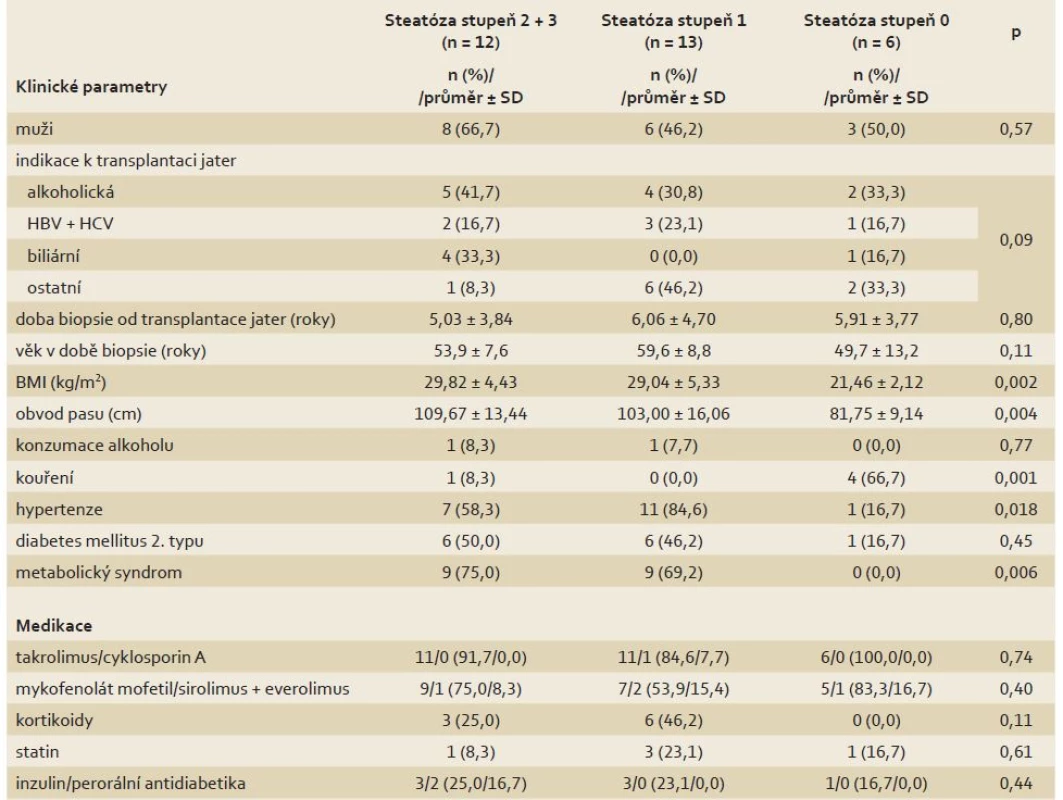
BMI – body mass index, HBV – virová hepatitida B, HCV – virová hepatitida C, SD – směrodatná odchylka Tab. 2. Rozdíly laboratorních a histologických parametrů mezi skupinami pacientů s různým stupněm steatózy v biopsii jater. Tab. 2. Diff erences in laboratory and histological parameters between groups of patients with various steatosis grade on the liver biopsy. 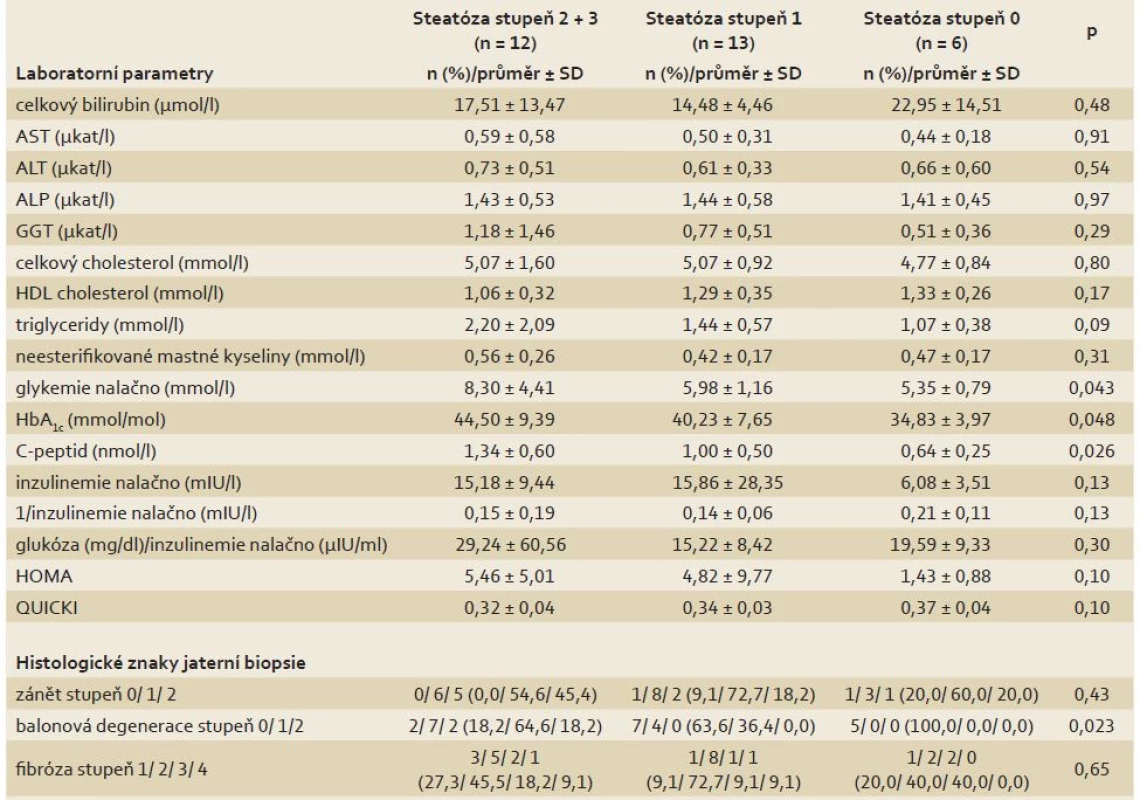
ALP – alkalická fosfatáza, ALT – alaninaminotransferáza, AST – aspartátaminotransferáza, GGT – gamaglutamyltransferáza, HbA1c – glykovaný hemoglobin, HDL – high density lipoprotein, SD – směrodatná odchylka, HOMA – homeostasis assessment model, QUICKI – quantitative insulin sensitivity check index Tab. 3. Rozdíly MR parametrů mezi skupinami pacientů s různým stupněm steatózy v biopsii jater. Tab. 3. Differences in MR parameters between groups of patients with various steatosis grade on the liver biopsy. 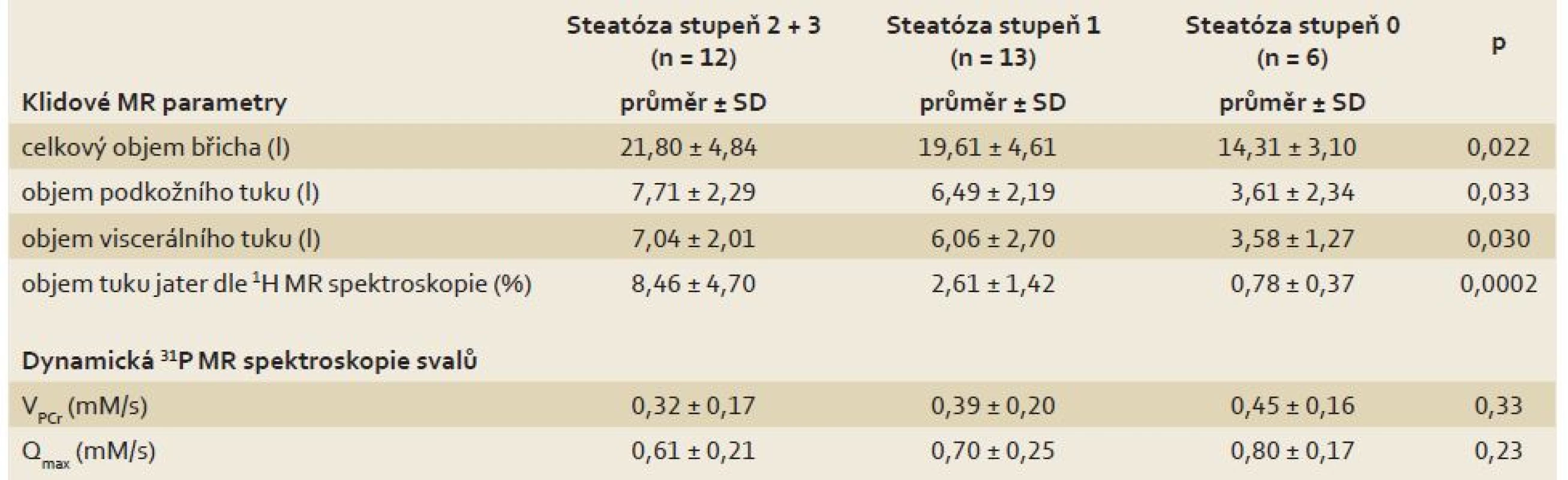
MR – magnetická rezonance, SD – směrodatná odchylka, Qmax – maximální mitochondriální kapacita, VPCr – časová konstanta regenerace fosfokreatinu po zátěži S rostoucím stupněm steatózy pozitivně koreloval BMI (p = 0,002), obvod pasu (p = 0,004), objem podkožního (p = 0,023) i viscerálního tuku (p = 0,034), výskyt metabolického syndromu (p = 0,006), lačná glykemie (p = 0,043), glykovaný hemoglobin (p = 0,048) a C-peptid (p = 0,026). Ve skupině se steatózou byl menší podíl kuřáků (p = 0,001). Mezi skupinami nebyly rozdíly v užívané imunosupresi a v hodnotách jaterních testů.
Vzestup HOMA indexu (p = 0,10), pokles QUICKI indexu (p = 0,10) a vzestup obsahu triglyceridů v séru (p = 0,09) nedosahovaly statistické významnosti.
Se vzrůstajícím stupněm steatózy jsme pozorovali trend k poklesu maximální mitochondriální kapacity (Qmax) lýtkových svalů měřené 31P MR spektroskopií, ale rozdíly nebyly statisticky signifikantní (p = 0,23). Histologický stupeň steatózy dobře koreloval se stupněm steatózy stanoveným 1H MR spektroskopií (p = 0,0002).
Z histologických parametrů s rostoucím stupněm steatózy stoupal stupeň balonové degenerace (p = 0,023), nelišil se stupeň zánětu nebo fibrózy.
V tab. 4 jsou uvedeny Spearmanovy korelační koeficienty závislosti mezi objemem jaterního tuku stanoveného 1H MR spektroskopií a parametry obezity, glukózového metabolizmu/ inzulinové rezistence a dynamické 31P MR spektroskopie. Z parametrů obezity nejlépe s objemem jaterního tuku koreloval objem viscerálního tuku a obvod pasu, dále BMI a celkový objem břicha. Z parametrů glukózového metabolizmu/ inzulinové rezistence objem jaterního tuku koreloval s lačnou glykemií, glykovaným hemoglobinem a C-peptidem. Korelace mezi objemem jaterního tuku a maximální mitochondriální kapacitou hodnocenou dynamickou 31P MR spektroskopií nebyla statisticky významná.
Tab. 4. Korelace mezi objemem jaterního tuku stanoveným 1H MR spektroskopií a parametry obezity, inzulinové rezistence a dynamické 31P MR spektroskopie. Tab. 4. Correlation between liver fat volume measured by 1H MR spectroscopy and parameters of obesity, insulin resistance and dynamic 31P MR spectroscopy. 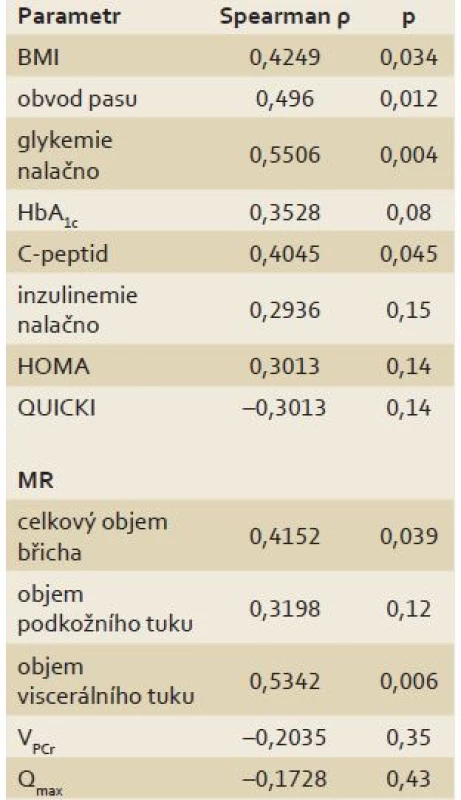
BMI – body mass index, HbA1c – glykovaný hemoglobin, HOMA – homeostasis assessment model, QUICKI – quantitative insulin sensitivity check index, MR – magnetická rezonance, Qmax – maximální mitochondriální kapacita, VPCr – časová konstanta regenerace fosfokreatinu po zátěži Diskuze a závěr
V naší předchozí retrospektivní studii [6] jsme prokázali, že steatóza jaterního štěpu se týká velkého počtu pacientů po transplantaci jater (56,4 %) a její výskyt narůstá s dobou od transplantace (30,3 % v jednom roce; 47,6 % v 10 letech). Prospektivní studií navazujeme na předchozí výsledky s cílem zpřesnit metabolický profil pacientů ve vztahu k výskytu NAFLD, výsledky pilotní části zahrnující 31 pacientů po OLT předkládáme v této práci.
Výskyt NAFLD jaterního štěpu stanovený histologicky koreloval dle očekávání s abdominální obezitou, množstvím viscerálního tuku a výskytem metabolického syndromu. Z laboratorních parametrů nejlépe se stupněm steatózy korelovaly lačná glykemie, glykovaný hemoglobin a C-peptid. C-peptid je markerem endogenní sekrece inzulinu, který není ovlivněn exogenně podávaným inzulinem, takže ve skupině pacientů s častým diabetem léčeným inzulinem dává přesnější výsledky než inzulinemie [7].
Z indexů inzulinové rezistence/ senzitivity měly v našem souboru hraniční významnost HOMA a QUICKI, ostatní indexy inzulinové rezistence (lačná glykemie/inzulinemie nebo 1/lačná inzulinemie) nebyly v našem souboru statisticky významné. Na rozdíl od literatury jsme nepozorovali vliv stupně steatózy na hladinu neesterifikovaných mastných kyselin [15,16].
S rostoucím stupněm steatózy klesala maximální mitochondriální kapacita kosterního svalstva měřená 31P MR spektroskopií, nicméně tento rozdíl nebyl v našem malém souboru statisticky signifikantní. Některé studie však naznačují, že změny v energetickém metabolizmu kosterního svalstva se mohou vyskytovat v časné fázi patofyziologie DM2T a inzulinové rezistence [9,10].
V souladu s literaturou dobře koreloval histologický stupeň steatózy s objemem jaterního tuku stanoveným 1H MR spektroskopií, což dále potvrzuje, že je tato metoda vhodná ke stanovení stupně steatózy jaterního štěpu [12,13].
Stupeň steatózy v naší studii nekoreloval s hodnotou jaterních testů a dokonce i většina pacientů se steatózou nad 33 % měla hodnoty jaterních testů v rámci normy, což zdůrazňuje nutnost hledání jiných parametrů, které mohou steatózu predikovat.
Byť má většina imunosupresiv podávaných po orgánových transplantacích nežádoucí metabolické účinky na výskyt hyperlipoproteinemie a DM2T [17], v naší pilotní studii jsme nepozorovali vliv jednotlivých imunosupresiv na stupeň steatózy jaterního štěpu. Příčinou může být delší časový odstup od transplantace u většiny nemocných (v průměru 5,7 let), kdy je snaha dávky imunosupresiv minimalizovat vždy, je-li to možné.
V naší pilotní prospektivní studii jsme prokázali, že histologický stupeň steatózy koreluje s BMI, obvodem pasu, objemem podkožního i viscerálního tuku, výskytem metabolického syndromu, lačnou glykemií, glykovaným hemoglobinem a C-peptidem. Ve skupině se steatózou byl menší podíl kuřáků. Vzestup HOMA indexu a pokles QUICKI indexu nedosahovaly statistické významnosti. Se vzrůstajícím stupněm steatózy jsme pozorovali trend k poklesu maximální mitochondriální kapacity kosterního svalstva měřené 31P MR spektroskopií, ale rozdíly nebyly statisticky signifikantní. Histologický stupeň steatózy dobře koreloval se stupněm steatózy stanoveným 1H MR spektroskopií. V dalším výzkumu je třeba pokračovat prospektivní studií na větším souboru pacientů.
Studie vznikla za podpory grantů AZV MZ ČR 15-26906A a IGA MZ ČR NT11275-6.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Doručeno: 11. 7. 2016
Přijato: 1. 8. 2016
MU Dr. Mgr. Irena Hejlová
Klinika hepatogastroenterologie
Transplantcentrum, IKEM
Vídeňská 1958/ 9
140 21 Praha 4
irhe@ikem.cz
Zdroje
1. Bedogni G, Miglioli L, Masutti F et al. Prevalence of and risk factors for nonalcoholic fatty liver disease: the Dionysos nutrition and liver study. Hepatology 2005; 42(1): 44 – 52.
2. Browning JD, Szczepaniak LS, Dobbins R et al. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology 2004; 40(6): 1387 – 1395.
3. Adams LA, Lymp JF, St Sauver J et al. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology 2005; 129(1): 113 – 121.
4. Söderberg C, Stål P, Askling J et al. Decreased survival of subjects with elevated liver function tests during a 28-year follow-up. Hepatology 2010; 51(2): 595 – 602. doi: 10.1002/ hep.23314.
5. Anstee QM, Seth D, Day CP. Genetic factors that affect risk of alcoholic and nonalcoholic fatty liver disease. Gastroenterology 2016; 150(8): 1728 – 1744. doi: 10.1053/ j.gastro.2016.01.037.
6. Hejlova I, Honsova E, Sticova E et al. Prevalence and risk factors of steatosis after liver transplantation and patient outcomes. Liver Transpl 2016; 22(5): 644 – 655. doi: 10.1002/ lt.24393.
7. Wallace TM, Matthews DR. The assessment of insulin resistance in man. Diabet Med 2002; 19(7): 527 – 534.
8. Muniyappa R, Lee S, Chen H et al. Current approaches for assessing insulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage. Am J Physiol Endocrinol Metab 2008; 294(1): E15 – E26.
9. Petersen KF, Dufour S, Befroy D et al. Impaired mitochondrial activity in the insulin-resistant offspring of patients with type 2 diabetes. N Engl J Med 2004; 350(7): 664 – 671.
10. Scheuermann-Freestone M, Madsen PL,Manners D et al. Abnormal cardiac and skeletal muscle energy metabolism in patients with type 2 diabetes. Circulation 2003; 107(24): 3040 – 3046.
11. Šedivý P, Kipfelsberger MC, Dezortová M et al. Dynamic 31P MR spectroscopy of plantar flexion: influence of ergometer design, magnetic field strength (3 and 7 T), and RF-coil design. Med Phys 2015; 42(4): 1678 – 1689. doi: 10.1118/ 1.4914448.
12. Thomsen C, Becker U, Winkler K et al. Quantification of liver fat using magnetic resonance spectroscopy. Magn Reson Imaging 1994; 12(3): 487 – 495.
13. Hájek M, Dezortová M, Wagnerová Det al. MR spectroscopy as a tool for in vivo determination of steatosis in liver transplant recipients. MAGMA 2011; 24(5): 297 – 304. doi: 10.1007/ s10334-011-0264-9.
14. Kleiner DE, Brunt EM, Van Natta M et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 2005; 41(6): 1313 – 1321.
15. Zhang J, Zhao Y, Xu C et al. Association between serum free fatty acid levels and nonalcoholic fatty liver disease: a cross-sectional study. Sci Rep 2014; 4 : 5832. doi: 10.1038/ srep05832.
16. Larter CZ, Yeh MM, Haigh WG et al. Hepatic free fatty acids accumulate in experimental steatohepatitis: Role of adaptive pathways. J Hepatol 2008; 48(4): 638 – 647. doi: 10.1016/ j.jhep.2007.12.011.
17. Sorice GP, Muscogiuri G, Mezza T et al. Metabolic syndrome in transplant patients: an academic or a health burden? Transplant Proc 2011; 43(1): 313 – 317. doi: 10.1016/ j.transproceed.2010.09.099.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2016 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Klinická a experimentální gastroenterologie
- Pneumokoková vakcína – vzácná nežádoucí reakce
- Pankreatické cystické léze u pacientů po transplantaci jater
- První hodnocená zkušenost s testem Septin 9 v České republice
- Význam regulácie tranzientných relaxácií dolného pažerákového zvierača v patogenéze pažerákovej refluxovej choroby
- Bronchogenní cysta jícnu
- Apoptóza při vývoji kolorektální neoplazie
- Primární adenokarcinom žaludku s yolk sac diferenciací
- Metabolický profil pacientů po transplantaci jater ve vztahu k rozvoji NAFLD – výsledky pilotní studie
- Nezvyklá manifestace časného kryptogenního hepatocelulárního karcinomu
- Nedostatočná liečba tiopurínmi u pacientov s nešpecifickými zápalovými ochoreniami čreva odoslaných na anti-TNF liečbu
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Noví členové redakční rady časopisu
- Falk Symposium 202 – Evolving therapies in clinical practice in IBD
- Výběr z mezinárodních časopisů
-
Správná odpověď na kvíz
Pemfigus - Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Olysio® (simeprevir)
- SOUTĚŽ O DVĚ NEJLEPŠÍ PŮVODNÍ PRÁCE 2016
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- První hodnocená zkušenost s testem Septin 9 v České republice
- Obstrukce duodena a obstrukční ikterus jako první symptomy primárního maligního duodenálního lymfomu
- Flush, rosacea, alebo červenanie – pochopenie rozdielov
- Bronchogenní cysta jícnu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



