-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Budesonid MMX (Cortiment® 9 mg) v léčbě ulcerózní kolitidy v reálné klinické praxi
Budesonide MMX (Cortiment® 9 mg) in the treatment of ulcerative colitis in real clinical practice
Background:
Budesonide MMX (Cortiment® 9 mg) is a novel local-acting glucocorticoid for the treatment of mild-to-moderate active ulcerative colitis (UC).Aim:
To assess the efficacy and safety of this treatment in UC patients.Methods:
In 81 patients (ten centers in the Czech Republic were involved) with mild-to-moderate UC, treatment with Cortiment® 9 mg once daily was initiated according to routine clinical practice. These patients were included in an 8 week retrospective multicenter study. The partial Mayo score and endoscopic Mayo score were assessed at weeks 0, 4 and 8, resp. 0 and 8. Adverse events of special interest, as well as tolerability and compliance data, were collected at weeks 4 and 8.Results:
The clinical and endoscopic activity of UC was significantly decreased; the mean partial resp. endoscopic Mayo score decreased from 5.46, resp. 2.09 at week 0 to 1.99, resp. 1.02 at week 8. Complete mucosal healing (Mayo 0) was observed in 22 (29.3%) patients at week 8. Clinical remission was achieved in 14% (week 4) and 52% (week 8) of patients. A clinical response was observed in 70% (week 4) and 84% (week 8) of patients. The safety profile was excellent: the incidence of each adverse event did not exceed 5%, an adverse event was reported by 13 patients (16%), and only four patients (4.9%) discontinued the medication because they experienced an adverse event.Conclusion:
Our results demonstrated the very good efficacy and excellent safety profile of Cortiment® 9 mg in the treatment of UC.Key words:
ulcerative colitis – glucocorticoids – budesonide
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
15. 11. 2016Accepted:
22. 11. 2016
Autoři: Luděk Hrdlička 1; M. Bortlík 2; T. Douda 3; P. Drastich 4
; Přemysl Falt 5
; P. Matějková 6; J. Koželuhová 7; M. Liberda 8; L. Nedbalová 9; A. Novotný 10; M. Kolář 2
; M. Lukáš 2
Působiště autorů: Gastroenterologie, Medicon a. s., Poliklinika Budějovická, Praha 1; Klinické a výzkumné centrum pro střevní záněty, ISCARE I. V. F. a. s., Praha 2; II. interní gastroenterologická klinika LF UK a FN Hradec Králové 3; Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 4; Centrum péče o zažívací trakt, Vítkovická nemocnice a. s., Ostrava 5; Gastroenterologické oddělení, EGK s. r. o., Sanatorium sv. Anny, Praha 6; Gastroenterologie, I. interní klinika LF UK a FN Plzeň 7; Gastroenterologická ambulance, Nemocnice Valašské Meziříčí, a. s. 8; IBD centrum Turnov, Krajská nemocnice Liberec, a. s. IV. interní klinika – klinika gastroenterologie a hepatologie, 1. LF UK a VFN v Praze 9; IV. interní klinika – klinika gastroenterologie a hepatologie, 1. LF UK a VFN v Praze 10
Vyšlo v časopise: Gastroent Hepatol 2016; 70(6): 509-513
Kategorie: IBD: původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh2016509Souhrn
Úvod:
Budesonid MMX (Cortiment® 9 mg) je novým topickým kortikosteroidem určeným pro léčbu mírně až středně aktivní ulcerózní kolitidy (UC).Cíl:
Zhodnotit efektivitu a bezpečnost podávání přípravku Cortiment® 9 mg v léčbě pacientů s UC.Metodika:
Do multicentrického (10 pracovišť) retrospektivního osmitýdenního sledování bylo zařazeno celkem 81 pacientů s mírně až středně aktivní UC, u kterých byla v souladu s klinickou praxí zahájena terapie budesonidem MMX v dávce 9 mg denně. Efektivita léčby byla sledována pomocí klinického (týdny 0, 4 a 8) a endoskopického Mayo skóre (týdny 0 a 8). Bezpečnost, tolerance léčby a adherence k léčbě byly monitorovány dotazníkovou metodou v týdnech 4 a 8.Výsledky:
Při terapii lékem Cortiment® 9 mg v jedné denní dávce došlo k významnému snížení klinické a endoskopické aktivity UC se snížením průměrné hodnoty parciálního Mayo skóre z 5,46 na začátku léčby na hodnotu 1,99 v týdnu 8. Průměrná hodnota endoskopického Mayo skóre na začátku terapie byla 2,09, v týdnu 8 poklesla na průměrnou hodnotu 1,02. Zcela normální endoskopický nález (Mayo 0) v týdnu 8 byl zaznamenán u 22 (29,3 %) pacientů. V klinické remisi (parciální Mayo skóre ≤ 1) se nacházelo 14, resp. 52 % nemocných v týdnech 4 a 8, klinickou odpověď jsme zaznamenali u 70 % pacientů v týdnu 4 a u 84 % pacientů v týdnu 8. Bezpečnostní profil podávané medikace byl výborný.Závěr:
Zjištěné výsledky krátkodobé léčby přípravku Cortiment® 9 mg prokazují velmi dobrou efektivitu a výborný bezpečnostní profil v léčbě nemocných s mírnou až středně závažnou formou UC.Klíčová slova:
ulcerózní kolitida – glukokortikoidy – budesonidÚvod
Cortiment® 9 mg je novým lékem určeným pro léčbu mírně až středně aktivní ulcerózní kolitidy (UC), účinnou látkou je syntetický topický glukokortikoid budesonid, jenž se vyznačuje vysokou afinitou ke glukokortikoidnímu receptoru. Jeho významnou předností je vysoký „first-pass effect“, který zajišťuje odbourání cca 90 % budesonidu vstřebaného ze střeva při prvním průchodu játry a podstatnou eliminaci nežádoucích účinků glukokortikoidové léčby. Uvolnění účinné látky až v tlustém střevě je pak docíleno použitím unikátního vazebného systému označovaného jako MMX (multi-matrix).
Efektivita a bezpečnost terapie přípravkem Cortiment® 9 mg je dokumentována velkými registračními studiemi 3. fáze nazvanými CORE I a CORE II. Obě studie zahrnuly > 1 000 pacientů s mírně až středně aktivní UC zařazených do obou projektů na čtyřech kontinentech. Primárního cíle studií, tj. kombinované klinické a endoskopické remise, bylo po osmi týdnech léčby dosaženo u 17,4 % (CORE II), resp. 17,9 % (CORE I) nemocných; v porovnání s placebovými rameny (4,5, resp.7,4 %) byly rozdíly statisticky významné [1,2]. V sekundárních cílech studií (významné klinické a endoskopické zlepšení, histologické zhojení) bylo dosaženo velmi příznivých a povětšinou statisticky průkazných benefitů léčby budesonidem MMX v porovnání s placebem. Cortiment® 9 mg byl v obou projektech velmi dobře tolerován, závažné nežádoucí účinky se objevily zcela výjimečně a jejich výskyt se statisticky významně neodlišoval od jejich frekvence ve skupině pacientů na placebu, stejně výborný byl bezpečnostní profil i při selektivním hodnocení potenciálních negativních glukokortikoidových efektů [1,2]. Přesvědčivé výsledky těchto dvou velkých studií fáze 3 vedly k tomu, že Evropská agentura pro kontrolou léčiv EMA povolila užívání léčiva v klinické praxi pro nemocné s UC s mírnou až střední aktivitou. Na našem trhu se tento lék objevil zcela nedávno a z pochopitelných důvodů s ním nebyly žádné větší praktické zkušenosti. Cílem této studie bylo zhodnotit efektivitu a bezpečnost podávání budesonidu MMX (Cortiment® 9 mg) v domácí reálné klinické praxi v léčbě pacientů s mírnou až středně aktivní UC.
Metodika a soubor pacientů
Jedná se o retrospektivní multicentrické sledování, do kterého bylo zařazeno celkem 81 pacientů s mírně nebo středně aktivní UC celkem z 10 českých pracovišť. V souladu s doporučeními byla u všech pacientů zavedena léčba preparátem Cortiment® 9 mg v dávce jedna tableta denně po dobu osmi týdnů. Kritéria pro zařazení pacientů byla následující: pacient ve věku ≥ 18 let s aktivní lehkou až středně těžkou UC (parciální Mayo skóre 2–6) v rozsahu postižení tlustého střeva > 20 cm. Hodnoceni byli nově diagnostikovaní pacienti i nemocní se známou diagnózou UC, kteří na udržovací terapii vykazovali známky exacerbace. Povolená konkomitantní medikace při vstupu do studie zahrnovala aminosalicyláty, imunosupresiva (azathioprin, 6-merkaptopurin), biologickou terapii anti-TNF-a i lokální terapii (topický mesalazin, topické kortikoidy). Vyřazovacími kritérii byly UC limitovaná na rektum – proktitida, aktuální léčba systémovými kortikoidy, gravidita, laktace, známá dysplazie nebo karcinom tlustého střeva a konečníku a věk < 18 let.
Sledování pacientů v týdnech 0, 4 a 8 bylo realizováno pomocí elektronických kazuistických formulářů vyplňovaných v období březen–září 2016. Monitorována byla klinická aktivita choroby (parciální Mayo skóre v týdnech 0, 4 a 8) a endoskopický nález na sliznici tračníku (endoskopické Mayo skóre v týdnech 0 a 8), zaznamenávány byly změny v konkomitantní medikaci (týdny 4 a 8) a výskyt nežádoucích účinků, snášenlivost terapie a pacientova subjektivní vyjádření adherence k léčbě v týdnech 4 a 8.
Za klinickou odpověď bylo považováno snížení parciálního Mayo skóre o ≥ 2 bodů proti výchozí hodnotě v týdnu 0. Klinická remise onemocnění byla definována hodnotou parciálního Mayo skóre 1 nebo 0. Endoskopická hodnocení byla provedena při proktosigmoideoskopickém vyšetření nebo koloskopii podle klasifikačního systému endoskopického subskóre Mayo indexu v týdnu 0 a v týdnu 8 [3,4].
Klinická a demografická data sledovaných pacientů jsou uvedena v tab. 1.
Tab. 1. Klinické a demografické charakteristiky souboru při zařazení do sledování. Tab.1. Clinical and demographic characteristics of the cohort at baseline. 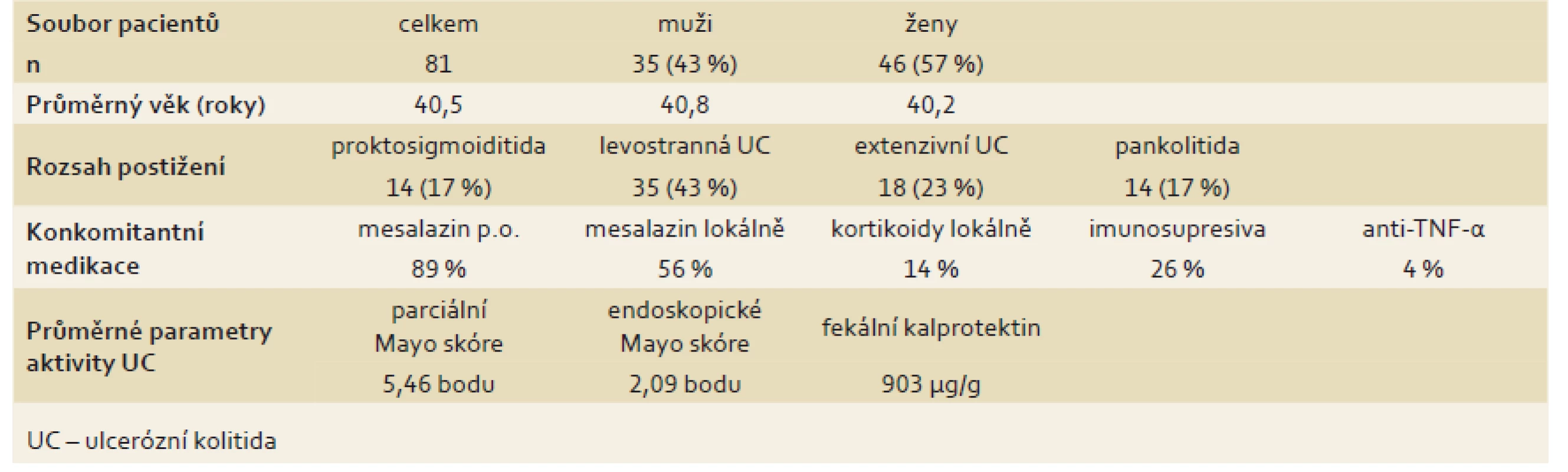
Výsledky
Klinický efekt
Osmitýdenní léčbu dokončilo 72 pacientů (89 %); u devíti pacientů byla medikace předčasně ukončena, z toho u pěti z nich z důvodu její neefektivity. Během osmitýdenní léčby preparátem Cortiment® 9 mg 1× denně došlo k významnému poklesu klinické aktivity onemocnění, průměrná hodnota parciálního Mayo skóre poklesla z 5,46 na začátku léčby na 3,16 v týdnu 4 a na hodnotu 1,99 v týdnu 8. O něco lépe zareagovali na medikaci nemocní s levostranným postižením, nicméně také u pacientů s pankolitidou došlo k podstatnému snížení aktivity choroby. Bylo zaznamenáno zásadní zmírnění nebo úplné vymizení krvácení, průměrná hodnota subskóre krvácení poklesla z výchozí 1,43 v týdnu 0 na 0,71, resp. 0,36 v týdnech 4 a 8.
V klinické remisi se nacházelo 14, resp. 52 % nemocných v týdnech 4 a 8, klinickou odpověď jsme zaznamenali dokonce u 70 % pacientů v týdnu 4 a 84 % pacientů v týdnu 8. Při ukončení sledování v týdnu 8 pokračovalo v medikaci Cortiment® 40 pacientů (49 %), 35 pacientů pokračovalo na dávce 9 mg denně, pět pacientů užívalo nadále 9 mg ob den.
Slizniční hojení
Výsledky dokumentují i zlepšení endoskopického nálezu, průměrná hodnota endoskopického Mayo skóre poklesla z 2,09 při zahájení léčby na 1,02 v týdnu 8. Zcela normální endoskopický nález – kompletní slizniční zhojení (endoskopické subskóre Mayo 0) – mělo při ukončení sledování 22 (29,3 %) pacientů (graf 1 a 2).
Graf 1. Vývoj průměrného parciálního Mayo skóre a subskóre krvácení. Graph 1. Average partial Mayo score and bleeding sub-score throughout the study. 
Graf 2. Vývoj endoskopického Mayo skóre, proporce pacientů s klinickou odpovědí a pacientů v remisi. Graph 2. Endoscopic Mayo score, patients with clinical response and in clinical remission. 
Vedlejší účinky
Bezpečnostní profil podávané medikace byl velmi dobrý, vč. cíleně sledované potenciální glukokortikoidové toxicity, výskyt jednotlivých nežádoucích účinků v týdnech 4 i 8 byl relativně velmi nízký. Žádný z nich se nevyskytoval u > 5 % sledovaných pacientů. Celkem referovalo alespoň jeden vedlejší účinek léčby 13 pacientů (16 %). Medikace byla pro nežádoucí účinky vysazena u čtyř pacientů (4,9 %). Důvody pro ukončení léčby byly: svědivý exantém na zádech a ve vlasech, amenorea, palpitace a oprese na hrudi a obava pacienta z nové medikace. Subjektivní snášenlivost podávané medikace a adherenci k ní hodnotili jednotliví probandi vysoce pozitivně (graf 3 a 4).
Graf 3. Nežádoucí účinky léčby. Graph 3. Adverse effects of medication. 
Graf 4. Subjektivní snášenlivost a compliance k léčbě. Graph 4. Subjective tolerance and compliance. 
Diskuze
Efektivita léčby preparátem Cortiment® 9 mg v souboru pacientů z 10 českých gastroenterologických pracovišť v běžné klinické praxi je výrazně lepší, než byly výsledky provedených klinických zkoušek 3. fáze [1,2]. Důvodem pro to mohou být nejen relativně přísná zařazovací kritéria do zmiňovaných studií CORE I a CORE II, ale také striktní hodnoticí kritéria. Primárním cílem v obou studiích bylo zjistit poměr pacientů, kteří dosáhnou v 8. týdnu léčby remise choroby, jež byla určena hodnotou celkového Mayo skóre 0–1, které odpovídá kompletní kombinované klinické a endoskopické remisi choroby. V českém souboru pacientů byly hodnocené parametry pro klinickou a endoskopickou remisi zvažovány odděleně.
Pro hodnocení účinnosti protizánětlivé léčby preparátem Cortiment® je zásadní údaj o snížení průměrné hodnoty endoskopického subskóre, které je objektivním ukazatelem závažnosti zánětu a také významným prediktorem setrvalého účinku léčby. Naproti tomu některá klinická kritéria, jako je krvácení a především frekvence počtu stolic, jsou parametry relativně méně spolehlivými, s modifikujícím vlivem vlastní zánětlivé aktivity a také funkční poruchy tlustého střeva [5,6]. Vstupní průměrná hodnota fekálního kalproketinu byla několikanásobně zvýšena oproti horní hranici normy uváděné pro pacienty se střevními záněty (250 µg/ g) a svědčila pro vysoce aktivní fázi nemoci. Bohužel v současné době nejsou k dispozici data o vývoji tohoto důležitého biologického parametru zánětu při léčbě pacientů ve sledované kohortě.
Na rozdíl od velkých, randomizovaných, placebem kontrolovaných a dvojitě zaslepených studií fáze 3 se v této kohortové observační studii ukázalo, že postavení budesonidu MMX v klinické praxi může být ještě daleko širší, než jak tomu bylo v uvedených registračních projektech. Určitým překvapením je příznivé využití přípravku Cortiment® v terapii pacientů, u kterých došlo k exacerbaci UC, jenž byli na dlouhodobé terapii imunosupresivy, a také jako určitá „stabilizační“ terapie u nemocných na biologické léčbě, kteří vykazovali druhotnou ztrátu terapeutické odpovědi. Podávání topického kortikosteroidu s preferenčním uvolňováním v tlustém střevě může u těchto pacientů s relativně komplikovaným průběhem UC nahradit kortikosteroidy se systémovým účinkem. Pro potvrzení dlouhodobého významu této „stabilizační“ terapie budou nezbytná ještě další a pečlivá sledování těchto pacientů.
Česká studie potvrdila excelentní bezpečnostní profil léku s velmi nízkým výskytem nežádoucích účinků, který byl srovnatelný s údaji z citovaných klinických zkoušek. Zajímavým a důležitým zjištěním je skutečnost, že téměř u poloviny pacientů byla medikace podávána i po ukončení osmitýdenního období sledování, přičemž délka sledování ve studii odpovídá doporučované délce doby podávání. O dlouhodobé léčbě přípravkem Cortiment® není dostatek informací, data jsou dostupná v podstatě pouze z analýzy 12měsíčního klinického hodnocení zaměřeného zejména na bezpečnost podávání Cortiment® v dávce 6 mg denně (62 pacientů na účinné látce vs. 61 na placebu). Výsledky studie potvrzují přetrvávající benefit léčby při zachování dobrého bezpečnostního profilu podávané medikace [7–9]. U pacientů z našeho souboru, u kterých je medikace podávána nadále, bude pokračováno ve sledování, plánovány jsou kontroly po 24 a 48 týdnech.
Závěr
Data z české kohorty pacientů s mírnou až středně závažnou UC potvrzují dobrou efektivitu a výtečný bezpečnostní profil preparátu Cortiment® 9 mg. Během léčby došlo k významnému snížení klinické aktivity onemocnění, podstatnému zlepšení endoskopického nálezu a bylo dosaženo vysokého podílu pacientů v klinické remisi.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 15. 11. 2016
Přijato: 22. 11. 2016
MU Dr. Luděk Hrdlička
Gastroenterologie
Medicon a. s., Poliklinika Budějovická
Antala Staška 1670/ 80
140 00 Praha 4
ludek.hrdlicka@post.cz
Zdroje
1. Travis S, Danese S, Kupcinskas L et al. Once-daily budesonide MMX in active, mild-to-moderate ulcerative colitis: results from the randomised CORE II study. Gut 2014; 63(3): 433–441. doi: 10.1136/ gutjnl-2012-304258.
2. Sandborn WJ, Travis S, Moro L et al. Once-daily budesonide MMX® extended-release tablets induce remission in patients with mild to moderate ulcerative colitis: results from the CORE I study. Gastroenterology 2012; 143(5): 1218–1226. doi: 10.1053/ j.gastro.2012.08.003.
3. Schroeder KW, Tremaine WJ, Ilstrup DM. Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis. A randomized study. N Engl J Med 1987; 317(26): 1625–1629.
4. Rutgeerts P, Sandborn WJ, Feagan BG et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005; 353(23): 2462–2476.
5. Jharap B, Sandborn WJ, Reinisch W et al.Randomized clinical trial: discrepancies between patients-reported outcomes and endoscopic appearance in moderate to severe ulcerative colitis. Aliment Pharmacol Ther 2015; 42(9): 1082–1092. doi: 10.1111/ apt.13387.
6. Colombel JF, Keir ME, Scherl A et al. Discrepancies between patient-reported outcomes and endoscopic and histologic appearance in UC. Gut 2016. In press. doi: 10.1136/ gutjnl-2016-312307.
7. Sandborn WJ, Danese S, Ballard ED et al.Efficacy of budesonide MMX® 6 mg QD for the maintenance of remission in patients with ulcerative colitis: results from a phase III, 12 month safety and extended use study. Gastroenterology 2012; 142 (5 Suppl 1): S564. Abstract Su2080.
8. Travis S, Danese S, Ballard ED et al. Safetyanalysis of budesonide MMX 6 mg used for the maintenance of remission in patients with ulcerative colitis: results from a phase III, 12 month safety and extended use study. Gastroenterology 2012; 142 (5 Suppl 1): S566–S567.
9. Lichtenstein GR, Danese S, Ballard ED et al. Effect of budesonide MMX 6 mg on the hypothalamic–pituitary–adrenal (HPA) axis in patients with ulcerative colitis: results from a phase III, 12 month safety and extended use study. Gastroenterology 2012; 142 (5 Suppl 1): S785.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2016 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Dětská gastroenterologie a hepatologie
- Bariatrie
- Jaká je Vaše diagnóza?
- Niektoré genetické determinanty celiakie, význam HLA typizácie v klinickej praxi a zastúpenie HLA-DQ haplotypov v súbore 306 detských pacientov
- Význam fekálního kalprotektinu v diagnostice a sledování dospělých a dětských pacientů s idiopatickými střevními záněty
- Současná bariatricko-metabolická chirurgie
- Endoskopický duodenojejunální bypass (EndoBarrier®) jako nový terapeutický přístup u obézních diabetiků 2. typu – efektivita a faktory predikující optimální efekt
- Výsledky bezinterferonové léčby virové hepatitidy C v ČR v reálné praxi
- Budesonid MMX (Cortiment® 9 mg) v léčbě ulcerózní kolitidy v reálné klinické praxi
- Biosimilární infliximab v terapii anti-TNF naivních pacientů s IBD – jednoleté klinické sledování
- Doporučené postupy České gastroenterologické společnosti ČLS JEP pro diagnostickou a terapeutickou koloskopii
- Vídeňské ozvěny
- 1st National Congress of Gastrointestinal Oncologywith international participation
- Výběr z mezinárodních časopisů
-
Správná odpověď na kvíz
Diferenciální diagnóza – Crohnova choroba nebo hypersekreční stav podmíněný hypergastrinemií? - Kreditovaný autodidaktický test: dětská gastroenterologie a hepatologie + bariatrie
- Kombinace sofosbuviru a velpatasviru (Epclusa®)
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Význam fekálního kalprotektinu v diagnostice a sledování dospělých a dětských pacientů s idiopatickými střevními záněty
- Budesonid MMX (Cortiment® 9 mg) v léčbě ulcerózní kolitidy v reálné klinické praxi
- Doporučené postupy České gastroenterologické společnosti ČLS JEP pro diagnostickou a terapeutickou koloskopii
- Endoskopický duodenojejunální bypass (EndoBarrier®) jako nový terapeutický přístup u obézních diabetiků 2. typu – efektivita a faktory predikující optimální efekt
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



