-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Toxické a lékové poškození jater a ledvin
Toxic and drug damage of the liver and kidneys
Prevalence of toxic injury with parenchymous organ damage has been growing over recent decades. This could be due poisoning in acute or long-term /follow up. The cause is direct damage or toxoallergic effect. The majority of cases are following oral administration. Therefore, first management should focus on all methods of elimination from the gastrointestinal tract (vomiting, diarrhoea, gastrolavage), by kidneys (forced diuresis), antidotal, and methods of drug elimination by hemoperfusion, hemofiltration, hemodialysis or plasmaferesis. Often there is combined liver and kidney damage. In serious cases the most frequent symptoms are – inhibition of central nervous system (CNS) with cognition disturbance, excitation of CNS, miosis, mydriasis, muscle cramps, cholinergic, anticholinergic symptoms, hyper-and hypoventilation, increased osmotic gap, and metabolic acidosis. Poisoning by methy lalcohol, ethyl alcohol, ethylene glycol, organic solvents, mushrooms, snake and insect toxins and analgesics are frequent. But the most frequent damage is evident after drug administration.
Key words:
nephrotoxicity – hepatotoxicity – elimination – clinical features – treatment
Submitted: 31. 10. 2018
Accepted: 3. 2. 2019
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Autori: Teplan V. 1–4; Ševela K. 5
Pôsobisko autorov: Klinické a výzkumné centrum pro střevní záněty ISCARE I. V. F. a. s., Praha 1; 1. LF UK, Praha 2; Subkatedra nefrologie, Institut postgraduálního vzdělávání ve zdravotnictví, Praha 3; Katedra interních oborů a Interní klinika FN a LF OU, Ostrava 4; II. interní klinika FN u sv. Anny a LF MU, Brno 5
Vyšlo v časopise: Gastroent Hepatol 2019; 73(1): 66-75
Kategória: Vybrané kapitoly z vnitřního lékařství: přehledová práce
doi: https://doi.org/10.14735/amgh201966Súhrn
Toxických poškození parenchymových orgánů v posledních desetiletích významně přibývá. Může se jednat o poškození polékové či poškození způsobené toxickou látkou probíhající akutně či chronicky. Odezva na požitou látku může být přímé toxické poškození či poškození toxoalergické. Většina těchto látek je přijímána per os. Proto léčebné postupy zahrnují nejprve jednoduché eliminace formou odstranění z gastrointestinálního traktu (zvracení, průjem, výplach žaludku, adsorpční uhlí) či ledvinami (forsírovaná diuréza) a dále podání vyvazujících antidot či odstranění eliminačními metodami formou hemoperfuze, hemofiltrace, hemodialýzy či plazmaferézy. Vzhledem k metabolickým a eliminačním cestám je časté spolupostižení jater a ledvin. V závažných případech jsou nejčastějšími příznaky akutní útlum centrálního nervového systému (CNS) s poruchou vědomí, stimulace CNS, mióza, mydriáza, křeče kosterního svalstva, cholinergní projevy, anticholinergní projevy, hyper - a hypoventilace, zvýšený osmolální gap, metabolická acidóza. K častějším intoxikacím patří otravy metylalkoholem, etylalkoholem, etylenglykolem, organickými rozpouštědly, houbami, hadím a hmyzím jedem a analgetiky. Zdaleka nejčastější je však poškození polékové.
Klíčová slova:
nefrotoxicita – hepatotoxicita – eliminace – klinické příznaky – léčb
Úvod
Toxické postižení parenchymových orgánů a gastrointestinálního traktu
Nejčastější cestou vstupu toxických látek do organismu je perorální příjem. Proto také první cesta eliminace by měla být spojena s odstraněním přijaté látky z gastrointestinálního traktu (GIT) ještě před její resorpcí (zvracení, průjem, adsorpční uhlí). Navíc vedle přímého poškození jater může dojít k následnému poškození jater a ledvin a také elektrolytový a vodní rozvrat při postižení GIT může akcentovat postižení obou parenchymových orgánů [1].
Akutní poškození jater může vzniknout při řadě intoxikací, např. paracetamolem, etanolem, amatoxinem, tetrachlormetanem, halotanem, izoniazidem, aflatoxinem atd.
Téměř všechna léčiva podávaná pacientům s různým typem onemocnění ledvin, jejichž biotransformace probíhá v játrech, mohou vyvolat nežádoucí reakce projevující se laboratorním i klinickým obrazem akutního nebo chronického jaterního onemocnění s možným spolupostižením i dalších částí GIT. Velmi časté je současné poškození obou hlavních parenchymových orgánů těla, ledvin a jater.
I když mechanismy poškození jater a ledvin léky nejsou zcela objasněny, lze rozeznávat dva typy polékových reakcí:
- a) závislé na dávce – obvykle u léčiv s přímou hepato - či nefrotoxicitou, při určité dávce nastávají prakticky u každého jedince, lze je předvídat a reprodukovat v pokusu na zvířeti. Po vysazení léčiva nežádoucí reakce většinou rychle odeznívá, po opětném podání se objevuje znovu (např. azathioprin, paracetamol, allopurinol, izoniazid, methyldopa aj.);
- b) nezávislé na dávce – často se jedná o imunologicky podmíněné reakce charakteru idiosynkrazie nebo alergie, které u jednotlivce nelze předvídat, nejsou reprodukovatelné v experimentu (tzv. toxoalergická reakce). Objevují se až po opakovaném podání léčiva, velikost dávky není rozhodující. Poškození jater i ledvin může pokračovat a dále progredovat i po vysazení léku a nezřídka končí fatálně. Reakce je obvykle provázena horečkou, eozinofilií, kožními exantémy, často jsou prokazovány autoprotilátky v séru (např. halotan, chlorpromazin, ajmalin aj.).
Diagnostika polékových poškození je často velmi obtížná vzhledem k poměrně uniformní klinické i laboratorní symptomatologii jaterních a ledvinných chorob. K správné diagnóze se často dospěje per exclusionem, zásadní je ovšem na možnost polékové reakce myslet a včas přerušit podávání léčiv, které mohou být vyvolávajícím agens. V případě toxicity závislé na dávce někdy stačí snížit dávku. Opakované podání léčiv, po nichž se objevila reakce na dávce nezávislá, je nejen neetický, ale i non-lege artis postup [2].
Vzhledem k obvyklé polypragmazii spojené s větší pravděpodobností lékových interakcí je riziko polékového poškození jater a ledvin u pacientů po transplantaci výrazně zvýšené. Nejzávažnější problém představuje hepatotoxicita a nefrotoxicita imunosupresivních léků (azathioprin, cyklosporin A, tacrolimus), které musí být u transplantovaných pacientů podávány kontinuálně po dobu mnoha let a mohou vyvolat progresivní onemocnění jater končící vznikem cirhózy a jaterního selhání.
Toxické nefropatie a hepatopatie
Toxické nefropatie jsou charakterizovány jako funkční či morfologické změny v ledvinách způsobené podáváním léků, chemikálií či biologického materiálu. Mohou probíhat jako akutní intoxikace či chronické poškození. Z toho vyplývá odlišný přístup v léčebném algoritmu [3].
Patofyziologie
Ledviny mají mnoho unikátních fyziologických schopností, které je ovšem na druhé straně činí zranitelné k projevům toxicity. Poškození funkce přesto může být přesně a časně zjištěno, a to i při nevelkých poruchách. V ledvinách je největší průtok krve ze všech orgánů (s výjimkou plic). Koncentrace cirkulujících látek je mnohem vyšší (až 50×), než je tomu v jiných tkáních. Ledviny mají také největší endoteliální povrch na gram tkáně se dvěma kapilárními systémy. Glomerulární systém má nejvyšší hydrostatický tlak a nejvyšší filtrační frakci. Volné soluty zde cirkulaci opouštějí filtrací přesahující 1,5 ml/ s, mnohem intenzivněji než v ostatních orgánech. Nejčastější nefrotoxické a hepatotoxické látky jsou shrnuty v tab 1.
Tab. 1. Nejčastější nefrotoxické a hepatotoxické látky.
Tab. 1. The most common nephrotoxic and hepatotoxic substances.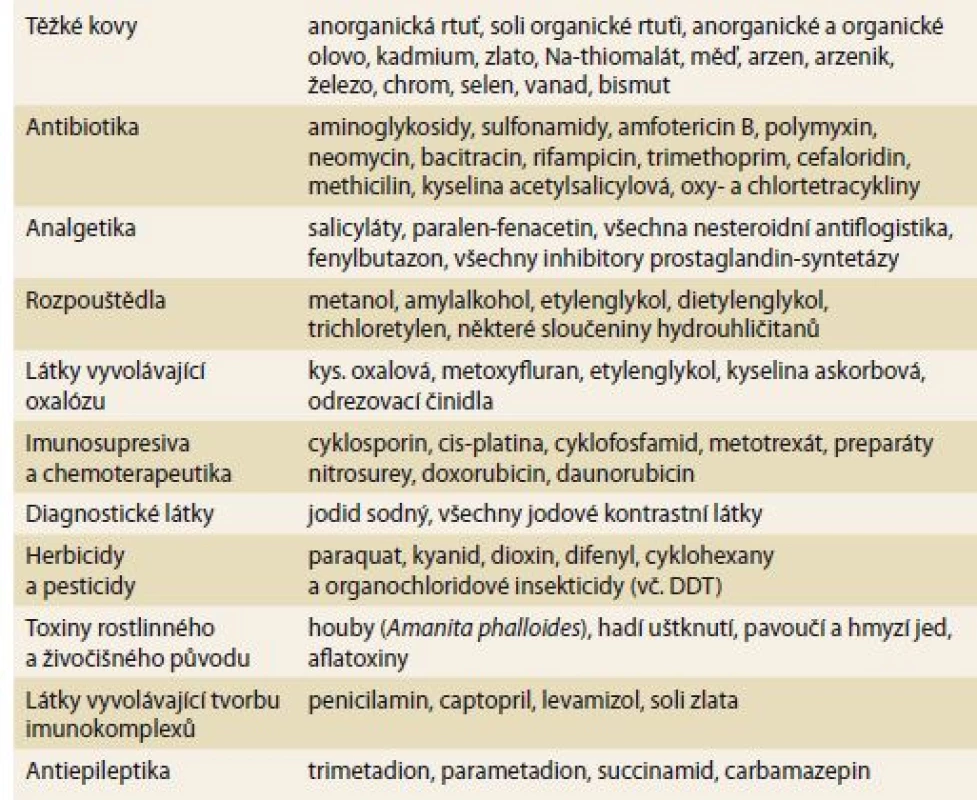
DDT – dichlordifenyltrichloretan V důsledku vysoké resorpce primárního glomerulárního filtrátu při tvorbě koncentrované moči je vystaven luminální povrch tubulárních buněk až 300× větší koncentraci, než je koncentrace sérová, pokud se jedná o látky vylučované glomerulární filtrací, a až 1 000× větší v případě sekrece látek. Tato plocha je enormně veliká, počítáme-li povrch kartáčového lemu proximálních tubulárních buněk. Protiproudový systém vede ke zvyšování koncentrace v dřeňovém intersticiu (a tím zvýšení koncentrace moči). V žádné jiné tkáni nedochází k tak intenzivní koncentraci, která přesahuje v průměru 4× hodnotu sérovou. Tubulární transport jednotlivých léků navázaných na proteinový nosič představuje ochranný systém pro ostatní buňky. Transcelulární transport vystavuje intracelulární prostor a buněčné organely možnému vlivu nově transportovaných chemikálií. Vazebná místa (např. sulfhydrylové skupiny) mohou usnadnit vstup, ale zpomalit výstup (např. těžké kovy). Ledviny mají největší spotřebu kyslíku a glukózy na gram tkáně, a jsou proto velmi citlivé na toxické poškození buněčného energetického systému.
Pokud zjistíme depozici imunokomplexů, je velmi pravděpodobné imunologické poškození. Lokálním působením antigenu dochází následně k aktivaci lymfocytů a celulární imunitní reakci. Mezangium představuje místo pro invazi monocytů, fagocytů a ostatních biologicky aktivních buněk migrujících sem z krve. Imunologická reakce v mezangiu může ovlivnit fyziologické reakce cév, např. stimulací angiotenzinových receptorů pravděpodobně zprostředkovaných lymfokiny. Podocyty (buňky epitelu kapilár) jsou místem lokalizace receptorů C3 složky komplementu.
Etiologie
Tabulka 1 shrnuje klinicky nejdůležitější léky a chemikálie, které způsobují závažnou nefrotoxicitu a často i hepatotoxicitu. Řada z nich je přímo cytotoxická buď známým, či dosud neznámým mechanizmem. Ostatní látky mohou poškozovat nepřímými mechanizmy, které často nejsou jasné ani z chemického složení dané látky.
U pacientů s přítomným renálním onemocněním je třeba dávat zvláštní pozor na léky, které jsou vylučovány především ledvinami, a jejich podávání je tudíž spojeno s nebezpečím nefrotoxicity.
V renální insuficienci se často snižuje vazebná schopnost transportních bílkovin. Transportní proteiny představují nejen hlavní determinantu ve farmakokinetice, ale současně tak i ovlivňují možnou toxicitu v jednotlivých orgánech. Renální selhání ovlivňuje metabolizaci léků – oxidaci a redukci, konjugaci (glukuronid, sulfát, glycin), acetylaci a hydrolýzu. Přehled takových interakcí je uveden v tab. 2.
Tab. 2. Některé klinicky významné léky, které se akumulují při snížené funkci ledvin.
Tab. 2. Some clinically significant drugs that accumulate with the reduced kidney function.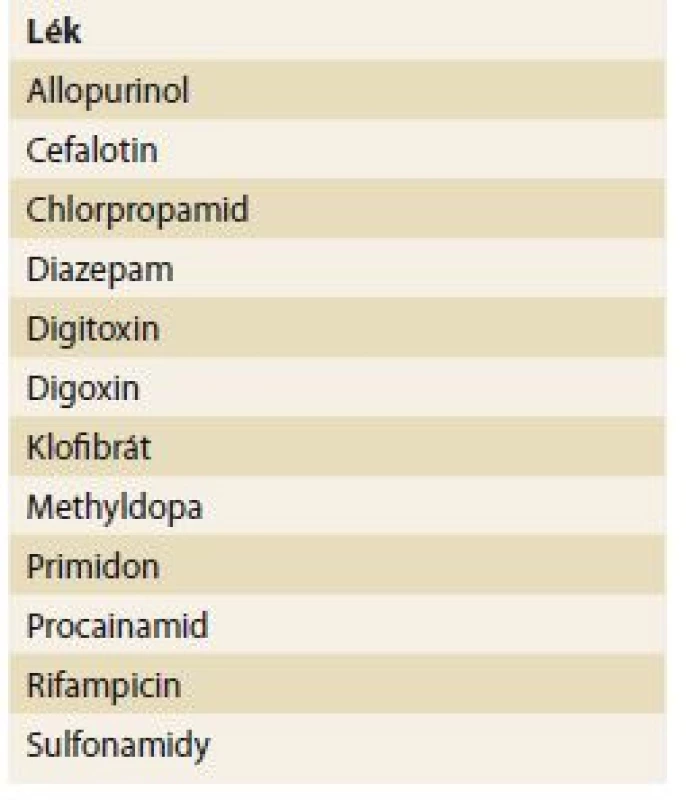
Diagnostika a základní léčebné postupy u akutních intoxikací
Rozhodující význam pro prognózu pacienta s akutní intoxikací má včasné stanovení diagnózy, které musí v přednemocniční fázi vycházet ze znalosti časných klinických příznaků jednotlivých intoxikací, v pozdější nemocniční fázi ze znalosti souborů klinických příznaků. Včasné stanovení diagnózy musí být následováno včasným zahájením odpovídající léčby [4].
Nejčastější klinické příznaky závažných akutních otrav
- útlum centrálního nerovového systému (CNS) s poruchou vědomí od otupělosti po hluboké kóma – barbituráty, benzodiazepiny, alkoholy a glykoly, opioidy, meprobamát, metachalon, guaifenesin, glutethimid, fenothiaziny, butyrofenony, tricyklická antidepresiva, antiepileptika, antihistaminika, antihypertenziva, antidysrytmika, oxid uhličitý, oxid uhelnatý;
- stimulace CNS (zahrnuje tachykardii, dysrytmii, hypertenzi, tachypnoi, agitovanost, neklid, třes, křeče, reaktivní mydriázu) – amfetaminy vč. extáze a pervitinu, kokain, námelové alkaloidy, LSD, meskalin, metylfenidát, lithium, sympatomimetika, anticholinergika, salicyláty, isoniazid, teofylin, kofein, strychnin;
- mióza – organofosfáty, opioidy (s výjimkou pethidinu), etanol, barbituráty, fenothiaziny, klonidin, fyzostigmin, neostigmin, karbamáty, pilokarpin;
- mydriáza – tricyklická antidepresiva, amfetaminy, kokain, anticholinergika, antihistaminika, katecholaminy, glutetimid, LSD;
- křeče kosterního svalstva – amfetaminy, kokain, teofylin, isoniazid, lithium, antidepresiva, karbamáty, organofosfáty, etylalkohol, salicyláty;
- cholinergní projevy (zvýšené slzení, slinění, bronchiální sekrece, průjmy, mióza) – organofosfáty, karbamáty, fyzostigmin, neostigmin;
- anticholinergní projevy – atropin, skopolamin, spasmolytika, fenothiaziny, tricyklická antidepresiva, antiparkinsonika, antihistaminika;
- hypoventilace – etylalkohol, barbituráty, benzodiazepiny, opioidy, tricyklická antidepresiva, strychnin;
- kardiogenní plicní otok – antidysrytmika, beta-blokátory, blokátory kalciového kanálu, tricyklická antidepresiva;
- nekardiogenní plicní otok – kokain, opioidy, salicyláty, paraquat, etylenglykol, fosgen;
- hypertermie – látky vyvolávající křeče kosterního svalstva a svalovou rigiditu;
- hypotermie – etylalkohol, neuroleptika, barbituráty, deriváty sulfonylmočoviny, opioidy, tricyklická antidepresiva, oxid uhelnatý;
- zvýšený osmolální gap (nárůst rozdílu mezi naměřenou a vypočtenou osmolalitou séra) – metylalkohol, etylalkohol, etylenglykol (u všech tří krátce po požití, s časovým odstupem zvýšené osmolální okno mizí na úkor rozvíjející se metabolické acidózy);
- metabolická acidóza – etylenglykol, metylalkohol, etylalkohol (u všech tří se acidóza rozvíjí až s časovým odstupem, po metabolické přeměně na příslušné kyseliny), salicyláty, kyanidy, oxid uhelnatý, etylalkohol, isoniazid;
- akutní poškození jater – paracetamol, etylalkohol, amatoxiny, tetrachlormetan, isoniazid;
- akutní poškození ledvin – etylenglykol, paraquat, tetrachlormetan, paracetamol, amatoxiny u nemocných s těžkou dehydratací [5].
Inaktivace otravné látky v krevním kompartmentu
Část toxické látky, která pronikla až do krevního kompartmentu, je možné inaktivovat podáním antidota. V tab. 3 jsou nejčastěji používaná antidota u akutních otrav [6].
Tab. 3. Nejčastěji používaná antidota v léčbě akutních otrav (dle Ševely) [4].
Tab. 3. The most commonly used antidote in the treatment of acute poisoning (according to Ševela) [4].![Nejčastěji používaná antidota v léčbě akutních otrav (dle Ševely) [4].<br>
Tab. 3. The most commonly used antidote in the treatment of acute poisoning (according to Ševela) [4].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/7f5c254cb39d46f2c3e6162b8b8c87ad.jpeg)
Ca – vápník, BAL – British anti-Lewisite, LMWH – low-molecular-weight heparin, inj. – injekce, tbl. – tablety, inf. – infuze Eliminace toxických látek
Gastrointestinální dekontaminace
Výplach žaludku
Výplach žaludku se doporučuje jako základní opatření u většiny perorálních otrav. Je vhodný u osob již přijatých do zdravotnických zařízení. Uplatní se zejména u perorálních otrav tekutinami a dobře rozpustnými, rozpuštěnými, emulgovanými, rozmělněnými či rozdrcenými pevnými látkami. U závažných otrav je výplach žaludku spojen s rizikem nebezpečných komplikací, především možností aspirace do plic, vyvolání křečí, dysrytmií, event. i perforací jícnu, žaludku nebo i dolních dýchacích cest. Výplach žaludku je indikován v situacích, kdy od požití nebezpečného množství jedu neuběhlo více než 6 hod, nejlépe však do 1 hod po požití. Výjimečně lze indikovat výplach i v delších intervalech (12 či dokonce 24 hod) tam, kde by byl předpoklad retence dané látky, např. velkého množství požitých tablet v žaludku. S výhodou lze zde využít gastrofibroskopie.
Výplach žaludku je kontraindikován po požití korozivních látek (kyseliny, zásady – riziko perforce), požití uhlovodíků, benzinu, petroleje a jejich derivátů, nekontrolovaných křečí, srdeční arytmie a poruch vědomí (nutná intubace). Výplach žaludku se technicky provádí pomocí žaludeční sondy v celkovém množství 5– 10 l a na závěr většinou doplníme podáním adsorpčního uhlí v dávce1 g/ kg tělesné hmotnosti ve 250ml roztoku. Mezi léky dobře adsorbovatelné patří paracetamol, salicyláty, benzodiazepiny, barbituráty, meprobamát, antidepresiva, antikolvulziva, teofylin a digoxin. Naopak mezi látky špatně adsorbovatelné patří kovy, alkoholy a glykoly (etanol, metanol, etylenglykol), silné kyseliny a zásady, benzin, nafta, petrolej, kyanidy, strychnin, projímadla obsahující sodík, hořčík draslík.
Gastrointestinální dialýza
Gastrointestinální dialýza pomocí opakovaného podávání adsorpčního uhlí se může uplatnit u látek, které mají enterohepatální cirkulaci, popř. s žaludeční sekrecí. Současně se při ní uplatňuje negativní difuzní gradient mezi střevním obsahem a krví. Je vhodný u otrav paracetamolem, salicyláty, nesteroidními antiflogistiky, digitalisem, teofylinem, některými antidepresivy i cyklosporinem.
Navození průjmu
Zrychlení pasáže za použití kombinace adsorpčního uhlí s projímadlem je nejisté. Nejvhodnější je podání 40% sorbitolu (3– 4 ml/ kg) či 10% roztoku MgSO4 (2– 3 ml/ kg). Kontraindikací je porucha střevní pasáže, obstrukce, krvácení, perforace, již přítomné průjmy a vodní a minerálová dysbalance.
Eliminace látek z krevního kompartmentu
Forsírovaná diuréza
Touto léčebnou metodou potencujeme vylučování toxické látky ledvinami (za podmínky, že nejsou závažně poškozeny). Nezbytnou podmínkou je přiměřená substituce vody a elektrolytů, která odstraní případný deficit a pak vede ke zvýšení perfuzního tlaku v ledvinách. Teprve po splnění tohoto cíle podáváme diuretika. Jejich podání však není nezbytné, pokud je přítomna dostatečná diuretická odpověď na podané infuze. Velikost diurézy za časovou jednotku je jediným kritériem správně prováděného výkonu (400– 500 ml/ hod). Hodnoty centrálního žilního tlaku udržujeme mezi +8 a +12 cm H2O vyváženým podáním infuzí nebo infuzí v kombinaci s diuretiky. Při případném převodnění a nedostatečné odezvě na podaná diuretika zvažujeme provedení hemodialýzy.
K forsírované diuréze jsou indikovány otravy látkami, které nejsou převážně vázány na krevní bílkoviny a které jsou i mimo zákrok vylučovány převážně ledvinami – etylenglykol, metylalkohol, lithium.
Mezi komplikace forsírované diurézy patří pokles krevního tlaku při nedostatečné náhradě infuzemi a minerálová dysbalance při nedostatečné substituci.
Mezi kontraindikace výkonu patří hypokalemie před substitucí, renální insuficience a akutní závažné poškození ledvin (oligurie), srdeční selhání, hypotenze nereagující na podání infuzí, šokový stav a maligní hypertenze bez odpovědi na podaná antihypertonika.
Hemoperfuze
Hemoperfuze využívá k odstranění otravných látek adsorpci při průtoku krve (150– 250 ml/ min.) hemoperfuzní kolonu vyplněnou adsorpčním materiálem (adsorpční uhlí, syntetické pryskyřice). Afinita otravné látky k adsorbentu musí být vyšší než její afinita k albuminu, na který jsou otravné látky nejčastěji navázány. K zajištění dostatečného krevního průtoku je nezbytné kanylovat centrální žilní systém, měřit krevní tlak v mimotělním oběhu před krevní pumpou, ale také za krevní pumpou před hemoperfuzní kolonou a v návratovém setu za hemoperfuzní kolonou.
Ze dvou nejčastěji používaných adsorbentů je adsorpční uhlí (nejčastěji připraveno pomalou karbonizací kokosových skořápek) indikováno zejména u akutních otrav – barbituráty, karbamazepinem, toxiny muchomůrky zelené, salicyláty, teofylinem.
Syntetická pryskyřice, nejčastěji styrendivinylbenzen (Amberlite), má užší spektrum účinnosti, k některým látkám však vykazuje vyšší afinitu (např. k teofylinu).
Vedle xenobiotik jsou v hemoperfuzní koloně vychytávány i běžné součásti séra – kreatinin, glukóza, mastné kyseliny, fosfolipidy, kyselina močová, kalcium, acetylcholin, adrenalin, aldosteron, kortizol, noradrenalin, serotonin, testosteron, tyreoidální hormony.
Vedle komplikací spojených se zajištěním krevního přístupu (kanylace velkých cév) s prováděnou hemoperfuzí souvisí mimo jiné i změny aktivity krevního koagulačního systému. Tyto změny mohou být vyvolány přímým působením toxické látky na krevní koagulační systém; působením toxické látky na cílový orgán s následným uvolněním tkáňových působků, které ovlivňují krevní koagulační systém; poruchou perfuze tkání, která je příčinou uvolnění tkáňových působků; kontaktem s cizorodými povrchy v mimotělním oběhu; kontaktem se vzduchem (v expanzních průtokových baňkách); poškozením erytrocytů v oblasti krevní pumpy (podtlakem v hadici před krevní pumpou, mechanicky pod přítlačnými válci rotoru, vysokými smykovými rychlostmi, které závisí na schopnosti hadice vložené do statoru držet svůj původní tvar, i na rozdílu tlaků za a před přítlačným válcem rotoru v okamžiku, kdy tento válec opouští okluzní dráhu statoru), které vede k uvolnění adenozindifosfátu, významného aktivátoru vnitřního koagulačního systému.
V průběhu hemoperfuze může docházet k poklesu tělesné teploty (ochlazení krve v hemoperfuzní koloně) nebo ke zvýšení tělesné teploty (uvolnění pyrogenů při kontaktu leukocytů s cizorodým povrchem v mimotělním oběhu).
V průběhu hemoperfuze může být ovlivněn krevní tlak, což může souviset s toxickou látkou (závisí na druhu toxické látky a velikosti dávky) nebo s částečnou adsorpcí katecholaminů v hemoperfuzní koloně.
Mezi kontraindikace patří stavy, kdy je hemoperfuze technicky neproveditelná, jako je těžká hypovolemie, generalizovaný krvácivý stav či trombocytopenie pod 50 000 mm3.
Hemodialýza
Hemodialýza využívá k odstranění toxických látek z krve jejich přestup polopropustnou membránou do dialyzačního roztoku difuzí (podle koncentračního gradientu) či filtrací (podle tlakového gradientu). K zajištění dostatečného krevního průtoku je nezbytné kanylovat centrální žílu a zajistit stejné podmínky jako u hemoperfuze. Hemodialýzou jsou dobře odstranitelné látky s malou molekulou a látky dobře rozpustné ve vodě. Vazba na krevní bílkoviny nemusí být rozhodující, záleží spíše na rychlosti obnovy stálého poměru mezi frakcí vázanou a nevázanou.
Hemodialýza je účinná u otrav těmito látkami: metylalkohol, etylenglykol, etylalkohol, lithium, kyselina acetylsalicylová.
Syntetické membrány s většími póry jsou u akutních otrav obecně účinnější ve srovnání s membránami vyrobenými z derivátů celulózy.
Mezi závažné komplikace u pacientů s akutními otravami patří hypotenze, dysekvilibrace, svalové křeče a iontové poruchy, změny aktivity koagulačního systému. Kontraindikace hemodialýzy jsou shodné s kontraindikacemi hemoperfuze u akutních otrav.
Hemofiltrace
Hemofiltrace využívá k odstranění otravných látek z krve přestup polopropustnou membránou. Na rozdíl od hemodialýzy zde na druhou stranu membrány není přiváděn dialyzační roztok, proto je přechod látek přes membránu ovlivňován filtrací, to znamená tlakovým gradientem a velikostí pórů v membráně. Nejčastěji jsou používány syntetické membrány s velikostí pórů, které umožňují přestup látek do 30 000 daltonů. Technické zabezpečení je podobné jako u hemodialýzy, jen místo dialyzačního roztoku je kontinuálně připravován substituční roztok.
K provedení hemofiltrace jsou jako u hemodialýzy indikovány otravy ve vodě rozpustnými látkami. Hemofiltrace má proti hemodialýze přednost u pacientů s hypotenzí, která přetrvává i po úpravě intravazálního objemu substitucí.
Z komplikací jsou při hemofiltraci méně časté hypotenze s nutností doplnění substitučního roztoku. Kontraindikace jsou shodné s kontraindikacemi u hemodialýzy.
Plazmaferéza
Plazmaferéza je standardní metodou při léčbě intoxikace Amanitou Phaloides do 3 dnů po požití jedovatých hub (doporučený postup vydaný Českou hepatologickou společností) s užitím speciálního plazmafiltru a nezbytnou substitucí náhradního roztoku.
Kontinuální eliminační metody
Kontinuální eliminační metody (veno-venózní hemofiltrace i veno-venózní hemodiafiltrace) mají uplatnění v léčbě pacientů s akutními otravami při stabilizaci základních životních funkcí a nutnosti dlouhodobé eliminace dané látky s podáním substitučního roztoku [6– 8].
Otrava metylalkoholem
Metanol je široce používaným průmyslovým rozpouštědlem. Ve vysokých koncentracích může být používán jako nemrznoucí kapalina (95 %), jako palivo do modifikovaných motorů a pohon pro modelové motory. Ve srovnání s etanolem vyvolává méně „stav opilosti“, ale je chuťově nerozeznatelný, a proto byl také kriminálně přidáván do levného alkoholu. Metanol je především absorbován GIT (vrcholové hodnoty v plazmě za 30– 60 min). Distribuční objem metanolu odpovídá celkové tělesné vodě (0,6– 0,7 l/ kg). Metanol je netoxický. Alkoholdehydrogenázou v játrech a ledvinách je však metabolizován na formaldehyd, následuje rychlá oxidace na kyselinu mravenčí a pomalé štěpení (kumulace kyseliny mravenčí = metabolická acidóza) na oxid uhličitý a vodu. Oxidace metanolu probíhá ve srovnání s oxidací etanolu pouze 15% rychlostí [9].
Klinický obraz
Bez anamnestických údajů o požití metanolu je obtížné stanovit diagnózu. Pacient je zmatený, ale nikoli opilý. Teprve později s kumulací kyseliny mravenčí nastupuje aniontový gap (metabolická acidóza) a zvýšená sérová osmolalita (osmolální gap) společně s klinickými symptomy – zvracením, bolestí v horní části břicha, průjmem, bolestí zad, závratí, bolestí hlavy, hyperpnoí a poruchami vidění (gangliové buňky retiny jsou postiženy destruktivním zánětem s následnou atrofií a přechodnou nebo trvalou slepotou). Smrt nastává náhle nebo po několika hodinách kómatu v důsledku selhání respirační činnosti po tonickém spasmu kosterního svalstva.
Léčebná opatření
Výplach žaludku je vhodný až do 8 hod po požití. Adsorpční uhlí není indikováno. Adekvátní ventilace je nezbytná, protože metanol se odstraňuje ve vydechovaném vzduchu. Antidotem je kontinuálně podávaný etanol (cílem je udržovat koncentraci etanolu v krvi kolem 1 ‰). Počáteční korekce acidózy s aniontovým gapem podáním bikarbonátu je nezbytná. Hemodialýza je účinná, má být zahájena co nejdříve. Forsírovaná diuréza je málo účinná, hemoperfuze je neúčinná. Antidotum 4-metyl-pyrazol je účinný a slibný inhibitor alkoholové dehydrogenázy (dostupný z dovozu).
Otrava etylalkoholem
Akutní otrava etylalkoholem je častá. Etylalkohol se rychle a úplně absorbuje již v horních úsecích zažívacího traktu (dutina ústní, žaludek, duodenum). V lidském organismu je 90– 98 % oxidováno (zpravidla podle kinetiky nultého řádu), zbytek je eliminován v nezměněné formě ledvinami a plícemi. Degradace alkoholu na acetaldehyd probíhá působením alkoholové dehydrogenázy, acetaldehyd je konvertován na acetyl koenzym A, který buď vstupuje do Krebsova cyklu, nebo konvertuje na mastné kyseliny. Na odbourávání etylalkoholu se účastní také jaterní kataláza a mikrozomální etylalkohol oxidující systém. Jednotlivé druhy alkoholických nápojů obsahují: pivo nejčastěji 5 vol. % alkoholu = 40 g/ l, víno 12,5 vol. % = 99 g/ l, whisky 43 vol. % = 340 g/ l.
Klinický obraz
Klinické příznaky akutní intoxikace etylalkoholem lze rozdělit do 4 stadií:
- exitativní (euforické),
- hypnotické,
- narkotické,
- asfyxie.
Při hodnotách nad 4,0 g/ l (4 ‰) dochází ke kómatu a smrti (útlumem dýchání, zástavou oběhu v důsledku medulární paralýzy, ale také extrémní hypotermií). Přítomna bývá metabolická acidóza (laktátová i ketoacidóza), hyperkalemie, zvýšení sérové osmolality. Alkohol (i jeho metabolit acetát) působí vazodilataci, která přispívá k hypotermii a hypotenzi. Hypoglykemie bývá u dětí a špatně živených chronických alkoholiků [10].
Léčebná opatření
Navodit zvracení a provést výplach žaludku je vhodné pouze do 90 min po požití. Umělá plicní ventilace překlene periodu útlumu dýchání. Glukóza (až 2 g/ kg hmotnosti/ 24 hod) je nezbytná. Teplotu těla udržujeme v rozmezí normálních hodnot. Neklid je obtížně zvládnutelný, se sedativy čekáme co možná nejdéle. Podávání kofeinu je sporné. Hemodialýza (nebo peritoneální dialýza u dětí) je účinná, ale nezbytná jen při jinak nezvladatelné hyperosmolalitě. Forsírovaná diuréza je neúčinná. Intravenózní podání bikarbonátu a elektrolytů je nezbytné u metabolické acidózy.
Otrava etylenglykolem
Etylenglykol se užívá při výrobě celulózy, plastických hmot, barev a nemrznoucích směsí do chladičů motorových vozidel. Letální dávka je 100– 150 ml 50% roztoku. Při perorálním požití dochází k rychlému vstřebávání. Odbourávání probíhá převážně v játrech alkoholdehydrogenázou na glykolaldehyd a dále na kyselinu glykolovou a šťavelovou, které jsou odpovědné za toxicitu [11].
Klinický obraz
Klinické příznaky intoxikace nauzea, vomitus a obluzení korespondují s nejvyšší koncentrací aldehydu v krvi, 12– 24 hod po požití se objevuje tachypnoe, tachykardie, hypertenze, plicní edém a městnavá srdeční slabost, metabolická acidóza s pH < 7. Za 24– 72 hod po intoxikaci se projevuje bolest v bederní krajině a akutní ledvinové selhání (nekróza tubulárních epitelií a obturace lumen tubulů krystaly šťavelanu vápenatého). Diagnózu akutní otravy podporují vyšší osmolalita v krvi, metabolická acidóza, krystaly šťavelanu vápenatého v moči, později elevace močoviny a kreatininu.
Léčebná opatření
Výplach žaludku – jen při požití velkého množství etylenglykolu do 1 hod po požití. Etylalkohol (vyšší afinita k alkoholdehydrogenáze) podáváme a udržujeme nad 1 ‰ koncentrace v krvi. Hemodialýza je jednoznačně indikována i při dosud intaktních renálních funkcích (etylenglykol i kyselina šťavelová jsou dobře dialyzovatelné, hemodialýza navíc koriguje metabolickou acidózu). Specifický antagonista alkoholdehydrogenázy je 4-methylprazol (fomepizol).
Otrava organickými rozpouštědly
Nejzávažnější otravy z této skupiny vyvolává tetrachlormetan CCl4, který byl používán jako výborné rozpouštědlo tuků, vosků, pryskyřic a kaučuku, součást odmašťovadel, náplň hasicích přístrojů a veterinární antiparazitikum. Dnes je používán málo pro svou vysokou toxicitu. Rychle se vstřebává GIT, kůží, nejrychleji však plícemi při inhalační otravě. Pro svou vysokou liposolubilitu se distribuuje do tkání obsahujících tuk. V játrech je metabolizován na trichlormetylové radikály, které způsobí peroxidaci lipidů a mají toxický vliv na cytochrom P-450. Převážná část absorbované dávky je vyloučena v nezměněné formě plícemi (60– 90 %), zbytek je metabolizován [12].
Klinický obraz
Akutní otrava začíná bolestmi hlavy, nevolností, zvracením a průjmy, následuje lehké obluzení až narkóza, s odstupem několika dní dochází k rozvoji jaterního a ledvinového selhání. Otravu prohlubuje současné požití etanolu nebo fenobarbitalu.
Léčebná opatření
Postiženého je třeba co nejrychleji odstranit z prostředí, kde došlo k inhalační otravě, potřísněné sliznice a kůži omýt proudem vody. Už za převozu do nemocnice podáváme zvlhčený 100% kyslík (supresivní vliv na peroxidaci lipidů a tvorbu trichlormetanu CC13). Podáván je cholestyramin, N-acetylcystein a vitamin E. Při perorálním požití se doporučuje výplach žaludku, pokud je možné ho provést do 1 hod po požití. Následně aplikujeme adsorpční uhlí v dávce 50– 100 g. Z eliminačních metod se doporučuje hemodialýza a hemoperfuze přes aktivní uhlí.
Toxicita po otravě houbami, hadím a hmyzím jedem
Otrava houbami patří mezi nejnebezpečnější otravy jednak pro těžko kontrolovatelný sběr a požívání houbových jídel, jednak pro dlouhou latenci prvních příznaků a nezřídka i dnes letální komplikace.
Otravy houbami dělíme dle predilekčního orgánového postižení na typ hepatonefrotoxický (muchomůrka zelená), dále typy neurotoxický (muchomůrka červená, tygrovaná, vláknice, strmělky), čistý gastroenteritický (hřib satan, ryzec kravský apod.) a vazotoxický (hnojník – příznaky jako po požití alkoholu).
Nejtěžší otravy způsobuje požití muchomůrky zelené (Amanita phalloides) a jí příbuzných druhů. Nefrotoxiny obsahuje i ucháč obecný (Gyromitra esculenta) a některé druhy pavučinců (Cortinarius orellanus). Muchomůrka zelená obsahuje dvě skupiny toxických látek – falotoxiny a amatoxiny. Při otravě amatoxiny, které mají enterohepatální oběh, jsou cílovými orgány poškození především játra (akutní nekróza jater) a ledviny (akutní tubulární nekróza proximálního a distálního tubulu). Toxický efekt se uplatňuje enzymovou inhibicí proteosyntézy a následnou buněčnou cytolýzou. Na rozvoji akutního poškození ledvin se podílí i prerenální složka těžkou dehydratací při profuzním zvracení a průjmech. Otrava tohoto typu probíhá v několika stadiích. Po bezpříznakovém údobí (12– 24 hod) převládá v klinickém obraze gastrointestinální symptomatologie (zvracení, průjmy, dehydratace, metabolický a minerálový rozvrat). Tento stav trvá 2– 3 dny a může se již objevit oligoanurie, 3.– 4. den nastává přechodné zlepšení následované v dalších dnech projevy orgánového selhání jater a ledvin. V těžkých případech dojde 7.– 12. den k úmrtí nejčastěji za příznaků fulminantního selhání jater [13].
Hadí uštknutí může způsobit akutní selhání ledvin především hemolyticko-toxickými účinky jedu. Projevuje se hemoglobinurií, myoglobinurií a syndromem podobným diseminované intravaskulární koagulopatii.
Podobným mechanizmem může při větší dávce působit i jed včel, vos a sršňů.
Hepatotoxicita a nefrotoxicita při otravě analgetiky a antiflogistiky
Nejvýznamnější z této skupiny je poškození jater při často užívaném paracetamolu.
Toxická je dávka 150 mg/ kg tělesné hmotnosti u dětí, u dospělých 7,5 g a více. Intoxikace paracetamolem vede k jaterní nekróze. Paracetamol je metabolitem dříve užívaného analgetika fenacetinu. Snižuje syntézu prostaglandinů v CNS, inhibuje cyklooxygenázu v hypotalamu (antipyretický účinek) a nepřímo působí na serotoninové receptory v míše (analgetický účinek). Po užití se rychle vstřebává v žaludku a tenkém střevě, vrchol plazmatické hladiny je za 1– 2 hod. Metabolizován je v játrech konjugací na glukoronid nebo sulfát, 4– 15 % se metabolizuje cytochromem P450 na reaktivní metabolit N-acetyl-p-benzochinonimin (NAPQI), který se konjuguje v játrech s glutathionem na metabolity vylučované močí.
Při předávkování se metabolizace léku konjugací saturuje a zvyšuje se produkce reaktivního metabolitu NAPQI. Při nadměrné tvorbě NAPQI se tento metabolit váže na SH-částice buněčných bílkovin, kde působí toxicky, vyvolává kaskádu oxidativních poškození, mitochondriálních dysfunkcí a celkové poškození jaterních buněk ústící do rozvoje centrilobulární jaterní nekrózy. Léčebně lze zasáhnout podáním N-acetylcysteinu, jehož molekula obsahuje SH-skupiny a nahrazuje spotřebovaný glutathion.
Klinický obraz otravy má 4 fáze:
- fáze (0– 24 hod po požití): postupně nechutenství, nauzea, zvracení, malátnost, mírný nárůst transamináz v séru od 12. hod po požití;
- fáze (24– 72 hod po požití): bolest v pravém horním břišním kvadrantu, progredující nechutenství, nauzea, zvracení, další nárůst transamináz;
- fáze (72– 96 hod po požití): nekróza jater, ikterus, koagulopatie, jaterní encefalopatie, selhání ledvin;
- fáze (4 dny až 3 týdny po požití): pokud pacient přežije, dochází k ústupu příznaků a orgánovému zotavení vč. regenerace jater.
Nesteroidní antiflogistika
Na trhu je více než 100 druhů různých nesteroidních protizánětlivých léků (NSA – nesteroidní antirevmatika). Většina z nich má podobnou farmakokinetiku. Největší terapeutický, ale i toxický efekt NSA je dán inhibicí syntézy prostaglandinů. NSA mají vysokou vazbu na bílkoviny (90– 99 %) a malý distribuční objem. Některé podléhají enterohepatální recirkulaci a jsou částečně eliminovány biliární cestou. Dominantní je však většinou renální exkrece. Akutní otrava NSA nemá typické ani specifické příznaky – dominují gastrointestinální a neurologické obtíže, v těžkých případech může dojít až k multiorgánovému selhání.
Salicyláty
Léky jsou často ordinované pro analgetický, antipyretický, protizánětlivý a antiagregační efekt. Denní dávka nad 150 mg/ kg tělesné hmotnosti již může být toxická. V buňkách zasahují salicyláty do mitochondriální oxidativní fosforylace, inhibují dehydrogenázu Krebsova cyklu, dále snižují metabolismus glukózy v periferních tkáních a koncentraci glukózy v mozku, stimulují metabolismus lipidů a inhibují metabolismus aminokyselin. Dále inhibují ATP-dependentní reakce, zvyšují konsumpci O2 a tvorbu CO2; v ledvinách se zvyšuje vylučování hydrogenkarbonátu sodného. Často po požití bývá nauzea, zvracení, dehydratace, tachypnoe, někdy tinitus i letargie. Pro těžkou intoxikaci je typická metabolická acidóza, encefalopatie, kóma, křeče, hypoglykemie, hypertermie, otok plic a mozku. Eliminaci salicylátů zvýšíme alkalizací moči, účinná je hemodialýza a hemoperfuze.
Všechna periferně účinkující protizánětlivě působící analgetika jsou i potenciálně nefrotoxická, což většinou neplatí pro centrálně působící analgetika. Salicyláty mají přímý nefrotoxický a potencující účinek u smíšené analgetické nefropatie. Vzhledem k velice častému zastoupení salicylátů v nejrůznějších léčebných směsích je obtížně odhadnout, jaký je skutečný podíl salicylátu při rozvoji toxického orgánového poškození. Ve skutečnosti všechna nesteroidní analgetika (která jsou s různou intenzitou inhibitory prostaglandin-syntetázy) mohou vést k poškození renálního tubulárního epitelu, hypoperfuzi, papilární nekróze a chronické tubulointersticiální nefritidě.
Problematika je v dnešní době v popředí zájmu vzhledem k velkému rozšíření těchto léků v současné preskripci [14].
Diagnóza
Diagnóza vyžaduje podrobnou anamnézu a někdy i detektivní talent. K rozsáhlým znalostem léků a projevů jejich toxicity musí klinik přidat i pečlivé zhodnocení psychického profilu pacienta s aspektem možného suicidia či sebepoškození.
Samozřejmě je třeba věnovat velkou pozornost možné expozici toxické látce při zaměstnání, rekreaci, zábavě a koníčcích a v neposlední řadě stravě vč. nápojů.
Léčba
Obecné postupy zahrnují především odstranění vyvolávající toxické látky – vyvolání zvracení, potenciace vylučování (např. cheláty či diuretiky), a to v případech, kdy je zachována renální funkce. Při všech závažnějších otravách je pak namístě užít účinných metodik k přímému odstranění toxické látky z oběhu (obvykle hemodialýzy s užitím dialyzátoru o velkém povrchu, hemoperfuze přes aktivní uhlí či pryskyřice, plazmaferézy, eventuálně s další sorpční metodou).
Kombinovaná léčba znamená užití více metodik současně (otrava analgetiky spolu s alkoholem apod.).
Otravy návykovými látkami
Patří sem opioidy (přírodní morfin a kodein, semisyntetické heroin, hydromorfon, oxymorfon, oxykodon a syntetické petidin, metadon, fentanyl, propoxyfen), kokain, amfetaminy (metamfetamin = pervitin a 3,4-metylendioxymetamfetamin – extáze) [15].
Klinický obraz – opioidy
Otravy opioidy vykazují triádu: kóma, útlum dýchání (bradypnoe s hlubokými dechy) a špendlíkové symetrické zornice reagující na osvit. Riziko aspirační bronchopneumonie je vysoké, bývá pokles krevního tlaku, bradykardie, svalová ochablost, hyporeflexie, obleněná peristaltika, hypotermie, případně křeče. Při diagnostice pomůže rychlá odpověď na intravenózní podání naloxonu.
Léčebná opatření
Základem je podpora základních životních funkcí vč. umělé plicní ventilace. Kontinuálně intravenózně podáváme naloxon, vhodné je intravenózní podání glukózy a tiaminu.
Klinický obraz – amfetaminy
Amfetaminy jsou nepřímo sympatomimeticky působící látky. Potlačují únavu, vyvolávají euforii, pocit zvýšené výkonnosti a zrychlené psychiky. Závažné otravy jsou provázeny hyperpyrexií, křečemi, arytmiemi, bezvědomím, rabdomyolýzou a renálním selháním.
Léčebná opatření
Zajistíme vitální funkce. Při neklidu, křečích a hypertenzi podáme benzodiazepiny, při hypotenzi krystaloidy v infuzi, podle potřeby i vazopresory, při supraventrikulární tachykardii antiarytmika. Podáváme diuretika, podle potřeby léčíme hemodialýzou.
Klinický obraz – kokain
Kokain má sympatomimetické vlastnosti a je silné stimulans CNS, kromě toho patří mezi lokální anestetika. Účinky kokainu jsou bifazické. Po počáteční stimulaci následuje deprese (kóma, dechový útlum, hypotenze, kardiální selhání). Vyskytuje se mydriáza zornic a riziko náhlé srdeční zástavy.
Léčebná opatření
Jsou převážně shodná s léčením otrav amfetaminy. Při komorových arytmiích podáváme natrium hydrogenkarbonát intravenózně (koriguje pH a zvyšuje vazbu pH na bílkoviny).
Závěr
Toxických poškození parenchymových orgánů v posledních desetiletích významně přibývá. Zdaleka nejčastější je poškození polékové, k častým intoxikacím patří otravy metylalkoholem, etylalkoholem, etylenglykolem, organickými rozpouštědly, houbami, hadím a hmyzím jedem a analgetiky. Většina těchto látek je přijímaná per os. Proto léčebné postupy zahrnují nejprve jednoduché eliminace formou odstranění z GIT (zvracení, průjem, výplach žaludku, carbo medicinalis) či ledvinami (forsírovaná diuréza). Řada látek má i specifická antidota. Nejúčinnější je odstranění eliminačními metodami formou hemoperfuze, hemofiltrace, hemodialýzy či plazmaferézy.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 31. 10. 2018
Přijato: 3. 2. 2019
prof. MU Dr. Vladimír Teplan, DrSc.
Klinické a výzkumné centrum pro střevní záněty ISCARE I. V. F. a. s.
Jankovcova 1569/ 2c, 170 00 Praha 7
Zdroje
1. Ševela K. Akutní intoxikace a nefrotoxické poškození ledvin. In: Teplan V (ed). Praktická nefrologie. 2. zcela přepracované a doplněné vydání. Praha: Grada Publishing 2006 : 459– 479.
2. Aggarwal P, Handa R, Wali JP. Acute poisoning – management guidelines. J Indian Academy Clin Med 2017; 5(2): 142– 147.
3. Teplan V. Nefrologické minimum pro klinickou praxi. 2. přepracované a doplněné vydání. Praha: Mladá fronta 2017 : 231– 257.
4. Ševela K, Ševčík P et al. Akutní intoxikace a léková poškození v intenzivní medicině. 2. doplněné a aktualizované vydání. Praha: Grada Publishing 2011.
5. Seyffart G. Poison index: The treatment of acute intoxication. Lengerich: Pabst Science Publishers 1997.
6. Petejová N, Martinek A. Acute intoxication in the intensive care unit. In: Petejová N, Marti-nek A (eds). The basic principles of critical care nephrology. New York: Nova Science Publishers, Inc. 2018 : 125– 151.
7. Rademacher S, Oppert M, Jörres A. Artificial extracorporeal liver support therapy in patients with severe liver failure. Expert Rev Gastroenterol Hepatol 2011; 5(5): 591– 599. doi: 10.1586/ egh.11.59.
8. Mydlík M, Derziová K. Liver and kidney in acute poisoning. Bantao J 2006; 4(1): 30– 33.
9. Bursová M, Hložek T, Čabala R. Simultaneous determination of methanol, ethanol and formic acid in serum and urine by Headspace GC-FID. J Anal Toxicol 2015; 39(9): 741– 745. doi: 10.1093/ jat/ bkv075.
10. Kaplan MS, McFarland BH, Huguet N et al. Acute alcohol intoxication and suicide: a gender-stratified analysis of National Violent Death Reporting System. Inj Prev 2013; 19(1): 38– 43. doi: 10.1136/ injuryprev-2012-040317.
11. Henderson WR, Brubacher J. Methanol and ethylene glycol poisoning: a case study and review of current literature. CJEM 2002; 4(1): 34– 40.
12. Mydlík M, Derziová K. Náhle zlýhanie obliček po akútných otravách. In: Teplan V (ed). Akutní poškození a selhání ledvin v klinické medicíně. Praha: Grada Publishing 2010 : 291– 301.
13. Garcia J, Costa VM, Carvalho A et al. Amanita phalloides poisoning: Mechanisms of toxicity and treatment. Food Chem Toxicol 2015; 86 : 41– 55. doi: 10.1016/ j.fct.2015.09.008.
14. Sorge M, Weidhase L, Bernhard M et al. Self-poisoning in acute care medicine 2005– 2012. Anaesthesist 2015; 64(6): 456– 462. doi: 10.1007/ s00101-015-0030-x.
15. Ševela K. Akutní intoxikace se selháním ledvin. In: Teplan V (ed). Akutní poškození a selhání ledvin v klinické medicíně. Praha: Grada Publishing 2010 : 271– 289.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2019 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Doporučení pro podávání biologické léčby pacientům s idiopatickými střevními záněty: čtvrté, aktualizované vydán
- Vedolizumab vs. ustekinumab u Crohnovy choroby jako léčivo druhé linie v klinické praxi
- Hladiny vedolizumabu měřené v časné fázi léčby nemají vztah ke krátkodobé odpovědi na terapii u pacientů s idiopatickými střevními záněty
- Idiopatické střevní záněty v posudkovém lékařství
- Léčba Crohnovy choroby ustekinumabem v těhotenství – kazuistika
- Crohnova nemoc ileocekální oblasti a familiární adenomatózní polypóza u jednoho pacienta – kazuistika
- Novinky pro rok 2019
- Překvapivá etiologie stenózy terminálního choledochu
- Terapeutický test s inhibítory protónovej pumpy v manažmente pacientov s laryngofaryngálnym refluxom
- Biologika v léčbě idiopatických střevních zánětů – počtvrté
- Zlepší komprese břicha pásem úspěšnost a toleranci koloskopie?
- Toxické a lékové poškození jater a ledvin
- Díl I. Editorial – zpravodajství Národního zdravotnického informačního systému
- Výběr z mezinárodních časopisů
- First European Conference of Young Gastroenterologists – ECYG
- Kreditovaný autodidaktický test
- Správná odpověď na kvíz
- Clensia® – první kombinovaný očistný prostředek se simetikonem
- Kvíz z klinické praxe
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Clensia® – první kombinovaný očistný prostředek se simetikonem
- Toxické a lékové poškození jater a ledvin
- Překvapivá etiologie stenózy terminálního choledochu
- Terapeutický test s inhibítory protónovej pumpy v manažmente pacientov s laryngofaryngálnym refluxom
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



