Neobvyklá manifestace tuberkulózy u pacienta s ulcerózní kolitidou léčeného infliximabem
Unusual manifestation of tuberculosis in an ulcerative colitis patient treated with infliximab
Tumor necrosis factor alpha (TNF-α) inhibitors are very potent treatments for ulcerative colitis (UC). However, infectious complications, including tuberculosis (TB), are a major risk with these medications. This study aimed to present a case report of a TB patient treated with infliximab (IFX) and to summarize recent information about TB in the Czech Republic. A refractory UC patient treated with IFX was repeatedly hospitalized due to infectious complications. Following extensive differential diagnosis, TB infection with predominant brain involvement was diagnosed. The major cause of TB infection during anti-TNF (a-TNF) therapy is probably reactivation of the latent form. TNF plays an essential role in the pathogenesis of TB infection, and the host immune system fails when TNF is blocked. Therefore, TB usually develops soon after initiation of a-TNF therapy, and prophylactic antituberculotic treatment is often ineffective. The extrapulmonary form is more common than the pulmonary form. TB is an important complication of a-TNF treatment. Preventive examinations prior to initiation of a-TNF therapy only reduce the disease incidence. One possible solution is consistent implementation or further tightening of professional guidelines.
Doručeno/Submitted: 24. 3. 2019
Přijato/Accepted: 18. 6. 2019
MUDr. Martina Škrobánková
Interní klinika LF OU a FN Ostrava
17. listopadu 1790
708 00 Ostrava-Poruba
martinaskrobankova@email.cz
Keywords:
infliximab – Ulcerative colitis – tuberculosis
Autori:
Dombrovská K. 1; Hrabovský V. 1,2; Štefaňáková Z. 1; Škrobánková M. 1,2; Svoboda P. 1,2
Vyšlo v časopise:
Gastroent Hepatol 2019; 73(4): 339-344
Kategória:
IBD: Kazuistika
doi:
https://doi.org/10.14735/amgh2019339
Súhrn
Biologická léčba založená na blokádě tumor nekrotizujícího faktoru alfa (TNF-α) představuje v léčbě ulcerózní kolitidy (UC – ulcerative colitis) velmi potentní terapeutickou modalitu. Významným rizikem jejího podávání jsou však infekční komplikace, vč. zvýšeného rizika rozvoje tuberkulózy (TBC). Cílem této práce je prezentovat kazuistiku onemocnění TBC u pacienta léčeného infliximabem (IFX) a současně se pokusit o souhrn recentních informací o této problematice v České republice. Autoři prezentují kazuistiku muže s těžkou formou UC, který byl léčen IFX. Po zahájení léčby se objevily četné infekční komplikace, které si vyžádaly opakované hospitalizace. V rámci široké diferenciální diagnostiky byla nakonec zjištěna TBC s dominantním postižením mozku. Hlavní příčinou vzniku TBC při léčbě preparáty anti-TNF je zřejmě reaktivace její latentní formy. TNF hraje během nákazy zásadní roli, a pokud je jeho účinek blokován, ochranný efekt selhává. Rozvoj TBC je obvykle časný a nezabrání mu ani profylaxe antituberkulotiky. Často převládá extrapulmonální manifestace. TBC je závažnou komplikací podávání anti-TNF preparátů a zavedená preventivní opatření ji dokázala v posledních letech pouze snížit. Jedním z možných řešení této nepříznivé situace jsou další apelace na důsledné naplňování odborných doporučení v rámci screeningu, popřípadě jejich další zpřísnění.
Klíčová slova:
ulcerózní kolitida – tuberkulóza – infliximab
Úvod
Ulcerózní kolitida (UC – ulcerative colitis) je chronické zánětlivé onemocnění tlustého střeva ze skupiny idiopatických střevních zánětů (IBD – inflammatory bowel disease). Příčina je nejasná, a tudíž neexistuje kauzální terapie. Během několika posledních dekád se v léčbě UC významně uplatnila řada biologických preparátů. Jedním z nich je rovněž infliximab (IFX), který patří do skupiny tumor nekrotizující faktor alfa (TNF-α) inhibitorů. Je známo, že podávání biologické léčby (BL), zejména u pacientů s těžkým, na klasickou léčbu refrakterním, průběhem, významně zlepšuje kvalitu života a současně vede k nižšímu počtu relapsů [1–3]. Během podávání BL je však bezpodmínečně nutné respektovat její indikační omezení a nežádoucí účinky. Jedním z významných rizik je rovněž rozvoj tuberkulózy (TBC). Cílem této práce je prezentovat případ pacienta s UC na BL anti-TNF preparátem, u kterého se rozvinula TBC.
Kazuistika
U 56letého muže, který pracoval jako řidič autobusu a v minulosti prodělal hlubokou žilní trombózu, byla v prosinci 2007 diagnostikována UC. Z tohoto důvodu byla zahájena léčba kortikoidy a mesalazinem. Jinak nebyl sledován pro žádné jiné onemocnění.
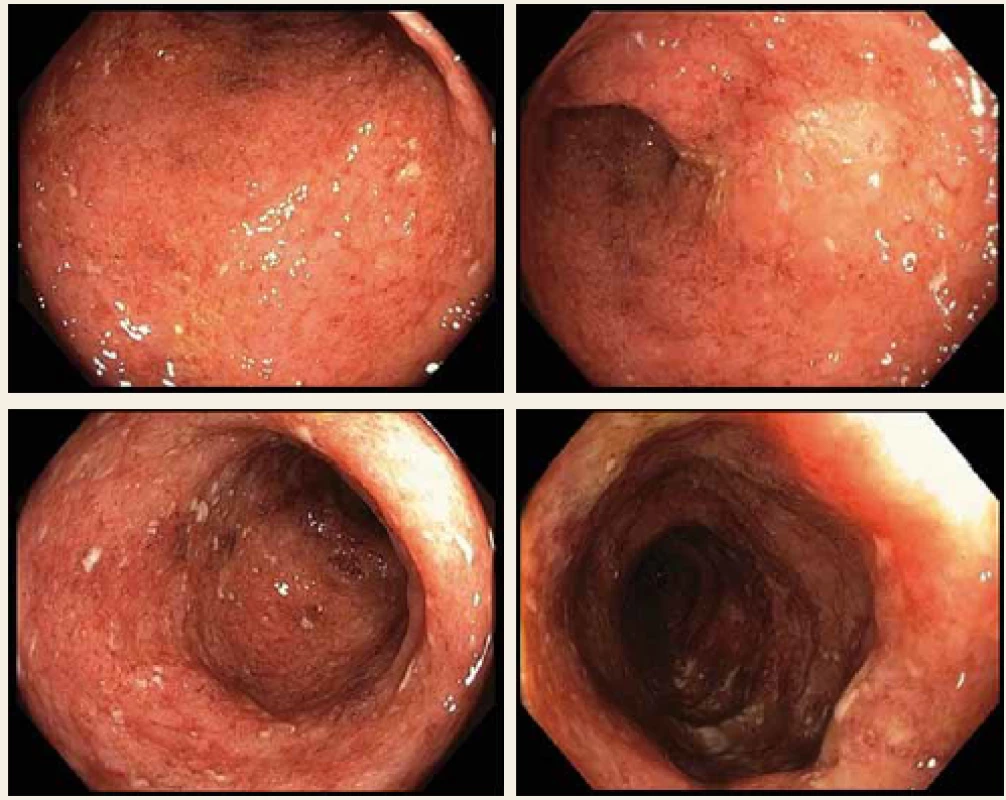
V průběhu roku 2016 prodělal těžkou akutní exacerbaci, která si vyžádala hospitalizaci a pulzní léčbu kortikoidy s následným nasazením azathioprinu. Další exacerbace proběhla v srpnu 2017. Tentokrát byl ale průběh na kortikoterapii refrakterní, navíc byla detekována infekce cytomegalovirem (CMV) – sérologicky a imunohistochemicky z biopsie kolon. Pacient byl léčen valganciklovirem, ale pro rozvoj febrilní neutropenie bylo nutno léčbu vysadit, vč. imunosupresiva azathioprinu. Byla nasazena širokospektrá antibiotika a teprve po stabilizaci byla léčba virostatiky a imunosupresivy opět obnovena. Tato hospitalizace byla rovněž komplikována recidivou tromboembolické příhody s nutností antikoagulační terapie. Po komplexní léčbě bylo dosaženo klinické stabilizace a pacient byl propuštěn do ambulantní péče. Nicméně kontrolní koloskopie v tuto dobu remisi nepotvrdila (Mayo subskóre = 3) (obr. 1). Proto byla podána žádost o zahájení BL.
Fig. 1. Colonoscopy before biological treatment, Mayo subscore = 3.
Po jejím schválení (přípravek Remsima – IFX) byla provedena vyšetření (Quantiferon (QFT) a rentgen (RTG) plic), které nepotvrdily inaktivní ani aktivní formu TBC. Tato vyšetření byla provedena podle doporučení pro podávání BL pacientům s IBD z roku 2016 [4].
První podání proběhlo v říjnu 2017 v indukční dávce 5 mg/kg/infuzi, současně byl pacient léčen mesalazinem a azathioprinem. Další aplikace ve stejné dávce byla podána 2., 6., 14. a 22. týden. V únoru 2018 pro přetrvávající klinickou aktivitu byla provedena kontrolní koloskopie, která prokázala perzistující těžký zánět s negativním imunohistochemickým vyšetření na CMV. Současně byla stanovena tzv. údolní (trough) koncentrace IFX (1,43 mg/l) a protilátky proti IFX (negativní). Toto vyšetření bylo stanoveno v rámci grantu LF Ostravské univerzity SGS02/LF/2018-2019. Na základě výsledků byl pacient indikován k intenzifikaci režimu zkrácením intervalu mezi infuzemi na 4 týdny. K intenzifikaci režimu však nakonec nedošlo pro vznik následujících komplikací.
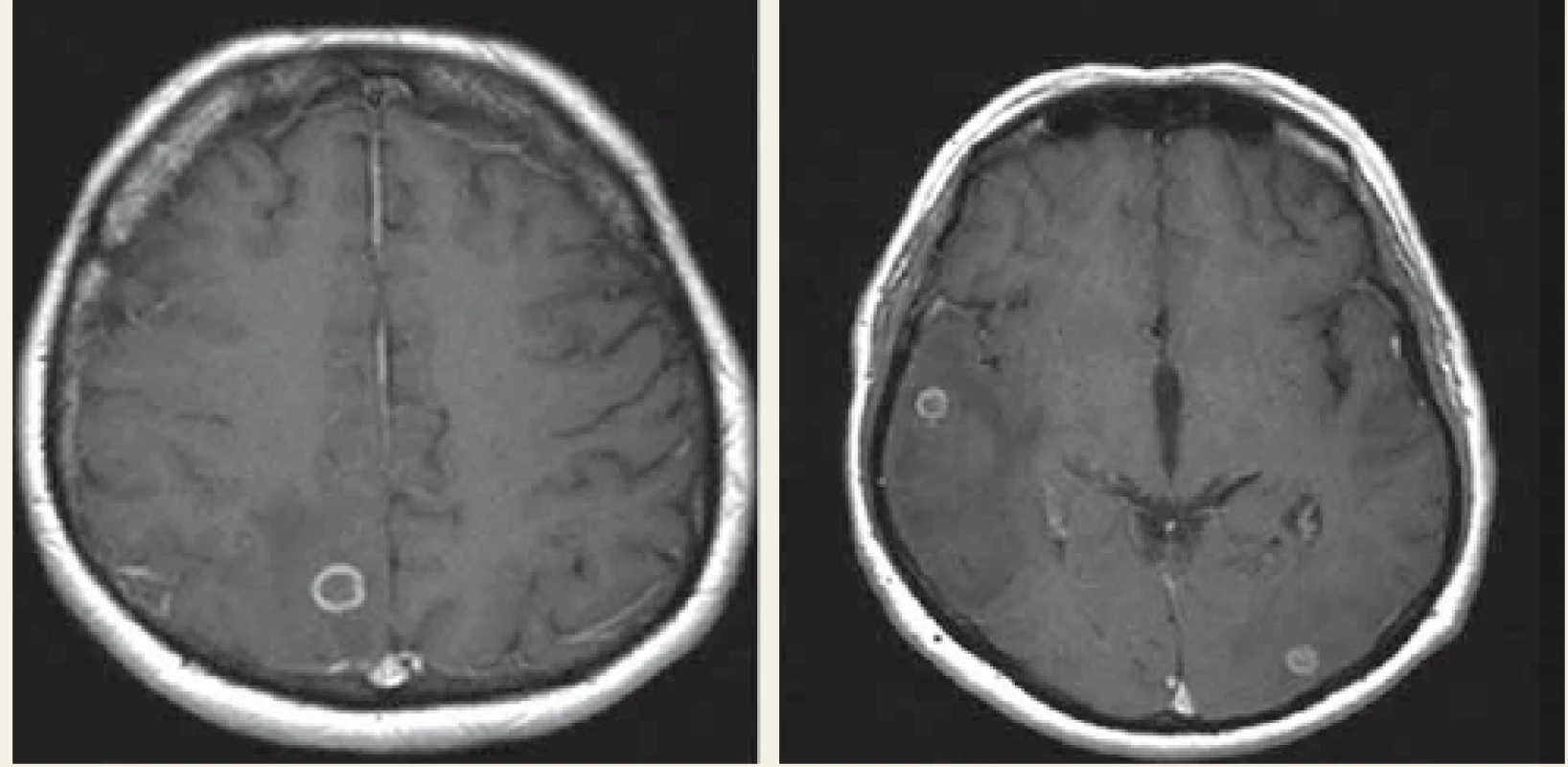
Dne 3. 4. 2018 pacient přišel na interní příjmovou ambulanci pro teploty. Klinicky i laboratorně stav odpovídal akutní bronchitidě s negativním RTG plic. Na klinice plicních nemocí a tuberkulózy byl léčen antibiotiky a dne 13. 4. 2018 byl propuštěn domů. Dne 24. 4. 2018 přichází opět kvůli horečce a po přijetí na interní kliniku byl u něj prokázán pozitivní Clostridiový antigen ve stolici, což bylo hodnoceno jako postantibiotická kolitida. Po zvládnutí stavu byl opět propuštěn domů, ale dne 1. 6. 2018 byla zahájena třetí hospitalizace pro teploty. Laboratorně byly vstupně detekovány nespecifické hodnoty zánětlivých parametrů (leukocyty 3,99 × 109, C reaktivní protein 104 mg/l, prokalcitonin 0,02 µg/l). Bylo zahájeno komplexní vyšetřování teplot nejasného původu. Mimo jiné jícnová echokardiografie, ORL vyšetření, gastroskopie a mikrobiologické testy. Stomatochirurgickým vyšetřením byla prokázána devastace chrupu s indikací k extrakci, ale toto pacient odmítl. Na RTG plic byl popsán drobný bazální výpotek vpravo. Febrilie však trvaly, proto byla provedena pozitronová emisní tomografie v kombinaci s RTG počítačovou tomografií s nálezem generalizované lymfadenopatie a ložiskového postižení mozku. Následná magnetická rezonance (MR) prokázala vícečetná prstenčitá ložiska s výrazným perifokálním edémem temporoparietálně vpravo a okcipitálně vlevo (obr. 2). V této fázi byla zahájena mezioborová spolupráce internisty, neurologa, hematologa, pneumologa a infektologa. V úvahu přicházela zejména toxoplazmóza, TBC, lymfom, ale rovněž metastatické postižení. Vyšetření na toxoplazmózu (polymerázová řetězová reakce (PCR – polymerase chain reaction), krev a vyšetření likvoru) byly negativní. Vyšetření na TBC (PCR): sputum, moč, likvor a bronchoalveolární laváž byly také negativní, paralelně s tím probíhala kultivační vyšetření. Vyšetření trepanobiopsie kostní dřeně i biopsie lymfatické uzliny krku rovněž do případu nevnesly žádné nové informace. Dne 19. 6. 2018 byla ohlášena pozitivita IGRA testu (QFT).
Fig. 2. MRI of brain, the first examination – ring shaped focus, with a maximum right
parietal 11 × 12 mm, perifocal oedema temporoparietal left and right occipital.
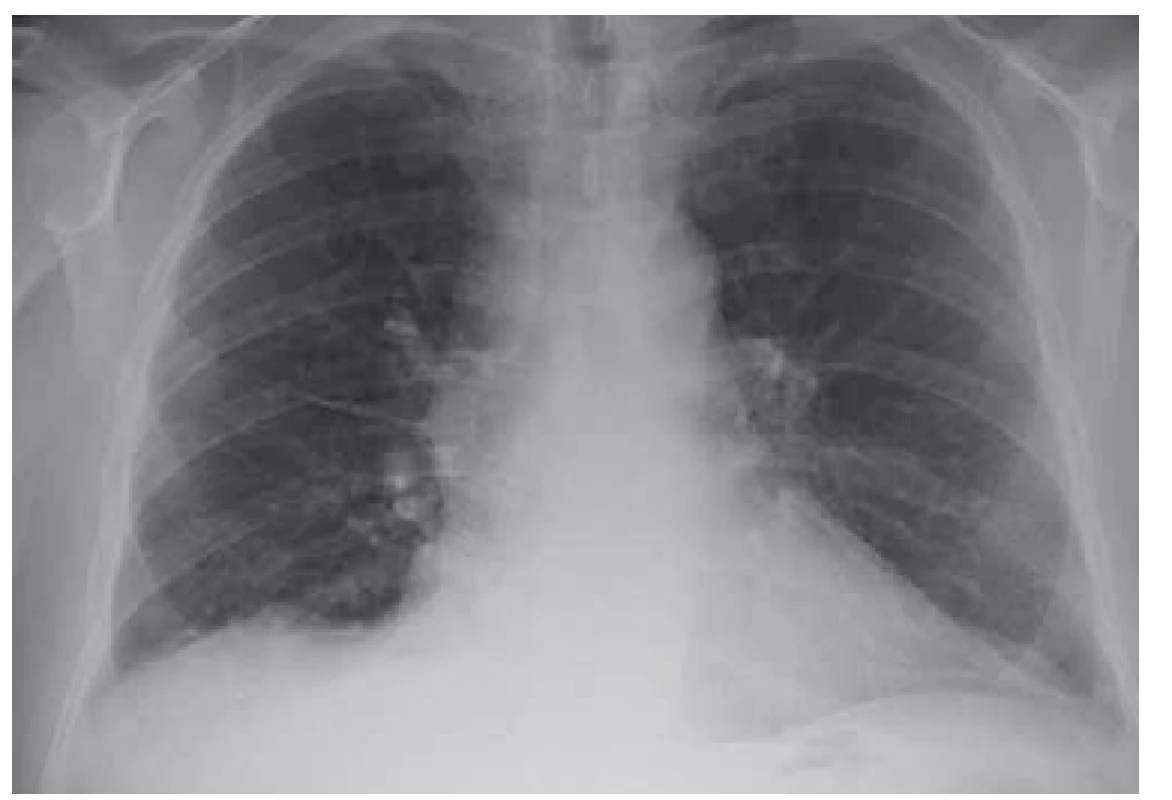
Po diskuzi s příslušnými odborníky byla zahájena kombinovaná terapie antibiotiky, antituberkulotiky a antiparazitiky. Po 6 týdnech léčby byla provedena kontrolní MR mozku se stacionárním nálezem a neurochirurg rozhodl z diagnostických rozpaků o exstirpaci ložiska v mozku. Dne 19. 7. 2018 byl pacient přeložen na neurochirurgické oddělení, ale k výkonu nakonec nedošlo. Po 6 dnech od překladu byla hlášena pozitivní prodloužená kultivace na Mycobacterium tuberculosis v jednom z odběrů sputa. Stav byl uzavřen jako plicní a mimoplicní forma TBC a byl realizován překlad do Odborného léčebného ústavu Jevíčko. Zde byl pacient léčen od 28. 7. 2018 cíleně kombinační terapií (rifampicin, isoniazid, pyrazinamid, streptomycin, ethambnutol) s dobrou tolerancí. Postupně byl nemocný stabilizován, RTG nález plic byl normální (obr. 3 a 4), a proto mohl být po redukci terapie (na rifampicin, isoniazid) dne 3. 10. 2018 propuštěn do domácí péče. Kontrolní MR mozku proběhla dne 10. 11. 2018 a neurochirurg stav zhodnotil jako regredující s doporučením pokračovat v zavedené konzervativní terapii.
Fig. 3. Lung X-ray – basal right fluidothorax (6/2018).
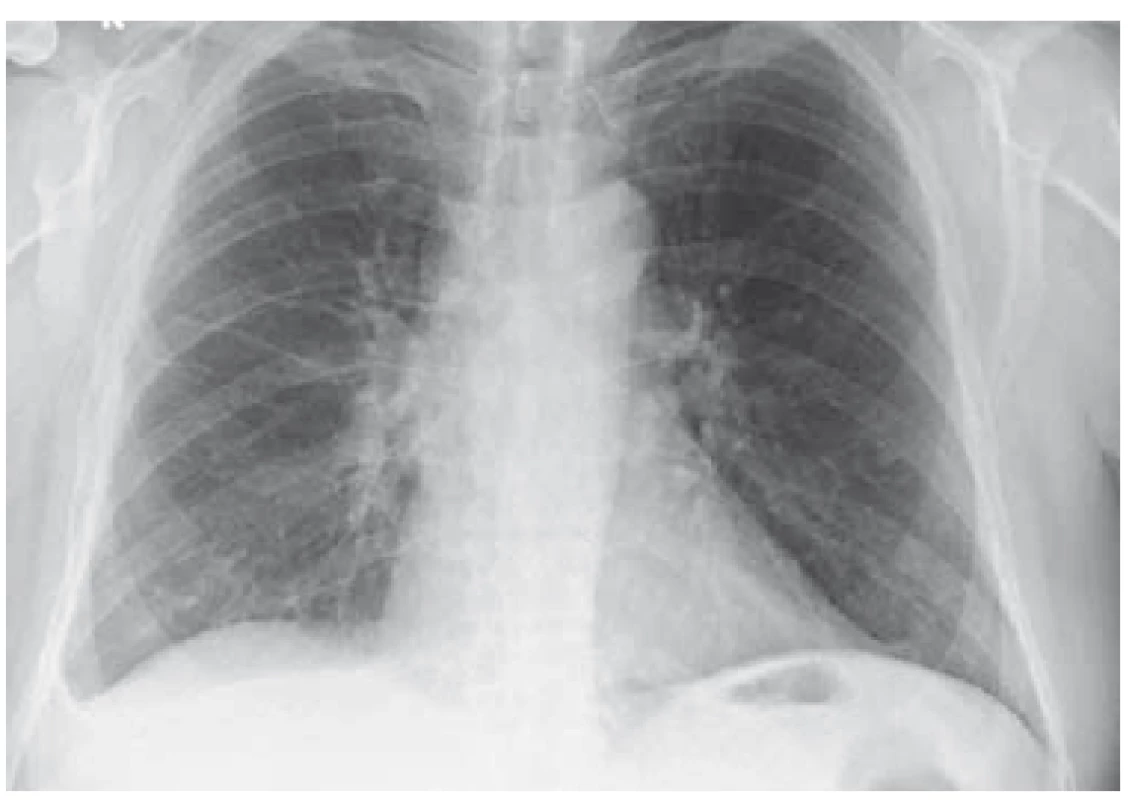
Fig. 4. Lung X-ray after treatement – regression (10/2018).
V současné době pokračuje léčba antituberkulotiky a ve spolupráci s ftizeology se uvažuje o obnovení BL pro těžký relaps základního onemocnění. Biologickým lékem první volby je u tohoto nemocného použití vedolizumabu, který nemá systémový imunosupresivní efekt, ale působí cíleně na oblast gastrointestinálního traktu.
Diskuze
UC je chronické neinfekční zánětlivé onemocnění tlustého střeva neznámé příčiny, bez možnosti kauzální terapie. Významnou terapeutickou roli zde, stejně jako u mnoha jiných imunopatologických chorob (např. Crohnova choroba, revmatoidní artritida, psoriáza), hraje BL. V případě UC se jedná zejména o IFX, adalimumab, golimumab a vedolizumab. První tři jsou namířeny proti aktivitě nejvýznamnějšího mediátoru zánětu – TNF. Poslední jmenovaný preparát pak suprimuje aktivitu konkrétního integrinu, tedy struktury, která se společně s adhezivními molekulami a selektiny podílí na migraci imunokompetentních buněk do místa zánětu [5].
Již mnohokrát byl publikován pozitivní vliv BL na průběh nemoci, zlepšení kvality života a snížení počtu relapsů [1–3]. Jedná se tedy o velmi potentní léčbu střední a těžké formy UC, kdy selhává konvenční imunosupresivní terapie [4]. Pacient prezentovaný v naší kazuistice trpěl těžkou formou UC, klasická imunosupresivní léčba selhávala, zvyšovala se četnost hospitalizací, nedařilo se navodit a udržet remisi, proto byl nakonec gastroenterologem indikován k BL (IFX).
Ačkoli je BL vysoce efektivní, je současně spojena s významnými riziky a nežádoucími účinky. Mezi nejvýznamnější patří komplikace infekční. Salmon-Ceron et al ve své práci uvádí výsledky 3letého sledování oportunních infekcí (kromě tuberkulózy) u 43 pacientů léčených anti-TNF [6]. Jedna třetina infekcí (ze 45 výskytů) byla bakteriálních, 40 % virových, 22 % mykotických a zbytek parazitárních. Zajímavé je rovněž spektrum detekovaných infekcí. Od listériózy, nokardiózy přes CMV, varicellu, herpes zoster až po pneumocystózu, kryptokokózu, invazivní aspergilózu a levish-maniázu. Riziko vzniku infekce navíc podle jejich výsledků potencuje užívání kortikoidů [6].
Neméně závažný je pak výskyt TBC. Jedná se o granulomatózní zánět, který se manifestuje plicní (P-TBC) nebo mimoplicní (EP-TBC) formou. V případě asymptomatického průběhu je označována za latentní (LTBC). Granulom je v postižené tkáni vytvářen prostřednictvím makrofágů, T lymfocytů, B lymfocytů a fibroblastů, čímž se zabraňuje dalšímu šíření a vytváří se prostor pro eliminaci infekční noxy [7]. TNF-α hraje v procesu tvorby granulomů zásadní roli, a navíc má přímý stimulační účinek na makrofágy likvidující mykobakteria [8]. Není tedy divu, že anti-TNF léčba riziko TBC infekce zvyšuje a, jak se ukazuje, výskytu onemocnění nezabrání ani realizace vstupních screeningových vyšetření, a dokonce ani eventuální antituberkulózní profylaxe [7,9,10].
Incidence TBC při anti-TNF terapii se v různých zdrojích liší. Závisí samozřejmě na regionu a jeho epidemiologické situaci, stejně jako na velikosti sledovaného souboru. Elbek et al uvádí během svého dvouletého sledování (2005–2007) incidenci 2/240 subjektů, resp. 833/100 000 pacientů/rok [11]. Z práce Cagatay et al vyplývají z 10letého pozorování (2005–2015) dvě zajímavosti. Jednak zaznamenal 31% nárůst pozitivity kožního tuberkulinového testu po roce léčby a dále rozvoj TBC u 22 pacientů z 1 887 sledovaných subjektů. Roční incidenci vypočítali na 423/100 000 pacientů [12] a Borekci et al (2003–2013) publikovali údaj 16/1 964 léčených subjektů s vypočtenou roční incidencí 466/100 000 pacientů [10]. Výsledky jsou v provedených studiích nejméně příznivé pro IFX, méně pro adalimumab a nejlepší pro ertanercept.
Výskyt TBC v rámci BL v ČR se nám primárně zjistit nepodařilo, a to ani rešerší odborné literatury, ani přímým dotazem na vedení České gastroenterologické společnosti (ČGS). Jak jsme byli informováni, existovala představa, že výskyt mykobakteriových infekcí u IBD pacientů léčených BL bude přibližně 100–120/100 000. V současné době se má za to, že po zavedení screeningového programu a pečlivého výběru a monitorování pacientů je výskyt manifestní TBC stejný jako v běžné populaci, tj. 5–7/100 000 obyvatel. Následně jsme požádali o informace z registru pacientů s IBD léčených BL (CREDIT). Do této databáze bylo od jejího počátku, tj. od 1. 3. 2016, zařazeno k 1. 5. 2019 celkem 3 817 pacientů. Z nich byla u 6 pacientů BL ukončena z důvodu prokázání určité formy TBC, většina (5 pacientů) měla pozitivní nález TBC plic (vč. 1 pacienta s miliární TBC), 1 pacient měl prokázanou TBC peritonitidu. Data byla poskytnuta doc. MUDr. Martinem Bortlíkem, Ph.D.
Pro srovnání z hlediska celkové incidence TBC v ČR bylo v roce 2017 detekováno 505 případů, tedy 4,77/100 000 obyvatel. Plicní a mimoplicní formu mělo 439 (4,15/100 000), resp. 66 (0,62/100 000) pacientů [13].
V souladu s výše uvedenými riziky doporučuje (nejen) ČGS provést před zahájením aplikace screeningové vyšetření na TBC a v případě pozitivity indikovat anti-TBC profylaxi isoniazidem [4]. Tato doporučení zůstávají stejná i dle čtvrtého aktualizovaného doporučení pro podávání BL pacientům s IBD, která vyšla recentně v roce 2019 [14]. Součástí vstupního vyšetření je podrobný odběr anamnézy a RTG plic ve dvou projekcích. Dále je doporučeno použití jednoho ze tří specifických testů: QuantiFERON-TB Gold test (QFT) a/nebo T-SPOT.TB test, což jsou tzv. IGRA (Interferon-γ release assays), hodnotící uvolnění interferonu gama T lymfocyty po kultivaci s antigeny Mycobacterium tuberculosis. Třetím je pak kožní tuberkulinový test Mantoux II (MTII). Opatření je zaměřeno zejména na odhalení LTBC, která je dnes považována za hlavní příčinu později zachycené manifestní TBC. Opodstatněním tohoto tvrzení je fakt, že projevy TBC se objevují velmi brzy, často během několika málo týdnů od zahájení aplikace anti-TNF [9,15]. Nicméně například Borekci et al ve své práci prezentují pozdní manifestaci TBC, kdy 10/16 pacientů TBC pozitivních onemocnělo až po 18. měsíci aplikace [10]. Je podle něj současně zajímavé, že výskyt TBC významněji neovlivní ani provedená anti-TBC profylaxe u rizikových skupin.
U našeho prezentovaného pacienta proběhlo zařazení v souladu s doporučením. Po odebrání infekční anamnézy absolvoval RTG hrudníku a současně QFT. Význam kožního tuberkulinového testu se často zpochybňuje. Důvodem je zřejmě jeho falešná negativita v souvislosti s jinou imunosupresivní terapií podávanou před zahájením BL a současně následně prezentovaného rozvoje TBC [9]. Na druhou stranu některé práce diagnostické přednosti IGRA před MTII zpochybňují [16].
Navzdory negativním vstupním výsledkům k aktivaci TBC u našeho pacienta došlo. BL byla zahájena v říjnu 2017 a definitivní diagnóza TBC byla stanovena po bezmála 10 měsících, na konci července 2018. První příznaky nejasného horečnatého stavu, pro které jsme neměli vysvětlení, se však objevily již o 6 týdnů dříve. Patologické nálezy byly lokalizovány zejména v oblasti centrálního nervového systému a lymfatických uzlin. Plicní vyšetření verifikovalo „pouze“ pravostranný výpotek. Ftizeologové však v časovém odstupu tento nález popsali jako pleuropneumonii. Přispěl k tomu zřejmě právě pozitivní nález ve sputu. U našeho nemocného se tedy jednalo o kombinaci P-TBC a EP-TBC. Ta druhá je podle dostupných dat, na rozdíl od běžného rozložení TBC v populaci, prezentována jako častější než ta první, plicní [10,15]. Naše kazuistika tedy v konečném hodnocení zapadá do širokého kontextu výše uváděného. Výskyt TBC se po zavedení vstupního screeningového vyšetření před zahájením BL snížil, ale k úplně eradikaci nedošlo [17]. Týká se to přitom i dětské populace [18]. Z pohledu bezpečnosti se zdá být slibnější vedolizumab, u kterého se popisují významně nižší frekvence oportunních infekcí, vč. TBC [19].
Podrobná vyšetření, zaměřená na prevenci rozvoje TBC, by měla být tím intenzivnější, čím vyšší je prevalence TBC v daném regionu [20]. Doporučení České pneumologické a ftizeologické společnosti je k tomuto tématu velmi podrobné [21]. Definuje devět situací podle výsledku provedených vyšetření a následně doporučuje zahájení či odklad BL, případnou TBC profylaxi a současně definuje další proces dispenzarizace. Tento postup je, na rozdíl od gastroenterologických doporučení [4], přebrán a velmi podobně popsán v doporučeních pro revmatologii [22]. Důraz je přitom kladen zejména na spolupráci s pneumologem či přímo ftizeologem. Ten by měl převzít stěžejní podíl na správném vyšetření před BL, určení četnosti laboratorních, RTG a klinických kontrol a samozřejmě také na indikaci k anti-TBC profylaxi. Tím by možná bylo možno ještě více redukovat skutečnost, že i pečlivě provedené a v konečném důsledku negativní výsledky rozvoji TBC během aplikace BL často nezabrání.
Závěr
TBC je častou komplikací podávání anti-TNF preparátů v rámci BL imunopatologických onemocnění. Incidence TBC je u těchto nemocných dle literárních dat vysoká a zavedená preventivní opatření ji dokázala v posledních letech pouze snížit. Výskyt v rámci ČR se nám nepodařilo zdokumentovat. Autoři chtěli v práci na konkrétním případu dokumentovat rovněž složitost diagnostického procesu a fakt, že mimoplicní manifestace nemoci se uvádí jako častější než ta klasická plicní. Jedním z možných řešení nepříznivé situace je další apelace na důsledné naplňování odborných doporučení v rámci screeningu, popřípadě jejich další zpřísnění.
Doručeno: 24. 3. 2019
Přijato: 18. 6. 2019
MUDr. Martina Škrobánková
Interní klinika LF OU a FN Ostrava
17. listopadu 1790
708 00 Ostrava-Poruba
martinaskrobankova@email.cz
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašují, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení.
Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Článek není podpořen grantem ani nevznikl za podpory žádné společnosti.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Zdroje
1. Rutgeerts P, Sandborn WJ, Feagan BG et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005; 353 (23): 2462–2476. doi: 10.1056/NEJMoa050516.
2. Sandborn WJ, Rutgeerts P, Feagan BG et al. Colectomy rate comparison after treatment of ulcerative colitis with placebo or infliximab. Gastroenterology 2009; 137 (4): 1250–1260. doi: 10.1053/j.gastro.2009.06.061.
3. Holdam AS, Bager P, Dahlerup JF. Biological therapy increases the health-related quality of life in patients with inflammatory bowel disease in a clinical setting. Scand J Gastroenterol 2016; 51 (6): 706–711. doi: 10.3109/ 00365521.2015.1136352.
4. Bortlík M, Ďuricová D, Kohout P et al. Doporučení pro podávání biologické terapie u idiopatických střevních zánětů: třetí, aktualizované vydání. Gastroent Hepatol 2016; 70 (1): 11–27. doi: 10.14735/amgh201611.
5. Buc M. Current and prospective biologics and small molecules in the treatment of inflammatory bowel diseases. Vnitr Lek 2018; 64 (3): 280–289.
6. Salmon-Ceron D, Tubach F, Lortholary O et al. Drug-specific risk of non-tuberculosis opportunistic infections in patients receiving anti-TNF therapy reported to the 3-year prospective French RATIO registry. Ann Rheum Dis 2011; 70 (4): 616–623. doi: 10.1136/ard.2010.137 422.
7. Winthrop KL. Risk and prevention of tuberculosis and other serious opportunistic infections associated with the inhibition of tumor necrosis factor. Nat Clin Pract Rheumatol 2006; 2 (11): 602–610. doi: 10.1038/ncprheum 0336.
8. Bekker LG, Freeman S, Murray PJ et al. TNF-alpha controls intracellular mycobacterial growth by both inducible nitric oxide synthase-dependent and inducible nitric oxide synthase-independent pathways. J Immunol 2001; 166 (11): 6728–6734. doi: 10.4049/jimmunol.166.11. 6728.
9. Tubach F, Salmon D, Ravaud P et al. Risk of tuberculosis is higher with anti-tumor necrosis factor monoclonal antibody therapy than with soluble tumor necrosis factor receptor therapy: the three-year prospective French Research Axed on Tolerance of Biotherapies registry. Arthritis Rheum 2009; 60 (7): 1884–1894. doi: 10.1002/art.24632.
10. Borekci S, Atahan E, Demir Yilmaz D et al. Factors affecting the tuberculosis risk in patients receiving anti-tumor necrosis factor-α treatment. Respiration 2015; 90 (3): 191–198. doi: 10.1159/000434684.
11. Elbek O, Uyar M, Aydin N et al. Increased risk of tuberculosis in patients treated with anti tumor necrosis factor alpha. Clin Rheumatol 2009; 28 (4): 421–426. doi: 10.1007/ s10067-008-1067-x.
12. Cagatay T, Bingol Z, Kıyan E et al. Follow-up of 1887 patients receiving tumor necrosis-alpha antagonists: tuberculin skin test conversion and tuberculosis risk. Clin Respir J 2018; 12 (4): 1668–1675. doi: 10.1111/crj.12726.
13. ÚZIS ČR. Tuberkuloza a respirační nemoci. 2014. [online]. Dostupné na: https: //www.uzis.cz/category/tematicke-rady/zdravotnicka-statistika/tuberkuloza-cr.
14. Bortlík M, Ďuricová D, Douda T et al. Doporučení pro podávání biologické léčby pacientům s idiopatickými střevními záněty: čtvrté, aktualizované vydání. Gastroent Hepatol 2019; 73 (1): 11–24. doi: 10.14735/amgh201911.
15. Keane J, Gershon S, Wise RP et al. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. N Engl J Med 2001; 345 (15): 1098–1104. doi: 10.1056/NEJMoa011 110.
16. Hanta I, Ozbek S, Kuleci S et al. Detection of latent tuberculosis infection in rheumatologic diseases before anti-TNFα therapy: tuberculin skin test versus IFN-γ assay. Rheumatol Int 2012; 32 (11): 3599–3603. doi: 10.1007/s00296-011-2243-x.
17. Lin J, Ziring D, Desai S et al. TNF alpha blockade in human diseases: an overview of efficacy and safety. Clin Immunol 2008; 126 (1): 13–30. doi: 10.1016/j.clim.2007.08.012.
18. Calzada-Hernández J, Anton-López J, Bou-Torrent R et al. Tuberculosis in pediatric patients treated with anti-TNFα drugs: a cohort study. Pediatr Rheumatol 2015; 13: 54. doi: 10.1186/s12969-015-0054-4.
19. Ng SC, Hilmi IN, Blake A et al. Low frequency of opportunistic infections in patients receiving vedolizumab in clinical trials and post-marketing setting. Inflamm Bowel Dis 2018; 24 (11): 2431–2441. doi: 10.1093/ibd/izy 153.
20. Lee JW, Choi CH, Park JH. Clinical features of active tuberculosis that developed during anti-tumor necrosis factor therapy in patients with inflammatory bowel disease. Intest Res 2016; 14 (2): 146–151. doi: 10.5217/ir.2016.14.2. 146.
21. Homolka J. Doporučení pro biologickou léčbu preparáty blokujícími účinek TNF alfa. 2016. [online]. Dostupné na: http: //www.pneumologie.cz/guidelines/.
22. Vencovský J. Výbor České revmatologické společnosti. Bezpečnost biologické léčby – doporučení České revmatologické společnosti. Čes Revmatol 2009; 17 (3): 146–160.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecnáČlánok vyšiel v časopise
Gastroenterologie a hepatologie
2019 Číslo 4
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Tramadol a paracetamol v tlumení poextrakční bolesti
Najčítanejšie v tomto čísle
- Inzulinom – příčina těžké hypoglykemie u pacientky s neurologickou symptomatikou
- Díl IV. – Mortalita a očekávaná doba dožití pacientů s IBD
- Nové perorálne antikoagulanciá a krvácanie do horného gastrointestinálneho traktu
- Dysfagie jako projev nežádoucího účinku antikoagulační terapie
