-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Eozinofilní ezofagitida – současný pohled na diagnostiku a léčbu
Eosinophilic esophagitis – current overview of diagnostic and treatment modalities
Eosinophilic esophagitis is immune-mediated inflammatory condition of the esophagus. It is a chronic disease with progressive esophageal remodeling. Eosinophilic esophagitis is characterized by symptoms of esophageal dysfunction and eosinophilic infiltration of the esophageal mucosa in the absence of secondary causes of eosinophilia. The management of eosinophilic esophagitis includes proton pump inhibitors, topical glucocorticoids and dietary interventions. Maintenance therapy should be considered for all patients. Endoscopic interventions include pneumatic dilation to treat strictures in symptomatic patients and extraction of impacted food bolus.
Keywords:
Diet – proton pump inhibitors – eosinophilic esophagitis – progression – corticoid – dilation
Autori: Kajzrlíková Mikoviny I. 1; Vitek P. 1,2
Pôsobisko autorov: Interní oddělení, Beskydské Gastrocentrum, Nemocnice ve Frýdku-Místku, p. o. 1; Lékařská fakulta OU 2
Vyšlo v časopise: Gastroent Hepatol 2020; 74(3): 228-232
Kategória: Digestivní endoskopie: přehledová práce
doi: https://doi.org/10.14735/amgh2020228Súhrn
Eozinofilní ezofagitida je imunitně podmíněný zánět jícnu. Jedná se o chronické progresivní onemocnění provázené postupnou remodelací jícnu. Diagnostika nemoci se opírá o příznaky dysfunkce jícnu, histologický nález > 15 eozinofilů/HPF v biopsii z jícnu a vyloučení dalších příčin hypereozinofilie. Léčebné možnosti zahrnují podání inhibitorů protonové pumpy, topických steroidů a eliminační dietu. Po dosažení remise je doporučována dlouhodobá udržovací léčba. Endoskopicky lze u symptomatických pacientů řešit stenózy jícnu pomocí pneumatické dilatace nebo dle potřeby provést extrakci impaktovaného sousta.
Klíčová slova:
eozinofilní ezofagitida – progrese – kortikoidy – dieta – inhibitory protonové pumpy – dilatace
Definice, epidemiologie, etiologie
Eozinofilní ezofagitida (EoE) je lokální imunitně podmíněný chronický zánět jícnu charakterizovaný klinicky symptomy dysfunkce jícnu a histologicky hypereozinofilií sliznice jícnu. V současnosti je to nejčastější příčina chronické ezofagitidy po gastroezofageální refluxní nemoci (GERD) a je to nejčastější příčina dysfagie a váznutí sousta u dětí a mladých dospělých [1]. Kazuistiky pacientů s EoE byly publikovány již v 70. letech 20. století, ale jako samostatná jednotka byla EoE poprvé popsána až v roce 1993 a 1994 [2,3].
Incidence i prevalence EoE mají vzrůstající tendenci. Incidence se momentálně udává 1–20/100 000, průměrně 7/100 000 osob, a prevalence se pohybuje mezi 14 a 49/100 000 osob [4]. Všechny studie zabývající se incidencí EoE potvrzují, že incidence narůstá velmi rychle, ve studiích z Evropy je patrné zvýšení incidence od konce 90. let 20. století v rozmezí 6× až ≥ 100×. Nárůst incidence EoE byl daleko vyšší než nárůst biopsií z jícnu a také zpětná analýza bioptických vzorků z jícnu z minulosti neukázala velké počty nediagnostikovaných pacientů. Jedná se tedy o reálný nárůst incidence onemocnění, nikoli o vyšší povědomí o této diagnóze a větší počet biopsií z jícnu [4–6].
Podle studie ze Španělska z roku 2018 narůstá výskyt EoE s věkem postupně, vrcholu dosahuje mezi 34. a 45. rokem a pak strmě klesá [7]. Rozdíl mezi vysokým výskytem nemoci v rozvinutých zemích a nízkým výskytem v rozvojových zemích poskytuje prostor pro studium etiologických faktorů, zejména faktorů vlivu prostředí [4].
Etiologie je multifaktoriální, roli hraje genetická predispozice i faktory prostředí, za nejkritičtější období se považují situace v raném dětství jako kojení, způsob vedení porodu, užívání antibiotik nebo expozice infekcím [8,9]. K dalším možným rizikovým faktorům patří vyšší hygienický standard nebo inverzní asociace s infekcí Helicobacter pylori [10–12].
EoE je chronické progresivní onemocnění, v jehož průběhu dochází k remodelaci jícnu a trvalým změnám. S každým rokem opoždění diagnózy se zvyšuje riziko striktury o 9 %. V průběhu nemoci postupně mizí známky akutního zánětu a naopak jsou častější fibrotické změny a striktury [13,14]. Spontánní vymizení jícnové eozinofilie u EoE je vzácné [4]. Vzhledem k tomu, že se jedná o progresivní onemocnění, je klíčová časná diagnostika a léčba.
Diagnostika
Diagnostika EoE se opírá o tři základní pilíře, kterými jsou symptomy dysfunkce jícnu, histologický nález > 15 eozinofilů/HPF, a to pouze v jícnu, ne v jiných orgánech, a dále je nutno vyloučit ostatní příčiny hypereozinofilie. Pravděpodobnost nemoci dále zvyšuje mužské pohlaví, přítomnost atopie a endoskopické známky EoE [1]. Podle mezinárodního konsenzu z roku 2018 již není součástí diagnostiky test s inhibitory protonové pumpy (PPI – proton pump inhibitor), který by prokázal inefektivitu PPI [15].
Klinické příznaky nemoci se liší u dětí a u dospělých. U dětí dominuje zvracení, bolest na hrudi a neprospívání, u dospělých se nejčastěji projevuje dysfagií a váznutím sousta [16]. Příznaky, zejména dysfagie, se objevují průměrně 4,5 roku před stanovením diagnózy [17]. Při podezření na EoE je indikováno gastroskopické vyšetření, kde mohou být přítomny některé endoskopické známky (obr. 1). Endoskopický nález je vhodné popisovat pomocí klasifikace EREFS, která hodnotí přítomnost a tíži otoku, prstenců, exsudátů, rýhování a striktur – edema (0, 1), rings (0, 1, 2, 3), exudates (0, 1, 2), furrows (0, 1), stricture (0,1). Endoskopické známky jsou přítomny u 93 % pacientů s EoE, i když samy o sobě přesně nevypovídají o aktivitě nemoci a efekt léčby nelze hodnotit pouze z endoskopického obrazu bez odběru histologie [18]. I endoskopický nález se liší u dětí a dospělých, u dětí převažují exsudáty, zarudnutí a častější je normální vzhled jícnu, u dospělých dominuje nález prstenců, zúžení a vzhled krepového papíru [16].
Obr. 1. Endoskopický obraz podélných rýh a striktury v oblasti dolního jícnu.
Fig. 1. Endoscopic appearance of longitudinal furrows and stricture of distalesophagus.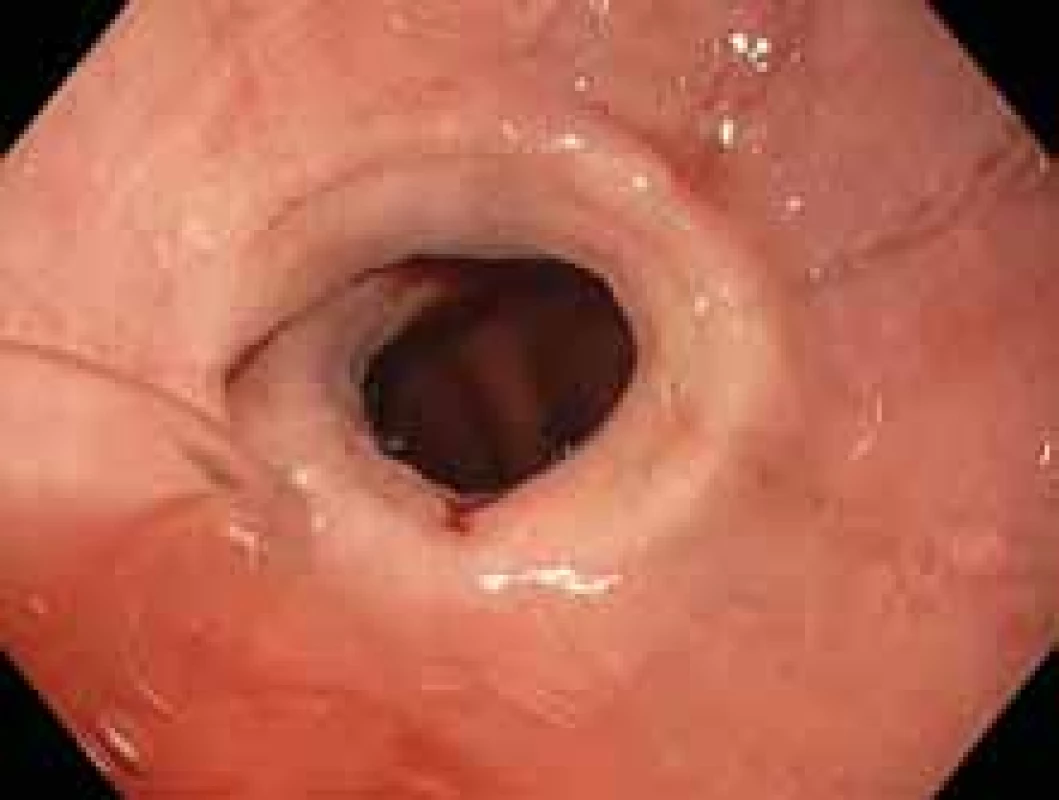
K diagnostice je klíčový nález 15 a více eozinofilů/HPF (60 eozinofilů/mm²) v jícnové biopsii ve standardním barvení pomocí hematoxylin-eozinu. Je doporučeno odebírat min. šest biopsií z různých míst, přičemž nejvýtěžnější jsou biopsie z distálního jícnu. Biopsie by měly být odebírány z patologických míst, zejména z podélných rýh a exsudátů, kde byla prokázána největší denzita eozinofilů [19].
Nově lze při sledování pacientů s EoE využít i endoluminální funkční zobrazovací sondu EndoFLIP, což je funkční vyšetření měřící distenzibilitu jícnu. Ta je u nemocných s EoE výrazně snížena, koreluje s tíží onemocnění a predikuje váznutí sousta v jícnu [1,20].
Dle studie z USA byly definovány tři subtypy EoE lišící se na histologické, endoskopické i molekulární úrovni. Typ 1je mírný, s normálním vzhledem jícnu, s mírnými histologickými, endoskopickými a molekulárními změnami. Typ 2je zánětlivý, s největší expresí zánětlivých cytokinů a genů reagujících na steroidy. Typ 3 je fibrostenotický, se zúženým jícnem, charakterizovaný pokročilým endoskopickým a histologickým nálezem [17,21].
Diferenciální diagnostika
K tomu, abychom mohli stanovit diagnózu EoE, je třeba vyloučit další onemocnění spojená s hypereozinofiií, nejčastěji jde o GERD a achalázii. K dalším diagnózám provázeným hypereozinofilií patří eozinofilní gastroenteritida, hypereozinofilní syndrom, Crohnova nemoc, infekce, onemocnění pojiva, autoimunitní onemocnění, vaskulitidy, poléková hypersenzitivita, kožní onemocnění s postižením jícnu, Marfanův syndrom a další.
Diferenciální diagnostika EoE a GERD je často svízelná. Je prokázáno, že přibližně 20 % pacientů s GERD nereaguje na léčbu PPI, a naopak až u 50 % pacientů s EoE je léčba PPI efektivní [22]. V doporučeních z roku 2014 se ještě psalo o tzv. PPI-responsive jícnové eozinofilii jako o samostatné jednotce, ale dnes se bere jako jeden z fenotypů EoE s odpovědí na PPI [23,24]. V současné době je přístup k oběma diagnózám takový, že EoE a GERD se vzájemně nevylučují, odpověď na PPI můžeme zaznamenat u EoE i GERD. Obě nemoci mohou koexistovat a vzájemně se ovlivňovat. EoE může vést k sekundárnímu refluxu kvůli poruše motility jícnu, a naopak GERD může vést k poruše integrity epiteliální bariéry s následnou hypereozinofilií [4].
Léčba
Cílem léčby by mělo být klinické zlepšení pacienta, úprava histologického nálezu a úprava endoskopického nálezu se zabráněním remodelace jícnu. V současné době jsou k dispozici tři různé léčebné modality. Volba léčebného postupu by měla být individuální a zohledňovat preference pacienta. Kontrola efektu by měla následovat po 8–12 týdnech léčby pomocí endoskopie s odběrem biopsií.
Jedním z možných léků první volby jsou PPI v dávce ekvivalentní 40 mg omeprazolu/den. Podle metaanalýzy z roku 2016 zahrnující 619 pacientů bylo dosaženo histologické remise u 50,5 % pacientů a úpravy symptomů u 60,8 % pacientů [22]. Kromě antisekrečního účinku mají PPI i účinek protizánětlivý, a to zejména díky blokádě exprese eotaxinu 3 [25].
Dalším možným lékem první volby jsou lokálně aplikované topické kortikosteroidy, které mají vliv na genovou regulaci v epiteliálních buňkách jícnu, spouští buněčnou apoptózu a působí proti fibrotizaci jícnu [26]. Topické steroidy jsou léky bezpečné, systémové účinky nebyly u EoE pozorovány, jejich nejčastějším vedlejším účinkem je kandidóza jícnu, která se může objevit u 10 % pacientů a projeví se obvykle zhoršením dysfagie, případně odynofagií. Lék je třeba polknout a po užití být přibližně 30 min nalačno. Používá se buď flutikason inhaler (880–1 760 µg denně pro dospělého, udržovací dávka 880 µg denně), nebo budesonid suspenze (2 mg denně, udržovací dávka 1 mg denně) [27]. Léčbu je doporučeno podávat dlouhodobě, protože po vysazení většina pacientů relabuje. V roce 2019 byla publikována první randomizovaná studie srovnávající flutikason s budesonidem, která prokázala, že oba preparáty mají srovnatelný efekt na úpravu obtíží, endoskopického nálezu a snížení počtu eozinofilů [28]. Recentně byla publikována multicentrická randomizovaná studie, která prokázala účinnost budesonidu ve formě orálně rozpustných tablet [29]. Budesonid je již v této formě v ČR registrován (preparát JORVEZA), zatím však není běžně dostupný a je jej možno pouze individuálně dovézt. Alternativně je však možno připravit suspenzi magistraliter (tab. 1) [26]. Systémové kortikosteroidy nejsou pro léčbu EoE doporučovány.
Tab. 1. Magistraliter předpis suspenze budesonidu, adaptováno z Menclová et al [26].<{r> Tab. ͷ. Magistraliter prescription of oral viscous budesonide, adapted from Menclová et al [26]. ![Magistraliter předpis suspenze budesonidu, adaptováno
z Menclová et al [26].<{r>
Tab. ͷ. Magistraliter prescription of
oral viscous budesonide, adapted
from Menclová et al [26].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/b5237159bb93a167f190c1e9906c352b.png)
Další léčebnou možností jsou eliminační diety, kterých se popisuje několik druhů podle počtu vysazených potravin. Největší efekt u téměř 80 % pacientů má six food elimination diet (SFED), kdy pacient vynechá mléko, obiloviny obsahující lepek, vejce, luštěniny, ořechy a mořské plody [1,30]. Ukázalo se, že efektivnější je step-up přístup, to znamená začít s vynecháním dvou druhů potravin, už to má efekt u 40 % pacientů, pak postupně přejít na vynechání čtyř druhů a eventuálně i šesti druhů potravin. Prokázalo se, že tato strategie šetří množství endoskopií o 20 % [31]. Možná je i elementární dieta, při které se pacient vyhne všem potravinovým alergenům. Je popsána také dieta 1-4-8, kdy pacient vynechá nejprve pouze mléko, pak mléko, vejce, pšenici a sóju a při neefektivitě omezí k předchozímu i kukuřici, kuřecí, hovězí a vepřové maso, což mělo efekt u 78 % pacientů [32]. Dlouhodobé udržování diety může být v klinické praxi problémem a s nutričním specialistou by měly být konzultovány případné nutriční deficity.
Plošné testování na potravinové alergie u všech pacientů s EoE není dle evropských doporučení efektivní a vynechání zjištěných potravin ve většině případů nevede k úpravě obtíží [1].
U pacientů se symptomatickou stenózou jícnu je vhodná endoskopická léčba pneumatickou dilatací (obr. 2). Dle metaanalýzy z roku 2017 zahrnující 1 820 dilatací u 845 pacientů, z toho 87 pediatrických, je dilatace u EoE bezpečná, s velmi nízkým rizikem perforace. Ve zmiňované metaanalýze byla popsána perforace u 0,38 %, krvácení u 0,05 % a nutnost hospitalizace u 0,67 % pacientů, klinický efekt byl pozorován u 95 % pacientů [33]. Dalším častým endoskopickým výkonem u pacientů s EoE je extrakce impaktovaného sousta, většinou jde o primomanifestaci choroby (obr. 3).
Obr. 2. Pneumatická dilatace stenózy jícnu.
Fig. 2. Pneumatic dilation of esophageal stenosis.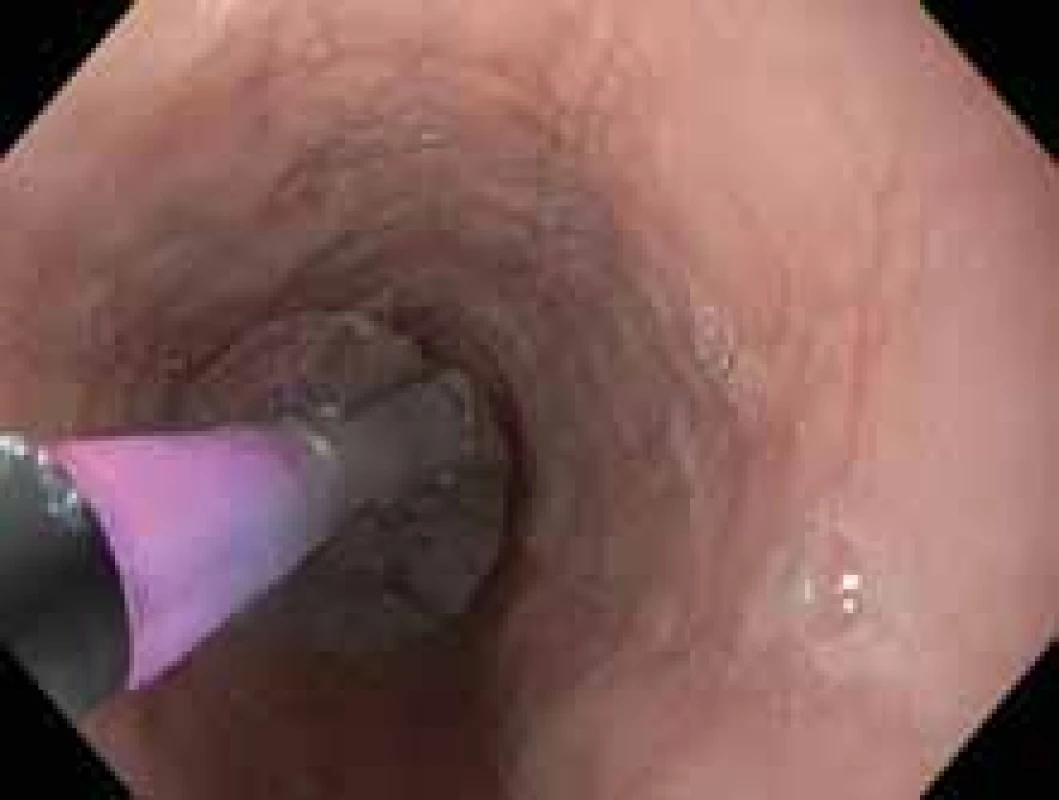
Obr. 3. Impaktované sousto.
Fig. 3. Impacted food bolus.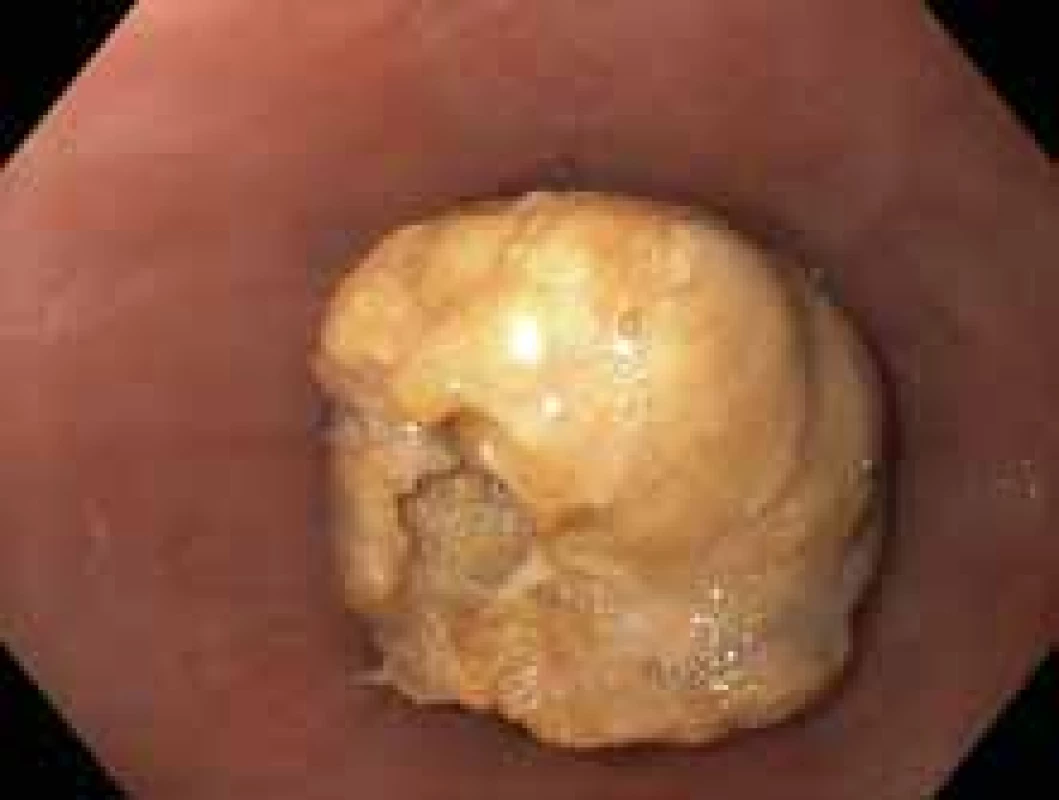
V klinických studiích byl prokázán efekt inhibitorů interleukinu 13, interleukinu 4 (dupilumab), interleukinu 5 (mepolizumab, reslizumab), monoklonálních protilátek anti-IgE, antagonistů prostaglandinových D2 receptorů, antihistaminink a kromolynu, montelukastu a lze použít i thiopuriny nebo infliximab [27]. Při neúspěchu zvolené léčebné metody následuje další možná léčebná modalita až do dosažení remise. Při přetrvávání obtíží a přítomnosti stenózy vhodné k dilataci následuje endoskopická léčba. Po dosažení remise by měla následovat dlouhodobá udržovací léčba (obr. 4).
Obr. 4. Léčebný algoritmus eozinofilní ezofagitidy pro klinickou praxi, adaptováno z Lucendo et al [1].
Fig. 4. Therapeutic algorithm proposed for eosinophilic esophagitis in clinical practice, adapted from Lucendo et al. [1].![Léčebný algoritmus eozinofilní ezofagitidy pro klinickou praxi, adaptováno z Lucendo et al [1].<br>
Fig. 4. Therapeutic algorithm proposed for eosinophilic esophagitis in clinical practice, adapted from Lucendo et al. [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/2e7535b6031fe3f5cc10a198d5d4a993.png)
EoE – eozinofilní ezofagitida, PPI – inhibitory protonové pumpy
EoE – eosinophilic esophagitis, PPI – proton pump inhibitorZávěr
EoE je chronické progresivní onemocnění, proto je klíčová včasná diagnostika a léčba. Diagnostická kritéria zahrnují příznaky dysfunkce jícnu, histologický nález 15 a více eozinofilů/HPF v biopsii z jícnu a vyloučení dalších příčin hypereozinofilie. Měli bychom odebírat min. šest biopsií z různých míst jícnu, zejména z patologicky změněné sliznice. K diagnostice se již nepoužívá test s PPI; PPI jsou však jednou z léčebných možností spolu s topickými steroidy, dietou a pneumatickou dilatací. Po dosažení remise je doporučována dlouhodobá udržovací léčba.
Doručeno/Submitted: 8. 3. 2020
Přijato/Accepted: 23. 3. 2020
MUDr. Ivana Mikoviny Kajzrlíková, Ph.D.
Interní oddělení, Beskydské Gastrocentrum,
Nemocnice ve Frýdku-Místku, p. o.
Elišky Krásnohorské 321
738 01 Frýdek-Místek
Zdroje
1. Lucendo AJ, Molina-Infante J, Arias Á et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J 2017; 5 (3): 335–358. doi: 10.1177/2050640616689525.
2. Attwood SE, Smyrk TC, Demeester TR et al. Esophageal eosinophilia with dysphagia. A distinct clinicopathologic syndrome. Dig Dis Sci 1993; 38 (1): 109–116. doi: 10.1007/BF01296781.
3. Straumann A, Spichtin HP, Bernoulli R et al. Idiopathic eosinophilic esophagitis: a frequently overlooked disease with typical clinical aspects and discrete endoscopic findings. Schweiz Med Wochenschr 1994; 124 (33): 1419–1429.
4. Dellon ES, Hirano I. Epidemiology and natural history of eosinophilic esophagitis. Gastroenterology 2018; 154 (2): 319–332. doi: 10.1053/j.gastro.2017.06.067.
5. Giriens B, Yan P, Safroneeva E et al. Escalating incidence of eosinophilic esophagitis in Canton of Vaud, Switzerland, 1993-2013: a population-based study. Allergy 2015; 70 (12): 1633–1639. doi: 10.1111/all.12733.
6. Whitney-Miller CL, Katzka D, Furth EE. Eosinophilic esophagitis: a retrospective review of esophageal biopsy specimens from 1992 to 2004 at an adult academic medical center. Am J Clin Pathol 2009; 131 (6): 788–792. doi: 10.1309/AJCPOMPXJFP7EB4P.
7. Molina-Infante J, Gonzalez-Cordero PL, Ferreira-Nossa HC et al. Rising incidence and prevalence of adult eosinophilic esophagitis in midwestern Spain (2007–2016). United European Gastroenterol J 2018; 6 (1): 29–37. doi: 10.1177/2050640617705913.
8. Jensen ET, Kuhl JT, Martin LJ et al. Early-life environmental exposures interact with genetic susceptibility variants in pediatric patients with eosinophilic esophagitis. J Allergy Clin Immunol 2018; 141 (2): 632–637. doi: 10.1016/j.jaci.2017.07.010.
9. Jensen ET, Dellon ES. Environmental factors and eosinophilic esophagitis. J Allergy Clin Immunol 2018; 142 (1): 32–40. doi: 10.1016/j.jaci.2018.04.015.
10. Okada H, Kuhn C, Feillet H et al. The hygiene hypothesis for autoimmune and allergic diseases: an update. Clin Exp Immunol 2010; 160 (1): 1–9. doi: 10.1111/j.1365-2249.2010.04139.x.
11. Elitsur Y, Alrazzak BA, Preston D et al. Does Helicobacter pylori protect against eosinophilic esophagitis in children? Helicobacter 2014; 19 (5): 367–371. doi: 10.1111/hel.12129.
12. Dellon ES, Peery AF, Shaheen NJ et al. Inverse association of esophageal eosinophilia with Helicobacter pylori based on analysis of a US pathology database. Gastroenterology 2011; 141 (5): 1586–1592. doi: 10.1053/j.gastro.2011.06.081.
13. Warners MJ, Oude Nijhuis RA, de Wijkerslooth LR et al. The natural course of eosinophilic esophagitis and long-term consequences of undiagnosed disease in a large cohort. Am J Gastroenterol 2018; 113 (6): 836–844. doi: 10.1038/s41395-018-0052-5.
14. Schoepfer AM, Safroneeva E, Bussmann C et al. Delay in diagnosis of eosinophilic esophagitis increases risk for stricture formation in a time-dependent manner. Gastroenterology 2013; 145 (6): 1230–1236. doi: 10.1053/j.gastro.2013.08.015.
15. Dellon ES, Liacouras CA, Molina-Infante J et al.Updated international consensus diagnostic criteria for eosinophilic esophagitis: proceedings of the AGREE conference. Gastroenterology 2018; 155 (4): 1022–1033. doi: 10.1053/j.gastro.2018.07.009.
16. Dellon ES, Gibbs WB, Fritchie KJ et al. Clinical, endoscopic and histologic findings distinguish eosinophilic esophagitis from gastroesophageal reflux disease. Clin Gastroenterol Hepatol 2009; 7 (12): 1305–1313. doi: 10.1016/j.cgh.2009.08.030.
17. Bonis PA, Gupta SK. Clinical manifestations and diagnosis of eosinophilic esophagitis. 2020. [online]. Available from: www.uptodate.com/contents/clinical-manifestations-and-diagnosis-of-eosinophilic-esophagitis.
18. Hirano I, Moy N, Heckman MG et al. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading system. Gut 2013; 62 (4): 489–495. doi: 10.1136/gutjnl-2011-301817.
19. Salek J, Clayton F, Vinson L et al. Endoscopic appearance and location dictate diagnostic yield of biopsies in eosinophilic oesophagitis. Aliment Pharmacol Ther 2015; 41 (12): 1288–1295. doi: 10.1111/apt.13201.
20. Nicodème F, Hirano I, Chen J et al. Esophageal distensibility as a measure of disease severity in patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2013; 11 (9): 1101–1107. doi: 10.1016/j.cgh.2013.03.020.
21. Shoda T, Wen T, Aceves SS et al. Eosinophilic oesophagitis endotype classification by molecular, clinical and histopathological analyses: a cross-sectional study. Lancet Gastroenterol Hepatol 2018; 3 (18): 477–488. doi: 10.1016/S2468-1253 (18) 30096-7.
22. Lucendo AJ, Arias Á, Molina-Infante J. Efficacy of proton pump inhibitor drugs for inducing clinical and histologic remission in patients with symptomatic esophageal eosinophilia: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2016; 14 (1): 13–22. doi: 10.1016/j.cgh.2015.07.041.
23. Molina-Infante J, Gonzalez-Cordero PL, Lucendo AJ. Proton pump inhibitor – responsive esophageal eosinophilia: still a valid diagnosis? Curr Opin Gastroenterol 2017; 33 (4): 285–292. doi: 10.1097/MOG.0000000000000371.
24. Molina-Infante J, Lucendo AJ. Proton pump inhibitor therapy for eosinophilic esophagitis: a paradigm shift. Am J Gastroenterol 2017; 112 (12): 1770–1773. doi: 10.1038/ajg.2017.404.
25. Cheng E, Zhang X, Huo X et al. Omeprazole blocks eotaxin-3 expression by oesophageal squamous cells from patients with eosinophilic oesophagitis and GORD. Gut 2013; 62 (6): 824–832. doi: 10.1136/gutjnl-2012-302250.
26. Menclová A, Hojný M, Dulavová M et al. Nové možnosti léčby eozinofilní ezofagitidy pomocí magistraliter připravovaného léčiva. Prakt lékáren 2016; 12 (1): 26–28. doi: 10.36290/lek.2016.006.
27. Bonis PA, Gupta SK. Treatment of eosinophilic esophagitis. 2019. [online]. Available from: www.uptodate.com/contents/treatment-of-eosinophilic-esophagitis.
28. Dellon ES, Woosley JT, Arrington A et al. Efficacy of budesonide vs fluticasone for initial treatment of eosinophilic esophagitis in a randomized controlled trial. Gastroenterology 2019; 157 (1): 65–73. doi: 10.1053/j.gastro.2019.03.014.
29. Lucendo AJ, Miehlke S, Schlag C et al. Efficacy of budesonide orodispersible tablets as induction therapy for eosinophilic esophagitis in a randomized placebo-controlled trial. Gastroenterology 2019; 157 (1): 74–86. doi: 10.1053/j.gastro.2019.03.025.
30. Arias A, Gonzalez-Cervera J, Tenias JM et al.Efficacy of dietary interventions for inducing histologic remission in patients with eosinophilic esophagitis: a systematic review and meta-analysis. Gastroenterology 2014; 146 (7): 1639–1648. doi: 10.1053/j.gastro.2014.02.006.
31. Molina-Infante J, Arias A, Alcedo J et al. Step-up empiric elimination diet for pediatric and adult eosinophilic esophagitis: the 2–4–6 study. J Allergy Clin Immunol 2018; 141 (4): 1365–1372. doi: 10.1016/j.jaci.2017.08.038.
32. Zhan T, Ali A, Choi JG et al. Model to determine the optimal dietary elimination strategy for treatment of eosinophilic esophagitis. Clin Gastroenterol Hepatol 2018; 16 (11): 1730–1737. doi: 10.1016/j.cgh.2018.04.013.
33. Moawad FJ, Molina-Infante J, Lucendo AJ et al.Systematic review with meta-analysis: endoscopic dilation is highly effective and safe in children and adults with eosinophilic oesophagitis. Aliment Pharmacol Ther 2017; 46 (2): 96–105. doi: 10.1111/apt.14123.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek EditorialČlánek Kvíz z klinické praxe
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2020 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial
- Kvíz z klinické praxe
- Vliv pandemie COVID-19 na endoskopickou praxi v České republice – dotazníková studie
- Syndrom odpojeného pankreatického vývodu – opomíjená komplikace akutní pankreatitidy
- Motorizovaná spirální enteroskopie – naše první zkušenosti
- Perioperační ezofagogastroduodenoskopie v prevenci a terapii anastomotických komplikací – přehledový článek
- Eozinofilní ezofagitida – současný pohled na diagnostiku a léčbu
- Herpetická ezofagitida u imunokompetentního sedmiletého pacienta
- Projekt „Endoskopická centra“v České republice
- Aktuální vědecké podklady pro dietu pro Crohnovu chorobu založenou na vyloučení konkrétních potravin (CDED)
- Budesonid MMX v léčbě ulcerózní kolitidy
- Neobvyklý případ dysfagie horního typu
- Renální onemocnění pacientů s idiopatickými střevními záněty
- Na památku doc. Jana Kotrlíka
- MUDr. Marek Beneš zemřel 18. 6. 2020 ve věku 44 let
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz: Ischemická kolitida na podkladě trombózy dolní mezenterické žíly
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Eozinofilní ezofagitida – současný pohled na diagnostiku a léčbu
- MUDr. Marek Beneš zemřel 18. 6. 2020 ve věku 44 let
- Neobvyklý případ dysfagie horního typu
- Motorizovaná spirální enteroskopie – naše první zkušenosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



