Syndrom odpojeného pankreatického vývodu – opomíjená komplikace akutní pankreatitidy
Disconnected pancreatic duct syndrome – a neglected complication of acute pancreatitis
Acute pancreatitis is a reversible pancreatic inflammatory process that may be accompanied by local and systemic complications. In a subset of patients with severe acute pancreatitis, necrosis affecting the major pancreatic duct may result in a discontinuity between the left-sided pancreas and duodenum. Such an interruption in the setting of a viable upstream portion of gland parenchyma gives rise to the disconnected pancreatic duct syndrome, which is generally regarded as a diagnostically and therapeutically difficult condition. The syndrome is associated with a prolonged disease course and poses a burden on patients’ quality of life and high health care resource utilization. There are currently no universally accepted guidelines for the diagnosis and treatment, the syndrome is often neglected and diagnosis delayed. The aim of our review article is to raise awareness of this serious complication of acute pancreatitis.
Keywords:
Pancreatitis – acute necrotizing pancreatitis – pancreatic ducts – disconnected pancreatic duct syndrome – walled-off necrosis – pancreatic pseudocyst – pancreatic fistula
Autori:
Vaněk P. 1,2; Falt P. 1,3; Urban O. 1
Pôsobisko autorov:
II. interní klinika – gastroenterologická a geriatrická LF UP a FN Olomouc
1; Division of Gastroenterology, Hepatology and Nutrition, University of Minnesota, MN, USA
2; II. interní gastroenterologická klinika LF UK v Hradci Králové
3
Vyšlo v časopise:
Gastroent Hepatol 2020; 74(3): 204-211
Kategória:
Digestivní endoskopie: přehledová práce
doi:
https://doi.org/10.14735/amgh2020204
Súhrn
Akutní pankreatitida je reverzibilní zánětlivý proces pankreatu, který může být provázen lokálními a systémovými komplikacemi. U podskupiny pacientů s těžkou akutní pankreatitidou může vést nekróza zasahující hlavní pankreatický vývod k diskontinuitě mezi levostrannou částí pankreatu a duodenem. Při zachování exokrinní funkce takto izolované distální části žlázy vzniká syndrom odpojeného pankreatického vývodu, který je všeobecně považován za diagnosticky a terapeuticky obtížný stav. Tento syndrom je spojen s vleklým průběhem, snížením kvality života pacientů a jeho léčba je náročná na zdroje zdravotní péče. V současné době nemáme k dispozici všeobecně akceptovaná doporučení pro diagnostiku a léčbu, syndrom je často opomíjen a stanovení diagnózy opožděno. Cílem našeho přehledového článku je zvýšit povědomí o této závažné komplikaci akutní pankreatitidy.
Klíčová slova:
pankreatitida – akutní nekrotizující pankreatitida – pankreatické vývody – syndrom odpojeného pankreatického vývodu – ohraničená nekróza – pankreatická pseudocysta – pankreatická fistula
Úvod
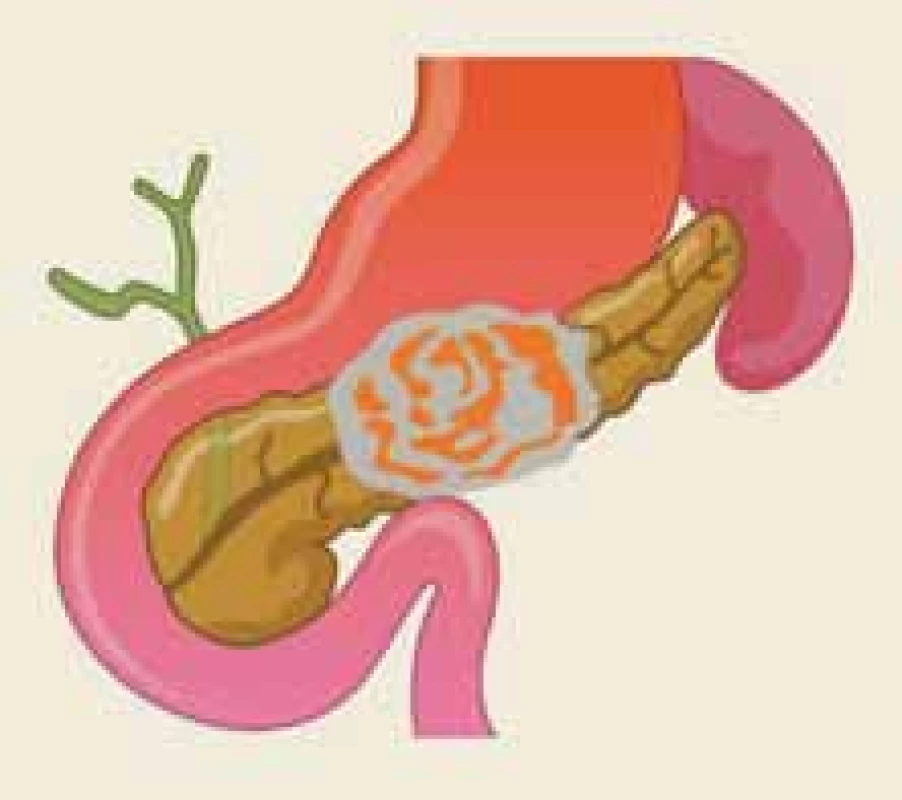
Akutní pankreatitida (AP) je jedním z nejčastějších gastrointestinálních onemocnění vyžadujících akutní hospitalizaci [1]. Revidovaná Atlantská klasifikace rozlišuje formu lehkou, středně těžkou a těžkou [2]. Zatímco lehká forma probíhá nekomplikovaně a nemocní zpravidla opouštějí nemocnici v průběhu jednoho týdne, jsou formy středně těžká a těžká provázeny lokálními, případně systémovými komplikacemi. Patofyziologickým korelátem středně těžké a těžké AP je zpravidla nekróza pankreatické a/nebo peripankreatické tkáně, která se vyvíjí u přibližně u 5–10 % nemocných (obr. 1).
Fig. 1. Acute necrotizing pancreatitis
in the body of the pancreas containing
the main pancreatic duct – an illustration.
Mortalita nekrotizující AP je historicky uváděna kolem 30 % [3]. V posledních letech jsme však svědky zásadního vývoje terapeutických možností od minimálně invazivních radiologických a endoskopických „step-up“ intervencí po otevřené chirurgické přístupy, které spolu s pokroky v intenzivní péči vyhlídky těchto nemocných zlepšily. Jedna z nedávných studií uvádí snížení celkové mortality v této pacientské populaci na hranici 10 % [4].
Vztaženo k lokálním komplikacím, většina dosud publikovaných studií se zabývala především managementem pankreatických kolekcí. Výsledkem bylo vypracování odborných doporučení založených na důkazech, která zdůrazňují multidisciplinární přístup s využitím endoskopických, radiologických a chirurgických intervencí [3,5–12]. V našich podmínkách se uvedená doporučení podařilo úspěšně a účinně implementovat vč. pokročilých endoskopických procedur [13,14]. Nicméně syndrom odpojeného pankreatického vývodu (DPDS – disconnected pancreatic duct syndrome), který je nutné považovat za zásadní lokální komplikaci akutní nekrotizující pankreatitidy (ANP), nebyl v těchto doporučeních systematicky zohledněn. Revidovaná Atlantská klasifikace zmiňuje DPDS, resp. disrupci vývodného systému pankreatu stručně v souvislosti s nekrotickými kolekcemi nebo jako možný faktor vzniku pankreatické pseudocysty. V části věnované ohraničené pankreatické nekróze (WON – walled-off necrosis) uvádí, že diagnostika přítomnosti, či nepřítomnosti duktální kontinuity není při klasifikaci WON nutná, ačkoli by mohlo mít její stanovení význam pro další péči [2].
Prevalence DPDS u nemocných s ANP se podle literárních údajů pohybuje nejčastěji v rozmezí 30–50 % [15–20]. Interpretace tohoto čísla ovšem vyžaduje obezřetnost. Nutnost provedení pokročilých diagnostických modalit v rámci inkluzních kritérií ve studiích, zpravidla endoskopické retrográdní cholangiopankreatografie (ERCP), cholangiopankreatografie magnetickou rezonancí (MRCP) a/nebo peroperační pankreatografie, může vést k podhodnocení skutečného stavu. U nemocných s DPDS je uváděna vyšší pravděpodobnost nutnosti hybridních terapeutických intervencí, reintervencí, záchranných chirurgických výkonů a déletrvajících hospitalizací [15,16,21].
Definice
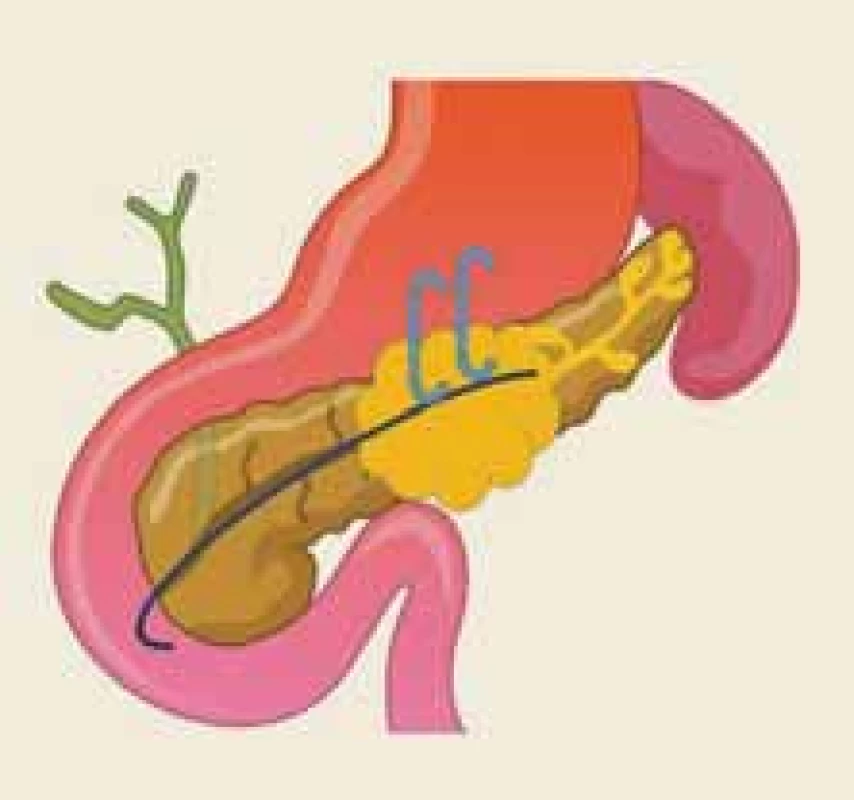
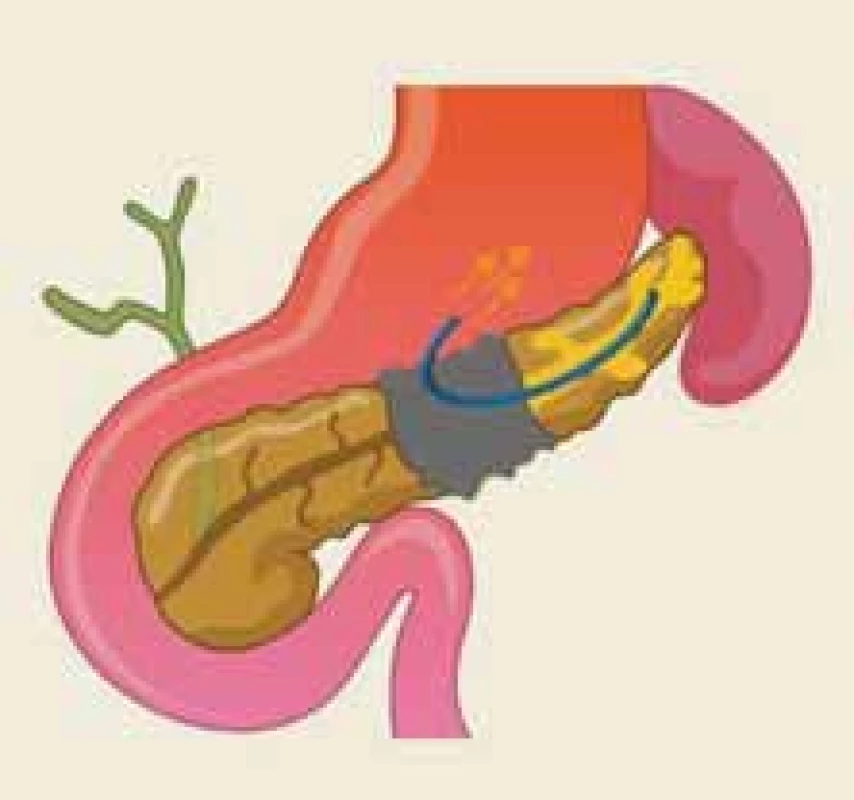
Disrupce vývodu je definována jako částečné přerušení duktální integrity, zatímco o jeho odpojení hovoříme v případě přerušení úplného, cirkumferenciálního [22]. Termín odpojený pankreatický vývod (DPD – disconnected pancreatic duct) popisuje anatomickou situaci, kdy je přerušena duktální kontinuita mezi viabilní pankreatickou tkání a duodenem (obr. 2). Naopak syndrom odpojeného pankreatického vývodu je klinický stav, charakterizovaný symptomatickou produkcí pankreatické šťávy v izolovaném pankreatickém segmentu (obr. 3).
Fig. 2. The anatomical situation of the
dis con nected pancreatic duct following
acute necrotizing pancreatitis – an
illustration.
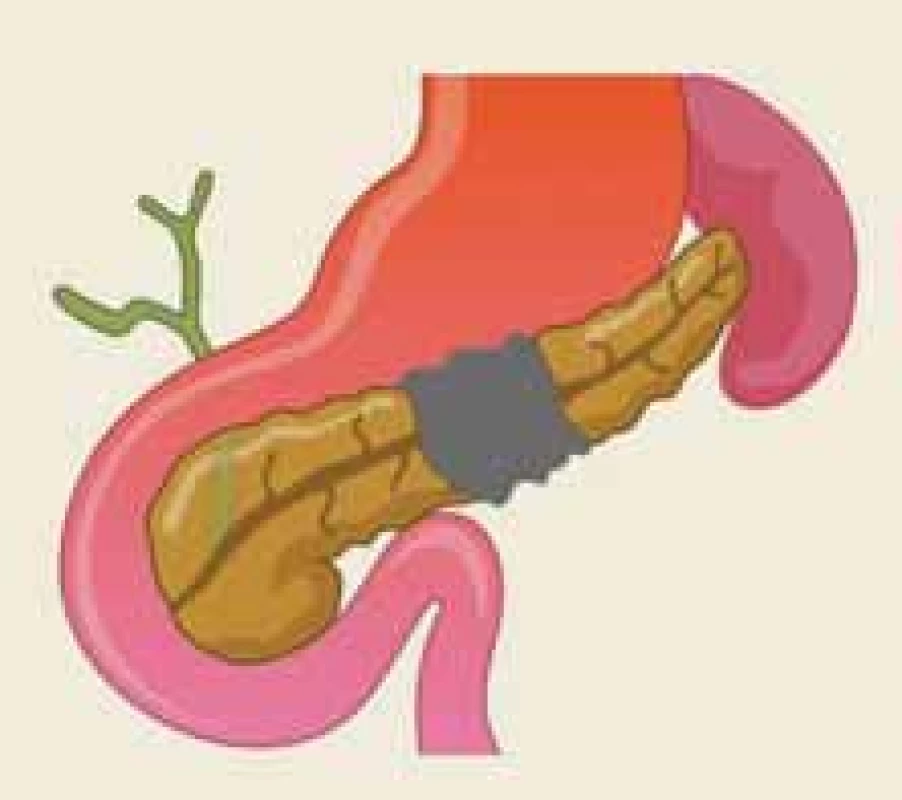
Fig. 3. The anatomical situation of the
disconnected pancreatic duct syndrome – an illustration.

Nejednotná je i samotná klinická terminologie. Ačkoli byla tato klinická jednotka prvotně popsána Kozarkem et al jako syndrom odpojeného pankreatického vývodu v roce 1996 [23], několik autorů následně užívalo názvů jako syndrom odpojené kaudy (disconnected pancreatic tail syndrome) či odpojený levý pankreatický remnant (disconnected left pancreatic remnant) [21,24]. Tyto termíny měly lépe vystihnout patofyziologické pozadí onemocnění. Nicméně Kozarkův název byl nakonec většinou expertů akceptován a nyní je v odborné literatuře označením takřka výhradním.
Patofyziologie
Syndrom odpojeného pankreatického vývodu vzniká nejčastěji jako komplikace AP nebo při tupém traumatu břicha, kdy je ruptura způsobena silou působící na žlázu proti obratlovému tělu (např. u dětí tzv. koloběžková nemoc) [25]. V případě AP se předpokládá výhradní výskyt u pacientů s těžkou nekrotizující formou. Např. ve studii Neoptolema et al hodnotící integritu hlavního pankreatického vývodu (MPD – main pancreatic duct) pomocí ERCP u pacientů s AP byl určitý stupeň poškození MPD prokázán u 44 % pacientů s těžkou AP, ale u žádného pacienta s lehkou formou AP [17]. Jiná studie rovněž prokázala, že DPDS je spojen se vznikem kolekcí charakteru WON, které bývají typicky větších rozměrů a vícenásobné [15]. V této studii byl DPDS přítomen u 84 % pacientů s WON.
Ztráta duktální integrity nastává, když pankreatická nekróza postihne duktální epiteliální buňky [16,17]. Obvyklou lokalizací takového poškození MPD je oblast hlavy a přilehlé části těla pankreatu (obr. 4), což je s největší pravděpodobností podmíněno náchylností této oblasti k ischemické nekróze v důsledku jemného vaskulárního zásobení [15]. Duktální diskontinuita má za následek extraduktální a extrapankreatický únik pankreatické šťávy do okolních tkání, což vede ke komplikacím s heterogenní klinickou manifestací. Důsledky patologické drenáže pokračují prakticky až do chvíle, dokud není patologická drenáž intervencí přesměrována nebo odpojený pankreatický segment resekován, případně dokud sám nepodlehne atrofii. Zjizvením mediálního konce odpojeného distálního vývodu se může navíc vytvořit překážka v odtoku pankreatické šťávy z vyloučeného parenchymu, která může být příčinou vzniku opakující se akutní nebo chronické pankreatitidy v izolovaném segmentu.
Fig. 4. A: CECT depicting acute necrotic collection (ANC) at the junction of the pancreatic head and body representing a likely site of MPD interruption and a viable segment of the pancreatic body and tail (arrows). B: MR of the pancreas in the same patient confirming the diagnosis of DPD (arrows). Courtesy of ML Freeman, University of Minnesota, MN, USA.
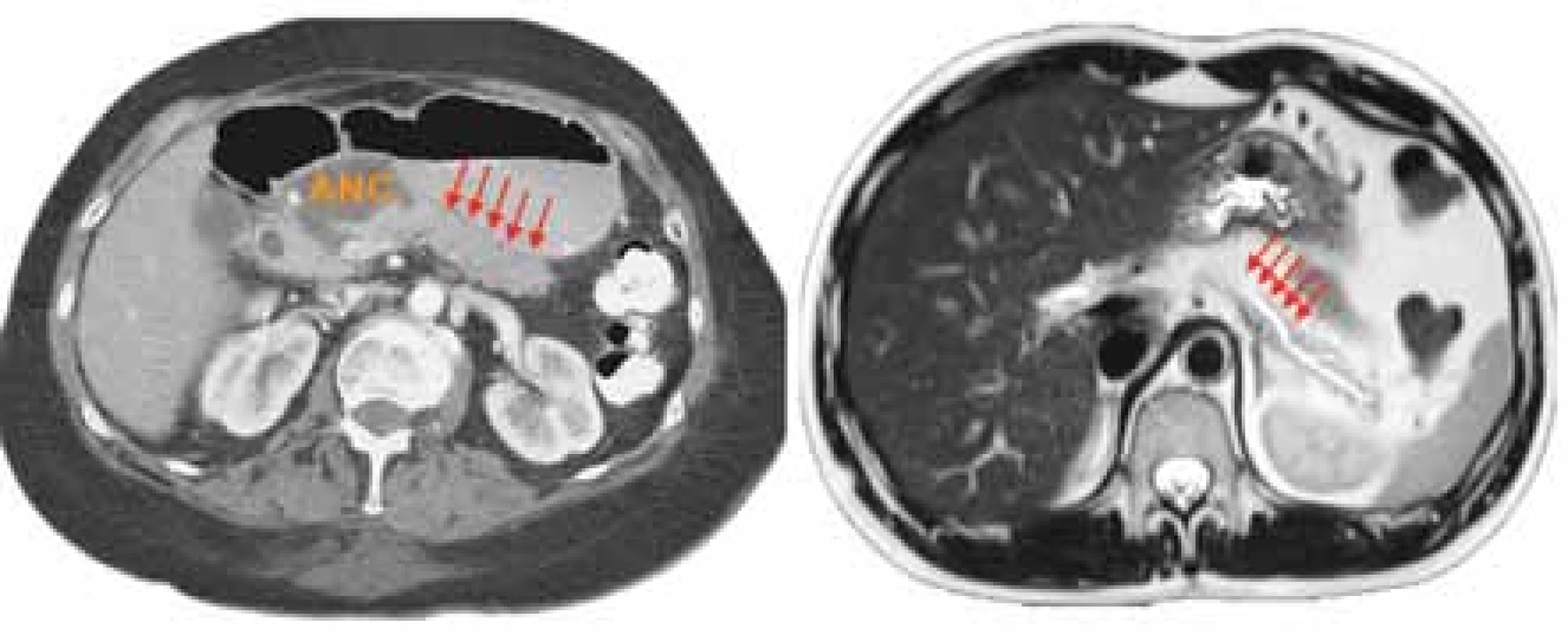
CECT – contrast-enhanced computed tomography, ANC – acute necrotic collection,
MPD – main pancreatic duct, DPD – disconnected pancreatic duct, MR – magnetic
resonance
Klinická manifestace
V rámci klinicky manifestovaného DPDS se popisují projevy pankreatických kolekcí, méně často pankreatického ascitu, pleurálního výpotku nebo pankreatické píštěle [26–31]. Většina autorů vnímá rekurentní tekutinové kolekce jako hlavní problém DPDS. Dalším neméně závažným, avšak nedostatečně popsaným a zřídka uvažovaným důsledkem je již zmíněná rekurentně probíhající akutní nebo chronická pankreatitida v izolovaném segmentu žlázy, která se objevuje zpravidla měsíce až roky po zhojení nekrózy [5]. V tomto ohledu zdůrazňujeme význam dlouhodobého klinického sledování pacientů s proběhlou nekrotizující pankreatitidou, a to i tehdy, pokud neudávají žádné potíže. Na druhé straně je vhodné podotknout, že diskontinuita pankreatické tkáně nemusí vést ve všech případech ke klinicky vyjádřenému DPDS. Na otázku, jak velká část pacientů zůstává asymptomatická, není v současné době odpověď.
Diagnostika
V současné době chybí všeobecně akceptované doporučené postupy k diagnostice poškození MPD u nemocných s ANP [3,7]. Pomineme-li klinické podezření, je diagnostika DPDS obecně postavena na zobrazovacích metodách. Na prvním místě je to široce dostupná kontrastní počítačová tomografie (CECT – contrast-enhanced computed tomography), dále ERCP, MRCP, endoskopická ultrasonografie (EUS) a peroperační pankreatografie.
Dosud uznávaná radiodiagnostická kritéria odpojeného pankreatického vývodu jsou následující:
a) úsek nekrotického pankreatu ≥ 2 cm (u kratších nekróz může dojít ke zhojení);
b)přítomnost distální viabilní pankreatické tkáně (obr. 5);
Fig. 5. An isolated distal pancreatic segment with duct dilatation in the setting of pancreatic body necrosis in a patient after endoscopic drainage of WON. Two DPSs left in place (arrows). Courtesy of R Attam, Kaiser Permanente, CA, USA.
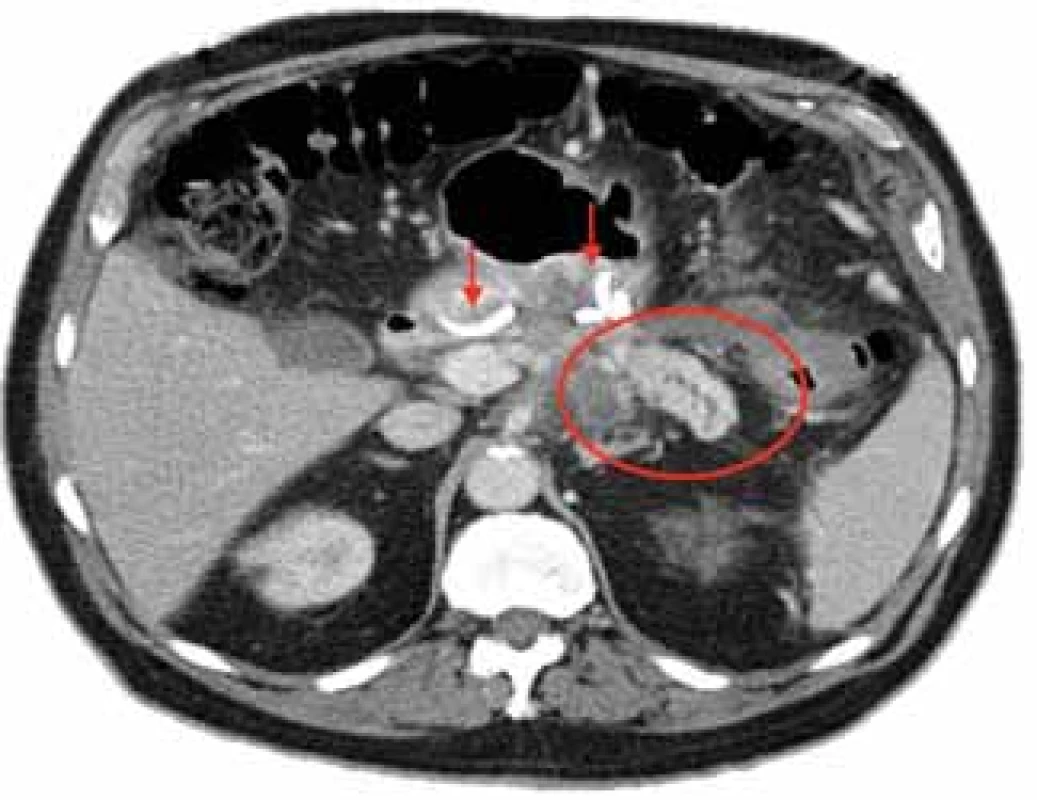
WON – walled-o necrosis, DPS – double pigtail stent
c)extravazace, nebo naopak úplné přerušení kontrastní náplně MPD při pankreatografii;
d)v přítomnosti pankreatické tekutinové kolekce do ní pankreatický vývod (je-li viditelný/dilatovaný) vstupuje pod pravým úhlem [32].
U pacientů s provedenou perkutánní drenáží tekutinové kolekce, ascitu nebo pohrudničního výpotku se dále nabízí možnost vyšetření hladiny amylázy v odpadu z drénu. Podezření na poškození pankreatického vývodu vzniká, jakmile obsahuje více než trojnásobek normální hladiny amylázy v séru [30,33,34]. Měření amylázy v drénované tekutině však nerozliší mezi částečným nebo úplným přerušením vývodu.
Za referenční metodu pro potvrzení diagnózy DPDS je zatím považována ERCP. Jako invazivní procedura s rizikem komplikací, jakými jsou sekundární infekce pankreatické nekrózy, post-ERCP pankreatitida, krvácení a perforace [35,36], ovšem podléhá přísným indikačním kritériím. V tomto ohledu je daleko vhodnější MRCP (obr. 6), jejíž dostupnost se zvyšuje. Naopak dostupnost sekretinové varianty (sMRCP) zůstává v našich podmínkách velmi nízká. Diagnostickým pilířem pro stanovení závažnosti akutní pankreatitidy a jejích komplikací včetně DPDS je nicméně CECT. Validní operační charakteristiky CECT v rámci detekce DPD ovšem nejsou k dispozici.
Fig. 6. A pancreatogram using sMRCP in a patient with DPDS
which was diagnosed 5.5 years following the index ANP. The isolated pancreatic duct is marked with arrows. Courtesy of ML Freeman, University of Minnesota, MN, USA.
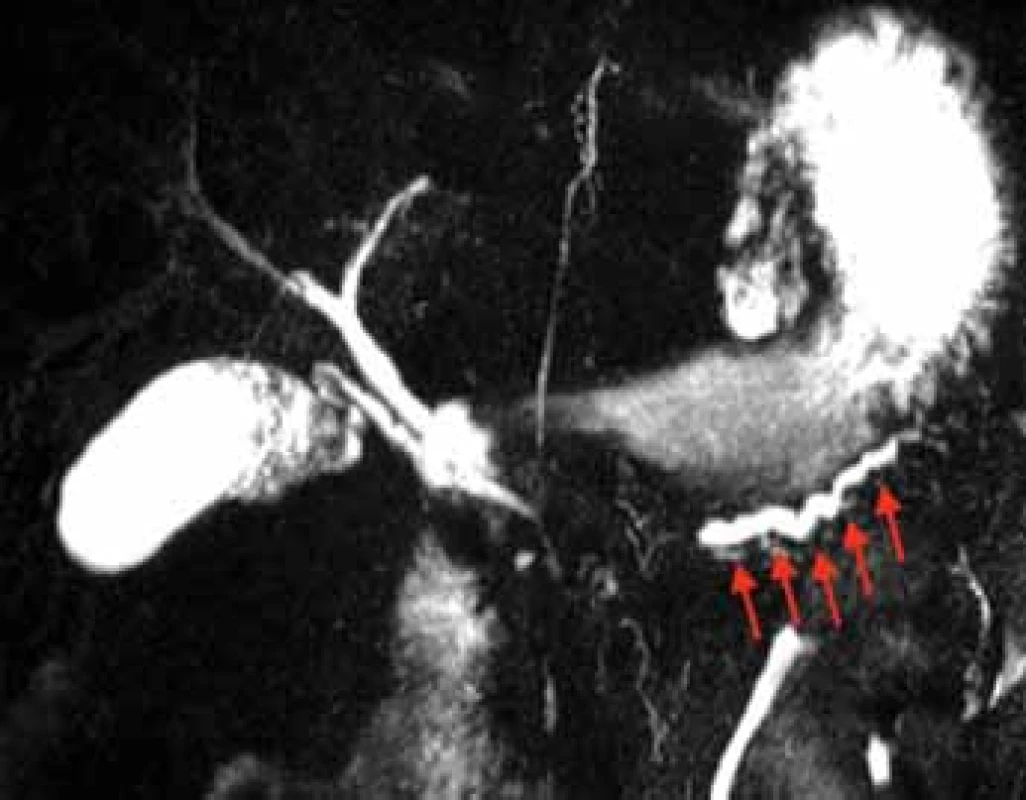
sMRCP – secretin-enhanced magnetic resonance cholangiopancreatography, DPDS – disconnected pancreatic duct syndrome, ANP – acute necrotizing pancreatitis
U mnoha pacientů s těžkou AP se zánětlivé změny a nekróza v průběhu času vyvíjí, a diagnostické znaky DPD tak nemusí být patrné od samotného počátku onemocnění [37]. Tato skutečnost však není klinicky relevantní, jelikož je počáteční léčba u všech pacientů se závažnou AP identická bez ohledu na integritu MPD. Dostupná data ukazují, že specifické CECT a MRCP známky DPD se u většiny pacientů objeví do 2 týdnů od počátku onemoc-nění [30,33]. Studie ovšem udávají medián stanovenídiagnózy DPDS v praxi až 163 dní (3–1 095 dní) od začátku symptomů [30,38]. Během tohoto diagnostického zpoždění si lze představit frustraci z přetrvávajících potíží pacientů či opakování neefektivních drenážních výkonů v případě rekurentních tekutinových kolekcí. V jedné z těchto studií byla retrospektivně srovnávána CT dokumentace 26 pacientů, kteří se dočkali ověření přítomnosti DPD až peroperačně. Přestože byly známky odpovídající odpojenému pankreatickému vývodu nalezeny na všech původních CT vyšetřeních, nebyla tato možná diagnóza zmíněna ani v jednom z popisů [30]. Nejčastějším důvodem opožděné diagnózy je tudíž nedostatečné povědomí až neznalost této jednotky mezi ošetřujícími lékaři a popisujícími radiology.
Studií na diagnostickou přesnost MRCP nebo EUS pro detekci disrupce či odpojení MPD u pacientů s AP je velmi málo. MRCP, za předpokladu technologické dostupnosti, lze provést prakticky u všech pacientů, navíc s možností podání sekretinu ke stimulaci pankreatické sekrece, a tím pádem snadnější identifikace pankreatického vývodu. V jedné studii porovnali MRCP (se sekretinem, nebo bez sekretinu) s ERCP u pacientů se středně těžkou až těžkou AP. Celkově obě varianty MRCP vykázaly senzitivitu 92 %, specificitu 100 % a celkovou přesnost 94 %. Výsledky pro sMRCP a MRCP zvlášť však uvedeny nebyly [39]. EUS byla hodnocena pouze v jedné studii zahrnující 21 pacientů. Autoři v ní demonstrovali 100% citlivost EUS ověřenou kombinací CECT a ERCP, u jednoho pacienta vyžadujícího distální pankreatektomii potom histopatologickým vyšetřením [40]. Pozoruhodné na této studii ovšem bylo, že zahrnovala pouze pacienty s WON o průměru ≥ 6 cm a vyloučeno bylo devět pacientů z důvodu suboptimálního zobrazení distálního segmentu žlázy pomocí EUS. V případě méně restriktivních inkluzních kritérií by byla citlivost jistě výrazně nižší, jelikož takto bylo poškození MPD přítomno u 95 % zařazených pacientů. Úspěšnost vizualizace byla navíc závislá na velikosti WON, což vyvolává dojem, že EUS má přidanou hodnotu pouze v selektivní skupině pacientů a v rukou expertů.
Terapie
Terapeutické postupy DPDS zahrnují konzervativní léčbu, endoskopické a radiointervenční metody, operační techniky a kombinaci výše uvedených. Souhrnná úspěšnost intervenčních léčebných strategií je podle nedávné metaanalýzy přes 80 % [41]. Dlouhodobý úspěch každé jednotlivé strategie však zůstává nejistý vč. míry úspěšnosti konzervativní léčby. Z důvodu absence jednoznačných odborných doporučení je léčba v současné době závislá na zkušenosti ošetřujících lékařů na jednotlivých pracovištích a může se výrazně odlišovat.
Vcelku odvážné prohlášení týkající se léčby DPDS bylo zveřejněno začátkem roku 2020 v Clinical Practice Update Americké gastroenterologické asociace (AGA). Distální pankreatektomie se souběžně provedenou splenektomií byla označena za standardní léčbu tohoto stavu a endoskopicky provedený transluminální stenting byl zmíněn jako upřednostňovaná možnost v případě nevhodných chirurgických kandidátů vzhledem k jejich operační morbiditě [42]. Tato doporučení však nejsou odrazem obecného konsenzu, ale spíše expertním názorem čtyř chirurgicky inklinovaných odborníků. Ačkoli je distální pankreatektomie spojena s vysokou mírou úspěšnosti, vykazuje nejvyšší míru rizika perioperačních komplikací a dlouhodobé endokrinní a exokrinní nedostatečnosti [41]. Se současným vývojem pokročilé endoskopie lze naopak polemizovat o tom, zda role chirurgie nebude v léčbě DPDS ustupovat. Např. operační cyst-jejunostomie byla v podstatě nahrazena endoskopickou transluminální cyst-gastrostomií [43,44]. Zcela jistě platí, že u vybraných pacientů může chirurgická resekce poskytnout definitivní řešení. Naopak výhodou endoskopické léčby je, že nebrání následné operaci v případě neúspěchu.
V současné klinické praxi se možnost poškození pankreatického vývodného systému u pacientů s ANP aktivně nezjišťuje. Po úspěšném zvládnutí iniciálního stavu však hraje integrita MPD důležitou roli k určení dlouhodobého léčebného výsledku. Např. nedávná studie identifikovala DPDS jako jeden z proměnných faktorů zvyšujících pravděpodobnost selhání perkutánní drenážní terapie [45]. Další studie popsaly výskyt rekurentních tekutinových kolekcí přes provedenou endoskopickou transluminální drenáž (ETD) v 7–15 % [46,47]. Nejčastěji užívaným postupem k prevenci opakovaného výskytu těchto kolekcí je ponechání cyst-gastrostomických/enterostomických stentů na dobu neurčitou k zachování průchodnosti umělé vnitřní fistuly a trvalého nasměrování pankreatické sekrece do gastrointestinálního lumen (obr. 7). V aktuálních doporučených postupech Evropské společnosti pro gastrointestinální endoskopii (ESGE) je tato strategie uvedena jako doporučená metoda u pacientů s potvrzením odpojeného pankreatického vývodu [7]. Jedna randomizovaná studie prokázala podstatné snížení míry rekurence tekutinových kolekcí (0 z 15 vs. 5 ze 13; p < 0,05) pomocí dlouhodobě zavedených dvojitých pigtail stentů (DPS) [48]. Toto pozorování bylo následně podpořeno retrospektivní studií (1,7 vs. 17,4 %; p < 0,001) [15]. Bezpečnost DPS byla potvrzena v několika dlouhodobých follow-up studiích [46–48]. Přestože se ponechání DPS ukazuje výhodné v případě tekutinových kolekcí, není jasné, zda je tento postup účinný při prevenci rekurentní akutní nebo chronické pankreatitidy v odpojeném segmentu žlázy [15,48].
Fig. 7. A schematic illustration of the most commonly used method to prevent recurrence of fluid collections in disconnected pancreatic duct syndrome, i.e. leaving long-term cyst-gastrostomy/enterostomy stents in place (two light-blue stents). The controversial transpapillary stenting is pictured as well (dark-blue stent).
Dvě autorské skupiny v tomto ohledu dále posuzovaly proaktivní umístění transpapilárních pankreatických stentů současně s prováděním transluminálních drenážních výkonů u pacientů s ANP (obr. 7). Jedna single-center retrospektivní studie vykázala pozitivní výsledky [49], zatímco druhá retrospektivní multicentrická studie zahrnující heterogenní indikace nevykázala žádnou výhodu [50]. ESGE tento postup nedoporučuje, resp. o přemostění pankreatickým stentem uvažuje pouze v případě parciální disrupce [7]. Přemosťující transpapilární stenting má nicméně svoje místo u pacientů s traumatickým přerušením MPD, případně u vybraných pacientů s chronickou pankreatitidou [51,52].
Alternativně může léčba chronického DPDS zahrnovat chirurgickou resekci vyloučené žlázy, event. doplněnou o autotransplantaci buněk Langerhansových ostrůvků ke snížení rizika vzniku diabetu [53] nebo, pokud je odpojený pankreatický vývod dostatečné velikosti, provedení Roux-en-Y pankreatikojejunostomie [5,54]. Při absenci tekutinové kolekce byla popsána technika pankreatikogastrostomie pod EUS navigací, která zahrnuje umístění transluminálního stentu vedeného retrográdně do distálního pankreatického vývodu za účelem vytvoření a udržení pankreatikogastrické fistuly [55] (obr. 8). V terénu pankreatokutánní píštěle je dalším přístupem kombinace endoskopické a perkutánní radiointervenční rendez-vous techniky k internalizaci píštělového traktu do žaludku nebo dvanáctníku [31].
Fig. 8. Endoscopic pancreaticogastrostomy as an alternative treatment for disconnected pancreatic duct syndrome in selected patients – an illustration.
Výhledy do budoucna
V době vzniku tohoto textu se chystá zveřejnění rozsáhlé metaanalýzy nizozemských autorů (Dutch Pancreatitis Study Group) týkající se zobrazovacích modalit v diagnostice poškození MPD, která jistě poskytne další cenné poznatky. Vzhledem k invazivní povaze jiných modalit lze očekávat magnetickou rezonanci s technikou MRCP (s podáním sekretinu, nebo bez něj) jako doporučenou standardní diagnostickou metodu. Rovněž probíhá aktualizace mezinárodně platných doporučených postupů u akutní pankreatitidy (IAP/APA Acute Pancreatitis Guidelines) s novou částí věnovanou právě syndromu odpojeného pankreatického vývodu.
V neposlední řadě je ANP známým rizikovým faktorem rozvoje diabetes mellitus [56,57]. Zda přítomnost DPDS a následná atrofie vyloučeného pankreatického parenchymu dále zvyšuje toto riziko, je nejasné a mělo by se vyhodnotit. Otázka, zda by tito pacienti profitovali z izolace buněk Langerhansových ostrůvků z vyloučeného pankreatického segmentu ještě před tím, než atrofuje či je operačně odstraněn, je rovněž velkého významu vzhledem ke zvyšující se dostupnosti metod buněčné prezervace a následné autotransplantace.
Do budoucna je tak zapotřebí rozsáhlých studií s neselektovanými kohortami pacientů po proběhlé nekrotizující pankreatitidě za účelem objektivního určení prevalence DPDS a stanovení optimálních strategií pro prevenci, včasnou diagnózu a léčbu.
Závěr
Syndrom odpojeného pankreatického vývodu je opomíjenou komplikací akutní nekrotizující pankreatitidy. V klinickém obraze se syndrom prezentuje různorodě. Nejčastějším důvodem opožděné diagnózy je nedostatečné povědomí lékařů. CT vyšetření zůstává nadále primární diagnostickou modalitou stanovující závažnost a prognózu všech případů těžké akutní pankreatitidy. Je samozřejmé, že jakákoli zobrazovací metoda bude mít nulovou senzitivitu, pokud hodnotící lékař nebude znát diferenciální diagnostiku v celém rozsahu. Pro adekvátní léčbu nemocných s DPDS je zásadní mezioborová spolupráce.
Doručeno/Submitted: 29. 3. 2020
Přijato/Accepted: 29. 3. 2020
MUDr. Petr Vaněk
II. interní klinika – gastroenterologická a geriatrická
Fakultní nemocnice Olomouc
I. P. Pavlova 185/6, 779 00 Olomouc
Zdroje
1. Besselink MG, van Santvoort HC, Buskens Eet al. Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double-blind, placebo-controlled trial. Lancet 2008; 23; 371 (9613): 651–659. doi: 10.1016/S0140-6736 (08) 60207-X.
2. Banks PA, Bollen TL, Dervenis C et al. Classification of acute pancreatitis – 2012: revision of the Atlanta classification and definitions by international consensus. Gut 2013; 62: 102–111. doi: 10.1136/gutjnl-2012-302779.
3. Besselink M, van Santvoort H, Freeman M et al.Working Group IAP/APA Acute Pancreatitis Guidelines. IAP/APA evidence-based guidelines for the management of acute pancreatitis. Pancreatology 2013; 13 (4 Suppl 2): e1–e15. doi: 10.1016/j.pan.2013.07.063.
4. Aparna D, Kumar S, Kamalkumar S. Mortality and morbidity in necrotizing pancreatitis managed on principles of step-up approach: 7 years experience from a single surgical unit. World J Gastrointest Surg 2017; 9 (10): 200–208. doi: 10.4240/wjgs.v9.i10.200.
5. Freeman ML, Werner J, van Santvoort HC et al.Interventions for necrotizing pancreatitis: summary of a multidisciplinary consensus conference. Pancreas 2012; 41 (8): 1176–1194. doi: 10.1097/MPA.0b013e318269c660.
6. Tenner S, Baillie J, DeWitt J et al. American College of Gastroenterology guideline: management of acute pancreatitis. Am J Gastroenterol 2013; 108 (9): 1400–1415; 1416. doi: 10.1038/ajg.2013.218.
7. Arvanitakis M, Dumonceau JM, Albert J et al. Endoscopic management of acute necrotizing pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) evidence-based multidisciplinary guidelines. Endoscopy 2018; 50 (5): 524–546. doi: 10.1055/a-0588-5365.
8. Trikudanathan G, Arain M, Attam R et al. Interventions for necrotizing pancreatitis: an overview of current approaches. Expert Rev Gastroenterol Hepatol 2013; 7 (5): 463–475. doi: 10.1586/17474124.2013.811055.
9. Sabo A, Goussous N, Sardana N et al. Necrotizing pancreatitis: a review of multidisciplinary management. JOP 2015; 16 (2): 125–135. doi: 10.6092/1590-8577/2947.
10. Portelli M, Jones CD. Severe acute pancreatitis: pathogenesis, diagnosis and surgical management. Hepatobiliary Pancreat Dis Int 2017; 16 (2): 155–159. doi: 10.1016/S1499-3872 (16) 60163-7.
11. Trikudanathan G, Attam R, Arain MA et al. Endoscopic interventions for necrotizing pancreatitis. Am J Gastroenterol 2014; 109 (7): 969–81. doi: 10.1038/ajg.2014.130.
12. Crockett SD, Wani S, Gardner TB et al. American Gastroenterological Association Institute guideline on initial management of acute pancreatitis. Gastroenterology 2018; 154 (4): 1096–1101. doi: 10.1053/j.gastro.2018.01.032.
13. Kliment M, Urban O, Fojtík P et al. Endoskopická drenáž pankreatických tekutinových kolekcií – 6-ročná skúsenosť v terciárnom gastroenterologickom centre v období rokov 2006–2012. Gastroent Hepatol 2017; 71 (3): 199–207. doi: 10.14735/amgh2017199.
14. Poc K, Mačinga M, Štirand P et al. Endosonograficky navigovaná drenáž pankreatických kolekcí – vlastní zkušenosti. Gastroent Hepatol 2017; 71 (5): 401–408. doi: 10.14735/amgh2017401.
15. Bang JY, Wilcox CM, Navaneethan U et al. Impact of disconnected pancreatic duct syndrome on the endoscopic management of pancreatic fluid collections. Ann Surg 2018; 267 (3): 561–568. doi: 10.1097/SLA.0000000000002082.
16. Jang JW, Kim MH, Oh D et al. Factors and outcomes associated with pancreatic duct disruption in patients with acute necrotizing pancreatitis. Pancreatology 2016; 16 (6): 958–965. doi: 10.1016/j.pan.2016.09.009.
17. Neoptolemos JP, London NJ, Carr-Locke DL. Assessment of main pancreatic duct integrity by endoscopic retrograde pancreatography in patients with acute pancreatitis. Br J Surg 1993; 80 (1): 94–99. doi: 10.1002/bjs.1800800131.
18. Varadarajulu S, Wilcox CM. Endoscopic placement of permanent indwelling transmural stents in disconnected pancreatic duct syndrome: does benefit outweigh the risks? Gastrointest Endosc 2011; 74 (6): 1408–1412. doi: 10.1016/j.gie.2011.07.049.
19. Uomo G, Molino D, Visconti M et al. The incidence of main pancreatic duct disruption in severe biliary pancreatitis. Am J Surg 1998; 176 (1): 49–52. doi: 10.1016/s0002-9610 (98) 00097-x.
20. Dua MM, Jensen CW, Friedland S et al. Isolated pancreatic tail remnants after transgastric necrosectomy can be observed. J Surg Res 2018; 231: 109–115. doi: 10.1016/j.jss.2018.05.020.
21. Lawrence C, Howell DA, Stefan AM et al. Disconnected pancreatic tail syndrome: potential for endoscopic therapy and results of long-term follow-up. Gastrointest Endosc 2008; 67 (4): 673–679. doi: 10.1016/j.gie.2007.07.017.
22. Nealon WH, Bhutani M, Riall TS et al. A unifying concept: pancreatic ductal anatomy both predicts and determines the major complications resulting from pancreatitis. J Am Coll Surg 2009; 208 (5): 790–799. doi: 10.1016/j.jamcollsurg.2008.12.027.
23. Kozarek RA, Traverso LW. Pancreatic fistulas: etiology, consequences, and treatment. Gastroenterologist 1996; 4 (4): 238–244.
24. Murage KP, Ball CG, Zyromski NJ et al. Clinical framework to guide operative decision making in disconnected left pancreatic remnant (DLPR) following acute or chronic pancreatitis. Surgery 2010; 148 (4): 847–856. doi: 10.1016/j.surg.2010.07.039.
25. Chen Y, Jiang Y, Qian W et al. Endoscopic transpapillary drainage in disconnected pancreatic duct syndrome after acute pancreatitis and trauma: long-term outcomes in 31 patients. BMC Gastroenterol 2019; 19 (1): 54. doi: 10.1186/s12876-019-0977-1.
26. Smoczyński M, Jagielski M, Jabłońska A et al. Transpapillary drainage of walled-off pancreatic necrosis – a single center experience. Wideochir Inne Tech Maloinwazyjne 2015; 10 (4): 527–533. doi: 10.5114/wiitm.2015.55677.
27. Larsen M, Kozarek RA. Management of Disconnected Pancreatic Duct Syndrome. Curr Treat Options Gastroenterol 2016; 14 (3): 348–359. doi: 10.1007/s11938-016-0098-7.
28. Kamal A, Singh VK, Akshintala VS et al. CT and MRI assessment of symptomatic organized pancreatic fluid collections and pancreatic duct disruption: an interreader variability study using the revised Atlanta classification 2012. Abdom Imaging 2015; 40 (6): 1608–1616. doi: 10.1007/s00261-014-0303-x.
29. Fulcher AS, Turner MA, Yelon JA et al. Magnetic resonance cholangiopancreatography (MRCP) in the assessment of pancreatic duct trauma and its sequelae: preliminary findings. J Trauma 2000; 48 (6): 1001–1007. doi: 10.1097/00005373-200006000-00002.
30. Tann M, Maglinte D, Howard TJ et al. Disconnected pancreatic duct syndrome: imaging findings and therapeutic implications in 26 surgically corrected patients. J Comput Assist Tomogr 2003; 27 (4): 577–582. doi: 10.1097/00004728-200307000-00023.
31. Irani S, Gluck M, Ross A et al. Resolving external pancreatic fistulas in patients with disconnected pancreatic duct syndrome: using rendezvous techniques to avoid surgery (with video). Gastrointest Endosc 2012; 76 (3): 586–593.e1–3. doi: 10.1016/j.gie.2012.05.006.
32. Sandrasegaran K, Tann M, Jennings SG et al.Disconnection of the pancreatic duct: an important but overlooked complication of severe acute pancreatitis. Radiographics 2007; 27 (5): 1389–1400. doi: 10.1148/rg.275065163.
33. Nadkarni NA, Kotwal V, Sarr MG et al. Disconnected pancreatic duct syndrome. Endoscopic stent or surgeon‘s knife? Pancreas 2015; 44 (1): 16–22. doi: 10.1097/MPA.0000000000000216.
34. Jin S, Shi XJ, Wang SY et al. Drainage fluid and serum amylase levels accurately predict development of postoperative pancreatic fistula. World J Gastroenterol 2017; 23 (34): 6357–6364. doi: 10.3748/wjg.v23.i34.6357.
35. Woods RW, Akshintala VS, Singh VK et al.CT severity of post-ERCP pancreatitis: results from a single tertiary medical center. Abdom Imaging 2014; 39 (6): 1162–1168. doi: 10.1007/s00261-014-0147-4.
36. Karjula H, Nordblad Schmidt P, Makela J et al. Prophylactic pancreatic duct stenting in severe acute necrotizing pancreatitis: a prospective randomized study. Endoscopy 2019; 51 (11): 1027–1034. doi: 10.1055/a-0865-1960.
37. Beger HG, Rau B, Mayer J et al. Natural course of acute pancreatitis. World J Surg 1997; 21 (2): 130–135. doi: 10.1007/s002689900204.
38. Pelaez-Luna M, Vege SS, Petersen BT et al. Disconnected pancreatic duct syndrome in severe acute pancreatitis: clinical and imaging characteristics and outcomes in a cohort of 31 cases. Gastrointest Endosc 2008; 68 (1): 91–97. doi: 10.1016/j.gie.2007.11.041.
39. Drake LM, Anis M, Lawrence C. Accuracy of magnetic resonance cholangiopancreatography in identifying pancreatic duct disruption. J Clin Gastroenterol 2012; 46 (8): 696–699. doi: 10.1097/MCG.0b013e31825003b3.
40. Bang JY, Navaneethan U, Hasan MK et al. EUS correlates of disconnected pancreatic duct syndrome in walled-off necrosis. Endosc Int Open. 2016; 4 (8): E883–E889. doi: 10.1055/s-0042-112586.
41. van Dijk SM, Timmerhuis HC, Verdonk RC et al. Treatment of disrupted and disconnected pancreatic duct in necrotizing pancreatitis: A systematic review and meta-analysis. Pancreatology 2019; 19 (7): 905–915. doi: 10.1016/j.pan.2019.08.006.
42. Baron TH, DiMaio CJ, Wang AY et al. American Gastroenterological Association Clinical Practice Update: Management of Pancreatic Necrosis. Gastroenterology 2020; 158 (1): 67–75. doi: 10.1053/j.gastro.2019.07.064.
43. Bakker OJ, van Santvoort HC, van Brunschot S et al. Endoscopic transgastric vs surgical necrosectomy for infected necrotizing pancreatitis: a randomized trial. JAMA 2012; 307 (10): 1053–61. doi: 10.1001/jama.2012.276.
44. van Brunschot S, van Grinsven J, van Santvoort HC et al. Endoscopic or surgical step-up approach for infected necrotising pancreatitis: a multicentre randomised trial. Lancet 2018; 391 (10115): 51–58. doi: 10.1016/S0140-6736 (17) 32404-2.
45. Maatman TK, Mahajan S, Roch AM et al. Disconnected pancreatic duct syndrome predicts failure of percutaneous therapy in necrotizing pancreatitis. Pancreatology 2020; 20 (3): 362–368. doi: 10.1016/j.pan.2020.01.014.
46. Ross AS, Irani S, Gan SI et al. Dual-modality drainage of infected and symptomatic walled-off pancreatic necrosis: long-term clinical outcomes. Gastrointest Endosc 2014; 79 (6): 929–935. doi: 10.1016/j.gie.2013.10.014.
47. Puli SR, Graumlich JF, Pamulaparthy SR et al. Endoscopic transmural necrosectomy for walled-off pancreatic necrosis: a systematic review and meta-analysis. Can J Gastroenterol Hepatol 2014; 28 (1): 50–53. doi: 10.1155/2014/539783.
48. Arvanitakis M, Delhaye M, Bali MA et al. Pancreatic-fluid collections: a randomized controlled trial regarding stent removal after endoscopic transmural drainage. Gastrointest Endosc 2007; 65 (4): 609–619. doi: 10.1016/j.gie.2006.06.083.
49. Trevino JM, Tamhane A, Varadarajulu S. Successful stenting in ductal disruption favorably impacts treatment outcomes in patients undergoing transmural drainage of peripancreatic fluid collections. J Gastroenterol Hepatol 2010; 25 (3): 526–531. doi: 10.1111/j.1440-1746.200 9.06109.x.
50. Yang D, Amin S, Gonzalez S et al. Transpapillary drainage has no added benefit on treatment outcomes in patients undergoing EUS-guided transmural drainage of pancreatic pseudocysts: a large multicenter study. Gastrointest Endosc 2016; 83 (4): 720–729. doi: 10.1016/j.gie.2015.10.040.
51. Rogers SJ, Cello JP, Schecter WP. Endoscopic retrograde cholangiopancreatography in patients with pancreatic trauma. J Trauma 2010; 68 (3): 538–44. doi: 10.1097/TA.0b013e3181b5db7a.
52. Dite P, Ruzicka M, Zboril V et al. A prospective, randomized trial comparing endoscopic and surgical therapy for chronic pancreatitis. Endoscopy 2003; 35: 553–558. doi: 10.1055/s-2003-40237.
53. Bellin MD, Freeman ML, Gelrud A et al. Total pancreatectomy and islet autotransplantation in chronic pancreatitis: recommendations from PancreasFest. Pancreatology 2014; 14 (1): 27–35. doi: 10.1016/j.pan.2013.10.009.
54. Pearson EG, Scaife CL, Mulvihill SJ et al. Roux-en-Y drainage of a pancreatic fistula for disconnected pancreatic duct syndrome after acute necrotizing pancreatitis. HPB (Oxford) 2012; 14 (1): 26–31. doi: 10.1111/j.1477-2574.2011. 00397.x.
55. François E, Kahaleh M, Giovannini M et al.EUS-guided pancreaticogastrostomy. Gastrointest Endosc 2002; 56 (1): 128–133. doi: 10.1067/mge.2002.125547.
56. Shen HN, Yang CC, Chang YH et al. Risk of diabetes mellitus after first-attack acute pancreatitis: a national population-based study. Am J Gastroenterol 2015; 110 (12): 1698–1706. doi: 10.1038/ajg.2015.356.
57. Tu J, Yang Y, Zhang J et al. Effect of the disease severity on the risk of developing new-onset diabetes after acute pancreatitis. Medicine (Baltimore) 2018; 97 (22): e10713. doi: 10.1097/MD.0000000000010713.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecnáČlánok vyšiel v časopise
Gastroenterologie a hepatologie
2020 Číslo 3
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Tramadol a paracetamol v tlumení poextrakční bolesti
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
Najčítanejšie v tomto čísle
- Eozinofilní ezofagitida – současný pohled na diagnostiku a léčbu
- MUDr. Marek Beneš zemřel 18. 6. 2020 ve věku 44 let
- Neobvyklý případ dysfagie horního typu
- Motorizovaná spirální enteroskopie – naše první zkušenosti
